残存ウィルスとT細胞についての論文
デンマークの研究。
症状が治まっても、体内に残存するウィルスを調べた研究です。
症状が治まって数日したら、他人に感染させる能力はなくても、体内でウィルスが残存している。その残存ウィルスには抗体ではなくT細胞免疫が役目を果たしている(個人差あるけど、ウィルスクリアランスに3か月くらいかかることも)…みたいな感じでした。
※参照などは省略してあります。
元→https://www.thelancet.com/action/showPdf?pii=S2352-3964%2821%2900023-2
・・・・・・・・・・・・・・・
SARS-CoV-2 persistence is associated with antigen-specific CD8 T-cell responses
SARS-CoV-2の持続性は、抗原特異的なCD8T細胞応答に関連しています
ABSTRACT
Background:
Upon SARS-CoV-2 infection, most individuals develop neutralizing antibodies and T-cell immunity.
SARS-CoV-2に感染すると、ほとんどの人が中和抗体とT細胞免疫を発達させます。
However, some individuals reportedly remain SARS-CoV-2 PCR positive by pharyngeal swabs weeks after recovery.
ただし、一部の個人は、回復後数週間で咽頭スワブによってSARS-CoV-2PCR陽性のままであると報告されています。
Whether viral RNA in these persistent carriers is contagious and stimulates SARS-CoV-2-specific immune responses is unknown.
これらの持続性キャリアのウイルスRNAが伝染性であり、SARS-CoV-2特異的免疫応答を刺激するかどうかは不明です。
Methods:
This cohort study was conducted between April 3rd-July 9th 2020, recruiting COVID-19 recovered individuals that were symptom-free for at least 14 days.
このコホート研究は、2020年4月3日から7月9日の間に実施され、少なくとも14日間症状のないCOVID-19回復個体を募集しました。
We collected serum for SARS-CoV-2-specific total Ig, IgA and IgM detection by ELISA, pharyngeal swabs (two time points) for ddPCR and PBMCs for anti-SARSCoV-2 CD8 T-cell dextramer analyses.
我々は、SARS-CoV-2特異的総Ig、ELISAによるIgAおよびIgM検出用の血清、ddPCR用の咽頭スワブ(2つの時点)、および抗SARSCoV-2 CD8T細胞デキストラマー分析用のPBMCを収集しました。
Findings:
We enrolled 203 post-symptomatic participants with a previous RT-PCR-verified SARS-CoV-2 infection.
以前にRT-PCRで検証されたSARS-CoV-2感染症の203人の症状後の参加者を登録しました。
At time point 1, a median of 23 days (range 15-44) after recovery, 26 individuals (12.8%) were PCR positive.
回復後の中央値23日(範囲15-44)の時点1で、26人(12.8%)がPCR陽性でした。
At time point 2, 90 days (median, range 85-105) after recovery, 5 (5.3%) were positive.
回復後90日(中央値、範囲85-105)の時点2で、5(5.3%)が陽性でした。
There was no difference in SARS-CoV-2 antibody levels between the PCR negative and positive group.
PCR陰性群と陽性群の間でSARS-CoV-2抗体レベルに差はありませんでした。
The persistent PCR positive group however, had SARS-CoV-2-specific CD8 T-cell responses of significantly increased breadth and magnitude.
ただし、持続性PCR陽性グループでは、SARS-CoV-2特異的CD8 T細胞応答があり、幅と大きさが大幅に増加しました。
Assisted contact tracing among persistent PCR positive individuals revealed zero new COVID-19 diagnoses among 757 close contacts.
持続的なPCR陽性の個人間のコンタクトトレーシングの支援により、757人の密接な接触の中で新しいCOVID-19診断がゼロであることが明らかになりました。
Interpretation:
Persistent pharyngeal SARS-CoV-2 PCR positivity in post-symptomatic individuals is associated with elevated cellular immune responses and thus, the viral RNA may represent replicating virus.
症状発現後の個人における持続性咽頭SARS-CoV-2PCR陽性は、細胞性免疫応答の上昇と関連しており、したがって、ウイルスRNAは複製ウイルスを表している可能性があります。
However, transmission to close contacts was not observed indicating that persistent PCR positive individuals are not contagious at the post-symptomatic stage of the infection.
ただし、密接な接触への感染は観察されませんでした。これは、持続的なPCR陽性の個人が、感染の症状後の段階で伝染しないことを示しています。
1. Research in context
1.1. Evidence before this study
We searched on PubMed on November 10th, 2020, with the terms ”SARS-CoV-2”, “COVID-19”, “coronavirus”, “persistent PCR positive”, ”viral load”, ”immune response.”
2020年11月10日にPubMedで、「SARS-CoV-2」、「COVID-19」、「コロナウイルス」、「持続的PCR陽性」、「ウイルス量」、「免疫応答」という用語で検索しました。
We found several papers focusing on the immune responses in SARS-CoV-2 infection.
SARS-CoV-2感染の免疫応答に焦点を当てた論文がいくつか見つかりました。
Some studies assessed antibody responses and/or clinical characteristics in persistent RT-PCR positive patients.
一部の研究では、持続性RT-PCR陽性患者の抗体反応や臨床的特徴を評価しました。
One of these studies did not assess antigen-specific responses and included four patients only.
これらの研究の1つは、抗原特異的反応を評価せず、4人の患者のみを対象としました。
Another study only assessed antibody responses but not cellular responses.
別の研究では、抗体反応のみを評価し、細胞反応は評価しませんでした。
A few studies were based on clinical characteristics of hospitalized patients with persistent positive RT-PCR tests and relating antibody responses.
持続的な陽性RT-PCRテストと関連する抗体反応を伴う入院患者の臨床的特徴に基づいた研究はほとんどありません。
We further found four small observational cohort studies on hospitalized adults and one Letter to the Editor describing the prevalence of persistent RT-PCR positivity among >7000 patients discharged from hospital, not including any immunological analyses.
さらに、入院中の成人に関する4つの小規模な観察コホート研究と、免疫学的分析を含まない、退院した7000人を超える患者における持続的なRT-PCR陽性の有病率を説明する編集者への1つの手紙が見つかりました。
We found 2 case reports on persistent SARS-CoV-2 infected patients and two studies on convalescent plasma donors, all of which were not conducted as observational cohort studies.
持続性SARS-CoV-2感染患者に関する2つの症例報告と、回復期の血漿ドナーに関する2つの研究が見つかりました。これらはすべて、観察コホート研究として実施されたものではありません。
We found 2 case reports of immunocompromised patients being RT-PCR and outgrowth positive for up to 70 days.
免疫不全患者の2つの症例報告がRT-PCRであり、最大70日間増殖陽性であることがわかりました。
No studies that combined data on persistent RT-PCR positive individuals with analyses of both antigen-specific cellular and humoral immune responses were identified.
持続的なRT-PCR陽性の個人に関するデータと、抗原特異的な細胞性免疫応答と体液性免疫応答の両方の分析を組み合わせた研究は確認されていません。
Also, we found no observational cohort studies where the composition of the cohort was reflecting the grades of COVID-19 severity as is observed in vivo, with 80% of infected individuals recovering at home and 20% hospitalized, hereof 5% critically ill.
また、コホートの構成がin vivoで観察されたCOVID-19の重症度を反映しており、感染者の80%が自宅で回復し、20%が入院しており、そのうち5%が重症であるという観察コホート研究は見つかりませんでした。
1.2. Added value of this study
The question of continuing PCR positivity versus risk of transmission is important to address.
PCR陽性の継続と感染のリスクの問題に取り組むことが重要です。
We found that persistent PCR positive individuals had an ongoing cellular anti-SARS-CoV-2 response in contrast to PCR negative individuals, indicative of persistent viral replication.
PCR陰性の個体とは対照的に、持続的なPCR陽性の個体は、進行中の細胞性抗SARS-CoV-2応答を示し、持続的なウイルス複製を示していることがわかりました。
Serum levels of immunoglobulins were equal between PCR positive versus negative individuals.
免疫グロブリンの血清レベルは、PCR陽性者と陰性者の間で同等でした。
We further did assisted contact tracing among the persistent PCR positive individuals and found that these individuals were not transmitting at the post-symptomatic stage of infection.
さらに、持続性PCR陽性の個人間でコンタクトトレーシングを支援したところ、これらの個人は感染の発症期後の段階では伝染させていないことがわかりました。
1.3. Implications of all the available evidence
Several other viral infections like Zika virus, Ebola virus and Measles are known to cause persistent or prolonged viral shedding.
ジカウイルス、エボラウイルス、はしかなどの他のいくつかのウイルス感染は、持続的または長期のウイルス排出を引き起こすことが知られています。
For some of these, e.g. Zika, the potential transmission period can be very long.
これらの一部(ジカ熱など)では、潜在的な伝染期間が非常に長くなる可能性があります。
SARS-CoV-2 is to be placed among these types of long-term detectable viruses.
SARS-CoV-2は、これらのタイプの長期的に検出可能なウイルスの中に配置されます。
The results of this study support the current COVID-19 management where infected individuals can discontinue self-isolation ≧48 h after recovery.
この研究の結果は、感染した個人が回復後48時間以上で自己隔離を中止できる現在のCOVID-19管理をサポートしています。
For individuals who are persistently or intermittently PCR positive there is however a hypothetical risk of recurrent COVID-19 in case of immune suppression (e.g. iatrogenic), which should be considered by clinicians.
ただし、持続的または断続的にPCR陽性である個人の場合、免疫抑制(医原性など)の場合に再発性COVID-19の仮想リスクがあり、臨床医が検討する必要があります。
Evidence from this and several other studies show, that seroconversion and enhanced CD8 T-cell activity is not able to completely eliminate mucosal virus in some individuals.
この研究や他のいくつかの研究からの証拠は、セロコンバージョンと強化されたCD8 T細胞活性が、一部の個人の粘膜ウイルスを完全に排除できないことを示しています。
The molecular basis for this phenomenon is not yet understood, why further in-depth virological and molecular immunological studies needs to be undertaken to clarify potential consequences, who is at risk and the full extend of persistent PCR positive testing period.
この現象の分子基盤はまだ理解されていません。潜在的な結果・リスクのある人・および永続的なPCR陽性テスト期間の全期間を明確にするために、さらに詳細なウイルス学的および分子免疫学的研究を行う必要がる理由です。
2. Introduction
Novel coronavirus, SARS-CoV-2, has elicited a global health crisis with overwhelming consequences for healthcare, societies and economics.
新しいコロナウイルスSARS-CoV-2は、世界的な健康危機を引き起こし、医療、社会、経済に圧倒的な影響を及ぼしています。
According to the World Health Organization, the pandemic has affected more than 200 countries, infected 80 million people and claimed millions of lives by December 2020.
世界保健機関によると、パンデミックは200か国以上に影響を及ぼし、8000万人に感染し、2020年12月までに数百万人の命を奪っています。
Persistent SARS-CoV-2 RNA shedding has been described, but the nature of this phenomenon is not fully understood, as most reports are anecdotal and lack in-depth immunological analyses.
持続的なSARS-CoV-2 RNA放出が説明されていますが、ほとんどの報告は逸話的であり、詳細な免疫学的分析が不足しているため、この現象の性質は完全には理解されていません。
Two case reports have indicated that seroconversion does not necessarily lead to elimination of viral RNA from the pharyngeal mucosa with cases being RT-PCR positive up to 63 days and 104 days after symptom onset despite having neutralizing antibodies.
2つの症例報告では、中和抗体があるにもかかわらず、セロコンバージョンが必ずしも咽頭粘膜からのウイルスRNAの除去につながるとは限らず、症状の発症後63日と104日までRT-PCR陽性であることが示されています。
Xu et al followed a cohort of 113 hospitalized patients with a median duration of 17 days of RNA positivity and assessed clinical risk factors associated with prolonged RNA detection.
Xuらは、中央値が17日間のRNA陽性である113人の入院患者のコホートを追跡し、長期のRNA検出に関連する臨床的危険因子を評価しました。
However, the role of antigen-specific CD8 T-cell responses in combination with antibodies in persistent SARS-CoV-2 RNA carriers is largely unknown.
ただし、永続的なSARS-CoV-2 RNAキャリアにおける抗体と組み合わせた抗原特異的CD8T細胞応答の役割はほとんど知られていません。
Further, it is unclear if viral RNA represents contagious virus in post-symptomatic individuals who remain SARS-CoV-2 PCR positive.
さらに、SARS-CoV-2 PCR陽性のままである無症候性の個人において、ウイルスRNAが伝染性ウイルスを表すかどうかは不明です。
This gap in our understanding of COVID-19 has important implications.
COVID-19の理解におけるこのギャップは、重要な意味を持っています。
For persistent PCR positive individuals it is essential to be informed if there is a transmission risk and when to safely discontinue self-isolation.
PCR陽性の個人の場合、感染のリスクがあるかどうか、および自己隔離を安全に中止する時期を通知することが不可欠です。
Additionally, it is essential for health care personnel to provide instructions regarding hygiene and physical distance to patients and their contacts after hospital discharge.
さらに、医療従事者は、退院後の患者とその連絡先までの衛生状態と物理的距離に関する指示を提供することが不可欠です。
Lastly, health care workers themselves are at increased risk of COVID-19.
最後に、医療従事者自身がCOVID-19のリスクが高くなっています。
Thus, a potential post-symptomatic transmission risk is important to prevent, as they work with vulnerable populations.
したがって、潜在的な無症候性感染リスクは、脆弱な集団と連携するため、予防することが重要です。
Our objective was to investigate immunological responses and viral persistence upon SARS-CoV-2 infection.
私たちの目的は、SARS-CoV-2感染時の免疫応答とウイルスの持続性を調査することでした。
Here, we report a cohort study of 203 convalescent individuals with a history of RT-PCR verified SARS-CoV-2 infection.
ここでは、RT-PCRで検証されたSARS-CoV-2感染の病歴を持つ203人の回復期の個人のコホート研究を報告します。
3. Methods
3.1. Study design
The study was conducted at the Department of Infectious Diseases at Aarhus University Hospital, Denmark from April 3rd-July 9th 2020.
この調査は、2020年4月3日から7月9日まで、デンマークのオーフス大学病院の感染症科で実施されました。
Inclusion criteria: Age >18 years, documented SARS-CoV-2 RT-PCR positive within the preceding 12 weeks, fully recovered from COVID19 (defined as no ongoing COVID-19 symptoms, except loss of sense of smell/taste and cognitive deficits, which are symptoms equivalent to Long-COVID-19]), and able to give informed consent.
選択基準:年齢 18歳以上、過去12週間以内にSARS-CoV-2 RT-PCR陽性、COVID19から完全に回復(Long-COVID-19と同等の症状である、嗅覚/味覚の喪失および認知障害を除いて、進行中のCOVID-19症状がないこととして定義されます])、インフォームドコンセントを与えることができます。
Exclusion criteria: Current febrile illness, immunosuppressive treatment/known immunodeficiency and pregnancy.
除外基準:現在の発熱性疾患、免疫抑制治療/既知の免疫不全および妊娠。
Participants were invited for a visit at time point 1 (minimum 14 days after full recovery and maximum 12 weeks after first positive SARS-CoV-2 RT-PCR) and time point 2 (optional) for a 2nd swab test, 6-10 weeks after time point 1.
参加者は、時点1(完全に回復してから最短14日、最初に陽性のSARS-CoV-2 RT-PCRから最長12週間)で集められました。時点2(オプション)は、時点1の6-10週間後で2回目のスワブ検査をします。
Clinical data on baseline characteristics, comorbidities, symptoms and duration of COVID-19 were collected to assess if certain parameters predicted persistent SARS-CoV-2 positive PCR testing.
ベースラインの特徴、併存症、症状、COVID-19の期間に関する臨床データを収集して、特定のパラメーターが持続的なSARS-CoV-2陽性のPCR検査を予測したかどうかを評価しました。
Participants were allocated in 5 groups according to severity of COVID-19 history (Table 1).
参加者は、COVID-19の履歴の重大度に応じて、5つのグループに割り当てられました(表1)。
3.2. Ethics
The study was approved by The National Health Ethics Committee (case number 1-10-72-76-20) and the Danish Data Protection Agency (case number not applicable).
この研究は、国民健康倫理委員会(ケース番号1-10-72-76-20)とデンマークのデータ保護局(ケース番号は適用されません)によって承認されました。
Each participant provided written informed consent before any study activities.
各参加者は、研究活動の前に書面によるインフォームドコンセントを提供しました。
3.3. Total Ig, IgM and IgA detection
Serum levels of anti-SARS-CoV-2 antibodies were detected by semi-quantitative ELISA.
抗SARS-CoV-2抗体の血清レベルは、半定量的ELISAによって検出されました。
IgA antibodies were measured using the Euroimmun Anti-SARSCoV-2 IgA ELISA (Euroimmun Medizinische Labordiagnostika AG, Lubeck, Germany, #El 2606-9601 A), according to manufacturer € ’s instructions and as previously described elsewhere.
IgA抗体は、Euroimmun Anti-SARSCoV-2 IgAELISA(Euroimmun Medizinische Labordiagnostika AG, Lubeck, Germany, #El 2606-9601 A)を使用して測定しました。メーカー€の指示に従い、他の場所で前述したとおりです。
The Euroimmun ELISA assay has demonstrated high sensitivity and specificity for IgA detection (90% and 93%, respectively) .
Euroimmun ELISAアッセイは、IgA検出に対して高い感度と特異性を示しました(それぞれ90%と93%)。
Serum IgM and total Ig against SARS-CoV-2 receptor binding domain (RBD) were measured using the Wantai SARS-CoV-2 IgM and SARS-CoV-2 Ab ELISA kits (Beijing Wantai Biological Pharmacy Enterprise Co., Beijing, China, Cat. No. WS-1196 and WS-1096) as previously described and according to manufacturer’s instructions.
血清IgMおよびSARS-CoV-2受容体結合ドメイン(RBD)に対する総Igは、Wantai SARS-CoV-2IgMおよびSARS-CoV-2AbELISAキット (Beijing Wantai Biological Pharmacy Enterprise Co., Beijing, China, Cat. No. WS-1196 and WS-1096)を使用して測定されました。前述のとおり、メーカーの指示に従います。
Sensitivity for the Wantai ELISA kit is reported to be 90-100% and the specificity 100%.
Wantai ELISAキットの感度は90〜100%、特異性は100%と報告されています。
All serum samples were run in duplicates.
すべての血清サンプルは重複して実行されました。
3.4. ddPCR for SARS-CoV-2
SARS-CoV-2 was detected from pharyngeal swabs, using ddPCR with primers and probe targeting the nucleocapsid; Forward: 5’-GACCCCAAAATCAGCGAAAT-3’(LGC Biosearch Technologies),Reverse: 5’-TCTGGTTACTGCCAGTTGAATCTG-3’(LCG Biosearch Technologies), probe: 5’-FAM-ACC CCG CAT TAC GTT TGG TGG ACC BHQ1-3’ (nCOV_N1 probe, IDT) published by the CDC.
SARS-CoV-2は、ヌクレオカプシドを標的とするプライマーとプローブを備えたddPCRを使用して、咽頭スワブから検出されました。
Primers and probes targeting the human gene RPP30 was used as internal control to detect background sample material; Forward: 5’-GATTTGGACCTGCGAGCG-3’ (IDT), Reverse: 5’-GCGGCTGTCTCCACAAGT-3’ (IDT) and Probe: 5’-6FAM-CTGACCTGAAGGCTCT-3’ (Applied Biosystems, UK).
ヒト遺伝子RPP30を標的とするプライマーとプローブは、バックグラウンドサンプル材料を検出するための内部コントロールとして使用されました。
For RNA extraction, media from the swabs were collected and spun for 1 h at 21.000 x g at 4°C, supernatant was discarded and pellet dissolved in 200 mL TBS.
RNA抽出のために、スワブから培地を収集し、4°Cで21.000 x gで1時間回転させ、上清を廃棄し、ペレットを200 mLTBSに溶解しました。
RNA was extracted using QIAamp Viral RNA Mini Kit (Qiagen) according to manufacturer’s instruction and eluted in 70 mL buffer AVE.
RNAは、QIAamp Viral RNA Mini Kit(Qiagen)を製造元の指示に従って使用して抽出し、70mLバッファーAVEで溶出しました。
ddPCR was performed using Bio-Rad One-step RT ddPCR advanced kit according to the instructions.
ddPCRは、Bio-Rad One-step RTddPCRアドバンストキットを使用して指示に従って実行しました。
Samples were assayed in duplicates for SARS-CoV-2 with 10 mL RNA in each reaction and a final concentration of 1000 nM primer and 250 nM probe.
サンプルは、SARS-CoV-2について、各反応で10 mLのRNAを使用し、最終濃度が1000nMのプライマーと250nMのプローブで2回ずつアッセイされました。
Droplets were generated using the QX200 Droplet generator (BioRad) and amplified in a C1000 Touch Thermal Cycler (Bio-Rad) under the following conditions; 25°C for 3 min, 50°C for 1 h, 40 cycles of 95° C for 30 s and 55°C for 1 min, lastly 98°C for 10 min and infinite hold on 12°C.
液滴は、QX200液滴ジェネレーター(BioRad)を使用して生成され、C1000 Touchサーマルサイクラー(Bio-Rad)で次の条件下で増幅されました;25°Cで3分間、50°Cで1時間、95°Cで30秒間、55°Cで1分間を40サイクル、最後に98°Cで10分間、12°Cで無限に保持します。
Subsequently droplets were read in a QX200 droplet reader (Bio-Rad) and analysis was performed in QuantaSoftTM analysis software (Bio-Rad).
続いて、QX200液滴リーダー(Bio-Rad)で液滴を読み取り、QuantaSoftTM分析ソフトウェア(Bio-Rad)で分析を実行しました。
Total concentration per sample was calculated based on total N1 concentration per reaction.
サンプルあたりの総濃度は、反応あたりの総N1濃度に基づいて計算されました。
Non-template-control plates were run with nuclease-free water with a total of 176 wells to determine background signal yielding false positive events.
テンプレート以外のコントロールプレートは、ヌクレアーゼフリーの水と合計176ウェルで実行され、偽陽性イベントを生成するバックグラウンドシグナルを決定しました。
False positive events were found with 1 droplet/well in a total of 14 wells out of 176.
偽陽性イベントは、176個中合計14個のウェルで1滴/ウェルで検出されました。
To avoid false positive quantified signals in study-samples, positive outcomes were defined as ≧3 events per duplicate wells.
研究サンプルにおける偽陽性の定量化されたシグナルを回避するために、陽性の結果は、重複ウェルあたり≧3イベントとして定義されました。
3.5. HLA-A2 typing and dextramer staining by flow cytometry
For HLA-A2 typing cryopreserved PBMCs were thawed, stained at room temperature for 20 min with HLA-A2 (clone BB7.2, BioLegend Cat# 343328, RRID: AB_2721564) or matching isotype control (Biolegend #400356 ) and acquired on a five-laser Fortessa flow cytometer.
HLA-A2タイピングでは、凍結保存されたPBMCを解凍し、HLA-A2(クローンBB7.2、BioLegendカタログ番号343328、RRID:AB_2721564)またはマッチングアイソタイプコントロール(Biolegend#400356)で室温で20分間染色しました。5レーザーのフォルテッサフローサイトメーターで取得しました。
Overall, 113 participants were HLA-A2 positive, from which we analyzed 106 samples.
全体として、113人の参加者がHLA-A2陽性であり、そこから106個のサンプルを分析しました。
The dextramer stains were then performed on the HLA-A2 positive samples as previously described.
次に、前述のように、HLA-A2陽性サンプルに対してデキストラマー染色を行いました。
PBMCs were incubated at room temperature for 30 min with the following SARS-CoV-2 dextramers (all from Immundex): A*0201/TLACFVLAAVPE (WB3848-PE), A*0201/GMSRIGMEV-FITC (WB5751-FITC), A*0201/ LLLDRLNQL-APC (WB5762-APC), A*0201/ILLNKHIDA-PE (WB5848-PE), A*0201/RLNEVAKNL-FITC (WB5750-FITC), A*0201/YLQPRTFLLAPC (WB5824-APC), A*0201/VLNDILSRL-PE (WB5823-PE), A*0201/ NLNESLIDL-FITC (WB5850-FITC), A*0201/FIAGLIAIV-APC (WB5825-
APC), human corona virus 229E dextramer A*0201/LLLNCLWSV-PE (WB3513-PE), or positive/negative control dextramers: A*0201/ NLVPMVATV-PE (WB2132-PE, Pos. Control, CMV), A*0201/ NLVPMVATV-FITC (WB2132-FITC, Pos. Control, CMV), A*0201/ NLVPMVATV-APC (WB2132-APC, Pos. Control, CMV), A*0201/Neg. Control-PE (WB2666-PE), A*0201/Neg. Control-FITC (WB2666-FITC), A*0201/Neg. Control-APC (WB2666-APC).
PBMCは、次のSARS-CoV-2デキストラマー(すべてImmundex製)またはポジティブ/ネガティブコントロールデキストラマーとともに室温で30分間インキュベートしました。
Cells were washed and stained with viability dye (Zombie Violet, Biolegend, #423114 ) and CD8 (Clone RPA-T8, BD, #563795 ) and acquired on a five-laser Fortessa flow cytometer.
細胞を洗浄し、生存率色素(Zombie Violet、Biolegend、#423114)およびCD8(Clone RPA-T8、BD、#563795)で染色し、5レーザーFortessaフローサイトメーターで取得しました。
Data was analyzed using FlowJo (Version 10.7.1).
FlowJo(バージョン10.7.1)を使用してデータを分析しました。
3.6. Assisted contact tracing
Guidelines in Denmark dictates self-isolation until 48 h after symptom resolution.
デンマークのガイドラインでは、症状が解決してから48時間後まで自己隔離が規定されています。
Assisted contact tracing was done to determine if persistent post-symptomatic viral RNA positivity is associated with COVID-19 transmission.
持続的な発症後のウイルスRNA陽性がCOVID-19感染に関連しているかどうかを判断するために、支援されたコンタクトトレーシングが行われました。
We instructed individuals from the PCR positive group, to record each person they had been into close contact with (<2 m for >15 min) from >48 h after recovery and until the time point 1 study visit.
PCR陽性グループの個人に、回復後48時間以上から時点1の研究訪問まで、密接に接触した各個人を記録するように指示しました(2m以内で15分以上)。
Contacts (colleagues, household contacts, private contacts) that were infected during the symptomatic phase were excluded.
症状のある段階で感染した連絡先(同僚、世帯の連絡先、個人の連絡先)は除外されました。
Contacts where the index person had been wearing a face mask/visor and one-time contacts where the index person was not capable of knowing the future outcome were all excluded.
インデックス担当者がフェイスマスク/バイザーを着用していた連絡先と、インデックス担当者が将来の結果を知ることができなかった1回限りの連絡先はすべて除外されました。
3.7. Statistical analyses
Given the explorative nature of the study, no sample size calculations were performed.
研究の探索的性質を考慮して、サンプルサイズの計算は実行されませんでした。
Numbers of enrolled participants were based on the number of eligible study subjects within the time frame of the study.
登録された参加者の数は、調査の期間内の適格な調査対象の数に基づいていました。
Graphs and data analyses were performed using GraphPad Prism 7.0 and STATA 13.1.
グラフとデータ分析は、GraphPad Prism7.0とSTATA13.1を使用して実行されました。
Specific statistical tests to assess changes from baseline are called out in the figure legends.
ベースラインからの変化を評価するための特定の統計的検定は、図の凡例で示されています。
Test for normality distribution was by Shapiro-Wilk test.
正規性の分布の検定は、シャピロ-ウィルク検定によって行われました。
Mann-Whitney U test or Students t-test were used for comparison between groups as appropriate.
必要に応じて、グループ間の比較にマンホイットニーのU検定またはスチューデントのt検定を使用しました。
Spearman rank correlation coefficient was used to assess significant correlations.
スピアマンの順位相関係数を使用して、有意な相関を評価しました。
3.8. Role of the funding source
The funding source had no role in the study design, collection, analysis, and interpretation of data, writing of the paper or the decision to submit the paper for publication.
資金源は、研究の設計、収集、分析、データの解釈、論文の執筆、または論文を出版のために提出する決定に関与していませんでした。
4. Results
4.1. Cohort and study visits
We recruited 203 convalescent individuals with a history of a positive RT-PCR test for SARS-CoV-2 during acute infection.
急性感染時にSARS-CoV-2のRT-PCR検査で陽性の病歴を持つ203人の回復期の個人を募集しました。
Ninety-two (45.3%) of the participants were females.
参加者の92(45.3%)は女性でした。
There was no significant difference in age between males and females.
男性と女性の間で年齢に有意差はありませんでした。
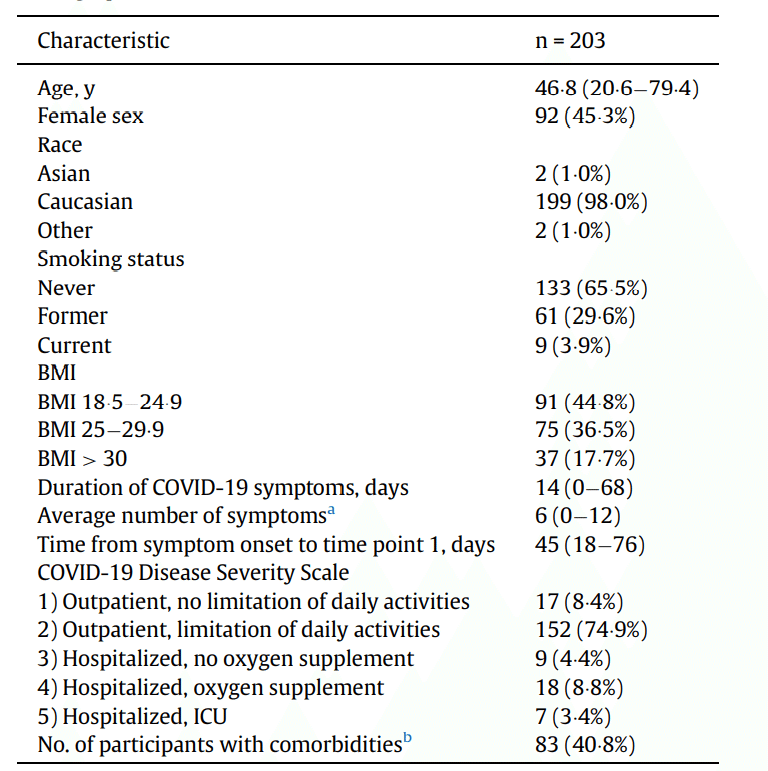
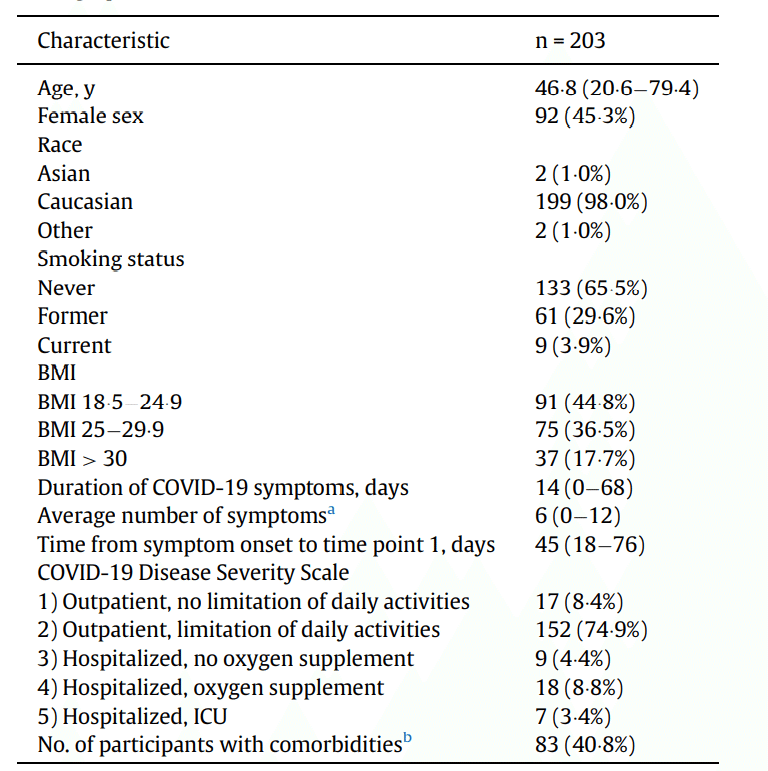
Baseline and clinical characteristics are shown in Table 1.
ベースラインと臨床的特徴を表1に示します。
At time point 1, all participants had fully recovered from COVID-19 symptoms (with the exception of loss of smell and/or taste and cognitive deficits).
時点1で、すべての参加者はCOVID-19の症状から完全に回復しました(匂いや味の喪失、認知障害を除く)。
Median time since onset of symptoms was 45 days (range: 18-76) and median time since recovery was 31 days (range: 14-61).
症状の発症からの期間の中央値は45日(範囲:18〜76)であり、回復からの期間の中央値は31日(範囲:14〜61)でした。
An additional pharyngeal swab was done for 93 of the 203 participants 4 months (time point 2) after onset of symptoms (median 108 days, range 68-127 for all 93 participants).
症状の発症から4か月後(時点2)、203人の参加者のうち93人に対して追加の咽頭スワブが行われました(中央値108日、93人の参加者全員で範囲68-127)。
COVID-19 severity (Table 1) in this cohort varied from grade 1 (8.4%) and 2 (74.9%) (both ambulatory) to requiring hospital admission without/with supplementary oxygen (4.4% and 8.8%) and intensive care unit treatment (3.4%).
このコホートのCOVID-19の重症度(表1)は、グレード1(8.4%)および2(74.9%)(両方とも外来)から、酸素補給の有無にかかわらず入院が必要(4.4%および8.8%)および集中治療室での治療 (3.4%)までさまざまでした。
4.2. Persistent SARS-CoV-2 PCR positivity after recovery of acute infection
At time point 1, 26 individuals (12.8% of 203) were positive for SARS-CoV-2 a median of 23 days (range 15-44) after full recovery.
時点1で、26人(203人の12.8%)が完全に回復してから中央値23日(範囲15〜44)でSARS-CoV-2に陽性でした。
Moreover, 5 individuals (5.3% of 93 individuals) were positive at time point 2 up to 105 days after recovery (median, range 85-105, for the 5 individuals) (Fig. 1a).
さらに、5人(93人の5.3%)は、回復後105日までの時点2で陽性でした(5人の場合、中央値、範囲85〜105)(図1a)。
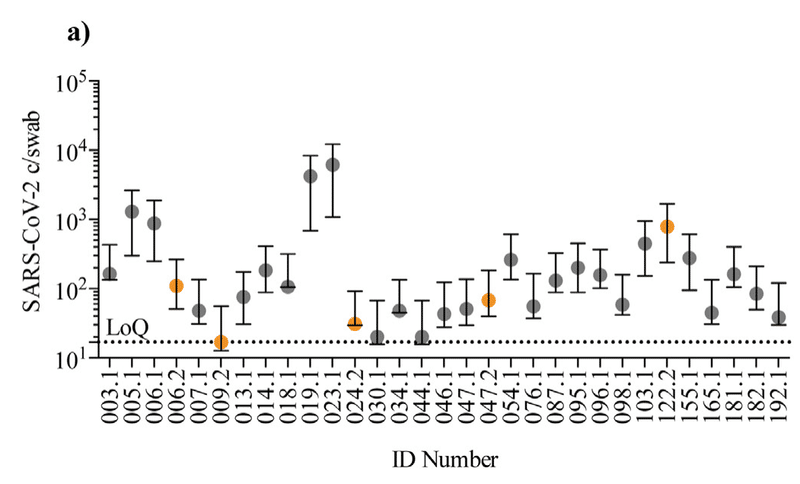
Only 2 of the 5 (ID 006 and 047) were positive on both time points.
5つのうち2つ(ID 006と047)のみが両方の時点で陽性でした。
The remaining 3 individuals testing positive only at time point 2, did not experience re-onset of COVID-19-like symptoms from time point 1 to time point 2.
残りの3人は、時点2でのみ陽性であり、時点1から時点2までCOVID-19のような症状の再発はありませんでした。
In total, 29 individuals (14.3%) tested positive several weeks-months after recovery.
合計で、29人(14.3%)が回復後数週間から数か月後に陽性を示しました。
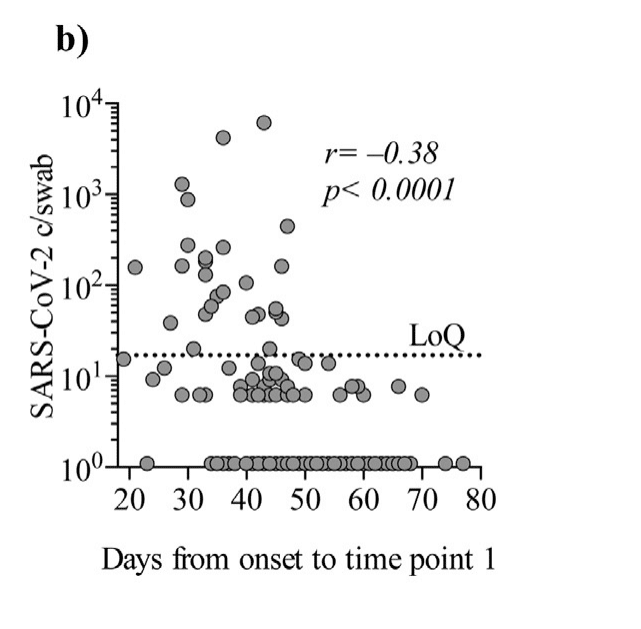
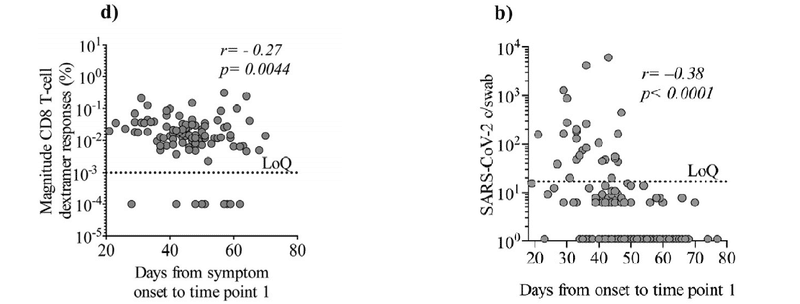
Timespan from onset of symptoms until time point 1 and viral copy numbers were inversely correlating (Spearman’s rank correlation coefficient: p < 00001, r = -038 Fig. 1b).
症状の発症から時点1までの期間とウイルスのコピー数は逆相関していました(スピアマンの順位相関係数:p <00001、r = -038 図1b)。
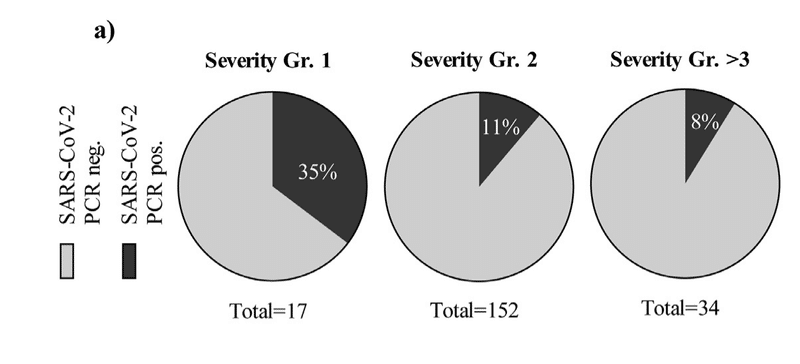
Further, a higher proportion of participants with grade 1, mild/asymptomatic COVID-19 illness had a positive PCR test at time point 1, compared to severity groups 2 or >3 (moderate illness, hospitalized or in ICU) (Fig. 2a).
さらに、重症度グループ2または> 3(中等度の病気、入院中またはICU)と比較して、時点1で陽性である割合が、グレード1の軽度/無症候性のCOVID-19疾患の参加者の方が大きかった(図2a)。
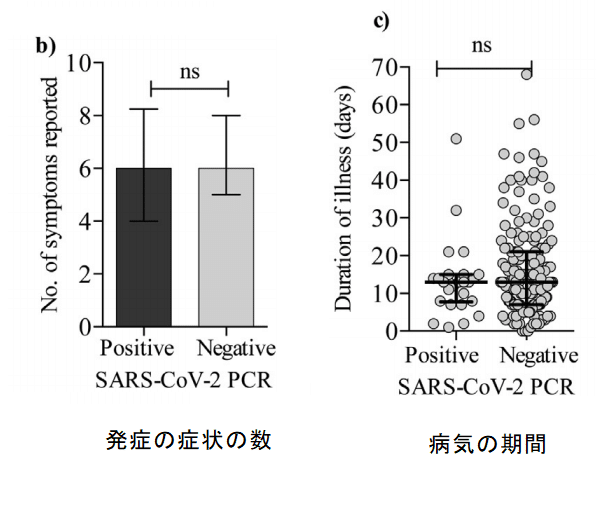
There was no difference in the number of symptoms reported (e.g. headache, fever, cough etc.) between the PCR positive and negative group (Fig. 2b) and no difference in the duration of illness (Fig. 2c).
PCR陽性群と陰性群の間で報告された症状(頭痛、発熱、咳など)の数に差はなく(図2b)、病気の期間にも差はありませんでした(図2c)。
We found, that for the negative vs. positive group, there was a significantly longer timespan from onset of illness until sample collection (Mann-Whitney U test: p < 00001) (Fig. 2d).
ネガティブグループとポジティブグループでは、病気の発症からサンプル収集までの期間が大幅に長いことがわかりました(マンホイットニーU検定:p <00001)(図2d)。
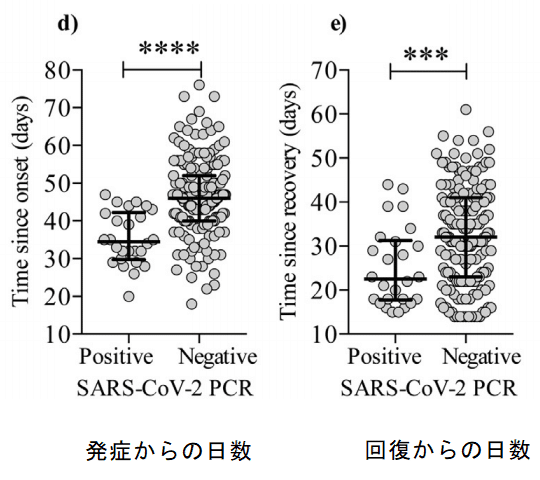
Also, timespan from recovery until sample collection was longer for the PCR negative vs. PCR positive group (Mann-Whitney U test: p = 0001) (Fig. 2e).
また、PCR陰性群とPCR陽性群では、回復からサンプル収集までの期間が長かった(マンホイットニーU検定:p = 0001)(図2e)。
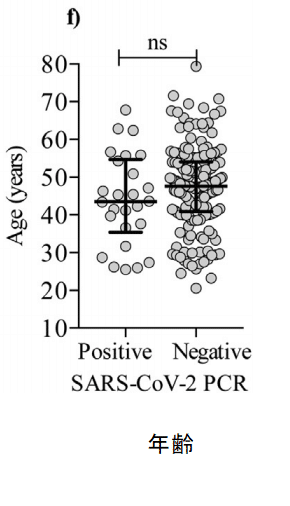
In contrast to previous reports, we did not find an association between age and persistent viral RNA detection (Fig. 2f).
以前のレポートとは対照的に、年齢と持続的なウイルスRNA検出との間に関連性は見つかりませんでした(図2f)。
In conclusion, while the fraction of SARS-CoV-2 PCR positive individuals declined over time for the entire cohort, we detected SARS-CoV-2 RNA for as long as 109 days after onset of COVID-19.
結論として、SARS-CoV-2 PCR陽性の個人の割合はコホート全体で時間の経過とともに減少しましたが、COVID-19の発症後109日間はSARS-CoV-2 RNAが検出されました。
We found that participants in COVID-19 disease severity group 1 were more likely to be persistently PCR positive.
COVID-19疾患重症度グループ1の参加者は、持続的にPCR陽性である可能性が高いことがわかりました。
4.3. Seroconversion does not affect viral RNA shedding
Next, we analyzed serum levels of SARS-CoV-2-specific total Ig, IgA, and IgM.
次に、SARS-CoV-2に特異的な総Ig、IgA、およびIgMの血清レベルを分析しました。
We found that 202 individuals (99.5%) had seroconverted at time point 1, a median of 45 days after symptom onset.
202人(99.5%)が時点1(症状発現してから45日後:中央値)で抗体陽転したことがわかりました。
Surprisingly, there was no difference in the levels of total Ig, IgA or IgM in the PCR positive vs. PCR negative group (Fig. 3a-c).
驚いたことに、PCR陽性群とPCR陰性群では、総Ig、IgA、またはIgMのレベルに差はありませんでした(図3a-c)。
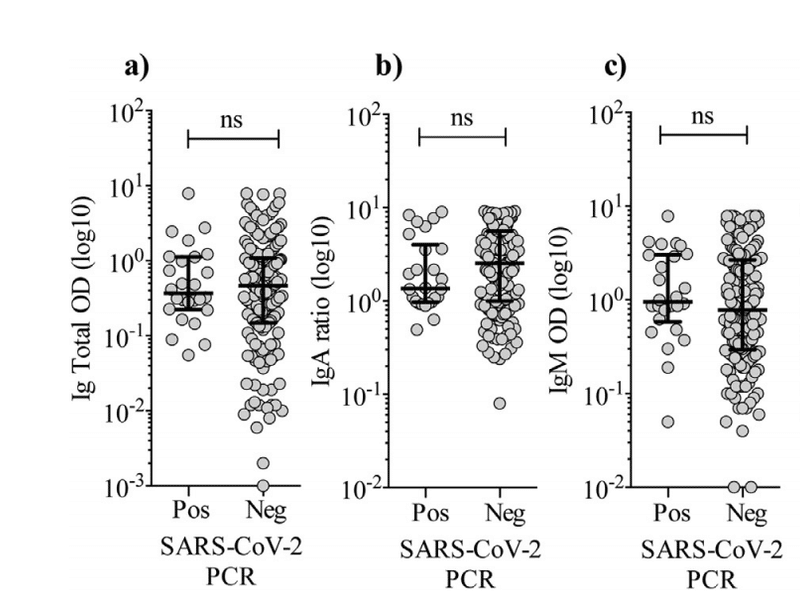
We divided the PCR positive individuals at time point 1 in two groups based on the level of total Ig, IgM, and IgA, respectively.
時点1のPCR陽性の個人を、それぞれ総Ig、IgM、IgAのレベルに基づいて2つのグループに分けました。
The groups consisted of the 50% highest (n = 102) and the 50% lowest (n = 101), total Ig, IgM, and IgA (Fig. 3d-e).
グループは、50%最高(n = 102)と50%最低(n = 101)、合計Ig、IgM、およびIgAで構成されていました(図3d-e)。
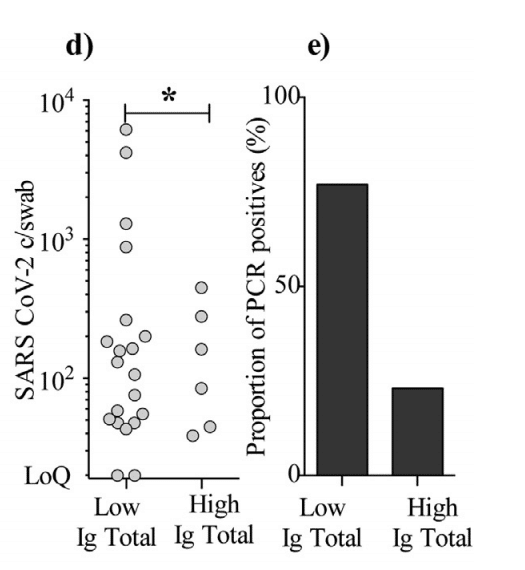
We found that the “high total Ig group” had a significantly lower SARS-CoV-2 copies/swab level and fewer PCR positives (6 individuals) compared to the “low total Ig group” (20 individuals) (Mann-Whitney U test: p = 0014).
「高総Igグループ」は、「低総Igグループ」(20人)と比較して、SARS-CoV-2コピー/スワブレベルが大幅に低く、PCR陽性(6人)が少ないことがわかりました。(マンホイットニーU検定:p = 0014)。
For IgA and IgM, the trend was similar but not statistically significant.
IgAとIgMの傾向は似ていましたが、統計的に有意ではありませんでした。
Thus, we conclude that seroconversion does not eliminate viral RNA from the pharyngeal mucosa, although a higher SARS-CoV-2-specific total Ig level may be associated with lower likelihood of persistent shedding.
したがって、SARS-CoV-2に特異的な総Igレベルが高いほど、持続的な脱落の可能性が低くなる可能性がありますが、セロコンバージョンによって咽頭粘膜からウイルスRNAが排除されるわけではないと結論付けます。
4.4. Contacts of persistent post-symptomatic SARS-CoV-2 PCR positive individuals
To assess if persistent post-symptomatic viral RNA shedding leads to increased risk of transmission, we conducted assisted contact tracing for each PCR positive individual.
持続的な発症後のウイルスRNA放出が感染リスクの増加につながるかどうかを評価するために、PCR陽性の各個人に対して支援されたコンタクトトレーシングを実施しました。
The number of close contacts varied greatly (Table 2), as some individuals were working from home or isolated themselves in fear of transmitting the virus, while most returned to work in e.g. primary health care settings like elderly ursing homes.
密接な連絡先の数は大きく異なります(表2)。一部の個人は自宅で仕事をしていたか、ウイルスの感染を恐れて孤立していましたが、ほとんどの人は高齢者のナーシングホームなどのプライマリヘルスケア環境で職場に戻っていました。
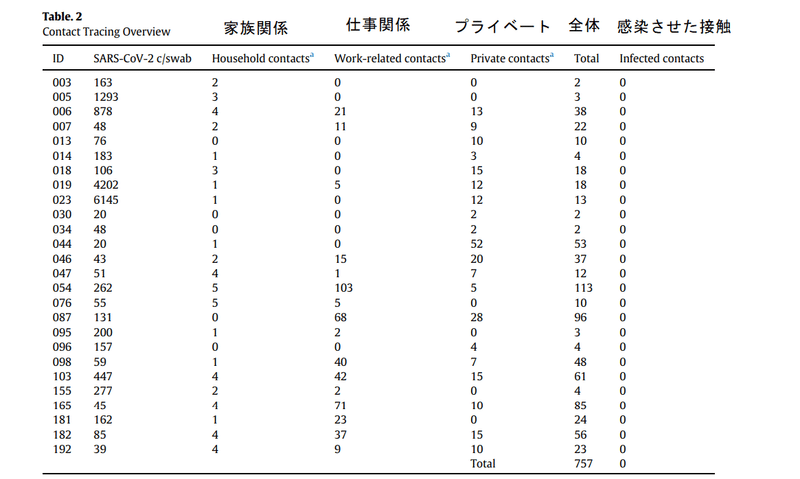
Among 757 close contacts, zero new COVID-19 infections were identified for a period of 23 days (median) after recovery, corresponding to a transmission risk of 0-0.13% for developing symptomatic COVID-19 among close contacts of persistent PCR positive individuals.
757の密接な接触の中で、回復後23日間(中央値)の間にゼロの新しいCOVID-19感染が確認されました。これは、持続的なPCR陽性の個人の密接な接触の中で症候性COVID-19を発症する感染リスク0〜0.13%に相当します。
Therefore we conclude that fully recovered individuals with persistent viral RNA shedding are unlikely to be a significant source of SARS-CoV-2 transmission.
したがって、ウイルスRNAの放出が持続する完全に回復した個人が、SARS-CoV-2感染の重要な原因になる可能性は低いと結論付けています。
4.5. Breadth and magnitude of CD8 T-cell responses are increased in persistent PCR positive individuals
We analyzed SARS-CoV-2-specific CD8 T-cell responses using a dextramer stain investigating nine different CD8 T cell epitopes.
9つの異なるCD8T細胞エピトープを調査するデキストラマー染色を使用して、SARS-CoV-2特異的CD8T細胞応答を分析しました。
We found that individuals with a higher pharyngeal viral load also had increased breadth and magnitude of the SARS-CoV-2-specific CD8 Tcell responses (Fig. 4a-b).
咽頭ウイルス量が多い人は、SARS-CoV-2特異的CD8 T細胞応答の幅と大きさも増加していることがわかりました(図4a-b)。
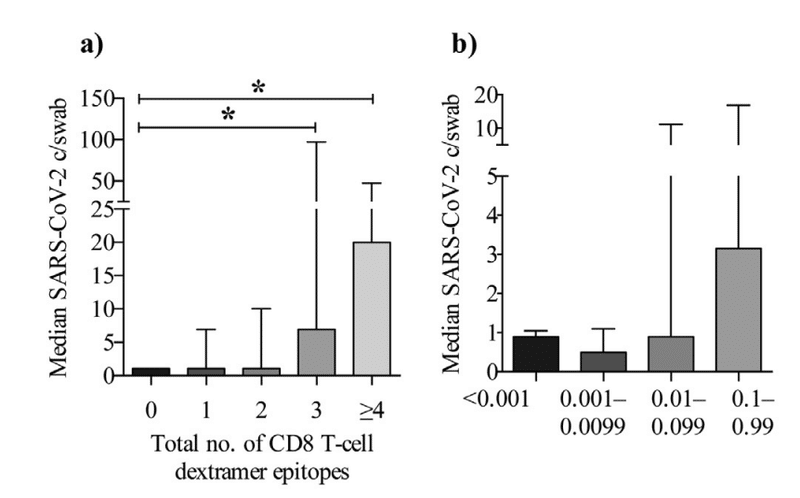
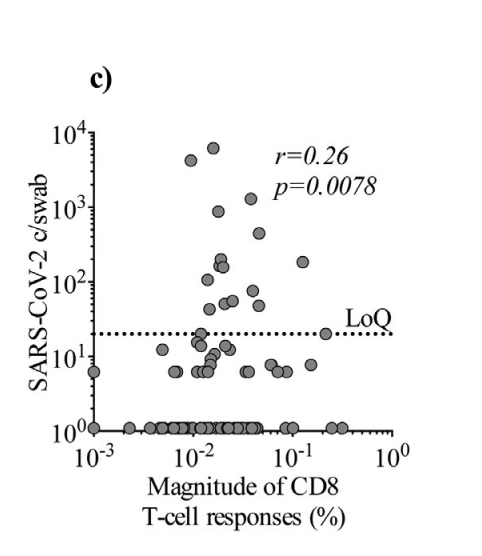
Further, we found that the magnitude of the CD8 response correlated with SARS-CoV-2 copies/swab (Spearman’s rank correlation coefficient: p = 0.0078, r = 0.26), suggesting that a higher viral load maintains a CD8 T-cell response (Fig. 4c).
さらに、CD8応答の大きさはSARS-CoV-2コピー/スワブと相関していることがわかり(スピアマンの順位相関係数:p = 0.0078、r = 0.26)、ウイルス量が多いほどCD8 T細胞応答が維持されることが示唆されます(図4c)。
Also, we found a negative correlation (Spearman’s rank correlation coefficient: p = 0.0044, r = -0.27) between the magnitude of the CD8 T-cell response and time from symptom onset to sample collection, indicating that the CD8 T-cell response wanes over time (Fig. 4d) comparable to what was observed for pharyngeal viral load (Fig. 1b).
また、CD8 T細胞応答の大きさと症状の発症からサンプル収集までの時間の間に負の相関(スピアマンの順位相関係数:p = 0.0044、r = -0.27)が見つかりました。CD8 T細胞応答が時間の経過とともに衰えることを示し(図4d)、咽頭ウイルス量で観察されたもの(図1b)に匹敵します。
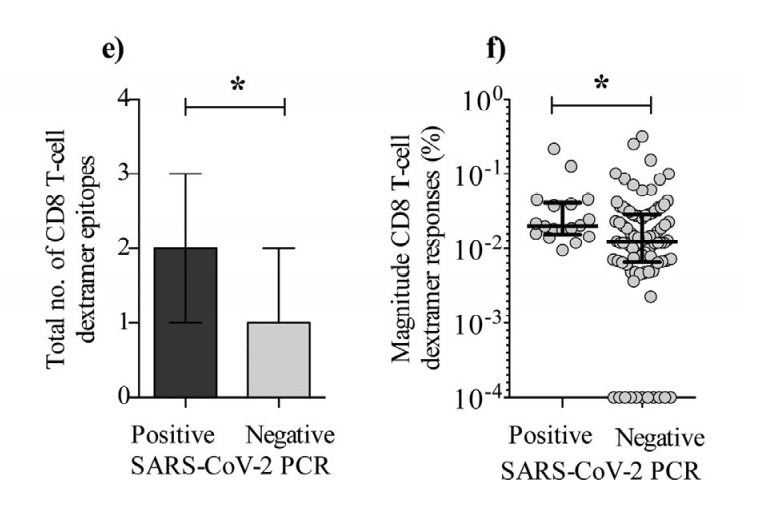
Lastly, we found that persistently PCR positive individuals had increased breadth and magnitude of the SARS-CoV-2-specific CD8 T-cell response compared to PCR negative individuals (Fig. 4e-f).
最後に、持続的にPCR陽性の個体は、PCR陰性の個体と比較して、SARS-CoV-2特異的CD8 T細胞応答の幅と大きさが増加していることがわかりました(図4e-f)。
Based on the data, we find evidence that persistent PCR positive individuals exhibits elevated SARS-CoV-2-specific CD8 T-cell immune responses.
データに基づいて、持続的なPCR陽性の個人がSARS-CoV-2特異的CD8T細胞免疫応答の上昇を示すという証拠が見つかりました。
5. Discussion
Our finding that a total of 14.3% of the participants were repeatedly PCR positive for a prolonged period after recovery is in line with previous data.
参加者の合計14.3%が、回復後長期間にわたって繰り返しPCR陽性であったという私たちの発見は、以前のデータと一致しています。
However, the duration of this period is greater than any previously reported (up to 109 days after onset for this cohort).
ただし、この期間の期間は、以前に報告されたどの期間よりも長くなります(このコホートの発症後最大109日)。
Further, during follow-up, a subset of participants had remarkably high viral loads (10³ copies per swab) which is comparable to what is found in symptomatic/acutely affected individuals despite our sampling being more than 4 weeks after symptoms onset.
さらに、フォローアップ中、参加者のサブセットは、症状の発症から4週間以上経過しているにもかかわらず、症状のある/急性の影響を受けた個人に見られるものに匹敵する非常に高いウイルス量(綿棒あたり10³コピー)を持っていました。
In contrast to previous studies, which have focused on the fraction of infected who are severely il, our cohort consisted mainly of non-hospitalized individuals, which also represents the majority of COVID-19 cases.
重症の感染者の割合に焦点を当てた以前の研究とは対照的に、私たちのコホートは主に入院していない個人で構成されており、これもCOVID-19症例の大部分を表しています。
Thus, the data presented here is representative for the general population and the results have high external validity.
したがって、ここに示されているデータは一般の人々を代表するものであり、結果には高い外部妥当性があります。
During SARS-CoV-2 infection, most individuals develop varying levels of neutralizing antibodies, with higher titers observed in severe cases.
SARS-CoV-2感染中、ほとんどの人はさまざまなレベルの中和抗体を発現し、重症の場合はより高い力価が観察されます。
Additionally, studies demonstrate that SARS-CoV-2- specific T-cell immunity is also induced and some SARS-CoV2 exposed individuals, even develop T-cell responses in the absence of antibodies.
さらに、研究によると、SARS-CoV-2特異的T細胞免疫も誘導され、一部のSARS-CoV2曝露者は、抗体がない場合でもT細胞応答を発症します。
Also, previously SARS-CoV-1 infected individuals possess preserved memory T cells which are responsive to SARS-CoV2 years after the 2003-SARS outbreak.
また、以前にSARS-CoV-1に感染した個人は、2003-SARSの発生から2年後にSARS-CoV2に反応するメモリーT細胞を保存しています。
Thus, T cells are likely crucial for the protection against and eradication of SARS-CoV-2.
したがって、T細胞はSARS-CoV-2に対する保護と根絶に不可欠である可能性があります。
Interestingly, we found that on a cohort level, seroconversion did not affect SARS-CoV-2 RNA shedding, as individuals with high antibody levels were also observed in the PCR positive group.
興味深いことに、PCR陽性グループでも抗体レベルの高い個体が観察されたため、コホートレベルでは、セロコンバージョンはSARS-CoV-2RNAをそぎ落とすことに影響を与えないことがわかりました。
We also observed that individuals with immunoglobulin levels around or below the limit of detection were found in the PCR negative group.
また、PCR陰性グループで、検出限界付近またはそれ以下の免疫グロブリンレベルを持つ個人が見つかったことも観察されました。
Therefore, seroconversion is not a requisite leading to complete elimination of viral RNA.
したがって、セロコンバージョンはウイルスRNAの完全な排除につながる必要条件ではありません。
On the contrary, we found that levels of SARSCoV-2-specific CD8 T cells were increased in PCR positive individuals.
それどころか、SARSCoV-2特異的CD8T細胞のレベルがPCR陽性の個体で増加することを発見しました。
We consider this finding important, for the following reasons;
以下の理由により、この発見は重要であると考えています。
It has been suggested that persistent PCR positive signals originate from nucleic acid remnants and also shown that SARS-CoV-2 outgrowth cultures can only be established if a corresponding RT-PCR Ct value is below 24, implying that above this threshold, in vitro infectivity is insignificant.
持続的なPCR陽性シグナルは核酸の残骸に由来することが示唆されており、SARS-CoV-2増殖培養は、対応するRT-PCR Ct値が24未満の場合にのみ確立できることも示されており、このしきい値を超えると、invitroでの感染力は重要ではないことを意味します。
We used ddPCR, which is more sensitive and allows for an absolute quantitation of copy numbers as compared to RT-PCR.
RT-PCRと比較して、感度が高く、コピー数の絶対的な定量化が可能なddPCRを使用しました。
As opposed to RT-PCR, ddPCR is shown to have a sensitivity of 100% in detecting SARS-CoV-2.
RT-PCRとは対照的に、ddPCRはSARS-CoV-2の検出において100%の感度を持つことが示されています。
Moreover, the RT-PCR assay is implemented with several different protocols and approaches around the world, why the Ct values are not reproducible and comparable across laboratories, machines or sample techniques.
さらに、RT-PCRアッセイは、世界中のいくつかの異なるプロトコルとアプローチで実装されています。そのため、Ct値は再現性がなく、実験室、機械、サンプル技術間で比較できません。
We did not perform outgrowth culture of virus, as this also has certain limitations when viral copy numbers are relatively low.
ウイルスのコピー数が比較的少ない場合にも一定の制限があるため、ウイルスの増殖培養は実行しませんでした。
Pharyngeal swabs also collect mucosal neutralizing IgA, which can opsonize viral particles and thus bias the outcome of a swab-based culture.
咽頭スワブは粘膜中和IgAも収集します。これにより、ウイルス粒子がオプソニン化され、スワブベースの培養の結果にバイアスがかかる可能性があります。
Further, the minimal amount of virus necessary in a biological specimen to initiate and propagate infection in vitro remains undefined making it even harder for in vivo projections.
さらに、in vitroで感染を開始および伝播するために生体試料に必要なウイルスの最小量は未定義のままであり、invivoでの予測はさらに困難になります。
Given that RNA is labile and based on the anti-SARS-CoV-2 CD8 T cell data presented here, we propose that virus from persistent PCR positive individuals is in fact viable and/or intact, but that other factors, like e.g. mucosal IgA, prevents transmission.
RNAは不安定であり、ここに示す抗SARS-CoV-2 CD8 T細胞データに基づいていることを考えると、持続性PCR陽性の個体からのウイルスは実際に生存可能および/または無傷であると提案します。しかし、他の要因、例えば 粘膜IgAは、感染を防ぎます。
Our observation, that SARSCoV-2 is detectable months after recovery is in line with one other study, which recovered nucleic acids in the gut of convalescent individuals, associated with ongoing antibody evolution.
SARSCoV-2が回復してから数か月後に検出可能であるという私たちの観察は、他の1つの研究と一致しています。その研究は、進行中の抗体の進化に関連して、回復期の個人の腸内の核酸を回収しました。
This antigen carrier state could become clinically significant if persistent PCR positive individuals are subsequently immunosuppressed.
この抗原キャリア状態は、持続的なPCR陽性の個人がその後免疫抑制される場合、臨床的に重要になる可能性があります。
Data on other virus infections (MERS-CoV, SARS-CoV-1, Ebola virus, Zika virus, Measles) demonstrate that viral shedding may be detectable for weeksmonths after recovery despite ongoing antiviral immune responses and therefore this phenomenon is not unique to SARS-CoV-2.
他のウイルス感染(MERS-CoV、SARS-CoV-1、エボラウイルス、ジカウイルス、はしか)に関するデータは、進行中の抗ウイルス免疫応答にもかかわらず、回復後数週間はウイルス排出が検出される可能性があることを示していますしたがって、この現象はSARS-CoV-2に固有のものではありません。
An interesting perspective could be whether persistent viral RNA shedding leads to more durable immunity in these individuals.
興味深い視点は、持続的なウイルスRNAの放出が、これらの個人の免疫をより持続させるかどうかということかもしれません。
Follow-up studies addressing this issue are needed.
この問題に対処する追跡調査が必要です。
We show that individuals with persistent virus are not contagious, as we performed extensive assisted contact tracing and were unable to identify a single case of transmission from these post-symptomatic carriers.
広範囲にわたるコンタクトトレーシングの支援を実施し、これらの無症候性キャリアからの感染の単一の症例を特定できなかったため、持続性ウイルスを持つ個人は伝染性ではないことを示しています。
A limitation is that we did not test the contacts of the index persons and by our exclusion of one-time contacts.
制限は、インデックス担当者の連絡先をテストしておらず、1回限りの連絡先を除外していることです。
Another limitation to our conclusion, is that we cannot definitively rule out, that the 3 individuals who only tested positive at time point 2 were not in fact re-infections.
私たちの結論に対するもう1つの制限は、時点2でのみ陽性と判定された3人の個人が、実際には再感染ではなかったことを明確に除外できないことです。
We do however find the possibility of re-infections unlikely, because studying risk of transmission in a Danish setting has been optimal for the following reasons;
ただし、デンマークの環境での伝染リスクの調査は次の理由から最適であるため、再感染の可能性は低いと考えられます。
Danish authorities have not encouraged the use of facemasks until July 31st, and thus not during the time of this study.
デンマーク当局は7月31日までフェイスマスクの使用を推奨しておらず、したがってこの調査期間中は推奨していません。
The use of them in public has been completely absent.
公共の場での使用は完全にありません。
Further, testing for COVID-19 is free and widely available even without symptoms or referral.
さらに、COVID-19の検査は無料で、症状や紹介がなくても広く利用できます。
During AprilJune 2020, R0 has been below or equal to 1 in Denmark and comprehensive measures were taken by authorities to prevent community transmission.
2020年4月から6月の間、デンマークではR0が1以下であり、コミュニティの感染を防ぐために当局によって包括的な対策が講じられました。
Re-infection is a very rare event even in high-prevalence areas.
再感染は、有病率の高い地域でも非常にまれなイベントです。
With low prevalence of COVID19, new infections or debut of COVID-19 symptoms in the closest relations were efficiently traced, detected and tested.
COVID19の有病率が低いため、最も近い関係でのCOVID-19症状の新たな感染またはデビューが効率的に追跡、検出、およびテストされました。
We find it unlikely that transmission events resulting in symptomatic infection would go unnoticed.
症候性感染を引き起こす伝染イベントが見過ごされる可能性は低いと思われます。
Asymptomatic infections may however have gone undocumented.
ただし、無症候性の感染は文書化されていない可能性があります。
Our conclusion, that post-symptomatic persistent virus is not transmitted in vivo is in line with previous studies suggesting, that most transmissions occur in the pre-symptomatic stage.
症状後の持続性ウイルスはinvivoで感染しないという結論は、ほとんどの感染が症状前の段階で発生することを示唆する以前の研究と一致しています。
We therefore conclude, that SARS-CoV-2 RNA can be recovered in pharyngeal mucosa ≧105 days after recovery.
したがって、SARS-CoV-2 RNAは、回復後105日以上で咽頭粘膜で回復する可能性があります。
Further, insufficient levels of circulating SARS-CoV-2-specific antibodies do not explain this persistent viral RNA shedding.
さらに、循環するSARS-CoV-2特異的抗体のレベルが不十分であっても、この持続的なウイルスRNAの放出を説明することはできません。
SARS-CoV-2 RNA detection is characterized by an increased anti-SARS-CoV-2-specific CD8 T-cell response suggestive of low-level viral persistence resulting in ongoing immune stimulation.
SARS-CoV-2 RNA検出は、進行中の免疫刺激をもたらす低レベルのウイルス持続性を示唆する抗SARS-CoV-2特異的CD8T細胞応答の増加を特徴としています。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
