JN.1 系統の SLip、FLiRT、および KP.2 の中和回避、感染力および膜融合における特徴
Characteristics of JN.1-derived SARS-CoV-2 subvariants SLip, FLiRT, and KP.2 in neutralization escape, infectivity and membrane fusion
JN.1 由来の SARS-CoV-2 サブバリアント SLip、FLiRT、および KP.2 の中和回避、感染力および膜融合における特徴
SUMMARY
SARS-CoV-2 variants derived from the immune evasive JN.1 are on the rise worldwide.
免疫回避性 JN.1 に由来する SARS-CoV-2 変異種は世界中で増加しています。
Here, we investigated JN.1-derived subvariants SLip, FLiRT, and KP.2 for their ability to be neutralized by antibodies in bivalent-vaccinated human sera, XBB.1.5 monovalent-vaccinated hamster sera, sera from people infected during the BA.2.86/JN.1 wave, and class III monoclonal antibody (Mab) S309.
ここでは、JN.1 由来のサブバリアント SLip、FLiRT、および KP.2 について、二価ワクチン接種されたヒト血清、XBB.1.5一価ワクチン接種ハムスター血清、BA.2.86/JN.1波の間に感染した人々からの血清中の抗体、およびクラスIIIモノクローナル抗体(Mab)S309によって中和される能力を調査しました。
We found that compared to parental JN.1, SLip and KP.2, and especially FLiRT, exhibit increased resistance to COVID-19 bivalent-vaccinated human sera and BA.2.86/JN.1-wave convalescent sera.
親JN.1と比較して、SLipおよびKP.2、特にFLiRTは、COVID-19 2価ワクチン接種ヒト血清およびBA.2.86/JN.1波回復期血清に対して耐性が増加していることが判明した。
Interestingly, antibodies in XBB.1.5 monovalent vaccinated hamster sera robustly neutralized FLiRT and KP.2 but had reduced efficiency for SLip.
興味深いことに、XBB.1.5 一価ワクチン接種ハムスター血清中の抗体は FLiRT および KP.2 を強力に中和しましたが、SLip に対する効率は低下していました。
These JN.1 subvariants were resistant to neutralization by Mab S309.
これらの JN.1 サブバリアントは、Mab S309 による中和に耐性がありました。
In addition, we investigated aspects of spike protein biology including infectivity, cell-cell fusion and processing, and found that these subvariants, especially SLip, had a decreased infectivity and membrane fusion relative to JN.1, correlating with decreased spike processing.
さらに、感染力、細胞間融合、プロセシングなどのスパイクタンパク質生物学の側面を調査したところ、これらのサブバリアント、特にSLipはJN.1と比較して感染力と膜融合が低下しており、スパイクプロセシングの低下と相関していることが判明した。
Homology modeling revealed that L455S and F456L mutations in SLip reduced local hydrophobicity in the spike and hence its binding to ACE2.
相同性モデリングにより、SLip の L455S および F456L 変異によりスパイクの局所的な疎水性が低下し、したがって ACE2 への結合が低下することが明らかになりました。
In contrast, the additional R346T mutation in FLiRT and KP.2 strengthened conformational support of the receptor-binding motif, thus counteracting the effects of L455S and F456L.
対照的に、FLiRT および KP.2 における追加の R346T 変異は、受容体結合モチーフの立体構造のサポートを強化し、L455S および F456L の効果を打ち消しました。
These three mutations, alongside D339H, which is present in all JN.1 sublineages, alter the epitopes targeted by therapeutic Mabs, including class I and class III S309, explaining their reduced sensitivity to neutralization by sera and S309.
これら 3 つの変異は、すべての JN.1 亜系統に存在する D339H と並んで、クラス I およびクラス III S309 を含む治療用 Mab の標的となるエピトープを変化させ、血清および S309 による中和に対する感受性の低下を説明します。
Together, our findings provide insight into neutralization resistance of newly emerged JN.1 subvariants and suggest that future vaccine formulations should consider JN.1 spike as immunogen, although the current XBB.1.5 monovalent vaccine could still offer adequate protection.
まとめると、我々の発見は、新しく出現したJN.1サブバリアントの中和耐性についての洞察を提供し、現在のXBB.1.5一価ワクチンは依然として十分な防御を提供できる可能性があるが、将来のワクチン製剤ではJN.1スパイクを免疫原として考慮する必要があることを示唆しています。
INTRODUCTION
Tracking the ongoing evolution of SARS-CoV-2 and its impacts on spike protein biology, particularly sensitivity to neutralizing antibodies, is critical as the pandemic continues.
SARS-CoV-2の進行中の進化とスパイクタンパク質の生物学への影響、特に中和抗体に対する感受性を追跡することは、パンデミックが続く中重要である。
The pandemic underwent a turning point in late summer 2023 with the emergence of BA.2.86, a variant characterized by over 30 spike protein mutations relative to then dominate variant XBB.1.5.
パンデミックは、2023 年の夏の終わりに、当時主流だった変異体 XBB.1.5 と比較して 30 を超えるスパイクタンパク質の変異を特徴とする変異体 BA.2.86 の出現により転換点を迎えました。
Fortunately, despite its myriad mutations, BA.2.86 did not exhibit increased immune evasion, but was better neutralized by antibodies in convalescent and vaccinated sera relative to XBB-lineage variants.
幸いなことに、その無数の突然変異にもかかわらず、 BA.2.86は免疫回避の増加を示さず、XBB系統変異体と比較して、回復期血清およびワクチン接種血清中の抗体によってよりよく中和された。
However, mounting concern has arisen with the subsequent variants that have evolved from BA.2.86.
しかし、BA.2.86 から進化した後続の亜種に関しては懸念が高まっています。
This includes JN.1, which emerged in late 2023 and is characterized by the single spike mutation L455S relative to BA.2.86.
これには、2023 年後半に出現し、BA.2.86 と比較して単一のスパイク変異 L455S を特徴とする JN.1 が含まれます。
This single mutation launched JN.1 to dominance worldwide from late 2023 through May 2024.
この単一の変異により、JN.1 は 2023 年末から 2024 年 5 月まで世界中で優勢になりました。
L455S contributes to the lower affinity of JN.1 for human ACE2 but enhances its immune evasion to neutralizing antibodies and viral transmission.
L455S は、ヒト ACE2 に対する JN.1 の親和性の低下に寄与しますが、中和抗体およびウイルス感染に対する免疫回避を強化します。
Since JN.1’s emergence, a series of variants that possess mutations at key sites in spike have been identified, including L455, F456, and R346 (Figure 1A).
JN.1 の出現以来、L455、F456、R346 など、スパイクの主要な部位に変異を持つ一連の変異体が特定されています (図 1A)。

Initially, the so-called FLip variants emerged, possessing L455F and F456L mutations in the backbone of XBB.1.5 , hence the name “FLip”.
当初、XBB.1.5 のバックボーンに L455F および F456L 変異を持つ、いわゆる FLip 変異体が出現し、そのため「FLip」と呼ばれるようになりました。
These sites have continued to be hotspots, with a strain called “SLip” having emerged, which has the JN.1 spike protein with the F456L mutation - the “S” referring to the L455S mutation that characterizes JN.1.
これらの部位は引き続きホットスポットであり、「SLip」と呼ばれる株が出現しました。この株は、F456L 変異を持つ JN.1 スパイクタンパク質を持っています。「S」は、JN.1 を特徴づける L455S 変異を指します。
More recently, we have seen the emergence of the FLiRT variant, which harbors an additional R346T mutation in the backbone of SLip.
さらに最近では、SLip のバックボーンに追加の R346T 変異を保有する FLiRT 変異体の出現が確認されました。
Another variant, called KP.2, contains both R346T in S1 as well as an V1140L mutation in S2.
KP.2 と呼ばれる別の変異体には、S1 の R346T と S2 の V1140L 変異の両方が含まれています。
JN.1 is currently waning in dominance around the world, becoming quickly supplanted in circulation by KP.2 and other JN.1 derived variants (Figure 1B).
JN.1 は現在、世界中でその優位性が薄れており、急速に KP.2 やその他の JN.1 派生亜種に取って代わられています (図 1B)。

It has been shown that JN.1 can be neutralized by XBB.1.5-monovalent vaccinated sera, albeit with a reduced efficiency.
JN.1 は、効率は低下しますが、XBB.1.5 で一価ワクチン接種された血清によって中和できることが示されています。
However, it is currently unclear whether additional spike mutations gained in the JN.1 lineage subvariants will affect the efficacy of this COVID-19 vaccine formulation, especially with the approach of upcoming fall and winter seasons.
しかし、JN.1系統サブバリアントで得られた追加のスパイク変異が、特にこれから秋から冬の季節が近づいている場合に、このCOVID-19ワクチン製剤の有効性に影響を与えるかどうかは現時点では不明である。
In this study, we investigated the ability of SLip, FLiRT, and KP.2, in parallel with their parental JN.1, to be neutralized by sera from: (i) individuals vaccinated with at least 2 doses of monovalent ancestral spike (wildtype, WT) mRNA vaccine with 1 dose of bivalent WT+BA.4/5 booster, (ii) hamsters vaccinated with 2 doses of XBB.1.5 monovalent recombinant mumps vaccine, and (iii) individuals infected during the BA.2.86/JN.1-wave of infection in Columbus, OH.
この研究では、親の JN.1 と並行して、SLip、FLiRT、および KP.2 が以下の血清によって中和される能力を調査しました。:①二価 WT+BA.4/5 ブースター 1 回分を含む一価祖先スパイク (野生型、WT) mRNA ワクチンを少なくとも 2 回接種された個体、②XBB.1.5一価組換えムンプスワクチンを2回接種したハムスター、③オハイオ州コロンバスにおける BA.2.86/JN.1 感染の波の間に感染した個人。
These analyses were conducted alongside the ancestral D614G and are supplemented with antigenic cartography analyses.
これらの分析は祖先 D614G と並行して実施され、抗原地図作成分析によって補足されています。
We also characterized the entry and fusogenicity of these variants in 293T-ACE2 and CaLu-3 cells, as well as the spike processing and expression on plasma membranes.
我々はまた、293T-ACE2 および CaLu-3 細胞におけるこれらの変異体の侵入と融合誘発性、ならびに細胞膜上のスパイクプロセシングと発現を特徴付けました。
Critically, our investigation focuses on the comparison between XBB.1.5 and JN.1 as immunogens against these JN.1-lineage variants and determines whether any dramatic changes in spike protein biology have occurred, as well as their impact on neutralization escape and viral infectivity.
重要なことに、 私たちの調査は、これらの JN.1 系統変異に対する免疫原としての XBB.1.5 と JN.1 の比較に焦点を当てており、スパイクタンパク質の生物学に劇的な変化が起こったかどうか、またそれらが中和回避やウイルス感染力に及ぼす影響を明らかにしています。
RESULTS
Impacts of JN.1-derived variants on viral entry and infectivity in 293T-ACE2 and CaLu-3 cells
293T-ACE2 および CaLu-3 細胞におけるウイルス侵入と感染力に対する JN.1 由来の変異体の影響
We first investigated the efficiency in which pseudotyped lentiviruses bearing SARS-CoV-2 spikes of interest can enter 293T cells overexpressing human ACE2 (293T-ACE2) and human lung epithelial cell line CaLu-3.
我々はまず、対象となるSARS-CoV-2スパイクを有するシュードタイプレンチウイルスが、ヒトACE2(293T-ACE2)を過剰発現する293T細胞およびヒト肺上皮細胞株CaLu-3に侵入できる効率を調査した。
As reported previously by our group, earlier Omicron variants, including BA.2 and XBB.1.5, exhibited higher infectivity relative to the ancestral D614G variant in 293T-ACE2 cells; however, infectivity decreased modestly for BA.2.86 and JN.1 (Figure 1C).
私たちのグループによって以前に報告されたように、BA.2 および XBB.1.5 を含む初期の Omicron 変異体は、293T-ACE2 細胞において祖先 D614G 変異体と比較してより高い感染力を示しました;ただし、BA.2.86 および JN.1 では感染力がわずかに減少しました (図 1C)。

Here we found that while FLiRT exhibited a similar infectivity to JN.1 in this cell line, KP.2 (p > 0.05), and especially SLip (p < 0.05), demonstrated modest reductions compared to JN.1 (Figure 1C).
ここで、FLiRT はこの細胞株で JN.1 と同様の感染力を示しましたが、KP.2 (p > 0.05)、特に SLip (p < 0.05) は JN.1 と比較して適度な減少を示したことがわかりました (図 1C)。
As we demonstrated previously, Omicron variants maintain a markedly reduced infectivity in CaLu-3 cells relative to D614G, with a notable increase for BA.2.86.
以前に実証したように、Omicron 変異体は、D614G と比較して CaLu-3 細胞における感染力の顕著な低下を維持しており、BA.2.86 では顕著な増加を示しています。
However, we observed here that JN.1, SLip, FLiRT and KP.2 exhibited decreased infectivity in CaLu-3 cells compared to BA.2.86 (p < 0.0001 for all), with SLip exhibiting the lowest infectivity of the group, ~2.2-fold decrease compared to JN.1 (p < 0.001) (Figure 1D).
ただし、ここでは、JN.1、SLip、FLiRT、および KP.2 が BA.2.86 と比較して CaLu-3 細胞の感染力の低下を示したことが観察されました (すべて p < 0.0001)。 Slip はグループ内で最も低い感染力を示し、JN.1 と比較して約 2.2 倍減少しました (p < 0.001) (図 1D)。

Overall, the recently emerged FLiRT and KP.2 subvariants, especially SLip, exhibit decreased infectivity in CaLu3 cells compared to earlier variants BA.2 and XBB.1.5, as well as their parental BA.2.86.
全体として、最近出現した FLiRT および KP.2 サブバリアント、特に SLip は、初期のバリアント BA.2 および XBB.1.5、およびその親 BA.2.86 と比較して、CaLu3 細胞における感染力の低下を示します。
Increased resistance of SLip, FLiRT and KP.2 to COVID-19 bivalent vaccinated human sera by newer variants compared to parental JN.1
新しい変異体によるCOVID-19 2価ワクチン接種ヒト血清に対するSLip、FLiRTおよびKP.2の耐性の増加(親のJN.1との比較)
To test the extent of escape from neutralization by selected variants, we first used sera were from a cohort of healthcare workers (HCWs) at The Ohio State University Wexner Medical Center, who had received at least 2 doses of monovalent mRNA vaccine (WT) plus at least 1 dose of bivalent vaccine containing both WT and BA.4/5 spikes (n=10) (Figures 2A-B).
選択した変異体による中和からの回避の程度をテストするために、私たちが最初に使用した血清は、オハイオ州立大学ウェクスナー医療センターの医療従事者 (HCW) の集団からのものでした。 一価mRNAワクチン(WT)を少なくとも2回接種し、さらにWTとBA.4/5スパイクの両方を含む二価ワクチンを少なくとも1回接種した患者(n=10)です(図2A~B)。

Neutralization was measured using pseudotyped lentiviruses mixed with serial dilutions of sera and infected 293T-ACE2 cells to determine neutralization titers at 50% (NT50) for each, JN.1 had markedly lower titers relative to the ancestral D614G, with a 53.3-fold decrease (p < 0.0001).
中和は、血清の段階希釈液と混合したシュードタイプのレンチウイルスと感染した 293T-ACE2 細胞を使用して測定し、それぞれの 50% (NT50) での中和力価を決定しました。 JN.1 の力価は祖先 D614G と比較して著しく低く、53.3 倍減少しました (p < 0.0001)。
SLip, FLiRT, and KP.2 also exhibited dramatically decreased titers, with NT50 56.3-fold (p < 0.0001), 86.4-fold (p < 0.0001), and 76.7-fold (p < 0.0001) lower than D614G, respectively.
SLip、FLiRT、および KP.2 も力価の大幅な低下を示し、NT50 はそれぞれ D614G の 56.3 倍 (p < 0.0001)、86.4 倍 (p < 0.0001)、および 76.7 倍 (p < 0.0001) 低かった。
Notably, whereas SLip showed a similar titer to JN.1, FLiRT and KP.2 had more dramatic decreases in titer, with 1.62-fold (p > 0.05) and 1.43-fold (p > 0.05) lower than JN.1, respectively (Figures 2A-B).
注目すべきことに、SLip は JN.1 と同様の力価を示しましたが、FLiRT および KP.2 はより劇的な力価減少を示し、それぞれ JN.1 よりも 1.62 倍 (p > 0.05) および 1.43 倍 (p > 0.05) 低くなりました。 (図2A~B)。
Overall, FLiRT and KP.2 exhibit increased escape from neutralizing antibodies in bivalent vaccinated sera compared to parental variant JN.1 and related variant SLip.
全体として、FLiRT および KP.2 は、親変異体 JN.1 および関連変異体 SLip と比較して、二価ワクチン接種血清中の中和抗体からの回避の増加を示します。
Antibodies in XBB.1.5 monovalent vaccinated hamster sera robustly neutralize FLiRT and KP.2, with reduced efficiency for SLip
XBB.1.5 の一価ワクチン接種ハムスター血清中の抗体は FLiRT および KP.2 を強力に中和しますが、SLip の効率は低下
We next measured neutralization using sera from golden Syrian hamsters vaccinated twice with XBB.1.5 monovalent recombinant mumps vaccine (n=10) (Figures 2C-D).
次に、XBB.1.5一価組換えムンプスワクチンを2回ワクチン接種したゴールデンシリアンハムスターからの血清を使用して中和を測定しました(n=10)(図2C〜D)。

As demonstrated previously, the hamster sera had robust neutralizing antibody titers against some of the latest Omicron subvariants, including BA.2.86, as compared to the ancestral D614G.
以前に実証されたように、ハムスター血清は、祖先の D614G と比較して、BA.2.86 を含むいくつかの最新の Omicron 亜変異体に対して強力な中和抗体力価を持っていました。
Neutralization titers for JN.1 were also increased, with a calculated NT50 value of 6,613, which was 22.5-fold high than D614G (p < 0.0001).
JN.1 の中和力価も増加し、計算された NT50 値は 6,613 で、これは D614G の 22.5 倍でした (p < 0.0001)。
The NT50 values for SLip, FLiRT, and KP.2 showed 9.9-fold (p < 0.0001), 15.8-fold (p <0.0001), and 15.6-fold (p < 0.0001) increases compared to D614G, respectively, corresponding to a 2.3-fold, 1.4-fold and 1.4-fold decrease, respectively, relative to JN.1 (p > 0.05 for each) (Figures 2C-D).
SLip、FLiRT、および KP.2 の NT50 値は、D614G と比較して、それぞれ 9.9 倍 (p < 0.0001)、15.8 倍 (p < 0.0001)、および 15.6 倍 (p < 0.0001) の増加を示しました。JN.1と比較して、それぞれ2.3倍、1.4倍、および1.4倍減少した(それぞれp>0.05)(図2C〜D)。
The overall high titer of XBB.1.5 monovalent vaccinated hamster sera against these new JN.1-derived variants was in sharp contrast to the generally low antibody titer exhibited by the bivalent vaccinated group (Figures 2A-D), but the downward trends of each variant were similar, except for SLip.
これらの新しい JN.1 由来変異体に対する XBB.1.5 一価ワクチン接種ハムスター血清の全体的な高い力価は、二価ワクチン接種グループが示す一般に低い抗体力価とは顕著な対照を示しました (図 2A ~ D)。 しかし、Slip を除いて、各亜種の減少傾向は同様でした。
The relatively strong neutralization escape of SLip from XBB.1.5 monovalent vaccine, as compared to FLiRT and KP.2, was likely due to a specific amino acid R346T change in the receptor-binding domain of XBB.1.5, FLiRT and KP.2 spikes, but not in the SLip spike (see Discussion).
FLiRTおよびKP.2と比較して、XBB.1.5一価ワクチン由来のSLipの中和回避が比較的強力であるのは、XBB.1.5、FLiRT、およびKP.2スパイクの受容体結合ドメインにおける特定のアミノ酸R346T(SLipスパイクにはない)の変化が原因である可能性が高いです(「ディスカッション」を参照)。
Nonetheless, sera from XBB.1.5-vaccinated hamsters can effectively neutralize JN.1 and JN.1-derived subvariants.
それにもかかわらず、XBB.1.5 ワクチン接種ハムスターからの血清は、JN.1 および JN.1 由来のサブバリアントを効果的に中和することができます。
SLip, KP.2, and especially FLiRT, exhibit decreased sensitivity to neutralization by BA.2.86/JN.1-wave convalescent sera compared to parental JN.1
SLip、KP.2、特に FLiRT は、親 JN.1 と比較して、BA.2.86/JN.1 波回復期血清による中和に対する感受性の低下を示す
To examine variant neutralization by antibodies induced during a natural infection, we employed sera from individuals who tested positive for COVID during the BA.2.86/JN.1 wave of infection during November 2023 and February 2024 in Columbus, Ohio (n=7) (Figures 2E-F).
自然感染時に誘導される抗体による変異体中和を調べるために、オハイオ州コロンバスで2023年11月から2024年2月にかけてのBA.2.86/JN.1感染波中にCOVID-19検査で陽性反応を示した個人の血清を使用した(n=7) (図2E〜F)。

Four were Columbus first-responders and their household contacts (n=4, P1 to P4) and three were ICU COVID-19 patients admitted to the OSU Medical Center (n=3, P5 to P7).
4人はコロンバス市の初期対応者とその世帯接触者(n=4、P1~P4)、3人はOSU医療センターに入院したICUのCOVID-19患者(n=3、P5~P7)であった。
All patients had received different doses of mRNA vaccine, with samples being collected between 34-892 days following the last vaccination (Table S1).
すべての患者は異なる用量の mRNA ワクチンを受けており、最後のワクチン接種後 34 ~ 892 日の間にサンプルが収集されました (表 S1)。
As we have shown previously, neutralization titers were detectable, albeit modest, and especially for P1-P4 against JN.1, with about 9-fold reduction relative to D614G (p < 0.01).
以前に示したように、特に JN.1 に対する P1 ~ P4 では、中和力価は控えめではあるものの検出可能でした。 D614G と比較して約 9 倍減少してます (p < 0.01)。
Titers against SLip, FLiRT, and KP.2 were further decreased, with reductions of 13.6-fold (p < 0.001), 15.2-fold (p < 0.001), and 12-fold (p < 0.01) relative to D614G, respectively.
SLip、FLiRT、および KP.2 に対する力価はさらに低下し、D614G と比較してそれぞれ 13.6 倍 (p < 0.001)、15.2 倍 (p < 0.001)、および 12 倍 (p < 0.01) 減少しました。
Similar to the bivalent cohort, the FLiRT variant exhibited the biggest drop in titers compared to JN.1 (1.70-fold decrease), though the difference was not statistically significant (p > 0.05) (Figures 2E-F).
二価コホートと同様に、FLiRT 変異体は JN.1 と比較して力価の最大の低下を示しました (1.70 倍の低下) が、その差は統計的に有意ではありませんでした (p > 0.05) (図 2E ~ F)。
Samples P5, P6, and P7 were collected from individuals admitted to the ICU at the Ohio State University Wexner Medical Center (Figure 2F, Table S1).
サンプル P5、P6、および P7 は、オハイオ州立大学ウェクスナー医療センターの ICU に入院した個人から収集されました (図 2F、表 S1)。
Notably, two of these patients, P6 and P7, exhibited higher titers against the JN.1-lineage variants.
注目すべきことに、これらの患者のうちの2人、P6およびP7は、JN.1系統の変異体に対してより高い力価を示した。
P6 is a 77-year-old male who received one dose of the Moderna monovalent vaccine and one dose of the Pfizer bivalent vaccine, with the sample taken 434 days after his last vaccination.
P6は77歳の男性で、モデルナの一価ワクチンを1回接種し、ファイザー二価ワクチンを1回接種したが、サンプルは最後のワクチン接種から434日後に採取された。
P7 is a 46-year-old female who received three doses of the Moderna monovalent vaccine and one dose of the Moderna bivalent vaccine, with her sample collected 334 days after her last vaccination.
P7は46歳の女性で、モデルナの一価ワクチンを3回接種し、モデルナ二価ワクチンを1回接種し、最後のワクチン接種から334日後にサンプルが採取された。
P5 is a 49-year-old male ICU patient and had only received two doses of the Moderna monovalent vaccine; his sample was taken 892 days after his last vaccination, with neutralizing antibody titers against JN.1, SLip, FLiRT, and KP.2 being the lowest among the three ICU patients.
P5は49歳の男性ICU患者で、モデルナ一価ワクチンを2回接種しただけだった;彼のサンプルは最後のワクチン接種から 892 日後に採取されており、JN.1、SLip、FLiRT、および KP.2 に対する中和抗体力価は 3 人の ICU 患者の中で最も低かった。
Overall, sera of BA.2.86/JN.1 convalescent individuals effectively neutralized the latest JN.1-lineage subvariants SLip, FLiRT and KP.2, but with somewhat reduced efficiency for FLiRT.
全体として、BA.2.86/JN.1 回復期個体の血清は、最新の JN.1 系統サブバリアント Slip、FLiRT および KP.2 を効果的に中和しましたが、FLiRT については効率が若干低下しました。
Class III monoclonal antibody (mAb) S309 does not neutralize SLip or FLiRT
クラス III モノクローナル抗体 S309 は Slip または FLiRT を中和しない
Another critical strategy for pandemic control measures is the use of therapeutic monoclonal antibodies, which was demonstrated during COVID-19 pandemic, especially between 2020-2021.
パンデミック対策のためのもう 1 つの重要な戦略は、治療用モノクローナル抗体の使用です。これは、特に 2020 年から 2021 年のCOVID-19パンデミック中に実証されました。
However, because of their binding being limited to a single epitope on the SARS-CoV-2 spike, single mutations can easily disrupt their efficacy, making most of the developed mAbs completely ineffective.
ただし、それらの結合は SARS-CoV-2 スパイク上の単一のエピトープに限定されているため、単一の変異によりその有効性が簡単に損なわれ、開発された mAb のほとんどが完全に無効になる可能性があります。
Notably, we and others have previously shown that binding of class III mAb S309 is largely maintained against Omicron subvariants, apart from BA.2.75.2, CA.3, CH.1.1, BA.2.86, and JN.1.
特に、我々および他の研究者は、クラス III mAb S309 の結合が Omicron サブバリアントに対してほぼ維持されていることを以前に示しました。ただし、 BA.2.75.2、CA.3、CH.1.1、BA.2.86、および JN.1 を除きます。
This trend appeared to continue, as both SLip and FLiRT exhibited a complete escape of neutralization by S309 (Figures 3A-B).
SLip と FLiRT の両方が S309 による中和の完全な回避を示したため、この傾向は継続しているように見えました (図 3A ~ B)。

We did not perform this experiment for KP.2, which harbors the conserved D339H mutation critical for S309 resistance (see Discussion).
この実験は KP.2 に対しては実行しませんでした。 KP.2は、S309 耐性に重要な保存された D339H 変異を保有しています (考察を参照)。
Antigenic cartography analysis demonstrates decreased antigenic distances of SLip, FLiRT and KP.2 in XBB.1.5 monovalent-vaccinated and BA.2.86/JN.1-infection groups
抗原地図分析により、XBB.1.5 一価ワクチン接種群および BA.2.86/JN.1 感染群における SLip、FLiRT および KP.2 の抗原距離の減少が実証
To further elucidate the relationships between these variants, we conducted antigenic cartography analysis (Figure 4).
これらの変異間の関係をさらに解明するために、抗原地図分析を実施しました (図 4)。

Briefly, this analysis transforms neutralization titers based on relative differences between titers for each variant (circles) and each serum sample (squares) displayed as antigenic units (AU).
簡単に言うと、この分析は、抗原単位 (AU) として表示される各変異体 (丸) と各血清サンプル (四角) の力価の間の相対的な差に基づいて中和力価を変換します。
As would be expected, JN.1 subvariants are antigenically distinct from the ancestral D614G in the bivalent cohort, with FLiRT being the most distinctive compared to SLip, KP.2 and their parental JN.1 (Figure 4A).
予想されるように、JN.1 サブバリアントは二価コホートの祖先 D614G とは抗原的に異なり、SLip、KP.2、およびそれらの親 JN.1 と比較して FLiRT が最も特徴的です (図 4A)。
In the XBB.1.5 monovalent vaccinated hamster group, distances between D614G and the JN.1 variants are markedly reduced, from ~6 AU in the bivalent cohort down to ~4-5 AU.
XBB.1.5 一価ワクチン接種ハムスター グループでは、D614G と JN.1 変異体の間の距離は、二価コホートの約 6 AU から約 4 ~ 5 AU まで著しく減少しています。
The variants are also clustered more closely to each other, with SLip being slightly further away from FLiRT and KP.2 (Figure 4B).また、変異体は互いにより近くにクラスター化されており、SLip は FLiRT および KP.2 からわずかに離れています (図 4B)。
A similar phenomenon was observed in the BA.2.86/JN.1 wave cohort, with overall shorter antigenic distances (~3-4 AU) compared to the bivalent and XBB.1.5 monovalent cohorts.
同様の現象が BA.2.86/JN.1 波コホートでも観察され、二価および XBB.1.5 一価コホートと比較して全体的に抗原距離が短くなりました (~3~4 AU)。
Again, JN.1-derived subvariants largely cluster together, with parental JN.1 being relatively distant from SLiP, FLiRT, and KP.2 (Figure 4C).
ここでも、JN.1 由来のサブバリアントは大部分がクラスター化しており、親 JN.1 は SLiP、FLiRT、および KP.2 から比較的離れています (図 4C)。
SLip, FLiRT, and KP.2 spikes exhibit modestly decreased fusogenicity, surface expression and processing relative to JN.1
SLip、FLiRT、および KP.2 スパイクは、JN.1 と比較して融合誘導性、表面発現、およびプロセシングがわずかに低下
Our previous studies revealed notable changes in spike biology of many Omicron variants, including their membrane fusogenicity and processing.
私たちのこれまでの研究では、膜融合性やプロセシングなど、多くの Omicron 変異体のスパイク生物学における顕著な変化が明らかになりました。
Here we characterized the ability of spikes from new JN.1-derived subvariants to trigger fusion between cell membranes (Figures 5A-D), their expression on cell plasma membranes (Figures 5E-F), as well as their processing into S1/S2 subunits by furin in virus producer cells (Figure 5G).
ここで我々は、新しい JN.1 由来のサブバリアントからのスパイクが細胞膜間の融合を引き起こす能力 (図 5A ~ D)、および細胞膜上での発現 (図 5E ~ F) を特徴付けました。 ウイルスプロデューサー細胞におけるフリンによる S1/S2 サブユニットへのプロセシングも同様に特徴付けました (図 5G)。


Similar to other Omicron variants, JN.1 exhibited markedly reduced cell-cell fusion activity relative to D614G.
他の Omicron 変異体と同様に、JN.1 は D614G と比較して細胞間融合活性が著しく低下しました。
This downtrend was maintained for FLiRT and KP.2, and more so for SLip, in both 293T-ACE2 and CaLu-3 cells (p < 0.0001 compared to D614G).
この下降傾向は、293T-ACE2 細胞と CaLu-3 細胞の両方において FLiRT および KP.2 で維持され、SLip ではさらに維持されました (D614G と比較して p < 0.0001)。
The level of cell-cell fusion activity for these three new subvariants appeared to be lower than parental JN.1 (p < 0.01).
これら 3 つの新しいサブバリアントの細胞間融合活性のレベルは、親 JN.1 よりも低いようです (p < 0.01)。
We also investigated expression of spikes on the surface of 293T cells, which were used to produce pseudotyped vectors.
また、シュードタイプベクターの作製に使用した 293T 細胞の表面におけるスパイクの発現も調査しました。
We found that JN.1-derived subvariants exhibited a 2~3-fold decrease in expression compared to ancestral D614G (p < 0.0001), with FLiRT being significantly lower than the parental JN.1 (p < 0.0001) (Figures 5E-F).
JN.1 由来のサブバリアントは、祖先 D614G と比較して発現が 2 ~ 3 倍減少していることがわかりました (p < 0.0001)。 FLiRT は親 JN.1 よりも大幅に低かった (p < 0.0001) (図 5E ~ F)。
We probed lysates of the 293T cells for S2 subunits of spike to determine the extent of furin cleavage efficiency by quantifying the ratio of S2/S, and we observed that the processing efficiency for SLip, FLiRT, and KP.2 spikes was modestly decreased compared to JN.1 (Figure 5G).
我々は、293T 細胞のライセートをスパイクの S2 サブユニットについてプローブし、S2/S の比を定量化することでフリン切断効率の程度を決定しました。 そして、SLip、FLiRT、および KP.2 スパイクの処理効率が JN.1 と比較して若干低下していることが観察されました (図 5G)。
Overall, the decreases in cell-cell fusion and spike processing are consistent with their attenuated infectivity in 293T-ACE2 and CaLu-3 cells (Figures 1C-D).
全体として、細胞間融合およびスパイク処理の減少は、293T-ACE2 細胞および CaLu-3 細胞における感染力の減弱と一致しています (図 1C ~ D)。
Structural modeling of mutations in SLip, FLiRT, and KP.2 spikes
SLip、FLiRT、および KP.2 スパイクにおける変異の構造モデリング
To better understand the impact of spike mutations on these new variants, we performed homology modeling to investigate alterations in receptor engagement, spike conformational stability, and antibody interactions.
これらの新しい変異体に対するスパイク変異の影響をより深く理解するために、ホモロジーモデリングを実行して、受容体結合、スパイク構造安定性、および抗体相互作用の変化を調査しました。
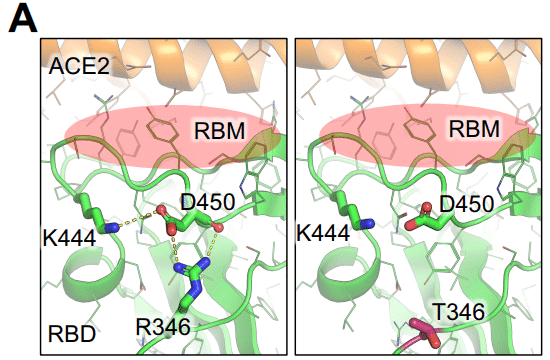
Residue R346 in the receptor binding motif (RBM) can form both a hydrogen bond and a salt bridge with residue D450, which is present in the parental BA.2.86 lineage (N450D).
受容体結合モチーフ (RBM) の残基 R346 は、親 BA.2.86 系統 (N450D) に存在する残基 D450 と水素結合および塩橋の両方を形成できます。
This interaction pulls residue D450 and its loop away from RBM and potentially disturbs the process of receptor engagement.
この相互作用は、残基 D450 とそのループを RBM から引き離し、受容体結合のプロセスを妨害する可能性があります。
The R346T mutation abolishes this interaction, releasing tension on residue D450 and the RBM, thus potentially enhancing ACE2 binding affinity (Figure 6A).
R346T 変異はこの相互作用を廃止し、残基 D450 と RBM の張力を解放し、ACE2 結合親和性を潜在的に強化します (図 6A)。
Conversely, residues L455 and F456, which are centrally located within the RBM, are encased in a hydrophobic cage formed by Y421, Y453, Y473, and Y489.
逆に、RBM 内の中央に位置する残基 L455 および F456 は、Y421、Y453、Y473、および Y489 によって形成される疎水性のケージに包まれています。
This hydrophobic core is crucial for ACE2 binding.
この疎水性コアは、ACE2 結合にとって重要です。
Mutations such as F456L and L455S found in strains JN.1 and SLip can reduce the local hydrophobicity of the RBM, diminishing interactions with ACE2 residues T27, K31, D30, and H34 and thus potentially decreasing viral affinity for ACE2 (Figure 6B).
JN.1 株や SLip 株に見られる F456L や L455S などの変異は、RBM の局所的な疎水性を低下させ、ACE2 残基 T27、K31、D30、および H34 との相互作用を減少させ、したがって ACE2 に対するウイルスの親和性を低下させる可能性があります (図 6B)。

Additionally, structural analysis indicates that residue V1104 is situated in a hydrophobic core, together with P1090, F1095 and I1115 on the spike stem region.
さらに、構造分析により、残基 V1104 がスパイクステム領域上の P1090、F1095、および I1115 とともに疎水性コアに位置していることが示されています。
The V1104L mutation fills a cavity and improves the local hydrophobic interaction, potentially stabilizing the prefusion spike conformation, which would reduce the efficiency of spike protein transition to a postfusion conformation (Figure 6C).
V1104L 変異は空洞を満たし、局所的な疎水性相互作用を改善し、融合前スパイク構造を安定化させる可能性があり、これによりスパイクタンパク質の融合後構造への移行効率が低下すると考えられます (図 6C)。

Residues D339 and R346 lie within the epitope region of class III antibodies, including S309 (Figure 6D).
残基 D339 および R346 は、S309 を含むクラス III 抗体のエピトープ領域内にあります (図 6D)。

Mutations at these positions are present in the BA.2.86 lineage and subsequent lineages FLiRT and KP.2, which could enhance viral evasion from antibody neutralization.
これらの位置の変異は、BA.2.86 系統とその後の系統 FLiRT および KP.2 に存在しており、抗体中和からのウイルス回避を強化する可能性があります。
Lastly, residues F456 and L455 on the RBM are frequently targeted by class I RBD neutralizing antibodies, such as CC12.1 (Figure 6E).
最後に、RBM 上の残基 F456 および L455 は、CC12.1 などのクラス I RBD 中和抗体によって頻繁に標的とされます (図 6E)。

Therefore, the L455S and F456L mutations, which involve changes in size and chemical properties, can effectively enable viral evasion from humoral immunity established by prior infection and/or vaccination.
したがって、サイズと化学的特性の変化を伴う L455S および F456L 変異は、以前の感染および/またはワクチン接種によって確立された体液性免疫からのウイルスの回避を効果的に可能にする可能性があります。
DISCUSSION
The ongoing evolution of the SARS-CoV-2 spike protein continues to pose significant challenges to control the COVID-19 pandemic.
SARS-CoV-2 スパイクタンパク質の進行中の進化は、COVID-19パンデミックを制御する上で重大な課題を引き起こし続けています。
Though BA.2.86 did not prove to have increased evasion of neutralizing antibodies in vaccinated and convalescent sera relative to prior variants, subsequent variants, namely JN.1, have shown mounting escape.
BA.2.86 は以前の変異体と比べてワクチン接種済み血清および回復期血清中の中和抗体の回避が増加していることは証明されていませんでしたが、その後の変異体、つまり JN.1 では回避が増加していることが示されています。
Recent SARS-CoV-2 Omicron variants have been accumulating convergent mutations in the spike, particularly at key sites including L455, F456, and R346.
最近の SARS-CoV-2 オミクロン変異体は、特に L455、F456、R346 などの重要な部位で、スパイクに収束性変異を蓄積しています。
These sites have critical roles in immunogenicity, receptor binding, and overall viral fitness.
これらの部位は、免疫原性、受容体結合、および全体的なウイルス適合性において重要な役割を果たします。
Interestingly, despite its detrimental impact on ACE2 binding, the single L455S mutation that differentiates JN.1 from BA.2.86 led to markedly more immune evasion, sending the variant to dominance worldwide.
興味深いことに、ACE2結合に対する有害な影響にもかかわらず、JN.1とBA.2.86を区別する単一のL455S変異は、免疫回避の顕著な増大をもたらし、この変異体が世界中で優勢になった。
Here, we show that F456L (SLip) and R346T (FLiRT) contribute to further escape of JN.1-derived variants from neutralizing antibodies in all cohorts tested relative to their parental JN.1 (Figures 2A-F).
ここで、我々は、F456L (SLip) および R346T (FLiRT) が、親 JN.1 と比較して試験したすべてのコホートにおいて、JN.1 由来変異体の中和抗体からのさらなる回避に寄与することを示す (図 2A ~ F)。



FLiRT displayed the greatest decreases of nAb titer in bivalent immunized HCWs and in BA.2.86/JN.1 wave patients, likely due to the fact that the immunogens for both cohorts, i.e., WT, BA.4/5 or BA.2.86/JN.1, lack the R346T mutation (Figures 2A-B, Figures 2E-F).
FLiRT は、二価免疫を受けた医療従事者および BA.2.86/JN.1 波患者において nAb 力価の最大の減少を示しました。 これはおそらく、両方のコホートの免疫原、すなわちWT、BA.4/5またはBA.2.86/JN.1がR346T変異を欠いているという事実によるものである(図2A〜B、図2E〜F)。
This notion is further supported by our finding that both FLiRT and KP.2 are neutralized better than SLip by the XBB.1.5-monovalent hamster serum samples, and that XBB.1.5 spike immunogen harbors the critical R346T mutation, which is present in both FLiRT and KP.2 but not SLip (Figures 2C-D).
この概念は、FLiRT と KP.2 の両方が、XBB.1.5 一価ハムスター血清サンプルによって SLip よりもよく中和されること、および XBB.1.5 スパイク免疫原が重要な R346T 変異を保有しているという我々の発見によってさらに裏付けられます。 これは FLiRT と KP.2 の両方に存在しますが、SLip には存在しません (図 2C ~ D)。
We and other groups have previously demonstrated that R346T is a critical site for monoclonal antibody binding and immune evasion.
私たちと他のグループは、R346Tがモノクローナル抗体結合と免疫回避にとって重要な部位であることを以前に実証しました。
Another advantage of the R346T mutation is compensating for the loss of affinity for ACE2 caused by the L455S and F456L mutations (Figure 6B).
R346T 変異のもう 1 つの利点は、L455S および F456L 変異によって引き起こされる ACE2 に対する親和性の損失を補うことです (図 6B)。

Both the L455S and F456L mutations reduce hydrophobic contacts in the RBD, leading to a less binding for ACE2.
L455S 変異と F456L 変異は両方とも RBD の疎水性接触を減少させ、ACE2 への結合を減少させます。
R346T helps compensate for this reduction by strengthening conformational support in the receptor-binding motif (RBM) (Figure 6A).
R346T は、受容体結合モチーフ (RBM) の立体構造サポートを強化することで、この減少を補うのに役立ちます (図 6A)。

The consequences of these effects can be seen in the increased viral infectivity in FLiRT and KP.2 relative to SLip (Figures 1C-D).
これらの効果の結果は、SLip と比較した FLiRT および KP.2 のウイルス感染力の増加で見ることができます (図 1C ~ D)。

In particular, the KP.2 variant benefits from the effects of V1104L, which serves to further stabilize the spike conformation through hydrophobic internal cavity filling (Figure 6C), likely resulting in a less efficient transition from prefusion and postfusion spike, therefore impeding infectivity.
特に、KP.2 バリアントは V1104L の効果の恩恵を受けており、疎水性の内部空洞充填を通じてスパイク構造をさらに安定化させるのに役立ちます (図 6C)。 おそらく、融合前および融合後のスパイクからの移行効率が低下し、感染力が阻害される可能性があります。

We found that FLiRT and SLip were both resistant to neutralization by class III monoclonal antibody S309 like their parental variants BA.2.86 and JN.1.
我々は、FLiRT と Slip が両方とも、親変異体 BA.2.86 や JN.1 と同様に、クラス III モノクローナル抗体 S309 による中和に耐性があることを発見しました。
Accordingly, all of these variants including KP.2 possess the D339H mutation, which is situated directly in the center of the class III antibody epitope, creating a steric hindrance that abolishes S309 binding (Figure 6D).
したがって、KP.2を含むこれらの変異体はすべて、クラスIII抗体エピトープの中心に直接位置するD339H変異を有しており、S309結合を無効にする立体障害を作り出している(図6D)。

The SLip variant displayed the lowest neutralizing antibody titers in the XBB.1.5-monovalent hamster cohort, likely due to the presence of the F456L mutation on top of its parental JN.1 containing L455S.
SLip 変異体は、XBB.1.5 一価ハムスター コホートの中で最も低い中和抗体力価を示しましたが、これはおそらく、L455S を含む親 JN.1 に加えて F456L 変異が存在するためと考えられます。
The F456L mutation has occurred in several previous circulating variants, including FLiP, thus contributing to their strong immune evasion.
F456L 変異は、FLiP を含むこれまでに流行しているいくつかの変異株で発生しており、強力な免疫回避に寄与しています。
It is of note that this mutation is increasing in frequency among circulating variants.
この変異は、流行している変異株の中で頻度が増加していることに注目してください。
F456L mediates immune evasion by altering key epitopes targeted by class I monoclonal antibodies (Figure 6E), although other mutations (e.g., L455S) also contribute to this disruption of the class I epitopes.
F456L は、クラス I モノクローナル抗体の標的となる重要なエピトープを変更することで免疫回避を媒介しますが (図 6E)、他の変異 (L455S など) もクラス I エピトープの破壊に寄与します。

Notably, F456L is not present in XBB.1.5 spike immunogen, which could explain why SLip had the lowest neutralizing antibody titers in the XBB.1.5-monovalent hamster cohort.
特に、F456L は XBB.1.5 スパイク免疫原には存在しません。 これは、SLip が XBB.1.5 一価ハムスター コホートにおいて中和抗体力価が最も低かった理由を説明できる可能性があります。
However, titers of XBB.1.5 monovalent hamster sera were still well above the limit of detection and only displayed a modest drop from JN.1, apart from SLip, suggesting that XBB.1.5 spike as an immunogen can still provide potentially effective protection against JN.1-lineage variants.
しかし、XBB.1.5 の一価ハムスター血清の力価は依然として検出限界をはるかに上回っており、SLip を除けば、JN.1 からわずかな低下を示しただけでした。 これは、免疫原としての XBB.1.5 スパイクが依然として JN.1 系列変異体に対して潜在的に効果的な防御を提供できることを示唆しています。
In addition, XBB.1.5-monovalent hamster sera exhibited less distance between the JN.1-lineage spikes, again suggesting that the XBB.1.5 spike as an immunogen could stimulate a broader antibody response than the WT+BA.4/5 bivalent vaccine (Figures 4A-B).
さらに、XBB.1.5 一価ハムスター血清は JN.1 系統のスパイク間の距離が短く、免疫原としての XBB.1.5 スパイクが WT+BA.4/5 二価ワクチンよりも広範な抗体反応を刺激する可能性があることを再度示唆しました (図4A~B)。

The BA.2.86/JN.1-wave cohort had similar antigenic mapping to the XBB.1.5 cohort, with even shorter distances between D614G and the JN.1 subvariants - and the JN.1 variants themselves were also closely clustered (Figure 4C).
BA.2.86/JN.1 波コホートは、XBB.1.5 コホートと同様の抗原マッピングを持っていました。 D614G と JN.1 サブバリアント間の距離はさらに短く、JN.1 バリアント自体も密接にクラスター化されていました (図 4C)。
This pattern of response is similar to data presented by other groups, which showed that JN.1 infection, together with prior immunization, stimulates superior neutralizing antibody titers against JN.1 variants compared to BA.5, XBB, or XBB.1.5 breakthrough infections.
この反応パターンは他のグループが提示したデータと似ています。つまり、JN.1 感染と事前の免疫化が、BA.5、XBB、または XBB.1.5 の突破感染と比較して、JN.1 変異体に対する優れた中和抗体力価を刺激することを示しました。
The shorter antigenic distance for our cohort, as well as the results from other groups, suggest that the JN.1 spike can and probably should serve as a more effective immunogen to stimulate neutralizing antibodies against JN.1-lineage variants.
私たちのコホートの抗原距離が短いこと、および他のグループの結果は、JN.1 スパイクが JN.1 系統変異体に対する中和抗体を刺激するためのより効果的な免疫原として機能する可能性があり、おそらくそうすべきであることを示唆しています。
Overall, the difference between XBB.1.5 and BA.2.86/JN.1 spikes as immunogens against JN.1 variants (except SLip) appears negligible (Figures 2C-F, Figures 4B-C).
全体として、JN.1 変異体 (SLip を除く) に対する免疫原としての XBB.1.5 スパイクと BA.2.86/JN.1 スパイクの間の違いは無視できるほどであると思われます (図 2C ~ F、図 4B ~ C)。
We did not find evidence of further enhanced nAb escape for KP.2 spike in three sets of sera relative to FLiRT and SLip (Figures 2E-F), which explains its increasing dominance in circulation.
FLiRTおよびSLipと比較して、3セットの血清においてKP.2スパイクに対するnAbエスケープがさらに強化されたという証拠は見つかりませんでした(図2E〜F)。これは、循環におけるその優勢性の増加を説明しています。
However, KP.2 acquired additional mutations in other regions of the SARS-CoV-2 genome, including a T2283I mutation in non-structural protein 3 (nsp3) outside the papain-like protease (PLP) domain, which likely facilitates viral replication and/or modulate the host immune response.
しかし、KP.2 は、パパイン様プロテアーゼ (PLP) ドメインの外側の非構造タンパク質 3 (nsp3) における T2283I 変異を含む、SARS-CoV-2 ゲノムの他の領域に追加の変異を獲得しました。 これにより、ウイルスの複製が促進されたり、宿主の免疫応答が調節されたりする可能性があります。
Further investigations using authentic KP.2 and related JN.1 lineage variants shall help distinguish between possible mechanisms that endow KP.2 with a selective advantage over JN.1 and other subvariants in the pandemic.
本物の KP.2 および関連する JN.1 系統変異体を使用したさらなる調査は、パンデミックにおいて KP.2 に JN.1 および他の亜変異体に対して選択的優位性を与える可能性のあるメカニズムを区別するのに役立つでしょう。
Another interesting and somewhat surprising finding of this work is that most of the newly emerged JN.1 subvariants, especially SLip, exhibit decreased infectivity and cell-cell fusion activity in CaLu-3 cells compared to the parental JN.1 (Figure 1, Figure 5).
この研究のもう 1 つの興味深い、そして少し驚くべき発見は次の通りです。 新しく出現した JN.1 サブバリアントのほとんど、特に SLip は、親 JN.1 と比較して、CaLu-3 細胞における感染力と細胞間融合活性の低下を示します (図 1、図 5)。
Flow cytometric and western blotting analyses reveal decreased expression levels of the variant spike proteins on the plasma membrane of virus-producing cells, as well as reduced efficiency of spike processing by furin in the cell.
フローサイトメトリーおよびウェスタンブロッティング分析により、ウイルス産生細胞の原形質膜上のバリアントスパイクタンパク質の発現レベルの低下と、細胞内のフリンによるスパイクプロセシングの効率の低下が明らかになりました。
Together, these findings could explain, in part, the observed infectivity and fusion phenotypes.
これらの発見を総合すると、観察された感染性と融合表現型を部分的に説明できる可能性があります。
Noticeably, these aspects of spike biology differ markedly from their parental BA.2.86 as well as some of the previously dominating Omicron variants, such as XBB.1.5 and EG.5.1, which exhibit increased spike processing, fusogenicity, and/or infectivity in CaLu-3 cells.
注目すべきことに、スパイク生物学のこれらの側面は、親の BA.2.86 や、XBB.1.5 や EG.5.1 などの以前に優勢だった Omicron 亜種の一部とは著しく異なります。 これらは、CaLu-3 細胞においてスパイクプロセシング、融合原性、および/または感染性の増加を示します。
While the mechanism and implications of these differences in spike biology remain to be further investigated, our results suggest that some of these mutations, including F456L, R346T and V1140L, though beneficial for antibody escape, could negatively impact other aspects of spike biology, highlighting the critical tradeoff between immune evasion and viral fitness.
スパイク生物学におけるこれらの違いのメカニズムと影響はさらに調査される必要があるが、我々の結果は、F456L、R346T、V1140Lを含むこれらの変異の一部は、抗体回避には有益であるものの、スパイク生物学の他の側面に悪影響を与える可能性があることを示唆している。 免疫回避とウイルス適合性の間の重要なトレードオフを強調しています。
While the global COVID-19 pandemic has been declared over, SARS-CoV-2 continues to evolve and escape from host immunity elicited by vaccination and/or infections.
COVID-19の世界的なパンデミックは終息したと宣言されているが、SARS-CoV-2は進化を続けており、ワクチン接種や感染症によって引き起こされる宿主の免疫から逃れている。
Our data suggest that more recent JN.1-lineage variants have altered properties in immune escape and biology, and they will continue to evolve.
私たちのデータは、より最近の JN.1 系統の変異体が免疫逃避と生物学の性質を変えており、今後も進化し続けることを示唆しています。
Our findings highlight the importance of continued tracking and characterization of emerging variants of SARS-CoV-2.
私たちの調査結果は、SARS-CoV-2の新たな変異種の継続的な追跡と特性評価の重要性を浮き彫りにしています。
Such studies are especially critical at this stage in the pandemic, when most people have been exposed to the virus at least once, if not several times, and thus have complex immunogenic backgrounds.
このような研究は、ほとんどの人が数回とは言わないまでも少なくとも1回はウイルスにさらされており、複雑な免疫原性の背景を持っているパンデミックの現段階では特に重要である。
Future vaccine development should consider JN.1 and/or closely related spikes as potential immunogen(s), though XBB.1.5 monovalent vaccines could still offer some protections.
将来のワクチン開発では、JN.1 および/または密接に関連したスパイクを潜在的な免疫原として考慮する必要がありますが、XBB.1.5 一価ワクチンは依然としてある程度の防御を提供できる可能性があります。
Limitations of Study
Our experiments make use of pseudotyped lentivirus bearing the spike protein of interest, not authentic infectious SARS-CoV-2 strains.
私たちの実験では、本物の感染性 SARS-CoV-2 株ではなく、目的のスパイクタンパク質を持つシュードタイプのレンチウイルスを利用します。
However, the lentivirus model has proven to be an accurate reflection on neutralization of live SARS-CoV-2 and shown to instrumental for evaluating the efficacy of COVID-19 vaccines.
しかし、レンチウイルス モデルは、生きた SARS-CoV-2 の中和を正確に反映していることが証明されており、COVID-19ワクチンの有効性を評価するのに役立つことが示されています。
In addition, the timeliness of this work would not allow for thorough higher biosafety level three (BSL3) experiments to be conducted.
さらに、この作業の適時性により、より高度なバイオセーフティ レベル 3 (BSL3) の徹底的な実験を実施することはできません。
The sample size of our cohorts, particularly the BA.2.86/JN.1 convalescents, is limited because of the IRB rules and restrictions.
私たちのコホート、特に BA.2.86/JN.1 回復期患者のサンプルサイズは、IRB の規則と制限により制限されています。
However, other similar studies have worked with cohorts of similar size, and we have also published work with similar cohort sizes with reliable results in the past.
ただし、他の同様の研究では同様の規模のコホートを使用した研究が行われており、私たちも過去に同様のコホートサイズで信頼できる結果が得られた研究を発表しました。
We recognize that homology modeling is not as precise as authentic cryoelectron microscopy (cryo-EM) structure, and the impact of key mutations on ACE2 interaction and antibody engagement would require confirmation by further structural studies.
我々は、相同性モデリングが本物の低温電子顕微鏡 (cryo-EM) 構造ほど正確ではなく、ACE2 相互作用や抗体結合に対する主要な変異の影響についてはさらなる構造研究による確認が必要であることを認識しています。
Nonetheless, data from these relatively small cohorts shall provide important insight into the biology of SARS-CoV-2 and offer timely guidance for future COVID-19 vaccine formulations.
それにもかかわらず、これらの比較的小規模なコホートからのデータは、SARS-CoV-2 の生物学についての重要な洞察を提供し、将来の COVID-19 ワクチン製剤に対するタイムリーな指針を提供するでしょう。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
