塩野義ワクチンの第2/3相試験の中間報告
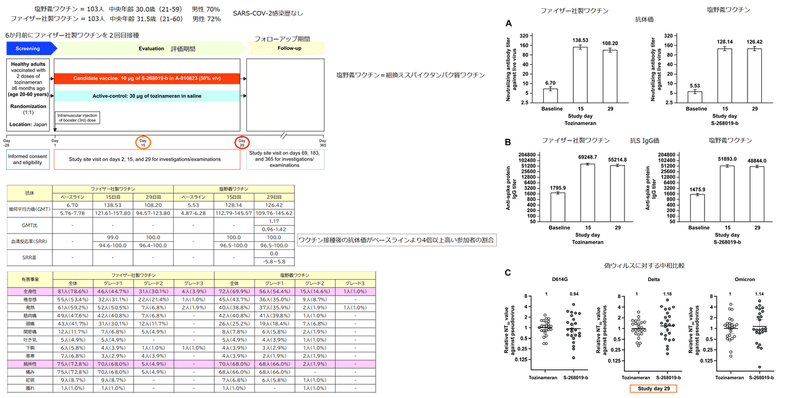
※参照などは省略してあります。
元→https://www.medrxiv.org/content/10.1101/2022.03.03.22271827v1.full.pdf
・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・
Immunogenicity and Safety of Booster Dose of S-268019-b or Tozinameran in Japanese Participants: An Interim Report of Phase 2/3, Randomized, Observer-Blinded, Noninferiority Study
日本人参加者におけるS-268019-bまたはトジナメランの追加免疫投与の免疫原性と安全性:第2/3相、無作為化、オブザーバー盲検、非劣性試験の中間報告
Abstract
In this randomized, observer-blinded, phase 2/3 study, we assessed S-268019-b—a recombinant spike protein vaccine.
この無作為化されたオブザーバー盲検の第2/3相試験では、組換えスパイクタンパク質ワクチンであるS-268019-bを評価しました。
We analyzed the noninferiority of S-268019-b (n=103), versus tozinameran (n=103), when given as a booster ≥6 months after the 2-dose tozinameran regimen in Japanese adults without prior COVID-19 infection.
S-268019-b(n = 103)とトジナメラン(n = 103)の非劣性を、COVID-19に感染していない日本人成人の2回投与トジナメランレジメンの6か月以上後に追加免疫として投与した場合に分析しました。
Interim results showed that S-268019-b was noninferior to tozinameran in co-primary endpoints: geometric mean titer (GMT) (126.42 versus 108.20; adjusted-GMT ratio [95% CI], 1.17 [0.96-1.42]; noninferiority P-value, <0.0001) and seroresponse rate (both 100%; noninferiority P-value, 0.0004) for neutralizing antibodies on day 29.
中間結果は、S-268019-bが共同プライマリエンドポイントでトジナメランに劣っていないことを示しました:幾何平均力価(GMT)(126.42対108.20;調整済みGMT比[95%CI]、1.17 [0.96-1.42];非劣性P値、<0.0001)、29日目の中和抗体の血清反応率(両方とも100%、非劣性P値、0.0004)。
Both vaccines elicited anti-spike protein immunoglobulin G antibodies, and produced T-cell response (n=30/group) and neutralized Delta and Omicron pseudovirus variants (n=24/group) in subgroups.
どちらのワクチンも、抗スパイクタンパク質免疫グロブリンG抗体を誘発し、サブグループでT細胞応答(n = 30 /グループ)と偽ウイルスのデルタおよびオミクロン株の中和(n = 24 /グループ)を生成しました。
Most participants reported low-grade reactogenicity on days 1 and 2, the most frequent being fatigue, fever, myalgia, and injection-site pain.
ほとんどの参加者は、1日目と2日目に軽度の反応性を報告しました。最も頻繁なのは、倦怠感、発熱、筋肉痛、注射部位の痛みです。
No serious adverse events were reported.
重篤な有害事象は報告されていません。
S-268019-b safety and robust immunogenicity as a booster, supporting its use as COVID-19 booster vaccine.
S-268019-bブースターとしての安全性と強力な免疫原性、COVID-19ブースターワクチンとしての使用をサポートします。
Highlights
• Third COVID-19 vaccine dose (booster) enhances immune response
•3回目のCOVID-19ワクチン投与(ブースター)は免疫応答を強化します
• Interim phase 2/3 data for booster ≥6 months after the 2nd dose in Japan are shown
•日本での2回目の投与から6か月以上経過したブースターの中間フェーズ2/3データが表示されます
• S-268019-b and tozinameran were safe and equal in inducing neutralizing antibodies
•S-268019-bとトジナメランは中和抗体の誘導において安全で同等でした
• Both boosters neutralized Delta and Omicron pseudovirus and induced T-cell response
•両方のブースターがデルタおよびオミクロン偽ウイルスを中和し、T細胞応答を誘導しました
• Results support use of S-268019-b as a booster in vaccinated adults
•結果は、ワクチン接種された成人の追加免疫としてのS-268019-bの使用をサポートしています
Introduction
Cases of coronavirus disease 2019 (COVID-19) caused by severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) are increasing periodically because of several reasons.
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によって引き起こされる2019年コロナウイルス病(COVID-19)の症例は、いくつかの理由により定期的に増加しています。
A third vaccine dose (booster) is recommended because of concerns regarding waning humoral immunity over 6 months after the second dose and consequent reduced effectiveness against SARS-CoV-2 infection, as well as threats from new mutant strains that may escape the vaccine-mediated immunity.
2回目の接種後6か月間で体液性免疫が低下し、その結果SARS-CoV-2感染に対する有効性が低下することが懸念されるため、また、ワクチンを介した免疫を逃れる可能性のある新しい変異株からの脅威もあるため、3回目のワクチン投与(ブースター)が推奨されます。
Booster immunization can substantially improve the humoral immune response against the emerging variants, including Omicron.
ブースター免疫は、オミクロンを含む新たな変異体に対する体液性免疫応答を大幅に改善することができます。
Shionogi & Co., Ltd., has developed a novel vaccine candidate—S-268019- b—comprising a modified recombinant spike protein of SARS-CoV-2 (S-910823, antigen) produced using the baculovirus expression system in insect cells and a squalene-based adjuvant (A-910823).
塩野義製薬は、SARS-CoV-2(S-910823、抗原)の改変組換えスパイクタンパク質を含む新規ワクチン候補S-268019-bを開発しました。昆虫細胞でのバキュロウイルス発現システムとスクアレンベースのアジュバント(A-910823)を使用します。
In a double-blinded, phase 1/2 trial, S-268019- b showed tolerability and a robust immunogenic response 4 weeks after the second dose.
二重盲検の第1/2相試験では、S-268019-bは、2回目の投与から4週間後に忍容性と強力な免疫原性反応を示しました。
Here, we present the interim results of a phase 2/3, randomized trial, wherein the immunogenicity and safety of a single booster dose of S-268019-b or tozinameran were assessed in Japan.
ここでは、S-268019-bまたはトジナメランの単回追加免疫投与の免疫原性と安全性が日本で評価された第2/3相ランダム化試験の中間結果を示します。
Methods
Study design and participants
This phase 2/3, single-center, randomized, observer-blinded, active- controlled, noninferiority trial comprised three periods: screening (day −28 to −1), evaluation (day 1 to 29), and follow-up (day 30 to 365) (Figure 1).
このフェーズ2/3、単一施設、ランダム化、オブザーバーブラインド、アクティブコントロール、非劣性試験は、スクリーニング(-28日から-1日)、評価(1日から29日)、フォローアップ(30日目から365日目)の3つの期間で構成されました(図1)。
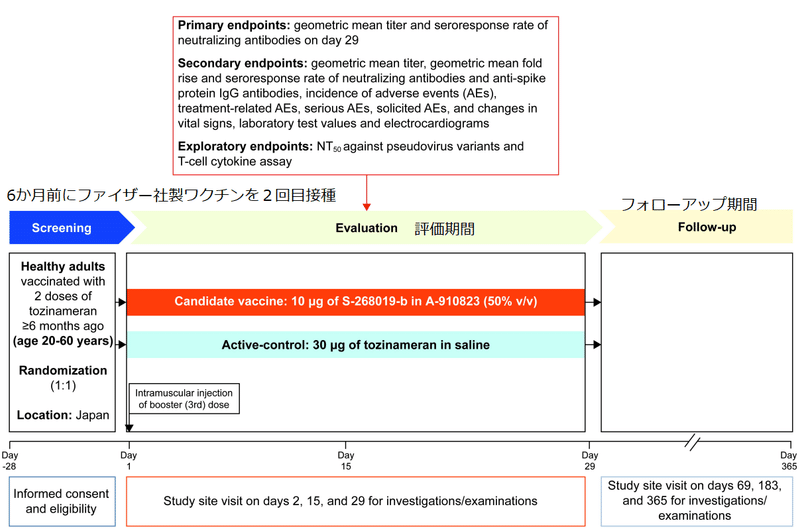
Participants were healthy immunocompetent Japanese adults (aged ≥20 years) who had received two doses of tozinameran (BNT162b2; Pfizer/BioNTech mRNA vaccine), with the second dose received ≥6 months ago.
参加者は、トジナメラン(BNT162b2; Pfizer / BioNTech mRNAワクチン)を2回接種し、6か月以上前に2回目の接種を受けた、健康な免疫能力のある日本人成人(20歳以上)でした。
Individuals with laboratory-confirmed SARS-CoV-2 infection at screening or known history of SARS-CoV-2 infection were excluded (See Supplementary Methods for details).
スクリーニング時にSARS-CoV-2感染が検査室で確認された個人、またはSARS-CoV-2感染の既知の病歴がある個人は除外されました(詳細については、補足方法を参照してください)。
Eligible participants were randomized 1:1, stratified by age (<40 and ≥40 years) and sex, to receive an intramuscular injection of either 0.5 mL of S-268019-b (10 μg antigen prepared with 50% v/v oil-in-water adjuvant emulsion) or 0.3 mL of tozinameran (30 μg in saline) on day 1.
適格な参加者は、年齢(40歳未満および40歳以上)および性別によって層別化された1:1でランダム化されました。1日目に0.5mLのS-268019-b(50%v / v水中油型アジュバントエマルジョンで調製された10μgの抗原)または0.3 mLのトジナメラン(生理食塩水中30μg)の筋肉内注射を受けます。
The study (jRCT2031210470) was conducted in compliance with the protocol, the Declaration of Helsinki and Council for International Organizations of Medical Sciences International Ethical Guidelines, the International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use Good Clinical Practice Guidelines, other applicable laws and regulations, and was approved by Institutional Review Board of Tokyo Shinagawa Hospital Medical Corporation Association Tokyokyojuno-kai.
研究(jRCT2031210470)は、次のプロトコルに準拠して実施されました。ヘルシンキ宣言と国際医学団体協議会国際倫理ガイドライン、人間が使用する医薬品の良き臨床基準ガイドラインのための医薬品規制調和国際会議、その他の適用法および規制。また、東京品川病院総合協会東京京純野会の倫理委員会の承認を受けました。
All participants gave their written informed consent.
すべての参加者は、書面によるインフォームドコンセントを行いました。
Outcomes
The primary objective of the study was to assess the noninferiority of S-268019-b versus tozinameran as a booster dose in inducing SARS-CoV-2 neutralizing antibodies on day 29.
この研究の主な目的は、29日目にSARS-CoV-2中和抗体を誘導する際の追加免疫として、S-268019-bとトジナメランの非劣性を評価することでした。
The co-primary endpoints included day 29 geometric mean titer (GMT) and seroresponse rate (SRR) for SARS-CoV-2 neutralizing antibodies.
主要評価項目には、SARS-CoV-2中和抗体の29日目の幾何平均力価(GMT)と血清反応率(SRR)が含まれていました。
SRR was defined as the proportion of participants with a post-vaccination antibody titer ≥4-fold higher than the baseline.
SRRは、ワクチン接種後の抗体価がベースラインより4倍以上高い参加者の割合として定義されました。
Secondary endpoints comprised other immunogenicity parameters and safety.
副次的評価項目は、他の免疫原性パラメーターと安全性で構成されていました。
These included GMT, geometric mean fold rise (GMFR), and SRR for neutralizing antibodies and anti-spike protein immunoglobulin G (IgG) antibodies on days 15 and 29.
これらには、GMT、幾何平均倍増(GMFR)、および15日目と29日目の中和抗体と抗スパイクタンパク質免疫グロブリンG(IgG)抗体のSRRが含まれます。
Exploratory analyses in a smaller sample included geometric means of 50% neutralization titer (NT50) against SARS-CoV-2 pseudovirus strains (wildtype [D614G], Delta, and Omicron) on day 29 and T-cell response on day 15.
小規模なサンプルでの探索的分析には、29日目のSARS-CoV-2偽ウイルス株(野生型[D614G]、Delta、およびOmicron)に対する50%中和力価(NT50)の幾何平均と15日目のT細胞応答が含まれていました。
Safety endpoints included incidence of adverse events (AEs), serious AEs, AEs of special interest, treatment-related AEs (TRAEs), medically attended TRAEs, solicited TRAEs, and changes in laboratory test values.
安全性のエンドポイントには、有害事象(AE)の発生率、深刻なAE、特別な関心のあるAE、治療関連のAE(TRAE)、医学的に参加したTRAE、要請されたTRAE、および臨床検査値の変更が含まれていました。
Immunogenicity variables with titer values below the lower limit of quantification (LLOQ) were replaced with 0.5 × LLOQ.
力価の値が定量下限(LLOQ)を下回る免疫原性変数は、0.5×LLOQに置き換えられました。
Statistical analyses
The study used a noninferiority design.
この研究では、非劣性の設計を使用しました。
Noninferiority of S-268019-b to tozinameran is confirmed when the lower limit of 95% CI is >0.67 for GMT ratio (S-268019-b/tozinameran) derived from the analysis of covariate model with age and sex as covariates, and more than −10% for SRR difference (S-268019-b minus tozinameran) by the Farrington-Manning method for neutralizing antibodies on day 29.
S-268019-bのトジナメランに対する非劣性は、共変量として年齢と性別を使用した共変量モデルの分析から導き出されたGMT比(S-268019-b /トジナメラン)の95%CIの下限が> 0.67である場合に確認されます。29日目に抗体を中和するためのFarrington-Manning法による、SRRの差(S-268019-bからトジナメランを差し引いたもの)が-10%を超えています。
The immunogenicity subset included participants who received ≥1 dose of the study intervention, had ≥1 post-vaccination immunogenicity data, and were negative for anti-SARS-CoV-2 N-protein antibody at screening.
免疫原性サブセットには、1回以上の研究介入を受け、ワクチン接種後の免疫原性データが1回以上あり、スクリーニング時に抗SARS-CoV-2Nタンパク質抗体が陰性であった参加者が含まれていました。
The safety analysis subset included participants who received ≥1 dose of the study intervention.
安全性分析のサブセットには、1回以上の試験介入を受けた参加者が含まれていました。
All analyses were conducted based on the actual intervention administered.
すべての分析は、実施された実際の介入に基づいて実施されました。
Data were summarized using measures of central tendency, dispersion, and frequency distribution.
データは、中心傾向、分散、度数分布の測定値を使用して要約されました。
Unless otherwise noted, all statistical tests were performed at the two-sided α=0.05.
特に明記されていない限り、すべての統計的検定は両側α= 0.05で実行されました。
Missing values were not imputed.
欠落している値は代入されませんでした。
All analyses were performed using SAS®v9.4 (SAS Institute, NC, USA).
すべての分析は、SAS®v9.4(SAS Institute、NC、USA)を使用して実行されました。
(See Supplementary Appendix for detailed methods and statistical analyses).
(詳細な方法と統計分析については、補足付録をご覧ください)。
Results
Trial Participants
All 206 participants screened were enrolled in the study (S-268019-b, n=103; tozinameran, n=103) during December 3–22, 2021 (Supplementary Figure 1).
スクリーニングされた206人の参加者全員が、2021年12月3〜22日に研究に登録されました(S-268019-b、n = 103、トジナメラン、n = 103)(補足図1)。
Baseline demographics and participant characteristics were balanced across S-268019-b and tozinameran groups: median age (range) was 30.0 (21-59) and 31.5 (21-60) years; male population, 70% and 72%, respectively (Supplementary Table 1).
ベースラインの人口統計と参加者の特徴は、S-268019-bグループとトジナメラングループの間でバランスが取れていました:年齢の中央値(範囲)は30.0(21-59)歳と31.5(21-60)歳;男性人口、それぞれ70%と72%(補足表1)。
Immunogenicity
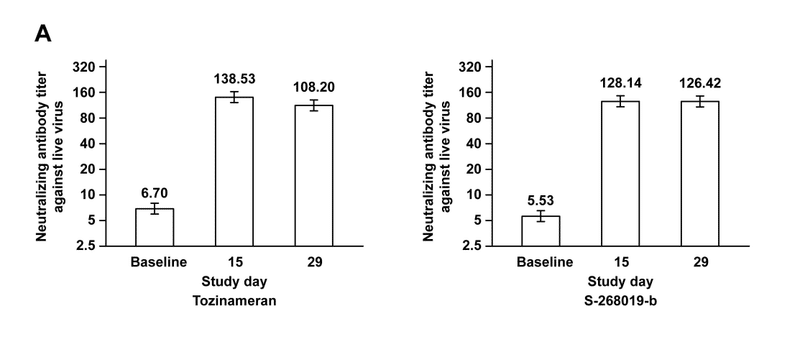
Per day 29 analysis, both co-primary endpoints were met: as a booster, S-268019-b was noninferior to tozinameran in SARS-CoV-2 neutralization.
29日目の分析では、両方の主要エンドポイントが満たされました。ブースターとして、S-268019-bはSARS-CoV-2中和においてトジナメランに劣っていませんでした。
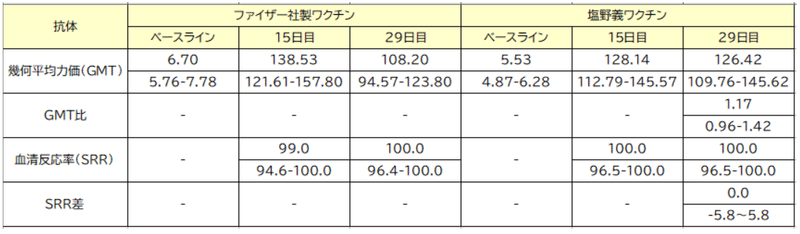
GMTs (95% CIs) for neutralizing antibodies at baseline were 5.53 (4.87-6.28) for S-268019-b group and 6.70 (5.76-7.78) for tozinameran, which increased to 126.42 (109.76-145.62) and 108.20 (94.57-123.80), respectively, by day 29 (adjusted-GMTR 1.17; 95% CI 0.96-1.42; one-sided P-value for noninferiority, <0.0001).
ベースラインでの中和抗体のGMT(95%CI)は、S-268019-bグループで5.53(4.87-6.28)、トジナメランで6.70(5.76-7.78)でした。これは、29日目までにそれぞれ126.42(109.76-145.62)と108.20(94.57-123.80)に増加しました(調整済み-GMTR 1.17; 95%CI 0.96-1.42;非劣性の片側P値、<0.0001)。
The SRR was 100% for both groups (SRR difference 0.0; 95% CI −5.8 to 5.8; one-sided P-value for noninferiority, 0.0004) (Figure 2A and Table 1).
SRRは両方のグループで100%でした(SRRの差0.0、95%CI -5.8〜5.8、非劣性の片側P値、0.0004)(図2Aおよび表1)。
The GMTs (95% CIs) for anti-spike protein IgG antibodies at baseline were 1475.9 (1280.1-1701.6) for S-268019-b and 1795.9 (1536.9-2098.6) for tozinameran; these were elevated to 48844.0 (41855.3-56999.7) and 55214.8 (49013.5-62200.7), respectively, on day 29 (Figure 2B), with both groups showing 100% SRR (Supplementary Table 2).
ベースラインでの抗スパイクタンパク質IgG抗体のGMT(95%CI)は、S-268019-bで1475.9(1280.1-1701.6)、トジナメランで1795.9(1536.9-2098.6)でした;これらは29日目にそれぞれ48844.0(41855.3-56999.7)と55214.8(49013.5-62200.7)に上昇し(図2B)、両方のグループが100%のSRRを示しました(補足表2)。
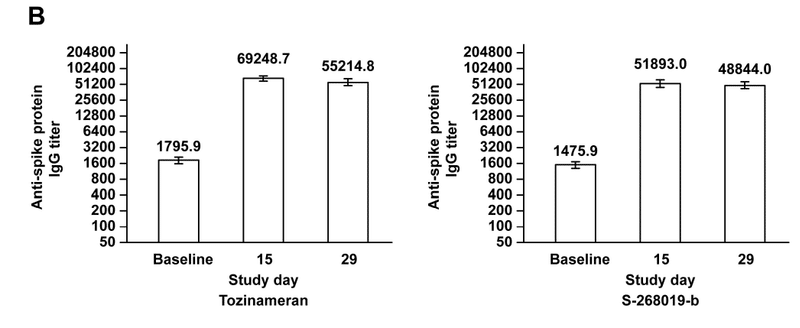
The GMFR and GMT results were consistent (Supplementary Table 2 and Figure 2).
GMFRとGMTの結果は一貫していました(補足表2と図2)。
Furthermore, the geometric mean NT50 against SARS-CoV-2 pseudovirus variants on day 29 were assessed in a smaller sample of the immunogenicity subset (n=24/group).
さらに、29日目のSARS-CoV-2偽ウイルス変異体に対する幾何平均NT50は、免疫原性サブセットのより小さなサンプルで評価されました(n = 24 /グループ)。
The sampling ensured no significant differences in age and neutralizing antibody titer against live wildtype virus on day 29 compared with the entire cohort (Supplementary Table 3).
サンプリングにより、29日目の生の野生型ウイルスに対する年齢と中和抗体価に、コホート全体と比較して有意差がないことが確認されました(補足表3)。
Serum samples from both vaccine groups neutralized Delta and Omicron pseudovirus variants with similar potency, as indicated by NT50 values relative to tozinameran (Figure 2C).
両方のワクチングループの血清サンプルは、トジナメランと比較したNT50値で示されるように、同様の効力を持つデルタおよびオミクロンの偽ウイルス変異体を中和しました(図2C)。
T-cell responses were assessed for a subgroup (n=30/group) sampled from participants who gave consent for cellular immunity assessments.
T細胞応答は、細胞性免疫評価に同意した参加者からサンプリングされたサブグループ(n = 30 /グループ)について評価されました。
Both vaccines induced antigen-specific polyfunctional CD4+ T-cell responses, as reflected in the interferon-gamma and interleukin-2 expression on day 15 (Supplementary Figure 2).
両方のワクチンは、15日目のインターフェロンガンマおよびインターロイキン-2の発現に反映されているように、抗原特異的な多機能CD4 + T細胞応答を誘導しました(補足図2)。
A strong bias toward the T-helper type 1 phenotype was noted.
Tヘルパー1型表現型への強い偏りが認められました。
Safety
Both, S-268019-b and tozinameran, displayed an acceptable safety profile as a booster.
S-268019-bとtozinameranはどちらも、ブースターとして許容できる安全性プロファイルを示しました。
There were no treatment-emergent serious AEs, deaths, grade 4-5 solicited TRAEs, or AEs of special interest reported until data cutoff date (February 4, 2022) (Supplementary Table 4).
データの締め切り日(2022年2月4日)まで、治療に起因する重篤なAE、死亡、グレード4〜5の要請されたTRAE、または特別な関心のあるAEは報告されませんでした(補足表4)。
Overall, 96.1% (99/103) participants reported 375 TRAEs in the S-268019-b group, and 98.1% (101/103) participants reported 464 TRAEs in the tozinameran group.
全体として、96.1%(99/103)の参加者がS-268019-bグループで375のTRAEを報告し、98.1%(101/103)の参加者がトジナメラングループで464のTRAEを報告しました。
Furthermore, solicited systemic TRAEs were reported by 69.9% (72/103) and 78.6% (81/103) participants and solicited local TRAEs by 68.0% (70/103) and 72.8% (75/103) participants in the S-268019-b and tozinameran groups, respectively.
さらに、S-268019-bグループとtozinameranグループでそれぞれ、要請された全身TRAEは69.9%(72/103)および78.6%(81/103)の参加者によって、 ローカルTRAEは68.0%(70/103)および72.8%(75/103)の参加者によって報告されました。
The most frequently reported solicited TRAEs within 7 days in both booster groups were injection-site pain, fatigue, fever, myalgia, and headache (Table 2).
両方の追加免疫群で7日以内に最も頻繁に報告された勧誘TRAEは、注射部位の痛み、倦怠感、発熱、筋肉痛、および頭痛でした(表2)。
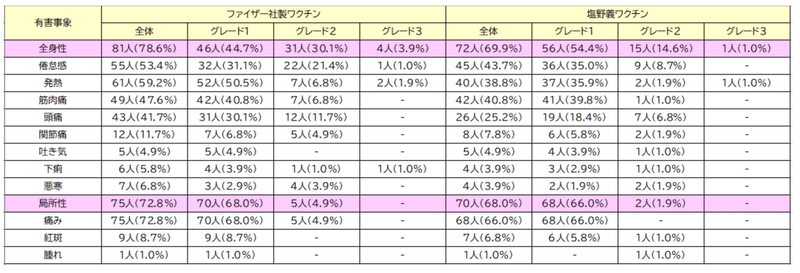
Most of the solicited TRAEs were grade 1-2 and were reported on day 1-2 of the booster dose injection (Supplementary Table 5).
要請されたTRAEのほとんどはグレード1〜2であり、追加免疫注射の1〜2日目に報告されました(補足表5)。
One participant in the S-268019-b group and four participants in the tozinameran group experienced grade 3 solicited TRAEs.
S-268019-bグループの1人の参加者と、トジナメラングループの4人の参加者は、グレード3の要請されたTRAEを経験しました。
Discussion
This study showed that S-268019-b as a booster (third) dose was noninferior to tozinameran in inducing SARS-CoV-2 neutralizing antibodies.
この研究では、追加免疫(3回目)としてのS-268019-bは、SARS-CoV-2中和抗体の誘導においてトジナメランより劣っていないことが示されました。
Both vaccines induced neutralizing antibodies against pseudovirus variants, and also elicited anti-spike protein IgG antibodies and T-cell responses within a month after the booster dose.
どちらのワクチンも、シュードウイルス変異体に対する中和抗体を誘導し、追加免疫投与後1か月以内に抗スパイクタンパク質IgG抗体とT細胞応答を誘発しました。
In other booster-dose studies, a third dose of either homologous or heterologous vaccines administered 3-9 months after the initial vaccination elicited robust immunogenicity against SARS-CoV-2 variants.
他の追加免疫研究では、最初のワクチン接種の3〜9か月後に投与された同種または異種ワクチンの3回目の接種により、SARS-CoV-2変異体に対する強力な免疫原性が誘発されました。
In the COV-BOOST trial, immunogenicity of various types of vaccines given as the third dose was assessed in participants with primary vaccination with either tozinameran or AZD-1222.
COV-BOOST試験では、トジナメランまたはAZD-1222のいずれかを一次ワクチン接種した参加者を対象に、3回目の接種で投与されたさまざまな種類のワクチンの免疫原性が評価されました。
While the booster dose of all types of vaccines (mRNA, protein subunit, adenovirus vector, and inactivated virus) amplified immune responses, mRNA vaccines (tozinameran and mRNA-1273) induced more potent immunogenicity than other types of vaccines.
すべての種類のワクチン(mRNA、タンパク質サブユニット、アデノウイルスベクター、不活化ウイルス)の追加免疫は免疫応答を増幅しましたが、mRNAワクチン(トジナメランとmRNA-1273)は他の種類のワクチンよりも強力な免疫原性を誘導しました。
Considering that S-268019-b booster is as immunogenic as the tozinameran booster, S-268019-b may elicit more potent humoral immunogenicity than other types of vaccines in the COV-BOOST study, although a direct comparison is not possible.
S-268019-bブースターはトジナメランブースターと同じくらい免疫原性があることを考えると、S-268019-bは、COV-BOOST研究で他のタイプのワクチンよりも強力な体液性免疫原性を誘発する可能性がありますが、直接比較することはできません。
Although no correlates of protection have been established in COVID-19, the neutralizing antibody titer against SARS-CoV-2 after primary vaccination is highly correlated with clinical efficacy against symptomatic COVID-19.
COVID-19には防御の相関関係は確立されていませんが、一次ワクチン接種後のSARS-CoV-2に対する中和抗体価は、症候性COVID-19に対する臨床効果と高い相関があります。
Humoral immunity in COVID-19 is known to wane over time, especially after 6 months, and so does protection against symptomatic COVID-19.
COVID-19の体液性免疫は、時間の経過とともに、特に6か月後に低下することが知られており、症候性COVID-19に対する防御も低下します。
In this study, lower baseline titers for neutralizing antibodies ≥6 months after the 2-dose tozinameran vaccination were observed, consistent with previous reports.
この研究では、2回投与のトジナメランワクチン接種から6か月以上経過した後の中和抗体のベースライン力価が低くなることが観察されました。これは、以前の報告と一致しています。
Meanwhile, studies have reported that a booster dose of tozinameran after 2 doses of tozinameran enhances humoral immunity.
一方、研究によると、トジナメランを2回投与した後、トジナメランを追加投与すると体液性免疫が強化されることが報告されています。
Moreover, a report from Israel stated greater efficacy against COVID-19-related hospitalization and death after three versus two tozinameran doses.
さらに、イスラエルからの報告によると、2回投与に比べてトジナメランの3回投与は、COVID-19に関連する入院と死亡に対する有効性が高いことが示されています。
Since our results show noninferiority of S-268019-b to tozinameran in inducing neutralizing antibodies, it is speculated that S-28019-b may also show clinical efficacy similar to the booster tozinameran, although further investigations to support this theory are warranted.
私たちの結果は、中和抗体の誘導においてS-268019-bがトジナメランに対して非劣性であることを示しているため、S-28019-bもブースタートジナメランと同様の臨床効果を示す可能性があると推測されますが、この理論を裏付けるさらなる調査が必要です。
A previous study showed that the NT50 against the live Omicron virus after two doses of tozinameran was below the detection limit and 61-fold lower compared with the wildtype NT50.
以前の研究では、トジナメランを2回投与した後の生きたオミクロンウイルスに対するNT50は検出限界を下回り、野生型NT50と比較して61分の1でした。
However, the third (booster) dose of tozinameran elicited neutralizing antibody titer against Omicron, with NT50 only 6-fold lower than that with the wildtype.
ただし、トジナメランの3回目(ブースター)投与では、オミクロンに対する中和抗体価が誘発され、NT50は野生型の6分の1にすぎませんでした。
Moreover, the tozinameran booster dose protected against symptomatic COVID-19 due to Omicron.
さらに、トジナメランブースター効果は、オミクロンによる症候性COVID-19から保護されました。
The current findings showing that S-268019-b and tozinameran are similar with respect to neutralizing antibody levels against Omicron suggest that S-28019-b might also show similar clinical efficacy against symptomatic COVID-19 due to Omicron.
S-268019-bとトジナメランがオミクロンに対する中和抗体レベルに関して類似していることを示す現在の調査結果は、S-28019-bがオミクロンによる症候性COVID-19に対しても同様の臨床効果を示す可能性があることを示唆しています。
The T-cell response in COVID-19 is crucial for sustained protection from severe disease progression.
COVID-19のT細胞応答は、重度の病気の進行からの持続的な保護に不可欠です。
Additionally, the T-cell response elicited by COVID-19 infection or prior vaccination is considered cross-reactive against other variants, including Omicron.
さらに、COVID-19感染または以前のワクチン接種によって誘発されたT細胞応答は、オミクロンを含む他の変異体に対して交差反応性があると見なされます。
In the current study, we only examined the T-cell response to the original wildtype strain, in which S-268019-b showed a response similar to tozinameran.
現在の研究では、S-268019-bがトジナメランと同様の応答を示した元の野生型株に対するT細胞応答のみを調べました。
However, due to the cross-reactive nature of the T-cell response, it is speculated that the T-cell response elicited by S-268019-b may possibly be effective in preventing severe diseases caused by Omicron and other future variants.
ただし、T細胞応答の交差反応性により、S-268019-bによって誘発されるT細胞応答は、オミクロンやその他の将来の変異体によって引き起こされる重篤な疾患の予防に有効である可能性があると推測されます。
In this study, both vaccines led to mainly low-grade reactogenicity, with fever, fatigue, myalgia, and injection-site pain being commonly reported, usually within 2 days of the booster dose.
この研究では、両方のワクチンが主に微熱反応を引き起こし、発熱、倦怠感、筋肉痛、注射部位の痛みが一般的に報告されており、通常は追加免疫投与から2日以内に報告されています。
Compared with tozinameran, S-268019-b led to a lower incidence of solicited TRAEs.
トジナメランと比較して、S-268019-bは要請されたTRAEの発生率を低下させました。
Similarly, across all 7 booster vaccines in the COV-BOOST trial, the most frequently solicited AEs reported within 7 days were low-grade fatigue, headache, and local pain.
同様に、COV-BOOST試験の7つのブースターワクチンすべてで、7日以内に報告された最も頻繁に求められたAEは、軽度の倦怠感、頭痛、および局所的な痛みでした。
Despite the differences in population and methodologies across different studies, reactogenicity patterns seem largely consistent across studies after the booster dose of either an mRNA, adenovirus vector, or protein subunit vaccine.
異なる研究間での母集団と方法論の違いにもかかわらず、反応原性パターンは、mRNA、アデノウイルスベクター、またはタンパク質サブユニットワクチンのいずれかの追加免疫投与後の研究間でほぼ一貫しているようです。
This is the first clinical trial report of a recombinant spike protein vaccine showing its noninferiority to an mRNA vaccine as a booster dose in Japanese participants.
これは、日本人参加者の追加免疫としてのmRNAワクチンに対する非劣性を示す組換えスパイクタンパク質ワクチンの最初の臨床試験報告です。
Some limitations of this study must however be acknowledged.
ただし、この研究のいくつかの制限を認める必要があります。
The study (1) was designed for an immunocompetent adult Japanese cohort with no known history of SARS-CoV-2 infection and prior vaccination with only tozinameran, and (2) has a short follow-up duration for interim analysis and relatively small sample size.
この研究は、(1)SARS-CoV-2感染の既往歴がなく、トジナメランのみの事前ワクチン接種を受けた免疫能のある成人日本人コホート向けに設計されたものであり、(2)中間分析の追跡期間が短く、サンプルサイズが比較的小さい 。
Also, this study was not powered to demonstrate clinical efficacy.
また、この研究は臨床的有効性を実証するために力を与えられていませんでした。
Despite these limitations, a booster dose of the recombinant spike protein vaccine, S-268019-b, elicited robust immunogenicity against SARS-CoV-2, with mostly low-grade reactogenicity.
これらの制限にもかかわらず、組換えスパイクタンパク質ワクチンS-268019-bの追加免疫は、SARS-CoV-2に対して強力な免疫原性を誘発し、ほとんどが低悪性度の反応原性を示しました。
Conclusion
The booster dose of S-268019-b vaccine was noninferior to tozinameran booster as per the findings of GMT and SRR for SARS-CoV-2 neutralizing antibodies, and was well-tolerated in fully vaccinated adult Japanese participants.
S-268019-bワクチンの追加免疫用量は、SARS-CoV-2中和抗体のGMTおよびSRRの結果によると、トジナメランブースターに劣らず、完全にワクチン接種された日本人の成人参加者で十分に許容されました。
S-268019-b booster was comparable with tozinameran booster in neutralizing the pseudovirus variants, Delta and Omicron.
S-268019-bブースターは、疑似ウイルスの亜種であるデルタおよびオミクロンを中和する点でトジナメランブースターと同等でした。
Thus, S-268019-b might be a future option for COVID-19 booster vaccine in adults.
したがって、S-268019-bは、成人におけるCOVID-19ブースターワクチンの将来の選択肢となる可能性があります。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
