中和抗体の成熟についての論文
専門的な論文です。
※参照などは省略してあります。
元→https://www.cell.com/immunity/pdfExtended/S1074-7613(21)00294-6
・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・・
Affinity maturation of SARS-CoV-2 neutralizing antibodies confers potency, breadth, and resilience to viral escape mutations
SARS-CoV-2中和抗体の親和性成熟は、ウイルスエスケープ変異に効力、幅、および回復力を付与します
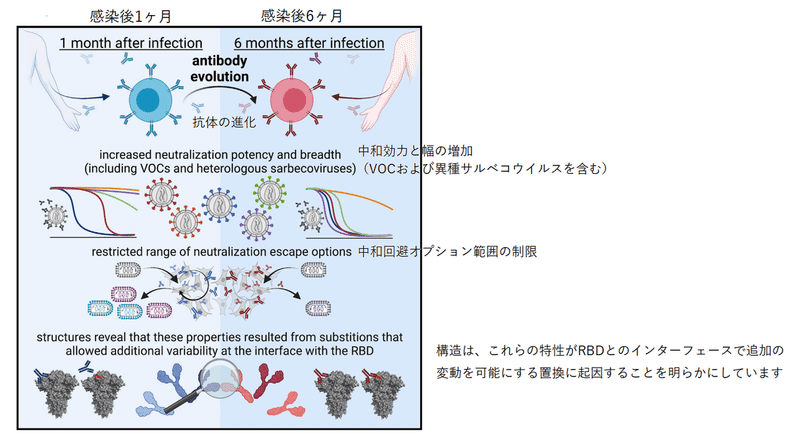
In brief
SARS-CoV-2 RBD-binding antibodies accumulate mutations over months of convalescence, but how maturation affects antibody properties is unclear.
SARS-CoV-2 RBD結合抗体は、回復期の数か月にわたって変異を蓄積しますが、成熟が抗体の特性にどのように影響するかは不明です。
Muecksch et al. analyze 6 groups of clonally related neutralizing antibodies from convalescent donors and reveal that antibody maturation increases affinity, potency, and breadth, and restricts viral escape options.
Mueckschらは、回復期のドナーからのクローンに関連する中和抗体の6つのグループを分析し、抗体の成熟が親和性、効力、幅を増加させ、ウイルスの逃避オプションを制限することを明らかにしました。
They also identify the structural basis for these improved antibody properties during maturation.
また、成熟中のこれらの改善された抗体特性の構造的基礎を特定します。
Highlights
・Maturation over months increases potency of SARS-CoV-2 neutralizing antibodies
・数ヶ月にわたる成熟は、SARS-CoV-2中和抗体の効力を高めます
・Antibody maturation restricts options for viral escape
・抗体の成熟はウイルスの逃避の選択肢を制限します
・Maturation of some antibodies enables neutralization of additional sarbecoviruses
・一部の抗体が成熟すると、追加のサルベコウイルスを中和できます
・Antibody-spike structures reveal changes that improve potency and breadth
・抗体スパイク構造は、効力と幅を改善する変化を明らかにします
SUMMARY
Antibodies elicited by infection accumulate somatic mutations in germinal centers that can increase affinity for cognate antigens.
感染によって誘発された抗体は、胚中心に体細胞変異を蓄積し、同族の抗原に対する親和性を高めることができます。
We analyzed 6 independent groups of clonally related severe acute respiratory syndrome-coronavirus-2 (SARS-CoV-2) Spike receptor-binding domain (RBD)-specific antibodies from 5 individuals shortly after infection and later in convalescence to determine the impact of maturation over months.
感染直後と回復期の5人の個体からクローン的に関連するSARS-CoV-2スパイクRBD特異的抗体の6つの独立したグループを分析し、数か月にわたる成熟の影響を判断しました。
In addition to increased affinity and neutralization potency, antibody evolution changed the mutational pathways for the acquisition of viral resistance and restricted neutralization escape options.
親和性と中和効力の増加に加えて、抗体の進化は、ウイルス耐性の獲得と中和回避オプションの制限のための突然変異経路を変更しました。
For some antibodies, maturation imposed a requirement for multiple substitutions to enable escape.
一部の抗体では、成熟は、脱出を可能にするために複数の置換の要件を課しました。
For certain antibodies, affinity maturation enabled the neutralization of circulating SARS-CoV-2 variants of concern and heterologous sarbecoviruses.
特定の抗体では、親和性成熟により、懸念される循環SARS-CoV-2変異株および異種サルベコウイルスの中和が可能になりました。
Antibody-antigen structures revealed that these properties resulted from substitutions that allowed additional variability at the interface with the RBD.
抗体-抗原構造は、これらの特性が置換に起因することを明らかにしました。これにより、RBDとのインターフェースで追加の変動が可能になりました。
These findings suggest that increasing antibody diversity through prolonged or repeated antigen exposure may improve protection against diversifying SARS-CoV-2 populations, and perhaps against other pandemic threat coronaviruses.
これらの発見は、長期または繰り返しの抗原曝露による抗体の多様性の増加は、SARS-CoV-2集団の多様化に対する防御を改善し、おそらく他のパンデミック脅威コロナウイルスに対する防御を改善する可能性があることを示唆しています。
INTRODUCTION
Neutralizing antibodies elicited by infection or vaccination are a central component of immunity to subsequent challenge by viruses and can also confer passive immunity in prophylactic or therapeutic settings.
感染またはワクチン接種によって誘発される中和抗体は、ウイルスによるその後の攻撃に対する免疫の中心的な要素であり、予防的または治療的な設定で受動免疫を与えることもできます。
In the case of severe acute respiratory syndrome-coronavirus-2 (SARS-CoV-2), an understanding of how viral variants evade antibodies and how affinity maturation could generate antibodies that maintain activity against viral variants is important to guide vaccination and treatment strategies.
重症急性呼吸器症候群-コロナウイルス-2(SARS-CoV-2)の場合、ウイルス変異体が抗体を回避する方法と、親和性成熟がウイルス変異体に対する活性を維持する抗体を生成する方法を理解することは、ワクチン接種と治療戦略を導くために重要です。
The receptor-binding domains (RBDs) of the SARS-CoV-2 Spike trimer are key neutralization targets, and potent RBD-specific antibodies have been isolated from many convalescent donors.
SARS-CoV-2スパイク三量体の受容体結合ドメイン(RBD)は重要な中和標的であり、強力なRBD特異的抗体が多くの回復期のドナーから分離されています。
Such antibodies are used for the treatment of SARS-CoV-2 infection.
このような抗体は、SARS-CoV-2感染症の治療に使用されます。
Typically, RBD-specific neutralizing antibodies isolated during early convalescence have low levels of somatic hypermutation, and nearly identical antibodies derived from specific rearranged antibody genes (e.g., VH3-53/VH3-63) are found in distinct convalescent or vaccinated individuals.
通常、回復期の初期に分離されたRBD特異的中和抗体は、体細胞超変異のレベルが低く、また、特定の再構成された抗体遺伝子(VH3-53 / VH3-63など)に由来するほぼ同一の抗体が、回復期またはワクチン接種を受けた個別の個人に見られます。
Consistent with these findings, high titer neutralizing sera are generated following the administration of at least some SARS-CoV-2 vaccines.
これらの発見と一致して、少なくともいくつかのSARS-CoV-2ワクチンの投与に続いて、高力価の中和血清が生成されます。
Conversely, SARS-CoV-2 infection may sometimes fail to induce sufficient B cell stimulation and expansion to generate high neutralizing antibody titers.
逆に、SARS-CoV-2感染は、高い中和抗体価を生成するのに十分なB細胞刺激と増殖を誘発できない場合があります。
Neutralizing titers are low in some convalescent individuals, including those from whom commonly elicited potent antibodies can be cloned.
一部の回復期の人では中和力価が低い。一般的に誘発される強力な抗体をクローン化できるものを含みます。
The RBD exhibits flexibility and binds the angiotensin-converting enzyme 2 (ACE2) receptor only in an ‘‘up’’ conformation, not in the ‘‘down’’ RBD conformation of the closed, prefusion trimer.
RBDは柔軟性を示し、アンジオテンシン変換酵素2(ACE2)受容体に結合するのは、閉じたプレフュージョン三量体の「ダウン」RBDコンフォメーションではなく、「アップ」コンフォメーションのみです。
Structural studies have allowed the designation of distinct RBD-binding antibody structural classes.
構造研究により、異なるRBD結合抗体の構造クラスを指定することができました。
Class 1 antibodies are derived from VH3-53 or VH3-63 gene segments, include short CDRH3s, and recognize the ACE2 binding site on RBDs in an up conformation.
クラス1抗体は、VH3-53またはVH3-63遺伝子セグメントに由来し、短いCDRH3を含み、RBD上のACE2結合部位をアップコンフォメーションで認識します。
Class 2 antibodies are derived from a variety of VH gene segments, also target the ACE2 binding site, but can bind to RBDs in either an up or a down conformation.
クラス2抗体は、さまざまなVH遺伝子セグメントに由来し、ACE2結合部位も標的としますが、アップコンフォメーションまたはダウンコンフォメーションのいずれかでRBDに結合できます。
Some class 2 antibodies (e.g., C144, S2M11) bridge adjacent down RBDs to lock the Spike trimer into a closed prefusion conformation.
一部のクラス2抗体(C144、S2M11など)は、隣接するダウンRBDをブリッジして、スパイク三量体を閉じた融合前コンフォメーションにロックします。
Class 3 antibodies, which can recognize up or down RBDs, do not target the ACE2 binding site.
アップまたはダウンRBDを認識できるクラス3抗体は、ACE2結合部位を標的としません。
Despite the fact that cloned RBD-specific antibodies can select resistance mutations, such as E484K, in cell culture, until recently, little evidence had emerged that antibodies have imposed selective pressure on circulating SARS-CoV-2 populations.
クローン化されたRBD特異的抗体は、細胞培養においてE484Kなどの耐性変異を選択できるという事実にもかかわらず、最近まで、抗体が循環SARS-CoV-2集団に選択圧を課したという証拠はほとんど出ていませんでした。
Nevertheless, variability and decay of convalescent neutralizing titers suggests that reinfection by SARS-CoV-2 may occur with some frequency.
それにもかかわらず、回復期中和力価の変動と減衰は、SARS-CoV-2による再感染がある程度の頻度で発生する可能性があることを示唆しています。
Recent reports have documented reinfection or rapidly increasing case numbers associated with SARS-CoV-2 variants with resistance to commonly elicited antibodies.
最近の報告では、一般的に誘発される抗体に耐性のあるSARS-CoV-2変異体に関連する再感染または急速に増加する症例数が報告されています。
The majority of SARS-CoV-2 antibodies that have been studied in detail were cloned from individuals early in convalescence and have relatively low numbers of somatic mutations.
詳細に研究されたSARS-CoV-2抗体の大部分は、回復期の初期に個人からクローン化されたものであり、体細胞変異の数は比較的少ないです。
However, recent work has shown that antibodies evolve in convalescent patients, accumulating somatic mutations that can affect function.
ただし、最近の研究では、回復期の患者で抗体が進化し、機能に影響を与える可能性のある体細胞変異が蓄積することが示されています。
Here, we present a detailed functional and structural characterization of several groups of clonally related antibodies recovered from the same 5 individuals shortly after infection and then later in convalescence.
ここでは、感染直後とその後の回復期に同じ5人の個人から回収されたクローン関連抗体のいくつかのグループの詳細な機能的および構造的特性を示します。
We show that somatic mutations acquired in the months after infection endow some SARS-CoV-2 RBD-specific antibodies with greater neutralization potency and breadth.
感染後数か月で獲得した体細胞変異は、いくつかのSARS-CoV-2RBD特異的抗体に中和力と幅を与えることを示しています。
We further show that the acquisition of somatic mutations enables some antibodies to maintain activity in instances in which viral mutations would otherwise enable escape from neutralization.
さらに、体細胞変異の獲得により、ウイルス変異が中和からの脱出を可能にする場合に、一部の抗体が活性を維持できることを示します。
RESULTS
SARS-CoV-2 RBD-specific antibody sequences evolve during convalescence
SARS-CoV-2 RBD特異的抗体配列は、回復期に進化します
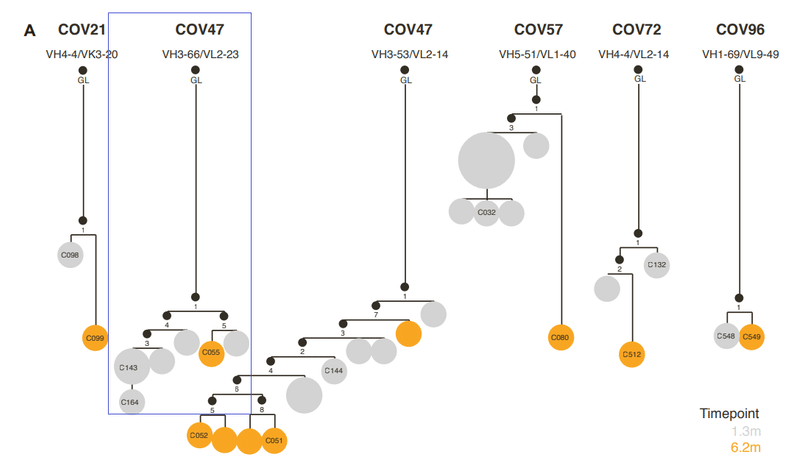
We studied RBD-specific antibodies selected from a set of 1,072 that were cloned from a cohort of convalescent individuals who were studied at a mean of 1.3 and 6.2 months after PCR diagnosis of mild to moderately severe coronavirus disease 2019 (COVID-19).
2019年の軽度から中等度のコロナウイルス病(COVID-19)のPCR診断から平均1.3か月と6.2か月後に調査された、回復期の個人のコホートからクローン化された1,072のセットから選択されたRBD特異的抗体を研究しました
Antibody sequences found at 6.2 months were more divergent than sequences found at 1.3 months from their unmutated common ancestors, illustrating continued antibody evolution during convalescence.
6.2か月で見つかった抗体配列は、1.3か月で見つかった、変異していない共通の祖先からの配列よりも多様であり、回復期に抗体が進化し続けていることを示しています。
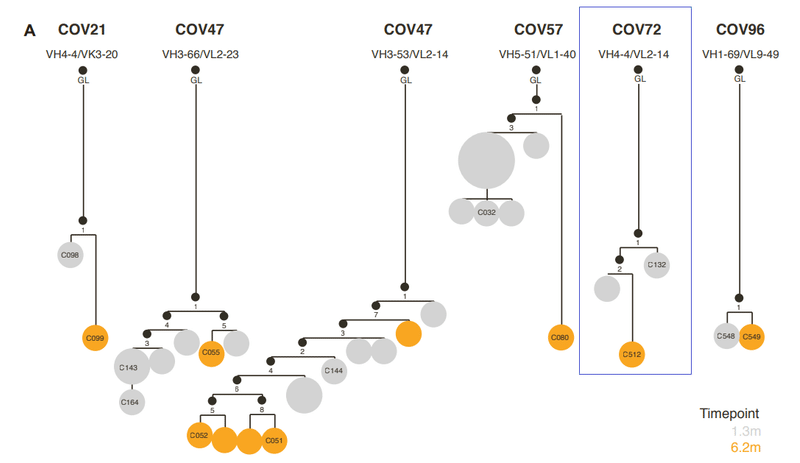
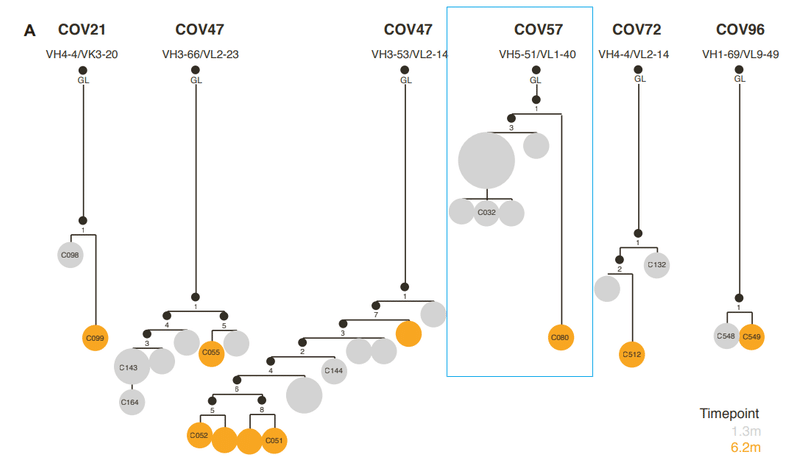
To determine the functional consequences of maturation of clonally related antibodies during SARS-CoV-2 convalescence, we analyzed 6 representative antibody groups from 5 different participants (Figure S1A; Table S1), with members of each antibody group isolated at 1.3 and 6.2 months.
SARS-CoV-2回復期のクローン関連抗体の成熟による機能的影響を判断するに、5人の異なる参加者からの6つの代表的な抗体グループを分析し(図S1A、表S1)、各抗体グループのメンバーは1.3か月と6.2か月で分離されました。
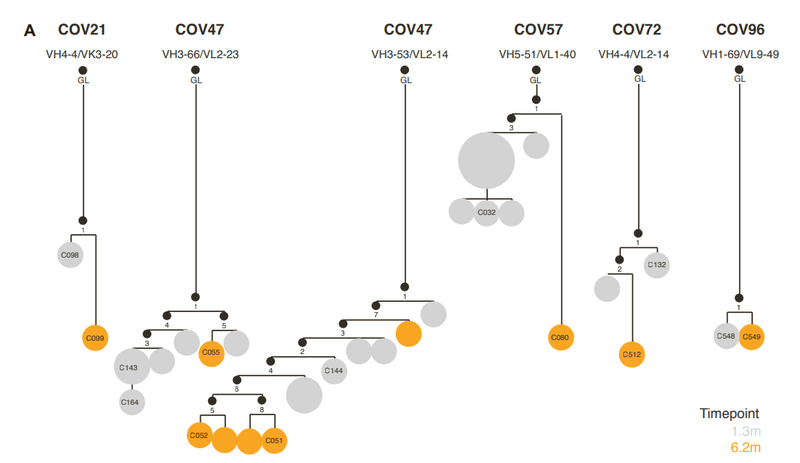
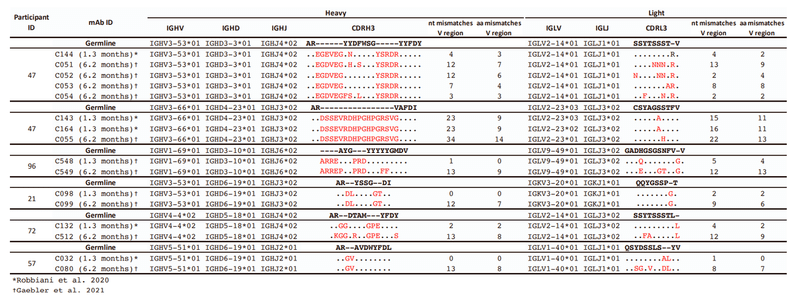
Selection of the antibodies were based on the approximate frequency of antibody RBD-binding classes found in our convalescent cohort.
抗体の選択は、回復期のコホートで見つかった抗体RBD結合クラスのおおよその頻度に基づいて行われました。
Class 2 is the predominant antibody class found in convalescent individuals, but class 1 and class 3 antibodies are also encountered frequently.
クラス2は回復期の個人に見られる主要な抗体クラスですが、クラス1およびクラス3の抗体も頻繁に見られます。
We measured antibody affinity, using Biolayer interferometry (BLI) and neutralization potency against a panel of SARS-CoV-2 pseudotypes with substitutions that can confer resistance to neutralization by human antibodies.
バイオレイヤー干渉法(BLI)と、ヒト抗体による中和に対する耐性を付与できる置換を伴うSARS-CoV-2シュードタイプのパネルに対する中和効力を使用して、抗体の親和性を測定しました。
In addition, to determine the ability of the SARS-CoV-2 Spike to acquire mutations conferring resistance, we used replication-competent chimeric vesicular stomatitis virus (VSV) derivatives (rVSV/SARS-CoV-21D7/2E1) to select escape variants for each of the antibodies.
さらに、SARS-CoV-2スパイクが耐性を付与する突然変異を獲得する能力を決定するために、複製能力のあるキメラ水疱性口内炎ウイルス(VSV)誘導体(rVSV / SARS-CoV-21D7 / 2E1)を使用して、各抗体のエスケープバリアントを選択しました。
Maturation increases the potency and resilience of class 2 SARS-CoV-2 neutralizing antibodies
成熟すると、クラス2 SARS-CoV-2中和抗体の効力と回復力が高まります
Class 2 anti-RBD antibodies are commonly elicited and recognize an epitope that includes E484, which is mutated in certain circulating SARS-CoV-2 ‘‘variants of concern’’ (VOC).
クラス2抗RBD抗体は一般的に誘発され、特定の循環SARS-CoV-2「懸念される変異株」(VOC)で変異しているE484を含むエピトープを認識します。
We examined members of 3 class 2 antibody groups.
3つのクラス2抗体グループのメンバーを調べました。
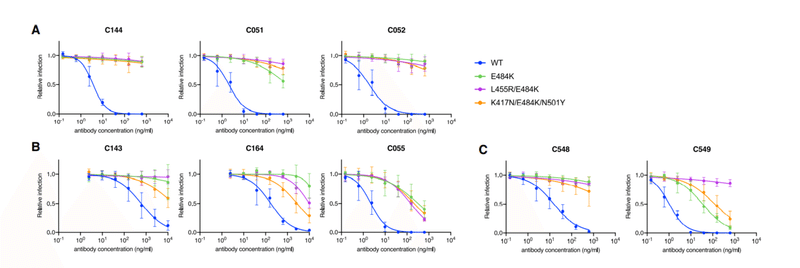
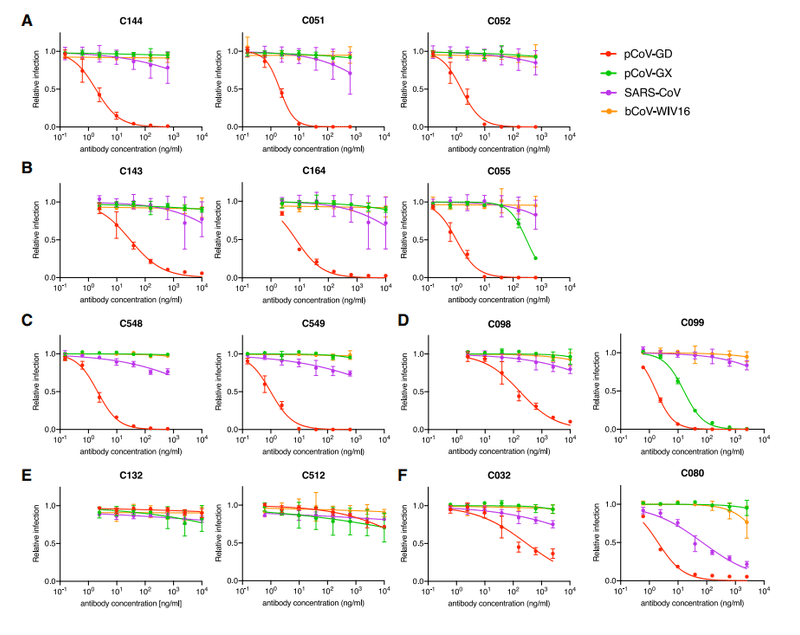
One group of class 2, VH3-53/VL2-14-encoded antibodies included C144, a potent neutralizing antibody (half-maximal inhibitory concentration [IC50] <10 ng/mL) isolated at 1.3 months of convalescence, which is in clinical development for therapy/prophylaxis.
クラス2の1つのグループ、VH3-53 / VL2-14でエンコードされた抗体には、回復期の1.3か月で分離された強力な中和抗体(最大阻害濃度の半分[IC50] <10 ng / mL)であるC144が含まれていました。これは、治療/予防のために臨床開発中です。
Two clonally related antibodies subsequently isolated from the C144 donor at 6.2 months included C051, which was marginally less potent (IC50 ~25 ng/mL), and C052, which had similar potency to C144.
その後6.2か月でC144ドナーから分離された2つのクローン関連抗体には、わずかに効力が低い(IC50〜25 ng / mL)C051と、C144と同様の効力を持っていたC052が含まれていました。
C051 and C052 had ~4-fold greater somatic hypermutation (SHM) frequency compared to C144 (Table S1).
C051とC052は、C144と比較して体細胞超変異(SHM)の頻度が約4倍高かった(表S1)。

SARS-CoV-2 pseudotype neutralization assay revealed that several RBD substitutions at positions L455, F456, E484, F490, Q493, and S494, which conferred C144 resistance, had no effect on C051 and C052 sensitivity (Figures 1A and 1B).
SARS-CoV-2疑似型中和アッセイにより、C144耐性を付与した、位置L455、F456、E484、F490、Q493、およびS494でのいくつかのRBD置換は、C051およびC052の感度に影響を及ぼさないことが明らかになりました(図1Aおよび1B)。
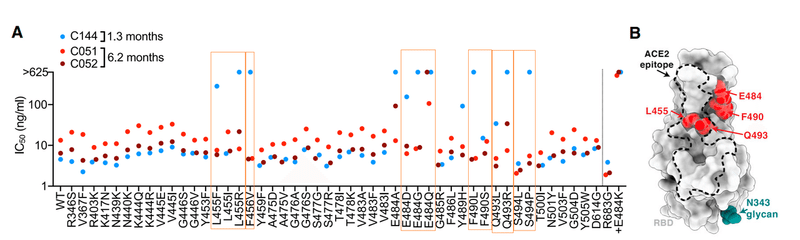
Some, but not all, naturally occurring E484 substitutions that conferred C144 resistance also conferred resistance to C051 and/or C052.
すべてではありませんが、C144耐性を付与する自然発生のE484置換の一部は、C051および/またはC052への耐性も付与しました。
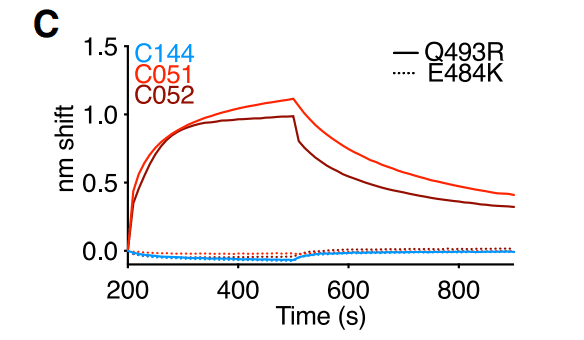
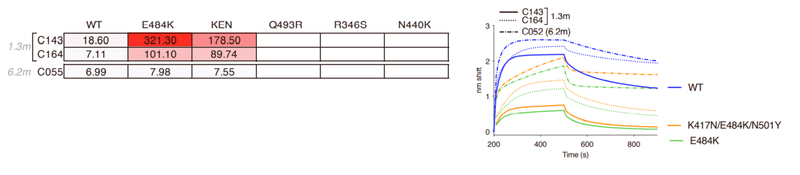
Consistent with this finding, C051 and C052 had increased affinity for Q493R mutant RBD compared to C144, but remained unable to bind the E484K RBD (Figures 1C and S1B).
この発見と一致して、C051とC052はC144と比較してQ493R変異体RBDに対する親和性が増加していました。しかし、E484K RBDを結合することはできませんでした(図1CおよびS1B)。

Selection for C144 resistance mutations using rVSV/SARS-CoV-2 yielded multiple substitutions at 2 positions; E484K/A/G and Q493R/K (Figure 1D), and plaque purification from selected virus populations yielded isolates with E484K or Q493R substitutions that confer C144 resistance.
rVSV / SARS-CoV-2を使用したC144耐性変異の選択により、2つの位置で複数の置換が生じました;E484K / A / GおよびQ493R / K(図1D)、および選択したウイルス集団からのプラーク精製により、C144耐性を付与するE484KまたはQ493R置換を有する分離株が得られました。
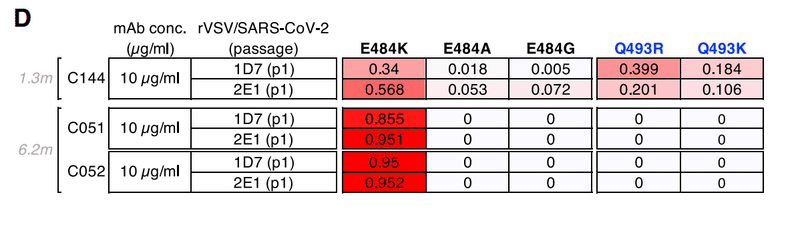
Conversely, rVSV/SARS-CoV-2 replication in the presence of C051 and C052 led to the dominance of the E484K mutant only, and rVSV/SARS-CoV-2 isolates bearing E484K substitutions were resistant to C051 and C052 (Figures 1D and S2A).
逆に、C051およびC052の存在下でのrVSV / SARS-CoV-2複製は、E484K変異体のみの優勢をもたらし、E484K置換を有するrVSV / SARS-CoV-2分離株は、C051およびC052に耐性がありました(図1DおよびS2A )。
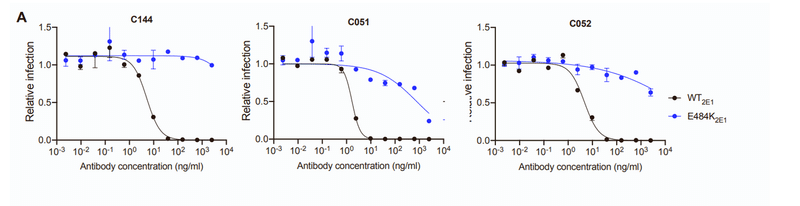
Thus, affinity maturation of this clonally related family of potently neutralizing antibodies enabled the retention of activity against a subset of naturally occurring potential escape variants.
したがって、強力に中和する抗体のこのクローン関連ファミリーの親和性成熟により、天然に存在する潜在的なエスケープバリアントのサブセットに対する活性の保持が可能になりました。
Nevertheless, the E484K substitution conferred resistance to each of the antibodies in this commonly elicited class (Figures 1A, 1B, and S2A).
それにもかかわらず、E484K置換は、この一般的に誘発されるクラスの各抗体に耐性を付与しました(図1A、1B、およびS2A)。
A second clonally related group of antibodies, encoded by VH3-66/VL2-33, included C143 and C164, isolated at 1.3 months, and C055, isolated at 6.2 months, were from the same individual as the C144 group (Figure S1A).
VH3-66 / VL2-33によってコードされる2番目のクローン関連抗体グループには、1.3か月で分離されたC143とC164が含まれ、6.2か月で分離されたC055は、C144グループと同じ個人からのものでした(図S1A)。
C143 and C164 had weak neutralizing activity (IC50 values 300–>625 ng/mL) against the HIV-1 pseudotype panel (Figure S2B).
C143およびC164は、HIV-1疑似型パネルに対して弱い中和活性(IC50値300→ 625 ng / mL)を示しました(図S2B)。
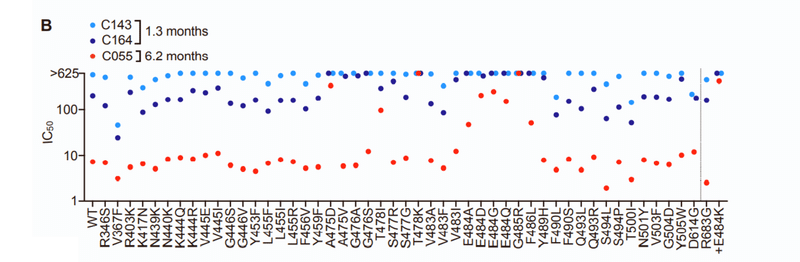
Conversely, C055 potently neutralized the majority of SARS-CoV-2 Spike variant pseudotypes (IC50 values of ~10 ng/mL) (Figure S2B).
逆に、C055は、SARS-CoV-2スパイクバリアントシュードタイプの大部分を強力に中和しました(IC50値は約10 ng / mL)(図S2B)。
C143 and C164 had quite high SHM frequencies relative to other 1.3-month antibodies, but this was further increased in C055 (Table S1).
C143およびC164は、他の1.3か月の抗体と比較して非常に高いSHM頻度を示しましたが、これはC055でさらに増加しました(表S1)。

While the increased potency of C055 was not fully reflected by changes in the affinity for the wild-type (WT) RBD, C055 exhibited clearly increased affinity for the E484K mutant RBD (Figure S1B).
C055の効力の増加は、野生型(WT)RBDに対する親和性の変化によって完全には反映されませんでしたが、C055はE484K変異体RBDに対する親和性の増加を明らかに示しました(図S1B)。
Naturally occurring Spike substitutions (at positions A475, T478, E484, G485, and F486) reduced C055 potency (Figure S2B), indicating a target epitope close to that of the C144/C051/C052 antibody group.
自然に発生するスパイク置換(位置A475、T478、E484、G485、およびF486)は、C055の効力を低下させ(図S2B)、C144 / C051 / C052抗体グループの標的エピトープに近いことを示しています。
Despite their modest potency, rVSV/SARS-CoV-2 replication with C143 or C164 led to the enrichment of T478K/R mutations, and a plaque-purified T478R mutant isolate exhibited near-complete resistance to C143 and C164, while an E484K mutant exhibited partial resistance (Figures S2C and S2D).
適度な効力にもかかわらず、C143またはC164を使用したrVSV / SARS-CoV-2複製により、T478K / R変異が濃縮されました。プラーク精製されたT478R変異体分離株は、C143およびC164に対してほぼ完全な耐性を示しましたが、E484K変異体は部分的な耐性を示しました(図S2CおよびS2D)。
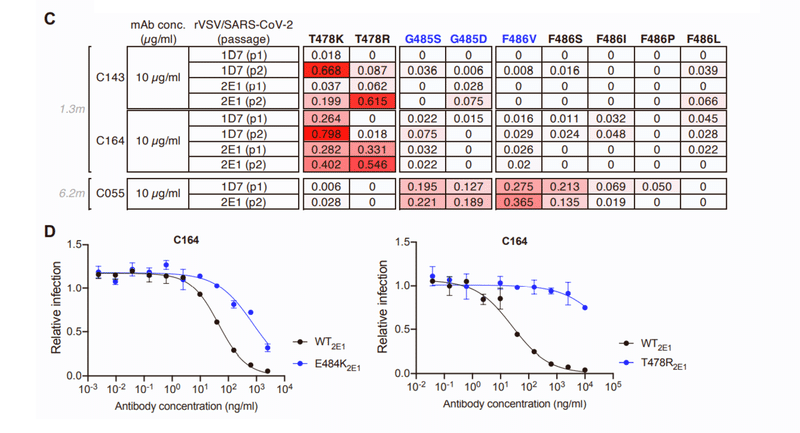
Conversely rVSV/SARS-CoV-2 selection with C055 yielded G485S/D and F486V/S mutations, and isolates with G485S, F486S, or F486V substitutions exhibited nearly complete resistance to C055 (Figures S2C and S2E).
逆に、C055によるrVSV / SARS-CoV-2の選択では、G485S / DおよびF486V / Sの変異が生じ、G485S、F486S、またはF486Vの置換による分離株は、C055に対してほぼ完全な耐性を示しました(図S2CおよびS2E)。
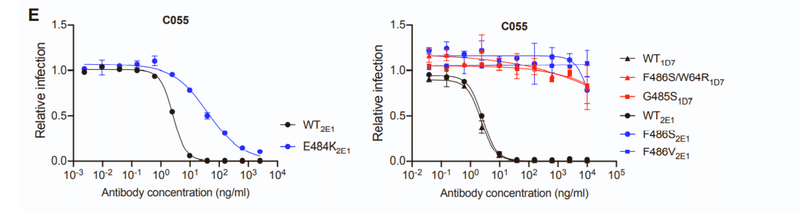
Overall, maturation of this clonally related class 2 antibody group yielded both greater potency and a change in the selected Spike substitutions that yielded neutralization escape (Figure S2C).
全体として、このクローン的に関連するクラス2抗体グループの成熟は、より大きな効力と、中和エスケープをもたらす選択されたスパイク置換の変化の両方をもたらしました(図S2C)。
A third group of class 2 antibodies, encoded by VH1-69/VL9-49, included C548, isolated at 1.3 months, and C549, isolated at 6.2 months (Figure S1A).
VH1-69 / VL9-49によってコードされるクラス2抗体の3番目のグループには、1.3か月で分離されたC548と6.2か月で分離されたC549が含まれていました(図S1A)。
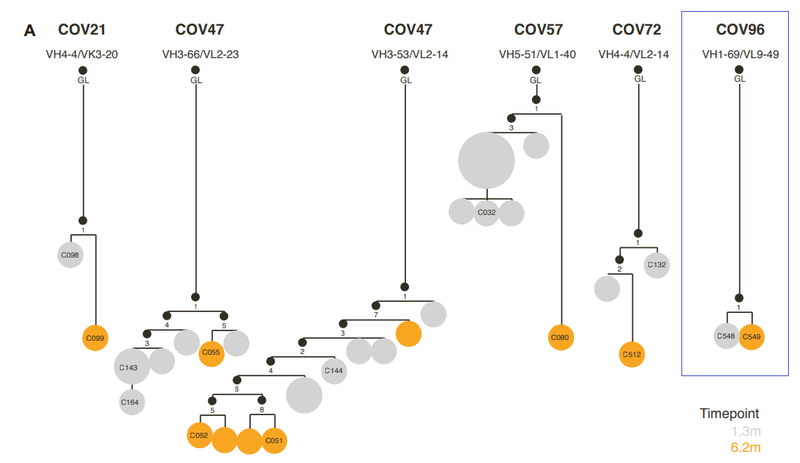
Notably, C548 had a near germline sequence with only 1 nucleotide mismatch in the light chain, while C549 acquired 13 and 8 nucleotide mismatches in the heavy and light chains, respectively (Table S1).
特に、C548は、軽鎖に1ヌクレオチドのミスマッチしかない生殖細胞系列に近い配列を持っていましたが、C549は、重鎖と軽鎖にそれぞれ13ヌクレオチドと8ヌクレオチドのミスマッチを獲得しました(表S1)。

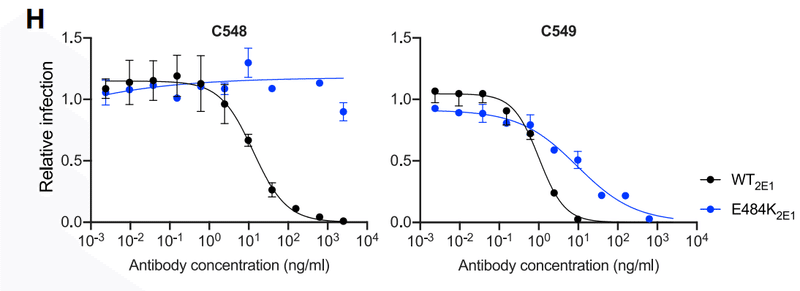
C548 was somewhat less potent (IC50 ~50 ng/mL) than C549 (IC50 ~15 ng/mL) and had a commensurately lower binding affinity for WT RBD (Figures 1E, 1F, and S1B).
C548はC549(IC50〜15 ng / mL)よりもやや効力が低く(IC50〜50 ng / mL)、WT RBDに対する結合親和性が相応に低かった(図1E、1F、およびS1B)。
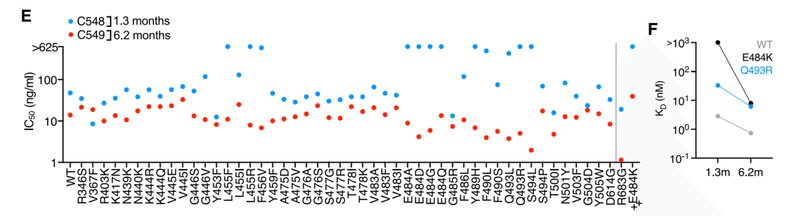
Similar to C144, naturally occurring substitutions at positions L455, F456, E484, Y489, S494, Q493, and S494 caused a near-complete loss of C548 potency (Figure 1E).
C144と同様に、位置L455、F456、E484、Y489、S494、Q493、およびS494で自然に発生する置換により、C548の効力がほぼ完全に失われました(図1E)。
However, C549 potency was unaffected or only marginally affected by most of these mutations (Figure 1E), properties that were reflected in its increased binding affinity for Q493R and E484K RBD (Figure 1F).
ただし、C549の効力は、これらの変異のほとんどによって影響を受けなかったか、わずかな影響しか受けませんでした(図1E)。これらの特性は、Q493RおよびE484K RBDに対する結合親和性の増加に反映されていました(図1F)。
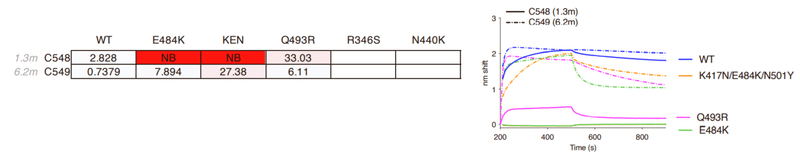
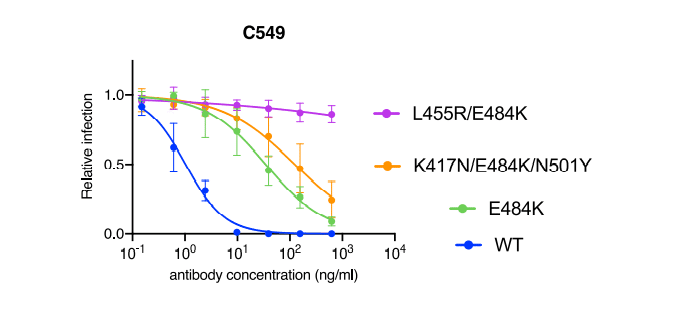
E484K conferred partial (~50- to 100-fold) resistance to C549 (Figure 1G) and reduced binding affinity (~10-fold) compared to WT.
E484Kは、WTと比較してC549に対して部分的(約50〜100倍)の耐性を付与し(図1G)、結合親和性を低下させました(約10倍)。
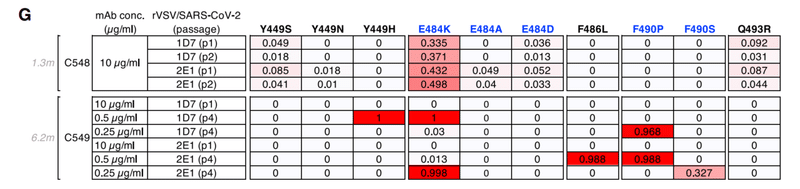
Selection experiments with C548 and rVSV/SARS-CoV-2 led to rapid enrichment of resistant mutants (E484K and Q493R; Figures 1G and 1H), consistent with the finding that E484K or Q493R substitutions conferred C548 resistance in the HIV-1 pseudotype assay (Figures 1E and S3A).
C548とrVSV / SARS-CoV-2を使用した選択実験により、耐性変異体(E484KとQ493R、図1Gと1H)が急速に濃縮されました。E484KまたはQ493R置換が、HIV-1疑似型アッセイでC548耐性を付与したという発見と一致しています(図1EおよびS3A)。
In contrast, initial attempts to select C549-resistant rVSV/SARS-CoV-2 mutants failed (Figure 1G).
対照的に、C549耐性rVSV / SARS-CoV-2変異体を選択する最初の試みは失敗しました(図1G)。
However, by reducing the selecting concentration of C549 and sequential passaging with antibody 4 times, we obtained rVSV/SARS-CoV-2 populations in which Y449H, E484K, F486L, and F490P/S mutations were enriched (Figure 1G).
ただし、C549の選択濃度を下げ、抗体で4回連続継代することにより、Y449H、E484K、F486L、およびF490P / S変異が濃縮されたrVSV / SARS-CoV-2集団が得られました(図1G)。
Notably, these selected populations yielded only isolates that encoded 2 RBD substitutions; one Y449H/E484K and the other F486L/F490P.
特に、これらの選択された集団は、2つのRBD置換をエンコードした分離株のみを生成しました。 1つはY449H / E484K、もう1つはF486L / F490Pです。
These viruses exhibited greater (1,000-fold) C549 resistance than the E484K single mutant (Figures 1I, S3A, and S3B).
これらのウイルスは、E484K単一変異体よりも高い(1,000倍)C549耐性を示しました(図1I、S3A、およびS3B)。
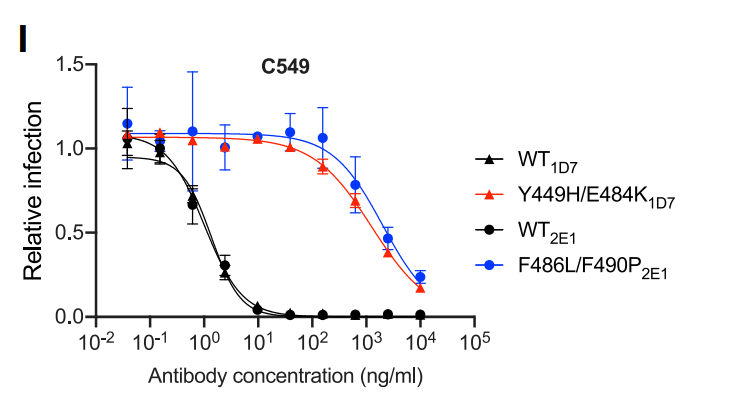
Because individual substitutions at Y449, E484, F486, and F490 caused only partial or no C549 resistance (Figures 1E, 1I, and S3), these data suggest that at least 2 substitutions are required to confer a large diminution in C549 potency.
Y449、E484、F486、およびF490での個々の置換は、C549耐性を部分的にのみ、またはまったく引き起こさなかったため(図1E、1I、およびS3)、これらのデータは、C549の効力を大幅に低下させるには、少なくとも2つの置換が必要であることを示しています。
Thus, for the C548/C549 antibody pair, affinity maturation appeared to heighten the genetic barrier for the acquisition of antibody resistance.
したがって、C548 / C549抗体ペアの場合、親和性成熟は抗体耐性を獲得するための遺伝的障壁を高めるように見えました。
Affinity maturation confers potency and resilience to escape in a class 1 antibody clone
親和性成熟は効果と、クラス1抗体クローンでの脱出に対する回復力を与えます
A fourth group of clonally related antibodies, encoded by VH3- 53/VK3-20 genes, also exhibited a large disparity in activity and breadth when 1.3- and 6.2-month clonal relatives were compared.
VH3- 53 / VK3-20遺伝子によってコードされるクローン関連抗体の4番目のグループもまた、1.3か月と6.2か月のクローンの親戚を比較すると、活動と幅に大きな違いが見られました。
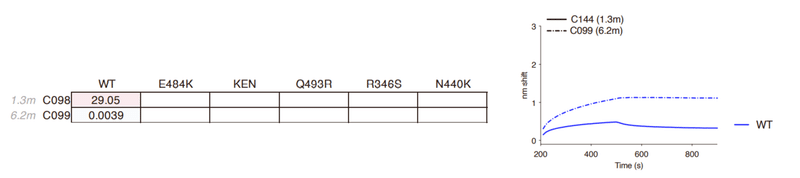
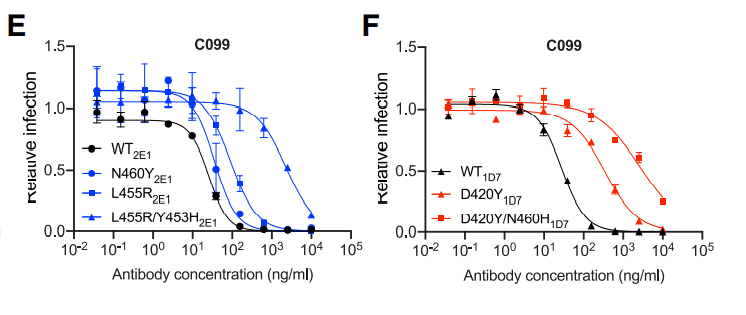
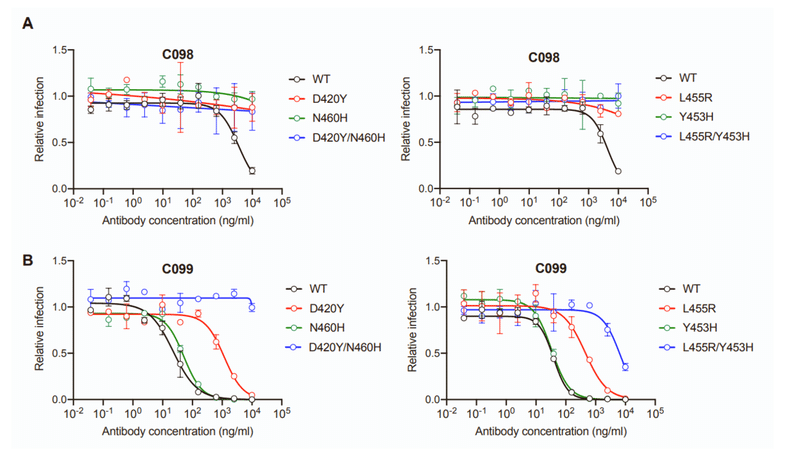
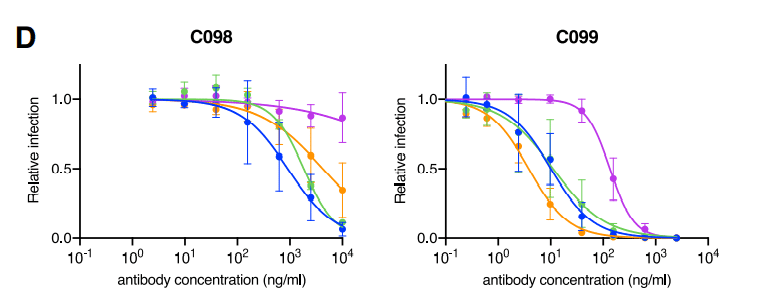
Specifically, C098, isolated at 1.3 months, displayed minimal activity (IC50 > 1,000 ng/mL) against most SARS-CoV-2 pseudotypes while a clonal relative isolated at 6.2 months, C099, had IC50 values ranging from ~15 to 48 ng/mL for all of the variants except L455R, for which the IC50 was increased to 123 ng/mL (Figures 2A and 2B).
具体的には、1.3か月で分離されたC098は、ほとんどのSARS-CoV-2偽型に対して最小限の活性(IC50> 1,000 ng / mL)を示しました。一方、6.2か月で分離されたクローンの親族であるC099のIC50値はL455R(IC50が123ng / mLに増加)を除くすべてのバリアントで約15〜48 ng / mLの範囲でした(図2Aおよび2B)。
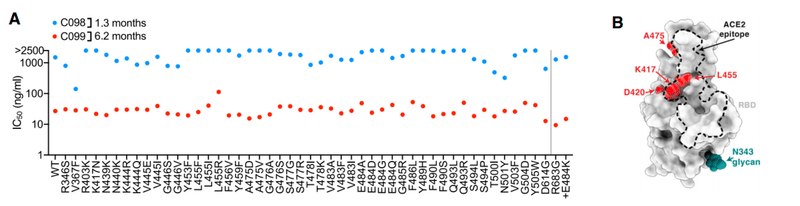
C099 also exhibited greatly increased binding affinity for WT RBD when compared to C098 (Figure S1B).
C099は、C098と比較した場合、WT RBDに対する結合親和性も大幅に向上しました(図S1B)。
In rVSV/SARS-CoV-2 selection experiments, the low potency of C098 was reflected in the modest enrichment of mutations.
rVSV / SARS-CoV-2選択実験では、C098の効力が低いことが、変異の適度な濃縮に反映されていました。
Nevertheless, there was some enrichment of N460 substitutions (Figures 2B and 2C), and after 2 passages, the rVSV/SARS-CoV-2 (N460Y) mutant was isolated that displayed nearly complete C098 resistance (Figure 2D).
それにもかかわらず、N460置換がいくらか濃縮され(図2Bおよび2C)、2継代後、ほぼ完全なC098耐性を示すrVSV / SARS-CoV-2(N460Y)変異体が分離されました(図2D)。
Initial attempts to isolate C099-resistant rVSV/SARS-CoV-2 mutants failed.
C099耐性rVSV / SARS-CoV-2変異体を分離する最初の試みは失敗しました。
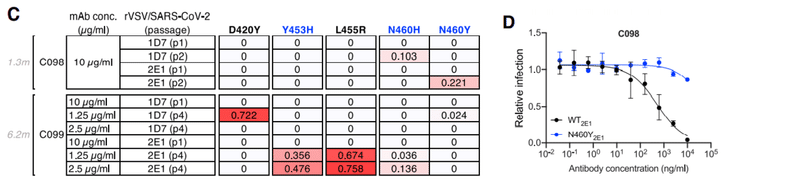
However, passaging rVSV/SARS-CoV-2 4 times in the presence of reduced concentrations of C099 yielded populations enriched most prominently in D420Y, Y453H, and L455R substitutions (Figures 2B and 2C).
ただし、C099の濃度を下げた状態でrVSV / SARS-CoV-2を4回継代すると、D420Y、Y453H、およびL455Rの置換が最も顕著に濃縮された集団が得られました(図2Bおよび2C)。
Plaque purification yielded D420Y, N460Y, or L455R single mutants with partial (%10-fold increase in IC50) C099 resistance (Figures 2B, 2E, and 2F) as well as D420Y/N460H and L455R/Y453H double mutants with a higher degree of C099 neutralization resistance (~100-fold increase in IC50; Figures 2E and 2F).
プラーク精製により、部分的(IC50の10倍の増加)C099耐性を持つD420Y、N460Y、またはL455R単一変異体と(図2B、2E、および2F)、より高度なC099中和耐性を持つD420Y / N460HおよびL455R / Y453H二重変異体が得られました(IC50の約100倍の増加、図2Eおよび2F)。
Analysis of HIV-1 pseudotypes with these mutations confirmed that D420Y, N460H, L455R, and Y453H alone each abolished the weak C098 neutralization activity but conferred no or partial C099 resistance Figures S4A and S4B.
これらの変異を伴うHIV-1シュードタイプの分析によって、D420Y、N460H、L455R、およびY453Hはそれぞれ単独で、弱いC098中和活性を無効にしましたが、C099耐性をまったくまたは部分的に与えないということが確認されました(図S4AおよびS4B)。
However, the D420Y/N460H or L455R/Y453H combinations conferred greater C099 resistance (Figure S4B).
ただし、D420Y / N460HまたはL455R / Y453Hの組み合わせは、より大きなC099抵抗をもたらしました(図S4B)。
Overall, affinity maturation of C098/99 conferred both greatly increased potency and appeared to impose a requirement for R2 mutations for large reductions in antibody-neutralizing activity.
全体として、C098 / 99の親和性成熟は、効力の大幅な増加と、抗体中和活性の大幅な低下のためのR2変異の要件の両方をもたらしたようです。
Class 3 antibody maturation confers potency and activity against 1.3-month antibody-resistant mutants
クラス3の抗体成熟は、1.3か月の抗体耐性変異体に対して効力と活性をもたらします
We next analyzed 2 pairs of class 3 antibodies, which do not directly compete for ACE2 binding to the SARS-CoV-2 RBD, yet exhibit potent neutralizing activity.
次に、SARS-CoV-2 RBDへのACE2結合と直接競合しないが、強力な中和活性を示す2対のクラス3抗体を分析しました。
Some antibodies in this class, while having very low IC50 values, also exhibit incomplete neutralization in pseudotype assays—in other words, a ‘‘non-neutralizable’’ fraction exists for class 3 antibodies.
このクラスの一部の抗体は、IC50値が非常に低いものの、疑似型アッセイでは中和が不完全です。—つまり、クラス3抗体には「中和不可能」な画分が存在します。
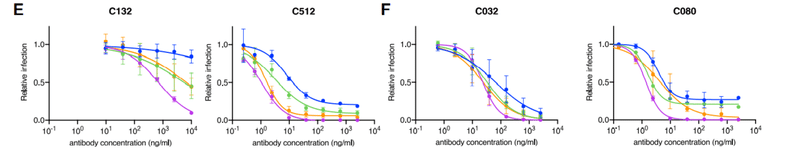
The VH4-4/VL2-14 encoded C132 antibody (Figure S1A), isolated at 1.3 months, had low numbers of somatic mutations (Table S1) and weak neutralizing activity against the Spike variants in the HIV-1 pseudotype assay (Figure 3A).
1.3ヶ月で分離されたVH4-4 / VL2-14でコードされたC132抗体(図S1A)は、体細胞変異の数が少なかった(表S1)。また、HIV-1疑似型アッセイでスパイクバリアントに対して弱い中和活性を示しました(図3A)。

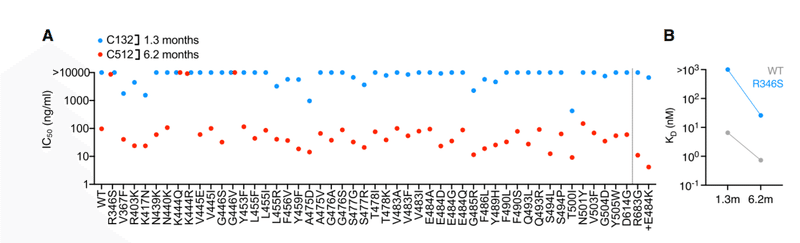
Conversely, its 6.2-month clonal derivative, C512, had a higher degree of SHM (Table S1) displayed potency in neutralization assays (IC50 ~100 ng/mL; Figure 3A) and had increased affinity for both WT and R346S mutant RBD proteins (Figure 3B).
逆に、その6.2か月のクローン誘導体であるC512は、中和アッセイでより高い程度のSHM(表S1)を示しました(IC50〜100 ng / mL;図3A)。また、WTおよびR346S変異RBDタンパク質の両方に対する親和性が増加しました(図3B)。
Substitutions at R346, K444, or G446 each conferred C512 resistance (Figures 3A and 3C).
R346、K444、またはG446での置換は、それぞれC512耐性を付与しました(図3Aおよび3C)。
Despite its poor potency, rVSV/SARS-2/EGFP replication with C132 generated viral populations enriched for R346 substitutions and a plaque-purified rVSV/SARS-2/EGFP (R346K) mutant that was resistant to the weak activity of C132 (Figures 3C–3E).
効力は低いものの、C132を使用したrVSV / SARS-2 / EGFP複製により、R346置換が豊富なウイルス集団と、C132の弱い活性に耐性のあるプラーク精製rVSV / SARS-2 / EGFP(R346K)変異体が生成されました(図3C–3E)。
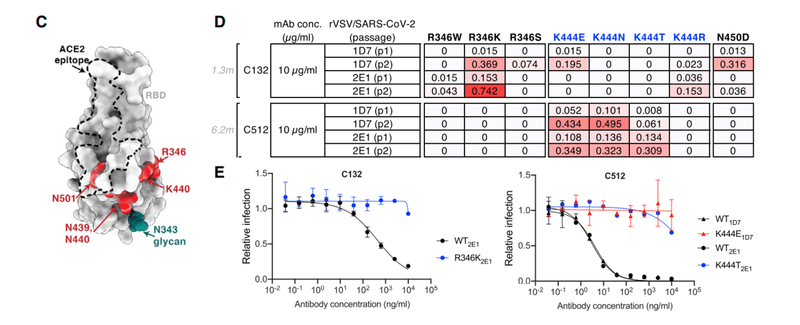
In contrast, and despite the fact that R346, K444, and G446 substitutions conferred resistance in the HIV-1 assay, C512 selected resistant rVSV/SARS-2/EGFP variants with K444 substitutions only (Figures 3D and 3E).
対照的に、R346、K444、およびG446の置換が、HIV-1アッセイで耐性を付与したという事実にもかかわらず、C512は、K444置換のみの耐性rVSV / SARS-2 / EGFPバリアントを選択しました(図3Dおよび3E)。
Thus, maturation of the C132/C512 antibody yielded a marked increase in potency and a concurrent change in the selected resistance mutations.
したがって、C132 / C512抗体の成熟により、効力が著しく増加し、同時に選択した耐性変異が変化しました。
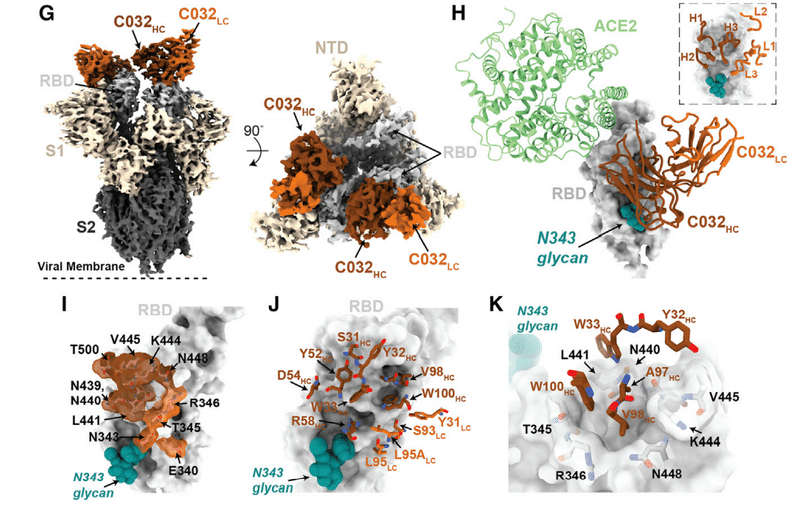
For a second clonally related pair of class 3 antibodies, encoded by VH5-51/VL1-40 (Figure S1A; Table S1), the antibody isolated at 1.3 months (C032) was only ~2-fold less potent than a derivative isolated at 6.2 months (C080).
VH5-51 / VL1-40によってコードされるクラス3抗体の2番目のクローン関連ペア(図S1A;表S1)の場合、1.3か月で分離された抗体(C032)は、6.2か月で分離された誘導体(C080)よりもわずか約2分の1の効力しかありませんでした。

However, binding affinity for WT, as well as R346S and N440K mutant RBD, was markedly increased in C080 compared to C032 and, notably, mutations at positions R346, N439, N440, K444, V445, and G446 conferred resistance to C032, but not to C080 (Figures 3F and 3G).
ただし、WT、R346SおよびN440K変異体RBDに対する結合親和性は、結合親和性はC032と比較してC080で著しく増加し、特に、位置R346、N439、N440、K444、V445、およびG446での変異は、C080ではなくC032に対する耐性を付与しました(図3Fおよび3G)。
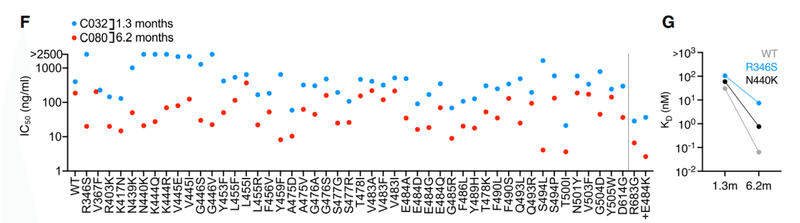
Like some other class 3 antibodies, C032 and C080 exhibited incomplete neutralization, complicating the selection of rVSV/SARS-CoV-2-resistant variants (Figure 3H).
他のいくつかのクラス3抗体と同様に、C032およびC080は不完全な中和を示し、rVSV / SARS-CoV-2耐性変異体の選択を複雑にしました(図3H)。
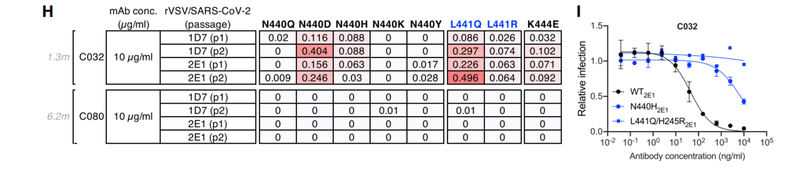
Nevertheless, rVSV/SARS-CoV-2 selection with C032 enriched N440 and L441 substitutions, both of which conferred C032 resistance (Figure 3I).
それにもかかわらず、C032に富んだN440およびL441置換を伴うrVSV / SARS-CoV-2の選択は、どちらもC032耐性をもたらしました(図3I)。
Under identical rVSV/SARS-CoV-2 selection conditions, no mutations were enriched in the presence of C080.
同一のrVSV / SARS-CoV-2選択条件下では、C080の存在下で変異は濃縮されませんでした。
Therefore, a key property acquired by the affinity matured antibody, C080, was retention of activity against viral mutants that escaped neutralization by its C032 progenitor.
したがって、アフィニティー成熟抗体C080によって獲得された重要な特性は、C032前駆体による中和を回避したウイルス変異体に対する活性の保持でした。
Affinity matured antibodies exhibit activity against SARS-CoV-2 VOC
アフィニティー成熟抗体は、SARS-CoV-2VOCに対して活性を示します
Selection for rVSV/SARS-CoV-2 resistance to class 1, 2, and 3 antibodies in cell culture has repeatedly identified K417, E484, and N501 substitutions, with E484K giving the most pervasive effects against polyclonal plasma.
細胞培養におけるクラス1、2、および3抗体に対するrVSV / SARS-CoV-2耐性の選択により、K417、E484、およびN501の置換が繰り返し特定され、E484Kがポリクローナル血漿に対して最も広範な効果を示しています。
We compared the ability of the antibodies studied herein to neutralize pseudotypes with a E484K substitution alone, or in combination with K417N and N501Y substitutions that naturally occur in the VOC (B1.351) that exhibits the greatest degree of neutralization resistance, or in combination with L455R, a mutation that reduced neutralization by multiple class 1 and class 2 antibodies (Figures 1 and 2).
ここで研究した抗体が、E484K置換のみで偽型を中和する能力を比較しました。または、最高度の中和耐性を示すVOC(B.1.351)で自然に発生するK417NおよびN501Y置換を組み合わせました。また、複数のクラス1およびクラス2抗体による中和を減少させる変異であるL455Rを組み合わせました(図1および2)。
The activities of all class 2 antibodies were diminished by the E484K substitution and the K417N/E484K/N501Y combination (Figures 4A–4C).
すべてのクラス2抗体の活性は、E484K置換とK417N / E484K / N501Yの組み合わせによって低下しました(図4A–4C)。
Nevertheless, while none of the antibodies in the C144/C051/C052 group show detectable affinity for and activity against E484K mutant (Figures 4A and S1B), the 6.2-month class 2 antibodies C055 and C549 exhibited increased affinity for and activity against E484K compared to their 1.3-month clonal relatives (Figures 4B, 4C, and S1B).
それでも、C144 / C051 / C052グループの抗体はいずれも、E484K変異体に対して検出可能な親和性と活性を示しませんが(図4AおよびS1B)、6.2か月のクラス2抗体C055およびC549は、1.3か月のクローンの親類と比較して、E484Kに対する親和性と活性の増加を示しました(図4B、4C、およびS1B)。
In the case of C549, activity and affinity were modestly reduced further by the K417N/E484K/N501Y combination compared to E484K alone and abolished by the L455R/E484K combination (Figures 4C and S1B), consistent with the notion that 2 substitutions were required to confer maximal C549 escape (Figures 2E, 2F, and S3).
C549の場合、K417N / E484K / N501Yの組み合わせにより、E484K単独と比較して、活性と親和性がさらにわずかに低下し、L455R / E484Kの組み合わせによって失効しました(図4CおよびS1B)。最大のC549エスケープを与えるには、2つの置換が必要であるという考えと一致しています(図2E、2F、およびS3)。
The C098/C099 class 1 antibodies were unaffected by the E484K mutation or the K417N/E484K/N501Y combination (Figure 4D).
C098 / C099クラス1抗体は、E484K変異またはK417N / E484K / N501Yの組み合わせの影響を受けませんでした(図4D)。
The partial loss of potency against the L455R/E484K combination was consistent with that seen for the L455R single mutant (Figure S4B).
L455R / E484Kの組み合わせに対する効力の部分的な喪失は、L455R単一変異体で見られたものと一致していました(図S4B)。
As expected, K417/E484K/N501Y and L455R/E484K mutations did not confer resistance to the class 3 antibodies (Figures 4E and 4F).
予想通り、K417 / E484K / N501YおよびL455R / E484K変異は、クラス3抗体に対する耐性を付与しませんでした(図4Eおよび4F)。
In fact, unexpectedly, these mutations sensitized the pseudotypes to some class 3 antibodies.
実際、予期せぬことに、これらの変異は一部のクラス3抗体に対してシュードタイプを感作しました。
Thus, the E484K substitution generally undermined the activity of class 2 antibodies, but RBD substitutions found in the B1.351 VOC did not affect the activity of the matured class 1 and class 3 antibodies tested herein.
したがって、E484K置換は通常、クラス2抗体の活性を損ないますが、B1.351 VOCで見つかったRBD置換は、ここでテストした成熟したクラス1およびクラス3抗体の活性に影響を与えませんでした。
Maturation of antibodies elicited by SARS-CoV-2 can generate activity against additional sarbecoviruses
SARS-CoV-2によって誘発された抗体の成熟は、追加のサルベコウイルスに対する活性を生み出す可能性があります
We next determined whether any of the antibodies could neutralize more divergent sarbecoviruses.
次に、いずれかの抗体がより多様なサルベコウイルスを中和できるかどうかを判断しました。
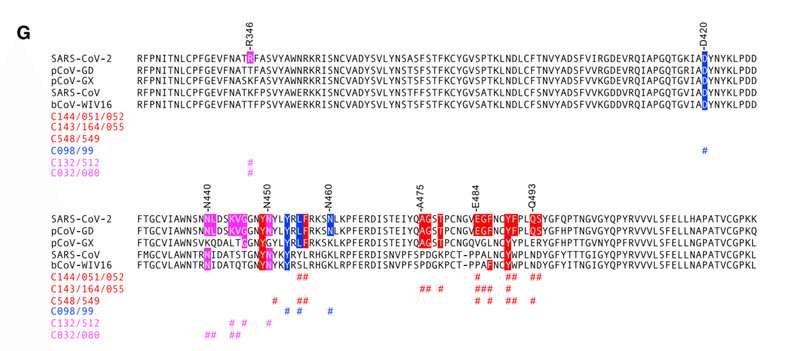
SARS-CoV-2 is closely related to the horseshoe bat (Rinolophus affinis) coronavirus bCoV-RaTG13 (97.4% amino acid identity in Spike) , but the SARS-CoV-2 RBD and within it the receptor binding motif (RBM) diverges from bCoV-RaTG13 (89.3% RBD and 76.4% RBM identity) and is more closely related (97.4% RBD and 98.6% RBM identity) to a pangolin (Manis javanica) coronavirus from Guandong, China (pCoV-GD).
SARS-CoV-2は、キクガシラコウモリ(Rinolophus affinis)コロナウイルスbCoV-RaTG13(スパイクで97.4%のアミノ酸同一性)と密接に関連しています。しかし、SARS-CoV-2 RBDとその中の受容体結合モチーフ(RBM)はbCoV-RaTG13とは異なり(89.3%RBDおよび76.4%RBM同一性)、中国広東省のセンザンコウ(Manis javanica)コロナウイルス(pCoV-GD)とより密接に関連しています(97.4%RBDおよび98.6%RBM同一性)
The RBD of a second pangolin coronavirus found in Guangxi (pCoV-GX) shares 87% RBD and 75% RBM amino acid identity with SARS-CoV-2.
広西チワン族自治区で見つかった2番目のセンザンコウコロナウイルスのRBD(pCoV-GX)は、SARS-CoV-2と87%のRBDおよび75%のRBMアミノ酸同一性を共有しています。
The SARS-CoV Spike protein is more closely related to coronaviruses found in Rinolophus sinicus, including bCoV-WIV16, with which it shares 94.3% RBD amino acid identity.
SARS-CoVスパイクタンパク質は、94.3%のRBDアミノ酸同一性を共有するbCoV-WIV16など、Rinolophussinicus(コウモリの一種)に見られるコロナウイルスとより密接に関連しています。
The SARS-CoV and bat-CoV-WIV16 RBDs share 73%–75.4% identity with the SARS-CoV-2 RBD, but only 50%–52.8% identity in the RBM.
SARS-CoVおよびbat-CoV-WIV16RBDは、SARS-CoV-2 RBDと73%〜75.4%の同一性を共有しますが、RBMでは50%〜52.8%の同一性しか共有しません。
None of the antibodies neutralized bCoV-WIV16 pseudotypes (Figure 5A–5F).
bCoV-WIV16シュードタイプを中和する抗体はありませんでした(図5A–5F)。
In contrast, all of the antibodies except C512 neutralized pCoV-GD pseudotypes.
対照的に、C512を除くすべての抗体は、pCoV-GDシュードタイプを中和しました。
Some matured antibodies isolated at 6.2 months (C055, C549, C099, and C080) neutralized pCoV-GD pseudotypes more potently than their 1.3-month clonal predecessors (Figures 5B–5D, 5F), recapitulating observations with SARS-CoV-2 pseudotypes.
SARS-CoV-2シュードタイプでの観察を要約すると、6.2か月で分離された一部の成熟抗体(C055、C549、C099、およびC080)は、1.3か月のクローンの前身(図5B〜5D、5F)よりも強力にpCoV-GDシュードタイプを中和しました。
In addition, C099, unlike its clonally related predecessor C098, potently neutralized the more distantly related pCoV-GX pseudotype (IC50 = 16 ng/mL; Figure 5D).
さらに、C099は、クローンに関連する前身のC098とは異なり、より遠に関連するpCoV-GX疑似型を強力に中和しました(IC50 = 16 ng / mL、図5D)。
Finally, the 6.2-month class 3 antibody, C080, neutralized SARS-CoV (IC50 = 71 ng/mL).
最後に、6.2か月のクラス3抗体であるC080は、SARS-CoVを中和しました(IC50 = 71 ng / mL)。
A comparison of the aligned SARS-CoV-2, pCoV-GD, pCoV-GX, SARS-CoV, and bCoV-WIV16 sequences revealed that many, but not all, of the resistance mutations selected in vitro coincided with residues that were variable among these sarbecoviruses, consistent with the general lack of sensitivity of the divergent viruses to the 1.3-month antibodies (Figure 5G).
整列したSARS-CoV-2、pCoV-GD、pCoV-GX、SARS-CoV、およびbCoV-WIV16配列の比較は、すべてではありませんが、in vitroで選択された耐性変異の多くが、これらのサルベコウイルス間で変動する残基と一致することを明らかにしました。1.3か月の抗体に対する発散ウイルスの感受性の一般的な欠如と一致しています(図5G)。
Nevertheless 2 of the three 6.2-month antibodies (C099 and C080) that apparently required multiple mutations for resistance, could neutralize viruses with preexisiting divergence in the resistance determinants.
それにもかかわらず、耐性のために複数の変異を必要としたと思われる3つの6.2か月抗体(C099およびC080)のうち2つは、耐性決定因子に既存の相違があるウイルスを中和する可能性があります。
Thus, in some cases, antibody evolution enabled neutralization of heterologous sarbecoviruses.
したがって、場合によっては、抗体の進化により、異種サルベコウイルスの中和が可能になりました。
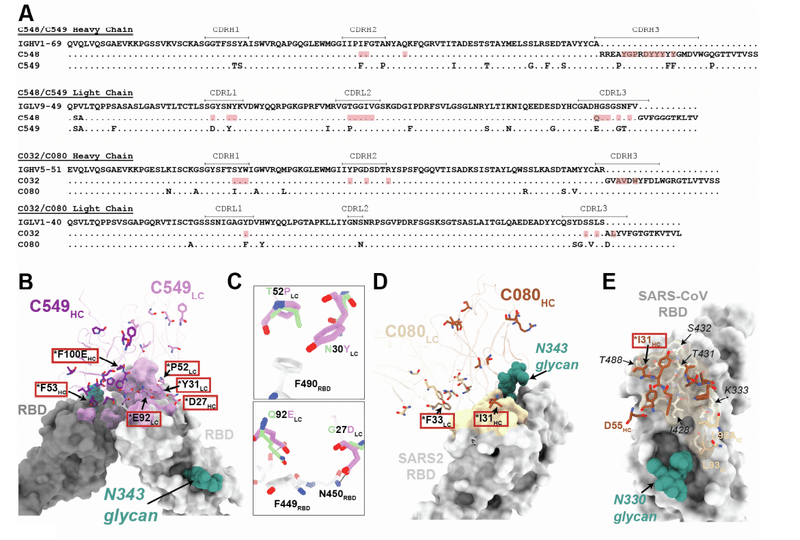
Structural analyses of antibody clonal pairs reveal molecular contacts that improve potency and breadth
抗体クローンペアの構造解析により、効力と幅を改善する分子接触が明らかになります
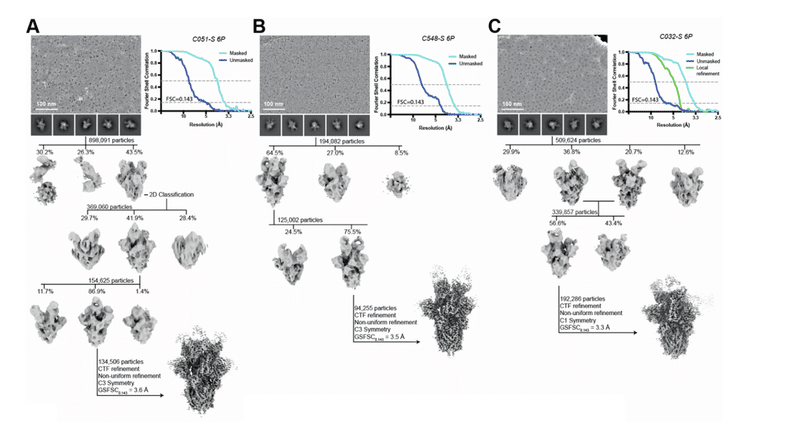
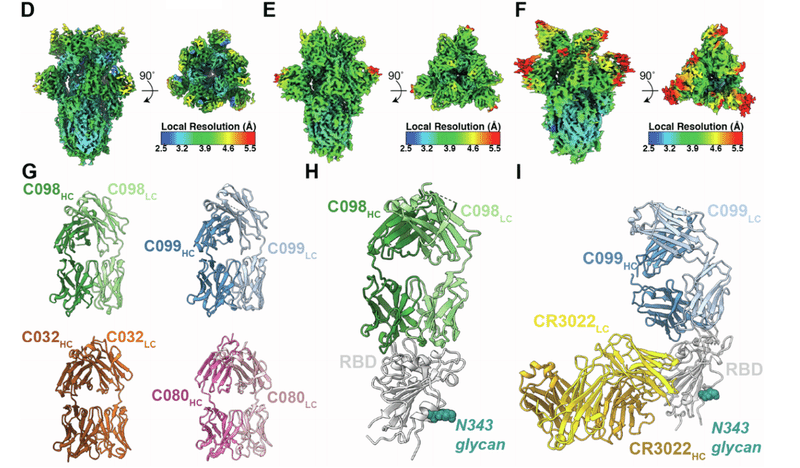
We investigated the effects of somatic mutations on antibody-antigen interactions by solving structures of 1.3- and 6.2-month pairs of class 1 (C098/C099) and class 2 (C144/C051) antibody Fab fragments bound to SARS-CoV-2 Spike trimers or monomeric RBDs.
SARS-CoV-2スパイク三量体または単量体RBDに結合したクラス1(C098 / C099)およびクラス2(C144 / C051)抗体Fabフラグメントの1.3か月および6.2か月のペアの構造を解くことによって、抗体-抗原相互作用に対する体細胞変異の影響を調査しました。
We also determined structures of 1.3-month class 2 (C548) and 1.3-month class 3 (C032) Fabs bound to S, allowing modeling of RBD interactions for their 6.2-month counterparts (C549 and C080, respectively) (Figures S5A–S5I; Tables S2 and S3).
また、Sにバインドされた1.3か月のクラス2(C548)および1.3か月のクラス3(C032)Fabの構造を決定し、6.2か月の対応するもののRBD相互作用のモデリングを可能にしました(それぞれC549とC080)(図S5A〜S5I、表S2とS3)。
Across these structures, most of the substitutions found at 6.2 months post-infection occurred in complementarity-determining region (CDR) loops, in or adjacent to antibody paratopes (Figures 6A–6J, 7A–7K, S6A–S6H, and S7A–S7E).
これらの構造全体で、感染後6.2か月で見つかった置換のほとんどは、抗体パラトープ内または隣接する相補性決定領域(CDR)ループで発生しました(図6A–6J、7A–7K、S6A–S6H、およびS7A–S7E)
To derive global properties of Fab-antigen interactions, we calculated shape complementarity (Sc) indices, which vary from 0 (not complementary) to 1 (a perfect fit) and are typically 0.64–0.68 for antibody-antigen interfaces.
Fab-抗原相互作用のグローバルプロパティを導出するために、形状相補性(Sc)インデックスを計算しました。これは0(補完的ではない)から1(完全に適合する)まで変化し、通常、抗体と抗原のインターフェースでは0.64〜0.68です。
For antibody pairs for which we had determined both 1.3- and 6.2-month structures, Sc values for 6.2-month antibodies were modestly increased compared with their 1.3-month counterparts: 0.56 versus 0.52 for C051 and C144 complexes with Spike, respectively (Sc values calculated for a Fab complexed with 2 adjacent RBDs), and 0.73 and 0.68 for C099 and C098 Fab complexes with RBD, respectively.
1.3か月と6.2か月の両方の構造を決定した抗体ペアの場合、6.2か月の抗体のSc値は、1.3か月の抗体と比較してわずかに増加しました:スパイクを含むC051およびC144複合体の場合はそれぞれ0.56対0.52(2つの隣接するRBDとの複合体のFabについて計算されたSc値)、RBDを含むC099およびC098Fab複合体の場合はそれぞれ0.73および0.68。
Similarly, buried surface area (BSA) calculations did not reveal large increases in Fab-antigen interface areas upon antibody maturation: total BSAs for C051 and C144 interfaces were ~2,520 and ~2,350 A˚ ², respectively, and ~2,540 and ~2,590 A˚ ² for C099 and C098, respectively.
同様に、埋没表面積(BSA)の計算では、抗体の成熟時にFab-抗原の界面面積が大幅に増加することは明らかになりませんでした:C051インターフェースとC144インターフェースの合計BSAは、それぞれ〜2,520と〜2,350A˚²であり、C099とC098ではそれぞれ〜2,540と〜2,590A˚²でした。
To understand the influence of individual mutations on potency and viral escape, we aligned RBD-bound Fab complexes from clonally related 1.3- and 6.2-month antibodies and inspected individual residue antibody-antigen interactions (Figures 6 and S6).
個々の変異が効力とウイルスの逃避に及ぼす影響を理解するために、クローンに関連する1.3か月と6.2か月の抗体からRBDに結合したFab複合体を整列させ、個々の残基の抗体と抗原の相互作用を調べました(図6とS6)。
For the class 1 C098/C099 pair, we compared 2.0- and 2.6-A˚ X-ray structures of the C098-RBD and C099-CR3022-RBD complexes, respectively (Figures S5H and S5I; Table S2).
クラス1のC098 / C099ペアについて、C098-RBDおよびC099-CR3022-RBD複合体の2.0Åおよび2.6ÅのX線構造をそれぞれ比較しました(図S5HおよびS5I、表S2)。
After superimposing the RBDs, the Fab VH-VL domains adopted the same binding pose such that the CDR loops at the Fab-RBD interface were aligned equivalently (Figures 6A and 6B).
RBDを重ね合わせた後、Fab VH-VLドメインは同じバインディングポーズを採用し、Fab-RBDインターフェースのCDRループが同等に配置されました(図6Aおよび6B)。
Overall, the footprints of the epitope on the RBD and the paratope on the Fab were conserved (Figures S6A–S6C), which is consistent with the highly similar binding orientations of class 1 anti-RBD neutralizing antibodies (Figures S6D and S6E).
全体として、RBDのエピトープとFabのパラトープのフットプリントは保存されていました(図S6A〜S6C)。これは、クラス1抗RBD中和抗体の非常に類似した結合方向と一致しています(図S6DおよびS6E)。
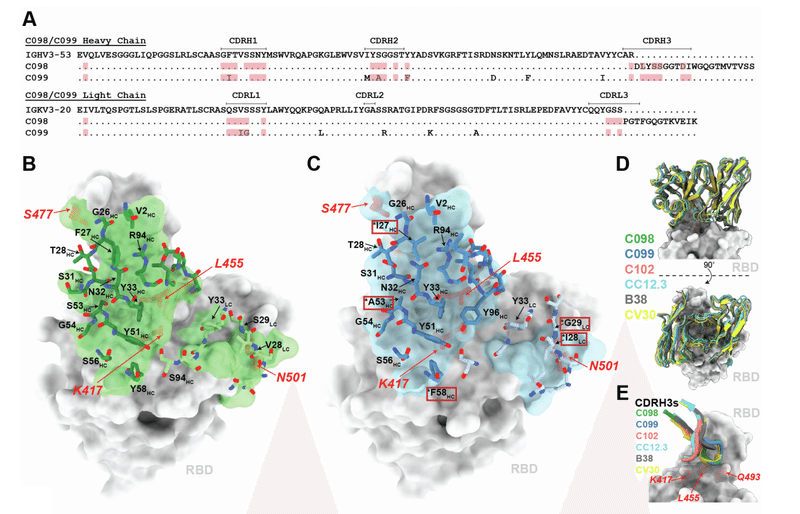
For C098 and C099, the majority of RBD contacts are mediated by CDR1 and CDR2 V gene-encoded regions (Figures S6A–S6C).
C098およびC099の場合、RBDの連絡先の大部分は、CDR1およびCDR2 V遺伝子にコードされた領域によって媒介されます(図S6A〜S6C)。
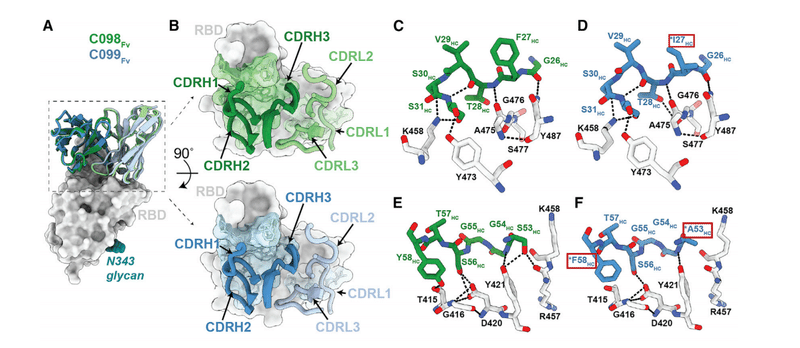
Given that the C098 VH and VL gene segment sequences contained no somatic hypermutations (Figure S6A), our structures provided the opportunity to analyze the effects of affinity maturation on the increased potency of the 6.2-month C099 antibody.
C098 VHおよびVL遺伝子セグメント配列に体細胞超変異が含まれていないことを考えると(図S6A)、私たちの構造は、6.2か月のC099抗体の効力の増加に対する親和性成熟の影響を分析する機会を提供しました。
Somatic mutations in C099 occurred in V geneencoded CDR loops and framework regions (FWRs), while the CDR3 loops remained unchanged from the germline (C098) antibody (Figures S6A and S6E).
C099の体細胞変異は、V遺伝子コード化CDRループおよびフレームワーク領域(FWR)で発生しました。一方、CDR3ループは生殖細胞系列(C098)抗体から変更されていません(図S6AおよびS6E)。
As previously noted for class 1 anti-RBD neutralizing antibodies, somatic mutations in the CDRH1 and CDRH2 of C099 appeared to drive improved binding and neutralizing characteristics.
クラス1抗RBD中和抗体について前述したように、C099のCDRH1およびCDRH2の体細胞変異は、結合および中和特性の改善を促進するように見えました。
For example, the F27IHC mutation found in C099 introduces a smaller hydrophobic residue that likely makes the CDRH1 loop more flexible, facilitating increased polar contacts and van der Waals interactions in this region (Figures 6C and 6D).
たとえば、C099で見つかったF27IHC変異は、より小さな疎水性残基を導入し、CDRH1ループをより柔軟にする可能性があります。この領域での極性接触とファンデルワールス相互作用の増加を促進します(図6Cおよび6D)。
In CDRH2, somatic mutations S53AHC and Y58FHC remove polar contacts with backbone carbonyl and side chain atoms at the RBD interface (Figures 6E and 6F).
CDRH2では、体細胞変異S53AHCおよびY58FHCにより、RBDインターフェースでのバックボーンカルボニルおよび側鎖原子との極性接触が除去されます(図6Eおよび6F)。
However, these mutations (particularly Y58FHC) increase binding affinity and neutralizing activity of class 1 anti-RBD antibodies, which can be partly explained by the introduction of stacking interactions with RBD residue T415 (Figure 6F).
ただし、これらの変異(特にY58FHC)は、クラス1抗RBD抗体の結合親和性と中和活性を高めます。これは、RBD残基T415とのスタッキング相互作用の導入によって部分的に説明できます(図6F)。
Thus, we conclude that a set of common somatic mutations found in C099 facilitates its improved neutralization potency.
したがって、C099に見られる一連の一般的な体細胞変異は、中和能の改善を促進すると結論付けます。
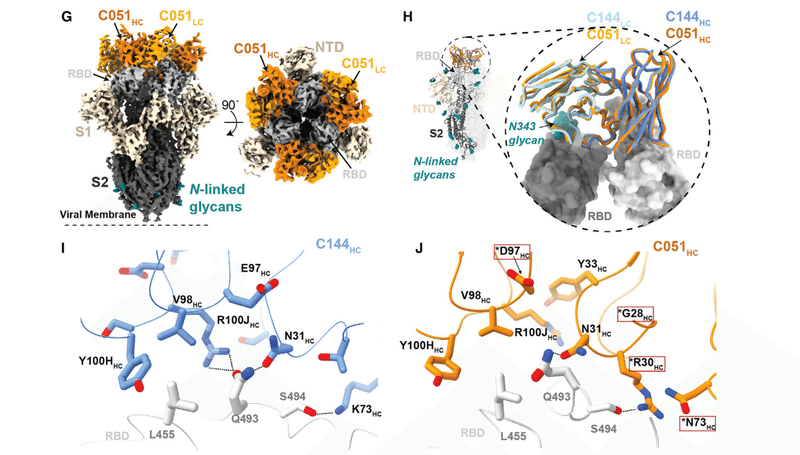
For the class 2 C144/C051 antibodies, we compared our previously reported 3.2-A˚ cryoelectron microscopy (cryo-EM) structure of a C144 Fab-S complex with the 3.5-A˚ C051-S structure reported here (Figure 6G).
クラス2C144 / C051抗体について、以前に報告されたC144 Fab-S複合体の3.2A°極低温電子顕微鏡(cryo-EM)構造を、ここで報告された3.5A°C051-S構造と比較しました(図6G)。
The C144 and C051 Fabs associate with the RBD through a similar binding mode to bridge adjacent RBDs on the surface of the S trimer (Figure 6H).
C144およびC051Fabは、同様のバインディングモードを介してRBDに関連付けられ、Sトリマーの表面上の隣接するRBDをブリッジします(図6H)。
As with C144, the C051 antibody heavy chain mediated the majority of RBD contacts (Figures S6F–S6H).
C144と同様に、C051抗体重鎖はRBD接触の大部分を媒介しました(図S6F–S6H)。
Mutations at RBD positions L455, F456, E484, and Q493 conferred escape from C144, while only the E484K mutation conferred escape from C051 (Figure 1A).
RBD位置L455、F456、E484、およびQ493での変異は、C144からの脱出をもたらしましたが、E484K変異のみがC051からの脱出をもたらしました(図1A)。
Viral escape at RBD positions L455 and Q493 is facilitated by an arginine substitution that would disrupt hydrogen-bonding networks at the C144-RBD interface (Figure 6I).
RBD位置L455およびQ493でのウイルスの脱出は、C144-RBDインターフェースでの水素結合ネットワークを破壊するアルギニン置換によって促進されます(図6I)。
Somatic mutations in the C051 CDRH1 (T28GHC and S30RHC) introduce addtional polar contacts with backbone carbonyl and side chain residues at the RBD interface, while allowing additional flexibility in CDRH1 (Figure 6J), similar to observations for class 1 antibodies (Figure 6D).
C051 CDH1(T28GHCおよびS30RHC)の体細胞変異は、RBDインターフェースでバックボーンのカルボニルおよび側鎖残基との追加の極性接触を導入します。クラス1抗体の観察結果(図6D)と同様に、CDRH1(図6J)の柔軟性を高めます。
In addition, the CDRH3 E97DHC somatic mutation in C051 introduces a smaller charged residue that may better accommodate an arginine side chain in this region (Figure 6J).
さらに、C051のCDRH3 E97DHC体細胞変異は、この領域のアルギニン側鎖によりよく適応する可能性のある、より小さな荷電残基を導入します(図6J)。
Somatic hypermutations in CDRH1 for this antibody group likely play an important role, as the clonally related C054 antibody isolated at 6.2 months is sensitive to the Q493R and L455R mutations.
この抗体グループのCDRH1の体細胞超変異は、6.2か月で分離されたクローン関連のC054抗体が、Q493RおよびL455R変異に感受性があるため、重要な役割を果たす可能性があります。
Structures of Spike trimer complexes with 1.3-month class 2 and class 3 antibodies explain viral escape
1.3か月のクラス2およびクラス3抗体を含むスパイク三量体複合体の構造がウイルスの逃避を説明する
To further understand the escape patterns of RBD-targeting antibodies, we determined cryo-EM structures of Fab-S complexes for 1.3-month class 2 (C548) and class 3 (C032) neutralizing antibodies (Figures 7 and S5) and derived homology models of the 6.2-month counterparts: C549 and C080, respectively (Figure S7).
RBDターゲティング抗体のエスケープパターンをさらに理解するために、1.3か月のクラス2(C548)およびクラス3(C032)中和抗体(図7およびS5)のFab-S複合体の低温電子顕微鏡構造を決定し、6.2か月の対応物(それぞれC549およびC080)のホモロジーモデルを導出しました(図S7)。
In both experimentally determined structures, Fabs recognized either up or down RBD conformations (Figure 7).
実験的に決定された両方の構造で、Fabは上または下のRBDコンフォメーションを認識しました(図7)。
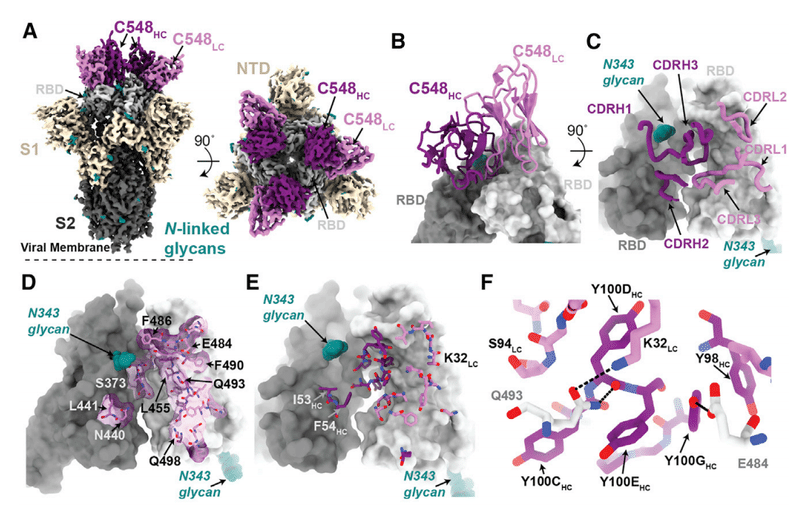
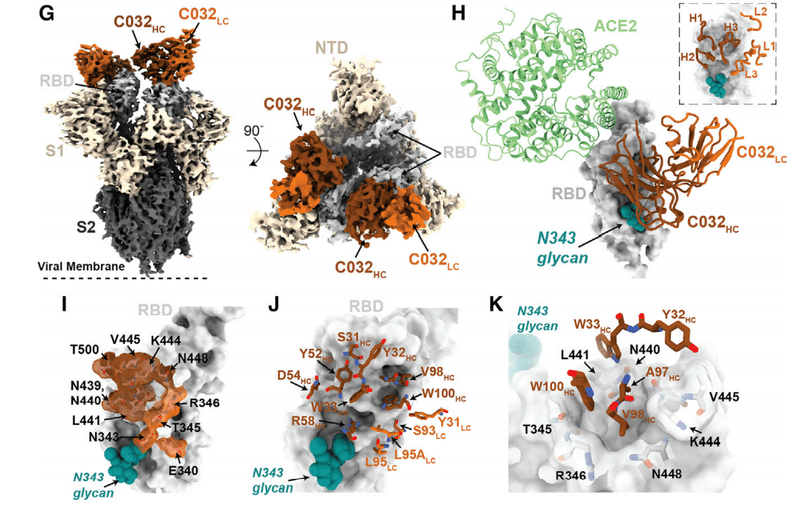
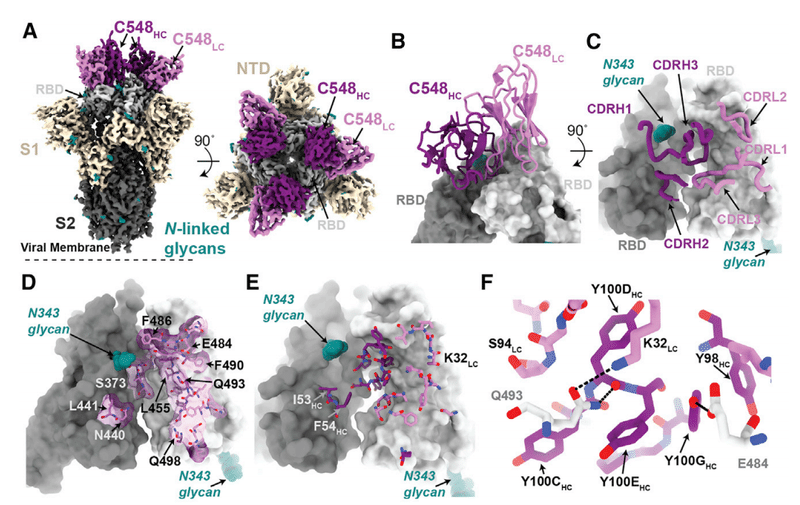
The 3.4-A˚ cryo-EM structure of C548 Fabs bound to a closed S trimer (Figure 7A) revealed a quaternary epitope that spanned neighboring RBDs (Figures 7B and 7C).
閉じたSトリマーに結合したC548Fabの3.4A°クライオEM構造(図7A)は、隣接するRBDにまたがる4次エピトープを明らかにしました(図7Bおよび7C)。
The antibody paratope involved 5 of 6 CDR loops, with the majority of contacts to RBD focused on residues involved in ACE2 recognition (Figures 7D and S7).
抗体パラトープは6つのCDRループのうち5つを含み、RBDへの接触の大部分はACE2認識に関与する残基に焦点を合わせていました(図7DおよびS7)。
C548 is encoded by the VH1-69 VH gene segment, which encodes a hydrophobic sequence at the tip of CDRH2 that has been shown to facilitate broad neutralization against influenza, hepatitis C, and HIV-1.
C548は、VH1-69 VH遺伝子セグメントによってコード化されます。これは、インフルエンザ、C型肝炎、およびHIV-1に対する広範な中和を促進することが示されているCDRH2の先端の疎水性配列をコード化します。
In C548, residues I53-F54HC target a hydrophobic patch in the neighboring RBD core that resides near the base of the N343-glycan and comprises RBD residues W436, N440, and L441 (Figures 7D and 7E).
C548では、残基I53-F54HCは、N343-グリカンの塩基近くにあり、RBD残基W436、N440、およびL441を含む隣接するRBDコアの疎水性パッチをターゲットとしています(図7Dおよび7E)。
These interactions are akin to those observed in the C144/C051 pair, in which either Phe-Trp or Leu-Trp at the tip of CDRH3 is buried in a similar manner on the adjacent RBD (Figures S6G and S6H).
これらの相互作用は、C144 / C051ペアで観察されたものと類似しており、CDRH3の先端にあるPhe-TrpまたはLeu-Trpのいずれかが、隣接するRBDに同様の方法で埋め込まれています(図S6GおよびS6H)。
These data demonstrate the convergent evolution of mechanisms for anti-RBD antibodies to target this hydrophobic patch on the RBD surface, with the potential to lock RBDs into the down position.
これらのデータは、RBDを下の位置に固定する可能性がある、RBD表面上のこの疎水性パッチを標的とする抗RBD抗体のメカニズムの収斂進化を示しています。
Viral escape from C548 was mediated by substitutions at positions L455, E484, F490, and Q493, likely due to the disruption of polar contacts at the RBD interface and/or insertion of bulky side chains into a sterically restricted region (Figure 7F).
C548からのウイルスの逃避は、位置L455、E484、F490、およびQ493での置換によって媒介されました。これは、RBDインターフェースでの極性接触の破壊、および/または立体的に制限された領域へのかさばる側鎖の挿入が原因である可能性があります(図7F)。
However, unlike the C144/C051 antibodies, C549 (the 6.2-month mature counterpart) maintained activity against all of the C548 viral escape mutants, including partial activity against the E484K mutant (Figure 1D).
ただし、C144 / C051抗体とは異なり、C549(6.2か月の成熟抗体)は、E484K変異体に対する部分的な活性を含む、すべてのC548ウイルス回避変異体に対する活性を維持しました(図1D)。
C549 exhibits accumulated somatic mutations (9 HC residues and 11 LC residues changed compared to germline) in both FWR and CDR loops (Figure S7A).
C549は、FWRループとCDRループの両方で蓄積された体細胞変異(生殖細胞系列と比較して9つのHC残基と11のLC残基が変化)を示します(図S7A)。
Using the C548-S structure, we made a homology model of the C549-RBD interactions (Figure S7B).
C548-S構造を使用して、C549-RBD相互作用のホモロジーモデルを作成しました(図S7B)。
Light chain somatic mutations are predicted to explain the increased resistance:
軽鎖の体細胞変異は、耐性の増加を説明すると予測されています。
30YLC stacks against residue F490 of the RBB, while 27DLC and 92ELC increase polar contacts with the side chain N450 and backbone of F449 of RBD, respectively. (Figure S7C).
30YLCはRBBの残基F490に対してスタックしますが、27DLCと92ELCは、それぞれRBDのF449の側鎖N450とバックボーンとの極性接触を増加させます。 (図S7C)。
While a number of potential positions are possible, we predict that thepartial retention of C549 activity against the E484K mutant likely results from a combination of increased polar and hydrophobic interactions.
いくつかの潜在的な位置が考えられますが、E484K変異体に対するC549活性の部分的な保持は、極性と疎水性の相互作用の増加の組み合わせに起因する可能性が高いと予測しています。
To understand the impact of maturation in the C032/C080 class 3 antibody pair, we determined a 3.3-A˚ cryo-EM structure of a C032-S trimer complex, revealing a Fab binding orientation that does not overlap with the ACE2 binding site (Figures 7G and 7H).
C032 / C080クラス3抗体ペアの成熟の影響を理解するために、C032-Sトリマー複合体の3.3A°クライオEM構造を決定しました。ACE2結合部位と重複しないFab結合方向を明らかにします(図7Gおよび7H)。
C032 recognizes a glycopeptidic epitope focused on a short helical segment in the RBD core that spans RBD residues 437–442 near the N343-glycan (Figure 7I), with a paratope BSA (~810 A˚ ²) equally distributed among the CDRH1, CDRH2, CDRH3, and CDRL3 loops (Figures 7J and S7A).
C032は、N343-グリカンの近くのRBD残基437〜442にまたがるRBDコアの短いヘリカルセグメントに焦点を合わせた糖ペプチドエピトープを認識します(図7I)。CDRH1、CDRH2、CDRH3、およびCDRL3ループに均等に分散されたパラトープBSA(〜810A˚²)を使用します(図7JおよびS7A)。
At the tip of CDRH3, hydrophobic residues A97HC, V98HC, and W100HC bury into a pocket shaped by RBD loops comprising residues 344–348 and 443–450 (Figure 7K), providing sequence-independent van der Waals interactions with the RBD backbone.
CDRH3の先端では、疎水性残基A97HC、V98HC、およびW100HCが、残基344–348および443–450を含むRBDループによって形成されたポケットに埋もれています(図7K)。RBDバックボーンとのシーケンスに依存しないファンデルワールス相互作用を提供します。
The mutation of residues comprising this RBD pocket confers C032 resistance (Figure 3E).
このRBDポケットを構成する残基の変異は、C032耐性を付与します(図3E)。
To predict how the affinity-matured 6.2-month antibody C080 avoids viral escape, we made a homology model of the C080-RBD structure.
アフィニティー成熟した6.2か月の抗体C080がウイルスの逃避をどのように回避するかを予測するために、C080-RBD構造のホモロジーモデルを作成しました。
The majority of somatic mutations in C080 are distal to the modeled Fab-RBD interface (Figure S7D), with the exception of Y33FLC and S31IHC.
Y33FLCとS31IHCを除いて、C080の体細胞変異の大部分は、モデル化されたFab-RBDインターフェース(図S7D)の遠位にあります。
I31HC fits within a hydrophobic pocket formed by V445, P499 of the RBD, and Y32HC.
I31HCは、V445、RBDのP499、およびY32HCによって形成される疎水性ポケット内に収まります。
Thus, C080 somatic mutations likely influence both direct packing and CDR loop conformation and flexibility at the antigen interface, as has been observed for neutralizing antibodies against the HIV-1 envelope.
したがって、C080の体細胞変異は、HIV-1エンベロープに対する中和抗体で観察されているように、抗原界面での直接パッキングとCDRループのコンフォメーションと柔軟性の両方に影響を与える可能性があります。
C080 also acquired activity against SARS-CoV (Figure 5F).
C080はSARS-CoVに対する活動も獲得しました(図5F)。
In the homology model of C080-SARS-CoV RBD, C080 somatic mutations I31HC and F33LC directly interact with RBD residues 444–445 and 346 (SARS-CoV-2 numbering), respectively, which differ between SARS-CoV-2 and SARS-CoV (Figures S7E and S7F).
C080-SARS-CoV RBDのホモロジーモデルでは、C080体細胞変異I31HCおよびF33LCは、それぞれRBD残基444〜445および346(SARS-CoV-2番号付け)と直接相互作用します。これはSARS-CoV-2とSARS-CoVで異なります(図S7EとS7F)。
The CDRL3 mutations are predicted to indirectly facilitate recognition of the SARS-CoV RBD.
CDRL3変異は、SARS-CoVRBDの認識を間接的に促進すると予測されています。
DISCUSSION
Here, we describe properties of SARS-CoV-2 neutralizing antibodies that change as a consequence of accumulated somatic mutations over months in convalescent individuals.
ここでは、回復期の個人で数か月にわたって蓄積された体細胞変異の結果として変化するSARS-CoV-2中和抗体の特性について説明します。
Persistent somatic mutation is associated with continued availability of antigen.
持続的な体細胞変異は、抗原の継続的な利用可能性と関連しています。
For example, during chronic HIV-1 infection, antibodies develop exceptionally large numbers of mutations compared to infections of limited duration.
たとえば、慢性的なHIV-1感染の間、抗体は限られた期間の感染と比較して非常に多くの突然変異を発症します。
In SARS-CoV-2 convalescent individuals, viral proteins and nucleic acids can persist in the gut for months, providing a source of antigen to fuel germinal centers.
SARS-CoV-2回復期の人では、ウイルスタンパク質と核酸が腸内に数か月間存続し、胚中心に燃料を供給する抗原の供給源を提供します。
Whether current vaccination schemes will afford a sufficient antigen persistence to elicit continued antibody maturation remains to be determined.
現在のワクチン接種スキームが、継続的な抗体成熟を誘発するのに十分な抗原持続性を提供するかどうかは、まだ決定されていません。
While each antibody group had unique characteristics that were affected by somatic mutations, general themes were evident.
各抗体グループには体細胞変異の影響を受ける独自の特徴がありましたが、一般的なテーマは明らかでした。
Typically, antibodies isolated at 6.2 months had increased potency compared to their clonal relatives isolated at 1.3 months.
通常、6.2か月で分離された抗体は、1.3か月で分離されたクローンの親類と比較して効力が増加していました。
An exception to this was C144, a particularly potent antibody, isolated at 1.3 months.
これの例外は、1.3か月で分離された特に強力な抗体であるC144でした。
Structural analysis suggests that the high potency of C144 is related to its ability to lock the S trimer in a prefusion, closed state.
構造分析によると、C144の高い効力は、Sトリマーを融合前の閉じた状態にロックする能力に関連していることが示唆されています。
Whereas antibody-producing plasma cells are selected based on their affinity for antigen, memory B cells are heterogeneous and encode a far more diverse set of antibodies with varying levels of affinity for the immunogen.
抗体産生形質細胞は抗原に対する親和性に基づいて選択されますが、メモリーB細胞は不均一であり、免疫原に対する親和性のレベルが異なる、はるかに多様な抗体のセットをコードします。
One of the consequences of accumulating a diverse group of closely related antibody-producing cells in the memory compartment is the ability to recognize and respond to closely related pathogens.
密接に関連する抗体産生細胞の多様なグループを記憶区画に蓄積することの結果の1つは、密接に関連する病原体を認識して応答する能力です。
Consistent with this observation, an important property that was recurrently evident in the clonally related antibody groups described herein was a change in the mutations that were selected and conferred resistance to 6.2-month antibodies as compared to 1.3-month antibodies.
この観察結果と一致して、ここで説明するクローン関連の抗体グループで繰り返し明らかになった重要な特性は、選択された変異の変化であり、1.3か月の抗体と比較して6.2か月の抗体に対する耐性を付与しました。
Striking features of some of the 6.2-month antibodies included restriction of the range of options for viral escape and the retention of neutralization activity in the face of point mutations that conferred resistance to 1.3-month antibodies.
一部の6.2か月の抗体の顕著な特徴には、ウイルスの逃避の選択肢の範囲の制限と、1.3か月の抗体に対する耐性を付与する点突然変異に直面した中和活性の保持が含まれていました。
The neutralization potency of certain matured antibodies, such as C549, C099, and C080, was maintained for all of the naturally circulating individual RBD substitutions tested, which is consistent with the observation of antibody antigen structures or models.
C549、C099、C080などの特定の成熟抗体の中和効力は、テストしたすべての自然循環する個々のRBD置換で維持されました。これは、抗体抗原の構造またはモデルの観察と一致しています。
In some cases, rVSV/SARS-CoV-2 selection experiments indicated that somatic mutations elevated the genetic barrier to antibody resistance, imposing a requirement for at least 2 substitutions for escape from neutralization.
場合によっては、rVSV / SARS-CoV-2選択実験により、体細胞変異が抗体耐性に対する遺伝的障壁を高め、中和からの脱出のために少なくとも2つの置換が必要であることが示されました。
The naturally circulating RBD triple mutant K417N/E484K/N501Y did not generally confer resistance to antibodies that were not already affected by the E484K mutation.
自然に循環しているRBDトリプル変異体K417N / E484K / N501Yは、通常、E484K変異の影響を受けていない抗体に対する耐性を付与しませんでした。
This finding suggests that separate antibodies may be generally responsible for the application of selection pressure at K417, E484, and N501.
この発見は、別々の抗体が、K417、E484、およびN501での選択圧の適用に一般的に関与している可能性があることを示唆しています。
Nevertheless, the E484K mutation undermined the activity of several class 2 antibodies.
それにもかかわらず、E484K変異は、いくつかのクラス2抗体の活性を弱体化させました。
While a number of naturally circulating substitutions at E484 conferred resistance to some class 2 antibodies, naturally occurring VOC often encode E484K, consistent with our finding that only the E484K substitution conferred more pervasive class 2 antibody resistance, including to some matured antibodies.
E484での多くの自然循環置換は、一部のクラス2抗体に対する耐性を付与しましたが、自然発生のVOCはE484Kをコードすることが多く、一部の成熟抗体を含め、E484K置換のみがより広範なクラス2抗体耐性を付与したという我々の発見と一致しています。
Similar principles, in terms of increasing breadth and potency, could apply to antibodies targeting other RBD epitopes or non-RBD epitopes such as those within the N-terminal domain.
幅と効力の増加という点で、同様の原則が、他のRBDエピトープまたはN末端ドメイン内のものなどの非RBDエピトープを標的とする抗体に適用される可能性があります。
In 2 cases described here, antibody maturation enabled the neutralization of heterologous sarbecoviruses, suggesting that the development of pan-sarbecovirus vaccines may be possible.
ここで説明する2つのケースでは、抗体の成熟により異種サルベコウイルスの中和が可能になりました。汎サルベコウイルスワクチンの開発が可能である可能性があることを示唆しています。
The greater neutralization potency, resilience to viral mutation, and breadth of SARS-CoV-2 RBD-specific antibodies that have undergone greater degrees of somatic mutation suggests that immunization schemes that elicit higher levels of antibody mutation and diversification are desirable.
より高い中和能、ウイルス変異に対する回復力、およびより高度な体細胞変異を受けたSARS-CoV-2 RBD特異的抗体の幅は、より高いレベルの抗体変異と多様化を誘発する免疫化スキームが望ましいことを示唆しています。
Antibody maturation may be especially important as SARS-CoV-2 diversifies and adapts to the range of human antibodies elicited in vaccinated and previously infected individuals.
SARS-CoV-2は多様化し、ワクチン接種を受けた個人や以前に感染した個人で誘発されるさまざまなヒト抗体に適応するため、抗体の成熟は特に重要です。
Moreover, a diverse set of broadly neutralizing SARS-CoV-2 Spike-specific antibodies that exhibit some activity against divergent sarbecoviruses may mitigate the threat posed by this group of pandemic-threat agents.
さらに、多様なサルベコウイルスに対してある程度の活性を示す、広く中和するSARS-CoV-2スパイク特異的抗体の多様なセットは、このパンデミック脅威エージェントのグループによってもたらされる脅威を軽減する可能性があります。
Limitations of the study
This study focused on representative antibodies from 3 of the 4 major classes of antibodies that target the SARS-CoV-2 RBD.
この研究では、SARS-CoV-2RBDを標的とする4つの主要なクラスの抗体のうち3つからの代表的な抗体に焦点を当てました。
The study is not comprehensive in describing the behavior of all of the antibodies that are elicited by SARS-CoV-2 Spike, but instead illustrates the potential for increasing the effectiveness of the neutralizing antibody response through maturation.
この研究は、SARS-CoV-2スパイクによって誘発されるすべての抗体の挙動を説明する上で包括的ではありません。しかし、代わりに、成熟を通じて中和抗体反応の有効性を高める可能性を示しています。
A key unknown that is not addressed in this study and is a crucial factor in determining neutralization breadth in convalescent or vaccinated individuals is the number of distinct epitopes that are targeted by SARS-CoV-2 neutralizing antibodies.
この研究では取り上げられていない要素であり、回復期またはワクチン接種を受けた個人の中和幅を決定する上で重要な要素でもある未知の重要な要素は、SARS-CoV-2中和抗体の標的となる別個のエピトープの数です。
The study illustrates the mutation pathways that can confer viral resistance to individual specific antibodies and antibody resilience to individual viral mutations, but the actual pathways followed in the context of natural infection may depend on the presence of other antibodies and viral variants.
この研究は、個々の特定の抗体に対するウイルス耐性と個々のウイルス変異に対する抗体の回復力を与えることができる変異経路を示しています。ただし、自然感染の状況でたどる実際の経路は、他の抗体やウイルス変異体の存在に依存する可能性があります。
Finally, the optimal level of antibody mutation and the maximum breadth that is achievable through mutation of individual antibodies was not determined.
最後に、抗体変異の最適レベルと、個々の抗体の変異によって達成可能な最大幅は決定されていません。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
