SARS-CoV-2 mRNAワクチン接種を繰り返した後の、非炎症性のスパイク特異的IgG4抗体へのクラススイッチ
元→SARS-CoV-2 mRNAワクチン接種を繰り返した後の非炎症性のスパイク特異的IgG4抗体へのクラス切り替え |科学免疫学 (science.org)
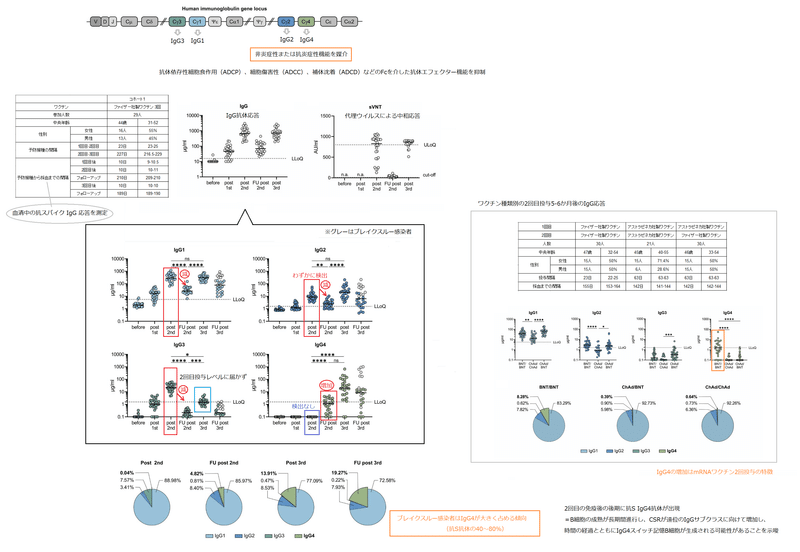

Class switch towards non-inflammatory, spike-specific IgG4 antibodies after repeated SARS-CoV-2 mRNA vaccination
SARS-CoV-2 mRNAワクチン接種を繰り返した後の、非炎症性のスパイク特異的IgG4抗体へのクラススイッチ
Abstract
RNA vaccines are efficient preventive measures to combat the SARS-CoV-2 pandemic.
RNA ワクチンは、SARS-CoV-2 のパンデミックと闘うための効果的な予防手段です。
High levels of neutralizing SARS-CoV-2-antibodies are an important component of vaccine-induced immunity.
高レベルの中和 SARS-CoV-2 抗体は、ワクチン誘発免疫の重要な要素です。
Shortly after the initial two mRNA vaccine doses, the IgG response mainly consists of the pro-inflammatory subclasses IgG1 and IgG3.
最初の 2 回の mRNA ワクチン投与の直後に、IgG 応答は主に炎症誘発性サブクラス IgG1 および IgG3 で構成されます。
Here, we report that several months after the second vaccination, SARS-CoV-2-specific antibodies were increasingly composed of non-inflammatory IgG4, which were further boosted by a third mRNA vaccination and/or SARS-CoV-2 variant breakthrough infections.
ここでは、2 回目のワクチン接種から数か月後、SARS-CoV-2 特異的抗体が非炎症性 IgG4 で構成されていたことを報告します。これらは、3回目のmRNAワクチン接種および/またはSARS-CoV-2バリアントのブレークスルー感染によってさらに後押しされました。
IgG4 antibodies among all spike-specific IgG antibodies rose on average from 0.04% shortly after the second vaccination to 19.27% late after the third vaccination.
すべてのスパイク特異的 IgG 抗体の中で IgG4 抗体は、平均で 2 回目のワクチン接種直後の 0.04% から 3 回目のワクチン接種後の 19.27% まで上昇しました。
This induction of IgG4 antibodies was not observed after homologous or heterologous SARS-CoV-2 vaccination with adenoviral vectors.
この IgG4 抗体の誘導は、アデノウイルスベクターによる同種または異種の SARS-CoV-2 ワクチン接種後に観察されませんでした。
Single-cell sequencing and flow cytometry revealed substantial frequencies of IgG4-switched B cells within the spike-binding memory B-cell population (median 14.4%; interquartile range (IQR) 6.7–18.1%) compared to the overall memory B-cell repertoire (median 1.3%; IQR 0.9–2.2%) after three immunizations.
シングルセルシーケンスとフローサイトメトリーにより、3回の予防接種後の全体的な記憶B細胞レパートリー(中央値1.3%、IQR 0.9〜2.2%)と比べ、スパイク結合記憶 B 細胞集団内に IgG4 スイッチ B 細胞がかなりの頻度で存在することが明らかになりました (中央値 14.4%; 四分位範囲 (IQR) 6.7–18.1%)。
Importantly, this class switch was associated with a reduced capacity of the spike-specific antibodies to mediate antibody-dependent cellular phagocytosis and complement deposition.
重要なことに、このクラス スイッチは、スパイク特異的抗体が抗体依存性細胞食作用および補体沈着を媒介する能力の低下と関連していました。
Since Fc-mediated effector functions are critical for antiviral immunity, these findings may have consequences for the choice and timing of vaccination regimens using mRNA vaccines, including future booster immunizations against SARS-CoV-2.
Fc を介したエフェクター機能は抗ウイルス免疫にとって重要であるため、これらの発見は、SARS-CoV-2 に対する将来の追加免疫を含む、mRNA ワクチンを使用したワクチン接種レジメンの選択とタイミングに影響を与える可能性があります。
INTRODUCTION
During the ongoing pandemic of the severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) that has reached over half a billion cases worldwide, new and efficient vaccines were developed with unprecedented speed and likely prevented millions of deaths.
重症急性呼吸器症候群コロナウイルス 2 (SARS-CoV-2) のパンデミックが世界で 5 億件以上に達している現在、新しく効率的なワクチンが前例のないスピードで開発され、数百万人の死亡を防いだ可能性があります。
Two mRNA vaccines (Comirnaty from BioNTech/Pfizer and Spikevax from Moderna) were the first mRNA vaccines approved for use in humans.
2 つの mRNA ワクチン (BioNTech/Pfizer の Comirnaty と Moderna の Spikevax) は、ヒトへの使用が承認された最初の mRNA ワクチンでした。
Both showed high efficacies of around 90% in preventing SARS-CoV-2 infections in clinical trials and real-world scenarios.
どちらも、臨床試験と現実世界のシナリオで、SARS-CoV-2 感染の予防において約 90% の高い有効性を示しました。
Several studies documented that antibody responses after a third immunization were superior with regard to their neutralizing capacity against a broad spectrum of SARS-CoV-2 variants of concern (VOC) compared to antibody responses measured after the initial two-dose regimen.
いくつかの研究では、3回目の免疫後の抗体反応は、最初の2回の投与レジメン後に測定された抗体反応と比較して、懸念されるSARS-CoV-2バリアント(VOC)の広範なスペクトルに対する中和能力に関して優れていることが実証されています。
It was further shown that antibody avidity increased following mRNA booster vaccination, which was partly explained by prolonged germinal center (GC) activation and ongoing B-cell maturation.
さらに、mRNAブースターワクチン接種後に抗体結合力が増加したことが示されました。これは、胚中心 (GC) 活性化の長期化と進行中の B 細胞成熟によって部分的に説明されました。
SARS-CoV-2 vaccine-derived mRNA and spike protein was detected even several weeks after vaccination.
SARS-CoV-2ワクチン由来のmRNAとスパイクタンパク質は、ワクチン接種後数週間でも検出されました。
Sequencing of memory B cells revealed somatic hypermutation (SHM) in GCs for up to six months, which resulted in broadening and diversification of the memory B cell repertoire as well as in an improved effectiveness against VOC.
メモリー B 細胞の配列決定により、最大 6 か月間の GC の体細胞超変異 (SHM) が明らかになりました。その結果、メモリー B 細胞のレパートリーが広がり、多様化し、VOC に対する有効性が向上しました。
Activation-induced cytidine deaminase (AID) is the enzyme that catalyzes SHM in antibody variable (V) regions.
活性化誘導シチジンデアミナーゼ (AID) は、抗体の可変 (V) 領域で SHM を触媒する酵素です。
It is expressed in GC B cells and also mediates class switch recombination (CSR) of constant (C) region genes.
これは GC B 細胞で発現し、定常 (C) 領域遺伝子のクラス スイッチ組換え (CSR) も仲介します。
IgG3 encoded by the γ3 C-region is the most upstream (5′) Cγ-region in the immunoglobulin heavy chain gene locus on chromosome 14 (Fig. 1A).
γ3 C 領域によってコードされる IgG3 は、14 番染色体上の免疫グロブリン重鎖遺伝子座の最も上流 (5') の Cγ 領域です (図 1A)。

Ongoing activity of AID can lead to switching towards more downstream Cγ regions, i.e. γ1, γ2 and γ4, which encode IgG1, IgG2 and IgG4.
AIDの進行中の活性は、IgG1、IgG2、およびIgG4をコードする、より下流のCγ領域、すなわちγ1、γ2、およびγ4への切り替えにつながる可能性があります。
CSR is highly regulated during an immune response.
CSR は、免疫応答中に高度に規制されています。
The C-region to which a B cell switches is modulated by cytokines and B-cell activators at the level of transcription of non-rearranged heavy chain constant genes.
B 細胞が切り替わる C 領域は、再構成されていない重鎖定常遺伝子の転写レベルで、サイトカインおよび B 細胞活性化因子によって調節されます。
However, the regulators for germline transcription of the γ2 and γ4 gene locus are not very well understood in humans.
ただし、γ2 および γ4 遺伝子座の生殖細胞系転写の調節因子は、ヒトではあまりよく理解されていません。
IL-4 in concert with IL-10 has been described to be involved in switching to IgG4.
IL-10 と協調する IL-4 は、IgG4 への切り替えに関与することが記載されています。
Most notably, distal IgG variants, in particular IgG2 and IgG4, were reported to mediate mostly non-inflammatory or even anti-inflammatory functions due to decreased Fc-mediated antibody effector functions including antibody-dependent cellular phagocytosis (ADCP), cellular cytotoxicity (ADCC) and complement deposition (ADCD).
最も注目すべきは、遠位 IgG バリアント、特に IgG2 および IgG4 が、ほとんどの場合非炎症性または抗炎症性機能を媒介することが報告されていることです。抗体依存性細胞食作用(ADCP)、細胞傷害性(ADCC)、補体沈着(ADCD)などのFcを介した抗体エフェクター機能の低下によるものです。
Shortly after the administration of two doses of SARS-CoV-2- mRNA vaccine (either Comirnaty or mRNA-1273), IgG1 and IgG3 were found to be the predominant IgG subclasses, whereas IgG2 responses were rare and IgG4 responses almost undetectable.
SARS-CoV-2-mRNA ワクチン (Comirnaty または mRNA-1273) を 2 回投与した直後に、IgG1 と IgG3 が主要な IgG サブクラスであることがわかりました。一方、IgG2 応答はまれであり、IgG4 応答はほとんど検出されませんでした。
However, the longitudinal evolution of all four IgG subclasses (IgG1, 2, 3 and 4) in response to mRNA vaccination – and particularly their long-term development after the second and the third dose – has not yet been analyzed.
ただし、mRNA ワクチン接種に応答した 4 つのすべての IgG サブクラス (IgG1、2、3、および 4) の縦方向の進化、特に 2 回目と 3 回目の投与後の長期的な展開はまだ分析されていません。
Here, we report on the analysis of two independent cohorts of vaccinated health-care workers, who developed an increase in anti-spike IgG4 antibodies and IgG4-switched memory B cells five to seven months after the second mRNA immunization with Comirnaty.
ここでは、ワクチン接種を受けた医療従事者の 2 つの独立したコホートの分析について報告します。これらのコホートは、Comirnaty による 2 回目の mRNA 免疫の 5 ~ 7 か月後に、抗スパイク IgG4 抗体と IgG4 スイッチ メモリー B 細胞の増加を示しました。
This response was further boosted by a third mRNA vaccination and/or by breakthrough infections with SARS-CoV-2 VOC.
この反応は、3回目のmRNAワクチン接種および/またはSARS-CoV-2 VOCによるブレークスルー感染によってさらに促進されました。
While we confirmed an increased antibody avidity and higher neutralization capacity against the recently emerged Omicron VOC after the third vaccine dose, the switch towards distal IgG subclasses was accompanied by reduced fragment crystallizable (Fc) gamma receptor (FcγR)-mediated effector functions such as ADCP and ADCD.
3回目のワクチン投与後、最近出現したOmicron VOCに対する抗体結合力の増加と中和能力の向上を確認しましたが、 遠位 IgG サブクラスへの切り替えには、ADCP や ADCD などのフラグメント結晶性 (Fc) ガンマ受容体 (FcγR) を介したエフェクター機能の低下が伴いました。
RESULTS
Longitudinal monitoring of anti-spike antibody subclass responses
抗スパイク抗体サブクラス応答の縦断的モニタリング
In a cohort of 29 health care workers (cohort 1), we analyzed the antibody response after SARS-CoV-2 vaccination with three doses of Comirnaty (Table 1).
29 人の医療従事者のコホート (コホート 1) で、SARS-CoV-2 ワクチン接種後の Comirnaty の 3 回接種後の抗体反応を分析しました (表 1)。

The first two doses were given at an interval of three to four weeks and a further booster vaccination was applied about seven months after the second immunization.
最初の 2 回の接種は 3 ~ 4 週間の間隔で行い、2 回目の免疫の約 7 か月後にブースターワクチン接種を行いました。
Using a flow cytometry-based antibody assay, anti-spike IgG responses were measured in sera ten days after each vaccination, 210 days after the second and 180 days after the third dose.
フローサイトメトリーに基づく抗体アッセイを使用して、各ワクチン接種の 10 日後、2 回目の接種の 210 日後、および 3 回目の接種の 180 日後に血清中の抗スパイク IgG 応答を測定しました。
In line with earlier reports, mRNA immunizations induced robust IgG antibody response in all vaccinees (Fig. S1A).
以前の報告に沿って、mRNA免疫はすべてのワクチン接種者で強力なIgG抗体応答を誘導しました(図S1A)。

Neutralizing capacity was assessed in a surrogate virus neutralization assay confirming the dynamics of vaccine-induced antibody responses (Fig. S1B).
中和能力は、ワクチン誘導抗体応答のダイナミクスを確認する代理ウイルス中和アッセイで評価されました(図S1B)。
Ten days after two immunizations, anti-spike antibodies of the subclasses IgG1, IgG2 and IgG3 were readily detectable in a multiplexed flow cytometric assay, whereas anti-S IgG4 antibodies were undetectable (Fig. 1B).
2 回の免疫の 10 日後、サブクラス IgG1、IgG2、および IgG3 の抗スパイク抗体が、マルチプレックス フローサイトメトリー アッセイで容易に検出されました。一方、抗S IgG4抗体は検出できませんでした(図1B)。

IgG2 levels were markedly lower than IgG3 and IgG1 levels.
IgG2 レベルは、IgG3 および IgG1 レベルよりも著しく低かった。
Intriguingly, 210 days after the second immunization, the levels of spike-specific IgG4 antibodies exceeded the lower limit of quantification in the sera of about half of the vaccinees.
興味深いことに、2 回目の免疫の 210 日後に、ワクチン接種者の約半数の血清中のスパイク特異的 IgG4 抗体のレベルが定量下限を超えました。
The levels for all other subclasses dropped significantly as expected from the overall anti-S response.
他のすべてのサブクラスのレベルは、全体的な抗 S 応答から予想されるように大幅に低下しました。
To explore whether the rise in IgG4 antibody levels was specific for the homologous mRNA vaccination regimen used, we analyzed sera from an independent cohort, in which we compared the immunogenicity of homologous and heterologous vaccination regimens with Comirnaty and the adenoviral vector-based vaccine ChAdOx1 (AZD1222, Vaxzevria) (see Table S1).
IgG4抗体レベルの上昇が、使用された同種mRNAワクチン接種レジメンに特異的であるかどうかを調査するために、独立したコホートからの血清を分析し、同種および異種のワクチン接種レジメンの免疫原性をComirnatyおよびアデノウイルスベクターベースのワクチンChAdOx1(AZD1222、Vaxzevria)と比較しました(表S1を参照)。
Five to six months after the second immunization, spike-specific IgG4 antibodies were again detectable in half of the sera of the BNT-BNT cohort, but only in one of the 51 sera from the two other vaccine cohorts (Fig. S2).
2回目の免疫化の5〜6か月後、スパイク特異的IgG4抗体はBNT-BNTコホートの血清の半分で再び検出されましたが、他の2つのワクチンコホートからの51の血清のうちの1つでのみ検出されました(図S2)。
After the third mRNA immunization, the amounts of all IgG subclasses were elevated again and reached levels as measured shortly after the second vaccination in the case of IgG1 and IgG2 (Fig. 1B).
3回目のmRNA免疫後、すべてのIgGサブクラスの量が再び上昇し、IgG1およびIgG2の場合、2回目のワクチン接種直後に測定されたレベルに達しました(図1B)。
IgG3 remained at lower levels compared to the time point shortly after second vaccination.
IgG3 は、2 回目のワクチン接種直後の時点と比較して、低いレベルのままでした。
Notably, a marked increase in IgG4 antibody levels was observed after the booster immunization in nearly all vaccinees.
特に、ほぼすべてのワクチン接種者で追加免疫後に IgG4 抗体レベルの顕著な増加が観察されました。
Until this time point, none of the participants reported an episode of SARS-CoV-2 infection and we could also not detect anti-nucleoprotein antibodies in any of the serum samples.
この時点まで、参加者の誰もSARS-CoV-2感染のエピソードを報告しておらず、血清サンプルのいずれからも抗核タンパク質抗体を検出できませんでした.
To analyze the contribution of IgG4 antibodies to the long-lived antibody pool after the third immunization, additional serum samples were collected after a mean period of 180 days from 27 individuals after the third mRNA vaccination.
3回目の免疫後の長寿命抗体プールに対するIgG4抗体の寄与を分析するために、3回目のmRNAワクチン接種後、27人から平均180日後に追加の血清サンプルを収集しました。
At this time point, several participants reported anamnestic breakthrough infections, which was in line with nucleoprotein serological testing (Fig. 1B, grey dots).
この時点で、何人かの参加者が既往性ブレークスルー感染を報告しましたが、これは核タンパク質の血清学的検査と一致していました (図 1B、灰色の点)。
Notably, the relative contribution of IgG4 antibodies to the total pool of anti-S IgG increased over time, arguing against a transient expansion of short-lived plasmablasts after the third immunization (Fig. 1C; Fig. S1C).
特に、抗S IgGの総プールに対するIgG4抗体の相対的な寄与は、時間の経過とともに増加しました。3回目の免疫後の短命形質芽細胞の一過性増殖に反対しています(図1C;図S1C)。

In four individuals IgG4 even became the most prominent IgG subclass after the third immunization.
4 人の個人では、3 回目の免疫後、IgG4 が最も顕著な IgG サブクラスにさえなりました。
Specifically in individuals having experienced an additional infection, IgG4 antibodies accounted for 40–80% of all anti-S antibodies (Fig. S1C).
特に追加の感染を経験した個人では、IgG4抗体はすべての抗S抗体の40〜80%を占めました(図S1C)。
Longitudinal monitoring of class-switching in SARS-CoV-2-specific memory B cells
SARS-CoV-2特異的記憶B細胞におけるクラススイッチングの縦断的モニタリング
The appearance of anti-S IgG4 antibodies late after the second immunization suggests that a long period of ongoing B-cell maturation might come along with increased CSR towards distal IgG subclasses resulting in the generation of IgG4-switched memory B-cells over time.
2回目の免疫後の後期に抗S IgG4抗体が出現したことは、B細胞の成熟が長期間進行し、CSRが遠位のIgGサブクラスに向けて増加し、時間の経過とともにIgG4スイッチ記憶B細胞が生成される可能性があることを示唆しています。
To validate the presence of these cells beyond serological testing, we characterized spike-specific memory B cells according to their IgG subclasses by flow cytometry in longitudinal PBMC samples of 11 individuals with representative, varying degrees of anti-S IgG4 antibodies late after the second immunization, shortly after third immunization as well as late after third immunization (Fig. 2).
血清学的検査を超えてこれらの細胞の存在を検証するために、代表的な11人の個人の縦断PBMCサンプルで、フローサイトメトリーにより、IgGサブクラスに従ってスパイク特異的メモリーB細胞を特徴付けました。さまざまな程度の抗 S IgG4 抗体は、2 回目の免疫の後期、3 回目の免疫の直後、および 3 回目の免疫の後期に現れました (図 2)。

Spike-binding B cells were detected in considerable frequency almost exclusively within the CD27+ memory B cell population (Fig. 2A).
スパイク結合 B 細胞は、ほぼ独占的に CD27+ メモリー B 細胞集団内でかなりの頻度で検出されました (図 2A)。
While the frequency of IgG4-expressing memory cells among non-spike binding memory B cells was in the range of 1–8% as described before, a significantly higher frequency of spike-binding memory B cells expressed IgG4 at all time points, reaching up to 37% of all IgG subclasses (Fig. 2B; Fig. S3).
前述のように、非スパイク結合記憶 B 細胞のうち IgG4 発現記憶細胞の頻度は 1 ~ 8% の範囲でしたが、スパイク結合記憶 B 細胞の有意に高い頻度がすべての時点で IgG4 を発現し、すべての IgG サブクラスの最大 37% に達しました (図 2B; 図 S3)。
As expected from serological data, IgG3 was underrepresented and considerable frequencies of IgG2-positive memory B cells were found among spike-binding memory B cells (Table S2).
血清学的データから予想されるように、IgG3は過小評価されており、スパイク結合メモリーB細胞の中でかなりの頻度でIgG2陽性メモリーB細胞が見つかりました(表S2)。
In addition to the flow cytometric analyses, we performed single-cell RNA sequencing (scRNA-seq) of spike-specific B cells from four selected donors 210 days after the second or 10 days after the third Comirnaty dose (Fig. S4).
フローサイトメトリー分析に加えて、2回目の210日後または3回目のComirnaty投与の10日後に、4人の選択されたドナーからのスパイク特異的B細胞の単一細胞RNAシーケンス(scRNA-seq)を実行しました(図S4)。
We used cellular indexing of transcriptomes and epitopes (CITE)-seq to label spike- and receptor binding domain (RBD)-binding B cells and enriched for spike-binding IgG+ B cells by flow cytometry prior to scRNA-seq.
トランスクリプトームとエピトープの細胞索引付け(CITE)-seqを使用して、スパイクおよび受容体結合ドメイン(RBD)結合B細胞を標識し、scRNA-seqの前にフローサイトメトリーによってスパイク結合IgG + B細胞を濃縮しました。
In line with the flow cytometric data, 16% of the sorted spike-specific memory B-cells from all four donors showed sequences encoding the IgG4 subclass which were barely detectable among non-binders.
フローサイトメトリーのデータに沿って、4 人のドナーすべてからの選別されたスパイク特異的記憶 B 細胞の 16% が、非バインダー間ではほとんど検出されなかった IgG4 サブクラスをコードする配列を示しました。
Frequencies of IgG4 anti-spike memory B cells for individual donors as determined through scRNA-seq thereby mirrored serological IgG4 anti-spike levels (Fig. S4B).
scRNA-seqによって決定された個々のドナーのIgG4アンチスパイクメモリーB細胞の頻度は、血清学的IgG4アンチスパイクレベルを反映していました(図S4B)。
Of note, among all spike- and RBD-binding B cells identified, B cells with an IgG4 subclass were not phenotypically different from B cells with other IgG subclasses (Fig. S4C).
注目すべきは、同定されたすべてのスパイク結合および RBD 結合 B 細胞の中で、IgG4 サブクラスを持つ B 細胞は、他の IgG サブクラスを持つ B 細胞と表現型に違いはありませんでした (図 S4C)。
To confirm the spike-specificity of the IgG4-producing B cell clones (Fig. S4D), four recombinant monoclonal antibodies were cloned from the obtained B cell receptor (BCR) sequences, expressed in eukaryotic cells and tested for binding to RBD and full-length spike.
IgG4 産生 B 細胞クローンのスパイク特異性を確認するために (図 S4D)、得られた B 細胞受容体 (BCR) 配列から 4 つの組換えモノクローナル抗体をクローニングし、真核細胞で発現させ、RBD への結合と全長スパイクについて試験しました。
All four monoclonal antibodies (mAbs) were able to bind to the spike protein, and one clone recognized RBD, which was in accordance with the CITE-seq results (Fig. S4E).
4つのモノクローナル抗体(mAb)すべてがスパイクタンパク質に結合でき、1つのクローンがRBDを認識しました。これはCITE-seqの結果と一致していました(図S4E)。
In summary, flow cytometry and scRNA-seq confirmed a high frequency of IgG4 spike-binding memory B cells immediately before the third immunization, which even increased thereafter.
要約すると、フローサイトメトリーと scRNA-seq により、3 回目の免疫の直前に高頻度の IgG4 スパイク結合メモリー B 細胞が確認され、その後さらに増加しました。
The IgG4 subclass does not prevail after repeated vaccination with tetanus toxoid or respiratory syncytial virus infection
IgG4 サブクラスは、破傷風トキソイドまたは呼吸器合胞体ウイルス感染による反復ワクチン接種後に優勢ではありません
Generally, IgG4 responses have been rarely observed even after repeated immunizations or infections.
一般に、免疫や感染を繰り返しても IgG4 応答はほとんど観察されません。
To corroborate this, we analyzed tetanus-specific antibody responses in 23 volunteers who had received several doses (2–16, median 6) of a tetanus toxoid (TT) vaccine (Table S3).
これを裏付けるために、破傷風トキソイド(TT)ワクチンを数回(2〜16、中央値6)接種した23人のボランティアの破傷風特異的抗体反応を分析しました(表S3)。
Sera were tested for TT-specific total IgG or IgG4 antibodies using an ELISA format.
ELISAフォーマットを使用して、TT特異的全IgGまたはIgG4抗体について血清を試験した。
TT-specific IgG4 were detectable in 9 of 23 sera, albeit at very low levels, and no correlation was found with the number of vaccinations received (Fig. S5A, B).
TT特異的IgG4は、非常に低いレベルではありますが、23個の血清のうち9個で検出可能であり、受けたワクチン接種の数との相関は見られませんでした(図S5A、B)。

Additionally, we tested ten individuals from our cohort 2 (Table 1) for the presence of antibodies against the respiratory syncytial virus (RSV), a respiratory pathogen that regularly causes re-infections in humans.
さらに、コホート 2 (表 1) から 10 人を対象に、呼吸器合胞体ウイルス (RSV) に対する抗体の存在を調べました。これは、人間に定期的に再感染を引き起こす呼吸器病原体です。
While we found RSV-F protein-specific IgG1 antibodies in all tested sera, IgG4 was not detected (Fig. S5C).
試験したすべての血清でRSV-Fタンパク質特異的IgG1抗体が見つかりましたが、IgG4は検出されませんでした(図S5C)。

These findings support the notion that class-switching to IgG4 is not a general consequence of repeated antigen exposure in form of vaccinations or infections.
これらの調査結果は、IgG4 へのクラス切り替えは、ワクチン接種や感染の形での抗原曝露の繰り返しの一般的な結果ではないという考えを支持しています。
IgG4 occurrence correlates with increased avidity, but decreased antibody effector function in an independent cohort of SARS-CoV-2 mRNA vaccinees
IgG4 の発生は結合活性の増加と相関するが、SARS-CoV-2 mRNAワクチン接種者の独立したコホートでは抗体エフェクター機能が低下
To exclude any unrecognized bias or specific characteristics of the initially described cohort 1 (Table 1, Fig. 1), a second cohort of 38 volunteers was analyzed, who had received three doses of Comirnaty using a very similar vaccination schedule (Table 1, cohort 2).
最初に記述されたコホート 1 (表 1、図 1) の認識されていないバイアスまたは特定の特性を除外するために、38 人のボランティアの 2 番目のコホートが分析されました。非常によく似たワクチン接種スケジュールを使用してComirnatyを3回接種した人たちです(表1、コホート2)。
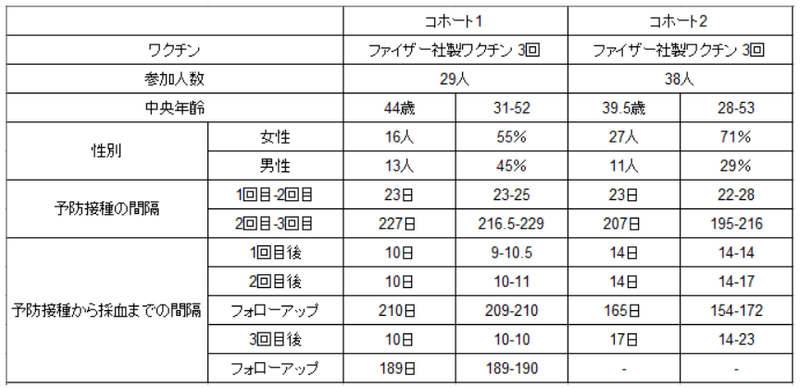
Only one individual in this cohort showed a positive nucleoprotein serology, despite no anamnestic clinical breakthrough infection, and was not included in a smaller sub-cohort used for functional testing.
このコホートで 1 人だけが陽性の核タンパク質血清学的検査を示しましたが、既往歴のある臨床的ブレークスルー感染はなく、機能テストに使用される小規模なサブコホートには含まれていませんでした。
Sera taken shortly after the second or the third vaccination (2 to 5 weeks) showed a comparable spike-specific antibody subclass distribution (Fig. 3) as described before (Fig. 1).
2 回目または 3 回目のワクチン接種の直後 (2 ~ 5 週間) に採取した血清は、前述のように (図 1)、匹敵するスパイク特異的抗体サブクラス分布 (図 3) を示しました。
Again, there was a substantial increase in IgG4 (38.6-fold) levels after the third immunization, whereas e.g. spike-specific IgG3 did not reach the levels seen after the second dose (Fig. 3A; Fig. S6).
この場合も、3 回目の免疫後に IgG4 レベルが大幅に増加した (38.6 倍)一方、例えばスパイク特異的IgG3は、2回目の投与後に見られるレベルに達しませんでした(図3A;図S6)。

Since the total amount of anti-spike IgG antibodies was only moderately (1.6-fold) elevated after the third compared to the second vaccine dose, we next investigated whether the increased proportion of IgG4 antibodies had functional consequences.
抗スパイク IgG 抗体の総量は、2 回目のワクチン投与と比較して 3 回目以降は中程度 (1.6 倍) しか上昇しなかったため、次に、IgG4 抗体の割合の増加が機能的な結果をもたらすかどうかを調査しました。
To this end, paired sera from a representative subcohort of ten volunteers were analyzed.
この目的のために、10 人のボランティアの代表的なサブコホートからのペア血清を分析しました。
First, RBD-specific IgG1 and IgG4 antibodies were determined via ELISA.
最初に、RBD 特異的 IgG1 および IgG4 抗体を ELISA で測定しました。
IgG4 levels were significantly increased after the third vaccination, whereas the levels of RBD-binding IgG1 were not different at the two time points (Fig. 3B).
IgG4レベルは3回目のワクチン接種後に有意に増加しましたが、RBD結合IgG1のレベルは2つの時点で差がありませんでした(図3B)。

The avidity was clearly increased after the third vaccination (Fig. 3C), which is in line with recent reports.
アビディティは、3回目のワクチン接種後に明らかに増加しました(図3C)。これは、最近の報告と一致しています。
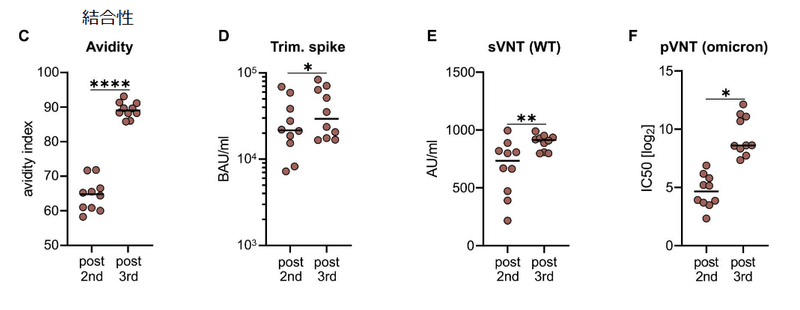
Furthermore, the capacities to bind trimeric spike protein (Fig. 3D) and to prevent soluble RBD binding to ACE2 (Fig. 3E), which both serve as surrogate markers for virus neutralization, were increased after the third dose.
さらに、どちらもウイルス中和の代理マーカーとして機能する三量体スパイクタンパク質に結合する能力 (図 3D) および可溶性 RBD の ACE2 への結合を防止する能力 (図 3E) は、3 回目の投与後に増加しました。
Accordingly, this translated into superior neutralization of lentiviral (LV) particles pseudotyped with spike proteins derived from the Omicron VOC (Fig. 3F).
したがって、これは、Omicron VOC に由来するスパイクタンパク質で偽型化されたレンチウイルス (LV) 粒子の優れた中和に変換されました (図 3F)。
In conclusion, repeated vaccination improved antibody effector functions mediated through the variable domain.
結論として、反復ワクチン接種は、可変ドメインを介して媒介される抗体エフェクター機能を改善しました。
However, IgG2 and IgG4 are considered to have a lower potential to mediate FcγR-dependent secondary effector function.
ただし、IgG2 および IgG4 は、FcγR 依存性の二次エフェクター機能を媒介する可能性が低いと考えられています。
Therefore, we performed an ADCP assay with the monocytic THP-1 cell line (Fig. 3G).
したがって、単球THP-1細胞株を使用してADCPアッセイを実行しました(図3G)。
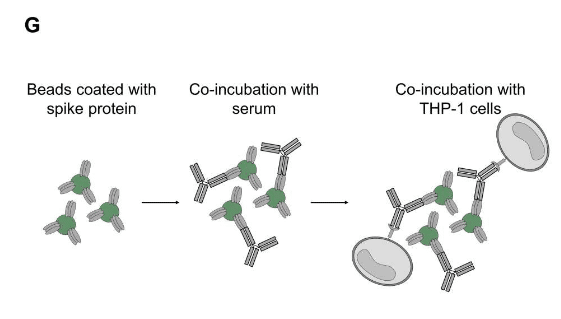
Using fluorescently labeled microbeads loaded with spike protein as targets and equal amounts of our recombinant monoclonal anti-RBD antibodies, we confirmed that IgG3 and IgG1 are more potent in inducing phagocytosis than IgG4 and IgG2 (Fig. S7).
スパイクタンパク質を搭載した蛍光標識マイクロビーズをターゲットとして使用し、等量の組換えモノクローナル抗RBD抗体を使用して、IgG3およびIgG1がIgG4およびIgG2よりも食作用を誘導するのに強力であることを確認しました(図S7)。
Using FcγRIIA, FcγRIIB or FcγRIII-expressing reporter cells, engagement of IgG2 and IgG4 results in reduced activation of the FcγRIIA, which was reported to be a key mediator of ADCP (Fig. S7).
FcγRIIA、FcγRIIB、またはFcγRIIIを発現するレポーター細胞を使用すると、IgG2およびIgG4の関与により、ADCPの重要なメディエーターであると報告されているFcγRIIAの活性化が減少します(図S7)。
Consistent with this, sera taken after the third vaccination and normalized to the amount of anti-spike antibodies yielded significant lower phagocytic scores than sera from the same donors after two immunizations (Fig. 3H).
これと一致して、3回目のワクチン接種後に採取され、抗スパイク抗体の量に対して正規化された血清は、2回の免疫化後の同じドナーからの血清よりも有意に低い貪食スコアをもたらしました(図3H)。
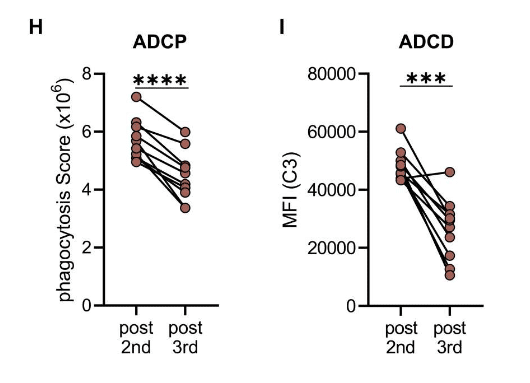
Furthermore, antibody-dependent complement deposition on spike-coated microbeads was also significantly reduced after incubation with sera taken after the third vaccination (Fig. 3I).
さらに、スパイクコーティングされたマイクロビーズへの抗体依存性補体沈着も、3回目のワクチン接種後に採取した血清とのインキュベーション後に大幅に減少しました(図3I)。
Together, these data show that spike protein-reactive IgG2 and IgG4 exhibit reduced Fc-mediated effector functions.
まとめると、これらのデータは、スパイクタンパク質反応性 IgG2 および IgG4 が Fc を介したエフェクター機能の低下を示すことを示しています。
Impact of breakthrough infections on vaccine-induced antibody responses
ワクチン誘発抗体反応に対するブレークスルー感染の影響
The fact that individuals, who experienced a breakthrough infection after being three times vaccinated with mRNA, showed the highest IgG4 levels in cohort 1 (Fig. 1) suggested that infections with SARS-CoV-2 can also activate IgG4-switched memory B cells.
mRNAを3回接種した後に画期的な感染を経験した個人が、コホート1で最高のIgG4レベルを示したという事実(図1)は、SARS-CoV-2による感染もIgG4スイッチ記憶B細胞を活性化できることを示唆しています。
To investigate this in more detail, we identified twelve persons from a study cohort of breakthrough infections (CoVaKo study), who were vaccinated two or three times with SARS-CoV-2 mRNA vaccines and who experienced a breakthrough infection 25 to 257 days after the second or 57 to 164 days after the third mRNA vaccination (Table S4).
これをより詳細に調査するために、ブレイクスルー感染症の研究コホート (CoVaKo 研究) から 12 人を特定しました。SARS-CoV-2 mRNAワクチンを2、3回接種した人で、2回目のmRNAワクチン接種の25〜257日後または3回目のmRNAワクチン接種の57〜164日後に突破感染を経験した人です(表S4)。
Serum samples were collected on the day of study inclusion (visit (V) 1, typically within the first week) as well as two (V2) and four weeks (V4) after infection-confirming PCR.
血清サンプルは、感染確認 PCR の 2 週間後 (V2) および 4 週間後 (V4) だけでなく、研究に含めた日 (訪問 (V) 1、通常は最初の 1 週間以内) に収集されました。
In all individuals, we detected an anamnestic antibody response with an increase in spike-binding antibodies from V1 to V4 irrespective of IgG subclasses (Fig. S8).
すべての個人で、IgGサブクラスに関係なく、V1からV4へのスパイク結合抗体の増加を伴う既往抗体応答が検出されました(図S8)。
Consistent with our previous findings, IgG4 levels were generally higher in individuals having received three compared to two mRNA vaccinations.
以前の調査結果と一致して、IgG4レベルは、2回のmRNAワクチン接種と比較して、3回受けた個人の方が一般的に高かった。
Interestingly, in the cohort that had two mRNA vaccinations before breakthrough infections, only three individuals developed IgG4 antibodies that were above the lower limit of quantification.
興味深いことに、ブレークスルー感染の前に 2 回の mRNA ワクチン接種を受けたコホートでは、3 人だけが定量下限を超える IgG4 抗体を発症しました。
These three individuals experienced the infection with the largest time difference to the last vaccination, at 95, 201 or 257 days after the second vaccination, while in the other nine patients the infection took place between 25 and 78 days after the second mRNA shot.
これらの 3 人は、2 回目のワクチン接種から 95 日、201 日、または 257 日後に、最後のワクチン接種までの最大の時間差で感染を経験しましたが、他の 9 人の患者では、2 回目の mRNA 注射の 25 日から 78 日後に感染が起こりました。
This supports the hypothesis that the switch to IgG4 is a consequence of ongoing GC maturation and that it takes several months until IgG4-switched memory B cells appear.
これは、IgG4 への切り替えが進行中の GC 成熟の結果であり、IgG4 に切り替えられた記憶 B 細胞が現れるまでに数か月かかるという仮説を支持しています。
DISCUSSION
In the present study we longitudinally tracked the antibody response in volunteers vaccinated with two or three doses of Comirnaty for a period of at least 8 months after the first vaccination.
本研究では、最初のワクチン接種後少なくとも 8 か月間、Comirnaty を 2 回または 3 回接種したボランティアの抗体反応を縦断的に追跡しました。
We found an mRNA vaccine-driven expansion of memory B cells expressing IgG4.
IgG4 を発現するメモリー B 細胞の mRNA ワクチンによる増殖が見られました。
We detected spike-specific IgG4 antibodies in about half of the serum samples collected five to seven months after the second immunization, all of which did not show any IgG4 at earlier time points.
2 回目の免疫から 5 ~ 7 か月後に採取した血清サンプルの約半分で、スパイク特異的な IgG4 抗体が検出されました。
For all other IgG subclasses, a decline was seen in the same period.
他のすべての IgG サブクラスでは、同じ期間に減少が見られました。
Moreover, after the third immunization, IgG4 levels sharply increased and became detectable in almost all vaccinees.
さらに、3 回目の免疫後、IgG4 レベルは急激に増加し、ほとんどすべてのワクチン接種者で検出可能になりました。
In line with the proposed ongoing GC reaction, the appearance of IgG4 antibodies might be a consequence of consecutive events of CSR and the maturation of IgG4-switched memory B cells.
提案されている進行中のGC反応に沿って、IgG4抗体の出現は、CSRの連続イベントとIgG4スイッチ記憶B細胞の成熟の結果である可能性があります。
IgG3 antibodies were less efficiently boosted and did not reach the levels seen after the second dose.
IgG3 抗体のブースト効率は低く、2 回目の投与後に見られるレベルには達しませんでした。
Considering the order of the four γ heavy chain genes (γ3-γ1-γ2-γ4) within the immunoglobulin gene complex on chromosome 14, this would support the hypothesis of consecutive CSR from proximal IgG3 to distal IgG4.
染色体 14 上の免疫グロブリン遺伝子複合体内の 4 つの γ 重鎖遺伝子 (γ3-γ1-γ2-γ4) の順序を考慮すると、これは近位 IgG3 から遠位 IgG4 までの連続した CSR の仮説を支持します。
Interestingly, it is reported for the adult immune repertoire that CSR towards IgG2 or IgG4 is more frequently occurring from IgG1 B cells than from IgM/IgD cells.
興味深いことに、成体免疫レパートリーでは、IgG2 または IgG4 に対する CSR が IgM/IgD 細胞よりも IgG1 B 細胞からより頻繁に発生することが報告されています。
When we isolated spike-specific memory B cells from vaccinees 210 days after the second vaccination as well as ten days and 5 months after the third vaccination, we confirmed by flow cytometry and single-cell sequencing the presence of substantial numbers of spike-reactive, IgG4 switched B cells, whereas IgG3-positive clones were hardly detectable.
2回目のワクチン接種から210日後、および3回目のワクチン接種から10日と5か月後にワクチン接種者からスパイク特異的記憶B細胞を分離したところ、フローサイトメトリーと単一細胞配列決定により、かなりの数のスパイク反応性 IgG4 スイッチ B 細胞の存在が確認されましたが、IgG3 陽性クローンはほとんど検出されませんでした。
We cannot formally rule out de novo class-switching towards IgG4 immediately after booster vaccination.
ブースターワクチン接種直後の IgG4 への de novo クラススイッチングを正式に除外することはできません。
However, the presence of IgG4 antibodies in the sera at that time point, together with the rapid rise of IgG anti-spike serum antibodies, supports the idea of a reactivation of already present IgG4 memory B cells through the booster immunization.
しかし、その時点での血清中の IgG4 抗体の存在は、IgG 抗スパイク血清抗体の急速な上昇とともに、追加免疫による既存の IgG4 記憶 B 細胞の再活性化の考えを支持します。
In a cohort of breakthrough infections, the anamnestic IgG4 antibody response correlated with the time interval between immunization and infection.
ブレイクスルー感染症のコホートでは、既往の IgG4 抗体応答は、予防接種と感染の間の時間間隔と相関していました。
Individuals having experienced a breakthrough infection within the first 70 days after the second vaccination did not have substantial serum levels of anti-spike IgG4 at their first visit, which also did not significantly increase during the following observation period.
2 回目のワクチン接種後 70 日以内にブレークスルー感染を経験した個人は、最初の来院時にアンチスパイク IgG4 の実質的な血清レベルを持っていませんでした。これは、次の観察期間中にも大幅に増加しませんでした。
In contrast, anamnestic IgG4 responses were seen when breakthrough infections occurred later than 3 months after the second immunization, and were robustly detectable when the study participants had been vaccinated three times before infection.
対照的に、既往性 IgG4 応答は、2 回目の予防接種後 3 か月以降にブレークスルー感染が発生した場合に見られ、研究参加者が感染前に 3 回ワクチン接種を受けていた場合に確実に検出可能でした。
Although the number of subjects studied was limited and we did not stratify for potential confounding factors (e.g., the initial viral load, severity of disease or the VOC causing the infection), the presented data are consistent with the hypothesis of a slowly developing pool of IgG4-switched memory B cells after two doses of mRNA vaccines.
研究された被験者の数は限られており、潜在的な交絡因子(初期のウイルス量、疾患の重症度、感染を引き起こすVOCなど)について層別化はしていませんが、 提示されたデータは、mRNAワクチンを2回投与した後、ゆっくりと成長するIgG4スイッチメモリーB細胞のプールの仮説と一致しています。
Furthermore, we observed significantly higher IgG4 levels after two doses of Comirnaty mRNA vaccine compared to a heterologous immunization regimen with a primary Vaxzevria vaccination followed by one dose of Comirnaty, although the total anti-spike IgG response was comparable.
さらに、Vaxzevria の初回ワクチン接種に続いて Comirnaty を 1 回接種する異種免疫レジメンと比較して、Comirnaty mRNA ワクチンを 2 回接種した後に、有意に高い IgG4 レベルが観察されました。ただし、総アンチスパイク IgG 応答は同等でした。
This argues against the hypothesis that repeated exposure to the spike protein itself triggers the unusual IgG4 response.
これは、スパイクタンパク質自体への反復暴露が異常な IgG4 応答を引き起こすという仮説に反するものです。
It is currently not clear whether or to what extent the Comirnaty mRNA vaccination or the short interval of immunizations are responsible for the observed long-lasting GC reactions, but a prolonged presence of vaccine mRNA or antigen in the lymph node might be a potential explanation.
Comirnaty mRNAワクチン接種または短い間隔の免疫が、観察された長期にわたるGC反応の原因であるかどうか、またはどの程度の範囲であるかは現在明らかではありません。 しかし、リンパ節にワクチンのmRNAまたは抗原が長期間存在することは、潜在的な説明かもしれません。
Furthermore, a robust and persistent T follicular helper cell (TFH) response for up to six months after mRNA vaccination has been described in draining lymph nodes, which might be involved in the regulation of CSR by recurrent interactions of GC B cells with TFH cells.
さらに、mRNA ワクチン接種後最大 6 か月間の強力で持続的な T 濾胞性ヘルパー細胞 (TFH) 応答が、流出領域のリンパ節で報告されています。 これは、GC B細胞とTFH細胞との反復的な相互作用によるCSRの調節に関与している可能性があります。
Of note, our study was restricted to vaccinees receiving the Comirnaty vaccine.
注目すべきは、私たちの研究はComirnatyワクチンを受けているワクチン接種者に限定されていたことです。
Since the quantities and the functional profile of spike-specific antibodies induced by Comirnaty and mRNA-1273 have been reported to be slightly different, it will be interesting to analyze whether repeated vaccination with mRNA-1273 induces a similar switch to non-inflammatory IgG subclasses.
Comirnaty と mRNA-1273 によって誘導されるスパイク特異的抗体の量と機能プロファイルはわずかに異なることが報告されているため、mRNA-1273 による反復ワクチン接種が非炎症性 IgG サブクラスへの同様の切り替えを誘導するかどうかを分析することは興味深いでしょう。
Independent of the underlying mechanism, the induction of antiviral IgG4 antibodies is a phenomenon infrequently described and raises important questions about its functional consequences.
根底にあるメカニズムとは無関係に、抗ウイルス IgG4 抗体の誘導はめったに説明されない現象であり、その機能的結果について重要な問題を引き起こします。
Neutralizing antibodies preventing the initial binding of the viral particle to its specific cellular receptor are considered to be the most protective measure against SARS-CoV2 infections.
ウイルス粒子がその特定の細胞受容体に最初に結合するのを防ぐ中和抗体は、SARS-CoV2 感染に対する最も防御的な手段であると考えられています。
This competitive binding is mediated by the variable antigen-binding site and does not rely on the constant part of the Fc fragment.
この競合的結合は、可変抗原結合部位によって媒介され、Fc フラグメントの定常部分には依存しません。
Indeed, in the present study we confirmed previous reports on improved avidity and neutralizing potential of vaccine-induced antibodies after the third vaccination.
実際、本研究では、3回目のワクチン接種後のワクチン誘導抗体のアビディティの改善と中和の可能性に関する以前の報告を確認しました。
However, the large number of breakthrough infections caused by the Omicron variant indicates that current vaccination regimens do not confer sterilizing protection.
しかし、Omicron バリアントによって引き起こされる多数のブレークスルー感染は、現在のワクチン接種レジメンが滅菌保護を提供しないことを示しています。
Once infection is established, Fc-mediated effector functions become more relevant to clear viral infections.
感染が確立されると、Fc を介したエフェクター機能は、ウイルス感染の除去により関連するようになります。
Systemic serology approaches have even revealed that different antibody functions can contribute to various degrees to protection dependent on the viral pathogen, as shown for influenza viruses, RSV or SARS-CoV-2.
全身血清学アプローチは、インフルエンザウイルス、RSV、またはSARS-CoV-2で示されているように、さまざまな抗体機能がウイルス病原体に応じてさまざまな程度の保護に寄与できることさえ明らかにしました。
Passive immunization studies in animal models have further demonstrated that the degree of protection achieved by the application of monoclonal antibodies depends on their IgG subclass.
動物モデルにおける受動免疫の研究は、モノクローナル抗体の適用によって達成される保護の程度がそれらの IgG サブクラスに依存することをさらに実証しました。
In this regard, IgG4 is considered as an anti-inflammatory IgG with low potential to mediate Fc-dependent effector function such as ADCC or ADCP.
この点で、IgG4 は、ADCC や ADCP などの Fc 依存性エフェクター機能を媒介する可能性が低い抗炎症性 IgG と見なされます。
High levels of antigen-specific IgG4 have been reported to correlate with successful allergen-specific immunotherapy by blocking IgE-mediated effects.
高レベルの抗原特異的 IgG4 は、IgE を介した効果をブロックすることにより、アレルゲン特異的免疫療法の成功と相関することが報告されています。
In addition, increasing levels of bee venom-specific IgG4 have been detected in beekeepers over several beekeeping seasons and finally even became the dominant IgG subclass for the specific antigen, i.e. phospholipase A (PLA).
さらに、ハチ毒特異的 IgG4 のレベルの増加が、数回の養蜂シーズンにわたって養蜂家で検出されており、最終的には特定の抗原、すなわちホスホリパーゼ A (PLA) の主要な IgG サブクラスにさえなりました。
Interestingly, the IgG4 response is characterized by a very slow kinetics and takes several months to appear, whereas PLA-specific IgG1 antibodies were already measurable at earlier time points, which resembles our findings in this study.
興味深いことに、IgG4 応答は速度が非常に遅いという特徴があり、現れるまでに数か月かかりますが、PLA 特異的 IgG1 抗体は以前の時点ですでに測定可能であり、この研究での発見と似ています。
Furthermore, an increase in PLA-specific IgG4-switched B cells was observed in patients undergoing specific immunotherapies (SIT).
さらに、特異的免疫療法(SIT)を受けている患者では、PLA特異的IgG4スイッチB細胞の増加が観察されました。
So far, only few studies on the role of vaccine-induced IgG4 responses against infectious diseases are available.
これまでのところ、感染症に対するワクチン誘導 IgG4 応答の役割に関する研究はほとんどありません。
In the field of HIV vaccine development, repeated protein immunization in the trial VAX003 led to higher levels of HIV gp120-specific IgG2 and IgG4, whereas a prime-boost immunization with a canarypox vector (ALVAC) and the same protein vaccine in the RV144 trial resulted in higher HIV-specific IgG3 responses correlating with partial protection against HIV.
HIV ワクチン開発の分野では、試験 VAX003 でのタンパク質免疫の繰り返しにより、HIV gp120 特異的 IgG2 および IgG4 のレベルが高くなりました。一方、カナリア痘ベクター (ALVAC) と RV144 試験での同じタンパク質ワクチンによるプライムブースト免疫は、HIV に対する部分的な防御と相関する、より高い HIV 特異的 IgG3 応答をもたらしました。
Furthermore, the vaccine-elicited IgG3 antibodies enhanced effector functions as ADCC and ADCP, but vaccine-induced IgG4 inhibited those functions.
さらに、ワクチンによって誘発された IgG3 抗体は、ADCC および ADCP としてのエフェクター機能を強化しましたが、ワクチンによって誘発された IgG4 はこれらの機能を阻害しました。
With respect to the control of viral infections, little is known regarding virus-specific IgG4 antibody responses.
ウイルス感染の制御に関しては、ウイルス特異的な IgG4 抗体応答に関してはほとんど知られていません。
As shown here for RSV-specific IgG responses, IgG4 is hardly induced by acute respiratory viral infections even after repeated exposure.
RSV 特異的 IgG 応答についてここに示されているように、IgG4 は急性呼吸器ウイルス感染によって、繰り返し曝露された後でもほとんど誘導されません。
Although measles-specific IgG4 antibodies can be induced by natural infection, even chronic viral infections like HCMV do not trigger significant specific IgG4 antibodies.
麻疹特異的 IgG4 抗体は自然感染によって誘発される可能性がありますが、HCMV のような慢性的なウイルス感染でさえ、有意な特異的 IgG4 抗体を誘発しません。
There are very few reports on the induction of IgG4 after natural infection with SARS-CoV-2.
SARS-CoV-2 による自然感染後の IgG4 の誘導に関する報告はほとんどありません。
The dominant subclasses were mostly IgG1 and IgG3.
支配的なサブクラスは、主に IgG1 と IgG3 でした。
Nevertheless, a Brazilian study during the early phase of the pandemic correlated an early onset and high levels of anti-spike IgG4 antibodies with a more severe COVID-19 progression after SARS-CoV-2 infection, which might indicate a less effective antibody response.
それにもかかわらず、パンデミックの初期段階におけるブラジルの研究では、SARS-CoV-2 感染後のより深刻な COVID-19 の進行と、早期発症および高レベルの抗スパイク IgG4 抗体との相関関係がありました。 これは、抗体反応の効果が低いことを示している可能性があります。
Additionally, Della-Torre et al. reported on a significant association of high IgG4/IgG1 ratios with poor disease outcome.
さらに、Della-Torre らは、高い IgG4/IgG1 比と不良な疾患転帰との有意な関連性について報告しました。
However, in the case of a primary immune response, the causality is difficult to address, since it is also possible that a more severe infection leads to an IgG4 response and not vice versa.
しかし、一次免疫応答の場合、より深刻な感染が IgG4 応答を引き起こし、その逆ではない可能性があるため、因果関係に対処することは困難です。
In our study, antibody-mediated phagocytic activity and complement deposition were reduced in sera after the third immunization, in parallel to higher proportions of anti-spike IgG4 antibodies.
私たちの研究では、抗スパイク IgG4 抗体の割合が高くなるのと並行して、抗体を介した食作用活性と補体沈着が 3 回目の免疫後の血清で減少しました。
However, how these changes affect subsequent virus infections remains unclear.
ただし、これらの変更がその後のウイルス感染にどのように影響するかは不明のままです。
Since Fc-mediated effector function could be critical for viral clearance, an increase in IgG4 subclasses might result in longer viral persistence in case of infection.
Fc を介したエフェクター機能はウイルスのクリアランスに重要である可能性があるため、IgG4 サブクラスの増加は、感染の場合にウイルスの持続性を高める可能性があります。
However, it is also conceivable that non-inflammatory Fc-mediated effector functions reduce immunopathology while virus is still being neutralized via high-avidity antibody variable regions.
しかし、非炎症性の Fc を介したエフェクター機能が免疫病理学を低下させる一方で、ウイルスは依然として高アビディティ抗体可変領域を介して中和されていることも考えられます。
In a cohort of vaccinees with breakthrough infections, we did not obtain any evidence for an alteration of disease severity, which was mild in almost all of our cases.
ブレークスルー感染症のワクチン接種者のコホートでは、疾患の重症度の変化に関する証拠は得られませんでした。ほとんどすべてのケースで軽度でした。
Larger cohorts with differential disease severities will be needed to address this aspect in the future.
将来的にこの側面に対処するには、疾患の重症度が異なる大規模なコホートが必要になります。
However, our results clearly demonstrate that a subsequent infection can further boost IgG4 antibody levels, with IgG4 becoming the most dominant among all anti-spike IgG subclasses in some individuals.
しかし、我々の結果は、その後の感染がIgG4抗体レベルをさらに上昇させ、一部の個人ではIgG4がすべてのアンチスパイクIgGサブクラスの中で最も優勢になることを明確に示しています。
In summary, our study demonstrates an mRNA vaccine-induced antiviral IgG4 antibody response appearing late after secondary immunization.
要約すると、私たちの研究は、mRNA ワクチンによる抗ウイルス IgG4 抗体応答が、二次免疫後の後期に現れることを示しています。
Further investigations are needed to clarify the precise immunological mechanisms driving this response and to evaluate whether an IgG4-driven antibody response affects subsequent viral infections and booster vaccinations.
この応答を駆動する正確な免疫学的メカニズムを明らかにし、IgG4 駆動型抗体応答がその後のウイルス感染とブースターワクチン接種に影響を与えるかどうかを評価するには、さらなる調査が必要です。
This is not only relevant for potential future vaccine campaigns against SARS-CoV-2, but also for new mRNA-based vaccine developments against other pathogens.
これは、SARS-CoV-2 に対する潜在的な将来のワクチン キャンペーンだけでなく、他の病原体に対する新しい mRNA ベースのワクチンの開発にも関連しています。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
