HPVの病原性(pathogenicity)
§§ はじめに §§
まず、パピローマウイルスがどんなウイルスであるか。その病原性の発揮の仕方の面から話してみよう🐰
パピローマウイルス(Papillomavirus, PV)は広く脊椎動物をホストとするウイルス。構造的には、エンベロープ(脂質による膜構造)をもたず、カプシド蛋白質からなる正二十面体のウイルス粒子(直径55nm)とその中に二本鎖環状DNA (8000塩基対)をゲノムにもつ、比較的小さくて単純な構成をしているウイルスです。
脊椎動物の重層扁平上皮(皮膚や粘膜)に感染するウイルスで、2022年6月現在674種類のPVが同定・報告されていて、そのうち448種類がヒトから発見されたHPVになります(番号がついているのはHPV 229まで)。PVはそのウイルスL1遺伝子配列の分子系統解析から49属(genus)に分類され,そのうち5 属にヒトに感染するHPVが含まれます(図1)。 PVの特徴の一つとして,そのDNA配列上の多様性(型)に対応した,型特異的な感染動物(種)・感染部位嗜好性(トロピズム)や発症病変の肉眼的・病理組織学的変化を示すということがあります(型特異的CPE、HPV type-specific cytopathic/cytopathogenic effect)。
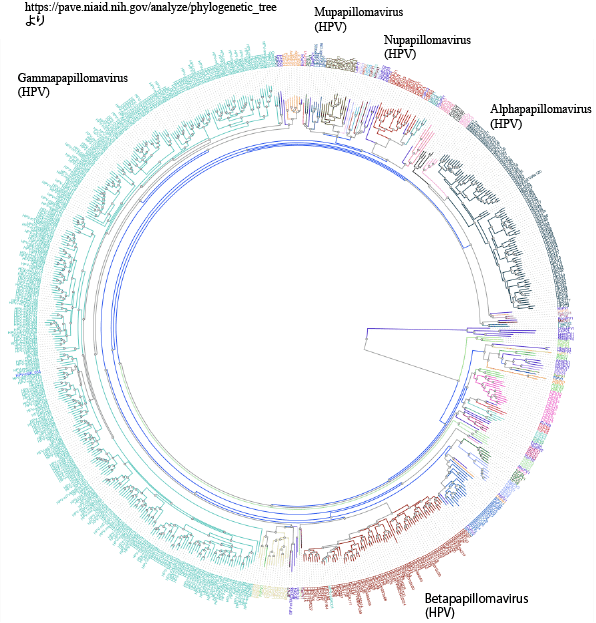
DNA 配列の近縁関係で現在49 属に分類される。その中に(Alpha, Beta, Gamma, Mu, Nu)5属のヒトパピローマウイルス(HPV)が分散している。ミルメシア(足底疣贅)の原因ウイルスであるHPV1(Mupapillomavirus)は他属のHPV よりもウサギ🐰のパピローマウイルス(Kappapapillomavirus)と近い関係となる。これは,ウサギとヒトの共通祖先において将来Mu 属のPVに進化するPV とAlpha 属(ヒトに病原性を有する多くのHPVが属する。子宮頸がんやコンジローマの原因ウイルスはこの属)に進化するPV はすでに分岐していたことを示す。生物種の多様化・進化に加えて,種内におけるニッチの多様化・進化に伴ってPV が進化してきたことを端的に示している。
それにしても、我が(?)Gammapapillomavirusの勢力は圧倒的ではないか。健康な免疫正常な集団でイボを形成するのは極々一部のみ。あとは何をしているのか?目に見えないようなマイクロリージョンを形成して、知らない間にヒトの間で繁栄しているのだろうが。
言い換えると、PVは基本的に種を超えては感染せず,それぞれのHPVはヒトに尋常性疣贅,扁平疣贅,尖圭コンジローマや子宮頸がん(異形成)など,型ごとに異なる特徴(発症分布,感染標的細胞,臨床・病理組織学的形態変化や転帰など)を示す感染病変を生じるということです。
この『型特異的に異なる病原性をもつこと』は非常に重要な考えかた・性質で,近年導入された子宮頸がんにおける高リスクHPVの遺伝子検査や,HPV16/18型に対するがん予防ワクチンの有効性の理論的背景にあります。
(特定の型に感染していることがわかれば、臨床的表現系である発癌リスクの高いことがわかる(HPV検査の意味)。ワクチンによって特定の型に感染することを防ぐと発がんリスクが減少する。特定の型だけワクチンで相手にすればいい理由)
§§ パピローマウイルスの「多様性」と「型特異的性質」の意味 §§
最初の祖PV は,上皮形態の進化に伴う新しいニッチ(感染することできる環境、PVにとっては重層扁平上皮)の出現に伴って進化・出現したと考えられます。最近になり魚類にもPVが発見されたことから、現在ヒトをはじめとするさまざまな動物種に感染するPVの起源を,少なくとも4 億年以上前の共通祖先にまで遡ることができると考えられます。最初に出現した、動物の共通祖に感染していた祖PVは,種の進化だけでなく体毛や汗腺の出現などニッチの進化に応じて、現在の多様な姿にまで進化を遂げました(型特異的感染動物・感染標的細胞特異性を持つことの説明)。(図2)
これは、各PVがそれぞれの宿主(動物種・ニッチとしての体の中での部位)として選択した上皮が異なる生物学を持つということです。皮膚粘膜組織とその付属器は上皮組織としての括りは同じでも、異なる生物学・分子生物学をもちます。その異なる組織を宿主として選択したPVはそれぞれ異なる分子生物学(ウイルスとしての仕組みくらいの意味)を持つということです。毛に感染するPVと汗腺に感染するPVでは異なるシステムを持たなければ成り立ちません。『PVの特徴の一つとして,そのDNA配列上の多様性(型)に対応した,型特異的な感染動物(種)・感染部位嗜好性(トロピズム)や発症病変の肉眼的・病理組織学的変化を示す』ことのウイルス進化上の意味です。このように種やニッチの進化に対応する形で数億年かけて進化してきたPVが簡単に種を超えて感染したり、突然変異をして異なる病原性を獲得したりすることがないのが想像つくでしょう。PVの進化・変異というのはもっとゆっくりとしたプロセスになります。また、宿主の分子生物学の違いが、変異や病原性の変化が急激に起こることに対する障壁でもあります。別のことばで表現すると、あまりにも宿主(の分子生物学)に適応する形で進化してきたために、宿主の進化スピードと同じ程度でしか進化・変化できないということです(実際2〜5倍の進化速度とされています)。

パピローマウイルスは一般に種を超えては感染しない。魚類においてPV が発見されていることを考えると,最初のPVの起源は少なくともヒトと魚類の共通祖先が分岐した時点まで遡ることができるだろう(★)。我々現生人類が東アフリカを出発した時、その集団内には現在存在するのと同じだけのHPVが存在していたと考えていい。その足の裏にはミルメシアがあった。
両生類を標的とするPVは存在すると考え てよい(トランスクリプトーム上は存在が示唆されている、誰がみつけるかな?)。
PV が重層扁平上皮をニッチとして進化したことを考えると円口類(ヤツメウナギ)や頭索類(ナメクジウオ)にPV は存在すると考えるのは自然だが。
また,ウイルス生活環(virus life cycle)の様式もさまざまで「増殖性病変を形成して大量のウイルスを産生し,比較的短期間のうちにホストの免疫により排除されるもの」(皮膚科領域において治療対象となるミルメシアやコンジローマのようなもの)から,「宿主の免疫的排除を避けながら,無症候性に長期間にわたって比較的少量のウイルスを産生するもの」(子宮頸部や陰茎などの病変はこちらの性質がつよい)など,その戦略はさまざまです。このように,性質の異なる上皮を自らのニッチ(子孫ウイルスを産生するのに適応した微小環境)として異なった戦略を進化させた結果の現れが,PVの「多様性」と「型特異的性質」になります。
(棲息環境に適応した性質の異なるさまざまな異なる型のHPVがいるってこと。生き物の多様性が生まれたのと考え方はまったく同じ、おもしろいよね)
§§ 重層扁平上皮の分化と連動したHPVの生活環 §§
HPV 各型が“異なる生物学”を有するウイルスであることに注目してきましたが,同時に、基本的な大枠として多くのHPVの間で共通しているのものを見てみましょう。まずあげられるものに,重層扁平上皮を共通の感染標的とし,その生活環が重層扁平上皮の分化(角化)に連動しているという特徴があります(図3)。

PVの特徴として,その生活環が上皮細胞の分化と連動していることがあげられる。HPVは 短くても数カ月、長くは生涯感染が持続すると考えられることから,基底層にある組織幹細胞様細胞が感染の標的となる。基底層では感染細胞の分裂に伴ってウイルスゲノムが娘細胞に複製・分配され感染を維持される。感染細胞が基底層から離れると, 細胞は分化(角化)を開始する。分化をトリガーとしてウイルスゲノムの増幅(100 万倍以 上)と続いてのウイルス粒子の産生が行われる。基底層にある感染細胞ではウイルス外殻蛋白質の産生やウイルス粒子の産生はない(現行のワクチンが感染細胞の排除に効かない理由)。現行のワクチンの誘導する獲得免疫の対象外。(Viruses 7: 3863-3890, 2015. より改変)
HPV は短いものでも数カ月,長いものは数年から一生涯にわたって感染病変を維持し続けることから(潜伏持続感染はここでは考えない),その感染の標的は上皮基底層にある組織幹細胞的性質をもつ細胞だと考えられています(寿命が長い必要があると言うこと)。また,汗腺・毛包や子宮頸部においては特定の組織幹細胞がHPV の感染標的になっていると想定されています(ニッチ・感染棲息環境の違い)。一方,毛包間表皮の基底層における感染標的たる特定の組織幹細胞の存在についてはよくわかっていなくて,また,重層扁平上皮の生物学を説明するのに必ずしも必要ではありません(特定の幹細胞を想定する必要がないくらいの意味)。むしろ、HPV 感染症においてはHPV感染が感染基底細胞の寿命を延ばし,組織幹細胞的性質を付与する可能性が指摘されています。感染細胞の寿命が伸びれば長く感染を維持でき、多くの子孫ウイルスを産生するチャンスがあるということです。
HPVは重層扁平上皮に感染すると、基底層にある感染細胞の分裂に応じて,ウイルスゲノムを必要最小限のウイルス蛋白質の発現で複製しながら感染を維持しつつ,いったん細胞が基底層を離れ分化が始まると,それをきっかけにウイルスゲノムの増幅と子孫ウイルス粒子の産生を活発に行い始めます。このような細胞の分化に連動した複雑な生活環を,HPV は比較的少数のウイルス遺伝子(図4)と生活環の各ステージに応じた精密な発現制御によって行っています。
(別の言い方をすると、HPVは遺伝子全長8000塩基対、7−8の遺伝子導入実験を自然に行なってくれているわけです。しかも、400種類も違う遺伝子セットを用いて。各HPV間の違いは必ず分子生物学的な意味があるはずで、HPV感染症をモデルとした、皮膚・粘膜組織の生物学の理解というのが純粋な科学的興味から見た研究対象とした場合のHPVの面白さになります。一方で、がんを起こすという点は、研究予算を投入すると言う意味では一番大きなものだった。一定の成果が得られ、基本的にHPV感染症はワクチンによって制御できるとわかった今、HPVの基礎研究の世界は斜陽の時代に入ったとも言えます。そんなことないぞと踏ん張っては見ますが、さて🐰)

LCR(long control region)はL1遺伝子の終わりからE6遺伝子始まりまでの遺伝子をコードしない領域で,複製開始点および ウイルス遺伝子発現のプロモーター・エンハンサー領域を含む。
ウイルス遺伝子はそのコードする蛋白質の性質でコア遺伝子と アクセサリー遺伝子に分類される。
コア遺伝子はウイルスゲノムの複製・増幅(E1,E2)およびウイルス粒子の産生(L1,L2)と いった,ウイルス生活環における基本的な機能を担う蛋白質をコードする。すべてのパピローマウイルスにおいて保存されてり,機能も共通する。E4 遺伝子はE2 遺伝子に重複してコードされている。ウイルス生活環後期に大量に発現し,ウイルス粒子の放出や伝播に関与す ると考えられているが,機能はよくわかっていない。魚類のPV(SaPV)ではE1,E2,L1,L2のみコードしており,E4 は保存され ていない。
アクセサリー遺伝子はウイルスが感染部位において生活環を全うし子孫ウイルス粒子を産生するために細胞環境をコ ントロールする。感染細胞の維持・増殖や分化した細胞内でのウイルスゲノム増幅のサポートおよび宿主の免疫能からの回避などを担う。臨床的な病原性はアクセサリー遺伝子の発現と機能による。とくに,高リスク粘膜型のE6 ,E7 はいわゆるウイルスがん遺伝子であり,その基底層における異常発現が子宮頸がん等のHPV による発がんの原因となる。(Viruses 7: 3863-3890, 2015.より改変)
§§ HPV の現行分類法とその問題点 §§
遺伝子とその遺伝子のコードする蛋白質の機能およびその発現制御の違いが,HPV の病原性の違いを決定しており,その違いは根本的にはDNA配列の違いに帰せられるはずです。実際,特定の病変から特定のHPV 型が検出される事実もって,HPV の遺伝子型と病原性の対応関係を軸にHPV 感染症の理解は進みました(ハイリスクHPVとローリスクHPVの対比を見よ)。現在HPV(およびPV)の分類は単純なDNA配列(とくにL1 ウイルスカプシド遺伝子)の比較によって行われています(図1)。L1 遺伝子の10%以上の違いをもつものを「型」と分類し,いくつかの「型」は分子遺伝学的近縁関係で,「種」および「属」にまとめられます。単純なDNA 配列を基にした分類ですが,予想されるとおり病原性との対応関係をある程度明解に説明できます.たとえば,Alphapapillomavirus 9(種)はHPV16 , 31,33 , 35 , 52 , 58 および67(型)を含み,このうちHPV67 を除くものは疫学的にヒトに対して発がん性があると示されています。しかしながら一方で,それぞれの発がん性には大きな違いがあり,HPV16 の感染と他の型の感染とを同列に扱うのには無理があります。加えて,HPV16 感染自体,多くが宿主の免疫能によって排除され,がん化するのはごく一部にすぎません。また,感染部位(感染細胞)によってもその発がん性には大きな違いがあり(後述),子宮頸部感染(子宮頸部異形成)と皮膚感染(ボーエン様丘疹症)とでは,同じHPV16であっても異なる病原性と生物学をもつと考えるべきです。宿主が変わったために、感染の性質が変わってしまったと解釈できます。
また近年のシークエンス技術の進歩とそれに伴うデータの蓄積は型内の系統(lineage、HPV16A-Dなど)やサブ系統(HPV16D1-4など)ごとに病原性(ハイリスクHPVのがんリスクの違い)が指摘され、またその病原性の違いがホストの違い(地域的な人種の違い、遺伝的にやや異なる集団くらいの意味)によっても影響を受けている可能性の示唆など、その正確な理解への道のりは遠いと言えます。
理想的には,ウイルスの分類は単純なDNA配列の違いだけではなく,系統発生,ウイルス遺伝子および蛋白質の構成,生物学および病原性を統合したものであるべきですが,HPV においては,研究の進んでいる一部の型を除いてはウイルスゲノムのDNA 配列以外は情報に乏しく,生物学的評価はほとんどなされていないのが現状です。
§§ HPV にみられる顕性/ 不顕性感染の両局面 §§
最近のPCR(polymerase chain reaction)・シークエンス技術の進歩に伴って,多くの新型を含むHPV-DNA が病変からだけでなく,免疫能が正常な一般集団のサンプル(皮膚・粘膜表面,毛包やうがい液)より検出されることがわかってきました。おそらく肉眼では見逃してしまう程度の微小病変もしくは潜伏感染に由来するDNA と考えられますが,このことは,いわゆる治療対象となるような増殖性病変を伴う感染はHPV 感染のなかで極一部にすぎないことを示しています。
新たに発見されるHPVにBeta やGamma属が多いことから(図1),これらの属のHPV 感染の本態は無症候性であると考えらます。もちろん,型特異的CPE の原則どおり,型による顕性・不顕性感染の傾向はありますが,高リスク型を含むAlpha 属HPV も正常皮膚・粘膜からのサンプルに(口腔うがい液)おいても検出されることから,HPV には基本的に顕性感染と不顕性感染の両局面があると考えるほうが自然です。顕性感染の自然消褪から潜伏感染への移行,免疫能抑制に伴う再活性化がOcPV(ウサギパピローマウイルス)において示されていることや,子宮頸部感染においても潜伏感染の存在が指摘されることも,このことを支持しています。
病原性(pathogenicity)は, 宿主と病原体(pathogen) 間にある“host-pathogen interaction(宿主病原体相互作用)”の中で決まります。HPV の病原性は,遺伝子型や感染標的細胞の種類(トロピズム)のほか,宿主の遺伝的背景や免疫能によっても修飾されます。以下,いくつかの例を示しながらHPV の病原性を規定する因子や発症の意味について考えてみましょう🐰
1) 高リスク粘膜型HPV 感染(子宮頸がん)
①ウイルス遺伝子の機能の違い
がんが人類の健康に与えるインパクトからも,HPV 研究が高リスク粘膜型の発がん性を軸に進んだのは自然だと言えます。まず,一部のHPVが子宮頸がんを生じさせる理由として注目されたのが,ウイルス遺伝子のコードする蛋白質(特にアクセサリー蛋白質)の機能の差です。
基本的にがん化したHPV 感染病変で発現するウイルス遺伝子はE6 とE7 で,がん細胞の増殖自体E6 とE7 に依存していることがわかっています(oncogene addiction)。がん化の観点からいうと,高リスク粘膜型HPV のE6 ,E7 は,低リスクHPV のE6 ,E7にはないさまざまな機能をもつことがわかっています(図5)。細胞の不死化,異常増殖,アポトーシスの抑制,分化抑制,免疫応答抑制,遺伝子変異の促進や蓄積の許容など,高リスク粘膜型HPV のE6 ,E7 は発現さえすればがん化に必要な多くのステップをこなすことができます。一方,低リスクHPV のE6 ,E7 にはそのような機能がないか,もしくは不十分な形でしか持たないことが示されてきました。この機能の差は,なぜ高リスクHPV ががんを生じさせて低リスクHPV が生じさせさないかをよく説明しています。

ハイリスクHPVが子宮頸部に(持続)感染すると、免疫による制御の程度に応じて色々な感染病変を成立させる。その中で、子孫ウイルスの産生を伴う正常の感染病変(軽度異形成に相当する)と子孫ウイルスの産生を伴わない不全感染(高度異形成に相当する)が異形成の罹患・発症として認知されます。高度異形成では、ウイルス(がん)遺伝子の発現制御に異常があり過剰に発現している状態であり、感染細胞は細胞の不死化・異常増殖・アポトーシスの抑制・分化抑制・免疫応答の抑制・遺伝子異常の促進・許容と発癌に必要とされる様々な性質を獲得してしまいます。このような、高度異形成を形成する細胞から一定の確率でがんが発症することがあるわけです。
しかし,低リスクHPV が,これらのがん化に必要な機能なしにヒトに感染病変を成立させ,むしろ高リスク型以上に繁栄していることを考えると,感染上皮でどのように生活環を成立させ子孫ウイルスを産生するかのメカニズムが,発がんに関する高リスク低リスクとはまた別の問題であることは明らかです。また,がん化した病変は一般に子孫ウイルスの産生を伴わない不全感染(abortive infection, non-productive infection)であることを考えると,がん化すること自体はウイルスにとってメリットがありません 。このことからも,高リスクHPV のもつがん化に有利な諸機能も,がん化のために進化したのではないのは明らかで,ウイルス生活環のなかでの意味を再評価する必要があります(たとえば,“テロメアーゼ活性化能の獲得により,分裂能が低く寿命の短い細胞に感染しても病変を成立させることが可能となった – 特定の細胞で感染が長期間維持され子孫ウイルスを産生できるようになった– ためニッチを広げることができた”とか、特定の蛋白質を分解することが特定の上皮に感染成立するために必要であるとか)。
②ウイルス遺伝子の発現制御の違い
高リスク型HPV 感染といっても,ほぼすべての人が一生に一度は感染するといえるほどありふれたもので,しかもそのほとんどは不顕性か一過性の病変を生じては自然消褪し,がん化するのは一部の持続した感染においてのみになります(図5)。持続感染の過程で,各ウイルス遺伝子の発現がよく制御された子孫ウイルスの産生を伴う“正常な生活環”から,E6 ,E7 のみが異常高発現し子孫ウイルスを産生しなくなる“不全感染”へと移行するとされています。このことについては,持続感染中におこるウイルスゲノムの染色体への組み込みなどによるE6 ,E7 の異常高発現が重要なステップであると考えられています。このようなウイルス遺伝子の異常高発現,不全感染からがん化に至る考え方はHPV に特有のものではなく,アデノウイルス(E1a ,E1b)やポリオーマウイルス(T 抗原)においても動物を用いたモデルで古くから示されています。
③感染細胞の違い
HPV の病原性については、『HPV がどの細胞に感染したか」も重要因子です。「ウイルスは,本来の宿主細胞においてはウイルス遺伝子がタイミングよく発現制御され,子孫ウイルス産生を伴う正常な生活環を完遂しがん化しないが,本来とは異なるタイプの細胞にたまたま感染してしまうと,制御を逸脱したウイルス遺伝子の発現や不全感染を誘導し,がん化につながる」という考えがあります(前述)。HPV においても「感染するとウイルス遺伝子発現異常をおこしやすい特殊な細胞(cuboidal cells, reserve cells) が子宮頸部にあり,がんに進行しやすい不全感染の発生母地になりうるのではないか,そのことがとくに子宮頸部にがんをおこしやすい原因ではないか」と考えられるようになってきています。一言で子宮頸がん・子宮頸部感染病変と言っても、子宮頸部の上皮細胞にたくさん種類があるように、その感染する細胞によって様々な性質の違う感染病変を成立させる。その中で、がんに進みやすいもの・進みにくいものなどの性質の違うものがあるだろう。一つの種類の子宮頸がんとその前がん病変があるわけではないという解釈です。現在の、HPV感染から子宮頸がん発症までの自然史を説明したものは、将来書き換えられるものになるでしょう(図6)。

ほとんどの子宮頸がんは移行帯(transforation zone)に発生する。移行帯はreserve cell として知 られ る特殊な組織幹細胞(紫) によって維持されている。また,扁平円柱上皮境界にcuboidal cells(黄色) という組織幹細胞の存在も指摘されている。これらの細胞は細胞外の環境に よって,円柱上皮にも重層扁平上皮に も分化する。子宮頸膣部では他の重層 扁平上皮と同様の基底層にある上皮幹細胞によって維持されている。これらの感染標的細胞の違いがウイルス遺伝子の発現制御の違いを生むと考えられる。子宮頸膣部(ectocervix)に感染するとウイルス粒子の産生を伴う正常感染になりやすく,がんに進行しにくい。一方, 子宮頸内膜(ndocervix)側に感染すると,ウイルス 粒子の産生を伴わない不全感染をおこしやすく,がんへ進行しやすいと考えられる。
このように,高リスクHPV 感染においても,ウイルス蛋白質の機能に加えて,感染部位(感染細胞)や細胞におけるウイルス遺伝子発現の違い,および表現型の違いは病原性を考慮するうえで重要な因子となっています。
2) 疣贅状表皮発育異常症(epidermodysplasiaverruciformis:EV 症)
一般正常免疫集団において,「無症候性HPV感染」はよくホストの免疫システムによってコントロールされた感染状態を指し,病原性があるとは考えられていません。一方で,そのような感染も免疫不全患者や特殊な遺伝的背景のもとにおいては顕性感染化し,がん化とも関連することがわかっています。
① Beta 属HPV(EV-HPV)感染
EV 症は稀な遺伝性疾患で,とくにBeta 属HPVに対する易感染性を示します。典型的には扁平疣贅様増殖性病変を発症し,日光裸露部を中心に30 ~ 50%ががん化します。臓器移植後など免疫抑制状態にある個人にも同様の病態(acquired EV)が存在することから,Beta 属(や普段は病原性を示しにくい)HPV に対する免疫異常と考えられてきました。また,正常免疫の一般集団において,とくに毛包より高頻度にBeta 属HPVが検出されることから,Beta 属HPV 感染および無症候性病変自体はめずらしいものではなく,通常の宿主においてHPV の感染はよくコントロールされていると考えられています。HPVは皮膚・粘膜の常在ウイルスであると言った時、このようなHPV感染を想定しています。
(Tree Man SyndoromeもこのEV症関連疾患に入るでしょう。一般正常集団において尋常性疣贅のような普通のイボの原因となっているHPV2や4が全身の皮膚で増殖性病変を形成しています。CD28の欠損が同定されています。)
② EV 症の責任遺伝子と機能
EV 症の発症に遺伝的背景のあることは,長くHPV 研究分野の解明すべき重要な研究課題でしたが,近年になりEV 症の75%においてEVER1 およびEVER2 遺伝子のホモ接合体異常が報告されました。EVER1 および2 はtransmembrane channel-like(TMC)6 と8 をコードしており,EV 症患者におけるその異常と角化細胞やリンパ球における亜鉛イオンの代謝異常との関連が報告されています。感染角化細胞に注目すると,細胞の亜鉛濃度の上昇が転写因子の活性化を介してウイルス遺伝子の発現を活性化し,感染の顕性化や持続化,ひいてはがん化を誘導するという仮説が提唱されています。
③ EV 症,Beta 属HPV 感染と免疫
免疫能に関しては,亜鉛イオンの代謝異常に関連して多くの免疫学的異常が報告されているものの,EV 症患者はHPV 以外のpathogensに対する易感染性は示しません。また,正常免疫であってもBeta 属HPV感染はめずらしくない,むしろ,そのような集団において感染・増殖するよう適応していることもあわせて考えると,EV 症がBeta 属HPV に対する「免疫不全」を主体とした病態かどうか自体,いまだ答えられていない問いと言わざるをえません。実際,一般集団の日光裸露部位における発がんにBeta 属HPV の関与が示唆されていることは,紫外線曝露や炎症がウイルス遺伝子の発現を変化させた結果と解釈することも可能です。一方,acquired EV の存在やT 細胞免疫不全とのEV様病態の報告から免疫能全般がBeta 属HPV 感染の制御に関与することは間違いないと考えられます。
いずれにせよEV 症やacquired EV は,宿主側要因によるウイルス遺伝子の発現制御・ウイルス生活環のパターンの変化に伴う病原性の変化(非顕性→顕性→持続→がん化)を考えるうえでモデルとなる例と言えます。
3) 再発性喉頭乳頭腫症(recurrent respiratory papillomatosis:RRP)
EV 症と同様の例を,低リスク粘膜型HPV 感染症にもみることができます。HPV11はHPV6ともにAlphapapillomavirus10 に分類され,外陰部・性器の尖圭コンジローマの原因ウイルスです。子宮頸部悪性腫瘍からも検出されますが,きわめて稀で,一般にはがんの原因になるとは考えられていません。一方RRP は,同じHPV6 やHPV11 の感染によって生じる疾患ですが,治療をしても再発を繰り返すことが多い上に、喉頭という発症部位から放置すると気道閉塞を来すことばかりでなく,高リスク型と同様の発がんとの関連から病態はまったく異なります。他のHPV6 ,11 関連疾患(尖形コンジローマ)と比べて発症頻度が極端に低いこと,その若年性,多発性,治療抵抗性および易再発性から,宿主側の「局所的」な,「特定のHPV(Alphapapillomavirus 10)に対する易感染性」を背景とする病態として捉えることが可能です。主な発生母地である声帯が一種の重層扁平上皮−単層上皮移行帯であることから,子宮頸部の扁平円柱上皮境界(squamocolumnar junction:SCJ)におけるreserve cell 同様,異なる種類の感染標的細胞が存在することも考慮すべきかもしれません。また、若い女性へのHPVワクチン接種の進むオーストラリアにおいて、ワクチン接種された母から生まれた、新生児・乳幼児のRRPの罹患率の減少が報告されています。ワクチンによって母親がHPV6型11型のキャリアであることが減少した結果、母子感染・出産時の産道感染などが減少したことによるのでしょう。一方、ワクチンの集団接種以前においても、母親のHPV6型11型の感染率に比較すると、新生児・乳幼児のRRPの罹患率が二桁以上低いことや、母親の尖圭コンジローマ罹患歴が直接新生児・乳幼児のRRPの罹患につながらないことなど、感染機会があること以上に、感染した側の要素(気道におけるHPV6型11型の感染を制御できるかどうか)がRRPの発症に重要であることが考えられます。
このように,RRP もEV 症と同様の「宿主側要因による,ウイルス遺伝子の発現制御やウイルス生活環のパターンの変化」に伴う病原性の変化の一例としてみることができます。
§§ まとめ §§
ここから先は
¥ 150
この記事が気に入ったらサポートをしてみませんか?