
mRNAワクチンを繰り返し接種すると、免疫を抑制するIgG4が顕著に増えたという論文
Class switch towards non-inflammatory IgG isotypes after repeated SARS-CoV-2 mRNA vaccination
SARS-CoV-2 mRNAワクチン接種の繰り返しによる非炎症性IgGアイソタイプへのクラススイッチ
※ この論文は未査読です。
【 解説 】
宮澤大輔医師ネット さんのNOTE記事中の論文を翻訳しました。
解説については、上記宮澤大輔先生の記事をご覧ください。
以下、記事の翻訳。
概要
SARS-CoV-2のパンデミック対策として、mRNAワクチンの反復接種が有効な手段である。高レベルの中和SARS-CoV-2抗体は、ワクチン誘発免疫の重要な構成要素である。1回目または2回目のmRNAワクチン接種後まもなく、IgG反応は主に炎症性アイソタイプIgG1およびIgG3からなり、Tヘルパー(Th)1細胞によって駆動されている。本論文では、2回目のワクチン接種から数ヵ月後、SARS-CoV-2特異的抗体は、非炎症性IgG2、特にIgG4で構成されるようになり、3回目のmRNAワクチン接種やSARS-CoV-2亜型の破たん感染によってさらに増強されたことを報告する。IgG抗体は親和性成熟しており、高い中和能を有していたが、定数ドメインの切り替えにより、貪食能の低下など、フラグメント結晶化(Fc)受容体を介したエフェクター機能に変化が生じていることがわかった。IgG4の誘導は、Th2細胞によっても、アデノウイルスベクターを用いた同種または異種のSARS-CoV-2ワクチン接種後にも観察されなかった。さらに、IgG2およびIgG4産生メモリーB細胞は、IgG1またはIgG3産生細胞と表現型的に区別されなかった。Fcを介したエフェクター機能は抗ウイルス免疫に重要であり、ワクチン接種やウイルス感染後にほとんど起こらない非炎症性IgGアイソタイプへのクラススイッチの存在は、mRNAワクチンを用いたワクチン接種レジメンの選択とタイミングに影響を与える可能性がある。
はじめに
現在進行中の重症急性呼吸器症候群コロナウイルス2型(SARS-CoV-2)のパンデミックでは、世界中で5億人以上の患者が発生していますが、これまでにないスピードで新しい効率的なワクチンが開発され、おそらく数百万人の追加死亡を防ぐことができました1, 2. 同時に、このパンデミックとワクチン接種キャンペーンは、感染や免疫後のウイルス抗原に対するデノボなヒト免疫応答を解析するユニークな機会を提供しました。
最初のワクチン候補のうち、2つのmRNAワクチン(Biontech/PfizerのComirnatyとModernaのSpikevax)が米国と欧州でライセンスされ、これらはヒトへの使用が承認された最初のmRNAワクチンとなりました。両mRNAワクチンは、臨床試験3, 4、さらには実環境5-8においても、約90%という高いSARS-CoV-2感染予防効果を示しています。当初適用された2回投与のmRNAワクチンでは、強固な抗原特異的免疫応答が誘導されました。しかし、免疫力の低下や、B1.1.529(omicron)のような免疫逃避型変異体(VOC)の出現により、SARS-CoV-2感染に対するワクチン効果は大きく低下しました9-11。その結果、mRNAワクチンによる3回目のブースター接種が各国で推奨されるようになりました。いくつかの研究により、3回目の免疫後の抗体反応は、最初の2回投与後に測定された抗体反応と比較して、様々なVOCに対する中和能力に関して優れていることが確認されました12-14。さらに、mRNAブースターワクチン接種後に抗体価が上昇することが示されましたが、これは胚中心(GC)の活性化の延長とB細胞の成熟が進行していることが一因であると考えられています。SARS-CoV-2ワクチン由来のmRNAとスパイクタンパク質は、ワクチン接種後数週間経過しても検出された15。記憶B細胞の詳細なシークエンス解析により、GCにおける体細胞超変異(SHM)が最大6ヶ月間記録され、記憶B細胞レパートリーの拡大と多様化をもたらし、本来ワクチンが設計されていないVOCに対して有効であった13、15-20。
活性化誘導型シチジンデアミナーゼ(AID)は、抗体可変(V)領域のSHMを触媒する酵素である。GC B細胞に発現し、定常領域(C)遺伝子のクラススイッチ組換え(CSR)も媒介する21, 22。γ3 C領域がコードするIgG3は、14番染色体上の免疫グロブリン重鎖遺伝子座の最も上流(5')にあるCγ-領域である。AIDの継続的な活動により、より下流のCγ領域、すなわちIgG1、IgG2およびIgG423, 24をコードするγ1、γ2およびγ4へのスイッチングが起こりうる。CSRは、免疫応答において高度に制御されている。B細胞が切り替わるC領域は、サイトカインやB細胞活性化因子によって、未整列の重鎖定数遺伝子の転写レベルで制御されている21。しかし、ヒトではγ2、γ4遺伝子座の生殖細胞転写の制御因子はあまりよく分かっていない。IL-4はIL-10と協調してIgGへのスイッチングに関与していることが報告されている425。興味深いことに、遠位型IgG変異体、特にIgG2およびIgG4は、抗体依存性細胞貪食(ADCP)、抗体依存性細胞傷害(ADCC)または補体依存性細胞傷害(CDC)などのFc介在抗体エフェクター機能が低下するため、ほとんど非炎症的または抗炎症機能をも媒介すると報告されている23。
SARS-CoV-2-mRNA ワクチンの2回接種後まもなく、IgG1 と IgG3 がワクチン接種者に見られる主なIgGアイソタイプであったのに対し、IgG2反応はまれで、IgG4反応はほとんど検出されなかった26, 27. これは、mRNA ワクチン接種後に見られる Th1 に偏った細胞反応と一致する28。しかし、mRNAワクチン接種に対する4つのIgGアイソタイプ(IgG1-IgG4)の縦断的な進展、特に2回目と3回目(ブースター)接種後の長期的な進展は、まだ解析されていない。
我々は,ワクチン接種を受けた医療従事者の2つの独立したコホートにおいて,2回目のmRNAワクチン接種から5~7カ月後に,IgG4アイソタイプの抗スパイク抗体がTh2非依存的に増加したことを報告する.この反応は、3回目のmRNAワクチン接種および/またはSARS-CoV-2 VOCの画期的な感染によってさらに増強された。抗体反応の多様化が報告されているように、SARS-CoV-2メモリーB細胞の単細胞RNA配列解析(scRNA seq)により、IgG4アイソタイプの生成をもたらす抗体の成熟と進行中のCSRの両方が確認された。3回目のワクチン接種後、最近出現したオミクロンVOCに対する抗体アビディティの増加と高い中和能を確認したが、遠位IgGアイソタイプへの切り替えは、ADCPなどのフラグメント結晶化可能(Fc)γ受容体(FcγR)媒介エフェクター機能の低下を伴うことが判明した。動物モデルにおけるSARS-CoV-2を含むウイルス感染症の制御、予防または治療におけるFcエフェクター機能の重要性を考慮すると、この異常なワクチン反応とIgGアイソタイプの切り替えは、ヒトにおけるその後のSARS-CoV-2感染症にも影響を与えるかもしれない。
結果
抗スパイク抗体アイソタイプ反応の経時的モニタリング
29人の医療従事者からなる最初のコホートにおいて、コミルナティを3回接種した後の抗体反応を解析した(表1)。最初の2回の接種は3〜4週間の間隔で行われ、さらに2回目の接種から約7カ月後にブースター接種が適用された。以前に確立されたフローサイトメトリーベースの抗体アッセイ36を用いて、単回接種のそれぞれ10日後と2回目の接種から210日後に採取した血清中の抗スパイクIgG応答を測定した。以前の報告3, 4と同様に、2回のmRNA免疫により、すべての被接種者で強固なIgG抗体反応が誘導され、中央値は697.5 µg/mlであった(図1A)。その後、7ヶ月間で82.3 µg/mlまで著しく低下したが、3回目の免疫で抗体レベルは効率的に回復した(中央値699.7 µg/ml)。興味深いことに、抗スパイクIgG抗体の絶対量は、2回目と3回目の接種の10日後に有意な差はなかった。中和能力は、ワクチン誘発抗体応答の動態を確認する代替ウイルス中和アッセイで評価された(図1B)。


IgGのアイソタイプを研究するために、4つの異なる定常重鎖から成るが抗原結合Fab断片を共有するリコンビナント抗レセプター結合ドメイン(RBD)抗体を作製した。これにより、多重化フローサイトメトリーアッセイにおいて、異なる抗スパイクIgGアイソタイプの標準的な定量が可能となった(方法参照)。2回の免疫の10日後、アイソタイプIgG1、IgG2およびIgG3の抗スパイク特異的抗体が容易に検出されたが、抗S IgG4抗体は全く検出されなかった(図1C)。IgG2レベルは、IgG3およびIgG1レベルより著しく低かった。興味深いことに、2回目の免疫から210日後、スパイク特異的IgG4抗体のレベルは、約半数のワクチン接種者の血清で定量下限値を超えていた。他のすべてのアイソタイプのレベルは、抗S反応全体から予想されるように、著しく低下した。IgG1は依然として最も優勢なアイソタイプであったが、IgG3は定量下限値を下回るようになった。3回目の接種後、IgG1の量は再び上昇し、2回目の接種の直後に測定されたレベルに達した。注目すべきは、ほぼすべての被接種者で、ブースター接種後にIgG4抗体量の顕著な上昇が認められたことである。IgG4は抗S抗体の中で2番目に多いアイソタイプとなった人もいた.同様に、IgG2レベルは3回目の接種後に上昇したが、IgG3の上昇はごくわずかで、初回接種後の早い時期に見られたレベルにしか達しなかった。
mRNAワクチン接種の繰り返しによるIgG4誘導の特異性
2回目の免疫後期にIgG4抗体の上昇が見られたことから、次に、これが(相同)mRNAワクチン接種レジメンに特異的かどうかを検討した。そこで、コミルナティとアデノウイルスベクターベースのワクチンChAdOx1(AZD1222、Vaxcevria)による同種・異種ワクチン接種レジメンの免疫原性を比較した既報コホート37の血清を解析した(補足表1参照)。2回目の接種から5〜6ヵ月後、3回の接種スケジュールのいずれにおいても、IgG1が優位なアイソタイプであることが確認された(図2)。さらに,同種BNT-BNTまたは異種Chad-BNTの接種者は,Vaxcevria(Chad-Chad)2回接種者と比較して抗S抗体レベルが高かった.さらに興味深いことに、スパイク特異的IgG4抗体は、BNT-BNTコホートの半数の血清で検出され(図1のコホート1で得られたデータを確認)、他の2つのワクチンコホートの51血清のうち1つのみで検出された(図2)。

IgG4 値が高い人のスパイク反応性 T 細胞における Th1 表現型
抗原特異的IgG4抗体の誘導は、IL-4/Th2駆動の細胞応答の結果である可能性があるので38, 39、IgG4抗体のレベルが低いか高い代表的ドナーの末梢血単核細胞(PBMC)を、コミルナティによる3度目のワクチン接種後100日から120日目に収集し、スパイクペプチドプールで刺激した。ペプチド刺激により、活性化CD4+ T細胞(CD137とCD154の同時発現により同定)の割合は、刺激されていない対照細胞と比較して増加した(図3A)。IgG4抗体のレベルが低いか高い個体では、同量のスパイク反応性CD4 T細胞を見つけることができた(Fig. 3B)。これにより、S反応性CD4 T細胞の大部分はIFN-γおよび/またはIL-2を産生し、IL-4陽性はごく一部に過ぎなかった。このことから、S反応性CD4 T細胞は3回目の免疫後期においてもTh1表現型を維持していることが確認できた(Fig. 3C)。このように、SARS-CoV-2 mRNAの反復接種後のIgG4の発生は、Th2非依存的なプロセスであると思われる。

SARS-CoV-2特異的メモリーB細胞の表現型、体細胞超変異、重鎖アイソタイプのトランスクリプトームプロファイリング
抗体親和性成熟と抗体定数(C)領域遺伝子のCSR(図4A)は、いずれもAIDによって駆動されている。スパイク特異的メモリーB細胞のシークエンス解析により、ワクチン接種後、長期間にわたって抗体が成熟することが明らかになった16, 17, 20。このことは、遠位IgGアイソタイプに対するCSRの増加とともに、IgG4スイッチメモリーB細胞の生成につながる可能性がある。
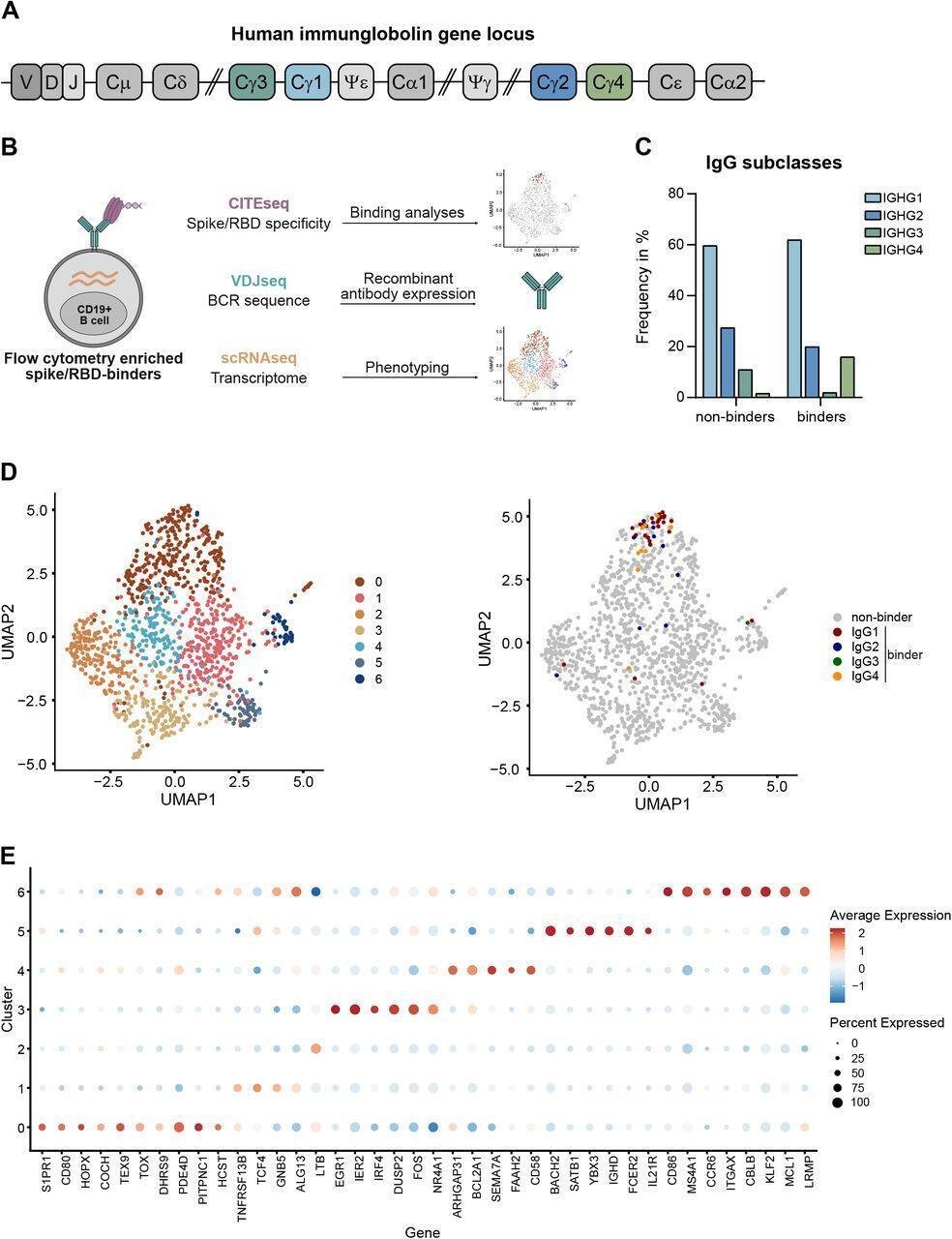
メモリーB細胞コンパートメント内のこれらの細胞の存在を検証し、それぞれのメモリー細胞の多様性と転写シグネチャーに関する洞察を得るために、我々は選択した4人のドナーから2回目のコミルナティ投与から210日後、または3回目の投与から10日後にscRNA seqを行った。同じサンプル内の他のメモリーB細胞集団と公平に比較するため、CITE(cellular indexing of transcriptomes and epitopes)seq40を用いてスパイクおよびRBD結合B細胞を標識し、scRNA seqの前にフローサイトメトリによってスパイク結合IgG+ B細胞を濃縮した(Fig. 4B)。合計で、4人のドナーすべてからソートされたスパイク特異的メモリーB細胞の16%が、IgG4アイソタイプをコードする配列を示した(図4C)。scRNA seqを通じて決定された個々のドナーのIgG4抗スパイクメモリーB細胞の頻度は、それによって血清学的IgG4抗スパイクレベルを反映した(補足表2)。一方、IgG4アイソタイプは非結合体ではほとんど検出されなかった(図4C)。これらの結果は、このタイプのワクチン誘発IgGアイソタイプ反応の頻度が異常に高いことを強調するものである。
CITEとscRNA seqを用いて同定したIgG4産生B細胞クローンのスパイク特異性を確認するため、得られたB細胞受容体(BCR)配列から4つの組み換えモノクローナル抗体をクローニングし、真核細胞で発現させてRBDおよび全長スパイクへの結合について試験した。4つのモノクローナル抗体(mAbs)はすべてスパイクタンパク質に結合することができ、1つのクローンはRBDを認識し、これはフローサイトメトリーソーティングおよびCITE seqの結果と一致した(補足図1A)。
scRNA seqデータの詳細な解析により、IgGアイソタイプにかかわらず、ほぼすべてのスパイク結合メモリーB細胞は、メモリーB細胞についてこれまで報告されていない明確な発現プロファイルを持つ細胞集団(クラスタ0)に属していることが明らかになった(図4D)。抗原提示に関わる遺伝子(CD80)、スイッチメモリーB細胞やメモリーCD8 T細胞に見られる遺伝子群(HOPX、TOX、COCH)41の発現上昇が、シグナル伝達過程に関わる遺伝子(HCST/DAP10、PDE4D)と共に認められた(図4E)。さらに、スフィンゴシン1リン酸レセプター1(S1PR1)のmRNAの発現が増加したことから、胚中心から最近放出された可能性がある41。ワクチン接種者のスパイク結合細胞とは関連しない記憶細胞の中には、最近活性化した細胞(クラスター3)、ナイーブ様細胞(クラスター5)、胚中心B細胞の特徴を持つ活性化Bリンパ球(クラスター6、図4D、E)の署名が含まれる他の異なるクラスターがあった。
遠位型アイソタイプに対する進行中のSHMとCSRの潜在的な相関を評価するために、スパイク結合型と非結合型のメモリーB細胞のSHMレベルを詳しく調べた。先に述べたように42、IgG4を使って、非結合型メモリーB細胞のVH遺伝子に最も多くの体細胞突然変異を観察した(補図1B)。一般に、スパイク結合メモリーB細胞は、IgG4スパイク結合細胞を含む同じアイソタイプのメモリー細胞全体と比較すると、SHMの数が少なかった(Suppl. Fig.) このことは、mRNAワクチン応答が、成人の生涯にわたって獲得される他のすべての記憶B細胞の大部分よりも、まだ多様化および/または親和性の成熟が進んでいないという見解と一致する。限られた数のスパイク結合メモリーB細胞の分析では、遠位アイソタイプ配列を使用するクローンにおける体細胞突然変異の頻度が有意に高いことは明らかにされなかった(補足図1B)。
要約すると、scRNA seqデータは、IgG4スパイク結合メモリーB細胞の異常に高い頻度を確認し、それはスパイク結合IgG1メモリーB細胞と特異的トランスクリプトームプロファイルを共有するものであった。
IgG4アイソタイプは、破傷風トキソイドのワクチン接種や呼吸器合胞体ウイルスの感染を繰り返しても優勢になることはない
免疫や感染を繰り返しても、IgG4応答が観察されることは稀であった。これを裏付けるために、我々は破傷風トキソイド(TT)ワクチンを数回(2-16、中央値6)接種したボランティア23人の破傷風特異的抗体反応を分析した(補足表3)。血清は、TT特異的な総IgGまたはIgG4抗体についてELISA形式で検査された。TT特異的IgG4は、23人中9人の血清で、非常に低レベルではあるが検出可能であり、受けたワクチン接種の回数との相関は認められなかった(補足図2A,B)。さらに、コホート2(表1)の10人について、ヒトに定期的に再感染を起こす呼吸器病原体であるrespiratory syncytial virus(RSV)に対する抗体の有無を検査した。その結果、すべての血清でRSV-F蛋白質特異的なIgG1抗体が検出されたが、IgG4は検出されなかった(補足図2C)。これらの結果は、IgG4へのアイソタイプスイッチングは、ワクチン接種や感染症などの反復抗原曝露の一般的な結果ではないという考え方を支持するものである。
SARS-CoV-2 mRNAワクチン接種者の独立したコホートにおいて、IgG4の出現は抗体活性の上昇と相関しているが、抗体エフェクター機能は低下していた。
最初に記述したコホート1(表1、図1)の認識されていない偏りや特異的な特徴を除外するために、非常に類似したワクチン接種スケジュールでコミルナティを3回接種した38人のボランティアから成る第2のコホートを分析した(表1、コホート2)。2回目あるいは3回目の接種直後(2〜5週間)に採取した血清には、前述と同様の抗S抗体アイソタイプ分布が認められた(図1)。ここでも、3回目の接種後にIgG2(3.5倍)およびIgG4(38.6倍)の大幅な増加が見られたが、スパイク特異的IgG3は2回目の接種後に見られたレベルには達していなかった(図5A)。

抗スパイクIgG抗体の総量は、2回目のワクチン接種後と比較して3回目では中程度(1.6倍)にしか増加しなかったので、次に、IgG2抗体とIgG4抗体の割合の増加が機能的に影響を及ぼすかどうかを検討した。この目的のために、10人のボランティアの代表的なサブコホートのペア血清が分析された。まず、武漢RBDをコーティング剤として使用したELISAアッセイで、RBD特異的IgG1およびIgG4抗体の存在を測定しました(図5B)。RBD特異的IgG4抗体は、3回目のワクチン接種後に有意に増加したが、RBD結合IgG1のレベルは、2つの時点で差がなかった。抗S IgGの総量で正規化した血清を用いると、3回目のワクチン接種後に抗体価が明らかに上昇し(図5C)、これは最近の報告と一致する12。さらに、ウイルス中和の代替指標となる3量体スパイクタンパク質の結合能(図5D)、可溶性RBDのACE2への結合阻止能(図5E)も、3回目の接種後に上昇した。その結果、オミクロンVOC由来のスパイクタンパク質を偽陽性化したレンチウイルス(LV)粒子の中和能が向上した(Fig.5F)。つまり、繰り返し接種することで、可変ドメインを介した抗体エフェクター機能が向上することがわかった。
IgG2およびIgG4は、FcγR依存の二次エフェクター機能を介する可能性が低いと考えられるため、Fcを介した抗体エフェクター機能についても検討した。この目的のために、単球系THP-1細胞株を用いてADCPアッセイを行った43 (Fig. 5G)。スパイクタンパク質を担持した蛍光標識マイクロビーズをターゲットとして、私たちのリコンビナント抗RBD抗体を等量添加し、IgG3およびIgG1がIgG4およびIgG2よりも強力に貪食を誘導することが確認されました(図5H,I)。FcγRIIA、FcγRIIBまたはFcγRIII発現レポーター細胞44を用いると、IgG2およびIgG4の関与によって、ADCPの重要なメディエーターであることが報告されているFcγRIIAの活性化が低下する43、45 (Suppl. Fig.3)。これと一致して、3回目のワクチン接種後に採取した血清を抗スパイク抗体の量で正規化すると、2回接種後の同じドナーの血清よりも有意に低い貪食スコアが得られた(図5J)。
これらのデータは、スパイクタンパク質に反応するIgG2およびIgG4が、Fcを介したエフェクター機能の低下を示すことを示している。
ワクチン誘発抗体反応に対する画期的な感染症の影響
最後に、SARS-CoV-2に続いて感染した場合、IgG4スイッチメモリーB細胞も活性化されるかどうかを検討した。我々は、SARS-CoV-2 mRNAワクチンを2回接種し、2回目のmRNAワクチン接種から25日から257日後に破たん感染を起こした12人を破たん感染の研究コホート(CoVaKo)から同定した(補足表4)。感染はPCR(2xアルファ、7xデルタ、3xオミクロンバリアント)により確認され、その後、試験参加日(訪問(V)1、通常は1週間以内)、PCRから2週間(V2)、4週間(V4)に血清試料が採取された。全個体において、V1からV2にかけてスパイク結合抗体の初期増加を伴うアナムネティック抗体反応を検出した(Fig.6)。また、これらのサンプル中の異なるIgGアイソタイプの動態を測定した(図6)。すべての血清に適度な量のIgG1が含まれ、12人中7人がV1で定量下限を超えるIgG2抗体を有していた(Fig.6)。一方、V1血清中にスパイク特異的なIgG3またはIgG4抗体を含む者は、それぞれ2名のみであった(Fig.6)。さらに1名は、V2での感染に反応してIgG4抗体を発現した。V1で定量下限以上のIgG4抗体を持つこれら3人は、2回目のワクチン接種から95、201、257日後に感染を経験したが、他の9人の患者では、2回目のmRNA注射から25〜78日の間に感染が起こった。この9人はIgG4が検出されなかったが、IgG4は3回の接種期間中ほとんど上昇せず、IgG1はすべての感染者で上昇した。IgG2は1つのV4試料を除いて検出可能なレベルに達していたが、IgG3は全体的に低いレベルにとどまっていた。このことは、IgG4への切り替えはGCの成熟が進行した結果であり、IgG4切り替えメモリーB細胞が出現するまでには数ヶ月かかるという我々の仮説を支持するものである。

16 名の患者からなる第 2 のコホートでは、参加者全員が omicron 変異体に感染する前に mRNA ワクチンを 3 回投与されていた。サンプルは前述したように V4 まで採取された(Suppl. Table 4)。ブースター接種から感染までの期間は57〜164日であった。16人のうち4人はコミルナティの初回接種2回とスパイクバックスによるブースターの混合免疫で、他の人はコミルナティの3回接種を受けた。先に述べた2つのコホート1および2のデータ(図1、図5、表1参照)と同様に、3回接種者のうち1人を除く全員が、5μg/mlから168μg/mlの間で変動するものの、V1時にすでに検出可能な量の抗S血清IgG4抗体を持っていた(図6)。観察期間中(V1〜V4)、抗S IgG4値は破瓜感染後さらに上昇した。3人(ドナー17、18、24)では、IgG4がV1の時点ですでに抗S抗体の最も優勢なアイソタイプであり、解析の過程でこのアイソタイプが最も高い比率で増加していた。他の個体では、IgG1およびIgG4アイソタイプの増加は同程度であった。このことは、感染による抗原の追加接触が、抗体反応をさらにIgG4アイソタイプに向かわせることを示している。
考察
本研究では、コミルナティを2回または3回接種したボランティアにおける抗体反応を、最初の接種から少なくとも8カ月間、縦断的に追跡調査した。その結果、IgG4を発現するメモリーB細胞のmRNAワクチン駆動型増殖という予期せぬ現象を見出した。最初の2回接種直後の典型的な初期スパイク特異的抗体反応のピークに続いて、その後5~7カ月にわたって強く低下し、3回目のmRNAワクチン投与によるブースター効果が明らかになりました。興味深いことに、S特異的IgG抗体の総量は2回目接種後と3回目接種直後のピークで同程度であったが、ブースター接種後の抗体には明らかに質の違いが見られた。抗原認識の面では、最近のオミクロンVOCに対する抗体の高いアビディティと高い中和能によって示され、これは他の最近の研究12-14と完全に一致するものであった。抗体レパートリーの多様化と幅の拡大は、SARS-CoV-2 mRNAワクチン接種後の非常に長い期間にわたる抗体の成熟に起因するものである。B細胞配列解析のアプローチにより、最後のワクチン接種から数ヶ月後でも、新しいS反応性B細胞クローンが出現することが明らかになった13, 15-19. 興味深いことに、2回目の免疫後5~7カ月で採取した血清サンプルの約半分に、検出可能なレベルの抗S IgG4抗体を認めたが、これらはすべて以前の時点ではIgG4を示さなかったものであった。他のすべてのアイソタイプについても、同じ時期に減少が見られた。さらに、3回目の免疫後、IgG4レベルが急激に上昇し、ほぼすべての被接種者で検出可能になった。
このことから、IgG4抗体の出現は、GC反応の進行に伴い、CSRとIgG4スイッチメモリーB細胞の成熟が連続的に起こった結果であると考えられる。IgG3抗体は、あまり効率的に増加せず、2回目の接種後に見られるレベルには達しなかった。染色体1424上の免疫グロブリン遺伝子複合体において、4つのγ重鎖遺伝子がγ3-γ1-γ2-γ4と並んでいることを考慮すると、近位IgG3から遠位IgG442, 46への連続したCSRという仮説が支持されることになろう。興味深いことに、成人の免疫レパートリーでは、IgG2やIgG4へのCSRは、IgM/IgD細胞よりもIgG1 B細胞からの発生頻度が高いことが報告されている46。
3回目のワクチン接種から10日後にワクチン接種者からスパイク特異的メモリーB細胞を分離したところ、IgG3陽性クローンがほとんど検出されないのに対し、相当数のS反応性IgG4スイッチB細胞の存在が単細胞配列解析で確認された。ブースターワクチン接種直後のIgG4へのde novoスイッチングを正式に否定することはできない。しかし、その時点の血清中のIgG4抗体の存在は、IgG抗スパイク血清抗体の急速な上昇とともに、ブースター免疫によって既に存在していたIgG4メモリーB細胞が再活性化したとの考えを支持するものである。
スパイク・バインダーの体細胞超変異の頻度を解析したところ、解析した成人個体では、すべてのアイソタイプのメモリーB細胞のプールと比較して低いレベルであることが判明した。これは、生涯を通じて蓄積される「古い」記憶プールと比較して、比較的最近生まれたことを示すものかもしれない47。興味深いことに、スパイク結合IgG4クローンに関する我々の限られたデータは、IgG1クローンと比較して高い突然変異頻度を示していない。このことは、Mueckschら13が述べたように、数ヶ月にわたって持続するクローンにおける新しい突然変異の獲得が非常に限られていることと一致する。スパイク結合IgG1およびIgG4クローンにおける体細胞超変異の頻度がほぼ同じであることから、両イソタイプは連続的にではなく、並行して発生することが示唆される。IgG1クローンとIgG4クローンの遺伝子発現プロファイルが区別できないことも、この考えを支持している。しかし、これまでのところ、我々のサンプル中のスパイク特異的B細胞の数が限られているため、IgG1とIgG4のB細胞のクローン的に関連したペアの解析ができず、決定的な結論を得ることは困難であった。いずれにせよ、mRNAワクチン自体、および/または最初の2回の注射のタイミングが狭いことが、この効果の原因である可能性があります。
破瓜型感染症のコホートでは、無症候性IgG4抗体反応は、免疫と感染との間の時間間隔と相関していた。2回目接種後70日以内に破局感染を経験した者は,初診時に抗S IgG4の血清レベルがそれほど高くなく,その後の観察期間中も有意に上昇しなかった.一方、2回目のワクチン接種後3カ月以降にブレークスルー感染が発生した場合には、抗S IgG4抗体陽性反応が認められ、感染前に3回のワクチン接種を受けていた場合には、強固に検出された。研究対象者数が限られており、潜在的な交絡因子(初回ウイルス量、重症度、感染原因となった VOC など)の層別化は行っていないが、今回のデータは、mRNA ワクチン接種 2 回後に IgG4 スイッチメモリー B 細胞のプールがゆっくりと発達するという仮説と一致するものであった。さらに、全抗S反応は同等であったものの、一次ワクチン接種後にmRNAを1回投与する異種免疫と比較して、mRNAを2回投与した後にIgG4レベルが有意に高くなることが観察されました。このことは、スパイク蛋白質への反復暴露が異常なIgG4反応を引き起こすという仮説を否定するものである。全体として、今回の結果は、ワクチンによる異常なIgG4反応は、mRNAワクチンによる免疫の特異的特徴であるか、初回免疫と2回目免疫の間隔が比較的短い(3週間)こと、あるいはその両方であるという考え方を支持するものであった。観察された長期間のGC反応に、mRNAワクチン接種または免疫の短い間隔がどの程度関与しているかは、現在のところ明らかではありません。
抗原特異的 IgG4 抗体反応は、一般に Th2 を介した B 細胞の活性化に応答して、または慢性的な抗原曝露の結果として発現すると考えられている48, 49。寄生虫感染やアレルギー抗原は、IL-4、IL-5、IL-13などのサイトカインを産生するCD4+Th2細胞を駆動する可能性があることが知られているが、ほとんどのウイルス感染はTh1ベースの細胞応答を促進する50。mRNAワクチン候補であるBNT162b1に対する細胞反応に関する最初の報告では、第I/II相臨床試験においてTh1プロファイルが示され28、また他の報告ではTh2に偏った免疫反応は確認されていない51-53。このような背景から、Th2反応は、我々が2回目の免疫の後期と3回目の免疫の直後に観察した強固で一貫したIgG4反応の説明にはなりにくいと思われる。実際、IgG4レベルが高いまたは低いワクチン接種者のPBMCをスパイクT細胞エピトープで刺激しても、S特異的Th細胞の頻度に有意差は認められず、むしろ観察されたIFNγおよびIL-4産生細胞の頻度からTh1バイアスCD4応答が示唆された。一方、mRNA ワクチン接種後、最長 6 ヵ月にわたって強固で持続的な T 濾胞ヘルパー細胞反応が、排液リンパ節において細針吸引法によるバイオプシス20 で特徴づけられており、これは長期間継続する GC 反応に一致する15-17。この観測の根本的な理由はまだ解明されていませんが、ワクチン mRNA または抗原がリンパ節に長期間存在することは、潜在的な説明となるかもしれません15。
基礎的なメカニズムとは無関係に、抗ウイルスIgG4抗体の誘導は非常に珍しい現象であり、その機能的な後遺症について重要な問題を提起している。中和抗体は、ウイルス粒子とその特異的な細胞受容体との最初の結合を阻止するもので、SARS-CoV2感染に対する最も有効な防御手段であると考えられている54。この競合結合は、可変抗原結合部位を介して行われ、Fcフラグメントの定数部分にはあまり依存しない。実際、我々は、3回目のワクチン接種後にワクチン誘導抗体の活性と中和能が向上したという以前の報告をここで確認した12-14。しかし、omicron変異体によって引き起こされた膨大な数のブレークスルー感染は、現在のワクチン接種が無菌的な保護を与えていないことを示している。感染が成立すると、Fcを介したエフェクター機能が、ウイルス感染をクリアするために、より重要な意味を持つようになる。全身血清学的アプローチにより、インフルエンザウイルス、RSV、SARS-CoV-255-58で示されたように、異なる抗体機能がウイルス病原体に依存して様々な程度の防御に寄与することが明らかにさえなっている。動物モデルでの受動免疫試験により、適用されたモノクローナル抗体による防御の程度は、そのIgGアイソタイプに依存することがさらに証明されている32-35。この点から、IgG4は抗炎症性IgGであり、ADCCやADCPなどのFc依存性エフェクター機能を媒介する可能性は低いと考えられている23, 59. 抗原特異的IgG4が高レベルであることは、IgEを介した効果を阻害することによるアレルゲン特異的免疫療法の成功と相関していることが報告されている60。さらに、ハチ毒特異的IgG4は、数シーズンの飼育期間中に養蜂家において増加し、ついには特異抗原であるホスホリパーゼA (PLA) に対して優位なIgGアイソタイプにまでなった。興味深いことに、IgG4反応は非常にゆっくりとした速度論で特徴付けられ、出現までに数ヶ月かかる。一方、PLA特異的IgG1抗体はより早い時点ですでに測定可能であり、これは本研究で得られた結果と同様である61。さらに、PLA特異的IgG4スイッチB細胞の増加は、シーズン中の養蜂家や特異的免疫療法(SIT)を受けている患者でも観察されている62。ウイルス感染症の制御については、ウイルス特異的IgG4抗体反応についてあまり知られていない。RSV特異的IgG応答で示したように、IgG4は急性呼吸器ウイルス感染症に繰り返しさらされた後でもほとんど誘導されない。自然感染で誘導される麻疹特異的IgG4抗体を除けば63、HCMVのような慢性ウイルス感染でも有意な特異的IgG4抗体は誘導されない63。
SARS-CoV-2の自然感染による特異的IgG4の誘導についてはほとんど報告がない。支配的なアイソタイプはほとんどがIgG1およびIgG364-66であった。しかし、パンデミックの初期にブラジルで行われた研究では、SARS-CoV-2感染後の発症の早さとIgG4抗体の高値は、COVID-19の重症化と相関しており、抗体反応の低さを示している可能性がある66。しかし、一次免疫反応の場合、より重症な感染がIgG4反応を引き起こし、その逆ではない可能性もあるため、因果関係を明らかにすることは困難である。
これまでのところ、感染症に対するワクチンによるIgG4反応の役割に関する研究はほとんどない。HIVワクチン開発の分野では、VAX00367試験でタンパク質免疫の反復投与によりHIV gp120特異的IgG2およびIgG4レベルが高くなった。一方、RV144試験68でカナリアポックスベクター(ALVAC)と同じタンパク質ワクチンによるプライムブースト免疫により、HIVに対する部分防御と関連する高いHIV特異的IgG3反応が得られた69, 70。さらに、ワクチン誘導型IgG3抗体ではADCCやADCPなどのエフェクター機能が増強されたが、ワクチン誘導型IgG4ではこれらの機能が阻害された70。興味深いことに、マラリアワクチンRTS,Sでは、血清オプソノファゴサイト活性(OPA)とスポロゾイトチャレンジに対する防御力が逆相関していることが報告されている71。さらに、0-1-2ヶ月の接種スケジュールを0-1-7ヶ月の時間間隔と3回目の接種量を減らした遅延分割接種に変更すると、RTS,Sのワクチン効果が増加し、CSP特異的抗体価の上昇とCSP特異的B細胞における体細胞超変異頻度が高くなることが並行して報告された72。追跡調査では、ワクチン接種者はOPAレベルの減少を示し、これは遅延ワクチンレジメン後のより高い、より一貫したIgG4抗体反応と相関していた73。このことは、ワクチンによる防御には、ワクチンで誘導された抗体の量だけでなく、質が重要であることを示している。さらに、反応の種類は、免疫間の時間間隔やブースター接種の用量を変えることで直接影響を与えることができる。
我々の研究では,3回目の免疫後の血清では,抗S IgG4抗体の割合が高くなるのと並行して,抗体を介した食細胞活性が低下していた.しかし,これらの変化がその後のウイルス感染にどのように影響するかは,依然として不明である.破瓜型感染を起こしたワクチン接種者のコホートでは,重症度の変化を示す証拠は得られなかった.この点については、今後、重症度に差のある大規模なコホートが必要であろう。しかし、我々の結果は、その後の感染によってIgG4抗体レベルがさらに上昇し、一部の患者ではIgG4がすべての抗スパイク抗体アイソタイプの中で最も優勢なIgGアイソタイプになることを明確に示している。
結論として、mRNAワクチンは非常に高い免疫原性と有効性が証明されており、このパンデミックにおいて何百万人もの命を救ったと推測されます。その主な理由は、mRNAワクチンによって誘導される強力なGC反応であり、親和性の成熟と、おそらくより重要な、免疫系がまだ遭遇していない新しい抗原変異に反応できるメモリーB細胞プールの多様化につながると思われます。しかし、この免疫反応は、副次的な効果として、非炎症性IgGアイソタイプへの継続的なCSRをもたらし、Fcを介したエフェクター機能を弱める可能性がある。二次免疫の後期に現れる、珍しいmRNAワクチンによる抗ウイルスIgG4抗体反応に関する我々の知見は、明らかにさらなる調査を必要とするものである。この反応を引き起こす正確な免疫学的メカニズムの解明とは別に、IgG4による抗体反応がその後のウイルス感染やブースターワクチン接種にどのような影響を及ぼすかを評価することが必要である。このことは、SARS-CoV-2に対する将来のワクチンキャンペーンだけでなく、他の病原体に対する新しいmRNAベースのワクチン開発にも関連するものである。
翻訳ここまで。
参考記事
以上
