
低分子チロシンキナーゼ阻害剤 オフェブカプセル:ニンテダニブエタンスルホン酸塩
肺線維症進行抑制薬
オフェブ(ニンテダニブエタンスルホン酸塩)は,血小板由来増殖因子受容体(PDGFR)α,β 及び線維芽細胞増殖因子受容体(FGFR)1,2,3 及び血管内皮増殖因子受容体(VEGFR)を標的とする,低分子チロシンキナーゼ阻害剤です。オフェブはこれらの受容体のアデノシン 5'-三リン酸(ATP)結合ポケットに競合的に結合し,特発性肺線維症(IPF),全身性強皮症に伴う間質性肺疾患(SSc-ILD)及び進行性線維化を伴う間質性肺疾患(PF-ILD)の発症に関与するシグナル伝達を阻害します。2022年6月の時点で
特発性肺線維症(IPF)
全身性強皮症に伴う間質性肺疾患(SSc-ILD)
進行性線維化を伴う間質性肺疾患(PF-ILD)
上記の3つに適応を持ちます。
有効性と安全性
INPULSIS 試験
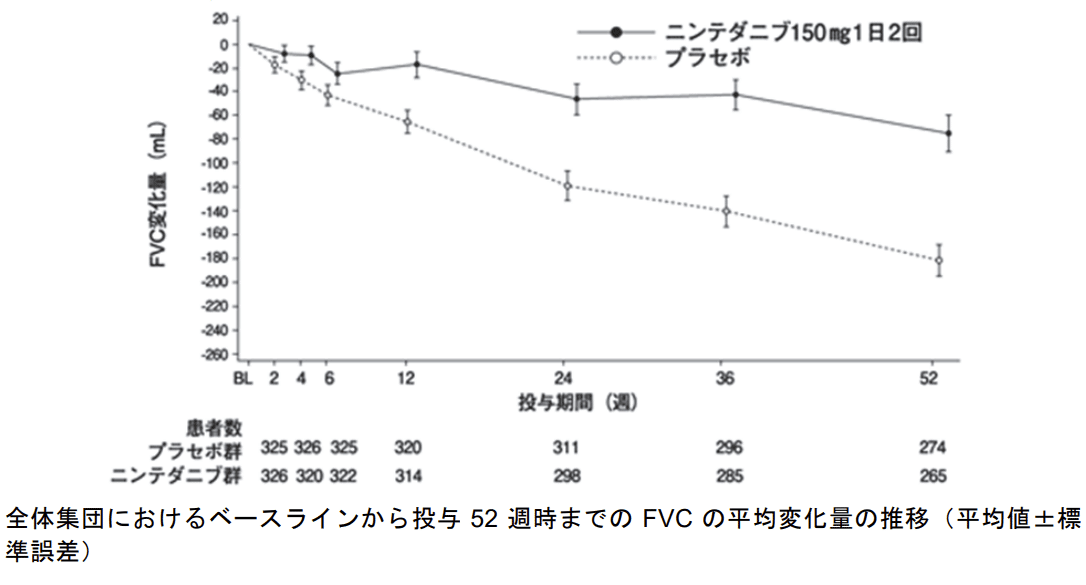
IPF 患者における呼吸機能低下(努力肺活量[FVC]の年間減少率)をプラセボに対して有意に抑制することが示されました。

最も多くみられた副作用は「胃腸障害」(17.7%対 62.4%)で,内容は「下痢」(10.9%対 53.4%)及び「悪心」(4.5%対 19.1%)が多くを占めました。また,「代謝および栄養障害」もニンテダニブ群で発現割合が高く(3.5%対 9.4%),その内容は,「食欲減退」(3.1%対 8.5%)に起因するものでした。「胃腸障害」の大部分は軽度又は中等度で,非重篤なものでした。これらは対症療法及び/又はニンテダニブの投与中断又は減量により管理可能でした。重篤な有害事象は,「胃腸障害」(1.7%対 3.0%),「臨床検査」(0.5%対 1.3%),「肝胆道系障害」(0.2%対 1.1%)でした。一方,最も多くみられた重篤な有害事象は「特発性肺線維症(原疾患の悪化,進行及び増悪を含む)」でした (9.2%対 6.6%)。
SENSCIS 試験
SSc-ILD 患者における呼吸機能低下(FVC の年間減少率)をプラセボに対して有意に抑制することが示されました。

発現割合が最も高かった有害事象は「胃腸障害」(プラセボ群:61.8%,ニンテダニブ群:88.9%)でした。内容は,「下痢」(32.6%対 76.4%),「悪心」(14.2%対 33.3%),「嘔吐」(11.5%対 27.1%)でプラセボ群に比べてニンテダニブ群の発現割合は高かった。また,「体重減少」(5.2%対 13.5%)及び「食欲減退」(4.9%対 9.7%)でもニンテダニブ群の発現割合が高かった。「ALT 増加」(1.4%対 7.6%),「GGT 増加」(1.4%対 6.6%),「AST 増加」(0.3%対 5.6%)の発現割合もプラセボ群に比べてニンテダニブ群のほうが高かった。最も多く報告された重篤な有害事象は「呼吸器,胸郭および縦隔障害」(11.8%対11.8%)であった。
INBUILD 試験
PF-ILD 患者における呼吸機能低下(FVC の年間減少率)をプラセボに対して有意に抑制することが示された。
発現割合が最も高かったのは「胃腸障害」(プラセボ群:49.5%,ニンテダニブ群:84.0% )でした。内容 は,「下痢」(25.7%対 72.3%),「悪心」(10.0%対 30.1%)及び「嘔吐」(4.8%対 19.3%)でした。また,「食欲減退」(6.9% 対 16.3%),「体重減少」(5.4%対 14.8%),「ALT 増加」(3.9%対 14.8%),「AST 増加」(3.9%対 13.0%)の発現割合もプラセボ群に比べてニンテダニブ群のほうが高かった。ニンテダニブ群でよくみられた副作用は基本語の「下痢」(18.7%対 64.5%),「悪心」(5.7%対 24.7%),「嘔吐」(2.1%対 13.3%)でした。発現割合が高かった重篤な有害事象は,「呼吸器,胸郭および縦隔障害」(28.1% 対 19.6%[65/332 例])でした。死亡に至った有害事象は,ニンテダニブ群での発現割合が高かった順に「急性呼吸不全」(0.6%対 1.5%),「呼吸不全」(1.5%対 1.2%),「間質性肺疾患」(2.1%対 0.6%),「肺炎」(0.9% 対 0.6%),及び「肺線維症」(0.0%対 0.6%)でした。
雑感
この3年ほど、COVID19の騒動で新薬の情報収集が滞っていました。
取り返すべく手当たり次第に目を通しておりますが、添付文書の情報を追うだけでも結構なボリュームです。
・・・あれ???
なんと、販売開始は2015年8月なので、ただの勉強不足ですね。。。
気を取り直して、
本剤は肺線維症の進行抑制に対して使用される内服薬です。
1回 150mg 1日2回が標準で、忍容性次第で1回 100mg 1日2回に減量です。
副次評価項目ですが、生命予後の改善は認めていません。
個人的にあまり触れることのない領域の薬剤なので、ミスリードにならないようここまでにします。
この記事が気に入ったらサポートをしてみませんか?
