バイオインフォマティクスの資格を取るためにメモしまくる件について 構造化学編(構造重ね合わせによるタンパク質立体構造の保存性分析)
タンパク質の立体構造の一致度を評価すること= 構造の保存性分析
2つのタンパク質のアミノ酸配列が非常に似ている→ 立体構造も似ている
配列の類似性が低くても→タンパク質の立体構造は良く保存される似ていることが多い。
どのくらいの配列の保存度(類似度)があればどのくらい立体構造が似ているのか評価する研究の概要を知るが今回のテーマ
配列類似性と立体構造類似性
アミノ酸配列の一致度と立体構造の一致度の関係はどのようになっているのだろうか。
1.配列一致度 100%のまったく同じタンパク質は、完全に同じ構造になるように思える。しかし実際は、RMSDは0にはならない場合がかなりある。
→理由:タンパク質自体が、熱振動をしていたり、機能する過程で大きく構造を変化させたりするから。
RMSD は平均して1~2 Å程度に収まる。> お互いの配列一致度が低下しても20%程度までであれば、RMSD 値が徐々に大きくなりながらも維持される。
↓
I.2つのアミノ酸配列は同じ起源のホモログであると推測される。なので、構造が類似する。
配列一致度が20%程度よりも低くなると、RMSD が大きい(>3Å)場合が急激に増え、6Å 以上であればまったく異なるフォールドである。
↓↓
II.配列一致度が20%以下であっても、RMSD が小さい場合が少なからず存在しており、これは配列上の類似性が低くても、立体構造を比較することによって認識できるのが、相同タンパク質。
機能部位の保存性
実験① 2つの機能がよく似ているファミリーに属するタンパク質のアミノ酸配列をアラインメント
↓
1.配列全体の一致度・・・一般に30%以上を示す
2.基質結合部位などの機能を担うアミノ酸残基に限定・・・配列全体の場合の一致度よりも高い配列一致度を保ち、立体構造もその周辺領域は保存性が高い場合が多い。
↓
タンパク質の機能発現に必要な活性部位(酵素で化学反応を触媒する)、他の分子を結合する相互作用部位(結合される分子をリガンド分子とよぶ)、あるいは立体構造形成に重要なアミノ酸残基は保存される傾向が高い。
↓
アミノ酸配列一致度の低いタンパク質に広げて、アミノ酸保存度から機能部位を判定することができる。
相同タンパク質のアミノ酸配列をマルチプルアラインスンドする,あるいは進化的隔たりの大きいタンパク質の立体構造の重ね合わせを行なうことで、保存残基を特定し立体構造上で観察
実験② 相同タンパク質のアミノ酸配列をマルチプルアラインスンドする、あるいは進化的隔たりの大きいタンパク質の立体構造の重ね合わせを行なうことで、保存残基を特定し立体構造上で観察する。
結果・・・おおむね1カ所に集中して基質結合や触媒機能にかかわっていることがわかる。
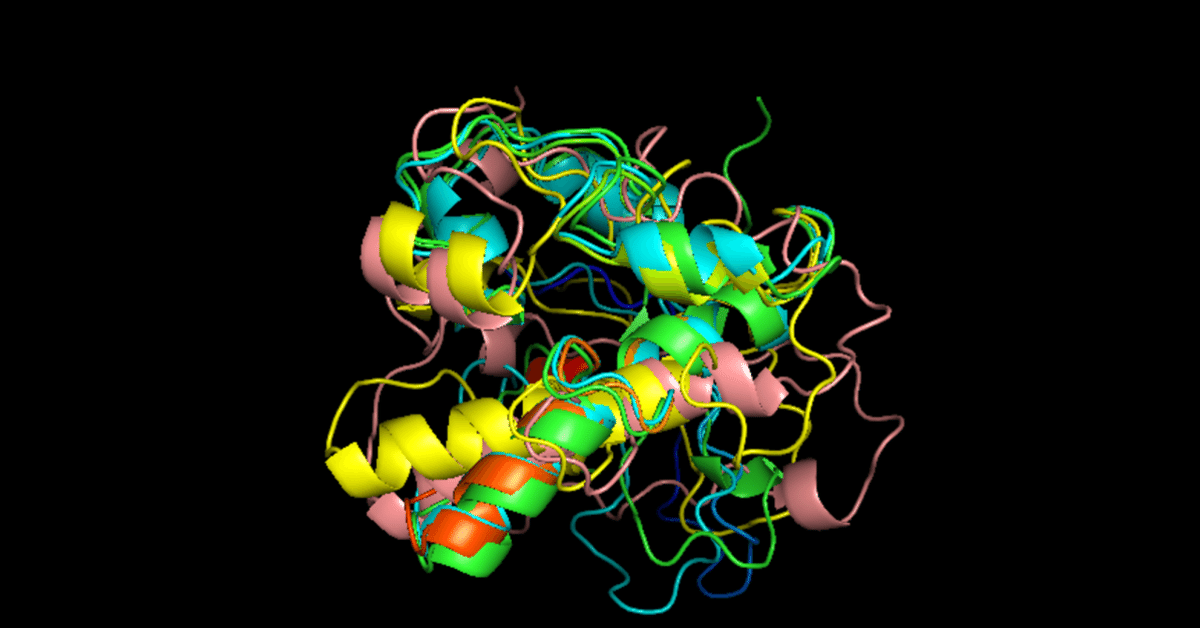
例:ペプチド分解酵素キモトリプシン(ChT)とウイルス NS3 プロテアーゼ(NS3)の構造の重ね合わせ
結果・・・特定された保存部位は 12 カ所。
そのうち2つは活性部位 Asp102 と His57(黒で示した側鎖)。
保存部位のいくつかも、リガンド(酵素の活性を抑える阻害剤)に近い位置に存在し、機能的に重要であると推定される。
↓
解析を保存部位のマッピング
アミノ酸が大きく変化したり、欠失(“-”で表わす。ギャップともいう)している部位は、タンパク質の表面に多い。
タンパク質の構造と機能への影響が比較的少ないため。
機能は基質結合部位の原子の空間配置により規定されることが多い。
同じフォールドをもつ2つのファミリーであっても、機能部位の構造が異なるために別の機能をもつケースがある。
全体のフォールドが異なる2つのファミリーであっても、機能部位の原子配置が類似した構造モチーフをもち、同一の機能をもつケースも見られる。
この記事が気に入ったらサポートをしてみませんか?
