すぬの一般気象学:大気の熱力学まとめ(1)
気体・ガスの研究、特に熱を加えたときのふるまいは、物理学の中でも比較的新しい分野といえる。産業革命が起きて蒸気機関の効率的なエネルギー利用への需要が高まってきた頃、つまり19世紀はじめにようやく、ゲーリュサックが気体を温めたときの膨らみ方の挙動を発表したところから始まる(現象の発見自体は15世紀ぐらいにボイルがしていたらしい)。主にそこからは熱機関のサイクル(エンジンとかのあれ)の挙動を説明するために工業熱力学などが発展していった。
一般気象学では、気体の上昇や下降に伴う熱的振る舞いを説明するために熱力学の知識を用いる。ここを抑えるとどうして雲ができるかが判るようになる。工業熱力学に比べて扱う現象がシンプルなので、高校物理の知識があるかないかぐらいでもなんとかなるが、気象予報士試験ではほぼ必修で、勘違いをすると後々困ることになるので、ここでしっかりまとめておくことにする。
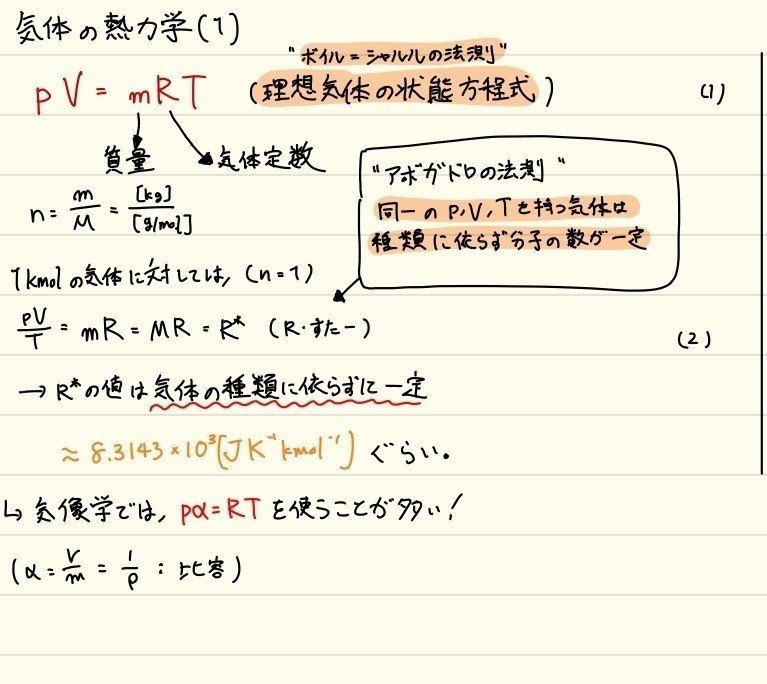
理想気体の状態方程式
- 一般には、pV = nRT (科学、mol単位) や、pV = mRT (熱工学、kg単位) で表される式。ボイル=シャルルの法則として知られている。分野によって比例定数の単位が異なる。気象学では後者を扱う。
- 気象学の分野では、物質量をキロモル[kmol]として表す。したがって気体定数Rの定義も異なる。
- ややこしいので整理しておくと、1kmolの酸素(分子量32.00) は 32kgの質量をもつ。1kmolに含まれる分子の数は一定(molと同様)。
- [kmol] = [kg] / [g/mol] = m / M
アボガドロの法則: 気体のp,V,Tが同じであれば、種類に依らず、その空気に含まれる分子の数は同じである。
- この法則を用いると、1kmolあたりの気体について、気体の種類に依らない一般気体定数を導入できる。
以上の計算について数式をまとめてみた↓
ダルトンの法則: 混合気体の圧力は、それぞれの気体の圧力(分圧)の直和となる
- これを用いると、平均気体分子量や混合気体の気体定数などが求められる。
これについてもまとめてみた。↓

この記事が気に入ったらサポートをしてみませんか?
