週末有機化学演習 第2回
大学学部~院生向けの有機化学に関する問題を更新していきます。
休日の時間つぶしにどうぞ。
演習問題の解答は次回の演習の後半に載せています。
例) 第一回演習問題の解答→第二回演習の後半
今回のジャンルは『有機化学 応用』です。
問A
問1
Fig.1 に芳香族化合物のニトロ化によく用いられる試薬を4つ示しています。これらの試薬を反応性の高い順、すなわちニトロ化能の高い順に並べてください。

問2
硝酸とその関連化合物、およびニトロ化合物に関する次の文章のうち、明らかに誤りを含むものをすべて選んでください。なお、誤りを含む文章の選択肢は最低でも1つあります。
濃硝酸は光により徐々に分解されて二酸化窒素(NO2)を生じ次第に黄褐色を帯びてくる。そのため、濃硝酸は褐色瓶に入れ冷暗所で保管するのが望ましい。なお、希硝酸は光に対して比較的安定である。
濃硝酸に触れると時に回復不能の損傷を皮膚にもたらすため、濃硫酸、濃塩酸同様危険な酸として扱わなければならない。亜硝酸誘導体であるN-ニトロソ化合物は強い発癌性を有するものが多く、試薬として使うのは勿論のこと副生する可能性のある反応も慎重に行う必要がある。
鎖状アルカンは濃硝酸に対して比較的安定であるが、両者の混合物を高温に加熱すると炭素鎖の切断をもとなうニトロ化や酸化を起こす。一方で三級炭素を持つアルカンと発煙硝酸との混合物を室温においておくと、三級炭素の位置でニトロ化や硝酸エステル化が進行しやすい。
亜硝酸は酸化剤としても還元剤としても振る舞う。かなり安定な物質であり、単体もしくは濃厚溶液で取り扱うことができる。主にジアゾ化やニトロソ化の試薬として重要である。
ニトロアルドール反応で合成できるβ-ニトロアルコールを脱水するとニトロオレフィンが得られる。ニトロオレフィン類は電子不足型のオレフィンであり室温でも重合を起こしやすく危険であるため、長期間の保管の際は重禁剤として微量の水分や塩基を加えておくのがよい。
問3
アンモニア、およびアミン化合物に関する次の文章のうち、明らかに誤りを含むものを一つ選択してどの記述が間違っているかを示し、正しい文になるように訂正してください。
アンモニアは加圧すると液化し、有機物をよく溶かすためBirch還元等の有機反応溶媒としても利用されている。試薬として、もしくは副生成物・分解物などでアンモニアが含まれている可能性のある混合物の蒸留に、水銀マノメーターを使うのは爆発性の水銀化合物が生成する可能性があるため危険である。
硝酸アンモニウムは肥料や火薬などの用途で広く用いられる。加熱すると急激な分解を起こし、気体の発生を伴う爆発を生じる。とはいえ大量に使用したり密閉状態にしたりしなければ意外と安全で、消防法でも自己反応性物質ではなく酸化性固体に分類されている。
N,N,N',N'-テトラメチルエチレンジアミンはTEMEDAなどの名称で呼ばれる求核性が低い塩基であり、プロトンの補足や配位子などの目的で使われることが多い。脂肪族アミンの乾燥には酸性物質や錯形成の可能性がある乾燥剤は不適であり、十酸化四リンや水素化カルシウム、酸化バリウム、モレキュラーシーブ等は乾燥剤として使用できない。塩化カルシウムや無水硫酸銅(II)等が適当である。
カルボニル化合物とアンモニアもしくは第一級アミンを作用させると、イミンもしくはシッフ塩基と呼ばれる化合物が得られる。配位子としてのシッフ塩基は二座キレート構造により多くの金属イオンと安定な錯体を生成することが知られる。
ニトロンはシッフ塩基のN-オキシド体ともいえるものであり、1,3-双極子付加反応の基質として重要である。芳香族ニトロンと比べて脂肪族ニトロンは不安定なものが多く、加熱等により爆発的な分解を生じる危険性がある。そのため加熱反応は慎重に行い、密閉容器での長期保存は避けるべきである。
問B
Horner-Wadsworth-Emmons(以下HWE) 反応は、α,β-不飽和エステル類を得る方法として現在も広く用いられる重要反応です。この反応について、掘り下げて考えてみましょう。
問1
基本的なHWE反応ではE選択的にオレフィンが形成されます。その理由を考察するために反応機構を考えてみることにしましょう。
問1-1
まずFig.2 に示すようなホスホン酸エステルに強塩基(図中ではBと表記) を作用させると対応するアニオンXが生じます。Fig.2 に曲がり矢印と生成するアニオンの構造式を記入して一段階目の反応機構を示してください。

問1-2
今回は『RCHO』で表せるアルデヒドへの付加について考えましょう。生じたアニオンXはアルデヒドに付加して中間体Yを与えます。その後中間体Yは四員環型の遷移状態の形成を経てリン酸エステル部の脱離を起こし、結果オレフィンが得られます。一連の反応における中間体の構造と曲がり矢印を記し反応機構を完成させてください。

問1-3
さて、このような機構でHWE反応は進行していくわけですが、ここで中間体Yに注目してみましょう。中間体Yはその立体構造を考えるとerythro型構造もしくはthreo型構造という異性体関係にある2種類の構造が考えられます。erythro型構造とthreo型構造の違いが分かるように、それぞれの構造の中間体Yを破線-くさび形表記で示してください。
問1-4
中間体Yの構造のうち、熱力学的に安定と考えられるのはerythro型構造とthreo型構造のどちらでしょうか。理由と共に述べてください。
問1-5
これまで得られた情報をもとに、一般的なHWE反応がE選択的にα,β-不飽和エステル類を与える理由を簡潔にまとめて記述してください。
(ヒント:中間体Yの形成は可逆的に進行できます。)
問1-6
以上より一般的なHWE反応がE選択的となりやすい理由が分かりました。ところで、ここまでの情報をもとに考察すればZ選択的なHWE反応を進行させるためにはどのような戦略をとればいいかが見えてくるかと思います。では最後に、どのような工夫をすればZ選択的なHWE反応を進行させられるか考察し記述してください。
第一回演習の解答例
問A
問1

出発物と生成物、そして問題文に与えられた順番に従って考えればFig. のような反応機構が自然でしょう。前半にある超原子価ヨウ素試薬が関与する反応の流れを思いつければ、反応機構を完成させるのは特に難しくないと思います。
問2-1

これも何も難しいことはないでしょう。アミド結合窒素の非共有電子対の倒れこみによってカルボニル炭素と窒素の間が二重結合性を帯びるわけですね。そう考えると問2-1で考えるべき二種類のコンフォメーションはFig. に示す二種類が考えられます。どちらをcis,transとするかは好みもあるでしょうが、まぁベンゼン環同士酸素原子同士が同じ側にあるConformation Bをcisとするのが自然ですかね。
問2-2
Fig. に示す反応機構より、本反応における環化反応はアミド結合窒素に結合しているオレフィン部位とカルボニル炭素に結合しているカルボカチオン間で進行することがわかります。それぞれの反応点の空間的位置について考えてみると、明らかに二つの反応点はFig. におけるConformation Bの方が近くにあり、Conformation Aは遠くにあることが分かります。そのため、反応が進行しやすいのはConformation B (cis配置)の時であると考えられるわけです。
問2-3
N-アルキル置換体であるR1=-Me,-CH2-Phの場合は、Fig に示すようなベンゼン環水素とアルキル基との間に生じる立体反発を回避するために反応に有利なConformation B型(cis型)で安定できると考えられます。一方R1=-Hの場合(もしくは-OMeの場合)はこのような立体反発を避けられますのでConformation A型(trans)で安定できます。
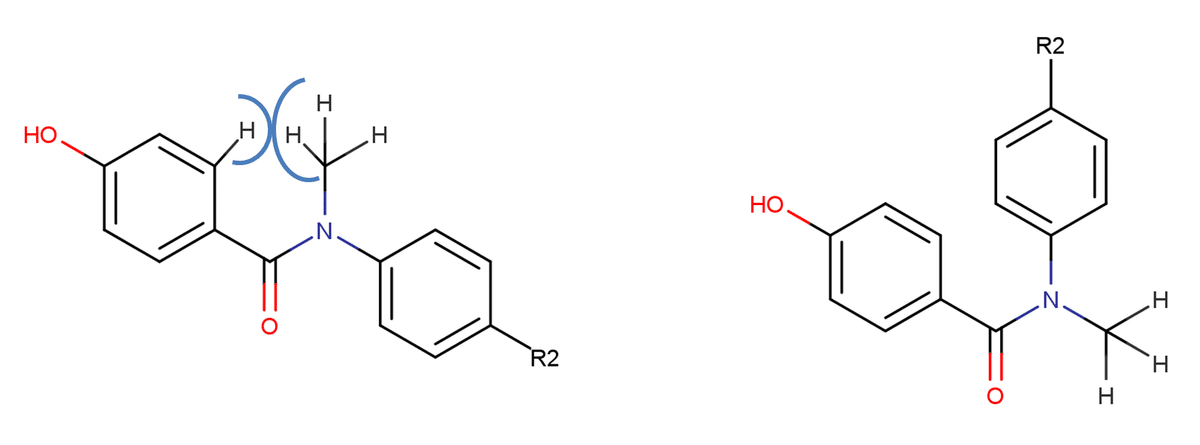
問2-4
反応に不利なコンフォメーションで安定となるということは、Fig でいうところのConformation Aで安定となっていることになります。アミド結合周りの双極子モーメントを考えますと、Conformation AではC=O結合における双極子モーメントとN-OMe結合における双極子モーメントの方向が逆向きになってますから、互いにある程度打ち消しあうことができます。一方、Conformation Bの場合はそれらが同じ側を向いていますからむしろ双極子モーメントを強めあう作用が働きます。そのため、分子全体でみた場合により中性となるConformation Aの方が有利といえます。また、Conformation Aでは二つのベンゼン環がアミド結合を介して共役することができます。すなわち、分子全体で共役系を構成できます。一方Conformation Bの場合、空間的に近いベンゼン環水素同士で生じる立体反発を避けるようにベンゼン環が回転しているであろうことが予想されます。ベンゼン環の回転が生じるとpオービタル間の相互作用が弱まり、結果Conformarion Aのような二つのベンゼン環同士の共役を構築できません。以上の結果として、R=-OMeの場合は反応に有利なConformation Aで安定になると考えられます。

※注意
今回のような双極子モーメントが打ち消しあい中性になるようなコンフォメーションの方が安定というのは分子内環化反応の系ではよく出会う現象で覚えておきたい概念ですが、溶媒などの周辺環境によっても状況は変動しうるということは覚えておきましょう。例えば非極性溶媒下では分子が全体的に中性となるConformation A(trans型) に大きく偏っていますが、アルコールなどの極性溶媒下では極性安定化を受けるのでConformation B(cis型) の割合が増えます。事実、今回の反応はトリフルオロエタノール溶媒での環化収率は27%でしたが、ジクロロメタン溶媒下では14%と約半分になるようです。
問B
問1
何も難しいことはありませんね、CIP則に従って優先順位を考えればよく、オレフィンA,BともにE配置だとわかります。
問2
Vinylogousという言葉にあまりなじみのない方がいらっしゃるかもしれませんが、これはカルボニルなどの電子吸引性基と共役関係にあるオレフィンのことを指します。そういったオレフィンは電子吸引性基と似たような反応性を示すことがあるので、これが関与するような反応をvinylogous反応なんて呼んだりします。Vinylogousで有名なのはVinylogous 向山アルドール反応でしょうか。Fig. に反応例を示しますが、エノールではなくエノールに共役しているオレフィンが反応していることが分かります。
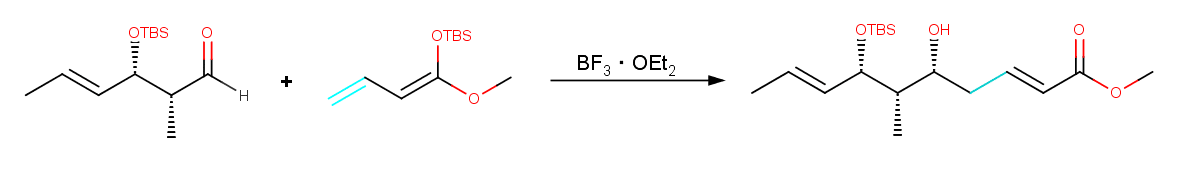
なのでVinylogous Morita-Baylis-Hillman反応もカルボニル(電子吸引基)に結合したオレフィンが関与するverの Morita-Baylis-Hillman反応を考えればよいということになります。この反応の機構は若干難しいですが、 Morita-Baylis-Hillman反応の反応機構を理解できていればいけるかもしれません。本反応は以下のような機構で進行すると考えれるでしょう。

トリブチルホスフィンは省略してPとしています。三段階目の水素引き抜きがほんとかよというところですが、エノールのプロトン化とプロトン引き抜きによるエノールの生成が示せていれば問題ないでしょう。反応機構に従えば生成物の構造はAと考えられるのでAまでたどり着けていれば正解でOKです。しかしながら、この化合物にあるような環内E配置多置換オレフィンは異性化を起こしやすい傾向にあります。実際この反応はどこかのタイミングで三置換オレフィンのE→Zへの異性化が進行するようで、最終的な生成物はFig. Bのような構造の化合物みたいですね。こういった異性化は光(紫外線) とかでも容易に起こりうるので、似たような化合物を扱う際は注意です。
問3
この反応の反応選択性は単純に立体障害で考えられるででしょう。1,4付加の場合ケトンカルボニルから見てβ炭素に対して攻撃が起こるわけですが、オレフィンAの場合はその隣に環の上下どちらにも突き出ているメチル基があってかなり邪魔そうです。一方オレフィンBではβ炭素周りがまだ空いています。なので、反応が選択的に進行するとしたらオレフィンBで起こる可能性が高く、得られるメトキシ誘導体Xの構造は以下のようになるでしょう。

問4-1
分子内[2+2]付加環化が生じる、そしてビシクロ[2.1.1]ヘキサン骨格ができるという条件から以下のような生成物が予想できます。
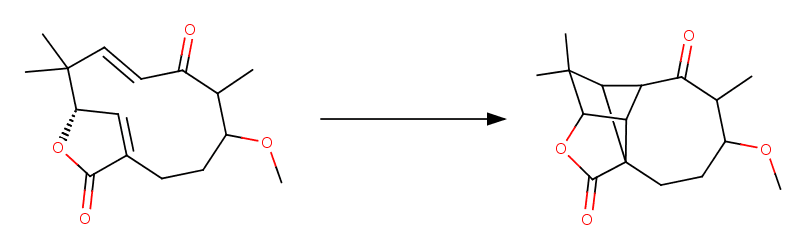
生成物はやや複雑な構造を有していますので、どの炭素とどの炭素の間に結合ができたのかをきちんと整理しましょう。
問4-2
ペリ環状反応はなかなか気難しい反応群なので、理論上起きてもいい反応が進行しない理由は何個も可能性が考えられます。が、今回は環の剛直性の観点からとあるので、それに従って考えてみましょう。
とはいっても答えは結構単純です。オレフィンを持つ環状化合物は持たない環状化合物と比べて環構造が剛直になります。すなわち分子のコンフォメーション変化に乏しくなるので、オレフィンBとα,β不飽和ラクトンのオレフィンが[2+2]付加環化に必要な軌道相互作用が生じるコンフォメーションをとることができないために反応が進行しなかった。一方メトキシ置換によってオレフィンを1つ除去してやると、環の剛直性が低下して[2+2]付加環化に必要なコンフォメーションをとることができる柔軟性(自由度)を獲得した。ということになるでしょう。
この記事が気に入ったらサポートをしてみませんか?
