
100 高尿酸血症と痛風の病因と病態
キーポイント
・尿酸は人間のプリン代謝の最終産物である。
・血清尿酸塩濃度は、尿酸塩の産生と排泄のバランスによって決定される。・臨床的な高尿酸血症のほとんどは、腎臓による尿酸塩の排泄不足と関連している。
・特定の有機アニオントランスポーター(OAT)は、腎臓による尿酸塩の排泄において中心的な役割を果たしている。
・高尿酸血症とは、血清尿酸値が血清中の尿酸溶解度の限界である6.8mg/dLを超える場合をいう。
・痛風の発症には、尿酸ナトリウム(MSU)結晶の析出を促進する高尿酸血症が必要である。
・MSU結晶は、IL-1βを処理・生成する細胞質多分子複合体であるNLRP3(NALP3)インフラマソームの活性化など、炎症反応を促進する。
・局所組織マクロファージによる痛風性炎症の開始は、関節内への好中球の流入を誘導する。好中球はMSU結晶に遭遇すると活性化され、さらに炎症を伝播させる。
・炎症は慢性痛風やtophusでは持続し、tophus内では炎症細胞が隣接する軟骨や骨の破壊を促進する。
・痛風がない場合でも、可溶性血清尿酸塩は生物学的に活性であり、無症候性高尿酸血症は臨床的意味を持つかもしれない。
Pearl:ヒトの血清尿酸値の基準値が高いのは、高尿酸血症が生存に有益であった時代の進化的圧力の結果かもしれない。
Comment: recent studies suggest that evolution has co-opted urate to play an important and perhaps critical role in organismal immunity. It has long been appreciated that the lysates of damaged mammalian cells can serve as adjuvants—that is, they can promote immune responses to injected antigens—but the mediator of adjuvant action was not known. Using classic biochemical techniques, investigators have demonstrated that the major endogenous adjuvant found in damaged or dying cells is uric acid. Thus uric acid may serve as a danger signal to promote immune responses.
・最近の研究では、進化が尿酸塩を生物の免疫において重要な、そしておそらくは極めて重要な役割を果たすようにしたことが示唆されている。
・損傷を受けた哺乳類細胞の溶解液がアジュバントとして機能すること、すなわち、注射した抗原に対する免疫反応を促進することは以前から知られていたが、アジュバント作用のメディエーターは不明であった。
・古典的な生化学的手法を用いて、傷ついた細胞や死にかけた細胞に見られる主な内因性アジュバントが尿酸であることを証明されている。従って、尿酸は免疫反応を促進する 危険信号として機能している可能性がある。文献3
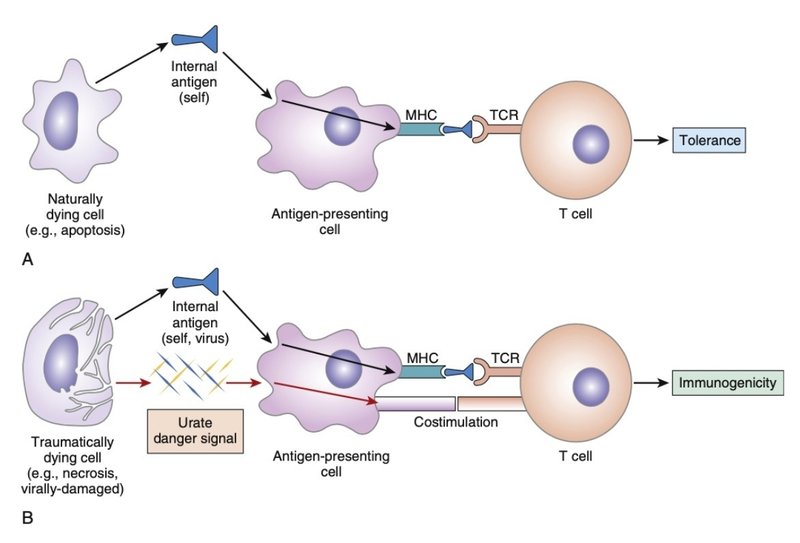
・ウイルス感染細胞でも尿酸の産生が亢進し、抗原提示を促進する上流シグナルとして機能している可能性も報告されている他、マウスモデルでは尿酸値の上昇が免疫腫瘍拒絶反応を促進する可能性が示唆されています。文献4, 5
Myths: 哺乳類はどの種であっても尿酸値の平均はおおよそ同じである。
Reality: Most mammals have serum urate levels in a range roughly between 0.5 and 2 mg/dL. In contrast, humans and other primates, including some New World monkeys, typically demonstrate serum urate levels between 4 and 6 mg/dL.
・ほとんどの哺乳類の血清尿酸値は、おおよそ0.5~2mg/dLの間である。一方、ヒトや新世界ザルを含む霊長類では、血清尿酸値は通常4~6mg/dLである。
・中新世(1,000万年から2,500万年前)の間に、様々な霊長類や一部のサル種で突然変異が起こり、尿酸をアラント酸に分解する酵素をコードするウリカーゼ遺伝子が不活性化した。
・遺伝学的研究によると、ウリカーゼ遺伝子のナンセンス変異やその他の変異は、一度だけでなく、複数のホミノイド系統にわたって複数回起こったことが示されている

・複数の独立した機能喪失突然変異が起こったことから、尿酸生成の増加がこれらの特定の種に生存利益をもたらしたのではないかという仮説を立てる生物学者もいる。
・いくつかの学説については以下のとおりです。
①更にもっと昔に霊長類がアスコルビン酸の産生を可能にする遺伝子を欠損してしまった→抗酸化物質を産生できなくなったことで、進化的な負荷が生じ、その代償として抗酸化物質である尿酸塩が増加するという進化の選択があった
②高尿酸血症が、抗酸化作用、あるいは神経刺激性アデノシン受容体の活性化(カフェインと同様の作用)を介して、ホミノイドの知的機能を促進することにより、進化的な利点をもたらした
③中新世はホミノイドの進化において重要な時代であり、その時期のホミノイドの食事は主に菜食で、塩分が極めて少なかったようだと指摘した。この時期のホミノイドは、特に直立歩行への移行に直面し、「低血圧危機」を経験した可能性を示唆している。さらに彼らは、血清尿酸値の上昇が、主に尿酸誘発性血管障害を通じて、正常血圧を回復するメカニズムを提供した
Myths:臨床的な痛風発作がなければMSU結晶やtophiの沈着は見られない
Reality: The balance between uric acid production and excretion determines the serum urate level. Most individuals maintain a relatively stable serum urate concentration between 4 and 6.8 mg/dL and a total body uric acid pool of approximately 1000 mg. Individuals with serum urate levels greater than 6.8 mg/ dL (e.g., hyperuricemia), even without clinical gout, may deposit MSU crystals either occultly or in the form of appreciable masses (tophi), with the consequence that the total body uric acid pool may be significantly higher in individuals with asymptomatic hyperuricemia than in people who are non-hyperuricemic. These occult deposits of uric acid (total body urate burden) may have implications for treatment because they act as a “buffering reservoir” that resists initial treatment with urate-lowering agents.
・ 尿酸の産生と排泄のバランスにより、血清尿酸値が決定される。ほとんどの人は、血清尿酸値が4~6.8mg/dLで比較的安定しており、全身の尿酸プールは約1000mgである。
・血清尿酸値が6.8mg/dLを超える人(例えば、高尿酸血症)は、臨床的な痛風がなくても、MSU結晶が潜行性に、あるいはかなりの塊(トフィ)の形で沈着することがあり、その結果、無症候性高尿酸血症の人では、高尿酸血症でない人に比べて全身の尿酸プールが有意に高くなることがある。
・このような潜伏性の尿酸沈着(全身尿酸負荷)は、尿酸降下剤による初期治療に抵抗する「緩衝リザーバー」として作用するため、治療に影響を及ぼす可能性がある。
・なかなか尿酸値が下がらない人は”尿酸タンク”があるのですね!
Pearl:先天的な高尿酸血症の原因はHGPRT1の欠損もしくはPRPP合成酵素の活性上昇である
Comment: In rare patients, inborn errors of metabolism lead to urate over-production and subsequent hyperuricemia. Several of these inborn errors of metabolism deserve mention. First, a small number of individuals possess PRPP synthetase enzymes that are hyperactive. The result is increased generation of PRPP. Because under normal circumstances PRPP concentrations are below the Michaelis constant (Km) of glutamine-PRPP amidotransferase for this substrate, increased PRPP levels drive amidotransferase activity and accelerate purine biosynthesis.The second well-described class of abnormality leading to urate overproduction occurs within the purine salvage pathway. Deficiencies of HGPRT1 result in impaired purine salvage and increased substrate for uric acid generation. Additionally, because purine salvage normally results in nucleotide monophosphate generation, patients with purine salvage deficiencies accumulate lower levels of nucleotide monophosphates, resulting in loss of feedback inhibition of both PRPP synthase and glutamine-PRPP amidotransferase.
・先天性代謝異常が尿酸塩の過剰産生とそれに続く高尿酸血症を引き起こすことがある。
①PPRP合成酵素活性の亢進:少数の患者ではPRPP合成酵素の活性が亢進している。その結果、PRPPの生成が増加する。悪条件下ではPRPP濃度はグルタミン-PRPPアミド基転移酵素のミカエリス定数(Km)以下であるため、PRPP濃度が上昇するとアミド基転移酵素の活性が促進され、プリン生合成が促進される。
②HGPRT1の活性低下:2番目のよく知られた種類の異常はプリンサルベージ経路内で起こる。HGPRT1が欠損するとプリンサルベージが障害され、尿酸生成の基質が増加する。さらに、プリンサルベージは通常ヌクレオチド一リン酸の生成につながるため、プリンサルベージ欠損患者ではヌクレオチド一リン酸の蓄積量が低下し、PRPP合成酵素とグルタミン-PRPPアミド転移酵素の両方に対するフィードバック阻害が失われる。

・HGPRT1の完全欠損はLesch-Nyhan症候群です。血清尿酸値が極めて高くなり、痛風発作、腎結石、精神発達遅滞、自傷行為を含む異常行動を特徴とする。神経学的所見は高尿酸血症を治療しても改善しない。
・HGPRT1部分欠損はKelley-Seegmiller症候群で、早期発症の高尿酸血症と痛風を呈するが、神経症状はほとんどないか、全くない。
Pearl:乾癬患者の高尿酸血症は皮膚のターンオーバーの亢進と関連があるかもしれない
Comment: Although somewhat more controversial, the increased cell turnover in patients with psoriasis has also been associated with elevated levels of serum urate.
・乾癬だけではなく、細胞が壊れターンオーバーが亢進する病態、血液疾患、G-CSFの使用、なぜかサルコイドーシスも関連しているかもしれない。
Pearl:尿細管における尿酸の再吸収には様々なトランスポーターが介在しており、尿中への尿酸を促す薬剤や、薬剤性の高尿酸血症におけるターゲットになっている
Comment:Urate resorption in the proximal tubule depends on the action of several apical surface transporters and at least one resorption transporter at the basolateral surface.

・URAT1:Cl-などの陰イオンと交換で尿酸を再吸収する、URAT1の不活性変異を持つ患者は極めて血清尿酸値が低くなる(腎結石は増える)、プロベネシドやロサルタン、ベンズブロマロン、高用量サリチル酸はURAT1を阻害することで尿中に尿酸を排泄する
・OATs, organic anion transporters:URAT1と同様陰イオン交換輸送体で、乳酸、フロセミド、シクロスポリン、ニコチン酸などはここがターゲットになる
・様々なorganic anionたちは、URAT1やOAT10による尿酸塩保持を促進する対イオンとして作用し血中の尿酸値を上げます。ニコチン酸、低用量アスピリンはこの機序で尿酸の再吸収を促してしまう。一方で高用量のサリチル酸は、URAT1をかえって阻害するようで、血清尿酸値を下げる。特に尿酸の再吸収を促す薬剤はピラジナミドで、ピラジナミドは代謝されると5-ヒドロキシピラジノ酸に代謝され、ニコチン酸や低用量サリチル酸と同じ作用で尿酸値を上げてしまいます。
・シクロスポリンは尿細管での尿酸輸送に直接作用して(詳細は記載ないが)血清尿酸値をあげる、この作用はタクロリムスには見られない。
Pearl:ヒポクラテスの鋭い格言によれば、「若い男は性交にふけるまでは痛風にかからない」、「女性は月経が止まらない限り痛風にかからない」。
Comment:Hippocrates’ astute aphorisms that “a young man does not take the gout until [around the time] he indulges in coition” and that “a woman does not take the gout, unless her menses be stopped.”
・小児期は尿酸値は低い傾向にあります
・男性は思春期に尿酸値が急上昇、女性は閉経後に上昇する、という事実に一致する格言です
・尿酸の調整には性ホルモンが関与していることを思わせる描写です
・実際にエストロゲンやプロゲステロンは腎尿酸排泄を促進し、アンドロゲンは高尿酸血症の促進に積極的な役割を果たしている可能性があります・
・ここでもヒポクラテスの格言が火を吹きます ”Eunuchs do not take the gout(宦官は痛風にかからない)”
Myths:利尿薬の使用による痛風リスクの増加はそこまで高くない
Reality: Despite early assessments suggesting otherwise, the increase in gout risk because of diuretic use is substantial and may range as high as 3- to 20-fold.
・初期の評価ではそうでないことが示唆されていたにもかかわらず、利尿剤の使用による痛風リスクの増加は相当なものであり、3倍から20倍にも達する可能性がある。
・フロセミドは尿酸トランスポーターにあるNPT4に直接作用し、尿酸値をあげる。利尿により尿量が減少して尿酸の分泌が下がる、のではないようで、カリウム保持性利尿薬では尿酸値は動かない。
Myths:糖類はいずれも尿酸値をあげる方向に作用する
Reality: As early as 1901, Osler recognized the ability of fructose to provoke gout flares. Little was made of this observation, however, until the 1960s and 1970s, when it was demonstrated that fructose loads, administered orally or intravenously, cause transient rises in serum urate levels, particularly in gout patients. These effects are reproduced with consumption of sucrose (which contains fructose), but not with consumption of glucose or galactose.
・早くも1901年には、オスラーは果糖が痛風発作を誘発することを認めていた。しかし、1960年代から1970年代にかけて、果糖を経口または静脈内投与すると、特に痛風患者において血清尿酸値が一過性に上昇することが証明されるまで、この観察はほとんど行われていなかった。
・これらの作用は、スクロース(フルクトースを含む)の摂取では再現されるが、グルコースやガラクトースの摂取では再現されない。
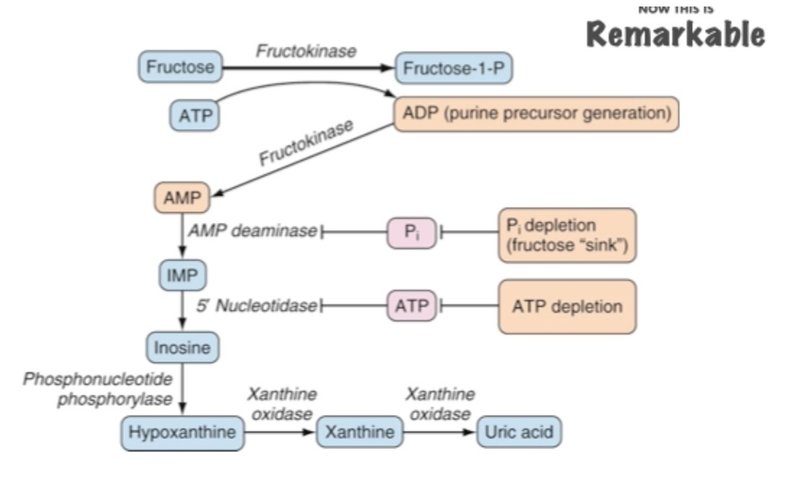
・このようにしてフルクトースはリン酸と結合してリン酸のため池として機能してしまい、その結果リン酸は枯渇、ATPも消費されてしまい、プリン合成経路を阻害するため、どんどん尿酸の合成が進んでしまう!
・疫学的研究により、高尿酸血症におけるフルクトース摂取の役割が確認されている;フルクトース加糖清涼飲料またはフルーツジュースの形でフルクトースを過剰に摂取している患者は、血清尿酸値が高く、痛風の発症率も高い。
・糖の重要性は、過去数十年間の痛風有病率の上昇と並行して、ブドウ糖の代わりに果糖が清涼飲料水や調理済み食品の主要添加物として工業的に使用されるようになったという事実からも明らかである。
・ちなみにエタノールも代謝の際にATPを必要とするため、そのためプリン体の代謝が回転しフルクトースと同じ経路で尿酸がたくさん作られてしまいます。
Pearl:鉛中毒は高尿酸血症の原因となる。
・西洋社会では鉛への曝露は一般的であるが、鉛への曝露が過剰であった時代も数多く存在する(ローマ帝国時代など)。鉛曝露、高尿酸血症、痛風との関連は、少なくとも18世紀から疑われてきた。
・20世紀には、鉛による高尿酸血症(=”saturnine gout”)の患者の大規模なコホートが、禁酒法時代とその後に認められ、主に米国南東部において、鉛をライニングした容器(典型的には自動車のラジエーター)を使用したウイスキー(moonshine, or white lightning)の自家醸造に関連していた。
・余談ですが、禁酒法時代の密造酒をmoon shineと呼ぶのは…
“ムーンシャイン”という言葉は、禁酒法時代にエチルアルコール(飲用)とメチルアルコール(工業用)を炎の色で区別していて、エチルアルコールは炎の色が月明かりのブルーだったことや、密造酒が月明りの下で密かに造られていたことなどが由来になっているそうです
・その他ベリリウム中毒も高尿酸血症になるようです
Myths:tophiは単に尿酸が結晶化した沈着物である
Reality: Although tophi are composed first and foremost of MSU crystals, they are complex structures in which urate (1) is embedded in a matrix of lipids, proteins, and mucopolysaccharides and (2) drives a persistent inflammatory state. A tophus can alternatively be conceived of as a granuloma of mononucleated and multinucleated macrophages arranged in three distinguishable zones
・tophiは、何よりもまずMSU結晶で構成されるが、尿酸塩が(1)脂質、タンパク質、ムコ多糖類のマトリックスに埋め込まれ、(2)持続的な炎症状態を引き起こす複雑な構造である単核および多核マクロファージが3つの区別可能なゾーンに配列した肉芽腫と考えることもできる。
・中心部を取り囲むのは、マクロファージ、多核マクロファージ様細胞、形質細胞、肥満細胞からなるコロナゾーンである。この生物学的に活性なコロナゾーンが、トフスを囲む無響縁という超音波所見の原因であると考えられている。

・というわけでtophiは単なるMSUの沈着ではなく、炎症細胞や炎症物質の塊なのです。
Pearl: 血清尿酸塩の悪影響とは対照的に、高尿酸血症は認知症、多発性硬化症、パーキンソン病やハンチントン病などの神経疾患を予防する可能性がある
・予防方面ではこれらの病気が有名どころでしょうか。
この記事が気に入ったらサポートをしてみませんか?
