
59 関節リウマチにおける自己抗体
キーポイント
・関節リウマチ(RA)における自己抗体は、診断および予後予測に有用である。
・自己抗体の発現はRAの発症に先行しており、このことはRAの病態形成における自己抗体の役割の可能性を支持するとともに、この疾患の発症経路を決定する重要なツールであることを示唆している。
・RAでは、シトルリン化に関与する成分(酵素と基質の両方)、化学的に修飾された自己抗原(カルバミル化およびマロンジアルデヒド-アセトアルデヒド[MAA]付加体)、および修飾されていないタンパク質を含む、多くの自己抗体の特異性が定義されている。
・抗シトルリン化蛋白抗体(ACPA)はRAにおける免疫反応の特徴である。
・ACPAは、 HLA-DRβ1 対立遺伝子や PTPN22 遺伝子の多型などの遺伝的因子や、喫煙や感染症などの環境因子に関連するRAの自己免疫過程を同定している。
・シトルリン化酵素(ペプチジルアルギニンデイミナーゼ[PAD])を標的とする自己抗体もRA患者に認められる。
・抗PAD4抗体はより重篤な疾患と関連しており、診断および予後予測ツールとして有用である。
・抗PAD2抗体と抗RA33((heterogeneous nuclear ribonucleoprotein, 異種核リボ核蛋白A2/B1)抗体は軽症のRAと関連している。
・リウマトイド因子(RF)はIgG分子のFc部分を認識する自己抗体であり、RAで最初に報告された自己抗体である。
・RFのRAに対する特異性は限定的であるが、より重篤な疾患のマーカーとしては有用である。
はじめに
・自己抗体は、自己免疫性リウマチ疾患の診断や予測に非常に有用なツールであることが証明されている。
・多くの自己免疫性リウマチ性疾患は、伝統的に表現型特異性の高い自己抗体反応(例えば、全身性エリテマトーデス[SLE]における抗二本鎖DNA抗体やびまん性強皮症における高力価抗トポイソメラーゼ-1抗体など)によって特徴づけられてきたが、関節リウマチ(RA)の特異性の高い自己抗体マーカーの発見は、これらの他の疾患に比べ著しく遅れていた。
・過去20年間で大きな進歩があったが、その大きな原動力となったのは、RAにおいてシトルリン化タンパク質が自己抗体の特異的標的であるという発見であった。
・この発見により、RAにおいて自己抗体が標的とする重要な抗原決定因子として翻訳後修飾(post-translational modifications; PTMs)がクローズアップされ、この疾患における新たな自己抗体システムと発症メカニズムが同定されるに至った。
・現在では、RAにおける自己抗体の標的蛋白質は多種多様であり(表参照)、これらはそれぞれ異なる発症機序を反映していると考えられ、RA患者の臨床的多様性の一因となっている。

Pearl: RA患者ではシトルリン化タンパクに対する自己抗体に加えて、PADに対する自己抗体も検出される
Reality: Patients with RA can develop antibodies to the products of citrullination (i.e., citrullinated proteins) as well as the PAD enzymes themselves (i.e., PAD2 and PAD4).
・RA患者では、シトルリン化の産物(すなわち、シトルリン化蛋白質)に対する抗体だけでなく、PAD酵素そのもの(すなわち、PAD2およびPAD4)に対する抗体も生じることがある。
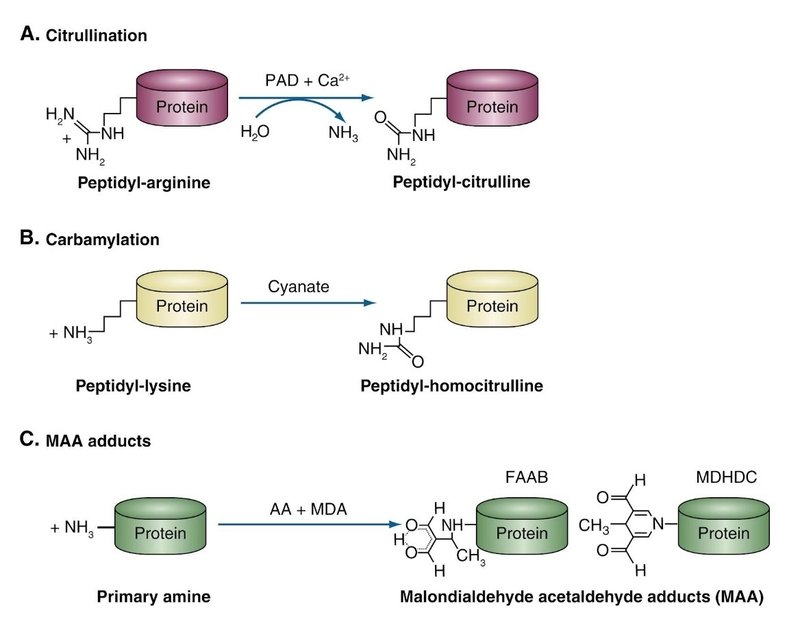
・関節リウマチではシトルリン化されたペプチドに対して自己抗体が産生されているというのは皆さん知っての通りと思います。これは、タンパク中に含まれるアルギニン残基が、PAD(ペプチジルアルギニンデアミナーぜ)の触媒により、水分子を利用しアミノ基の一つをアンモニアに分離した結果、シトルリンに変化する反応により生じます。
・ペプチジルアルギニン(=ペプチドについたアルギニン)がデアミ(アミノ基をはずす)するのがPADということです。
・関節リウマチでは様々なシトルリン化タンパクに対する自己抗体が検出されますが、PAD自身に対する自己抗体も検出され、臨床症状との一定の関連が知られています。
・シトルリン化タンパクに対する抗体が発見された経緯は非常に興味深いので簡単に紹介します。
①1964年ヒト頬粘膜の細胞において核を取り込むケラトヒアリン顆粒を染色する自己抗体を同定(抗核内因子; antiperinuclear factor; APF)、RAに対する疾患特異性は73~99%
②RA患者の血清が食道上皮の層状扁平上皮の抗原を認識することが判明、この染色性は抗ケラチン抗体(AKA)と呼ばれるに至った
③AKAの標的がヒト表皮におけるフィラグリン(フィラメント凝集タンパク質)の中性〜酸性のisoformであることがわかり、これまでAPFやAKAと呼ばれていたものが同じ自己抗体であることが判明
④フィラグリンは上皮細胞の分化後期に産生される。フィラグリンはプロフィラグリンという前駆タンパクとして顆粒内に産生され、分化の過程でタンパク質分解による切断を受ける。この切断の際にタンパクが脱リン酸化され、PADを介してアルギニン残基の多くがシトルリンに変換される。
⑤RA患者の血清では、このフィラグリンの中性アイソフォームを特異的に認識することがわかった。
⑥次に、RA患者血清がどのようにシトルリン化ペプチドを認識するか検証が行われた。方法としては、ヒトプロフィラグリンのアミノ酸配列から抗原性が高く、アルギニン残基が最も多い領域を選び、アルギニン残基をシトルリンに置換した合成ペプチドを作成した。そして、AKA/APF抗体がシトルリン化フィラグリンに対して、より強力な指向性があることがわかり、これはRAにおけるシトルリン化タンパクに対する抗体が、遊離したシトルリンではなく、ペプチドやタンパク配列の中にあるペプチジルシトルリンのみを認識する、という点が重要である。
⑦ただし、表皮はリウマチの標的ではなく、関節組織にはプロフィラグリンは発現していないため、関節局所での自己抗体の反応の原動力となっているかは疑問が残った。したがって、RAにおけるフィラグリンと自己抗体の関連は歴史的なものであり、病原性との関連は低い。
Myth: ACPAと抗CCP抗体は同一の抗体を指している
Reality: With the initial discovery of antibodies to specific citrullinated protein antigens, the term anti-citrullinated protein autoantibodies (ACPAs) was introduced to refer to RA autoantibodies detected using citrullinated proteins/peptides from putative RA-associated autoantigens, instead of filaggrin-derived or commercial CCPs. This is also the term now used to describe antibodies to citrullinated antigens that arise in patients with RA because anti-CCP antibodies are only those detected by the CCP assay.
・特異的なシトルリン化蛋白抗原に対する抗体が最初に発見されたことにより、フィラグリン由来や市販のCCPではなく、RA関連自己抗原と推定されるシトルリン化蛋白/ペプチドを用いて検出されるRA自己抗体を指すために、抗シトルリン化蛋白自己抗体(ACPA)という用語が導入された。
・抗CCP抗体はCCPアッセイで検出される抗体のみであるため、これは現在、RA患者で生じるシトルリン化抗原に対する抗体を表す用語としても使用されている。
・以下(小文字の部分)に抗CCP抗体の発見から、実際にACPAが標的とする抗原の発見に至る経緯を本文から抜粋します。
・合成されたCCPを標的とする抗体(=抗CCP抗体)がRA患者血清中に特異的に認められたわけですが、実際にRA患者血清中に含まれる抗体が認識する、罹患関節内のシトルリン化タンパクは100種類以上あるようです。これらのタンパクを”citrullinome”と呼び、このタンパクを認識する抗体を”ACPA”と呼んでいるのだと考えられます(多分)。
・その中でも特に臨床的に意義があると考えられているのが、フィブリノーゲン、ビメンチン、II型コラーゲン、およびα-エノラーゼに対する抗体です。
・これらのタンパクを特異的に認識するACPAの検出は一見役に立ちそうですが、今のところ既存の抗CCP抗体のassayに付加的な臨床的意義は見いだせておらず、抗CCP抗体の検出が今のところも重要であると考えられています。
・AKA/APF抗体の最初の特性評価では、フィラグリン由来の単一のC末端ペプチド(アミノ酸306から324)を用いて、5つのアルギニン残基をシトルリンに変化させた9つの変異体を、単独または対で作製し、これらのペプチドに対する免疫反応性を酵素結合免疫吸着測定法(ELISA)で測定した。
・興味深いことに、ペプチドはほとんど同じであったが、唯一の違いは、シトルリン残基のペプチド内での位置が異なっており、それぞれのペプチドに対する血清反応性には顕著な違いが見られた。このことは、シトルリン化がAKA/APF抗体による抗原認識に重要な役割を果たしているものの、抗体結合に影響を与える決定因子は修飾だけではないことを示唆している。
・ペプチドはしばしば抗体-ペプチド複合体の中でβ-ターン構造をとるので、システインで架橋された環状ペプチドは、抗体への親和性を高めて結合することが示されている。
・そこで、末端のセリン残基をシステインに置換し、ジスルフィド結合を形成してペプチドを環状化することにより、フィラグリンの環状シトルリン化ペプチドを作製した。
・この環状シトルリン化ペプチド(後に CCP1と命名)を直鎖ペプチドと比較したところ、環状構造は特異性に影響を与えることなく、アッセイの感度を68%対49%向上させることが示された。
・2000 年、CCP1 は、研究環境においてシトルリン化自己抗原に対する抗体を検出するために設計された第一世代の ELISA の抗原となり、 抗環状シトルリン化ペプチド(cyclic citrullinated protein; CCP)抗体と呼ばれるようになった。
・RAにおける自己抗体がシトルリン残基を含むペプチド配列を認識することはわかったが、フィラグリンがこれらの抗体の生理学的標的とは考えにくいという知見から、抗CCP
アッセイで検出される抗体の主要な標的タンパク質の探索が始まった。
・推定RA関連自己抗原由来のシトルリン化タンパク質/ペプチドを用いて検出されるRA自己抗体を指すために、 抗シトルリン化タンパク質自己抗体(anti-citrullinated protein antibody; ACPA)という用語が導入された。
・プロテオミクスアプローチと異なるソースからの抗原の解析を用いて、シトルリン化自己抗原候補が同定されている。これらには、ビメンチン、フィブロネクチン、アクチン、ヒートショックタンパク質(HSP)90、 ヒストン、異種核リボ核タンパク質(hnRNP)-A2/B1(RA33、RA33)、α-エノラーゼ、伸長因子-1α、アデニリルシクラーゼ関連タンパク質-1、 F-アクチンキャッピングタンパク質α-1サブユニット、アスポリン、カテプシンD、ヒスタミン受容体、タンパク質ジスルフィド異性化酵素、小胞体常在タンパク質60(ER60)前駆体、ミトコンドリアアルデヒド脱水素酵素、コラーゲンタイプIおよびII、 真核翻訳開始因子4G1、 アルドラーゼ、ホスホグリセリン酸キナーゼ-1(PGK1)、カルレティキュリン、HSP60、ファーアップストリームエレメント結合タンパク質(FUSE-BP)1および2、アポリポタンパク質E、骨髄核分化抗原( 表59.1)。
・このシトルリン化抗原群はRA抗体によって認識されるタンパク質を表しているが、リウマチ関節に見られるシトルリン化タンパク質の数はもっと多く、まだ特徴づけがなされていない100以上の分子が含まれている。
・これらのタンパク質を総称して RAシトルリノームと呼ぶ。 これらの分子一つ一つに固有のACPAが存在するのか、あるいはRAシトルリノーム内の数個のシトルリン化自己抗原のみが、RAにおける完全なACPA反応を促進する原因となっているのかは、まだ不明である。
・ACPAの中で、臨床的および病態的に最もよく特徴を表しているのは、フィブリノーゲン、ビメンチン、II型コラーゲン、およびα-エノラーゼに対する抗体である。
・ACPAを検出するために、これらの推定RA自己抗原に由来するシトルリン化タンパク質(フィブリノーゲンなど)またはシトルリン化ペプチド(ビメンチン、II型コラーゲン、α-エノラーゼなど)を用いたELISAベースのアッセイが開発されている。
・抗CCP ELISA法に比べ、単一の抗原を標的とするACPAの検出は、診断や予後に関する付加的な情報を提供するかもしれないと提唱されたが、この疑問に対する研究はまだ結論が出ていない。
・従って、臨床においてシトルリン化蛋白に対する抗体の存在を同定するためには、抗CCPアッセイが望ましい検査であることに変わりはない。
Pearl: タンパクのシトルリン化は、タンパク質の活性を変化させ、一般的には機能喪失をさせることが多い。
Reality: Unlike many other PTMs, citrullination appears to be an irreversible process, and enzymes that convert citrullinated pro- teins back to their native peptidylarginine containing forms have not been discovered. Because citrullination reduces the net charge of proteins by neutralizing one positive charge per arginine residue modified, it can increase protein hydrophobicity, lead to protein unfolding, and alter intra- and inter-molecular interactions. These structural changes can lead to alterations in protein activity, most commonly a loss of function.
・他の多くのPTMと異なり、シトルリネーションは不可逆的なプロセスであり、シトルリネーションされたプロテインを本来のペプチジルアルギニンを含む形態に戻す酵素は発見されていない。
・シトルリネーションはアルギニン残基1つにつき1つの正の電荷を中和することによりタンパク質の正味の電荷を減少させるので、タンパク質の疎水性を増加させ、タンパク質のアンフォールディングを引き起こし、分子内および分子間の相互作用を変化させる可能性がある。
・このような構造変化はタンパク質の活性を変化させ、最も一般的なのは機能の喪失である。
・ちなみにPADの活性を制御する重要な因子はカルシウムと酸化環境です。
Myth: PAD自体に対する自己抗体はRAの臨床症状と関連がない。
Reality: polymorphisms in the genes encoding PAD2 and PAD4 (PADI2 and PADI4, respectively) are independently associated with RA development, particularly in Asian populations. Although the susceptible haplotype generates a PAD4 molecule containing three amino acid substitutions in the N-terminal region (i.e., Gly55-Ser, Val82-Ala, and Gly112-Ala), current evidence suggests that these changes have no effect on the function of the protein. the PAD4 genotype may exert its effects on RA disease susceptibility as a consequence of its immunogenicity rather than its enzyme activity. Consistent with this hypothesis is the observation that, in addition to its ability to citrullinate RA autoantigens, PAD4 itself is an RA autoantigen. Although PADs can citrullinate themselves,antibodies to the PADs are distinct from ACPAs in that antibody recognition is independent of citrullination status. PAD4 autoantibodies are strongly associated with ACPAs, and are independently associated with the presence of radiographic joint damage in multiple studies.
・PAD2とPAD4をコードする遺伝子(それぞれ PADI2と PADI4)の多型は、特にアジア人の集団において、RA発症と独立して関連している。
・感受性ハプロタイプは、N末端領域に3つのアミノ酸置換(すなわち、Gly55-Ser、Val82-Ala、Gly112-Ala)を有するPAD4分子を生成するが、現在のところ、これらの変化はタンパク質の機能には影響しないことが示唆されている。
・PAD4の遺伝子型は、酵素活性よりもむしろ免疫原性の結果として、RA疾患感受性に影響を及ぼしている可能性がある。 RAの自己抗原をシトルリン化する能力に加えて、PAD4自体がRA自己抗原である可能性を示唆している。
・PADに対する抗体は、抗体の認識がシトルリン化の状態に依存しないという点で、ACPAとは異なる。
・RAに対するPAD4抗体の感度は23%〜45%で、特異度は95%以上である。PAD4自己抗体はACPAと強く関連しており、複数の研究でX線関節損傷の有無と独立して関連していることである。
・PADの遺伝子多型がRAの発症と関連、しかしアミノ酸配列の違いと機能には大きな変化はなく、PAD自体が抗原となり免疫原性がRAの発症と関連?してる?のかということです。ACPAの存在と強く関連しているということです。
・また、PAD3/PAD4に対する抗体は喫煙とは独立して、ILDのリスクと関連しているようで、PAD3/PAD4抗体が喫煙と相乗的に作用して肺疾患を誘発するという肺障害の2-hit theoryを支持するデータもあります。
・抗PAD4抗体は、PAD4の酵素活性を増強するユニークな能力を持っていて
RA病態の形成において新たな役割を果たしている可能性もある。
Pearl: shared epitope(SE)対立遺伝子はACPA陽性の関節リウマチの発症と強く関連している。この事実は、SEを含むHLA分子が、アルギニンを含むペプチドよりもシトルリン化ペプチドと優先的に結合することを示した研究によって裏付けられている。
Reality: A subset of HLA-DRB1 alleles termed the shared epitope (SE) alleles includes HLA-DRB1*0101, *0102, *0401, *0404, *0405, *0408, *0410, *1001, and *1402. SE alleles are named due to the presence of a similar amino acid sequence (QRRAA, QKRAA, or RRRAA) at position 70–74 of the β-chain in the peptide-binding groove.157 Although early studies identified SE alleles as inherited risk factors for RA development, the discovery of ACPAs revealed that SE was most strongly associated with ACPA-positive RA (see Fig. 59.3).158 This is supported mechanistically by structural studies, which have shown that SE-containing HLA molecules, preferentially bind citrullinated peptides over their arginine-
containing counterparts.
・共有エピトープ(SE)対立遺伝子と呼ばれる HLA-DRB1対立遺伝子のサブセットには、 HLA-DRB1*0101、*0102、*0401、*0404、*0405、*0408、*0410、*1001、*1402が含まれる 。 SE対立遺伝子は、ペプチド結合溝のβ鎖70-74位に類似のアミノ酸配列(QRRAA、QKRAA、RRRAA)が存在することから命名された。
・ACPAの発見により、SEがACPA陽性RAと最も強く関連していることが明らかになった。
・このことは、SEを含むHLA分子が、アルギニンを含むペプチドよりもシトルリン化ペプチドと優先的に結合することを示した構造研究によって、メカニズム的に裏付けられている。
・HLAのSE対立遺伝子以外の遺伝的要因としては、 PTPN22遺伝子の一塩基多型 (1858C/T)があります。ACPAと組み合わせるとRAに対して特異度100%で130倍のリスクが上昇します笑
Myth: ACPAは血清以外からは検出されない
Reality: There is growing support for the hypothesis that aberrant protein citrullination and breach of immunologic tolerance to citrullinated antigens initially occurs at mucosal sites, such as the oral mucosa, the lungs, and the gastrointestinal tract. In support of this hypothesis, ACPAs of the immunoglobulin (Ig)A class (an isotype associated with mucosal immunity) are found in about one-third of patients with recent-onset RA; and ACPAs can be detected in the sputum of individuals at risk of developing RA.
・タンパク質のシトルリン化異常とシトルリン化抗原に対する免疫寛容の破綻は、口腔粘膜、肺、消化管などの粘膜部位で最初に起こるという仮説に対する支持が高まっている。
・この仮説を支持するものとして、ACPA-IgAは、最近発症したRA患者の約3分の1に認められ、ACPAはRA発症リスクのある人の喀痰からも検出される。
Myth: ACPA自体はin vivoでも病原性を有している。
Reality: Mechanistically, in vitro evidence suggests that ACPAs can activate both the classic and alternative pathways of complement,203 and that ACPA immune complexes drive macrophages to produce TNF via engagement of Fcγ receptors and Toll-like receptor 4. Whether ACPAs may be pathogenic in vivo still remains an open question.
・ACPAは補体の古典的経路と代替経路の両方を活性化することができ、ACPA免疫複合体はFcγ受容体とToll様受容体4の関与を介してマクロファージにTNFを産生させることがin vitroの証拠から示唆されている。
・マウスの免疫によって生成されたシトルリン化II型コラーゲンに対するモノクローナル抗体は、関節軟骨に対する交差反応性によって関節炎を引き起こす可能性がある。 しかし、これらの所見はRA患者由来のACPAを用いても再現されていない。
・RA由来のモノクローナルACPAがマウスに疼痛を誘発し、in vitroで破骨細胞を活性化することが示唆された研究もあるが、これらの実験に用いられたモノクローナルACPAはシトルリン化残基に対する特異性を持たないことが後の研究で示されたため、これらの知見には疑問が呈されている。
・したがって、ACPAがin vivoで病原性を示すかどうかは、まだ未解決の問題である。
・ACPA自体が生体内でRAの発症を含めどのように悪さをしているかはまだよくわかっていないということですね。
Pearls: カルバミル化タンパク質に対する抗体(抗CarP抗体)はACPA陰性関節リウマチで比較的高頻度に検出される自己抗体である。
Comment: Using carbamylated–fetal calf serum and carbamylated-fibrinogen as surrogate antigens in ELISA assays, IgG and IgA antibodies recognizing homocitrulline-con- taining proteins (thereafter anti-carbamylated protein [anti-CarP] antibodies), were identified in more than 40% of patients with RA.
・カルバミル化子牛胎児血清とカルバミル化フィブリノーゲンを代用抗原としたELISA法により、ホモシトルリン保持蛋白を認識するIgG抗体とIgA抗体(以後、抗カルバミル化蛋白[抗CarP]抗体)がRA患者の40%以上で同定された。
・カルバミル化またはホモシトルリン化は、リジン残基がホモシトルリンに変換される非酵素的な翻訳後過程で、尿毒症、炎症、喫煙などシアン酸塩濃度を高める条件下では、カルバミル化が蓄積していきます。
・RAにおいてカルバミル化抗原が生成されるメカニズムはまだ不明ですが、炎症そのものがRAにおけるカルバミル化の亢進の引き金になっている可能性があります。
・RA患者の関節内の好中球から放出されるミエロペルオキシダーゼ(MPO)がチオシアン酸塩からシアン酸塩への変換を促進し、カルバミル化をさらに促進する可能性があります。
・今のところ、抗CarP抗体が標的とするタンパクがよくわかっていませんが、 α1-アンチトリプシンがRA患者の関節液中で大量にカルバミル化されていることが判明しており、抗CarP抗体の有力な標的抗原として注目されています。
・ACPA、抗CarP抗体以外の翻訳後修飾タンパクに対する抗体としてはマロンジアルデヒド-アセトアルデヒド(MAA)付加物に対する抗体が知られています。ACPA陰性RAの88%に認められるようです。ただし、RAに特異的な自己抗体ではない点に注意が必要です、
Pearls: RA患者においてRFが生じるメカニズムは完全には解明されていない
Comment: The mechanisms that drive the production of RF in people with RA are not fully understood. The presence of somatic hypermutation in RFs and the evidence that these antibodies are produced by plasma cells in the rheumatoid synovium have suggested that the RF response is driven locally by antigen.
・RA患者においてRFが産生されるメカニズムは完全には解明されていない。
・RFでは体細胞超変異が生じている事実や、これらの抗体がリウマチ患者の滑膜局所に存在する形質細胞によって産生されるという証拠から、RFが抗原によって局所的に駆動されていることが示唆されている。
・しかしながら、IgGがどのようにして関節リウマチ患者の関節滑膜において、自己免疫反応の標的になるのかはまだ不明である。
・ACPAなどの抗PTM抗体のように、RFが標的とするIgGが抗体認識のためにPTMなどの修飾を必要とする証拠はありません。
・関節リウマチにおいてRFが持つ役割はいくつも検証されており、免疫複合体の形成、細胞性抗原捕捉の増幅、シグナル伝達、エフェクター機能などである。それ以外にもACPA免疫複合体の補体を活性化し、マクロファージによる炎症性サイトカイン産生を刺激する能力を高めることが示唆されています。
・このように、RFはRAに特異的ではないですが、RA特異的な自己抗体の病原性を増強する役割があるのかもしれません。
・これまでの自己抗体の役割とRAの病態形成については以下のfigureがまとまっています。

RA発症のフィードフォワードモデル:
・シトルリン化関連抗体の重要な役割
・いったん免疫反応が始まると、標的組織の破壊と疾患のひろがりがフィードフォワードのループを形成し、その結果、臨床的に明らかなRAが発症する。
(A)シトルリン化関連自己抗体は、関節内のシトルリン化タンパク質やペプチジルアルギニンデイミナーゼ(PAD)酵素に結合し、炎症経路を活性化したり、損傷を誘発したりする。これは免疫複合体の形成によって媒介され、補体を固定したり、細胞性免疫や液性免疫を介して抗原発現細胞に障害を誘導したりする。
(B) ICは樹状細胞やマクロファージなどの抗原提示細胞(APC)によって認識され、シトルリン化ペプチドの提示と炎症性サイトカイン(腫瘍壊死因子(TNF)、インターロイキン(IL)-6、IL-1βなど)の産生を促進する。 リウマトイド因子(RF)はICと結合し、これらの免疫反応をさらに増幅させる。
(C)自己反応性T細胞は、サイトカインを分泌し、炎症細胞をリクルート/活性化することにより、細胞傷害性顆粒経路を介して組織破壊を媒介する。
(D) PAD酵素を豊富に含む好中球と単球が関節に動員される。PAD活性とシトルリン化タンパク質の生成は、免疫エフェクター経路によって誘導され、PAD発現細胞の活性化と死滅を促す。
(E) 損傷した細胞はPADとシトルリン化タンパク質をRA関節に放出し、免疫反応を伝播するシトルリン化関連自己抗原の継続的な供給源となる。抗PAD4抗体は、細胞外のPAD4を安定化し活性化することで、このプロセスをさらに増幅させる可能性がある。
この記事が気に入ったらサポートをしてみませんか?
