
有機金属化学の基礎(1)「18電子則」
有機金属化合物は,配位子(有機化学)と中心金属(無機化学)により,構造,反応性が決まる。
ここでは有機金属化学の基礎について解説していきます。
なお,本連載は不定期で行います。
有機化学の視点から解説するため,有機化学の基礎事項についての解説は省略しますが,無機化学の基礎事項についてはなるべくフォローしながら解説していきます。
今回のテーマは「18電子則」です。
遷移金属の特徴
今回のテーマである「18電子則」に入る前に,遷移金属の特徴を見てみましょう。
d軌道電子による支配
有機金属化合物が通常の有機化合物と特性が大きく異なる理由は,(中心)金属の電子状態に依存しております。
周期表における第3から11族の金属は遷移金属と呼ばれ,典型元素とは反応性や性質が大きく異なる。
(11族は半遷移金属に分類されることも)
これは遷移金属の性質がd電子に支配されているためです。
周期表の第3周期金属は3d軌道(周期表の赤枠),第4周期金属(周期表の青枠)は4d軌道により支配される。
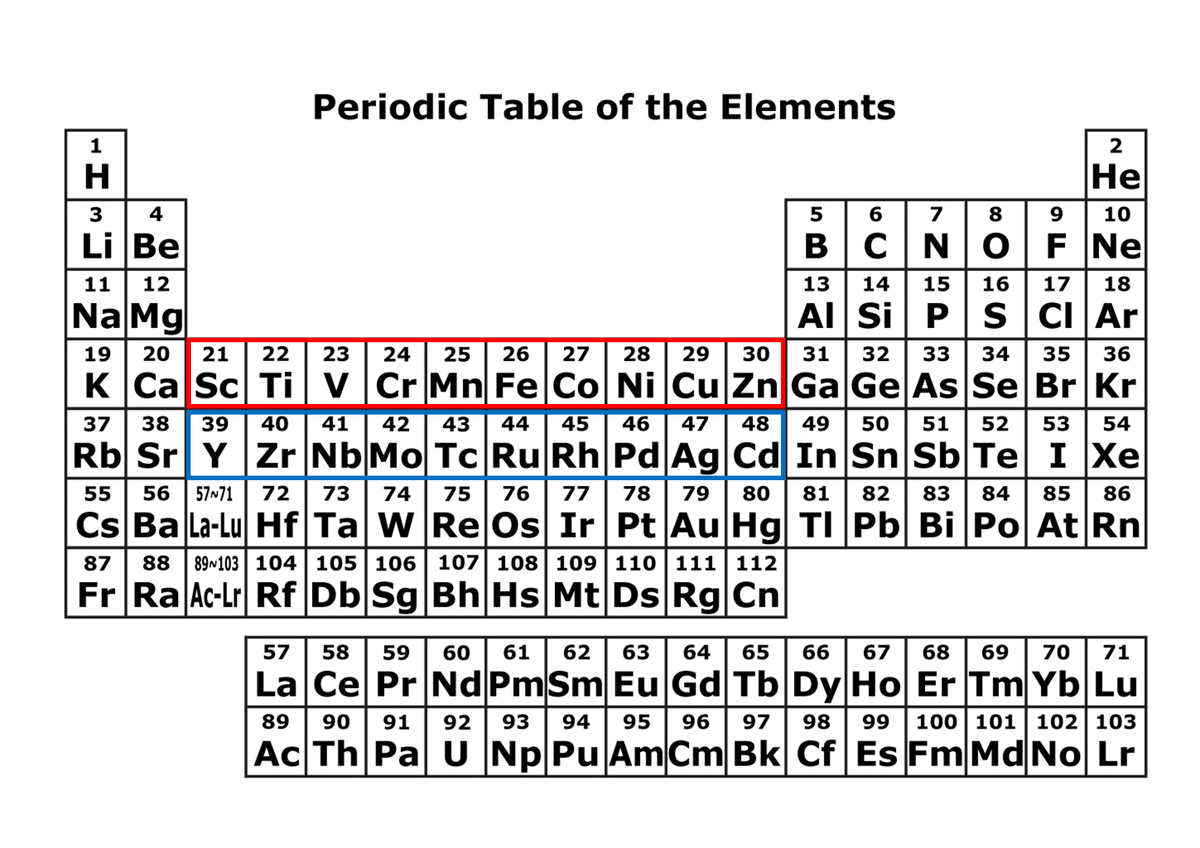
なお,ランタノイド,アクチノイドと呼ばれる金属種はf軌道電子による支配を受けているため,d軌道金属とは異なる性質を持っている。
本連載ではd軌道電子を主として取り扱う。
d軌道のエネルギー
d軌道には5つの軌道(dxy, dyz, dzx, dz2, dx2−y2)がある。
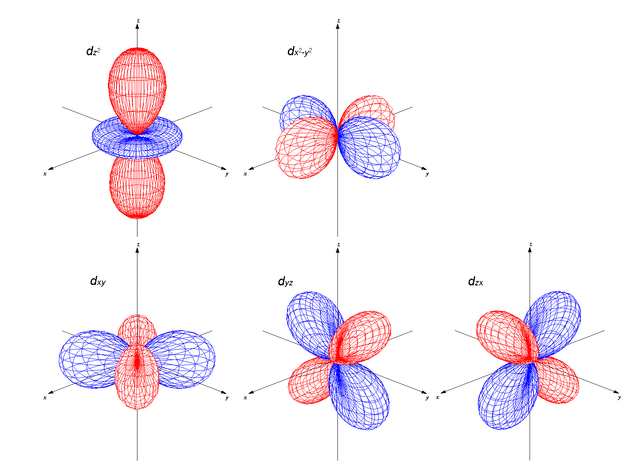
s軌道,p軌道と大きく異なる点として,これら5つの軌道エネルギーは等価ではないことである。
d軌道はエネルギーから,『dxy, dyz, dzx』と『dz2, dx2−y2』の2つに分けられる。
どちらの軌道エネルギーが大きくなるかは錯体の配位構造によって異なる。
これは結晶場理論や配位子場理論によって説明できる。
結晶場理論や配位子場理論については長くなってしまうため,今回は大雑把な結果のみについて説明する。
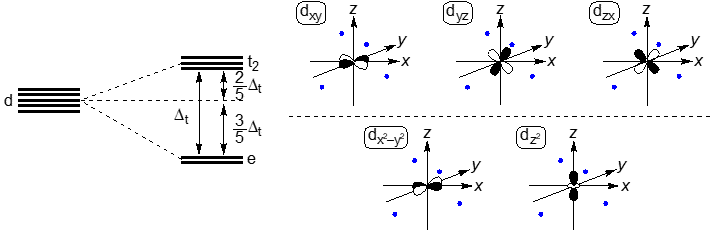
例えば,正八面体構造錯体(Oh)は,『dz2, dx2−y2』の2つの軌道エネルギー(eg軌道)の方が高く,『dxy, dyz, dzx』の3つの軌道エネルギー(t2g軌道)の方が低くなる。

一方,正四面体構造錯体(Td)では軌道エネルギーの高低が逆転する。
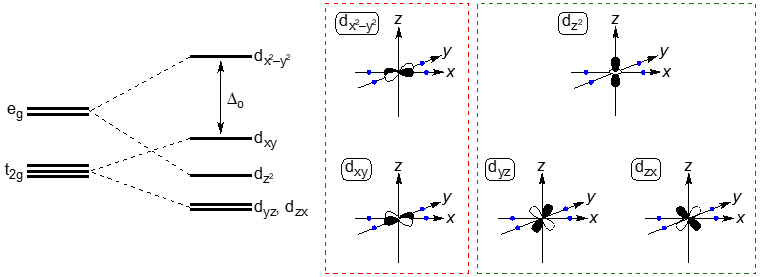
さらに複雑なのは平面四配位錯体(D4h)でエネルギー準位が4つに分裂する。
金属のd電子数
実際の金属のd電子数は周期表の順番で決まる。
3d金属を順に並べると,
Sc(d3),Ti(d4),V(d5),Cr(d6),Mn(d7),Fe(d8),Co(d9),Ni(d10),Cu(d10s1),Zn(d10s2)
となる。
酸化数を考える上ではこのd電子数が重要になる。
18電子則
酸化数の数え方
有機化学では形式電荷を考えるが,無機化学では形式酸化数を考える必要がある。
形式電荷の場合,結合の電子はそれぞれの原子に半分ずつ分けて数え,電子数の増減があれば形式電荷が発生する。

一方,形式酸化数の場合は,結合電子は電気陰性度の大きい原子にのみ帰属される。

遷移金属は配位子と比較して電気陰性度が小さいことが多い。
そのため,通常の電子数よりも少なくなることがある。
これが形式酸化数である。
例えば,塩化鉄(III)の3は形式酸化数であり,配位子であるClのほうが電気陰性度が大きいため,鉄の電子数が3少なくなっている。
中心金属の電子状態
前述の通り,遷移金属に配位子が配位した状態(錯体,有機金属化合物)では,電気陰性度の差から形式電荷が必ず生じると言ってよい。
配位子との結合の電子も中心金属に含まれていると考える,つまり有機化学で言うOctet則で考えると,ほとんどの場合18電子になることで,化合物が電子的に安定化される。
これを18電子則と呼ぶ。
例えば,Mn(I)CO5Me錯体の場合について考える。
Mnの電子数がd7で酸化数が1なので,Mn(I)はd6となる。各配位子から12電子がMn(I)へ供与されるため,Mn原子は18電子となる。
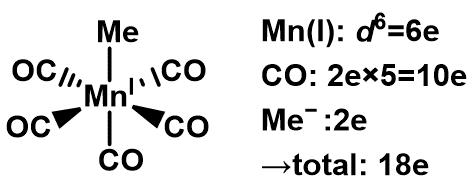
18電子則の例外
Octet則にホウ素やアルミニウムで例外があるように,18電子則の場合も例外がある。
Octet則を満たさない化合物は空気下で不安定だが,18電子則を満たさない化合物は空気下で取り扱える場合も多い。
①嵩高い配位子による速度論安定化
tert-ブチル配位子のような嵩高い配位子の場合,18電子則を満たさなくても錯体は安定に存在し得る。
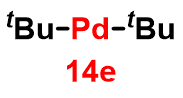
②前周期遷移金属錯体
前周期遷移金属はそもそもd電子数が少ないため,18電子則を満たさない場合もある。

※本連載は不定期連載であるため,次回更新日は未定です。
この記事が気に入ったらサポートをしてみませんか?
