
微生物叢に対するIgA応答
微生物叢に対するIgA応答
ジェフリー・J・バンカー、アルベルト・ベンデラック
論文情報
要旨
常在する微生物叢のかなりの部分が、恒常性維持のためにIgA抗体で覆われている。ここでは、この膨大な数の細菌抗原に対抗するために粘膜で展開される体液性戦略およびメカニズムについて論じる。恒常性維持のためのIgA応答は、微生物群の幅広い、しかし分類学的に異なるサブセットと結合するために、高度に多反応性なレパートリーを用いている。これらの抗体は、限られたT細胞の助けのもとで生じ、体細胞変異率が低く、親和性がほとんど成熟しない。このような過程は、粘膜病原体やワクチンによって引き起こされる高親和性T細胞依存性抗体反応の古典的パラダイムとは対照的であるが、微生物叢の抗原性の複雑さという課題に対する単純な免疫学的解決策を提供するものである。このモデルは、多反応性特異性がどのように生成されIgAレパートリーに選択されるのか、これらの抗体はどのようにエフェクター機能を発揮するのか、恒常性や疾病において他の免疫応答とどのように共存あるいは重複するのかなど、いくつかの基本的な将来の疑問を提起している。
はじめに
消化管環境は、免疫系にとって非常に大きな挑戦である。ここでは、食事や常在細菌叢からのほとんど無害な外来抗原と、時折発生する有害な病原体が複雑かつダイナミックに混在しており、古典的な寛容のメカニズムに挑戦することになる。そのため、粘膜組織とは異なる機能を果たす、多くのユニークな免疫学的メカニズムが出現している(Honda and Littman, 2016)。粘液、抗菌ペプチド、免疫グロブリンA(IgA)抗体からなる恒常性バリアは、内腔抗原とその下の上皮の間の分離を維持し、微生物叢と病原体の両方に対する第一線の防御として機能する。IgA抗体は、粘膜表面に非常に多く存在する。哺乳類の抗体分泌細胞(PC)の80%以上が腸に存在し、IgAアイソタイプを発現している(Fagarasan et al.、2010)。注目すべきは、これらの抗体は、炎症や免疫のない恒常性維持期に顕著に生じることである。しかし、IgAが豊富に存在するにもかかわらず、生体内におけるIgAの特異性と機能は謎のままであった。IgAが常在菌の細胞表面を覆うことは古くから知られていたが (Kroese et al., 1996; Tsuruta et al., 2009; van der Waaij et al..., 1996)、ハイスループット配列決定と組み合わせた細菌フローサイトメトリーを活用する最近の進歩は、IgA被覆細菌の同定を容易にし、免疫系による標的化につながる免疫学的メカニズムを明らかにした(Bunkerら、2017;Bunkerら、2015;Kauら、2015;川本ら、2014;Kubinakら、2015;Palmら、2014;Plainerら、2016)。驚くべきことに、これらの研究は、常在菌に対する恒常性反応と、病原体やワクチンに対する体液性免疫の古典的なパラダイムとの間の実質的な差異を明らかにしている。ここでは、文献をレビューし、2つの異なるタイプの体液性免疫が消化管粘膜に共存するモデルを提案する。第一は、常在菌に対する恒常的な反応であり、天然の多反応性特異性を持ち、T細胞の助けがほとんどなく、体細胞超変異や親和性成熟がほとんどない状態で分化する。第二は、病原体に対する防御反応であり、全身反応に類似したメカニズムによって胚中心で生成される高親和性かつ特異的な抗体の産生に関与するものである。これらの経路が恒常性維持や疾病時にどのように重なり合い、共存しているのかを明らかにすることは、今後の研究の重要な方向性を示している。
粘膜抗体の進化
IgMアイソタイプは、すべてのB細胞系譜の特徴であり、すべての顎脊椎動物において古くから高度に保存されている(Flajnik and Kasahara, 2010)。一方、IgAは比較的最近出現し、爬虫類、鳥類、哺乳類にのみ存在する。マウスは単一のIgAサブタイプを発現しているが、ヒトはIgA1およびIgA2と呼ばれる2種類のサブタイプを発現している。下顎の脊椎動物にはIgAが存在しないが、これらの生物の多くは収斂進化により生じた特殊な粘膜抗体アイソタイプを発現している。骨魚類は腸管組織にIgTを発現し、これらの抗体は腸内細菌叢を覆っている(Zhang et al.、2010)。両生類はIgX腸管抗体を発現している(Mussmann et al.、1996)。興味深いことに、粘膜抗体は共通の多量体構造を示す。IgAは通常2量体であるのに対し、IgXは5量体、IgTは4量体である(Mussmannら, 1996; Zhangら, 2010)。注目すべきは、IgT+およびIgX+の両PCは、後に詳述するように、マウスのIgAレパートリーのかなりの部分およびヒトのIgA2反応と同様に、T細胞の助けがない状態で分化するように見える(Bunkerら, 2017; Bunkerら, 2015; Heら, 2007; Macphersonら, 2000)ことである。これらの観察を総合すると、強い進化的圧力が特殊な粘膜抗体の出現を促したことがわかる。
粘膜B細胞応答の解剖学と組織化
IgA+ PCの最大の集団は小腸(SI)固有層(LP)に存在し、一方、大腸LPはわずかな集団しか保有していない(Bunkerら、2015;McWilliamsら、1977;WalkerおよびIselbacher、1977)。高レベルの微生物叢IgAコーティングおよび遊離IgAもSIに存在し、大腸ではより低いレベルである(Bunkerら、2015;Kroeseら、1996;Tsurutaら、2009)。IgA+形質細胞の追加のマイナーな集団は、唾液腺、肺、乳汁分泌乳腺(LMG)、肝臓、および骨髄(BM)を含む腸管外組織で検出可能である(Bunkerら、2017;Moro-Sibilotら、2016;Rouxら、1977;Wilmoreら、2018)。ヒトIgAサブタイプは明確な解剖学的発現パターンを示し、血清ではIgA1が、遠位腸ではIgA2が優勢である(He et al.、2007)。
腸管関連リンパ組織(GALT)は、IgAが誘導される主要な部位である。これらには、パイエルズパッチ(PP)、腸間膜リンパ節(mLN)、孤立リンパ濾胞(ILF)、およびセカルパッチ(Craig and Cebra, 1971; Hamada et al, 2002; Macpherson and Uhr, 2004; Masahata et al, 2014; McWilliams et al, 1977; Tsuji et al, 2008)が含まれる。IgAはまた、LPにおいてin situで誘導される可能性があり(Fagarasanら、2001)、特定の常在菌によるコロニー形成に応答して、三次リンパ構造がLPで観察されている(Lecuyerら、2014)。活性胚中心(GC)は、PPおよびmLNに構成的に存在し、したがってこれらの組織は、IgA PC分化のT細胞依存(TD)および-非依存(TI)経路の両方をサポートする(Bunkerら、2015;Macphersonら、2000)。対照的に、ILFは、T細胞をほとんど含まず、主にTI分化を支持する(Hamadaら、2002;Tsujiら、2008)。生体内では、これらの構造の間にかなりの重複があると思われる。実際、PPの切除やmLNの外科的除去は、個々にIgA+ PCの存在量にほとんど影響を与えない(Macpherson and Uhr, 2004; Yamamoto et al, 2000)。リンパ毒素シグナル伝達または転写因子レチノイン酸関連オーファン受容体γt(RORγt)を欠くマウスは、すべてのGALT組織を欠き、これらのマウスは、IgA+ PCにおいて有意ではあるが不完全な減少を示す(Kangら、2002;Tsujiら、2008)。これらのGALT非依存性PCは、3型自然リンパ球(ILC3)による可溶性リンパ毒素α3の発現を必要とするTD機構を介してリンパ毒素β欠損マウスに生じるが(Kruglovら、2013)、野生型(WT)マウスにおけるこの経路の関連性は依然として不明である。これらのことから、GALTはIgA PCの分化に厳密には必要ではないが、生体内のIgA PCの大部分はこの組織に由来する可能性が高いことが示唆される。
IgAクラススイッチの組換え、ホーミング、維持、および分泌
IgAアイソタイプへのクラススイッチ組換え(CSR)、細胞の移動と維持、およびIgA抗体の分泌を制御する機構は、広範囲に研究されレビューされているが、ここでは簡単に述べるにとどめる (Cerutti, 2008; Kaetzel, 2005; Phalipon and Corthesy, 2003; Tuma and Hubbard, 2003)。IgMとIgDを発現するナイーブB細胞前駆体は、腸内微小環境に構成的に存在する特定の因子の存在下で、細胞活性化によりIgAアイソタイプへの切り替えを誘導されるが、クラス切り替えを誘導する正確なシグナルは、活性化のTDおよびTI経路で異なる。いずれの場合も、BCR刺激は、IgAクラススイッチングに必須な活性化誘導型シチジンデアミナーゼ(AID)の発現を誘導するのに必要である(Fagarasanら、2002年)。TNFスーパーファミリーレセプターを介した追加のシグナルは、CSRを促進する。T細胞とのCD40-CD40L相互作用は、TD反応において重要な役割を果たす。TI反応における同様のシグナルは、BAFF/APRILと、膜貫通活性化およびカルシウム調節シクロフィリンリガンド相互作用因子(TACI)、BAFF受容体(BAFFR)およびB細胞成熟抗原(BCMA)等の3つの潜在的受容体と相互作用を行うことで得られる (Cerutti, 2008; Litinskiyら, 2002)。IgAアイソタイプへのクラススイッチには、Cαスイッチ領域(Sα)での転写の誘導が必要であり、これによりAID活性とその後のDNA組換えの基質が生成される。Sαにおける転写は、形質転換成長因子β1(TGFβ1)、IL-4、IL-6、IL-10、およびレチノイン酸(Cazac and Roes, 2000; Cerutti, 2008; Reboldi et al, 2016; Watanabe et al, 2010)などのGALT組織に存在する多数の因子によって開始され得る。これらのうち、TGFβ1は、かなりの重複があると思われるが、in vivoで最も重要である(Cazac and Roes, 2000; Reboldi et al., 2016)。ヒトでは、IgA1またはIgA2 CSRはIgM+細胞で起こり得る;あるいは、IgA1+細胞で順次IgA1→IgA2 CSRが開始され得る(He et al.、2007)。In vivoでは、BAFFおよびTGFβ1活性化因子を含むIgA CSRを制御する因子の多くは、GALT濾胞樹状細胞(fDC)、形質細胞様DC、および従来のDCによって発現される(Reboldiら、2016; Suzukiら、2010; Tezukaら、2011)。注目すべきは、IgA CSRを規定する同じシグナルが、インテグリンα4β7およびケモカイン受容体CCR9およびCCR10の発現を誘導することによって、腸管LPへのホーミングのために細胞を刷り込むことである(Kunkelら、2003; Moraら、2006)。細胞の活性化、IgAのCSR、腸のインプリンティングの後、リンパ芽細胞はリンパ管を通じてGALTを離れ、血流に再び入る。腸管血管系を循環すると、α4β7、CCR9、CCR10とそれらのリガンドである粘膜血管アドレッシング細胞接着分子1 (MAdCAM-1) 、CCL25、CCL27、CCL28がそれぞれ相互作用し、腸管LPへの移行を指示する。
マウスSI IgA+ PCの平均半減期は5日、最大寿命は7〜8週間である(Mattioli and Tomasi, 1973)。IgA+ PC集団は異質であり、短命の主要組織適合性複合体クラスII+(MHCII+)細胞と長命のMHCII-細胞の両方を含む(Kawamoto et al.、2012);ヒトでは例外的に長命のPCも確認されている(Landsverk et al.、2017)。しかし、腸管PCの維持とターンオーバーを制御する因子は、部分的にしか理解されていない。腸管上皮細胞および好酸球によって産生されるインターロイキン-6(IL-6)は、PCの維持に寄与する(Chuら、2014年;Ngら、2003年;Ramsayら、1994年)。腸管上皮細胞、好酸球、樹状細胞(DC)、および形質細胞様DCが産生するB細胞活性化因子(BAFF)および増殖誘導リガンド(APRIL)も同様にPCの生存を促進し(Chuら, 2014; Heら, 2007; Huardら, 2008; Tezukaら, 2011; Wangら, 2017)、追加の未確認因子も貢献していると思われる。注目すべきは、ほとんどの腸管PCがその細胞表面にB細胞受容体(BCR)を発現していることである(Di Niroら、2010);PCがそのBCRを介して信号を受け取ることができることを示唆するいくつかの証拠があるが(Blancら、2016;Pintoら、2013)、腸管PCが生体内でそのBCRを介して抗原を信号伝達または内在化するかどうかは依然として不明であり、PC維持における表面BCR発現の役割も不明なままである。
粘膜表面におけるIgA分泌の重要な経路には、高分子Ig受容体(pIgR)が関与している(Kaetzel, 2005; Phalipon and Corthesy, 2003)。粘膜分泌物中のIgAは、単量体も検出されるが、J鎖と呼ばれる小さなポリペプチドが連結した二量体として主に存在する(Iversen et al., 2017; Koshland, 1985)。 pIgRは腸管上皮細胞の基底側面表面に発現し、高分子IgAおよびIgMに選択的に結合する。結合すると、抗体は内在化され、トランスサイトーシスにより上皮細胞の頂膜表面に輸送され、そこでタンパク質分解により、分泌成分(SC)として知られるpIgRの高グリコシル化80kDa断片に結合した抗体が放出される。この二量体IgA、J鎖およびSCの複合体は、分泌型IgA(SIgA)と呼ばれる。多くの研究において、pIgR欠損マウスがSIgA欠損のモデルとして使用されてきた。しかし、これらのマウスの解析は、SI IgA力価の2〜3倍の欠損、糞便IgAの5〜10倍の減少、および母乳IgAの欠損のみを示す(Johansenら, 1999; Rogierら, 2014)。これらのデータは、傍細胞輸送などの代替経路がpIgRの損失を補うことができ、定常状態のIgA分泌にも寄与している可能性を示唆している(Van ItallieおよびAnderson、2006)。
微生物叢を標的とした恒常的なIgA応答の機序
微生物叢に対するIgA応答は、TIおよびTD経路の両方を介して起こり(Bunkerら、2015;Macphersonら、2000)、以下に詳細に検討する微生物叢の分類学的に異なるサブセットを標的としている。IgA+ PCの前駆体には、循環するナイーブ濾胞B2細胞及び生得的な腹膜B1b細胞が含まれ、天然血清IgM応答に寄与する腹膜B1a細胞は、IgAレパートリー内で観察されない(Bunkerら、2015;Mcphersonら、2000;Reynoldsら、2015;Royら、2013)。全身性免疫の古典的モデルでは、TI応答は、細菌多糖類などの多価抗原に応答して起こり、体細胞超変異(SHM)がほとんどない急速な細胞分化を伴う。対照的に、TD反応は一般的にタンパク質抗原を標的とし、CD4+ T濾胞ヘルパー細胞(Tfh)との同族体相互作用に基づいて、GCにおいてSHMと親和性の選択を繰り返し行う(Victora and Nussenzweig, 2012)。しかし、恒常的な粘膜IgA応答がこれらのプロセスにどの程度まで類似しているかは不明であり、いくつかの証拠が異なるメカニズムおよび制御を示唆している。
第一に、恒常性IgA抗体による個々の微生物抗原の特異的かつ高親和性認識は証明されていない。代わりに、モノクローナル抗体(mAbs)の研究は、IgA由来の抗体が一般的に多反応性であり、リポ多糖、DNA、フラジェリン、及び莢膜多糖(図1A)を含む多数の微生物抗原に低親和性結合を示すことを示している(Benckertら、2011;Bunkerら、2017;Fransenら、2015; Petersonら、2007; Petersonら、2015;Quanら、1997;Shimodaら、1999)。さらに、相当数の天然SI IgA PCが、外来抗原のない無菌(GF)マウスまたは抗原除去食を与えたGFマウス(GF/AF)において分化し、これらのIgA+ PCからクローニングされたmAbsは、特定病原体フリー(SPF)マウスのIgAで通常被覆された同じ細菌に結合できる(Bunker他、2017;Fransen他、2015;Wijburg他、2006)。さらに、ナイーブB細胞またはインフルエンザ特異的応答からクローニングされたランダム多反応性mAbsは、in vivoでIgAでコーティングされる微生物群の同じサブセットに結合する(Bunkerら、2017)。病原体によって誘発された糖鎖反応性であるがポリ反応性でない抗体も、常在菌に対して一般的に交差反応する(Rollenskeら、2018)。これらのデータを合わせると、抗体多反応および関連する自己反応性がIgA選択の主要なドライバーである可能性が示唆され、IgA多反応が複数の細菌表面分子への低親和性結合を可能にするというモデルが支持される(図1A)。

図1
図1
IgAで被覆された細菌の分類と標的化のメカニズム
マウスナイーブB細胞前駆体のごく一部は、多反応性特異性を発現し、生殖細胞の構成で微生物相を認識することができる(Bunkerら、2017)。これらの多反応性細胞は再循環し、PPなどのGALTで優先的に分裂するように誘導され、そこでケモカイン受容体CCR6の発現をアップレギュレートし、IgDをダウンレギュレートする(図2)(Bunkerら、2017;Reboldiら、2016)。CCR6シグナルは、PP上皮下ドーム(SED)への移動を指示し、そこでCD11c+CD11b+およびCD11c+CD11b-CD8-DCとの相互作用を介してTGFβ1シグナルを受け取る(Reboldi et al.,2016)。この細胞経路は、潜伏関連ペプチド(LAP)に結合して活性型TGFβ1を遊離するインテグリンαvβ8のDC発現を必要とする機構を介して、CCR6+細胞におけるIgA CSRを開始する(図2)(Reboldi et al.、2016)。SEDでシグナルを受け取ったB細胞は、CCR6をダウンレギュレートしてPP濾胞に戻り、そこで分化を継続する。脾臓細胞移植後、PPの実質的にすべての分裂するB細胞はCCR6を発現し、したがってこの集団は、おそらくTIおよびTD経路の両方を介して分化する細胞を含むが、CCR6欠損マウスはより深いTD欠損を示す(Bunkerら、2017;Reboldiら、2016)。注目すべきは、in vivoにおけるこの経路の関連性がPPにおいてのみ実証されていることであり、対照的に、mLN IgA応答はCCR6欠損によってほとんど影響を受けない(Reboldiら、2016)ことから、CCR6非依存経路がさらに寄与する可能性があることが示唆されたことである。

図2
図2
パイエル板におけるIgA選択機構
PPおよびmLN GCにおける恒常的IgA応答のSHMおよび親和性成熟も、全身性応答と大きく異なる可能性がある。SHM分布およびT細胞欠損マウスの解析は、SI IgA+ PCレパートリーがTIおよびTD特異性の混合物であることを示す:若いマウスおよびヒトでは、PCの〜75%が変異しており、おそらくTD由来であり、TD特異性の頻度は年齢とともに増加する(Bunkerら、2017年;Lindnerら、2015年;Lindnerら、2012年)。しかしながら、GALT GCは明らかにT細胞に依存しているが、微生物叢からの抗原に対する親和性成熟は証明されていない(Bunkerら、2015;Casolaら、2004;Guy-Grandら、1975;Macphersonら、2000)。BCRを欠くが構成的に活性なBCR代替物LMP2Aを発現するB細胞は、GALTにおいてGCを形成するが、腸管外リンパ組織では形成しない(Casolaら、2004)ことから、GC B細胞の分化が、同族抗原の不在下で起こりうることが示唆される。さらに、PP GC細胞におけるSHMパターンの慎重な解析は、親和性駆動型選択ではなく、DNA配列内在性AIDホットスポットによって駆動されるランダム変異を示唆している(Yeapら、2015年)。さらに、IgA PCにおけるアミノ酸置換とサイレント変異の比率は約2:1であり、これも選択のないランダムSHMを示唆する(Bunkerら、2017年)。多くの変異IgA mAbsは多反応性である:GCにおいて多反応性が獲得され得ることを示す研究もあるが(Mouquetら、2010;Tillerら、2007)、IgA mAbsの多反応性は通常、変異を生殖系列に戻した際に維持された(Bunkerら、2017)。さらに、T細胞、CD40、またはGCを欠くマウスの解析は、一握りの稀で非定型な常在菌を除いて、微生物叢のほぼ正常なIgAコーティングを示す(Bergqvistら、2006;Bergqvistら、2010;Bunkerら、2015)。おそらく、GALT組織における例外的に多様な抗原負荷と、非タンパク質抗原に対するT細胞ヘルプの希少性が、親和性成熟を妨げ、代わりに多反応性を選択するのであろう。さらに、TD経路を介して生成された記憶細胞は、TI刺激に応答して再活性化する可能性があるため、TIおよびTD経路は、いくつかの状況において絡み合っている場合がある(Magriら、2017)。このように、TIとTDの両方の応答が恒常的なIgAレパートリーに寄与しているが、これらの応答間の特異性の明確な差は記録されていない。対照的に、ワクチン接種または粘膜病原体に応答するPPにおけるIgA親和性成熟は、十分に文書化されており、恒常性応答とは機構的に異なる可能性がある(図2)(Bergqvistら、2013年)。
恒常的なTDおよびTI応答は、特異性において大きな違いを示さないが、T細胞は他の機構を介してIgA応答に影響を与える。注目すべきは、T細胞欠損マウスは、腸のIgA+ PCの存在量の著しい減少、及び腸外組織におけるIgA+ PCのほぼ完全な欠如を示す(Bunkerら、2017;Bunkerら、2015;Macphersonら、2000)ことである。先に述べたように、SI IgA+ PCのかなりの集団は、微生物叢または食事抗原の非存在下で分化することができる;しかしながら、これらのIgAは、大部分が変異していない(Bunkerら、2017;Lindnerら、2012)。GF PPではCCR6+分裂細胞が検出可能であるが、GCはほとんど存在しない(Kubinak et al.、2015)。実際、TD IgA応答を開始するためには、普遍的アダプタータンパク質である骨髄分化一次応答88(MyD88)を介したTLRを介した微生物シグナルのT細胞内在性感知が必要であると考えられる(Kubinakら、2015年)。この経路は、おそらくTfhおよびフォークヘッドボックスP3+(FoxP3+)T濾胞制御(Tfr)細胞の両方におけるMyD88シグナル伝達を含む(Kubinakら、2015年;Wangら、2015年)。粘膜Tfh/Tfrの起源及び特異性は依然として十分に理解されておらず、異なる研究は、これらの細胞がナイーブCD4+T細胞、Th17細胞、又はT制御細胞のいずれかから分化する可能性を示唆している(Congら、2009;広田ら、2013;川本ら、2014;Tsujiら、2009)。さらに、GALT Tfh/TfrとGC B細胞との相互作用が、どの程度まで同族抗原認識に依存するかは、依然として不明である。Tfhによる高親和性の同族抗原認識は、病原体に応答して親和性を成熟させるのに必要であるが、IgA PCが親和性成熟の兆候をほとんど示さないという観察は、GALTにおいて恒常性の間に他のメカニズムが働いている可能性を示唆するものである。例えば、自己反応性T細胞との低親和性相互作用、多反応性BCRによる多様なタンパク質および非タンパク質抗原の内在化および提示による特異性の異なるT細胞クローンによる連続的認識、および/またはサイトカイン駆動型相互作用が含まれる可能性がある。Tfhの特異性がIgAレパートリーにどの程度影響するかはまだ不明であるが、PD-1などの他のT細胞因子はTD IgA応答を負に制御することができる(Kawamoto et al.、2012)。まとめると、これらの観察結果は、T細胞による微生物叢の本質的な感知がGC形成を促進し、IgA応答の規模を増大させ、腸管外IgAの移動を促進し、IgAレパートリーをランダムに多様化するというモデルを支持するものであった。
IgA-seqとIgAで被覆された微生物相の同定
生体内でIgAに結合した常在菌は、生体外で直接採取した微生物叢を抗IgA検出試薬で染色した細菌フローサイトメトリーを用いて研究することが可能である。ヒトおよびマウスの微生物叢に関する初期の研究から、生体内でIgAで被覆されている常在菌はごく一部であることが明らかになった(Kroese et al, 1996; Tsuruta et al, 2009; van der Waaij et al, 1996)。近年、バクテリアフローサイトメトリーとハイスループット16S遺伝子アンプリコン(IgA-seq)と呼ばれるシーケンシングを組み合わせることで、新たな知見が得られている。この技術により、IgA結合または非結合細菌の完全なレパートリーを、in vivoで比較的偏りなくプロファイリングすることができる。いくつかの研究室が独立してIgA-seqの変種を開発し、これらの研究は、IgA抗体の頻繁な多反応性にもかかわらず、微生物叢の分類学的に異なるサブセットがマウスおよびヒトのin vivoでIgA抗体で被覆されることを普遍的に明らかにした(Bunker et al, 2017; Bunker et al., 2015; Dzidic et al., 2017; Kau et al., 2015; Kawamoto et al., 2014; Koch et al., 2016; Kubinak et al., 2015; Palm et al., 2014; Planer et al., 2016; Wilmore et al., 2018)があります。対照的に、ほとんどの微生物は、モノコロナイズド・グノトビオティックマウスにおいてIgAコーティングになることができ(Geva-Zatorskyら、2017)、おそらくモノコロナイズのアーティファクトを表している。さらに、IgA抗体がSC上の糖鎖を介してフラグメント抗原結合(Fab)非依存的に細菌と相互作用する可能性を示唆する研究もあるが(Mathias and Corthesy, 2011)、そのような相互作用は生体内で実証されておらず、微生物叢へのポリクローンIgA結合のパターンは、ヒトIgG1定常領域で発現したIgA由来のmAbの分析によってほぼ確認されている(Bunker et al, 2017)。これらの観察を合わせると、IgAは、主にFab依存性である相互作用を介して、in vivoで微生物叢の特定のサブセットを被覆していることが示唆される。ヒトの腸内細菌叢は、かなりの個人差を示す(Arumugamら、2011)。マウスの微生物叢は、同居している動物では比較的安定しているが、異なる環境履歴を持つマウスや動物施設間で大きく異なることがある(Stappenbeck and Virgin, 2016)。さらに、1つの種内の亜種は、16S配列解析では通常解決されないかなりの変異を示すことがある(Greenblum et al.、2015)。したがって、マウスおよび/またはヒトにおける異なる研究で同定されたIgA標的細菌を比較し一般化するには、ある程度の注意が必要である。以下では、インビボでIgAによって結合される細菌分類群と、それらの標的化を制御する体液性機構について考察する(図1B)。
いくつかの研究は、IgA+画分内のProteobacteria門の複数の分類群の実質的な濃縮を説明している(Bunkerら、2017;Bunkerら、2015;Planerら、2016;Wilmoreら、2018)。これらの生物は大腸では比較的まれであるが、SIではしばしば豊富であり、このことはSI内腔で典型的に観察されるIgA+菌の高い頻度を説明することができる(Bunkerら、2015;Kroseら、1996;Tsurutaら、2009)。実際、糞便中のIgA+細菌は、GFレシピエントへの移行の際にSIに優先的にコロニー形成する(Bunkerら、2015)。さらに、腸内Proteobacteriaは、BM IgA+ PCの存在量および血清IgAに影響を与える可能性がある(Wilmoreら、2018)。プロテオバクテリアは、in vivoでTIおよびTD IgA抗体の両方によって標的化されるが、それらの認識は通常、SHMまたはT細胞を必要としない(Bunkerら、2017;Bunkerら、2015)。さらに、個々の抗体は通常、複数の異なるProteobacterial分類群に結合する。様々な起源の多反応性抗体は、Proteobacteriaに頻繁に反応し、生殖細胞構成でこれらの分類体に結合することが多い;このように、Proteobacteria反応性抗体は、GFまたはGF/AFマウスのSIで自然に生じ得る。ProteobacteriaへのIgA結合が、これらの抗体を引き寄せる微生物因子の活発な発現を表すのか、または多反応性特異性の広範な結合を表すのかは依然として不明であるが、個々の細菌株は通常、in vitro培養時にこれらの抗体に対する反応性を失い、in vivo再導入後にその結合を回復し、異なる成長または環境条件で抗体結合が調節できることを示唆している(Bunkerら、2017)および(JJ Bunker、未発表の見解)。
いくつかの非定型常在菌に対するIgA応答は、独自にTD応答を必要とするようである。これらのうち、セグメント化糸状菌(SFB)は原型であり、回腸上皮に近接した異常なニッチに生息することが知られており、そこでIgA産生だけでなくCD4+Th17細胞分化を強力に刺激する(Ivanovら、2009;Klaasenら、1993)。SFBは、PP GC過形成、LPにおける三次リンパ構造形成、および相当量のSFB反応性およびSFB非反応性の両方のIgAを誘導する(Klaasenら、1993;Lecuyerら、2014;Talhamら、1999)。SFBは、SPFおよびモノコロナイズドマウスの両方においてIgAで高度にコーティングされている(Bunkerら、2015;Jiangら、2001;Palmら、2014)。SHMを欠くAID欠損マウスの研究では、SFBの伸長に応答してPPおよびILFの過形成が指摘されているが、これらの表現型はすべての研究で観察されているわけではない(Bunkerら、2015;Fagarasanら、2002;Suzukiら、2004;Weiら、2011)。SFBのIgAコーティングはT細胞欠損マウスで失われるが、AID(Aicda-/-)またはGC(CD4-cre Bcl-6fl/fl)欠損マウスではSFB Igコーティングは変化しておらず(Bunkerら、2015)、in vivoでSFBとProteobacterial分類体の両方に交差反応するポリリアクティブIgA mAbsが観察されており(Bunkerら、2017)、この応答にはどの程度、特異性の高い抗体に関わるかはまだ不明である。このように、SFB IgAコーティングは、T細胞に依存するがGCでもSHMでもない、非正規のメカニズムで起こるようである。
SFBに加えて、さらにいくつかの分類群が選択的にTD反応を誘発するようである。これらには、Mucispirillum属、Prevotella属、およびHelicobacter flexispiraが含まれる(Bunkerら、2015;Palmら、2014)。SFBと同様に、これらの細菌は、腸管上皮に近接した型にはまらないニッチに生息しているようである(Palmら、2014;Robertsonら、2005)。これらの分類群の標的化を制御する正確な体液性メカニズムは知られていないが、ムチスピリラムのIgAコーティングは、SFBと同様に、明らかにT細胞を必要とするが、SHMもGCも必要としない(Bunkerら、2015年)。
微生物叢の多くの分類群は、in vivoでIgA抗体によって結合されない(Bunkerら、2015;Palmら、2014)。これらには、大腸に通常豊富に存在するバクテロイデーテスおよびファーミキューテスという門のほとんどのメンバーが含まれる。なぜこれらの細菌がIgA抗体の標的とならないのかについては、依然として不明である。しかし、IgA標的分類群と一般的に交差反応する多反応性抗体は、in vivoではほとんどのBacteroidetesおよびFirmicutesと結合しないようです(Bunker et al.、2017)。これは、多反応性抗体の結合を妨げる因子の活発な発現によるものか、または抗体結合を妨げる細菌細胞表面分子の本質的な性質に関連するものか、その他の可能性がある。
他の多くの細菌分類群は、in vivoでIgAで被覆されている。ほとんどのFirmicutesはIgA抗体によって結合されないが、LactobacilliおよびすべてではないがいくつかのClostridial種のコーティングが観察されている(Bunkerら、2015;Planerら、2016)。Verrucomicrobia門のメンバーであるAkkermansia mucinophilaは、ヒトのIgA+画分に非常に濃縮されている(Bunkerら、2015年;Planerら、2016年)。多様な微生物叢のさらなる研究において、さらなる分類群が同定される可能性がある。さらに、後述するように、一部の病原体または日和見常在菌は、炎症またはディスバイオーシスの文脈で強いIgA応答を誘発する可能性がある(Kauら、2015;Palmら、2014)。
骨髄および授乳期乳腺のIgA
SIはIgA合成の主要な部位であるが、IgA+ PCは骨髄(BM)および乳汁分泌乳腺(LMG)を含む多くの腸管外組織にも見出される。BM IgA+ PCは、ほとんどの血清IgA抗体の供給源と推定され、これらの抗体の特異性は、血清で糞便細菌を染色した後にIgA-seqすることで解析されています(Kochら、2016年;Wilmoreら、2018年)。これらの実験により、血清IgA抗体は通常、腸内IgAが標的とする微生物叢と同様のサブセットに対して反応することが明らかになった。注目すべきは、血清IgAがProteobacterial分類群に顕著に結合し、腸内のこれらの微生物の相対的な存在量がBM IgA+ PC応答の大きさに影響を与える可能性があることである(Bunkerら、2017;Wilmoreら、2018)。BM IgAからクローニングされたmAbsの解析は、これらがProteobacterial分類群を結合する多くの多反応性特異性を含むことを示す(Bunkerら、2017年)。しかしながら、腸IgAレパートリーとは対照的に、実質的に全てのBM IgAはTD応答を介して生じる(Bunkerら、2017;Wilmoreら、2018)、おそらくT細胞由来のシグナルが、BMへの移動及びホーミングを促進するインテグリンα4β1及びCXCR4などのケモカイン受容体の誘導に必要であるから(Mora及びvon Andrian、2008)。
妊娠していない女性の乳腺には、IgA+ PCはほとんど見られないが、妊娠中および産後の授乳期にはこれらの細胞の劇的な蓄積があり、授乳が終わると減少する(図3)(Weisz-Carringtonら、1977)。これらの細胞は、母乳中に高力価で存在するIgAを分泌していると推定される(Rogierら、2014)。腸管IgA+ PCは幼若マウスでは3-4週齢まで出現しないため(Harrisら、2006)、母乳IgAは表向き、新生児マウスの腸内細菌叢をコーティングする役割を担っていると考えられる。実際、LMGおよびSI IgAのレパートリーは、個々のマウス内で非常に類似しており、共通の起源を示唆している(Lindnerら、2015)。LMG IgAからクローニングされたmAbの解析はさらに、これらの抗体が腸管IgAに類似しており、頻繁な多反応性と多くのProteobacteriaを含む様々な微生物分類群に結合することを示唆している(Bunkerら、2017年)。BM IgAと同様に、LMG IgAの分化は、主にTDおよび微生物群依存的である(Bunkerら、2017)。LMGへのIgA+ PCの移動は、CCR10およびそのリガンドCCL28の腺発現に依存している(Wilson and Butcher, 2004)。

図3
図3
母体抗体は新生児の微生物叢と免疫に影響を与える
微生物叢に対するIgMおよびIgG反応
IgA抗体に加えて、IgMおよびIgG抗体も微生物叢に対して反応することが、様々な研究によって証明されている。マウス腸内にはIgMまたはIgGを発現する検出可能なPCは事実上存在しないが、ヒト腸内ではIgM+およびIgG+PCが容易に検出される(Benckertら, 2011; Bunkerら, 2015; Magriら, 2017)。微生物叢のIgMおよびIgGコーティングは、ヒトでは観察可能であるがマウスでは観察できず、これらの抗体は、IgAによって結合される微生物叢と同様のサブセットをコーティングする(Magriら、2017; van der Waaijら、2004)。IgMはまた、粘膜IgTを主に発現する硬骨魚の微生物叢のサブセットを被覆する(Zhang et al.) 腸管のIgG+およびIgM+ PCの特性はまだよくわかっていないが、IgAsと同様の特異性を持つことから、これらの細胞はすべて同様の前駆体に由来する可能性が示唆される。しかし、これらの細胞がヒトに存在し、マウスに存在しないという事実は、これらの細胞が、炎症性サイトカインの存在によってIgAのCSRが損なわれる一過性の炎症期に分化することを示唆しているかもしれない。あるいは、これらの細胞が比較的早期に検出可能であるという観察結果は、これらの細胞が正常な個体発生の一部として自然に生じることを示唆しているかもしれない(Magri et al.、2017)。
IgM+およびIgG+ PCはマウス腸内では検出されないが、マウス血清による微生物叢の染色は、恒常性IgMおよびIgG抗体が微生物叢に結合できることを示している(Kochら、2016;Zengら、2016)。マイクロバイオータに反応する全身性IgGは、中枢耐性または抗HIV応答を変化させる特定の遺伝子欠損のような、自己反応性および多反応性抗体を選択する条件下でさらに豊富になる(Schickel他、2017;Slack他、2009;Williams他、2015)。マウスでは、IgG2bおよびIgG3アイソタイプの恒常性血清抗体は、微生物叢に共通して反応し、IgAで被覆されたものと同様のサブセットを結合する;IgG1抗体もより小さいサブセットを結合する(Kochら、2016年)。IgG2bおよびIgG3抗体は、TLR2およびTLR4を介したシグナル伝達に依存するTI機構を経由して生じる。IgG2bおよびIgG3を発現する前駆体は、GALTにおいて低頻度で検出可能であり、B1細胞から派生すると考えられる。これらの抗体は、一般的に腸内プロテオバクテリアと結合し、定常状態と炎症状態の両方で腸管外組織への移動を制限することができる(Zengら、2016)。興味深いことに、IgG2bおよびIgG3抗体は母乳で新生児に感染し、新生児の微生物叢をコーティングします(図3)(Koch et al.、2016)。また、これらの抗体は、母乳中に含まれる代謝産物に未知のメカニズムで影響を与え、その結果、新生児腸管ILC3やマクロファージの分化を間接的に調節すると考えられる(Gomez de Aguero et al.、2016)。IgG2bおよびIgG3を欠く母親から生まれたマウスは、GALTおよびGC過形成におけるエフェクターCD4+ T細胞分化の増加を示し、これらの抗体が新生児T細胞応答を制限することを示唆している(Kochら、2016年)。これらの抗体が微生物叢及び/又は新生児免疫に影響を与える正確なメカニズムは、依然として不明である。
IgAメモリー
腸内IgA+ PCの薬理学的枯渇は、類似した特異性の迅速な想起をもたらし、IgA+メモリーB細胞が恒常性条件下で分化することを示唆しているが(Lindnerら、2012)、残存PCの拡大もこの観察を説明することができる。しかし、マイクロバイオータに対するIgA応答は、全身免疫で観察される古典的なプライムブースト効果とは異なる、非典型的な記憶応答を生み出すようである。大腸菌の一過性コロニー形成を含む「可逆的」GFシステムを利用した研究によると、常在菌の反復暴露により、IgA力価は指数関数的ではなく、相加的に上昇することが示唆されている(Hapfelmeier et al.、2010)。これらの力価は、GFマウスでは大腸菌曝露後に長期間維持されるが、複雑な微生物叢にコロニー形成されると急速に失われる。メモリーB細胞の再活性化が繰り返され、そのたびに低レベルのランダムなSHMが生じることで、IgAレパートリーがほとんど親和性を成熟させずにSHMを蓄積するという観察が説明できるだろう(Lindnerら、2015年)。これらの研究を合わせると、IgA記憶細胞は正常な条件下で生じるが、ターンオーバーが速く、全身性記憶細胞と比較して再活性化時に減少した拡張を示すことが示唆される。
GALTにおけるIgAメモリー細胞の細胞表現型は、まだ十分に定義されていない。記憶細胞は、PPのIgD-CCR6+集団内に含まれると思われるが、この集団は不均一である可能性がある(Reboldiら、2016)。粘膜ワクチン接種に応答して、α4β7+CD73+PD-L2+CD80+メモリー集団が同定された(Bemark et al.、2016)。ヒトでは、CD19+CD27+IgA+メモリー集団が血中で同定可能であるが、これらの細胞と腸管応答との関係は依然として不明である(Prigent et al.、2016)。IgA+メモリー細胞の表現型および機能的特性を詳述したさらなる研究が必要である。
微生物叢に結合する抗体の機能
微生物叢に結合するIgAの機能的帰結は、一般的によく言われるが、まだ十分に理解されておらず、無傷の微生物叢がある恒常性条件下で、明確な機能があるとしてもほとんど実証されていない。IgA抗体の正確な機能評価は、分泌型抗体産生を真に欠損させた遺伝学的モデルがないために、複雑なものとなっている。先に述べたように、pIgRを欠くマウスは、IgA分泌の部分的な損失のみを示す(Johansenら、1999)。破壊されたIgμ定常領域(μMT)を有するマウスは、B細胞欠損のモデルとして広く用いられているが、これらのマウスは、腸内IgAのほぼ正常な力価を産生する(Macphersonら、2001b)。Ig重鎖J遺伝子座の欠失を有するマウス(JH-/-)は、全てのB細胞を欠いているが、リンパ系器官形成におけるこれらの細胞の重要な役割のために、ほとんどのGALTを欠いており、したがって多数のB細胞外性欠損を示す(Golovkinaら、1999年)。Igα定常領域の破壊またはAIDの欠失を介してIgAを欠くマウスは、通常IgAで被覆された同じ常在菌を標的とする代償的IgM応答を生じる(Bunkerら、2015年)。注目すべきは、IgA欠損は、最も一般的なヒト免疫不全の1つであり、様々な集団において1:400から1:3000である(Cunningham-Rundles、2001年)。IgA欠損マウスと同様に、これらの患者では代償的な粘膜IgM応答が生じる(Barrosら、1985;Fadlallahら、2018;Klemola、1988;Magriら、2017)。この観察と一致して、これらの患者は一般に臨床症状がほとんどない。しかしながら、IgA欠損患者は、再発性呼吸器感染症、セリアック病、および自己免疫を含む様々な病態に対する感受性の中程度の向上を示している(Cunningham-Rundles、2001)。以上のように、マウスやヒトにおける遺伝子解析では、恒常性IgA抗体の明確な機能的役割は明らかにされていない。
しかし、IgA反応の大きさと粘膜抗体分泌に対する強い進化的プレッシャーは、機能的関連性を示唆している。しかし、IgAで覆われた微生物が常に存在することから、IgAが微生物に対して有害な作用を及ぼすことは、一般に絶滅を促すほどではないことが示唆される。実際、莢膜多糖へのIgA結合は、粘液層に固定されたクラスターを形成し、それによって競合する種の侵入からニッチを確保するために、いくつかの微生物種によって利用される可能性がある(図4)(Donaldson et al.) 多くの研究が、微生物叢との恒常的な相互作用の文脈で、生体内で役割を果たすかどうかわからないこれらの抗体の機能の可能性を示唆しています(図4)。
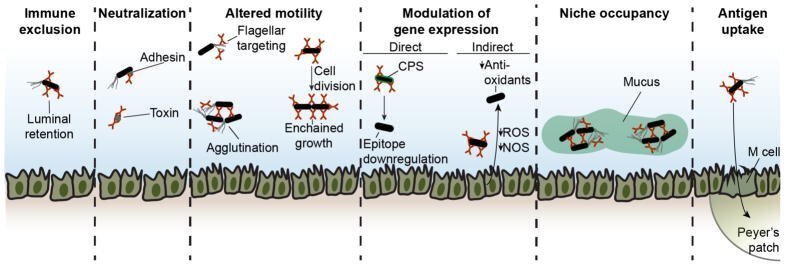
図4
図4
IgA抗体の潜在的な機能
IgGおよびIgM抗体の保護機能は、通常、オプソニン化および補体の動員、あるいはフラグメント結晶化可能(Fc)受容体への結合を伴う(RavetchおよびKinet、1991)。しかし、IgAは他のアイソタイプと比較して古典的補体経路の刺激に乏しい(Murphy and Weaver, 2016)。IgA Fc受容体であるFcαRIは、ヒト、霊長類、および他のいくつかの哺乳類に存在するが、マウスには存在しない(Bakema and van Egmond, 2011)。この受容体のライゲーションは、IgA刺激の単量体または二量体の性質に応じて、活性化作用または抑制作用をもたらす(Pasquierら、2005年)。FcαRIは好中球、好酸球、単球、マクロファージに発現しており、恒常性維持時にはほとんど存在しないが、炎症時には腸に浸潤することがある (Bakema and van Egmond, 2011)。これらの観察から、Fcレセプターと補体は、微生物が存在する正常な恒常性においては機能的な役割を果たしそうにないが、炎症性の状況においては関連性がある可能性が示唆される。
IgAの機能の一つは、標的の免疫排除であると考えられる。抗体結合は、抗原が消化または排除されるまで腸管内腔に留まり、それによって他の免疫反応のプライミングを妨げる。この機能は、モデル抗原と特異的モノクローナルIgA抗体との関係で実証されているが(Stokesら、1975)、IgA標的微生物群との関係では、生体内での関連性は未検証である。第二の機能は、侵入や病原性を促進するアドヘシンやピリなどの細菌表面抗原の中和であると考えられる。この機構は腸内病原体との関連で証明されているが (Williams and Gibbons, 1972)、常在菌との恒常性維持に関連するかどうかはまだ不明である。注目すべきは、GFマウスの微生物叢コロニー形成時に、常在菌がmLNに移動するのを防ぐためにB細胞が必要とされるが、その保護機構は未解明である (Macpherson and Uhr, 2004)。
IgA結合は、いくつかの可能なメカニズムによって細菌の運動を制限すると考えられるが、微生物叢と天然の微生物反応性IgAとの関連性については、まだ不明である。病原体であるShigella flexneriに特異的なモノクローナルIgA抗体の研究により、IgAが腸管上皮に重なる粘液層内に細菌を捕捉することが示唆されている(Boullier et al.、2009)。さらに、IgAは病原体を凝集させ、そのクリアランスを促進する可能性があります(Hendrickxら、2015年)。不活化サルモネラ・ティフィムリウムの経口ワクチン接種後に生成されたIgA抗体は、分裂している細菌の娘細胞を鎖でつなぎ、そのクリアランスを促進することが示された(Moor et al.、2017)。IgAはまた、細菌フラジェリンを結合することによって運動性を制限することができる:常在フラジェリンの特異的IgA認識は実証されていないが、多くの多反応性IgAが低親和性でフラジェリンを結合する(Bunkerら、2017; Cullenderら、2013)。フラジェリンに対する高親和性mAbのin vitro研究では、これらが細菌の運動性を制限することが実証されている(Cullenderら、2013)。さらに、フラジェリン自然免疫センサーTLR5を欠くマウスの微生物叢では、フラジェリン遺伝子発現の増加が観察可能であり、このプロセスにおけるIgAの役割が示唆されている(Cullender et al.、2013)。
もう一つの可能な機能として、微生物遺伝子発現の直接的または間接的な調節が考えられる。このことは、Bacteroides thetaiotaomicronをモノコロネーションしたマウスから分離したIgAハイブリドーマを、その後、IgAを欠くB. thetaiotaomicronモノコロネーションRag1-/-マウスに投与した研究によって裏付けられている(Peterson et al.、2007; Peterson et al.、2015)。直接的な調節では、IgA結合により細菌遺伝子の発現が変化する。例えば、莢膜多糖類抗原に対する1つのIgA mAbは、エピトープ発現をダウンレギュレートし、エピトープ欠損株と比較して細菌の体力を低下させた(Peterson et al.、2007年)。LPS O-抗原多糖に対する第2のmAbは、抗原発現または微生物フィットネスを調節せず、この性質が可変である可能性を示唆した(Peterson et al.、2015)。間接的な調節では、IgA結合が上皮細胞または他の細胞による遺伝子発現を変化させ、その結果、細菌の遺伝子発現を変化させる因子が分泌される可能性がある。Rag1-/-マウスをB. thetaiotaomicronで単コロニー化すると、腸管上皮における活性酸素および窒素種合成のアップレギュレーションと、それに伴う細菌の抗酸化酵素のアップレギュレーションが起こり、これらの表現型はIgAモノクローナル抗体の存在下で消失した( Peterson et al, 2007)。しかし、B. thetaiotaomicronは生体内ではIgA抗体の主要な標的ではないため、これらの原理が無傷の微生物叢の中で自然に発生するIgAに適用できるかどうかはまだ不明である。
恒常性IgA抗体は、特定の生理的状況において、異なる機能的役割を果たす可能性もある。正常な恒常性条件下で生じるProteobacteria反応性血清IgA応答は、腸管損傷後の多菌性敗血症に対して保護的であると思われる(Wilmoreら、2018);このモデルにおいてIgAが保護的である機構は依然として不明である。さらに、前述したように、母乳で伝わる母体抗体は、新生児の腸管免疫活性化を減弱させるようである(図3)。B細胞欠損の母親から生まれたマウスは、おそらくmLNへの常在菌の移動が増加した結果、生後早期に腸管IgA反応の誇張を示す(Harrisら、2006;Rogierら、2014)。母親のIgAはまた、未知のメカニズムを介して新生児の微生物叢の組成に影響を与える可能性がある(Rogierら、2014)。さらに、母体IgAは、IgG2bおよびIgG3抗体とともに、新生児TD反応を制限する部分的に冗長な役割を果たす可能性がある(Koch et al.、2016年)。最後に、IgAが腸の抗原に結合することで、上皮の小葉(M)細胞を通しての取り込みが促進され、さらなる応答のプライミングが強化される可能性がある(図4)(Fransenら、2015年)。
IgA抗体は、他の場所で広範にレビューされている様々な追加の文脈で粘膜病原体に応答して防御免疫を付与することができる(Lycke、2012;Macphersonら、2001a)。コレラ毒素はよく研究されており、中和を介して保護するTD反応を誘導する(Hornquistら、1995年)。In vitro の研究では、IgA が腸の LP で毒素と結合し、その排泄を促進することが示唆されている (Fernandez et al., 2003)。さらに、HIVエンベロープに対するIgA抗体は、RV144 HIVワクチン試験における防御と強く相関していた(Haynesら、2012年)。既存の多反応性IgA抗体は、Salmonella Typhimuriumに対する早期防御を提供することが示されたが(Wijburgら、2006)、大部分の感染症において、防御反応と既存の恒常的IgAとの関係は、依然として不明である。多くの場合、病原体に対する防御反応は、恒常的IgA反応よりも全身性免疫に近い細胞経路を介して進行すると考えられる。免疫前後のレパートリーと細胞プロセスの慎重な研究が、これらのメカニズムに光を当てるはずである。
炎症性腸疾患における微生物叢に対する抗体
粘膜抗体反応は、クローン病や潰瘍性大腸炎を含む炎症性腸疾患(IBD)において誇張されており、宿主の遺伝、環境因子、微生物叢の構成が複雑に絡み合っています(Dalal and Chang, 2014)。IgA、IgG、およびIgMによる糞便微生物叢のコーティングの増加は、ヒトIBDとマウスモデルの両方で観察されている(Palmら、2014;van der Waaijら、2004;Viladomiuら、2017)。IgM+およびIgG+ PCは、炎症を起こした腸に蓄積し、炎症を悪化させる可能性があるが、それらの特異性および病理への寄与はまだ十分に理解されていない(Kanaiら、2006年;Uoら、2013年)。IBD患者はまた、フラジェリンおよび様々な自己抗原に対して反応する血清IgAの上昇を示すが、これが特異的抗体の誘導を表すのか、あるいは多反応性特異性の拡大を表すのかは、依然として不明である(Landersら、2002; Lodesら、2004; Sitaramanら、2005)。リンパ球減少型レシピエントへのT細胞移入によって誘導された大腸炎のマウスモデルは、B細胞が病理学的な保護作用を有することを示唆しているが(Gerthら、2004)、ヒトIBDにおける保護機構およびその寄与は依然として不明である。最近、いくつかの研究は、IgAコーティングがIBDまたはIBD関連脊椎関節炎における微生物叢の疾患関連メンバーを特定できることを示唆している(Palmら、2014年;Viladomiuら、2017年)。これらの研究は、一般に、IgA+およびIgA-細菌の両方の系統的な分析を行うことなく、単一の微生物またはやや任意のコンソーシアムに焦点を当てている。正常な健康状態で見られる微生物叢の広範なIgAコーティングを考慮すると、IBD患者におけるすべてのIgA標的微生物が結腸原性であるとは考えにくい。より可能性の高いシナリオは、正真正銘の病原体がIgA反応を引き起こし、IgA+画分に多種多様な非病原性常在菌とともに存在することである。したがって、病原体と常在菌をより確実に識別するためには、IgA-seqと他のアッセイを併用することが必要であろう。
結論
現在のところ、腸管粘膜には2つの異なるタイプの体液性免疫が共存しているというモデルが支持されている(図2)。優勢な経路は、本質的に多反応性で低親和性であり、T細胞や体細胞突然変異にほとんど依存せず、生殖細胞にコードされた自然免疫の特徴を有する。この反応は、常在菌との恒常的相互作用にほとんど関与していると考えられる。もう一方の経路は、T細胞依存的で、突然変異が多く、親和性が成熟した適応反応の古典的な特徴を示し、主に病原体によって引き起こされる。これらの根本的に異なる応答がどのように統合され、微生物叢との共生関係を維持しながら宿主を守っているのかを明らかにすることは、今後の研究の大きな方向性である。
免疫学的な観点からは、IgAレパートリー内の多反応性特異性の濃縮は、これらの抗体を発現する細胞が、中枢性寛容の間にどのように欠失を回避するかについて疑問を投げかける(Wardemannら、2003年)。今後、これらの抗体がいつ、どのようにして寛容のメカニズムから逃れるのかを明らかにし、粘膜における抗体の選択に関与する細胞経路を明らかにする必要がある。さらに、抗体の多反応性の構造的基盤はまだ十分に理解されておらず、この反応性がどのように達成されるかを決定するには、詳細な構造および生化学的研究が必要である。さらに、多面的な反応性がどの程度まで病原体との交差反応を可能にするのか、また、既存の恒常的なIgA抗体が感染時の防御免疫に貢献するのかについても、依然として不明である。これらの疑問に対する答えは、粘膜ワクチン接種や、急速に変異するウイルスに対する多反応性広中和抗体の誘発に影響を与えるかもしれない(Andrewsら、2015年;Mouquetら、2010年)。
微生物学の観点からは、IgAの分子標的に関して大きな疑問が残されている。特に、生化学的および遺伝学的アプローチを用いて、IgA抗体によって認識される特異的抗原の同定に焦点を当てた研究が必要である。この問題は、多くの常在菌に関する遺伝子ツールやゲノム情報が一般的に不足しているために複雑になっている。また、IgA抗体の回避や誘引につながる細菌のメカニズムを明らかにすることも重要である。さらに、抗体結合が微生物に及ぼす影響を調査し、IgA結合が生理機能や体力を変化させる正確なメカニズムを明らかにする必要がある。これらの疑問に対する答えは、IgAの謎に包まれた機能に光を当て、その生物学的意義の理解に大きな影響を与える可能性がある。
近年、多くの重要な進歩が見られる一方で、IgA応答の多くの側面はまだ十分に理解されていない。今後、免疫や共生に関する進化的な側面から、腸管疾患の予防・治療・治癒のための宿主や微生物叢の新たな操作法まで、幅広い知見が得られる可能性がある。
論文情報
イミュニティ(Immunity)。著者原稿;PMC 2019 Feb 21で入手可能。
最終編集版として掲載
Immunity. 2018 Aug 21; 49(2): 211-224.
doi: 10.1016/j.immuni.2018.08.011
PMCID:PMC6107312
NIHMSID: NIHMS984911
PMID: 30134201
ジェフリー・J・バンカー1,2およびアルバート・ベンデラック1,2,*。
1シカゴ大学免疫学委員会、シカゴ、IL 60637、米国
2シカゴ大学病理学教室、シカゴ、IL 60637、USA
*Correspondence to: Albert Bendelac ude.ogacihcu.dsb@aledneba
著作権表示
この論文の出版社による最終編集版は、Immunityに掲載されています。
参考文献
Andrews SF, Huang Y, Kaur K, Popova LI, Ho IY, Pauli NT, Henry Dunand CJ, Taylor WM, Lim S, Huang M, et al. Immune history profoundly affects broadly protective B cell responses to influenza(インフルエンザに対する免疫履歴は、広く防御的なB細胞応答に深く影響する。Sci Transl Med. 2015;7:316ra192. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Arumugam M, Raes J, Pelletier E, Le Paslier D, Yamada T, Mende DR, Fernandes GR, Tap J, Bruls T, Batto JM, et al. Human gut microbiomeの腸型(Enterotypes of the gut microbiome). Nature. 2011;473:174-180. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Bakema JE, van Egmond M. The human immunoglobulin A Fc receptor FcalphaRI: a multifaceted regulator of mucosal immunity.(ヒト免疫グロブリンA Fc受容体FcalphaRI:粘膜免疫の多面的調節因子)。Mucosal Immunol. 2011;4:612-624. [PubMed][Google Scholar].
Barros MD, Porto MH, Leser PG, Grumach AS, Carneiro-Sampaio MM. 選択的IgA欠乏症患者の初乳の研究。Allergol Immunopathol(Madr)1985;13:331-334。[PubMed] [Google Scholar] 。
Bemark M, Hazanov H, Stromberg A, Komban R, Holmqvist J, Koster S, Mattsson J, Sikora P, Mehr R, Lycke NY. 経口免疫後の腸管IgA形質細胞とメモリーB細胞間の限られたクローン関連性。Nat Commun. 2016;7:12698. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Benckert J, Schmolka N, Kreschel C, Zoller MJ, Sturm A, Wiedenmann B, Wardemann H. The majority of intestinal IgA+ and IgG+ plasmablasts in the human gut are antigen-specific. J Clin Invest. 2011;121:1946-1955. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Bergqvist P, Gardby E, Stensson A, Bemark M, Lycke NY. CD40非存在下での腸管IgAクラススイッチ組み換えは、層状固有膜では起こらず、胚中心とは無関係である。J Immunol. 2006;177:7772-7783. [PubMed] [Google Scholar].
Bergqvist P, Stensson A, Hazanov L, Holmberg A, Mattsson J, Mehr R, Bemark M, Lycke NY.(ベルクヴィスト・ピー、ステンソンA、ハザノフL、ホルムバーグA、マトソンJ、メアR、ベマークM、ライクNY)。複数のパイエル板で胚中心を再利用すると、高度に同期化したオリゴクローナルでアフィニティ成熟した腸管IgA応答が生じる。Mucosal Immunol. 2013;6:122-135. [PubMed] [Google Scholar].
Bergqvist P, Stensson A, Lycke NY, Bemark M. T細胞に依存しないIgAクラススイッチの組み換えは、GALTに限定され、顕性胚中心形成の前に起こる。J Immunol. 2010;184:3545-3553. [PubMed][Google Scholar].
Blanc P, Moro-Sibilot L, Barthly L, Jagot F, This S, de Bernard S, Buffat L, Dussurgey S, Colisson R, Hobeika E, et al. Mature IgM-expressing plasma cells seens antigen and develop competence for cytokine production upon antigenic challenge(抗原を感知し、抗原に挑戦した際にサイトカイン産生の能力を獲得する成熟IgM発現形質細胞). Nat Commun. 2016;7:13600. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Boullier S, Tanguy M, Kadaoui KA, Caubet C, Sansonetti P, Corthesy B, Phalipon A. Secretory IgA-mediated neutralization of Shigella flexneri prevents intestinal tissue destruction by down-regulating inflammatory circuits. J Immunol. 2009;183:5879-5885. [PubMed][Google Scholar].
Bunker JJ, Erickson SA, Flynn TM, Henry C, Koval JC, Meisel M, Jabri B, Antonopoulos DA, Wilson PC, Bendelac A. Natural polyreactive IgA antibodies coat the intestinal microbiota(天然多機能IgA抗体が腸内細菌群を被覆する)。サイエンス. 2017;358 [PMCフリー記事] [PubMed] [Google Scholar].
Bunker JJ, Flynn TM, Koval JC, Shaw DG, Meisel M, McDonald BD, Ishizuka IE, Dent AL, Wilson PC, Jabri B, et al. Innate and Adaptive Humoral Responses Coat Distinct Commensal Bacteria with Immunoglobulin A.免疫学. 2015;43:541-553. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Casola S, Otipoby KL, Alimzhanov M, Humme S, Uyttersprot N, Kutok JL, Carroll MC, Rajewsky K. B細胞受容体のシグナル強度がB細胞の運命を決定する. Nat Immunol. 2004;5:317-327. [PubMed][Google Scholar].
Cazac BB, Roes J. TGF-β受容体は、in vivoでのB細胞の反応性とIgAの誘導を制御する。Immunity. 2000;13:443-451. [PubMed] [Googleスカラー]。
Cerutti A. IgAクラススイッチングの制御。Nat Rev Immunol. 2008;8:421-434. [PMC フリーアーティクル] [PubMed] [Google Scholar] 。
好酸球は、免疫グロブリンA発現形質細胞の生成と維持を促進し、腸管免疫恒常性に寄与する。Immunity. 2014;40:582-593. [PubMed][Google Scholar].
Cong Y, Feng T, Fujihashi K, Schoeb TR, Elson CO. A dominant, coordinated T regulatory cell-IgA response to the intestinal microbiota. 2009;106:19256-19261. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Craig SW, Cebra JJ. パイエル板:ウサギにおけるIgA産生免疫細胞の前駆体の豊富な供給源。J Exp Med. 1971;134:188-200. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Cullender TC, Chassaing B, Janzon A, Kumar K, Muller CE, Werner JJ, Angenent LT, Bell ME, Hay AG, Peterson DA, et al. 自然免疫と適応免疫が相互に作用して腸内の微生物鞭毛運動を抑制している。Cell Host Microbe. 2013;14:571-581. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Cunningham-Rundles C. IgAとIgA欠乏症の生理学。J Clin Immunol. 2001;21:303-309. [PubMed] [Google Scholar] 。
Dalal SR, Chang EB. 炎症性腸疾患の微生物基盤。J Clin Invest. 2014;124:4190-4196. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Di Niro R, Mesin L, Raki M, Zheng NY, Lund-Johansen F, Lundin KE, Charpilienne A, Poncet D, Wilson PC, Sollid LM.ロタウイルス特異的ロタウイルスの迅速な作製。小腸粘膜からのロタウイルス特異的ヒトモノクローナル抗体の迅速な作製。J Immunol. 2010;185:5377-5383. [PubMed][Google Scholar].
Donaldson GP, Ladinsky MS, Yu KB, Sanders JG, Yoo BB, Chou WC, Conner ME, Earl AM, Knight R, Bjorkman PJ, Mazmanian SK. 腸内細菌は粘膜コロニー形成のために免疫グロブリンAを利用する。サイエンス 2018 [PMC無料記事] [PubMed] [Google Scholar].
Dzidic M、Abrahamsson TR、Artacho A、Bjorksten B、Collado MC、Mira A、Jenmalm MC. 乳児期の腸内細菌叢に対する異常なIgA応答は、喘息およびアレルギーの発症に先行する。J Allergy Clin Immunol. 2017;139:1017-1025. e1014. [PubMed】【Google Scholar】。
Fadlallah J, El Kafsi H, Sterlin D, Juste C, Parizot C, Dorgham K, Autaa G, Gouas D, Almeida M, Lepage P, et al. Human IgA deficiencyにおける微生物生態の摂動. Sci Transl Med. 2018;10 [PubMed] [Google Scholar] を参照。
Fagarasan S, Kawamoto S, Kanagawa O, Suzuki K. Adaptive immune regulation in the gut.腸管における適応免疫制御。T細胞依存性IgA合成とT細胞非依存性IgA合成. Annu Rev Immunol. 2010;28:243-273. [PubMed] [Google Scholar].
Fagarasan S, Kinoshita K, Muramatsu M, Ikuta K, Honjo T. In situ class switching and differentiation to IgA-producing cells in the gut lamina propria.(腸管固有層におけるIgA産生細胞のクラススイッチングと分化). Nature. 2001;413:639-643. [PubMed] [Google Scholar].
腸内フローラのホメオスタシスにおける活性化誘導型シチジンデアミナーゼの重要な役割. Science. 2002;298:1424-1427. [PubMed] [Google Scholar] 。
Fernandez MI, Pedron T, Tournebize R, Olivo-Marin JC, Sansonetti PJ, Phalipon A. Anti-inflammatory role for intracellular dimeric immunoglobulin a by neutralization of lipopolysaccharide in epithelial cells.上皮細胞における細胞内二量体免疫グロブリンの抗炎症作用。Immunity. 2003;18:739-749. [PubMed][Google Scholar].
適応免疫系の起源と進化:遺伝的事象と選択的圧力. Nat Rev Genet. 2010;11:47-59. [PMC無料記事] [PubMed][Googleスカラー]。
BALB/c マウスと C57BL/6 マウスの多反応性 IgA 量に違いがあり、これが抗原特異的 IgA の生成と微生物叢の多様性に影響を及ぼしている。Immunity. 2015;43:527-540. [PubMed][Google Scholar].
Gerth AJ, Lin L, Neurath MF, Glimcher LH, Peng SL. 活性化T細胞核因子の非存在下での自然細胞媒介性、マウス潰瘍性大腸炎様症候群。Gastroenterology。2004;126:1115-1121. [PubMed] [Google Scholar] 。
このような場合、「免疫制御のためのヒト腸内細菌叢のマイニング(Mining the Human Gut Microbiota for Immunomodulatory Organisms)」と呼ばれます。Cell. 2017;168:928-943. e911. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Golovkina TV, Shlomchik M, Hannum L, Chervonsky A. Organogenic role of B lymphocytes in mucosal immunity. Science. 1999;286:1965-1968. [PubMed] [Google Scholar] 。
ゴメス・デ・アグエロ、ガナル・ヴォナルブルク、フーラー、ルップ、内村洋平、リー、シュタイナート、ハイケンヴァルダー、ハッフェルマイヤー、ザウアー、他 母体の微生物叢は生後早期の自然免疫の発達を促進する。Science. 2016;351:1296-1302. [PubMed][Google Scholar].
Greenblum S, Carr R, Borenstein E. Extensive strain-level copy-number variation across human gut microbiome species(ヒト腸内細菌種における広範な株レベルのコピー数変動)。Cell. 2015;160:583-594. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Guy-Grand D, Griscelli C, Vassalli P. Peyer's patches, gut IgA plasma cells and thymic function: study in nude mice bearing thymic grafts.ガイ-グランドD、グリセリC、ヴァッサリP.腸管IgA形質細胞と胸腺機能。J Immunol. 1975;115:361-364. [PubMed】【Google Scholar】。
マウス小腸の腸管壁に存在する複数のリンパ濾胞の同定。J Immunol. 2002;168:57-64. [PubMed][Google Scholar].
Hapfelmeier S, Lawson MA, Slack E, Kirundi JK, Stoel M, Heikenwalder M, Cahenzli J, Velykoredko Y, Balmer ML, Endt K, et al. 無菌マウスの可逆的微生物コロニー化によりIgA免疫応答の動態が明らかになる。Science. 2010;328:1705-1709. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Harris NL, Spoerri I, Schopfer JF, Nembrini C, Merky P, Massacand J, Urban JF, Jr, Lamarre A, Burki K, Odermatt B, et al. 新生児粘膜抗体防御のメカニズム. J Immunol. 2006;177:6256-6262. [PubMed][Google Scholar].
ヘインズBF、ギルバートPB、マッケラスMJ、ゾラ-パズナーS、トマラスGD、アラムSM、エバンスDT、モンテフィオーリDC、カルナスタC、サテントR、その他、HIV-1ワクチン効果試験の免疫関連解析。N Engl J Med. 2012;366:1275-1286. [PMC無料記事] [PubMed] [Google Scholar].
He B, Xu W, Santini PA, Polydorides AD, Chiu A, Estrella J, Shan M, Chadburn A, Villanacci V, Plebani A, et al. 腸内細菌はサイトカインAPRILの上皮細胞分泌を誘発することによりT細胞非依存性免疫グロブリンA(2)クラススイッチングの引き金となる。Immunity. 2007;26:812-826. [PubMed] [Google Scholar].
Hendrickx AP, Top J, Bayjanov JR, Kemperman H, Rogers MR, Paganelli FL, Bonten MJ, Willems RJ. 腸内細菌(Enterococcus faecium)の腸管上皮内凝集と代替分離を媒介する抗生物質駆動型ディスバイオシス(Dysbiosis)。MBio. 2015;6:e01346-01315. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Hirota K, Turner JE, Villa M, Duarte JH, Demengeot J, Steinmetz OM, Stockinger B. Plasticity of Th17 cells in Peyer's patches is responsible for the induction of T cell-dependent IgA response.パイエル板におけるTh17細胞の可塑性は、T細胞依存性IgA応答の誘導に関与している。Nat Immunol. 2013;14:372-379. [PMC フリーアーティクル] [PubMed] [Google Scholar].
本田和彦、Littman DR. 適応免疫のホメオスタシスと疾患における微生物叢。ネイチャー. 2016;535:75-84. [PubMed][Google Scholar].
Hornquist CE, Ekman L, Grdic KD, Schon K, Lycke NY.(ホーンクイスト・シー、エクマンL、グルディックKD、ションK、ライクNY)。CD4欠損マウスにおける逆説的IgA免疫。正常な腸管粘膜IgA分化にもかかわらず、コレラ毒素特異的な防御免疫の欠落。J Immunol. 1995;155:2877-2887. [PubMed][Google Scholar].
Huard B, McKee T, Bosshard C, Durual S, Matthes T, Myit S, Donze O, Frossard C, Chizzolini C, Favre C, et al. 好中球が分泌するAPRILはヘパラン硫酸プロテオグリカンに結合してヒト粘膜にプラズマ細胞のニッチを形成している。J Clin Invest. 2008;118:2887-2895. [PMC free article] [PubMed] [Google Scholar].
Ivanov II, Atarashi K, Manel N, Brodie EL, Shima T, Karaoz U, Wei D, Goldfarb KC, Santee CA, Lynch SV, et al. 細分化した糸状菌による腸のTh17細胞の誘導。Cell. 2009;139:485-498. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Iversen R, Snir O, Stensland M, Kroll JE, Steinsbo O, Korponay-Szabo IR, Lundin KEA, de Souza GA, Sollid LM.血清細胞間の強いクローン関連性。異なる血漿細胞起源にもかかわらず、血清と腸のIgAの間に強いクローン性関連性がある。Cell Rep. 2017;20:2357-2367. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Jiang HQ, Bos NA, Cebra JJ. 新生児マウス腸内における分節化糸状菌によるコロニー形成のタイミング、局在、および持続は、母親と仔の免疫状態に依存する。Infect Immun. 2001;69:3611-3617. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Johansen FE, Pekna M, Norderhaug IN, Haneberg B, Hietala MA, Krajci P, Betsholtz C, Brandtzaeg P. 高分子免疫グロブリン受容体/分泌成分欠損マウスにおける粘膜リークの増加を伴う上皮性免疫グロブリンA輸送の欠失。J Exp Med. 1999;190:915-922. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Kaetzel CS. 高分子免疫グロブリン受容体:粘膜表面における自然免疫反応と適応免疫反応の橋渡し. Immunol Rev. 2005;206:83-99。[PubMed] [Google Scholar].
CD4+CD45RBhighTリンパ球のヌードマウスへの養子移入によるTH1/TH2介在性大腸炎. Inflamm Bowel Dis. 2006;12:89-99. [PubMed] [Google Scholar].
Kang HS, Chin RK, Wang Y, Yu P, Wang J, Newell KA, Fu YX. 腸管固有層ストローマ細胞のLTbetaRを介したシグナル伝達は、IgA産生に必要である。Nat Immunol. 2002;3:576-582. [PubMed][Google Scholar].
Kau AL, Planer JD, Liu J, Rao S, Yatsunenko T, Trehan I, Manary MJ, Liu TC, Stappenbeck TS, Maleta KM, et al. 食事依存性腸症を引き起こす栄養不良マラウイの子供からの IgA標的細菌分類の機能的特徴付けを行った。Sci Transl Med. 2015;7:276ra224. [PMC フリーアーティクル] [PubMed] [Google Scholar].
川本 聡、丸谷 茂、加藤 LM、須田 和彦、アタラシ K、土井 康弘、筒井 康弘、秦 浩、本田 健、岡田 哲也、他 Foxp3(+) T細胞は免疫グロブリンa選択を制御し、免疫恒常性に関わる細菌種の多様化を促進する. Immunity. 2014;41:152-165. [PubMed][Google Scholar].
Kawamoto S, Tran TH, Maruya M, Suzuki K, Doi Y, Tsutsui Y, Kato LM, Fagarasan S. The inhibitory receptor PD-1 regulates IgA selection and bacterial composition in the gut.(抑制性受容体PD-1は腸内のIgA選択と細菌構成を制御する). Science. 2012;336:485-489. [PubMed][Google Scholar].
Klaasen HL, Van der Heijden PJ, Stok W, Poelma FG, Koopman JP, Van den Brink ME, Bakker MH, Eling WM, Beynen AC. 病原性腸内分節化糸状菌は、マウスの粘膜免疫系を刺激する。Infect Immun. 1993;61:303-306. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Klemola T. IgA欠損者の腸における免疫組織化学的所見:上皮内Tリンパ球の数が増加している。Jの小児科胃腸栄養学1988;7:537-543。[PubMed] [Google Scholar] 。
Koch MA, Reiner GL, Lugo KA, Kreuk LS, Stanbery AG, Ansaldo E, Seher TD, Ludington WB, Barton GM. 母体のIgGおよびIgA抗体は、幼少期の粘膜Tヘルパー細胞応答を減弱させる。Cell. 2016;165:827-841. [PMC フリーアーティクル] [PubMed] [Google Scholar].
コシュランド ME. 免疫グロブリンJ鎖の成熟期(The coming of age of the immunoglobulin J chain)。Annu Rev Immunol. 1985;3:425-453. [PubMed] [Google Scholar] 。
Kroese FG, de Waard R, Bos NA. B-1 細胞とそのマウス腸内細菌叢との反応性. Semin Immunol. 1996;8:11-18. [PubMed] [Google Scholar] 。
Kruglov AA, Grivennikov SI, Kuprash DV, Winsauer C, Prepens S, Seleznik GM, Eberl G, Littman DR, Heikenwalder M, Tumanov AV, Nedospasov SA. 自然リンパ球が産生する可溶性LTα3の腸管ホメオスタシスにおける非冗長な機能。Science. 2013;342:1243-1246. [PubMed] [Googleスカラー]。
Kubinak JL, Petersen C, Stephens WZ, Soto R, Bake E, O'Connell RM, Round JL.(クビナックJL、ピーターセンC、スティーブンスWZ、ソトR、ベイクE、オコーネルRM、ラウンドJL)。T細胞におけるMyD88シグナルは、健康を促進するためにIgAを介した微生物叢の制御を指示する。Cell Host Microbe. 2015;17:153-163. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Kunkel EJ、Kim CH、Lazarus NH、Vierra MA、Soler D、Bowman EP、Butcher EC. CCR10の発現は、循環系および粘膜上皮組織のIgA Ab分泌細胞の共通の特徴である。J Clin Invest. 2003;111:1001-1010. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Landers CJ, Cohavy O, Misra R, Yang H, Lin YC, Braun J, Targan SR.(ランダースCJ、コハビーO、ミスラR、ヤンH、リンYC、ブラウンJ、ターガンSR)。クローン病に関連した自己抗原および微生物抗原に対する免疫反応から証明される選択的寛容性喪失(Selected loss of tolerance evidenced by Crohn's disease-associated immune response to auto-and microbial antigens. Gastroenterology. 2002;123:689-699. [PubMed][Google Scholar].
Landsverk OJ, Snir O, Casado RB, Richter L, Mold JE, Reu P, Horneland R, Paulsen V, Yaqub S, Aandahl EM, et al. 抗体を分泌するプラズマ細胞はヒト腸内で何十年も存続している。J Exp Med. 2017;214:309-317. [PMC無料論文] [PubMed] [Google Scholar].
Lecuyer E, Rakotobe S, Lengline-Garnier H, Lebreton C, Picard M, Juste C, Fritzen R, Eberl G, McCoy KD, Macpherson AJ, et al. Segmented filamentous bacteria uses secondary and tertiary lymphoid tissues toduce gut IgA and specific T helper 17 cell response.分節した糸状菌は、二次および三次リンパ組織を使用して、消化器IgAおよび特異的Tヘルパー17細胞応答を誘発する。Immunity. 2014;40:608-620. [PubMed][Google Scholar].
Lindner C, Thomsen I, Wahl B, Ugur M, Sethi MK, Friedrichsen M, Smoczek A, Ott S, Baumann U, Suerbaum S, et al. Diversification of memory B cells drives the continuous adaptation of secretory antibodies to gut microbiota.記憶B細胞の多様化は、腸内細菌叢に対する分泌抗体の継続的な適応を駆動する。Nat Immunol. 2015;16:880-888. [PubMed][Google Scholar].
Lindner C, Wahl B, Fohse L, Suerbaum S, Macpherson AJ, Prinz I, Pabst O. Age, microbiota, and T cells shape diverse individual IgA repertoires in the intestine.(年齢、マイクロバイオータ、およびT細胞は、腸における多様な個々のIgAレパートリーを形成する。J Exp Med. 2012;209:365-377. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Litinskiy MB、Nardelli B、Hilbert DM、He B、Schaffer A、Casali P、Cerutti A. DCはBLySとAPRILを介してCD40非依存的な免疫グロブリンのクラススイッチングを誘導する。Nat Immunol. 2002;3:822-829. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Lodes MJ, Cong Y, Elson CO, Mohamath R, Landers CJ, Targan SR, Fort M, Hershberg RM. 細菌性フラジェリンはクローン病における支配的な抗原である。J Clin Invest. 2004;113:1296-1306. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Lycke N. Recent progress in mucosal vaccine development: potential and limitations. Nat Rev Immunol. 2012;12:592-605. [PubMed][Google Scholar].
Macpherson AJ, Gatto D, Sainsbury E, Harriman GR, Hengartner H, Zinkernagel RM.(マクファーソンAJ、ガットD、セインズベリーE、ハリマンGR、ヘンガートナーH、ジンカーナゲルRM)。腸管粘膜の常在菌に対するIgA応答の原始的なT細胞非依存性機構。Science. 2000;288:2222-2226. [PubMed][Google Scholar].
Macpherson AJ, Hunziker L, McCoy K, Lamarre A. 病原性および非病原性の微生物に対する腸粘膜のIgA応答。Microbes Infect. 2001a;3:1021-1035. [PubMed][Google Scholar].
Macpherson AJ, Lamarre A, McCoy K, Harriman GR, Odermatt B, Dougan G, Hengartner H, Zinkernagel RM. 発育中のB細胞でミュー鎖やデルタ鎖を発現しないIgA産生。Nat Immunol. 2001b;2:625-631. [PubMed】【Google Scholar】。
Macpherson AJ, Uhr T. 常在菌を保有する腸管樹状細胞による保護的IgAの誘導. Science. 2004;303:1662-1665. [PubMed][Google Scholar].
ヒト分泌性IgMは、腸管メモリーB細胞にクローン的に関連する形質細胞から出現し、高度に多様な常在菌を標的にする。Immunity. 2017;47:118-134. e118. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Masahata K, Umemoto E, Kayama H, Kotani M, Nakamura S, Kurakawa T, Kikuta J, Gotoh K, Motooka D, Sato S, et al. caecal patchにおける大腸IgA分泌細胞の生成. Nat Commun. 2014;5:3704. [PubMed][Google Scholar].
マティアスA、コルテシーB. ハイブリドーマおよびコロストラム由来の分泌型免疫グロブリンAによるグラム陽性腸内細菌の認識は、炭水化物が介在している。J Biol Chem. 2011;286:17239–17247. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Mattioli CA, Tomasi TB., Jr マウス腸管由来のIgA形質細胞の寿命. J Exp Med. 1973;138:452-460. [PMC無料記事] [PubMed][Googleスカラー]。
McWilliams M, Phillips-Quagliata JM, Lamm ME. 小腸に帰巣する腸間膜リンパ節Bリンパ芽細胞は、IgA合成に前置修飾されている。J Exp Med. 1977;145:866-875. [PMC無料記事] [PubMed][Googleスカラー]。
Moor K, Diard M, Sellin ME, Felmy B, Wotzka SY, Toska A, Bakkeren E, Arnoldini M, Bansept F, Co AD, et al. 高活性IgAが増殖中のバクテリアを繋ぎ止めて腸内を保護する。Nature. 2017;544:498-502. [PubMed][Google Scholar].
Mora JR, Iwata M, Eksteen B, Song SY, Junt T, Senman B, Otipoby KL, Yokota A, Takeuchi H, Ricciardi-Castagnoli P, et al. 腸管樹状細胞による腸管ホーミングIgA分泌B細胞の生成. Science. 2006;314:1157-1160. [PubMed][Google Scholar].
モーラJR、フォンアンドリアンUH。IgA分泌細胞の分化とホーミング。Mucosal Immunol. 2008;1:96-109. [PubMed] [Googleスカラー]。
マウスおよびヒトの肝臓には、パイエル板から発生し、腸管抗原に対して指向性を持つ免疫グロブリンAを分泌する細胞が存在する。Gastroenterology. 2016;151:311-323. [PubMed][Google Scholar].
Mouquet H, Scheid JF, Zoller MJ, Krogsgaard M, Ott RG, Shukair S, Artyomov MN, Pietzsch J, Connors M, Pereyra F, et al. Polyreactivity increases the apparent affinity of anti-HIV antibodies by heteroligation.日本語訳:多反応はヘテロライゲーションによって抗HIV抗体の見かけの親和性を高める。Nature. 2010;467:591-595. [PMC フリーアーティクル] [PubMed] [Google Scholar].
マーフィーK、ウィーバーC.ジェインウェイの免疫生物学。9. New York, NY: Garland Science/Taylor & Francis Group, LLC; 2016. Google Scholar] [Google Scholar] [Google Scholar] [Google Scholar
Mussmann R, Du Pasquier L, Hsu E. Is Xenopus IgX an analog of IgA? Eur J Immunol. 1996;26:2823-2830. [PubMed][Google Scholar].
Ng EK, Panesar N, Longo WE, Shapiro MJ, Kaminski DL, Tolman KC, Mazuski JE. ヒト腸管上皮細胞および平滑筋細胞は、IL-6の強力な産生者である。Mediators Inflamm. 2003;12:3-8. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Palm NW, de Zoete MR, Cullen TW, Barry NA, Stefanowski J, Hao L, Degnan PH, Hu J, Peter I, Zhang W, et al. Immunoglobulin A coating identifies colitogenic bacteria in inflammatory bowel disease.(免疫グロブリンAコーティングは炎症性腸疾患における結核菌を特定する). Cell. 2014;158:1000-1010. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Pasquier B, Launay P, Kanamaru Y, Moura IC, Pfirsch S, Ruffie C, Henin D, Benhamou M, Pretolani M, Blank U, Monteiro RC.を参照。炎症を制御する抑制性受容体としてのFcalphaRIの同定:FcRgamma ITAMの二重の役割。Immunity. 2005;22:31-42. [PubMed][Google Scholar].
ピーターソンDA、マクナルティNP、グルージJL、ゴードンJI。腸内ホメオスタシスのメディエーターとしての共生細菌に対するIgA応答。セルホストマイクロビー。2007;2:328-339. [PubMed】【Google Scholar】。
ピーターソンDA、プラナーJD、グルージJL、シュエL、ダウニー-ヴァージンW、グッドマンAL、シードルフH、ゴードンJI. このような場合、「痒い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」、「痛い」。J Biol Chem. 2015;290:12630–12649. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Phalipon A, Corthesy B. Novel functions of the polymeric Ig receptor: well beyond transport of immunoglobulins.(高分子Ig受容体の新しい機能:免疫グロブリンの輸送をはるかに超える)。Trends Immunol. 2003;24:55-58. [PubMed][Google Scholar].
Pinto D, Montani E, Bolli M, Garavaglia G, Sallusto F, Lanzavecchia A, Jarrossay D. Human IgA and IgM plasma cellsにおける機能的BCR.Blood. Blood. 2013;121:4110-4114. [PubMed] [Google Scholar].
Planer JD, Peng Y, Kau AL, Blanton LV, Ndao IM, Tarr PI, Warner BB, Gordon JI. 双子とgnotobioticマウスにおける腸内細菌叢と粘膜IgA応答の発達。Nature. 2016;534:263-266. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Prigent J, Lorin V, Kok A, Hieu T, Bourgeau S, Mouquet H. Scarcity of autoreactive human blood IgA(+) memory B cells.(自己反応性ヒト血中IgA(+)メモリーB細胞は少ない。Eur J Immunol. 2016;46:2340-2351. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Quan CP, Berneman A, Pires R, Avrameas S, Bouvet JP. ヒトにおける感染に対する可能なバリアとしての天然の多反応性分泌性免疫グロブリンA自己抗体。Infect Immun. 1997;65:3997-4004. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Ramsay AJ, Husband AJ, Ramshaw IA, Bao S, Matthaei KI, Koehler G, Kopf M. The role of interleukin-6 in mucosal IgA antibody responses in vivo. Script. Science. 1994;264:561-563. [PubMed][Google Scholar].
Ravetch JV, Kinet JP. Fcレセプター. Annu Rev Immunol. 1991;9:457-492. [PubMed][Google Scholar].
Reboldi A, Arnon TI, Rodda LB, Atakilit A, Sheppard D, Cyster JG. IgA産生には、パイエル板におけるB細胞と上皮下樹状細胞との相互作用が必要である。Science. 2016;352:aaf4822. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Reynolds AE, Kuraoka M, Kelsoe G. Natural IgM is produced by CD5- plasma cells that occupy a distinct survival niche in bone marrow.骨髄の生存ニッチを占めるCD5-形質細胞。J Immunol. 2015;194:231-242. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Robertson BR, O'Rourke JL, Neilan BA, Vandamme P, On SL, Fox JG, Lee A. Mucispirillum schaedleri gen.nov., sp.nov., a spiral-shaped bacterium colonizing the mucus layer of the gastrointestinal tract of laboratory rodents.(実験用げっ歯類腸管に生息する渦巻き状の細菌)。Int J Syst Evol Microbiol. 2005;55:1199-1204. [PubMed][Google Scholar].
Rogier EW, Frantz AL, Bruno ME, Wedlund L, Cohen DA, Stromberg AJ, Kaetzel CS.母乳中の分泌型抗体は母乳の分泌を促進する。母乳中の分泌抗体は、腸内細菌叢と宿主の遺伝子発現を調節することにより、長期的な腸のホメオスタシスを促進する。Proc Natl Acad Sci U S A. 2014;111:3074-3079。[PMC フリーアーティクル] [PubMed] [Google Scholar].
Rollenske T, Szijarto V, Lukasiewicz J, Guachalla LM, Stojkovic K, Hartl K, Stulik L, Kocher S, Lasitschka F, Al-Saeedi M, et al. Klebsiella pneumoniae LPS O-抗原に対するヒト保護抗体の交差特異性. Nat Immunol. 2018;19:617-624. [PubMed】【Google Scholar】。
Roux ME, McWilliams M, Phillips-Quagliata JM, Weisz-Carrington P, Lamm ME. 乳腺におけるIgA分泌形質細胞の起源。J Exp Med. 1977;146:1311-1322. [PMC無料記事] [PubMed][Googleスカラー]。
Roy B, Brennecke AM, Agarwal S, Krey M, Duber S, Weiss S. マウス腹膜B1b細胞がTGF-βとレチノイン酸の存在下でIgAにスイッチする本質的な性質がある。PLoS One. 2013;8:e82121. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Schickel JN, Glauzy S, Ng YS, Chamberlain N, Massad C, Isnardi I, Katz N, Uzel G, Holland SM, Picard C, et al. 自己反応型VH4-34発現IgG B細胞は常在菌を認識する。J Exp Med. 2017;214:1991-2003. [PMC無料記事] [PubMed] [Google Scholar].
Shimoda M, Inoue Y, Azuma N, Kanno C. Natural polyreactive immunoglobulin A antibodies produced in mouse Peyer's patches. Immunology. 1999;97:9-17. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Sitaraman SV, Klapproth JM, Moore DA, 3rd, Landers C, Targan S, Williams IR, Gewirtz AT. クローン病におけるフラジェリン特異的免疫グロブリンの上昇。アムJ Physiol Gastrointest肝臓Physiol。[PubMed] [Google Scholar] 。
Slack E, Hapfelmeier S, Stecher B, Velykoredko Y, Stoel M, Lawson MA, Geuking MB, Beutler B, Tedder TF, Hardt WD, et al. 自然免疫と適応免疫が柔軟に協力して宿主と微生物叢の相互作用を維持すること. Science. 2009;325:617-620. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Stappenbeck TS, Virgin HW. 実験科学における宿主-微生物相互作用の会計処理(Accounting for reciprocal host-microbiome interactions in experimental science). ネイチャー. 2016;534:191-199. [PubMed][Google Scholar].
ストークスCR、スーティルJF、ターナーMW. 免疫排除はIgAの機能である。Nature. 1975;255:745-746. [PubMed][Google Scholar].
濾胞樹状細胞による環境刺激の感知は、腸管における免疫グロブリンAの生成を促進する。Immunity. 2010;33:71-83. [PubMed][Google Scholar].
IgA欠損腸管における分節化した糸状菌の異常な増殖. Proc Natl Acad Sci U S A. 2004;101:1981-1986. [PMC フリーアーティクル] [PubMed] [Google Scholar].
タラムGL、ジアンHQ、ボスNA、セブラJJ. セグメント化された糸状菌は、マウス腸管粘膜免疫系の生理的に正常な状態の強力な刺激となる。Infect Immun. 1999;67:1992-2000. [PMC フリーアーティクル] [PubMed] [Google Scholar].
粘膜T細胞非依存的IgA誘導における形質細胞様樹状細胞の重要な役割. Immunity. 2011;34:247-257. [PubMed] [Google Scholar].
ヒトIgG+メモリーB細胞における自己反応性。Immunity. 2007;26:205-213. [PMC フリーアーティクル] [PubMed] [Google Scholar].
腸管パイエル板におけるFoxp3+ T細胞からの濾胞性BヘルパーT細胞の優先的産生。Science. 2009;323:1488-1492. [PubMed] [Google Scholar].
辻正人、鈴木啓介、北村秀夫、丸屋宗徳、木下公男、Ivanov II、伊藤和彦、Littman DR、Fagarasan S. 腸管における分離卵胞形成とT細胞非依存性免疫グロブリンA生成におけるリンパ系組織誘導細胞への要求(Requirement for lymphoid tissue-inducer cells in isolated follicle formation and T cell-independent immunoglobulin A generation in the gut, 2006). Immunity. 2008;29:261-271. [PubMed][Google Scholar].
分泌型IgAの量は、消化管内細菌の分泌型IgA被覆率を決定しない可能性がある。FEMS Immunol Med Microbiol. 2009;56:185-189. [PubMed][Google Scholar].
Tuma P, Hubbard AL. トランスサイトーシス:細胞間の障壁を越える。Physiol Rev. 2003;83:871-932。[PubMed][Google Scholar]。
粘膜CXCR4+ IgG形質細胞は、FcgammaRを介したCD14マクロファージの活性化を通じて、ヒト潰瘍性大腸炎の病態に寄与している。Gut. 2013;62:1734-1744. [PubMed][Google Scholar].
van der Waaij LA, Kroese FG, Visser A, Nelis GF, Westerveld BD, Jansen PL, Hunter JO. 炎症性腸疾患における糞便細菌の免疫グロブリンコーティング。Eur J Gastroenterol Hepatol. 2004;16:669-674. [PubMed] [Google Scholar] 。
van der Waaij LA, Limburg PC, Mesander G, van der Waaij D. In vivo IgA coating of anaerobic bacteria in human faeces. Gut. 1996;38:348-354. [PMC無料記事] [PubMed][Googleスカラー]。
ヴァン イタリー CM、アンダーソン JM。クラウジンと上皮小細胞輸送。Annu Rev Physiol.2006;68:403-429。[PubMed][Google Scholar].
Victora GD, Nussenzweig MC. 胚中心。Annu Rev Immunol. 2012;30:429-457. [PubMed] [Google Scholar] 。
Viladomiu M, Kivolowitz C, Abdulhamid A, Dogan B, Victorio D, Castellanos JG, Woo V, Teng F, Tran NL, Sczesnak A, et al. Crohn病の脊椎関節炎に濃縮したIgAコーティング大腸菌はTH17依存性の炎症を促進させる。Sci Transl Med. 2017;9 [PMCフリー記事] [PubMed] [Google Scholar].
ウォーカーWA、イッセルバッハKJ. 腸管抗体。N Engl J Med. 1977;297:767-773. [PubMed][Google Scholar]。
Wang S, Charbonnier LM, Noval Rivas M, Georgiev P, Li N, Gerber G, Bry L, Chatila TA. MyD88 Adaptor依存的な制御性T細胞による微生物感知は、粘膜耐性を促進し、コンセンサリズムを強制する。Immunity. 2015;43:289-303. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Wang Y, Liu L, Moore DJ, Shen X, Peek RM, Acra SA, Li H, Ren X, Polk DB, Yan F. An LGG-derived protein promotes IgA production through upregulation of APRIL expression in intestinal epithelial cells.腸管上皮細胞におけるLGG由来のタンパク質は、APRIL発現のアップレギュレーションを通じてIgA産生を促進する。Mucosal Immunol. 2017;10:373-384. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Wardemann H, Yurasov S, Schaefer A, Young JW, Meffre E, Nussenzweig MC.(ワーデマン、ユラソフ、シェーファー、ヤングJW、メッフルE、ヌッセンツヴァイク、MC. 初期ヒトB細胞前駆体による優勢な自己抗体産生。Science. 2003;301:1374-1377. [PubMed][Google Scholar].
TGF-β1およびレチノイン酸シグナルの下流で作用するIgAクラススイッチングにおけるRunxタンパク質の必要性。J Immunol. 2010;184:2785-2792. [PubMed][Google Scholar].
Aicdaのノックイン変異により体細胞超変異を起こしたマウスは、腸の恒常性が損なわれ、粘膜防御機能が低下している。Nat Immunol. 2011;12:264-270. [PubMed][Google Scholar].
Weisz-Carrington P, Roux ME, Lamm ME. 妊娠中および授乳中のマウス乳腺における形質細胞および上皮性免疫グロブリン。J Immunol. 1977;119:1306-1307. [PubMed] [Google Scholar] 。
Wijburg OL, Uren TK, Simpfendorfer K, Johansen FE, Brandtzaeg P, Strugnell RA. 自然免疫系の分泌抗体はSalmonella typhimuriumの自然感染から身を守る。J Exp Med. 2006;203:21-26. [PMC フリーアーティクル] [PubMed] [Google Scholar].
Williams RC, Gibbons RJ. 分泌型免疫グロブリンAによる細菌付着の抑制:抗原廃棄のメカニズム。Science. 1972;177:697-699. [PubMed][Google Scholar].
Williams WB, Liao HX, Moody MA, Kepler TB, Alam SM, Gao F, Wiehe K, Trama AM, Jones K, Zhang R, et al.HIV-1 VACCINES.(HIV-1ワクチン)。gp41-マイクロビオタ交差反応性抗体によるHIV-1ワクチン誘発免疫の転用。サイエンス. 2015;349:aab1253. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Wilmore JR, Gaudette BT, Gomez Atria D, Hashemi T, Jones DD, Gardner CA, Cole SD, Misic AM, Beiting DP, Allman D. Commensal Microbes Induce Serum IgA Responses that Protect against Polymicrobial Sepsis.ウィルモアJR、ゴーデットBT、ゴメスアトリアD、ハシェミT、ジョーンズDD、ガードナーCA、コールSD、ミシックAM、ベイティングDP、オールマンD. Cell Host Microbe 2018 [PMC無料論文] [PubMed] [Google Scholar].
ウィルソンE、ブッチャーEC. CCL28は、授乳期乳腺における免疫グロブリン(Ig)A形質細胞の蓄積と、新生児へのIgA抗体移行を制御します。J Exp Med. 2004;200:805-809. [PMC フリーアーティクル] [PubMed] [Google Scholar].
粘膜の代替免疫システム:組織化されたパイエル板は消化管のIgA反応に必要ない。J Immunol. 2000;164:5184-5191. [PubMed][Google Scholar].
このような場合、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」etc.Cell. 2015;163:1124-1137. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Zeng MY, Cisalpino D, Varadarajan S, Hellman J, Warren HS, Cascalho M, Inohara N, Nunez G. Gut Microbiota-Induced Immunoglobulin G Controls Systemic Infection by Symbiotic Bacteria and Pathogens.腸内細菌叢が共生細菌と病原体の感染を制御している。Immunity. 2016;44:647-658. [PMCフリーアーティクル] [PubMed] [Google Scholar].
Zhang YA, Salinas I, Li J, Parra D, Bjork S, Xu Z, LaPatra SE, Bartholomew J, Sunyer JO. 粘膜免疫に特化した原始的な免疫グロブリンクラスであるIgT。Nat Immunol. 2010;11:827-835. [PMC free article] [PubMed] [Google Scholar].
ご意見をお聞かせください
この記事が気に入ったらサポートをしてみませんか?
