人体における免疫細胞の総量、数、および分布
PNASロゴ
研究論文
オープンアクセス
共有する
人体における免疫細胞の総量、数、および分布
https://www.pnas.org/doi/full/10.1073/pnas.2308511120
Ron Sender https://orcid.org/0000-0002-1165-9818, Yarden Weiss https://orcid.org/0009-0000-0610-4482, Yoav Navon, +6, and Ron Milo https://orcid.org/0000-0003-1641-2299 ron.milo@weizmann.ac.ilAuthors Info & Affiliations
編集:David Baker(ワシントン大学、ワシントン州シアトル);2023年5月21日受領;2023年9月11日受理
2023年10月23日
120 (44) e2308511120
https://doi.org/10.1073/pnas.2308511120
第120巻|第44号
意義
要旨
材料と方法
結果
討論
データ、材料、ソフトウェアの入手
謝辞
サポート情報
参考文献
情報と著者
指標と引用
オプションの表示
参考文献
メディア
シェア
意義
我々は、人体の免疫細胞分布の特徴を明らかにし、その総重量を算出した。その結果、平均的なヒトの免疫系は約1.8兆個の細胞で構成され、その重さは約1.2kgであることがわかった。リンパ球は免疫細胞総数の40%を占め、その質量は15%である。同様に、好中球も同程度の割合を占めている。特筆すべきは、マクロファージが免疫細胞の10%を占めるが、サイズが大きいため、全細胞量の50%近くを占めていることである。この知識は免疫系を統合的に定量的にとらえ、モデルの開発を容易にする。
要旨
免疫系は、健康や病気において重要な機能を持つ細胞の複雑なネットワークである。しかし、免疫系を構成する細胞の包括的なセンサスは不足している。ここでは、ヒトの全組織に存在する主要な免疫細胞の種類を推定した。文献調査を行い、マルチプレックスイメージングとメチロームベースのデコンボリューションから得られたデータを統合した。また、細胞質量も考慮し、数と総質量の両面から免疫細胞の分布を明らかにした。その結果、体重73kgの標準的な男性の免疫系は、1.8×1012個の細胞(95%信頼区間1.5-2.3×1012)からなり、体重は1.2kg(95%信頼区間0.8-1.9)であった。リンパ球は免疫細胞総数の40%、質量の15%を占め、主にリンパ節と脾臓に存在する。好中球は免疫細胞の数と総質量の両方で同様の割合を占め、好中球のほとんどは骨髄に存在する。マクロファージはほとんどの組織に存在し、免疫細胞の10%を占めるが、サイズが大きいため細胞総量の50%近くを占める。今回発表された人体内の免疫細胞の定量化は、免疫機能をよりよく理解し、この重要なシステムの定量的モデリングを促進するのに役立つ。
PNASアラートに登録する
新しい論文のアラートや、論文が引用された際のアラートを受け取る。
免疫システムは、病原体や異物から身体を守るものであり、細胞、組織、臓器の複雑なネットワークから構成されている。体内の免疫細胞の分布は、免疫機能と健康全般を決定する重要な要素である。様々な細胞が様々な役割を担っており、効果的な応答を行うためには適切な数が存在していなければならない。しかし、免疫細胞集団の不均一性や免疫組織・臓器の複雑な組織構造のために、その分布を全体的に特徴づけることは困難である。
ヒトの免疫系を様々な角度から研究する研究は数多くあるが、様々なタイプの免疫細胞の分布と量に関する包括的な国勢調査が必要である。これまでの研究では、特定の組織や細胞タイプに焦点を当てたもの(1)や、詳細な解像度を持たないまま免疫細胞を全体の集計に含めたもの(2-4)があった。
これまでの定量的研究は、フローサイトメトリーや組織学など、様々な手法に頼ってきた。しかし、これらの研究は特定の組織や臓器に焦点を当てたものであることが多く、免疫細胞を定量化する方法や基準も異なっていたため、研究間で結果を比較することが困難であった。さらに、解析はげっ歯類に基づいて行われることが多く、ヒトへの一般化には限界があった。
以前から注目されてきた問題の一つは、ヒトの体内で最も免疫原性が高い臓器はどこか、というものである。腸を示唆する研究もあるが(5, 6)、別の候補を挙げる研究もある(7)。
本研究では、人体における免疫細胞の分布について、入手可能なデータの許す限り厳密かつ包括的に概観する。免疫細胞が存在する組織と臓器を探り、入手可能な文献を統合し、記述統計とメタアナリシスの手法を用いて、最近の情報源からのデータを分析する。また、年齢や性別など、免疫細胞の分布に影響を与える要因についても検討する。我々は、免疫系の複雑かつダイナミックな組織に関する洞察を提供し、健康と疾患における免疫細胞の分布を制御する要因に光を当てることを目的とする。
材料と方法
免疫細胞の種類
ヒトの免疫細胞の種類は多様であり、その様々な分類は研究の解像度によって異なる。この研究では、免疫学の教科書(8, 9)に定義されている主要な細胞型に焦点を当て、リンパ球系と骨髄系という2つの系統に分けた。
リンパ球は主に4つのタイプに分類される: T細胞、B細胞、NK細胞、そして形質細胞である。形質細胞はB細胞と密接な関係にあるが、その分布に関する過去の主張を再検討するために、本研究では別個に考察している(10)。この研究では、CD4またはCD8陽性T細胞、制御性T細胞、NK細胞以外の自然リンパ球など、リンパ球の亜集団を区別していない。
骨髄球に関しては、この研究では好中球、好酸球、好塩基球、肥満細胞の4種類の顆粒球を調べている。顆粒球以外の骨髄系細胞としては、マクロファージ、単球、樹状細胞の3種類も検討されている。しかしながら、古典的単球、非古典的単球、M1/M2マクロファージなど、これらの細胞型のさらなる亜集団については、この研究では明らかにしていない。ミクログリア、クッパー細胞、ランガンス細胞などの組織特異的マクロファージは、組織によって異なる細胞量を推定する以外は、区別することなくマクロファージとみなされる。
基準人物の定義と母集団間のばらつき。
私たちの調査では、歴史的に20歳から30歳の男性、体重73kg、身長176cmとされてきた標準的なヒトを利用した(11)。健康状態は免疫細胞集団に影響するため、標準的な参照ヒトを「健常」とした。
文献に掲載されている関連データのほとんどは、性・年 齢による層別化をしていないため、組織量1gあたりの細胞数(以後、「細胞密度」)の推定値は、性・年齢に依存しない広範な正常範囲を表している。細胞密度の推定値を用いて、組織や臓器の基準質量に基 づいて、私たちの結果を他の集団に外挿する(11)。このようにして、体重60kgの健康な成人女性と、体重32kgの10歳児の免疫細胞集団の基準推定値が得られた(11)。
様々な組織における免疫細胞集団の推定。
3つの主な方法を組み合わせて、人体各組織に存在する免疫細胞数を推定した。
組織学文献に基づく推定。
我々の目標は、主に組織学とフローサイトメトリー法を用いて、特定の組織の免疫細胞密度(すなわち、組織1gあたりの細胞数)を推定することに焦点を当てたデータベースを作成することであった。この目的を達成するため、各免疫細胞のタイプについて既存の文献を徹底的にレビューし、人体の様々な組織や臓器における分布の特徴を明らかにした研究を特定することを目指した。検索は電子データベースで行った: Google ScholarとPubMedの電子データベースで、特定の免疫細胞タイプと関連する組織や臓器に関連するキーワードを組み合わせて検索した。使用したキーワードは、"集団"、"数"、"密度"、"組織学"、"フローサイトメトリー "などである。
特定の免疫細胞の総数に関する過去の推定値を検討し、組織の体積または質量に基づいて細胞密度の推定値に変換した。推定値の主な情報源に十分な情報が含まれている場合は、代わりにその情報源を用いて細胞密度を直接算出した(Dataset S1)。
細胞密度の推定値は、組織学的に測定された細胞数(
)の組織学的測定値から導き出した。
)の組織学的測定値から導き出した。
)と単一細胞の直径(
)を用い、式(12, 13)に基づいて算出した:
[1]
体積密度は、脂肪組織(0.91 g/mL)を除き、1.03 g/mLという組織の基準比密度を乗じて組織1g当たりの密度に換算した。組織特異的密度の差は、解析における他の不確かさ因子と比較して無視できる程度である。
フローサイトメトリーの結果のような相対的存在量データは、細胞密度の推定値または一般的な細胞集団の絶対数に基づいて組み込まれた。例えば、皮膚マクロファージ密度は、深さ300μmまでの真皮における有核細胞の割合に基づいて推定した(4, 14)。
ICRP 2002 (11)の推定値を用いて、さまざまな身体系と臓器の総質量の基準を作成した。さらに、免疫細胞の存在の類似性に基づいて、組織と臓器を大まかなグループに分類した。これらのグループには、骨髄、リンパ系、血液、バリア上皮臓器(消化管(GI)、皮膚、肺、気道など)、その他の上皮臓器、筋、脂肪組織、その他の結合組織(末梢リンパ管を含む)、中枢神経系、細胞外液とマトリックスが含まれる。
腸や皮膚のように、上皮や真皮といった特定の組織セクションの密度が研究で示されている場合もある。そのような場合は、様々な区画の質量の近似値を用いて組織全体の平均密度を計算した。
i) マウス、ラット、サルなど他の哺乳類から得られたデータから外挿する方法、ii) 同一グループ内の類似臓器の平均細胞密度を計算する方法(幾何平均)。この2つの外挿法は似たような値を与え、その差は2倍より小さかった(SI Appendix, Fig. S8)。以下の推定には2つの方法の幾何平均を用いた。図1は、文献と外挿を用いた組織に関する情報に基づいて推定した密度を示している。図1Aから明らかなように、外挿データを加えても免疫細胞総数の推定値にはほとんど影響しなかった(外挿データの合計は、他の方法で得られた免疫細胞総数より少なくとも2桁少ない)。マクロファージやリンパ球は体内のほとんどの組織に相当量存在するが、好酸球や肥満細胞などの希少な免疫細胞タイプは、特定の組織にしか存在しないことが知られている(15, 16)。私たちは、これらの組織特異的免疫細胞に関する定性的な文献を用いて、関連組織におけるそれらの存在量を決定し、細胞密度を他の組織に外挿しませんでした。例えば、好酸球は主に消化管、骨髄、脾臓、リンパ節、胸腺に存在し、他の組織への浸潤は最小限である(15)。マスト細胞は結合組織とバリア上皮組織の前膜に存在し、骨髄にはごくわずかしか存在しない(16)。好塩基球は骨髄と血液中に存在する(16)。従って、好酸球、肥満細胞、好塩基球の密度は他の組織には外挿されなかった。
図1.
全身の免疫細胞数。免疫細胞の細胞密度は、文献と多重イメージングデータに基づいて推定した。(A)組織の総質量に対する総免疫細胞密度。両軸は対数スケールでプロットされている。対角線は臓器内の免疫細胞の総数を表す。マーカーの形は密度推定の主な方法を表す。大きな臓器や免疫細胞数の多い臓器には注釈が付されている。注釈のない組織には、黄色骨髄、軟骨、膵臓、気管支樹、副腎、胆嚢などが含まれる(臓器とその密度の完全なリストはデータセットS2を参照)。SI = 小腸。(B)様々な臓器と組織の特異的免疫細胞密度。文献とマルチプレックスに基づく推定値(外挿ではない)のみを示す。Y軸は対数スケールで示す。両パネルとも、組織と臓器は類似した構造と機能でグループ分けされている。
最後に、各組織の免疫細胞密度と細胞質量の推定値を組み合わせて、各組織に存在する各 種細胞の全体数を導き出した。
多重イメージングに基づく密度推定。
マルチプレックス・イメージングのような方法を用いると、一回の実験で複数のタンパク質やターゲットをin situで測定することができる(17-19)。これにより、サンプリングした組織における免疫細胞集団とその分布について、より詳細かつ正確に理解することができる。複数の分子標的を同時に解析することで、これらの技術は多様な免疫細胞集団のスナップショットを高解像度で提供する。従って、高分解能で複数の免疫細胞タイプの密度を決定するために使用することができる。
Liuら(20)は、脾臓、リンパ節、胸腺、扁桃腺を含む二次リンパ臓器の多重化データを提供した。著者らは、MIBI-TOFで解析された16のマーカーに基づいて、解析された組織で見つかった各細胞を特定の細胞タイプに割り当てた。該当する場合は、対照となる疾患のないリンパ系臓器のみを含むようにデータをフィルタリングし、各サンプルの細胞数について品質チェックを行い、異常値サンプル(zスコアが1.96を超えることで定義)を除去した。次に、サンプルの面積(400×400μm2)と、細胞1個の直径に相当する有効厚さ[特定の細胞タイプ(16, 21-23)に応じて約7.5~17μm;MIBI-TOFビームの厚さは無視できると仮定]を考慮して、式[1]を用いて各サンプルの各細胞タイプの密度を計算した。患者ごとにサンプルを集計し、その幾何平均値を基準密度として、患者内および患者間の値のばらつきに基づいて不確かさを推定した。解析結果はSI AppendixのFig.
メチル化アトラスに基づくデコンボリューション。
近年、研究者は遺伝子やエピジェネティックなシグネチャーの事前知識に基づいて、サンプル中の特定の細胞タイプの相対的な存在量を推定するためのデコンボリューション法を開発した。われわれは、Loyferら(24)が解析したメチル化ベースのデコンボリューションデータに注目し、免疫細胞組織集団の推定値を検証した。
メチル化ベースのデコンボリューションは、固有のメチル化パターンに基づいて異なるタイプの細胞を検出することができるため、組織の免疫細胞集団を推定する方法として信頼できる可能性がある。CpGアイランドは、一般的に多くの遺伝子の上流にある制御領域であり、メチル化されているか、あるいはメチル化されていないかのいずれかである。これは遺伝子発現のばらつきを引き起こす可能性がある。組織サンプルのメチル化パターンを解読することで、免疫細胞を含む細胞の亜集団を、その明確なメチル化パターンによって特定することが可能である。
彼らの研究では、Loyferらはすでに発表されたメチロームサンプルを調べ、脱メチル化された細胞型特異的シグネチャーのアトラスを用いて、細胞型構成をデコンボリューションし、異なる組織における細胞型の相対頻度を示した。組織免疫細胞集団の導出のために、相対頻度のLoyferらのデータセットを入手した。このデータセットには、得られたメチロームシグネチャーに応じて、様々な粒度で5つの免疫細胞タイプのグループの割合が含まれていた。リンパ球はB細胞、T細胞、NK細胞に分けられた。その他の免疫細胞群は、顆粒球(好中球、好酸球、肥満細胞、好塩基球のシグネチャーに対応すると仮定)またはマクロファージ+単球(我々は非顆粒球骨髄系と表記)に分類した。
各細胞種の相対頻度の推定値は、その組織における絶対的な総細胞数の推定値がすでに存在するアンカー細胞種を用いて絶対数に換算した。免疫細胞の絶対数(
)は、次式で推定した:
[2]
ここで、アンカー細胞の絶対数は(
)で与えられ、目的の免疫細胞とアンカー細胞の相対的な割合は(
,
で与えられる。)
アンカー値はSender and Milo 2021 (4)から得た。この文献には、人体全体に存在する様々な種類の細胞の絶対数の推定値が含まれている。異なる臓器全体の免疫細胞の分布を評価するために、同じ組織から採取した組織サンプルをクラスター化し、平均化した。不確かさの推定値は、誤差伝播によるサンプル間のばらつきに基づいて導き出された。
3つの方法の統合。
3つの方法(文献、多重イメージング、メチロームベースのデコンボリューション)で得られた結果を比較した。文献に基づく組織学的解析から得られた推定値は、ほとんどの組織で利用可能な唯一のものであったため、比較のベースラインとして使用した。異なる方法から得られた結果は、データが重なる部分であればどこでもよく一致した(SI Appendix、Fig.S2-S4)。我々は、対数空間における逆変量重み付けによって、文献に基づく組織学と多重イメージングからの結果を組み合わせ、対数正規パラメトリック推定を用いて不確実性を推定した。リンパ系臓器の結果を推定する際には、高分解能データを提供する多重イメージング法をより重視した。メチル化に基づくデコンボリューションの結果は比較的ばらつきが大きく、文献から得られた結果の検証としてのみ機能した。
タブラ・サピエンス組織学的推定による検証。
Tabula Sapiensプロジェクト(24)の一環として、病理学者が2人のドナーのヘマトキシリン・エオジン染色切片を調べ、内皮、上皮、間質、免疫の4つのコンパートメントにおける細胞タイプの割合を評価した。その相対的存在量の推定値と、事前の絶対細胞数の推定値(4)を組み合わせ、式(2)を用いて、与えられた組織の免疫コンパートメントに存在する細胞の絶対数を決定した。SI Appendix, Fig. S5に、この解析結果をまとめ、免疫細胞集団の現在の推定値と比較した。
細胞量の推定。
特定の免疫細胞の種類に関連するキーワードと、"cell"(細胞)、"volume"(体積)、"size"(大きさ)、"diameter"(直径)、"mass"(質量)などのキーワードのバリエーションを用いてGoogle Scholarで検索し、様々な種類の細胞の体積の推定値を得た。また、免疫学の教科書(16, 25)も参考にした。多くの推定値は、可能な細胞直径の範囲として示されていたため、平均直径を基に球形と仮定して細胞容積を計算した。直径の範囲が広い細胞については対数正規分布を考慮し、幾何平均を代表直径とした。血液塗抹標本からの推定値は高くなる傾向があるため、0.7の補正係数を適用し、細胞サイズを過大評価する潜在的なバイアスを考慮した。ほとんどの推定値はヒト検体から得られたが、データが限られている場合はげっ歯類からも値を収集し、それに応じてラベルを付けた。
対数正規分布を仮定して細胞体積の推定値を集計し、幾何平均を代表体積とし、対数空間におけるSEを不確かさの推定値として用いた。SI Appendix, Fig. S6Aに、異なる細胞タイプについて文献から得られた推定値をまとめた。
マクロファージは様々な大きさを示したが、これはそれらが存在する組織の影響を受けているようである。16、21、22、26を参照。我々は様々な組織から推定値を集め、単球から継続的に補充される組織と、そうでない組織の2つのグループに分類した(27)。SI Appendix, Fig. S6Bに組織別のマクロファージサイズの推定値を示す。可能な限り、マクロファージの体積は組織別の推定値を用いた。そうでない場合は、単球が組織のマクロファージ集団を補充しているかどうかに基づいて集計した推定値を用いた。
体積に一定の比密度1.07g/mLを乗じて細胞量を推定した(28)。免疫細胞間の比密度のばらつきは0.02 g/mL (28)程度とわずかであるため、体積推定の不確かさに比べれば無視できる。
不確実性の推定。
解析に用いた各値のSEを収集または算出した(データセットS1)。細胞密度の値は、組織や細胞の種類によって、数桁に及ぶ大きなばらつきがあった。特定の組織と細胞型の組み合わせに対す る推定値間のばらつきもかなり大きい。測定方法の違いや、被検者間の生物学的な差異が組み合わさった結果、特定のケースでは桁違いのばらつきに達することもあった。この点で、一次情報源の中にはサンプル数が少ないものがあることに注意する必要がある。組織間および組織内のばらつきが大きいため、不確かさは誤差の乗算係数(対数正規分布を持つ変数の不確かさ)として最も正確に表された。誤差の伝播を容易にするため、値とその不確かさを記述する正規分布に対数正規分布をフィッティングすることで、すべての値と対応する誤差を乗算誤差で表現できるように変換した。したがって、我々は値の周りの不確実性を、形状パラメータが
ここで
は乗算誤差係数である。例えば
は、真の値が与えられた値の半分から2倍の間にある確率が68%(1シグマ)であることを意味します。定義により、形状パラメータは、正規分布する指数変換された確率変数のSEを記述します。
と定義され、正規分布する。
乗算誤差を持つ2つの値の乗算誤差を伝播するために、数式を用いた解析的誤差伝播を行った:
[3]
この式は、2つの対数正規変数の乗算も対数正規分布に従うという事実に基づいており、形状パラメータは元の形状係数の2乗和の根に等しい。
我々は、非線形不確実性を持つ変数の和の誤差伝播を計算するためにブートストラップを使用した。具体的には、値の不確実性を記述する分布から1,000サンプルを抽出しました。
一般的に、様々な情報源(文献調査、手法など)から得られた値に関連する不確実性は無相関であり、伝播させることは容易である。しかし、密度値を複数の組織に外挿する場合など、場合によっては誤差が相関することが予想される。計算の際に潜在的な偏りを織り込んだ結果、合計値の不確かさがより大きくなった。
結果
文献から抽出した細胞密度データを図1Bに示す(Materials and Methods)。細胞密度は細胞の種類と組織ごとに描かれている。組織は類似の組成と機能でグループ分けされている。図1Aは、免疫系(Materials and Methods)に属するすべての細胞タイプを合計した、臓器ごとの総免疫細胞密度を示している。x軸は臓器と組織の質量を表し、対角線は組織内の免疫細胞の総数を表す。
免疫細胞密度が最も高いのはリンパ系と骨髄で、この臓器は主に免疫細胞で構成されている。免疫細胞密度は、全ての上皮性臓器(バリアー臓器と内部臓器の両方)で同様であり、骨髄のそれよりも一桁低い。特定の免疫細胞タイプの割合は、異なる上皮組織間で一桁違うこともある。マクロファージ、T細胞、B細胞の密度は、これらの組織で1グラム当たり106から107個の範囲で異なる。血漿細胞と好酸球は主に消化管に存在し、肥満細胞は主に結合組織と上皮臓器の固有層に存在する。
脂肪組織と骨格筋組織は全身の細胞量の約75%を占めるが、全身の細胞数の0.2%を占めるに過ぎない(3)。これらの組織の細胞密度は、細胞サイズが大きいため、上皮組織よりも数桁低い。同様に、脂肪組織や筋肉組織における免疫細胞密度は、上皮組織よりも2桁も低い。それにもかかわらず、これらの組織内の総免疫細胞数は、全体的に組織量が多いため、上皮組織と同程度である。
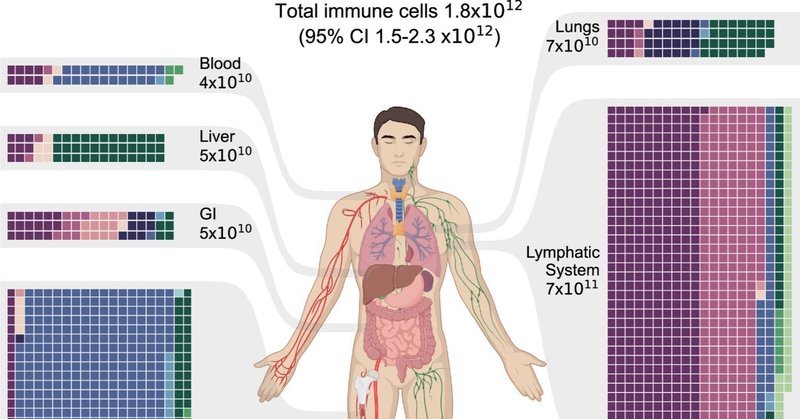
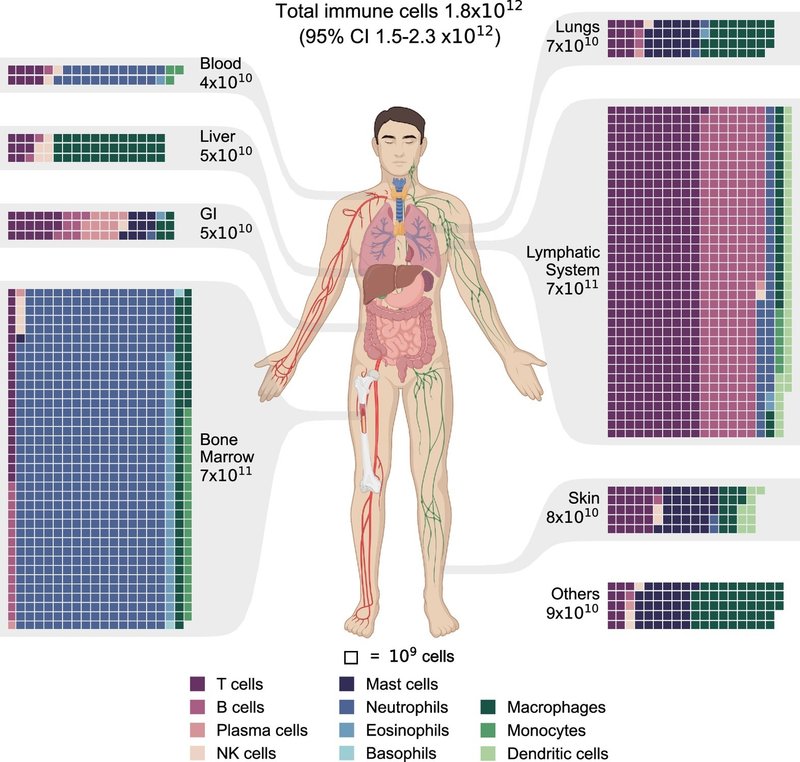
我々は、組織特異的免疫細胞密度と、基準となるヒト(11)の臓器質量を統合し、人体の様々な組織における免疫細胞総数の分布を推定した。図2に示すように、主要な臓器・器官別に推定値をまとめた。その結果、標準的な人の体内には、合計約1.8×1012個の免疫細胞が存在すると推定された(95%信頼区間1.5~2.3×1012)。ほとんどの免疫細胞は骨髄とリンパ系に存在し、それぞれ全細胞の40%と39%を占める。皮膚、肺、消化管は、それぞれ人体の全免疫細胞の3〜4%を占めるが、血液中には約2%しか存在しない。血液には体内の細胞の約90%が含まれているにもかかわらず(3, 4)、白血球はわずか0.1%で、残りは赤血球と血小板である。
図2.
人体における免疫細胞の分布。免疫細胞集団の細胞タイプ別推定値と主要組織・系別にグループ化された組織。組織は人体図によって表示される。ワッフル・チャートは各組織における免疫細胞の分布を表しており、各マス目は109個の細胞集団を表している。表示を容易にするため、個体数は109の倍数に四捨五入されている。各組織の総個体数は有効数字1桁で示した。全ての図を通して、参照しやすいように細胞の種類は色分けされている。GI=消化管。その他の組織や臓器には、脳、心臓、脂肪組織、骨格筋、腎臓などが含まれる。
図2の結果は、様々な組織で免疫細胞が多様に構成されていることを示している。骨髄には約7.4×1011個(95%信頼区間6-9×1011個)の細胞が存在し、その約80%を好中球が占めている。同様に、リンパ系には≈7.2×1011個の免疫細胞(95%信頼区間5-10×1011)が存在し、リンパ球が優勢な細胞型で全体の85%近くを占める。消化器系も比較的リンパ球が多く、消化管の免疫細胞5×1010個(95%信頼区間3-9×1010)の約70%をリンパ球が占めている。さらに、肥満細胞は消化器系の免疫細胞集団に大きく寄与しており、その約4分の1を占めている。マスト細胞は肺と皮膚の免疫細胞集団においても重要な役割を果たしており、それぞれの免疫細胞総数の約30%を占めている(肺は7×1010個、皮膚は8×1010個)。骨髄、リンパ系、消化管などの組織では、マクロファージは免疫細胞のごく一部である。しかし、肝臓では免疫細胞集団の約70%(5×1010、95%信頼区間4-7×1010)を占め、肺では全免疫細胞集団の約40%を占める。
図3は、体全体における免疫細胞タイプの全体的な分布という観点から、補完的な図を示している。図3は、組織全体における細胞タイプ別の分布を示している。T細胞、B細胞、樹状細胞は主にリンパ系に、形質細胞の約70%は消化管に存在する。好中球、好酸球、単球、好塩基球は主に骨髄に存在し、血液中には10%未満しか存在しない。対照的に、肥満細胞、NK細胞、マクロファージは組織常在細胞であり、どの系にも支配的な分布はない。
図3.
人体における免疫細胞の細胞タイプ別組織分布。免疫細胞集団の細胞タイプ別、組織別の推定値を主要組織と系別にグループ化したもの。各細胞タイプについて、細胞の絶対数(A)、細胞の絶対質量(B)、細胞の相対数(C)で、各系統にわたる分布が描かれている。
様々な組織における免疫細胞の推定数を検証するために、メチル化アトラス(29)に基づくデコンボリューション・アプローチのデータを用いた。Loyferらによって推定された組織内の細胞タイプの割合を用いて、これらの組織における特定の免疫細胞の総数を計算した(「材料と方法」のセクションを参照)。その結果、文献に基づいた方法による推定値と、メチロームに基づいたデータから得られた推定値は、比較的近い一致を示した(SI Appendix, Fig.) 推定値にかなりの不確実性があることを考慮すると、ほとんどのケースで一致している。特筆すべきは、リンパ球の推定値ではより良い一致が観察される一方、メチロームに基づく方法では顆粒球集団が過小評価される傾向があることである。
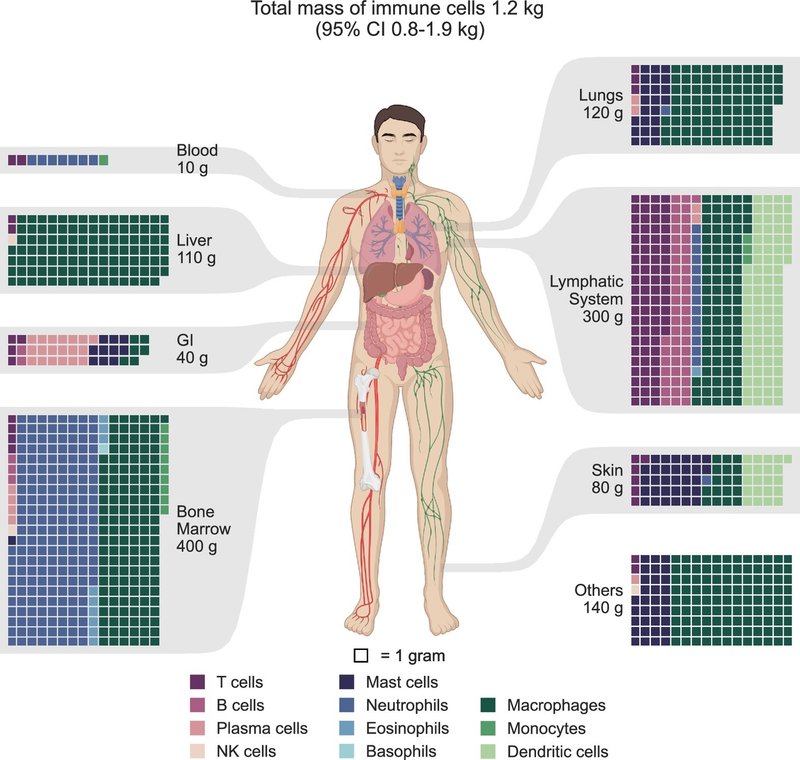
特定の免疫細胞の平均質量に関するデータは限られている。各細胞タイプの代表的な細胞質量を求めるため、私たちは文献から免疫細胞の大きさと体積に関するデータを収集し、それらを統合した。細胞分布と質量の推定値を組み合わせることで、図4に示すように、免疫細胞の質量別分布の推定値が得られた。この推定値から、体内には合計1.2kgの免疫細胞が存在することが示唆された(95% CI 0.8-1.9kg)。数による分布と同様に、骨髄とリンパ系が細胞量の大部分を占めており、それぞれ全質量の30%と27%を占めている。肺と肝臓はそれぞれ免疫細胞量の約10%を占め、血液中には約1%しか存在しない。消化管、皮膚、その他の組織には、全免疫細胞量の残り23%が含まれている。
図4.
人体における免疫細胞量の分布。免疫細胞量の推定値は、細胞量と細胞集団に基づいて統合された。推定値は主要な組織と系ごとに細胞の種類別にグループ分けされた。各組織は人体図によって表示され、各組織における免疫細胞量の分布はワッフル・チャートを用いて描かれ、各マス目は1gの免疫細胞を表している。表示を容易にするため、個体数は1gの倍数に四捨五入されている。すべての図において、参照しやすいように細胞の種類を色分けしている。GI=消化管。その他の組織や臓器には、脳、心臓、脂肪組織、骨格筋、腎臓などが含まれる。
表1は、免疫細胞の総数に対する各細胞種の寄与を、数と質量でまとめたものである。リンパ球は体内の免疫細胞の40%を占め、その数は約7.6×1011個(95%信頼区間5-12×1011)である。T細胞はリンパ球の60%を占め、B細胞は約3分の1を占める。顆粒球は免疫細胞の43%を占め、8×1011個(95%信頼区間7-10×1011)である。好中球はこれらの細胞の80%以上を占め、そのほとんどは骨髄に存在する。残りの15%は骨髄系細胞で、そのほとんどはマクロファージであり、様々な組織に分布している。
表1.
体内の免疫細胞総数
細胞種 総数 95%信頼区間 総質量[g](95%信頼区間)
T細胞 5×1011 3-7×1011 100 60-150
B細胞 3×1011 2-4×1011 60 40-90
形質細胞 2 × 1010 0.5-6 × 1010 30 4-170
NK 細胞 2 × 1010 0.9-4 × 1010 4 2-8
肥満細胞 9 × 1010 6-14 × 1010 100 40-200
好中球 7 × 1011 5-8 × 1011 200 160-300
好酸球 4 × 1010 2-8 × 1010 10 5-20
好塩基球 2 × 109 0.4-7 × 109 0.7 0.2-3
マクロファージ 2 × 1011 1.3-3 × 1011 600 300-1,400
単球 3 × 1010 2-4 × 1010 13 9-20
樹状細胞 5 × 1010 3-8 × 1010 100 40-300
合計 1.8 × 1012 1.5-2.3 × 1012 1,200 800-1,900
様々なタイプの免疫細胞の寄与を、数と総質量でまとめた。細胞タイプはそれぞれのグループに従って配列されている(全図にお けるレイアウトと同様)。推定値は有効数字の1桁目を四捨五入してある。各推定値には95%信頼区間を付してある。
免疫細胞の質量別分布は、細胞数別分布と大きく異なるが、その主な 原因は細胞の大きさにかなりのばらつきがあるためである(図5)。ほとんどの免疫細胞は比較的小さく、重さは数百ピコグラムであるが、マクロファージはかなり大きく、重さは数ナノグラムである。その結果、リンパ球は免疫細胞量の約15%を占めるに過ぎず、200グラム以下(95%信頼区間100-300グラム)に相当する。一方、マクロファージは600グラム(95%信頼区間は300-1,400グラム)、樹状細胞は100グラム(95%信頼区間は40-300グラム)で、主に細胞サイズが大きいため、免疫細胞総量の49%と9%を占める。顆粒球は免疫細胞量の約4分の1を占め、その重さは約320g(95%信頼区間240-420g)で、3分の2は主に骨髄に存在する好中球に由来する。
図5.
体内における免疫細胞の種類と数の割合。
これまでは、体重73kgの標準的なヒト(男性)を用いてきた(11)。性別や年齢に依存しない組織特異的密度データを用いて、体重60kgの基準女性と体重32kgの基準小児の臓器基準質量を考慮し、免疫細胞の分布を導き出した(11)。体重約1kgの基準女性には、1.5×1012個の免疫細胞が存在すると推定される。細胞の種類や組織別の分布は、性別や年齢を問わず、多くの組織の臓器基準質量が個体の質量に比例して直線的に増加することから、基準男性のそれと非常によく似ている。リンパ節の基準質量は小児や成人女性では示されていないため、成人男性の基準質量から直線的に補間した。
考察
ここでは、人体における免疫細胞の総数、質量、分布を推定した。これらの推定値は、これまで未解決であった免疫系に関するいくつかの基本的な定量的疑問に答えるためのベースとなる。例えば、人体で最大の免疫臓器はどこか?一般に、消化管は免疫細胞の大部分(5)、あるいは少なくともリンパ球の大部分(30, 31)を占めると言われている。我々の分析によれば、最も重要な免疫臓器は骨髄、リンパ節、脾臓である。消化管には免疫系細胞の約3%、リンパ球の約5%が存在する。したがって、GanusovとDe Boerが結論づけたように、リンパ球のほとんどは腸には存在しない(7)。しかし、ref. 10に示されているように、腸には体内の血漿抗体産生細胞の約70%が存在するため、体液性システムに関する体内で最大のコンパートメントである(図3)。NK細胞についても同様の状況が存在し、肝臓の集団が支配的である(NK細胞の約30%)。
先行する計算機による研究は、特定の組織や免疫細胞タイプに焦点を絞ったもの(1)か、より広範な解析の中で免疫細胞を検討したもの(2-4)のどちらかであったが、いくつかの詳細が欠けていた。今回の結果を先行研究と比較すると、Bianconiら(2)は血液中のリンパ球だけを調べ、骨髄中の細胞を区別しなかったため、免疫細胞のかなりの部分を見落としていたことがわかる。Senderら(3, 4)は、今回の解析と同様の免疫細胞総数の推定値を示した。現在の分布はより変化に富んでおり、骨髄系細胞の割合が高いため、全体の質量が大きくなっている。Trepelの研究(1)は、リンパ球とその人体全体における分布に焦点を当て、げっ歯類のデータをもとに、それをヒトに外挿したものである。Trepelは、ほぼ5×1011個の細胞があり、その3分の2がリンパ系に、10%が骨髄に、2%が血液中にあると推定した。今回の分析では、ヒトの細胞密度はほとんどの組織でげっ歯類に匹敵することが示された。全体の推定値である7.6×1011個(95%信頼区間4-12×1011)のリンパ球は、Trepelの外挿値とほぼ同じであるが、リンパ系に存在するリンパ球の集団がより多い。Storekら(32)の研究では、幹細胞移植を利用して、血液悪性腫瘍患者の細胞動態から循環リンパ球を定量し、約1012個と推定した。この方法の不確実性と血液学的悪性腫瘍患者のみを対象としたことを考えると、この結果はわれわれの所見と一致する。
免疫細胞の数と量の分布は、興味深い対比を示す。免疫細胞の約75%はリンパ球と好中球であるが、これらの細胞は体内で最も小さい細胞の一つであり、重さはわずか数百ピコグラムである。したがって、その細胞質量は免疫細胞全体の約30%に過ぎない。一方、マクロファージ、樹状細胞、マスト細胞は3倍から10倍も大きく、免疫細胞の20%にも満たないが、免疫細胞量の60%以上を占めている。
質量による分析でも、肝臓が免疫系においてユニークな内臓であることが浮き彫りになった。我々の推定によると、肝臓の質量1.8kg(基準ヒトの場合)の約6%が免疫系細胞で占められている。このことは、肝臓がその代謝・解毒機能を超えて、第一線の免疫バリアとして機能し、主に腸に由来する外来抗原に常にさらされていることに対抗しているという考え方と一致している(33)。
われわれは、推定値を検証するために、免疫細胞の密度や総数を定量化する独自の方法を探した。その結果、3つのデータソースが見つかったが、それぞれ範囲が限られていた。リンパ系臓器のマルチプレックスイメージングデータは、これらの組織における密度推定値の主要な検証データとなった(SI Appendix, 図S2)。これらの組織の細胞密度に関するヒトベースのデータは著しく限られていた。推定値の一部は動物データから得られたものであり、これらの知見をヒトに外挿する際にはかなりの不確実性が生じる。われわれは、文献と多重イメージングデータを組み合わせて、細胞密度の統合的推定値とその不確実性を導き出した。検証のためのもう一つの情報源は、メチロームのデコンボリューションデータであった。デコンボリューション法と文献に基づく推定値の不確実性を考慮すると、両者のアプローチは概ね一致していた(SI Appendix、図S3およびS4)。注目すべきは、メチロームに基づく方法では顆粒球集団が過小評価されるのに対して、リンパ球集団の推定値ではより強い一致が観察されたことである。これは、解離法が好中球のかなりの部分を除去する傾向があるためかもしれない。いくつかの例では、デコンボリューションベースの結果に偏りがあるように思われる。例えば膵臓免疫細胞では、デコンボリューションに基づく結果は文献に基づく結果より一桁高い。これは、デコンボリューション解析の精度が、アンカーとして使用されたごく一部のβ細胞に対して低かったためか、アンカーとして使用されたβ細胞の総数の推定値によるものかもしれない。別の説明としては、文献に基づく結果は類似組織からの外挿に基づいているため、過小評価されているということである。最後の検証方法は、Tabula Sapiensコンソーシアムによる免疫細胞の割合の独立した組織学的解析に基づくものであった(Materials and Methods)。これらのデータは、60歳前後の2人の患者から得られたもので、個々の細胞タイプに分けることはできなかった。それにもかかわらず、今回の推定値との比較では、各組織で1桁以下の差しかなく、一般的にTabula Sapiensの推定値が有利であることが示された(SI Appendix, Fig.S5)。
基準となる成人女性と小児における免疫細胞の分布は、集団間の分化に関するデータが不十分であったため、性別と年齢の独立性を仮定し、組織特異的密度を用いて推定した。従って、免疫細胞の総数と質量に対する若い年齢と性別の影響は、集団間の質量の違いによって、主に比例関係にあると推定される。参照臓器の質量におけるわずかな非線形性が、相対的な分布におけるわずかな違いを説明する(SI Appendix, Fig. S7B)。
性差が免疫系に及ぼす影響を調べた先行研究では、性差が血液中の免疫細胞組成全体に影響を及ぼす主要な因子であることが確認されている(34, 35)。エストロゲンやプロラクチンのような性ホルモンが、Bリンパ球やTリンパ球の成熟やB細胞抗体産生の増加に影響することも一因である(36)。しかし、身体の組織全体に分布する免疫細胞のタイプの違いを明らかにするには、より定量的なデータが必要である。このデータギャップを埋めることで、より微妙な性差の推定が容易になるであろう。
年齢による影響に目を向けると、まず骨髄とリンパ系に存在する免疫細胞の集団に注目することができる。すべての骨髄は出生後に活性化するが、小児期に活性化する割合は減少する。成熟期には活性骨髄の分布が大きく変化するにもかかわらず、活性骨髄が体全体に占める割合は、数十年にわたって比較的安定している(11)。骨髄内の細胞分布は、生後1年の間に明瞭な変化を受け、それ以降成人期までは比較的一定である(16)。加齢により、骨髄細胞の数と構成は最大40%減少し(37-41)、免疫細胞総数が20%近く減少し、その分布が変化する可能性がある。
リンパ系の免疫細胞集団は主に脾臓とリンパ節に存在し、胸腺に存在する割合は少ない。脾臓の質量は、小児および成人では体重に比例して増加する(11)。しかし、様々な国の様々な成人集団の間には、大きなばらつきが存在する。残念ながら、リンパ節総量の変化に関するデータは不足している。胸腺は思春期まで成長し、その後部分的に退縮するため(42)、加齢に伴って重量が減少し(11)、リンパ球密度も減少する(43、44)。胸腺の大きさが比較的小さい(成人のリンパ系の10%以下)ことを考えると、加齢によるリンパ球集団全体への影響は軽微である。
加齢は他の系でも免疫細胞集団に影響を与える。動物実験では、肝臓と脂肪組織のマクロファージ集団が加齢に依存して数倍増加することが示されており(45、46)、ヒトの脂肪組織でも同様の増加が観察されている(47)。主に血液中で観察されるリンパ球の加齢に関連した傾向には、ナイーブ細胞の減少と終末分化細胞の増加があり、ワクチン効率の低下に寄与している(48)。しかし、循環しているリンパ球の全体数はほとんど変化しない(49)。最近の総説(50)では、マウスとヒトの単一細胞研究から得られたデータを要約し、共通の傾向を明らかにしている:加齢に伴い、ほとんどの循環免疫細胞集団は減少するが、単球は増加する。このような一般的傾向は、免疫細胞組成の縦断的研究(51)と一致しており、加齢に関連した組成の変化が、免疫年齢の指標として意味があり、全死因死亡率を予測することを示している。
結論として、加齢に伴う変化により、血液で観察されるように、骨髄免疫細胞や潜在的に他の組織でも免疫細胞が大幅に減少する。同様に、脂肪組織や肝臓のような他の組織でも、骨髄性細胞が増加する。しかし、加齢が免疫細胞の分布に及ぼす影響を正確に定量化するには、さらなる特徴づけが必要である。
健常人における免疫系組成の変化について、より広いレンズを通して考察するため、定量的な測定が可能な血液を主な対象とした最近の研究を紹介する。これらの研究では、ゲノムワイド関連研究や双生児研究などの手法を用いて、免疫細胞や免疫関連タンパク質の組成に対する遺伝的・非遺伝的因子の影響を評価している。かなりの個人差があることは一般的に認められているが、その原因についてはまだ結論が出ていない。個人差の原因として遺伝的要因を強調する研究もあるが(52, 53)、性差や非遺伝的影響、例えば年齢、喫煙、サイトメガロウイルス(CMV)のような病原体への暴露を強調する研究もある(34, 35)。血液中の免疫細胞は全免疫細胞のごく一部であることを考えると、これらの因子が全身の免疫細胞の分布に与える影響について、さらなる調査が必要である。
病原体への暴露は、免疫細胞集団の多様性と偏在性に影響を与える重要な環境因子として認識されていることから(52)、その量的影響の可能性を探ることは価値がある。Wijeyesingheらによる最近の研究(54)では、ペットショップのマウスと同居させた実験用マウスと、標準的な条件で飼育したマウスを比較することによって、この点を調査した。様々な組織で定量的免疫蛍光顕微鏡検査を行ったところ、免疫細胞の頻度が増加し、臓器内の細胞数全体に寄与していることが観察された。特に、肝臓、腸、腎臓などの組織における免疫細胞集団は、25~100%という大幅な増加を示した。ヒトでも同様の影響があると考えるのが妥当であるが、これらの組織の免疫細胞総数への寄与は比較的小さいため、免疫細胞総数への影響は限定的であろう。
より一般的には、リンパ球集団の変化は、感染症、癌、その他の病態に対する免疫反応の際に起こりうる。リンパ節腫脹(リンパ節の大きさや硬さの増加)(55)は、細菌感染やウイルス感染、がんなど様々な要因によって引き起こされる。健康なリンパ節の直径は通常1cmまでである。感染症は通常、中等度かつ局所的な体積増加を引き起こす。ほとんどの場合、1.5×1.5cm2を超えて大きくなるリンパ節は悪性である(56, 57)。リンパ節ではリンパ球の細胞密度が最も高いので、この経験則を用いてリンパ節腫脹時のリンパ球数の増加を推定することができる。直径0.5cmの正常な球形リンパ節を仮定すると、推定基準サイズは約0.5cm3となり、これは以前の推定値(58, 59)と一致する。リンパ節腫脹の際、リンパ節の直径が2~2.5倍になると仮定すると、体積は8~15倍になる。しかし、このような増大は、体内に数多くあるリンパ節のごく一部に限られる。体内の全リンパ節の約2%に相当する10個までのリンパ節に影響が限局していると仮定すると、全リンパ節リンパ球の増加はせいぜい20%、または全リンパ球の増加は10%と予想される。伝染性単核球症などで起こる脾臓肥大は、脾臓の容積を2倍にし(60)、リンパ系を30%以上増大させる。したがって、この変化によって免疫細胞の総数が10%増加し、免疫系の重量が5〜10%増加する可能性がある。
肥満の場合、脂肪組織の重量は簡単に3倍になる。例えば、基準となるヒトと同じ身長で体重が50kg多い人の体格指数(BMI)は40kg/m2になる。この増加の大部分は脂肪組織に起因する。マウスとヒトを使った研究によると、肥満では脂肪組織マクロファージの密度が直線的に増加する(61)。従って、脂肪組織中のマクロファージの総数は一桁増加している。肥満は多臓器にわたる疾患であり、肥満が免疫系のサイズや構成に及ぼす影響を調べるには、皮下脂肪組織や内臓脂肪組織、骨格筋へのマクロファージ浸潤、骨髄の構成変化(62)などを考慮する必要がある。
免疫系は動的であり、病原体の出現などの状況の変化に対応できるように構築されている。健康状態が免疫細胞の数や分布に及ぼす影響を定量的に見積もることは難しい。病原体に対する免疫反応では、好中球と単球が感染場所に移動し、常在するマクロファージと相互作用する。好中球の分布は、脾臓や骨髄に存在するマージナルプールの移動により一時的に変化する。これはさらに、骨髄における好中球の産生率の上昇と、免疫反応によって誘導される寿命の延長によって変化する(63, 64)。
我々の解析は、様々な情報源と方法から統合された多数の構成要素から成り、それぞれに限界がある。私たちは、解析の様々な不確実性の原因を厳密に説明することを目指している。これを達成するために、各段階での誤差を注意深く評価し、潜在的なバイアスを考慮しながらそれを伝播させた。我々の解析における2つの主要な不確実性の原因は、リンパ球数とマクロファージの細胞量である。リンパ系におけるリンパ球密度の推定は、マルチプレックスデータと組織学の組み合わせから得られたもので、リンパ球数に劇的な影響を与える。しかし、文献データ、特にヒト患者からのデータが乏しく、多重化データでは患者数が少ないため、全体的な推定値にはかなりの不確実性がある。さらに、マルチプレックスイメージングは、疾患のない「対照」組織で行われたが、不健康な患者(多くの場合、死後)から得られた可能性があり、結果にバイアスがかかる可能性がある。マクロファージ1個の質量は組織によってほぼ1桁違う。われわれが得たマクロファージの大きさに関するデータのほとんどは、教科書的な直径の推定値から成っている。その結果、マクロファージの大きさの分布はよく理解されておらず、総質量の推定には大きな不確実性が伴う。
我々の分析では、臓器の質量に関する不確実性は重要でないという暗黙の前提のもとで行っている。そのため、参照集団(11)に提供された値を利用している。この仮定が最も大きな影響を及ぼすのは、免疫細胞の大部分を量的にも質量的にも担っている骨髄とリンパ系である。ICRPの報告書は、活性のある骨髄と脾臓の質量に関する文献を網羅的にレビューしているので、私たちの計算に大きな不確実性をもたらすことはないと予想される。しかし、リンパ節の解析基準質量は、先行報告(59)とモデリング研究(58)に限定されている。従って、この不確実性がリンパ球全体の推定値に数十%影響する可能性がある。
先に述べた不確実性の原因に加えて、この解析は、多くの組織の細胞構成に関するデータの入手可能性と分解能が限られているという制約がある。我々は、特定の組織の詳細なスナップショットを作成するために、コンピュテーショナル・デコンボリューションやマルチプレックス解析のようなハイスループット技術から得られたデータを利用することによって、限定的な方法でこれに対処している。このような方法は、同様の分析において人体の細胞組成に光を当てる大きな可能性を秘めていると、私たちは楽観視している。将来の研究では、異なる集団間の細胞組成とそのばらつきをより正確に特徴付けるための枠組みの中で、これらや他の高度な技術を用いることができるだろう。正確で自動化されたサイズ測定を含めることで、細胞量のより正確な推定にも貢献するだろう。
様々な組織における免疫細胞の分布を明らかにすることで、組織編成における共通の傾向だけでなく、組織特異的な差異も明らかになる。このように、今回の研究結果は、免疫系の複雑な性質を浮き彫りにし、その組織を支配する原理の解明につながる可能性がある。
データ、材料、ソフトウェアの入手
Liuら(20)の多重化データセットは、Zenodo: https://doi.org/10.5281/zenodo.5945388 (65)で入手できる。すべてのコードはJupyterノートブックでhttps://gitlab.com/milo-lab-public/distribution-of-immune-cells (66)。その他すべてのデータは、原稿および/またはサポート情報に含まれている。
謝辞
Uri Alon、Benny Chain、Yuval Dor、Lior Greenspon、Shalev Itzkovitz、Tommy Kaplan、Netanel Loyfer、Sam Lovat、Tomer Milo、Yuval Rosenbergには、本原稿に対する貴重なフィードバックをいただいた。資金提供 本研究は、Mary and Tom Beck Canadian Center for Alternative Energy Research、Schwartz-Reisman Collaborative Science Program、Miel de Botton(R.M.)より寛大な支援を受けた。本研究はイスラエル科学財団助成金158/18(D.B.-Z.)の支援を受けている。 ロン・ミロ教授はメアリー&トム・ベック・カナディアン・センター代替エネルギー研究所の所長であり、チャールズ&ルイーズ・ガートナー教授講座の現職である。図2と図4はBioRender.comで作成。
著者貢献R.S.、L.K.、S.F.、D.B.-Z.、E.N.およびR.M.が研究を計画し、R.S.、Y.W.、Y.N.、L.K.、S.F.、D.B.-Z.、E.N.およびR.M.が研究を遂行し、I.M.、N.A、 R.S.、Y.W.、Y.N.、I.M.、N.A.、E.N.、R.M.がデータを解析し、R.S.、L.K.、S.F.、D.B.-Z.、E.N.、R.M.が論文を執筆した。
利益相反著者らは利益相反がないことを表明している。
参考情報
付録01 (PDF)
ダウンロード
1.17 MB
データセット S01 (XLSX)
ダウンロード
262.55 KB
データセット S02 (XLSX)
ダウンロード
100.68 KB
参考資料
1
F. Trepel、ヒトにおけるリンパ球の数と分布。批判的分析。Klin. Wochenschr. 52, 511-515 (1974).
Crossref
PubMed
グーグル奨学生
2
Tabula Sapiens Consortium* et al., The Tabula Sapiens: A multiple-organ, single-cell transcriptomic atlas of humans. Science 376, eabl4896 (2022).
Google Scholar
3
E. Bianconi et al., An estimation of the number of cells in the human body. Ann. Hum. Biol. 40, 463-471 (2013).
Crossref
PubMed
グーグル奨学生
4
R. Sender, R. Milo, The distribution of cellular turnover in the human body. Nat. Med. 27, 45-48 (2021).
クロスレビュー
PubMed
グーグル奨学生
5
N. Wittkopf, M. F. Neurath, C. Becker, 腸管表面における免疫-上皮クロストーク. J. Gastroenterol. 49, 375-387 (2014).
Crossref
PubMed
グーグル奨学生
6
S. P. Wiertsema, J. van Bergenhenegouwen, J. Garssen, L. M. J. Knippels, The interplay between the gut microbiome and the immune system in context of infectious diseases throughout life and the role of nutrition in optimizing treatment strategies. Nutrients 13, 886 (2021).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
7
V. V. Ganusov, R. J. De Boer, ヒトのほとんどのリンパ球は本当に腸に存在するのか?Trends Immunol. 28, 514-518 (2007).
Crossref
PubMed
グーグル奨学生
8
C. A. Janeway, P. Travers, M. Walport, D. J. Capra, Immunobiology (Taylor & Francis Group UK: Garland Science, 2001).
参考文献へ
グーグル・スカラー
9
A. K. Abbas, A. H. Lichtman, S. Pillai, Cellular and Molecular Immunology (Elsevier Health Sciences, 2018).
参考文献へ
Google Scholar
10
R. Pabst, M. W. Russell, P. Brandtzaeg, Tissue distribution of lymphocytes and plasma cells and the role of the gut. Trends Immunol. 29, 206-208 (2008), author reply 209-210.
Crossref
PubMed
グーグル奨学生
11
ICRP, Basic Anatomical and Physiological Data for Use in Radiological Protection Reference Values (ICRP, 2002) (30 April 2020).
Google Scholar
12
G. Erdagら、腫瘍浸潤免疫細胞の免疫型および免疫組織学的特徴は、転移性黒色腫の臨床転帰と関連する。Cancer Res. 72, 1070-1080 (2012).
参考文献へ
クロスリファレンス
PubMed
Google Scholar
13
A. 腸管粘膜の形態学的解析。グルテン過敏症における直腸粘膜の定量的組織学的および免疫細胞化学的研究。Gut 34, 1225-1229 (1993).
参考文献へ
クロスレフ
PubMed
グーグル奨学生
14
N. McGovernら、ヒト真皮CD14+細胞は単球由来マクロファージの一過性集団である。Immunity 41, 465-477 (2014).
参考文献へ
クロスレフ
PubMed
Google Scholar
15
M. 加藤ら、正常ヒト組織における好酸球浸潤と脱顆粒。Anat. 252, 418-425 (1998).
Crossref
PubMed
グーグル奨学生
16
J. P. Greer, J. Foerster, J. N. Lukens, Eds., Wintrobe's Clinical Hematology (Lippincott Williams & Wilkins, ed. 11, 2004) (10 April 2023).
Google Scholar
17
M. ヒト乳腺腫瘍の多重イオンビームイメージング。Nat. Med. 20, 436-442 (2014).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
18
L. Keren et al., MIBI-TOF: A multiplexed imaging platform relates cellular phenotypes and tissue structure. Sci. Adv. 5, eaax5851 (2019).
Crossref
PubMed
グーグル奨学生
19
C. Giesen et al., マスサイトメトリーによるサブセル分解能での腫瘍組織の高多重イメージング。Nat. Methods 11, 417-422 (2014).
参考文献へ
クロスレフ
PubMed
グーグル奨学生
20
C. C. Liu et al., Multiplexed ion beam imaging by time-of-flight (MIBI-TOF) による保存ヒト組織の再現性の高い高次元イメージング。Lab. Invest. 102, 762-770 (2022).
論文
PubMed
グーグル奨学生
21
F. 肺胞マクロファージの細胞サイズ: 種間比較。Environ. Health Perspect. 105 Suppl 5, 1261-1263 (1997).
Crossref
PubMed
グーグル奨学生
22
K. C.ストーン、R.R.マーサー、P.ゲーア、B.ストックスティル、J.D.クラポ、哺乳類肺における細胞数とサイズの等尺関係。Am. J. Respir. Cell Mol. Biol. 6, 235-243 (1992).
参考文献へ
クロスリファレンス
PubMed
グーグル奨学生
23
D. N. Hart, J. L. McKenzie, ヒト扁桃樹状細胞の単離と特性化. J. Exp. Med. 168, 157-170 (1988).
参考文献へ
クロスリファレンス
パブコメ
グーグル
24
Tabula Sapiens Consortium et al., The Tabula Sapiens: A multiple-organ, single-cell transcriptomic atlas of humans. Science 376, eabl4896 (2022).
Crossref
PubMed
Google Scholar
25
M. リヒトマンほか、ウィリアムズ血液学(マグロウヒル・エデュケーション、第8版、2010年)。
参考文献へ
Google Scholar
26
R. van Furth, 正常状態と炎症における単核食細胞の特徴。Folia Haematol. Int. Mag. Klin. Morphol. Blutforsch. 111, 131-140 (1984).
参考文献へ
PubMed
グーグル
27
Y. 単球と組織常在マクロファージの起源と恒常性。J. Cell. Physiol. 233, 6425-6439 (2018).
参考文献へ
クロスレフ
PubMed
グーグル奨学生
28
A. Zipursky、E. Bow、R. S. Seshadri、E. J. Brown、健常人および急性リンパ芽球性白血病患者における白血球密度と体積。Blood 48, 361-371 (1976).
Crossref
PubMed
グーグル奨学生
29
N. Loyfer et al., A DNA methylation atlas of normal human cell types. Nature 613, 355-364 (2023).
参考文献へ
クロスリファレンス
PubMed
グーグル奨学生
30
G. A. Castro, C. J. Arntzen, 腸の免疫生理学: 一般的な粘膜免疫系の統合的研究のフロンティア。Am. J. Physiol. J. Physiol. 265, G599-G610 (1993).
参考文献へ
PubMed
Google Scholar
31
K. E. Barrett, F. K. Ghishan, J. L. Merchant, H. M. Said, J. D. Wood, Physiology of the Gastrointestinal Tract (Elsevier, 2006).
参考文献へ
クロスリファレンス
Google Scholar
32
J. Storekら、ヒトに注入されたB、CD4 T、CD8 T細胞の動態: 血管内:血管外比と総体数の推定。Clin. Immunol. 102, 249-257 (2002).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
33
Z. Stamataki, L. Swadling, The liver as an immunological barrier redefined by single-cell analysis. Immunology 160, 157-170 (2020).
参考文献へ
クロスレフ
PubMed
グーグル奨学生
34
P. ブロディン、M.M.デイビス、ヒト免疫系の変異。Nat. Rev. Immunol. 17, 21-29 (2017).
Crossref
PubMed
グーグル奨学生
35
P. Brodin et al., Variation in the human immune system is largely driven by non-heritable influences. Cell 160, 37-47 (2015).
Crossref
PubMed
グーグル奨学生
36
G.Ghazeeri、L.Abdullah、O.Abbas、男性と比較した女性の免疫学的差異: 概要とその要因。Am. J. Reprod. Immunol. 66, 163-169 (2011).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
37
M. 骨髄、胸腺、血液: 寿命に伴う変化。Aging Health 5, 385-393 (2009).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
38
W. W. Pangら、ヒト骨髄造血幹細胞は加齢とともに頻度が増加し、骨髄系に偏る。Proc. Natl. Acad. Sci. U.S.A. 108, 20012-20017 (2011).
クロスレビュー
PubMed
グーグル奨学生
39
T. H. Ambrosi et al., 肥満と加齢に伴う骨髄における脂肪細胞の蓄積は、幹細胞を用いた造血・骨再生を障害する。Cell Stem Cell 20, 771-784.e6 (2017).
Crossref
PubMed
グーグル奨学生
40
R. J. Hartsock, E. B. Smith, C. S. Petty, 前腸骨稜骨髄中の造血組織量の加齢に伴う正常変化。剖検による突然死177例からの研究。Am. Am. Clin. Pathol. 43, 326-331 (1965).
クロスレビュー
PubMed
グーグル奨学生
41
C. Ricciら、軸骨格における細胞性骨髄および脂肪性骨髄分布の正常な加齢関連パターン: MR画像研究。Radiology 177, 83-88 (1990).
参考文献へ
クロスリファレンス
PubMed
グーグル奨学生
42
K. K. A. Kooshesh, B. H. Foy, D. B. Sykes, K. Gustafsson, D. T. Scadden, Health Consequences of Thymus Removal in Adults. N. Engl. 389, 406-417 (2023).
参考文献へ
クロスレフ
PubMed
グーグル奨学生
43
J. グイ、L. M. ムスタチオ、D.-M. 胸腺の大きさと加齢に伴う胸腺の退縮: 初期プログラム、性的二型性、前駆細胞と間質。Aging Dis. 3, 280-290 (2012).
参考文献へ
PubMed
グーグル奨学生
44
M. Marusić et al., ヒト胸腺の生涯機能の間接的実証. Clin. Exp. Immunol. 111, 450-456 (1998).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
45
S. N.ヒルマー、V.C.コッガー、D.G.L.クトゥール、クッパー細胞の基礎活性は老齢に伴い増加する。J. Gerontol. A Biol. Sci. Med. 62, 973-978 (2007).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
46
C. N. Lumengら、加齢は内臓脂肪組織におけるT細胞と炎症性マクロファージの増加と関連している。J. Immunol. 187, 6208-6216 (2011).
参考文献へ
クロスリファレンス
PubMed
グーグル奨学生
47
E. O. M. de Victoriaら、皮下脂肪組織におけるマクロファージ含量: 健康なピマ・インディアンにおける脂肪率、年齢、炎症マーカー、全身のインスリン作用との関連。Diabetes 58, 385-393 (2009).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
48
K. 高齢者におけるインフルエンザワクチン接種に対する抗体反応: 定量的レビュー。Vaccine 24, 1159-1169 (2006).
参考文献へ
クロスレフ
PubMed
グーグル
49
S. N. Crooke, I. G. Ovsyannikova, G. A. Poland, R. B. Kennedy, Immunosenescence and human vaccine immune responses. Immun. Ageing 16, 25 (2019).
参考文献へ
クロスレフ
PubMed
グーグル・スカラー
50
D. A.モギレンコ、I.シュチュキナ、M.N.アルチョモフ、単一細胞レベルでの免疫老化。Nat. Rev. Immunol. 22, 484-498 (2022).
参考文献へ
クロスレフ
パブコメ
グーグル
51
A. Alpert et al., A Clinically meaningful metric of immune age derived from high-dimensional longitudinal monitoring. Nat. Med. 25, 487-495 (2019).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
52
E. Patin et al., 自然免疫細胞のパラメータにおける自然変異は、遺伝的要因によって優先的に駆動される。Nat. Immunol. 19, 302-314 (2018).
Crossref
PubMed
グーグル奨学生
53
V. Orrù et al., 免疫細胞における複雑な遺伝子シグネチャーが自己免疫の根底にあり、治療に役立つ。Nat. Genet. 52, 1036-1045 (2020).
参考文献へ
クロスレフ
パブコメ
グーグル
54
S. Wijeyesinghe et al., Expansible residence decentralizes immune homeostasis. Nature 592, 457-462 (2021).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
55
T. M. Habermann, D. P. Steensma, Lymphadenopathy. Mayo Clin. 75, 723-732 (2000).
参考文献へ
クロスレフ
PubMed
グーグル奨学生
56
R. E. Dorfman、M. B. Alpern、B. H. Gross、M. A. Sandler、上腹部リンパ節: CTによる正常サイズの判定基準。Radiology 180, 319-322 (1991).
参考文献へ
クロスレフ
PubMed
Google Scholar
57
G.B.スラップ、J.S.ブルックス、J.S.シュワルツ、若年患者における末梢リンパ節腫大の生検の実施時期。JAMA 252, 1321-1326 (1984).
参考文献へ
クロスレフ
PubMed
Google Scholar
58
C. 放射線量測定のための小児および成人ハイブリッドファントムにおける計算リンパ節モデル。Phys. Med. Biol. 58, N59-N82 (2013).
Crossref
PubMed
Google Scholar
59
W. S.スナイダー他、基準人タスクグループ報告書(ICRP、1975年)。
Google Scholar
60
J. Chapman, A. Goyal, A. M. Azevedo, Splenomegaly (StatPearls Publishing, 2022) (2023/5/8).
参考文献へ
Google Scholar
61
S. P. Weisbergら、肥満は脂肪組織におけるマクロファージの蓄積と関連している。J. Clin. Invest. 112, 1796-1808 (2003).
参考文献へ
クロスリファレンス
パブコメ
グーグル奨学生
62
A. 肥満による骨髄ホメオスタシスの変化。Front. Endocrinol. 11, 294 (2020).
参考文献へ
クロスレフ
パブコメ
グーグル
63
K. Leyら、好中球: 新たな洞察と未解決の問題。Sci. Immunol. 3, eaat4579 (2018).
参考文献へ
グーグル・スカラー
64
B. Malengier-Devlies, M. Metzemaekers, C. Wouters, P. Proost, P. Matthys, Neutrophil homeostasis and emergency granulopoiesis: 全身型若年性特発性関節炎の例。Front. Immunol. 12, 766620 (2021).
参考文献へ
クロスレフ
パブコメ
グーグル奨学生
65
C. C. Liuら, Multiplexed Ion Beam Imaging by Time-of-Flight (MIBI-TOF)による保存ヒト組織の再現性の高い高次元イメージング. https://doi.org/10.5281/zenodo.5945388. 2023年3月15日アクセス。
Google Scholar
66
R. Sender et al., 免疫細胞の分布. GitLab. https://gitlab.com/milo-lab-public/distribution-of-immune-cells. 2023年8月15日寄託。
Google Scholar
全文を見るpdfをダウンロード
この号でさらに読む
研究論文2023年10月23日
環境ショックに対する家計の境界合理的適応における不確実性
アレッサンドロ・タベルナ, タチアナ・フィラトヴァ, [...]ブレイトン・ノール
研究論文2023年10月16日
復元されたピエロラピテクス頭蓋と類人猿の顔の進化
ケルシー・D・ピュー、サンティアゴ・A・カタラーノ、[...]セルジオ・アルメシハ
研究論文2023年10月23日
共存するピコプランクトンは、海洋の生産性勾配全体で異なる相対的な摂食圧を経験する
マイケル・R・ランドリー、マイケル・R・スチュケル、[...]ラルフ・ゲーリケ
トレンド
研究論文2023年10月16日
進化するシステムにおける機能と選択の役割について
宇宙には複雑な進化システムが数多く存在するが、既存の巨視的物理法則はこれらのシステムを適切に記述していないように思われる。物理法則(運動法則、重力法則、電磁気法則、熱力学法則など)は、時空間における様々な巨視的自然システムの一般的な振る舞いを規定している。われわれは、これまで定式化されていなかった新たな法則が、自然界に存在する様々な巨視的自然システムの一般的な振る舞いを、時空を超えて体系化することを提案する。
マイケルL.ウォン、キャロルE.クレランド、[...]ロバートM.ヘイゼン、
研究論文2023年10月16日
成層圏エアロゾル粒子中の宇宙船再突入による金属
成層圏のエアロゾル粒子の約10%が、再突入時の人工衛星やロケットステージの「燃焼」に由来するアルミニウムやその他の金属を含んでいることが、測定によって示されている。直接的な健康や環境への影響はないものの...低軌道衛星の数の大幅な増加が今後数十年で予測されており [L. Schulz, K.-H. Glassmeier, Adv. Space Res. 67, 1002-1025 (2021)]、2030年までにおそらく50,000基の衛星が軌道上に追加される [GAO, Large constellations of ...]。
Daniel M. Murphy, Maya Abou-Ghanem, [...]Xiaoli Shen、
研究論文2023年10月9日
経験的に決定された低湿熱ストレス耐性の結果として、人間に対するリスクが大幅に高まる
高温多湿の増加は、人と社会を脅かす可能性がある。ここでは、実験室で測定された、生理学的根拠に基づく湿球温度の閾値を、気温と相対湿度の範囲にわたって組み込み、予測する...気候変動により熱波がより頻繁に、より激しく、より長く続くようになると、熱限界の突破という問題が差し迫ったものとなる。湿球温度(Tw)35℃は、人間の体温調節能力の理論的上限として提唱されている。
ダニエル・J・ヴェチェリオ、チンチン・コン、[...]マシュー・ヒューバー
ニュースレター
PNAS Highlightsニュースレター
詳細な科学記事を月2回受信トレイにお届けします。
name@example.com
購読する
PNASロゴ
閲覧
最新号
PNAS NEXUS
特集
ラスカー賞
号外リスト
論文集
ニュース
巻頭特集
ジャーナルクラブ
ポッドキャスト
インフォメーション
Pnasについて
ダイバーシティ&インクルージョン
編集委員会
執筆者
査読者
購読者
図書館員
プレス
コザレリ賞
PNAS更新情報
著作権 © 2023 米国科学アカデミー。無断複写・転載を禁じます。| オンライン ISSN 1091-6490
PNASはCHORUS、CLOCKSS、COPE、CrossRef、ORCID、Research4Lifeのパートナーです。
お問い合わせ サイトマップ 規約とプライバシーポリシー アクセシビリティ
当サイトでは、お客様の利便性を高めるためにクッキーを使用しています。このウェブサイトを利用することで、クッキーの設定に同意したものとみなされます。詳細を見る
リファレンス#1
この記事が気に入ったらサポートをしてみませんか?
