
歯周炎における口腔微生物叢の硝酸塩還元能の低下:全身的な一酸化窒素の利用可能性への潜在的影響
歯周炎における口腔微生物叢の硝酸塩還元能の低下:全身的な一酸化窒素の利用可能性への潜在的影響
https://www.medrxiv.org/content/10.1101/2023.06.21.23291703v1.full#F1



View ORCID ProfileBob Rosier, View ORCID ProfileWilliam Johnston, View ORCID ProfileMiguel Carda-Diéguez, View ORCID ProfileAnnabel Simpson, View ORCID ProfileElena Cabello-Yeves、 View ORCID ProfileKrystyna Piela, Robert Reilly, View ORCID ProfileAlejandro Artacho, View ORCID ProfileChris Easton, View ORCID ProfileMia Burleigh, View ORCID ProfileShauna Culshaw, View ORCID ProfileAlex Mira
doi: https://doi.org/10.1101/2023.06.21.23291703
この論文はプレプリントであり、査読を受けていない[これはどういう意味か?] まだ評価されていない新しい医学研究を報告しているため、臨床診療の指針として使用すべきではありません。
0000003
要旨
全文
情報/歴史
指標
プレビュー PDF
要旨
背景 口腔内細菌叢による硝酸塩の亜硝酸塩への還元は、口腔の健康にとって重要であり、その結果、一酸化窒素が形成され、高血圧や糖尿病などの心代謝状態を改善することができると提唱されている。歯肉縁下プラーク中の細菌組成の研究から、硝酸還元菌は健康な状態と関連していることが示唆されているが、歯周炎が硝酸還元能、ひいては一酸化窒素の利用可能性に及ぼす影響は評価されていない。本研究の目的は、歯周炎と歯周病治療が口腔内細菌叢の硝酸塩還元能にどのような影響を与えるかを評価することである。
方法 まず、健康な状態と歯周炎における硝酸還元細菌を比較するために、Dada2パイプラインを用いて、異なる国の5つの研究の16S rRNAシーケンスデータを解析した。さらに、42名の歯周炎患者の歯肉縁下プラーク、唾液および血漿サンプルを非外科的歯周治療(NSPT)前後に採取した。歯肉縁下プラーク細菌組成は、16S rRNA遺伝子のイルミナシーケンスを用いて決定し、硝酸塩還元性バイオマーカーであるRothia属の量はqPCRにより決定した。唾液および血漿中の硝酸塩および亜硝酸塩の測定を行い、in vitroで3時間培養後の唾液硝酸塩還元能(NRC)を測定し、健常人15人のNRCと比較した。
結果 歯周炎患者の歯肉縁下プラークでは、健常人と比較して硝酸還元菌が有意に少なかった(5つのデータセットすべてでp<0.05)。NSPT後、歯肉縁下プラーク中の硝酸還元菌は増加し(p<0.05)、歯周炎関連菌と負の相関を示した(p<0.001)。Rothia属の治療後の増加がqPCRで確認され(p<0.05)、唾液NRCの増加も確認された(p<0.05)。この集団では、血漿中の硝酸塩および亜硝酸塩濃度に対するNSPTの有意な効果は認められなかった。
結論 歯周炎では歯肉縁下細菌叢の硝酸還元菌レベルが低下し、NSPT後にはそのレベルと唾液NRCの両方が上昇する。我々は、NRCの障害は一酸化窒素の利用可能性に影響し、したがって歯周炎と全身状態の間の重要な関連になりうると仮定する。
はじめに
口腔衛生が不十分なために歯垢が蓄積すると、歯肉炎を発症しやすくなる1。歯肉炎はほとんどが可逆的であるが、特に影響を受けやすい人では、歯肉炎が長く続いたり繰り返されたりすることで、宿主組織が失われる慢性的で破壊的な炎症性疾患である歯周炎を発症する可能性がある。歯周炎では、歯周ポケットが形成され、歯肉縁下のプラーク細菌叢は、嫌気性、タンパク質分解性、炎症耐性、および/または好アルカリ性の菌種の増加を含む、疾患に関連した組成へと移行する2-4。
疾患関連菌の増加とともに、健康関連菌の減少も観察されている5, 6。健康な歯肉縁下環境は通常、好気性または通性嫌気性菌が優勢であることと関連している3。しかし、これらの健康な微生物集団を詳細に調査すると、生理学的測定によって硝酸塩を還元することが確認されているすべての属、すなわちRothia属、Neisseria属、Actinomyces属、Veillonella属、Kingella属、およびPropionibacterium属が含まれていることが明らかになった7。これらの属のうち、ロチア属とナイセリア属は硝酸塩と最も強い関連性を持つ細菌であり、口腔内コミュニティを硝酸塩に曝した研究のほとんど(すべてではないにせよ)で増加している8, 9。食事から摂取される硝酸塩の80%以上は野菜から摂取されると推定されており、この食品群は全身的な健康利益と強く関連している。しかし、歯周炎と硝酸塩を多く含む食品と全身的な健康結果との関係はまだ解明されていない。
何世紀にもわたり、歯周炎の影響は、炎症、出血、口臭、歯の喪失につながる口腔内だけにとどまらないことが知られてきた。口腔は呼吸器系と消化管の起点であり、高度に脈管化した口腔組織を介して血流に直結している10。歯周炎は、糖尿病、関節リウマチ、アテローム性動脈硬化症、高血圧、妊娠合併症、アルツハイマー病などのリスク増加と関連している11。このような歯周病と全身の関連性から歯周内科12という概念が生まれ、そのメカニズムは、歯周炎に関連した細菌、その産物、および/または炎症を起こした歯肉で産生された炎症性分子が、全身の炎症状態を介して体の様々な部位に到達し、合併症を引き起こすと説明されている10, 11。
全身性の合併症を引き起こす疾患関連菌種の増加とは対照的に、口腔微生物叢の産物の中には健康上の利益をもたらすものもある。例えば、口腔内の硝酸塩還元菌は硝酸塩を亜硝酸塩に還元し、場合によってはさらに一酸化窒素に還元する13, 14。口腔内細菌によって産生された一酸化窒素は、口腔粘膜を介して直接血流に入り、唾液中の亜硝酸塩の一部は飲み込まれ、胃(亜硝酸塩の酸性分解による)や宿主組織(例えば亜硝酸塩とヘミンの反応による)で一酸化窒素に変換される15。これは、血圧の低下、内皮機能の改善、運動パフォーマンスの効率化、メタボリックシンドロームの逆転、抗糖尿病効果など、いくつかの心臓代謝上の利点をもたらす可能性がある16, 17。したがって、歯周病原菌の炎症促進作用に加えて、歯周炎中に亜硝酸塩を利用する能力が低下し、この疾患の全身的な影響に関与している可能性があるかどうかを評価することは極めて重要である。
全身的な利点に加えて、口腔微生物叢による硝酸塩代謝は口腔の健康にとって重要であるようである(Rosierらによる総説、7)。一酸化窒素には抗菌作用があり、歯周炎に関連する嫌気性細菌を含む感受性の強い細菌種を死滅させる18。一方、ロチア菌とナイセリア菌の代表は硝酸塩の存在下で増加し、炎症がない状態と関連している。一酸化窒素はまた、上皮細胞に直接シグナルを送り、炎症を抑えながら血流と粘液厚を増加させることで、歯肉の恒常性に寄与している可能性がある。
そこで今回の研究では、歯周炎において硝酸還元菌のレベルが低下しているかどうか、また歯周病患者の硝酸還元能が低下しているかどうかを評価し、これが歯周炎と全身合併症との関連に寄与しているかどうかを評価することを目的とする。さらに、非外科的歯周治療(NSPT)後に硝酸塩還元属と硝酸塩還元能が増加するかどうかも明らかにすることを目的とした。そのために、歯肉縁下サンプルの16S rRNAシーケンスデータを分析し、亜硝酸塩産生菌が歯周炎では健康な歯周病と比較して少ないかどうかを調べた。さらに、非外科的歯周治療(NSPT)前後の歯周炎患者から歯肉縁下プラーク、唾液および血漿サンプルを採取した。唾液および血漿中の硝酸塩および亜硝酸塩を測定し、唾液を生理的硝酸塩濃度でインキュベートすることにより唾液硝酸塩還元能(NRC)を測定した。歯肉縁下プラーク中の亜硝酸塩産生菌に対するNSPTの効果を検討するため、イルミナシーケンスを用いて全体の細菌組成を決定し、硝酸塩還元の一貫したバイオマーカーと考えられるRothia属をqPCRで測定した。
材料と方法
健康と歯周炎を比較するバイオインフォマティクス解析
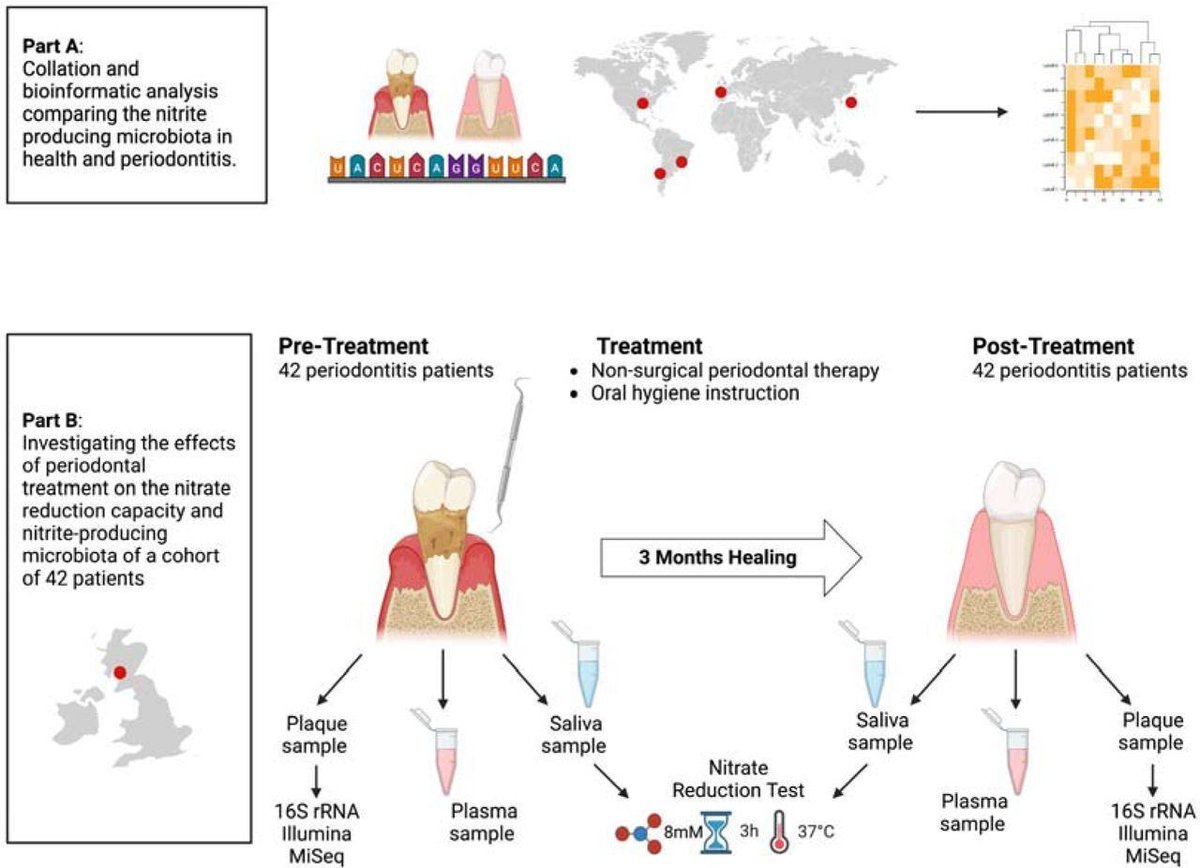
歯周病健常者と歯周炎患者との亜硝酸塩産生微生物叢の違いを見つけるために、これまでに発表されたデータセットのバイオインフォマティクス解析を行った(図1A)。歯肉縁下プラークサンプルの16S rRNAシーケンスデータを含むデータセットをNCBI SRA Databaseからダウンロードし、日本19、ブラジル20、チリ21、米国22、スペイン23の個体から得た。Fastqファイルは、DADA2 R Statisticsパッケージ(v1.20.0)24, 25を使用して、以前に説明したように処理した。簡単に説明すると、R1およびR2リードを長さでトリミングし、5個以上のエラーを持つリードを削除した。リードの重複を除去して真の配列変異を得、それをマージし(最小オーバーラップ15 bp)、SILVA v.138.1データベースにアノテーションした26, 27。さらに、Socranskyら28によって同定された赤色およびオレンジ色の複合体、Perez-Chaparoら29によって同定された歯周炎関連細菌、または赤色複合体のみを含む歯周炎関連細菌に分類した。4つのグループ(亜硝酸塩生産菌、確認された硝酸塩還元菌、歯周炎関連菌、レッドコンプレックス)の正確な菌種リストは、補足表1に記載されている。
図をダウンロードする
新しいタブで開く
図1:研究の概要。
A) 健康状態と歯周炎における硝酸還元細菌を比較するために、5カ国(日本、ブラジル、チリ、米国、スペイン)の5つの研究の16S rRNAシーケンスデータをDada2パイプラインで解析した。B) グラスゴー(スコットランド)に住む42人の歯周炎患者から、非外科的歯周治療(NSPT)の前後に歯肉縁下プラーク、唾液および血漿サンプルを採取した。歯肉縁下プラーク細菌組成は、16S rRNA遺伝子のイルミナシーケンスを用いて決定し、硝酸塩還元性バイオマーカーであるRothia属の量はqPCRにより決定した。唾液および血漿中の硝酸塩および亜硝酸塩の測定を行い、in vitroで3時間培養後の唾液硝酸塩還元能(NRC)を測定し、健常人15人のNRCと比較した。
歯周炎患者における歯周治療前後の細菌組成
歯周治療が硝酸塩還元微生物叢に及ぼす影響を調べるために、Davisonら30およびJohnstonら31に以前に記載された研究のデータとサンプルを使用した。本研究は、ヘルシンキ宣言(2013年)に従って実施され、倫理的承認を得た(London-Stanmore Research Ethics Committee, Reference: 14/LO/2064)。患者はグラスゴー歯科病院で募集し、歯周炎は第3大臼歯を除く非隣接部位の2歯以上のプロービングポケット深さ≧5mmと定義した。すべての患者は、参加前に書面によるインフォームド・コンセントに署名した。その他の参加基準とサンプル採取については、Johnstonら(2021)に記載されている。つまり、42名の患者が参加し、経験豊富な歯科衛生士1名による非外科的歯周治療(NSPT)を受けた。歯肉縁下プラーク(経験豊富な歯科衛生士1名がキュレットで採取)、よだれ唾液および血漿のサンプルを、いずれの治療来院前(ベースライン)および最後の治療来院から90日後(90日目)に採取した。90日目では、歯周病パラメータは有意に31改善していた。さらに、「口腔の健康と疾患における宿主と微生物叢の相互作用」研究(プロジェクト番号:2011002)のもと、ボランティアから健常対照唾液サンプルを採取した。この健常対照研究は、グラスゴー大学MVLS倫理委員会から倫理的承認を得た。すべてのサンプルは、使用前に-80℃で保存された。
DNAは、MagNA Pure LC DNA単離キット(Roche Diagnostics, Mannheim, Germany)を用いて歯肉縁下サンプル(ベースラインおよび90日目)から抽出し、Rosierら9に従って、リゾチーム、ムタノライシン、リゾスタフィンを含む酵素カクテルを用いた化学溶解工程を追加した。 Johnstonら31が以前に記載したように、DNA濃度はQubitTM 3 Fluorometer(Thermofisher, Waltham, Massachusetts, USA)を用いて測定した。イルミナアンプリコンライブラリーは、16S rRNA遺伝子メタゲノミックシークエンシングライブラリー調製イルミナプロトコル(Part #15 ,044,223 Rev. A)に従って調製した。 増幅後、製造元の指示に従ってIllumina MiSeq Sequencerで2lll×lll300塩基ペアエンドプロトコルを用いてDNAの塩基配列を決定した。分類学的分類のために、R 24のDADA2パイプラインを用いてアンプリコン配列変異(ASV)表を得た。分類はSILVAデータベース26との比較によって行い、ナイーブベイズ分類器を用いて種レベルでの配列の割り当てを行った。細菌種は、亜硝酸塩産生菌または歯周炎関連菌に分類された(補足表1)。
歯肉縁下プラーク中のRothiaのqPCR
歯肉縁下プラーク中のRothia細胞の総量は、Rosierら32の記載に従って、Rothia硝酸還元酵素narG遺伝子の定量的PCR(qPCR)増幅により分析した。プライマー配列は、Rothia mucilaginosa、R. dentocariosaおよびR. aeriaのnarGの保存領域を用いて、Rothia属に特異的に設計した。フォワードプライマー配列は5'-ACA CCA TYA AGT ACT ACGG-3'、リバースは5'-TAC CAG TCG TAG AAG CTG-3'であった。10μlのLight Cycler 480 SYBR Green I Master mix(Roche Life Science, Penzberg, Germany)、0.4μlの各特異的プライマー(10μM)、8.2μlの水、および1μlの鋳型DNA(歯肉縁下プラークサンプルから単離したDNA)からなるqPCRプレートの1ウェルあたり20μlの反応を加えた。各サンプルは二重に添加し、Light Cycler 480 Real-Time PCR System(Roche Life Science)を用いて以下の条件で測定を行った: ネガティブコントロールは、QubitTM 3 Fluorometer (Thermofisher)で定量したRothia属3種(R. mucilaginosa DSM-20746, R. dentocariosa DSM-43762, R. aeria DSM-14556)の等モルDNAミックスの連続希釈からなる標準曲線と同様に加えた。ゲノムサイズ33に基づき、1細胞あたりnarG遺伝子を1コピーと仮定してRothia細胞数を算出した。42個体中5個体のサンプルは、塩基配列決定手順の後にDNAが残っていなかったため、37個体のqPCRデータとなった。
唾液中硝酸塩還元試験
歯周病患者(n=42)および健常対照者(n=15)の硝酸塩還元能(NRC)は、唾液サンプルを氷上で解凍し、これを8mM硝酸塩存在下、37℃で3時間インキュベートすることにより測定した。これには、エッペンドルフチューブに入れた225μlの唾液に、80mMの硝酸ナトリウム(シグマ社製)を加えた水25μlを加えた。
唾液中の硝酸塩と亜硝酸塩
唾液中の硝酸塩と亜硝酸塩の測定には、Rosierら9の記載に従って、RQflex 10 Reflectoquant(Merck Millipore, Burlington, Massachusetts, USA)反射率計を使用した。硝酸塩用テストストリップ(Reflectoquant, Merck Millipore)の測定範囲は3~90 mg/Lで、亜硝酸塩用ストリップの測定範囲は0.5~25 mg/Lであった。両方のリフレクトメーター法の精度は、異なる化合物の既知濃度の標準溶液(Merck Millipore)を用いて確認した。唾液はそのまま使用するか、硝酸塩と亜硝酸塩の濃度に応じて5~10倍に希釈した。15μLの(希釈した)唾液をストリップ上の2つの反応性パッチそれぞれに加え、余分な液体はストリップの側面をティッシュの上に傾けて取り除いた。
硝酸塩測定の前に、希釈した上清を製造元の指示に基づきアミド硫酸(Sigma-Aldrich)で処理した。このために、35 µLの希釈上清を1.5 µLのアミド硫酸溶液(10%)と混合した。
血漿中の硝酸塩および亜硝酸塩の測定
血漿中の硝酸塩および亜硝酸塩濃度は、Liddleらの34. 血漿中亜硝酸塩の測定には、ヨウ化三試薬と100μLの消泡剤を50℃に加熱したパージ容器に入れた。100μLの亜硝酸塩溶液(62.5-1000nM)と対照試料(0nM)を注入して標準曲線を作成した。この後、血漿サンプルを37℃のウォーターバスで3分間解凍し、100μLのサンプルをパージ容器に二重に注入した。その後、反応中に開裂したNOの濃度をNOアナライザー(Sievers NOA 280i、Analytix、UK)で測定した。プラズマ硝酸塩の測定には、バナジウム試薬と100μLの消泡剤をガラス製パージ容器に入れ、95℃に加熱した。硝酸塩溶液(6.25~100μM)および対照試料(0μM)を25~50μL注入して標準曲線を作成した。血漿サンプルを解凍し、脱タンパクした。その後、サンプル50μLをパージ容器に二重に注入し、亜硝酸アッセイについて前述したように血漿硝酸塩を算出した。
統計分析
唾液および血漿中の硝酸塩および亜硝酸塩、ならびに歯肉縁下プラーク中のロチア細胞(qPCRにより測定)の統計解析は、IBM SPSS統計(バージョン27)またはGraphPad(バージョン9.5.1)を用いたノンパラメトリックWilcoxon検定を用いて行い、p値<0.05で統計的に有意とみなした。
細菌群(すなわち、亜硝酸塩産生菌、確認された硝酸塩還元菌、歯周炎関連菌、レッドコンプレックス)の解析には、統計計算にRプログラミング言語(v3.4lll+)を使用した。種の存在量はANCOM-BC 35を用いて標準化した。そして、異なるグループの細菌の標準化された組成データの合計は、Wilcoxon符号付き順位検定(Rのstatsライブラリのwilcox.test関数)を用いて比較され、調整されたp値<0.05で統計的に有意であるとみなされた。
細菌群内および細菌群間の相対存在量と生理学的パラメータとの相関は、スピアマンのrho(Rのstatsライブラリのcor.test関数)を用い、関連する調整p値とともに求めた。本研究のパラメータとは別に、Johnstonら31によって得られた唾液中サイトカイン[腫瘍壊死因子α(TNFα)、インターロイキン-6(IL-6)、インターロイキン-1β(IL-1β)]および臨床パラメータ[歯周ポケット深さ(PPD)、臨床的アタッチメントレベル(CAL)、フルマウスブリーディングスコア(FMBS)、フルマウスプラークスコア(FMPS)、歯周炎症表面積(PISA)]との相関を調べた。
図1、2および補足図1はMicrosoft Excelおよび/またはBioRenderを用いて作成し、その他の図はすべてGraphPad PRISM(バージョン9.5.1)を用いて組み立てた。
図のダウンロード
新しいタブで開く
図2:歯周炎と健康状態において確認された硝酸塩還元細菌。
棒グラフは、16S rRNA遺伝子のハイスループットシークエンシングによって推定された、各国の歯肉縁下プラークサンプル中の細菌の相対的存在量を示す。細菌はそれぞれ、Rosierら、Pérez-Chaparroら、Socranskyらに従って、確認された硝酸塩還元種、歯周炎関連種、または「レッドコンプレックス」歯周病原体にグループ分けされた(各グループの細菌種は補足表1に記載)。補足図1では、すべての既知の亜硝酸塩産生細菌(一部は硝酸塩還元以外の経路で亜硝酸塩を産生する可能性がある)が、同じパターンと健康な場合と歯周炎の場合の有意差に従って示されている。データセットには、日本(n=10歯周炎患者、10健常者)、スペイン(n=22歯周炎患者、60健常者)、アメリカ(n=29歯周炎患者、28健常者)、ブラジル(n=27歯周炎患者、21健常者)、チリ(n=22歯周炎患者、17健常者)の個体が含まれる。ANCOM-BCで標準化した組成データをWilcoxon検定で比較し、p<0.05で調整した。
結果
歯周病患者における硝酸還元菌のレベル
日本(歯周炎患者10名、健常者10名)、スペイン(歯周炎患者22名、健常者60名)、米国(歯周炎患者29名、健常者28名)、ブラジル(歯周炎患者27名、健常者21名)、チリ(歯周炎患者22名、健常者17名)の5つのデータセットについて、歯肉縁下サンプルの16S rRNA遺伝子配列解析を行った。予想通り、歯周炎に直接関与する "レッドコンプレックス "菌の割合は、5カ国すべてにおいて健常人と比較して歯周病患者において高かった(図2)。脱窒細菌叢に関しては、硝酸還元菌の相対的な割合はデータセットによって異なっていた。各国の健常人のレベルにかかわらず、硝酸還元菌の割合(図2)はすべてのケースで歯周病患者において有意に低かった(すべての国でp<0.05)。すべての既知の亜硝酸塩産生菌(一部は硝酸塩還元以外の経路で亜硝酸塩を産生する可能性がある)を考慮しても、そのパターンと統計的有意性は変わらなかった(補足図1)。
歯周治療前後の硝酸還元菌レベル
NSPT前後の歯肉縁下サンプルの細菌組成は、個人間で一貫したパターンを示した。ベースラインと比較して、硝酸塩を還元できる細菌が有意に増加し(図3A、補足図2)、Johnstonら31. このことは、NSPT後に歯肉縁下プラークによる硝酸塩代謝能が改善されることを示唆している。硝酸塩還元菌レベルの増加は、硝酸塩還元性バイオマーカーであるRothiaの特異的プライマーを用いたqPCRによって確認され、絶対レベルの有意な増加(図3B)およびこの生物の正規化レベルの増加傾向(図3C)を示した。qPCRで測定したRothiaの絶対レベルと正規化レベルは、いずれも硝酸還元菌の存在量と相関していた(それぞれr = 0.592とr = 0.574、BLとD90をグループ化した場合、いずれもp < 0.001)(補足データシート)。
図をダウンロード
新しいタブで開く
図3:歯周治療前と90日後の確認された硝酸塩還元菌種と疾患関連細菌。
A) 歯周炎患者42名の治療前(ベースライン、BL)と治療後90日(D90)の確認硝酸還元菌、レッドコンプレックスおよび歯周炎関連細菌の相対量。ANCOM-BCで標準化し、Wilcoxon検定で比較した組成データのadjusted p < 0.05、*** p < 0.001。BおよびC)治療前(BL)および治療90日後(D90)にqPCRで測定したロチア細胞(絶対量、n=37)(B)またはDNA1ngあたり(C)。*p<0.05はWilcoxon検定で求めた。DおよびE)ベースライン時(BL)と治療90日後(D90)における歯周病原菌と亜硝酸産生菌の存在量の相関。**Spearmanの順位相関のp<0.01(n.s.=有意ではない)で調整した。補足図2には、すべての既知の亜硝酸生成細菌(一部は硝酸塩還元以外の経路で亜硝酸塩を生成する可能性がある)の比較と相関が示されている。
硝酸塩還元菌のレベルと歯周炎関連菌のレベルとの間に有意な負の相関が認められた(r = -0.523、BLとD90をグループ化するとp < 0.001)(補足データシート)。治療前(BL)では、硝酸還元菌とレッドコンプレックスとの間に負の相関傾向がみられ、治療後(D90)では、硝酸還元菌と歯周炎関連菌との間に明らかな負の相関がみられた(図3Dおよび3E)。すべての亜硝酸塩産生菌群(補足表1)は、ベースライン時の唾液中IL-1βと負の相関を示した(r=-0.547、p<0.01)(補足データシート)。
健康と歯周炎における硝酸塩還元能
唾液サンプルを硝酸塩存在下で3時間インキュベートする間の硝酸塩利用率は、各個人の硝酸塩還元能(NRC)の推定値と考えられた。その結果、ベースライン時の硝酸塩濃度は3時間のインキュベーション期間中変化せず、歯周病患者に比べ健常人の方が硝酸塩還元能が高いことが明らかになった(図4A)。16S rRNAシークエンシングのデータと一致し、歯周病患者のNRCは歯周治療後に回復し、培養後の硝酸塩レベルは有意に減少した。このことから、歯周治療により歯肉縁下プラーク中の硝酸塩還元菌のレベルが上昇し、硝酸塩を代謝する能力が高まることが確認された。
図をダウンロード
新しいタブで開く
図4:健康状態と歯周炎下での硝酸塩還元能(NRC)。
AおよびB)棒グラフは、歯周病患者の歯周治療前(ベースライン、BL)および90日後(N = 42)の37℃、8mM硝酸塩存在下で3時間in vitro培養した唾液サンプルの硝酸塩(NO3 -)および亜硝酸塩(NO2 -)の濃度を、健常対照(n = 15)と比較したものである。C) 棒グラフは同じグループのこの培養期間中のpHを示す。アスタリスクは統計的に有意な差を示す(*p < 0.05, **p < 0.01, ***p < 0.001)。
硝酸塩還元菌の活性はpH測定によっても間接的に確認され、ベースライン時の歯周病患者のpH低下は治療後よりも大きかった(図4C)。これは、硝酸塩還元が脱窒または亜硝酸塩をアンモニウム7に還元する際にプロトンを消費してpH低下を緩衝することが知られていることから予想される。
上記と一致して、硝酸塩とのインキュベーションの前後でベースラインの歯周試料では亜硝酸塩濃度レベルに差がなく(図4B)、硝酸塩還元能が妨げられていることが確認された。歯周治療後、亜硝酸塩の有意な減少が観察された。この3時間の間に硝酸塩が消費されたことを考えると、亜硝酸塩レベルの低下は、亜硝酸塩がさらに一酸化窒素に還元された結果であると考えられる13。健常者では、亜硝酸塩濃度は培養後に上昇したが、この上昇は有意ではなく(p=0.17)、亜硝酸塩の初期濃度は、治療前(p<0.001)および治療後(p<0.05)の歯周炎と比較してはるかに低かった。
硝酸塩と亜硝酸塩の血漿レベル
硝酸塩と亜硝酸塩の唾液レベルとは対照的に、歯周病患者のベースライン時と歯周病治療後90日目に採取した朝の血液サンプル中の硝酸塩と亜硝酸塩の濃度を定量したところ、これら2つの時点の間に統計的な差は認められなかった(図5A-B)。両時点の血漿硝酸塩濃度は平均約50uMであり、これは硝酸塩を多く含む食事15後の生理的血中濃度の約10倍低い濃度であった。亜硝酸塩濃度は硝酸塩の400倍以上低く(図5C)、試料を採取した時点では硝酸塩還元代謝が検出されなかったことを示している。硝酸塩補給後のサンプルは採取されなかった。歯肉縁下プラーク中のロチア絶対値および規格化ロチア値と血漿亜硝酸塩との間には相関傾向があった(それぞれr=0.278および0.278、BLおよびD90をグループ化した場合、いずれもp=0.1)(補足データシート)。
図をダウンロード
新しいタブで開く
図5:歯周治療前と90日後の血漿硝酸塩と亜硝酸塩。
歯周炎患者42人の治療前(BL)と治療後(D90)のデータを示す。A) 血漿亜硝酸塩。B) 血漿硝酸塩 C) 硝酸塩/亜硝酸塩の比。
考察
本研究では、5カ国(日本、ブラジル、チリ、米国、スペイン)の16S配列決定データセットを用いて、歯周炎と健康状態における歯肉縁下プラーク細菌叢を比較した。すべての国で、歯周炎関連菌種が減少し、確認された硝酸塩還元菌種を含む亜硝酸塩産生菌が増加するという同じパターンに従った。この傾向は他の研究と一致している。例えば、Feresら(5)は、健康時と歯周炎時の歯肉縁下プラーク、および治療前後の歯周炎を比較したシークエンシング研究の知見を体系的に検討し、一般的な亜硝酸塩産生菌種が歯周の健康と関連していることを明らかにした(Steptococcus属、Neisseria longate、Neisseria subflava、Rothia aeria、Veilonella Parvula、Granulicatella adiacensなど)。さらにFeresら(2020)は、Rothia属が歯周の健康と最も強い関連性を持つ(すなわち、ほとんどの研究で歯周治療後の健康な個体で有意に高いことが判明)属であり、他の亜硝酸塩産生属(例えば、Neisseria属、Actinomyces属、Steptococcus属)がそれに続くことを見出した。これらの結果は、Veillonella、Neisseria、Rothia、Corynebacterium、Actinomyces(亜硝酸塩を産生する代表的な属をすべて含む)を歯周病の健康と関連付けたMeuricら36のバイオインフォマティクス解析や、Chenら6. 6 は、Steptococus sanguinis、Actinomyces naeslundii、Rothia aeria、Granulicatella adiacens、Rothia dentocariosa、Streptococcus mitis(すべて亜硝酸塩産生種)が、最も健康に関連する上位7種のうち6種であったと報告している。
口腔内細菌による硝酸塩の還元が口腔の健康に有益であると思われる基本的なメカニズムについては、解明が必要である7。 口腔内細菌は、亜硝酸塩をさらに一酸化窒素に還元することができる。一酸化窒素は、歯周炎に関連する嫌気性菌のような感受性の高い細菌種を抑制することができる抗菌特性を持つフリーラジカルである18。さらに、口腔内細菌による脱窒から得られる一酸化窒素は、ヒトの細胞に直接シグナルを送り、炎症を抑え、保護粘液の産生と血流を刺激する可能性がある15, 37, 38。我々の研究では、硝酸塩還元細菌は歯周炎関連細菌と負の相関を示し、この機能が口腔の健康にとって重要であるという考えを支持した。この負の相関は、歯周治療後の歯周炎患者42名において最も明確であった。これらの患者における治療後の炎症の軽減は、Johnstonら31によって以前に報告されており、すべての歯周臨床パラメータの明確かつ有意な改善から成っていた。我々の最近のin vitro研究では、歯周プラークに硝酸塩を添加すると、亜硝酸塩の産生(一酸化窒素産生の指標)、歯周炎関連種の減少、歯肉縁下の微生物異常指数の低下がみられた39。したがって、歯周炎におけるNRCの障害は、歯周炎関連種に選択的な利点を与える可能性がある。硝酸塩の消費量と患者のNRCが歯周治療の効率に及ぼす影響については、今後の研究でさらに調査する必要がある。
本研究の主要な結果の1つは、唾液サンプルのNRCが歯周炎で減少することである。刺激されていない唾液には、口腔表面から飛散した108~109個/mlの細菌40が含まれており、口腔内細菌叢の活性を研究するのに使用できる非侵襲的なサンプルである。さらに、-80℃で凍結し、氷上で解凍することにより、細菌のかなりの部分が生存していることが、本研究における37℃での3時間培養後の代謝パラメータの変化(例えば、唾液成分の細菌発酵によるpHのわずかではあるが有意な低下)によって実証された。有意な硝酸塩還元活性は、健康な15人の唾液でのみ認められ(p < 0.01)、治療前の歯周炎患者42人の唾液では認められなかった(p = 0.1)。しかし、治療から90日後には、歯周炎患者のNRCは健常人と同レベルまで回復した(p < 0.001)。Kapilら41は、硝酸塩を含む溶液で口をすすがせてNRCを測定した。NRCは歯肉の健康状態を示す有用な指標となり、全身的なパラメータとどのように相関するかを示す可能性があるため、今後の研究ではNRCを測定するさまざまな方法を比較する必要がある。
NRCの結果と同様に、歯肉縁下の硝酸塩還元性微生物叢は歯周炎では減少し(歯周健康状態と比較)、NSPT後には増加することが示された。具体的には、確認された硝酸塩還元菌を含む既知の亜硝酸塩産生菌の相対存在量について示した。これらの2つのグループの違いは、亜硝酸塩産生分離菌は、細菌を硝酸塩とインキュベートし、亜硝酸塩産生を測定することによって検出されることである。ほとんどの場合、この亜硝酸塩は硝酸塩の還元から生じるが、亜硝酸塩産生に至る経路は他にもある(例えば、一酸化窒素やアンモニウムの酸化)33。したがって、口腔内細菌のNRCは、硝酸塩の生理学的測定によって確認されるべきである7。我々の研究では、両群(亜硝酸塩産生群と確認された硝酸塩還元群)は、同様の統計的有意性(すなわち、歯周炎と健康、または歯周治療の前後でこれらの群を比較した場合、p<0.5のままであった)を示した。さらに、歯周炎治療前後の硝酸塩還元性バイオマーカーであるRothia属のqPCR測定では、サンプルあたりのRothia細胞の増加(p < 0.05)、およびng DNAあたりのRothia細胞の増加傾向(p = 0.1)が確認された。このように、歯周炎に伴う炎症とディスバイオシスの条件下では、歯肉縁下プラーク中の硝酸還元菌が減少することが確認された。また、Rothiaのレベルが硝酸塩還元菌の割合とよく相関していることも興味深い(Supplementary Datasheet)。このことは、この属が硝酸塩還元能の潜在的なバイオマーカーであることを裏付けている。実際、FMBおよびPISA指標で示される歯周炎の程度は、Rothiaレベルと(負の)相関傾向を示した(補足データシート)。このことは、最近提唱されたように、歯周保健におけるこの生物の役割の可能性、および潜在的な歯周プロバイオティクスとしての評価を支持するものである31, 39。
NRCの阻害による全身的健康への影響
歯周炎は、心血管疾患や糖尿病など、一酸化窒素42,43の欠乏と関連し、硝酸塩の補給によって改善する合併症16を含む、全身性疾患11のリスクを増加させる。本研究では、歯周炎患者の歯肉縁下プラーク中の硝酸塩還元細菌の濃度が低く、非外科的歯周治療(NSPT)後に増加することを示した。歯周炎患者では,硝酸塩還元菌量の低下とともに唾液中の硝酸塩還元能(NRC)が低下していたが,歯周治療後には健康なレベルに回復した.口腔内細菌による硝酸塩の還元は、硝酸塩-亜硝酸塩-一酸化窒素経路の重要なステップであり、全身的な一酸化窒素濃度に寄与している41。したがって、歯周炎におけるNRCの障害は、既知の炎症性および細菌性メカニズム(総説11)に加えて、さまざまな合併症の発症に寄与する可能性があると考えられる。今後、硝酸塩を多く含む食品の摂取によって歯周炎がどのような影響を受けるのか、また、硝酸塩を多く含む食事への介入が全身の一酸化窒素レベルや歯周の健康から得られる関連する利益にどのような影響を及ぼすのかを明らかにするための研究を行う必要がある。
2006年、硝酸ナトリウムの摂取が血圧を下げることが判明した44。同様に、特に硝酸塩を多く含むビートジュースは、健常人の血圧を急性的に低下させる45。2013年、Kapilら41は、硝酸塩-ヒト細胞が有効に利用できない無機化合物-と血圧との関連は、口腔微生物叢のNRCであることを確認した。絶食状態の人の口腔微生物叢のかなりの割合をクロルヘキシジンで殺菌すると、口腔微生物叢のNRCが損なわれ、血漿亜硝酸塩濃度が低下し、血圧が上昇した41。また、硝酸塩の摂取はメタボリックシンドロームの逆転や抗糖尿病作用と関連している16, 43。一方、市販のマウスウォッシュの使用は糖尿病や糖尿病予備軍の発症と相関することが判明している46。したがって、一酸化窒素が不足している状態42, 43では、口腔微生物叢による硝酸塩の還元を促進することが有効であるようだ。驚くべきことに、歯周炎は心血管疾患や糖尿病と関連している47, 48。一方、今回の研究では、歯周炎患者において歯肉縁下プラーク中の硝酸塩還元菌の減少とNRCの障害が認められた。したがって、歯周炎は、一酸化窒素欠乏を刺激することによって、心血管疾患、糖尿病、およびその他の一酸化窒素に関連する全身状態に寄与しているという仮説を立てた。このことは、口腔微生物叢による亜硝酸塩生成の増加と、心代謝リスク49の低レベルとの関連を示した、最近のメタゲノム推定研究によっても支持される。
子癇前症は、一酸化窒素の利用可能性の低下50と歯周炎の両方に関連する病態のもう一つの例である10。最近の研究で、この病態は口腔内の硝酸還元細菌の減少と関連していることが示された51。これに関連して、歯周炎の治療は妊婦の合併症を減少させるようであり52、おそらく胎児への炎症と細菌曝露を減少させることによってであろう10。われわれの研究では、NSPT後に歯肉縁下プラーク中の硝酸還元菌レベルは増加したが、NRCは健康なレベルに回復した。したがって、妊婦における歯周治療のもう一つの利点はNRCを刺激することであると考えられ、今後の研究で検討されるべきである。歯周治療はまた、内皮機能の長期的な改善とも関連している53。これについては、健康な人が硝酸塩を摂取すると内皮機能が改善することが示されている16。マウスを用いた最近の研究では、無機硝酸塩が亜硝酸塩、ひいては一酸化窒素レベルを回復させることにより、歯周炎によって誘発された内皮機能を保護し、部分的に回復させることが示された54。これらの結果を総合すると、歯周治療はNRCを増加させることにより、歯周炎の全身合併症のリスクを減少させる可能性がある。さらに、硝酸塩の摂取は、歯周炎患者の全身的パラメーターを改善するための補助的治療として試験されるべきであることを示している。
この研究の限界は、唾液と血漿のサンプルを提供する際、個人は絶食しておらず、唾液と血漿の硝酸塩と亜硝酸塩レベルに干渉する可能性のある他の習慣(例えば、運動、日光、水の摂取)に関する指示を受けていないことである。血漿および唾液中の硝酸塩および亜硝酸塩レベルに対する食事の影響が大きいことを考慮すると、歯周炎がこれらの分子のベースラインレベルにどのような影響を与えるかを見るには、この研究デザインは理想的ではなかった。このことは、硝酸塩と亜硝酸塩の血漿レベルが歯周治療の前後で有意差がなかった理由を説明することができる。しかし、唾液を硝酸塩とインキュベートすると、治療前後の歯周炎患者のNRC、および治療前の歯周炎患者と健常人との間に差が認められた。今後の研究では、この方法を、Kapilら41が用いた硝酸塩含有洗口後のin vivo測定など、すべての口腔バイオフィルムの活性を考慮したNRCを測定する他の方法と比較すべきである。本研究のもう一つの限界は、硝酸塩の利用可能性が高い条件下で血液サンプルを採取しなかったことである。したがって、今後の研究では、歯周炎患者と健常者において、硝酸塩への曝露(例えば、ビートジュースの摂取)が、唾液、血漿、硝酸塩および亜硝酸塩レベル、ならびにそれらに由来する全身的影響(例えば、血圧)に異なる影響を及ぼすかどうか、また歯周病治療後に逆転する可能性があるかどうかを検証することを提案する。最後に、本研究では、歯周炎によって最も影響を受ける歯肉縁下プラークの組成について検討した。しかし、硝酸塩の還元に関与する他の微生物群集(例えば、舌の微生物叢)に対するこの疾患の影響については調査されるべきである。
結論として、我々のデータは、歯周炎が硝酸塩還元能を低下させること、そしてこの低い硝酸塩還元能は非外科的歯周治療後に回復することを示している。硝酸塩の還元能が低下または消失すると、例えば消毒性の洗口剤によって血漿中の亜硝酸塩濃度が低下することから、歯周病は循環性の亜硝酸塩の欠損を引き起こす可能性があると考えられる。したがって、炎症作用に由来する口腔と全身との関連に加えて、歯周病患者における硝酸塩還元能の阻害もまた、一酸化窒素の利用可能性に影響される複数の全身状態の原因である可能性があることを提案する。今回の原稿が、この仮説を検証するためのさらなる実験的および臨床的研究を刺激し、健康な歯肉細菌群によって媒介される口腔内だけでなく全身の健康を改善するための食事介入による有益な効果の可能性を含むことを期待している。
競合利益
著者らは、本論文の研究、執筆、および/または発表に関して、以下の潜在的利益相反を宣言した: A.M.とB.T.Rosierは、プレバイオティクスとしての硝酸塩とプロバイオティクスとしての特定の硝酸塩還元細菌の使用を保護するFISABIO Instituteが所有する出願中の特許の共同発明者である。残りの著者は、競合する利害関係はないと宣言している。
倫理的承認の声明
本研究はヘルシンキ宣言(2013年)に従って実施された。歯周炎患者を対象とした研究については、英国National Health Service(NHS、イングランド)のLondon-Stanmore Research Ethics Committee(文献:14/LO/206)が倫理的承認を与えた。健常者の唾液サンプルを用いた研究については、University of Glasgow(スコットランド、英国)のMVLS倫理委員会(プロジェクト番号:2011002)が倫理的承認を与えた。
データの利用可能性に関する声明
治療前(BL)と治療後(D90)の歯周炎患者42名のシーケンスリードは、BioProject PRJNA725103の下、NCBI Sequencing Read Archive(SRA)に寄託されている。それ以上のデータは、対応する著者からの合理的な要求があれば入手可能である。
資金提供
歯周炎治療研究は、EU Marie Curie ITN RAPID(助成金番号290246)、Versus Arthritis(助成金番号20823)およびBBSRC(BB/P504567/1)からの助成金を受けた。William Johnstonは、グラスゴー大学とデンツプライ・シロナ社(プロジェクト番号300881)の学生俸給の支援を受けている。A.M.は、欧州地域開発基金およびスペイン科学・イノベーション・大学省からの助成金(参照番号RTI2018-102032-B-I00)、およびバレンシア・イノベーション庁からの助成金(参照番号INNVAL20/19/006)の支援を受けている。BRは、スペイン科学・イノベーション・大学省のFPIフェローシップ(Bio2015-68711-R)の支援を受けた。
参考文献
↵
Theilade, E. The non-specific theory in microbial etiology of inflammatory periodontal diseases. J Clin Periodontol. 13, 905-911 (1986).
CrossRefPubMedWeb of ScienceGoogle Scholar
↵
Rosier, B. T., Marsh, P.D., Mira, A. 健康における口腔微生物叢の回復力: 健康状態における口腔微生物叢の回復力:ディスバイオシスを防ぐメカニズム。J Dent Res. 97, 371-380 (2018).
CrossRefPubMedGoogle Scholar
↵
歯科疾患は生態学的大災害の例か?Microbiology. 149, 279-294 (2003).
CrossRefPubMedWeb of ScienceGoogle Scholar
↵
歯周病およびう蝕の発症における微生物群集の役割。Journal of clinical periodontology. J Clin Periodontol 44, S23- S38 (2017).
CrossRefGoogle Scholar
↵
Feres, M., Retamal-Valdes, B., Gonçalves, C., Cristina Figueiredo, L., Teles, F. オミックスは歯周治療を変えたか?歯周病2000。85, 182-209 (2021).
Google Scholar
↵
SMDI: An Index for Measuring Subgingival Microbial Dysbiosis. Journal of dental research 220345211035775. アドバンスオンラインパブリケーション(2021)。
Google Scholar
↵
Rosier、B.T.、Takahashi、N.、Zaura、E.、Krom、B.P.、MartÍnez-Espinosa、R.M.、van Breda、S.G.J.、Marsh、P.D.、Mira、A. The Importance of Nitrate Reduction for Oral Health. J Dent Res. 101, 887-897 (2022).
Google Scholar
↵
Vanhatalo,A.、Blackwell,J.R.、L'Heureux,J.E.、Williams,D.W.、Smith,A.、van der Giezen,M.、Winyard,P.G.、Kelly,J.、Jones,A.M. 硝酸塩応答性口腔マイクロバイオームはヒトにおける一酸化窒素の恒常性と血圧を調節する。Free Radic Biol Med. 124, 21-30 (2018).
Google Scholar
↵
口腔マイクロバイオームのための潜在的プレバイオティクスとしての硝酸塩。Sci Rep. 10, 12895, doi:10.1038/s41598-020-69931-x (2020).
CrossRefGoogle Scholar
↵
Hajishengallis, G. 歯周炎:微生物による免疫破壊から全身性炎症へ。Nat Rev Immunol. 15, 30-44 (2015).
CrossRefPubMedGoogle Scholar
↵
Hajishengallis, G., Chavakis, T. 歯周病と炎症性合併症を結びつける局所的・全身的メカニズム。Nat Rev Immunol. 21(7), 426-440 (2021).
CrossRefPubMedGoogle Scholar
↵
Beck, J. D., Papapanou, P.N., Philips, K.H., Offenbacher, S. Periodontal Medicine: 100年の進歩。J Dent Res. 98, 1053-1062 (2019).
CrossRefPubMedGoogle Scholar
↵
Schreiber, F., Stief, P., Gieseke, A., Heisterkamp, I.M., Verstraete, W., de Beer, D., Stoodley, P. ヒト歯垢における脱窒。BMC Biol.
Google Scholar
↵
Hyde, E. R., Andrade. 口腔内の硝酸還元細菌のメタゲノム解析:一酸化窒素のホメオスタシスへの示唆。PLoS One 26, 3 (2014).
Google Scholar
↵
Hezel, M. P., Weitzberg, E. The oral microbiome and nitric oxide homoeostasis. Oral Dis. 21, 7-16 (2015).
CrossRefPubMedGoogle Scholar
↵
Lundberg, J. O., Carlström, M., Weitzberg, E. Metabolic Effects of Dietary Nitrate in Health and Disease. Cell Metab. 28, 9-22, doi:10.1016/j.cmet.2018.06.007. (2018).
CrossRefPubMedGoogle Scholar
↵
Morou-Bermúdez, E., Torres-Colón, J.E., Bermúdez, N.S., Patel, R.P., Joshipura, K.J. Pathways Linking Oral Bacteria, Nitric Oxide Metabolism, and Health. J Dent Res. 101 (2022).
Google Scholar
↵
歯周病原菌に対する外因性一酸化窒素の抗菌効果。J Dent Res. 93 (2014).
Google Scholar
↵
日本人の歯肉縁下細菌叢の健康状態と疾患状態および歯周炎に伴う機能予測における役割.Odontology 108, 280-291 (2019).
Google Scholar
↵
Pérez-Chaparro, P. J., McCulloch, J.A., Mamizuka, E.M., Moraes, A.D.C.L., Faveri, M., Figueiredo, L.C., Duarte, P.M., Feres, M. Do different probing depths exhibit striking differences in microbial profiles? J Clin Periodontol. 45, 26-37 (2018).
Google Scholar
↵
Abusleme, L., Dupuy, A.K., Dutzan, N., Silva, N., Burleson, J.A., Strausbaugh, L.D., Gamonal, J., Diaz, P.I. The subgingival microbiome in health and periodontitis and its relationship with community biomass and inflammation. ISME J. 7, 1016-1025. (2013).
CrossRefPubMedWeb of ScienceGoogle Scholar
↵
ヒトの歯周炎と健康状態における特徴的で複雑な細菌プロファイルが16Sパイロシークエンシングによって明らかになった。ISME J., 1176-1185 (2012).
Google Scholar
↵
Camelo-Castillo, A. J., Mira, A., Pico, A., Nibali, L., Henderson, B., Donos, N., Tomás, I. 歯周炎と比較した健康状態における歯肉縁下細菌叢と喫煙の影響。Front Microbiol. 6 (2015).
Google Scholar
↵
Callahan, B. J., McMurdie, P.J., Rosen, M.J., Han, A.W., Johnson, A.J., Holmes, S.P. DADA2: High-resolution sample inference from Illumina amplicon data. Nat Methods. 13, 581-583 (2016).
CrossRefPubMedGoogle Scholar
↵
Team, R. C. R: A language and environment for statistical computing (http://www.R-project.org/), http://www.R-project.org/ (2014).
Google Scholar
↵
SILVAリボソームRNA遺伝子データベースプロジェクト:改良されたデータ処理とウェブベースのツール。Nucleic Acids research 41, D590-D596 (2013).
(2013年) CrossRefPubMedWeb of ScienceGoogle Scholar
↵
SILVAと「全生物種Living Tree Project (LTP)」の分類学的枠組み。Nucleic Acids Res. 42, D643-648 (2014).
CrossRefPubMedWeb of ScienceGoogle Scholar
↵
Socransky, S. S., Haffajee, A.D., Cugini, M.A., Smith, C., Kent, R.L. Jr. 歯肉縁下プラーク中の微生物複合体。J Clin Periodontol. 25, 134-144 (1998).
CrossRefPubMedWeb of ScienceGoogle Scholar
↵
Pérez-Chaparro, P. J., Gonçalves, C., Figueiredo, L.C., Faveri, M., Lobão, E., Tamashiro, N., Duarte, P., Feres, M. Newly identified pathogens associated with periodontitis: a systematic review. J Dent Res. 93, 846-858 (2014).
CrossRefPubMedGoogle Scholar
↵
Davison、E., Johnston、W., Piela、K., Rosier、B.T., Paterson、M., Mira、A., Culshaw、S. 歯周治療後の歯肉縁下プラークマイクロバイオーム、細菌に対する全身抗体およびシトルリン化蛋白質。Pathogens. 10, 193 (2021).
Google Scholar
↵
Johnston, W., Rosier, B.T., Artacho, A., Paterson, M., Piela, K.M., Delaney, C., Brown, J. L., Ramage, G., Mira, A., Culshaw, S. 機械的バイオフィルム破壊は、歯周炎患者の微生物および免疫学的シフトを引き起こす。
Google Scholar
↵
Rosier,B.T.、Palazón,C.、García-Esteban,S.、Artacho,A.、Galiana,A.、およびMira,A. 1回量の硝酸塩は、口腔マイクロバイオームによる糖発酵由来の酸性化に対する回復力を高める。11, 692883 (2021).
Google Scholar
↵
口腔と全身の健康のためのプロバイオティクスとしての硝酸塩還元細菌の単離と特性評価。Front Microbiol. 11 (2020).
Google Scholar
↵
Liddle、L.、Burleigh、M.C.、Monaghan、C.、Muggeridge、D.J.、Sculthorpe、N.、Pedlar、C.R.、Butcher、J.、Henriquez、F.L.、Easton、C. 食餌性硝酸塩投与後の生体液中の硝酸還元口腔内細菌および一酸化窒素代謝産物の変動性: 臨界差の評価。Nitric Oxide 82, 1-10 (2019).
グーグル・スカラー
↵
Lin, H., Peddada, S.D. Analysis of compositions of microbiomes with bias correction. Nat. Commun. 11 11 (2020).
Google Scholar
↵
Meuric, V., Le Gall-David, S., Boyer, E., Acuña-Amador, L., Martin, B., Fong, S.B., Barloy-Hubler, F., Bonnaure-Mallet, M. Signature of Microbial Dysbiosis in Periodontitis. Appl Environ Microbiol. 83 (2017).
Google Scholar
↵
消化管における一酸化窒素の役割。Arthritis research & therapy 10, S4 (2008).
Google Scholar
↵
Schairer, D. O., Chouake, J.S., Nosanchuk, J.D., Friedman, A.J. 抗菌剤としての一酸化窒素放出療法の可能性。Virulence 3, 271-279 (2012).
CrossRefPubMedGoogle Scholar
↵
Mazurel、D.、Carda-Diéguez、M.、Langenburg、T.、Žiemytė、M.、Johnston、W.、Martínez、C.P.、Albalat、F.、Llena、C.、Al-Hebshi、N.、Culshaw、S.、Mira、A.、Rosier、B.T. 歯周炎に対するプレバイオティクスまたはシンバイオティクス治療の可能性としての硝酸塩および硝酸塩還元Rothia aeria株。NPJ Biofilms Microbiomes. 9, 40 (2023).
Google Scholar
↵
Mantilla Gomez, S. M., Danser, M.M., Sipos, P.M., Rowshani, B., Van der Velden, U., Van der Weijden, G.A. 健常者/歯肉炎患者および歯周炎患者における舌苔と唾液細菌数。J Clin Periodontol. 28, 970-978 (2001).
CrossRefPubMedWeb of ScienceGoogle Scholar
↵
Kapil、V.、Haydar、S.M.、Pearl、V.、Lundberg、J.O.、Weitzberg、E.、Ahluwalia、A. 血圧コントロールにおける硝酸塩還元性口腔内細菌の生理的役割。Free Radic Biol Med. 55, 93-100 (2013).
CrossRefPubMedGoogle Scholar
↵
硝酸塩および亜硝酸塩の抗肥満および抗糖尿病効果。Nitric Oxide. 70, 9-24 (2017).
PubMedGoogle Scholar
↵
2型糖尿病とその合併症における無機硝酸塩/亜硝酸塩の有益な効果。Nutr Metab(ロンドン)。12, 16 (2015).
CrossRefPubMedGoogle Scholar
↵
Larsen, F. J., Ekblom, B., Sahlin, K., Lundberg, J.O., Weitzberg, E. 健康なボランティアにおける血圧に対する食事性硝酸塩の効果。N Engl J Med. 355, 2792-2793 (2006).
CrossRefPubMedWeb of ScienceGoogle Scholar
↵
Webb, A. J., Patel, N., Loukogeorgakis, S., Okorie, M., Aboud, Z., Misra, S., Rashid, R., Miall, P., Deanfield, J., Benjamin, N., MacAllister, R., Hobbs, A.J., Ahluwalia, A. 亜硝酸塩への生体変換を介した食事性硝酸塩の急性血圧低下、血管保護、抗血小板特性。高血圧 51, 784-790 (2008).
CrossRefPubMedGoogle Scholar
↵
Joshipura、K. J.、Muñoz-Torres、F.J.、Morou-Bermudez、E.、Patel、R.P. 市販マウスウォッシュの使用と糖尿病前症/糖尿病リスク。一酸化窒素 71, 14-20 (2017).
Google Scholar
↵
Preshaw, P. M., Alba, A.L., Herrera, D., Jepsen, S., Konstantinidis, A., Makrilakis, K., Taylor, R. Periodontitis and diabetes: a two-way relationship. Diabetologia 55, 21-31 (2012).
CrossRefPubMedWeb of ScienceGoogle Scholar
↵
Kebschull, M., Demmer, R.T., Papapanou, P.N. "Gum bug, leave my heart alone!"--epidemiologic and mechanistic evidence linking periodontal infections and atherosclerosis. Journal of dental research 89, 879-902 (2010).
CrossRefPubMedWeb of ScienceGoogle Scholar
↵
Goh、C.E.、Bohn、B.、Marotz、C.、Molinsky、R.、Roy、S.、Paster、B.J.、Chen、C.Y.、Rosenbaum、M.、Yuzefpolskaya、M.、Colombo、P.C.、Desvarieux、M.、Papapanou、P.N.、 Jacobs、D.R.、Knight、R.、Demmer、R.T.口腔マイクロバイオームの亜硝酸塩生成・消耗能と心代謝リスク:ORIGINSの結果。J Am Heart Assoc. 11, e023038 (2022).
Google Scholar
↵
Tashie, W., Fondjo, L.A., Owiredu, W.K.B.A., Ephraim, R.K.D., Asare, L., Adu-Gyamfi, E.A., Seidu, L. Altered Bioavailability of Nitric Oxide and L-Arginine Is a Key Determinant of Endothelial Dysfunction in Preeclampsia. Biomed Res Int.
Google Scholar
↵
Altemani、F.、Barrett、H.L.、Callaway、L.K.、McIntyre、H.D.、Dekker Nitert、M. 将来の子癇前症の女性の口腔微生物叢における硝酸塩還元細菌の存在量の減少。栄養素。14, 1139 (2022).
Google Scholar
↵
早産と低体重児出産を減らすための歯周炎のスケーリングとルートプレーニング治療:ランダム化比較試験のシステマティックレビューとメタアナリシス。J Periodontol. 83, 1508-1519 (2012).
PubMedGoogle Scholar
↵
Tonetti、M. S., D'Aiuto, F., Nibali, L., Donald, A., Storry, C., Parkar, M., Suvan, J., Hingorani, A.D., Vallance, P., Deanfield, J. 歯周炎の治療と内皮機能。N Engl J Med. 356 (2018).
Google Scholar
↵
Fernandes,D.、Khambata,R.S.、Massimo,G.、Ruivo,E.、Gee,L.C.、Foster,J.、Goddard,A.、Curtis,M.、Barnes,M.R.、Wade,W.G.、Godec,T.、Orlandi,M.、D'Aiuto,F.、Ahluwalia,A. 一酸化窒素の局所投与は、歯周炎における内皮機能障害を予防する。Pharmacol Res. 188, 106616 (2022).
Google Scholar
トップへ戻る
前へ 次へ
2023年6月29日掲載
PDFダウンロード
印刷/保存オプション
著者宣言
補足資料
データ/コード
電子メール
共有
引用ツール
COVID-19 SARS-CoV-2のプレプリント(medRxivおよびbioRxivより
主題領域
歯科および口腔医学
対象分野
すべての記事
中毒医学
アレルギー・免疫学
麻酔学
心臓血管医学
歯科および口腔医学
皮膚科学
救急医学
内分泌学(糖尿病および代謝性疾患を含む)
疫学
法医学
消化器病学
遺伝学・ゲノム医学
老年医学
医療経済学
医療情報学
医療政策
医療システムと質向上
血液学
HIV/エイズ
感染症(HIV/AIDSを除く)
集中治療とクリティカルケア医学
医学教育
医療倫理
腎臓学
神経学
看護学
栄養学
産婦人科
産業保健および環境保健
腫瘍学
眼科
整形外科
耳鼻咽喉科
疼痛医学
緩和医療
病理学
小児科
薬理学・治療学
プライマリ・ケア研究
精神医学と臨床心理学
公衆衛生・グローバルヘルス
放射線学と画像診断
リハビリテーション医学と理学療法
呼吸器内科
リウマチ学
性と生殖に関する健康
スポーツ医学
外科学
毒物学
移植
泌尿器科学
本論文の評価・議論 x
0 0 0 0 0 0 3
この記事が気に入ったらサポートをしてみませんか?
