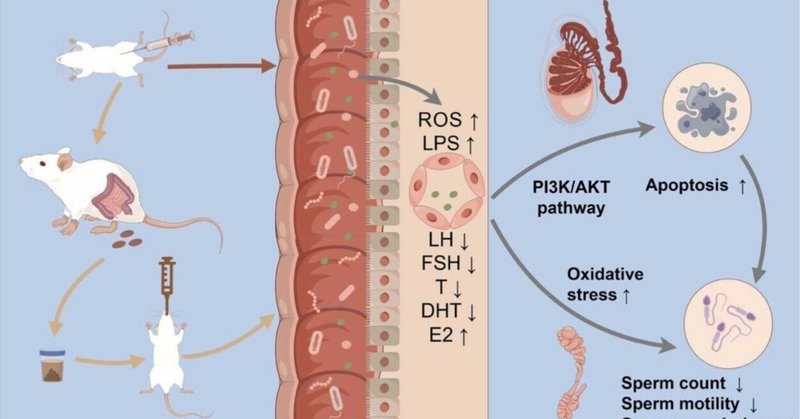
腸内細菌叢はメタンフェタミンによる雄マウスの生殖毒性に関与する
本文へスキップ記事へスキップ
エルゼビアロゴ
生態毒性学と環境安全性
第279巻 2024年7月1日 116457号
腸内細菌叢はメタンフェタミンによる雄マウスの生殖毒性に関与する
https://www.sciencedirect.com/science/article/pii/S0147651324005335?via%3Dihub

著者リンク オーバーレイパネルを開くJia-Li Liu a 1, Li-Jian Chen a 1, Yi Liu a, Jia-Hao Li a, Kai-Kai Zhang a, Clare Hsu a, Xiu-Wen Li a, Jian-Zheng Yang a, Long Chen a, Jia-Hao Zeng a, Xiao-Li Xie b, Qi Wang a
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.ecoenv.2024.116457
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
メタンフェタミン(METH)曝露は雄マウスに生殖毒性を誘発した。
メタンフェタミン(METH)曝露により腸内細菌叢に変化が生じ、腸管バリアの完全性が損なわれた。
METH曝露は精巣のトランスクリプトームと代謝発現プロファイルを変化させた。
糞便微生物叢移植により、METH投与マウスと健常レシピエントマウスで同様の生殖障害が認められた。
要旨
メタンフェタミン(METH)はアンフェタミン系覚醒剤に属する精神刺激薬であり、雄の生殖毒性を示すことが知られている。最近の研究では、METHが腸内細菌叢を破壊することが示唆されている。さらに、腸内細菌叢の機能不全と生殖の健康との間の潜在的な関連性から、腸-精巣軸の概念が注目されている。それにもかかわらず、雄性生殖毒性に対するMETHの影響を媒介する腸内細菌叢の役割については不明な点が多い。本研究では、精子の質、精巣病理、生殖ホルモンレベルを評価するために、METHを段階的に投与したマウスモデルを用いた。雄性生殖毒性に対する腸内細菌叢の影響を調べるために、糞便微生物叢移植法を採用した。トランスクリプトーム解析、メタボローム解析、微生物学的解析を行い、METHによる男性生殖系へのダメージメカニズムを探った。その結果、METH曝露により、マウスのホルモン異常、精子の質の低下、腸内細菌叢と精巣のメタボロームが変化することがわかった。精巣RNA配列決定により、PI3K-Aktシグナル伝達経路だけでなく、生殖プロセスに関連するいくつかのGene Ontology用語が濃縮されていることが明らかになった。FMTにより、METH投与マウスと健常レシピエントマウスとで同様の生殖障害が認められた。以上の所見から、腸内細菌叢がMETHによる生殖毒性を促進する上で重要な役割を果たしていることが示唆され、METH誘発性不妊症の治療介入のための有望な道が明らかになった。
グラフィカルアブストラクト
ダウンロード 高解像度画像ダウンロード(150KB)
ダウンロード フルサイズ画像のダウンロード
腸内細菌叢が雄マウスのMETH誘発生殖毒性に寄与していることを示す図。Figdraw(https://www.figdraw.com)で作成。
前の記事次の記事
キーワード
メタンフェタミン腸内細菌叢生殖毒性腸-精巣軸
はじめに
広く使用されているアンフェタミン型覚せい剤であるメタンフェタミン(METH)は、神経系、肝臓、心臓、生殖器官を含む様々な器官や系に有害な影響を及ぼすことが知られている(Aziziら、2023、Jayanthiら、2021、Kevilら、2019、Zhangら、2017、Zhangら、2021)。世界全体では、推定3,600万人がアンフェタミン型覚せい剤を乱用しており(UNODC, 2023)、中国のMETH使用者数は毎年増加し続けている(Liu et al.) 生殖年齢にある若者の間でMETH乱用の蔓延がエスカレートしていることは、差し迫った社会問題である(Dheinら、2018、Guerin and Kim、2021、Labossier and Hadland、2022、Steinbergら、2011、Uhlmannら、2014)。先行研究では、METHが生殖発達に大きな影響を与えることが示されている。METHは男性の生殖毒性を誘発し、精巣の損傷や精子の質の低下をもたらすことが実証されている(Linら、2014、Nudmamud-Thanoi and Thanoi、2011)。METHへの曝露は、性ホルモン障害や精巣におけるエストロゲン受容体およびプロゲステロン受容体の発現低下と関連している(Linら、2014;Nudmamud-Thanoiら、2016)。いくつかの研究では、γ-アミノ酪酸(GABA)やカテコールアミンに対する精巣受容体の変化も男性生殖機能障害の一因である可能性が強調されている(Janphetら、2017;Kaewmanら、2018)。さらに、運動性、受精能、先体反応などの精子の機能は、カルシウムチャネルに依存している(Darszonら、2005年)。METHはカルシウムチャネル関連遺伝子やタンパク質を変化させる可能性があり、その結果、精子のカルシウムシグナル伝達に異常をきたす(Allaeian Jahromiら、2022、Kaewmanら、2023)。げっ歯類の研究から、METHは酸化ストレス、DNA損傷、異常な精子形成の誘発を介して、男性の生殖能力を損なう可能性があることが示唆されている(Peirouvi and Razi, 2022, Saberi et al.)
近年、微生物叢が生殖に及ぼす潜在的な影響を様々なレベルで探求する研究が増えている(Wangら、2022b)。細菌は精液の質に直接影響し、これらの微生物が生殖管に存在すると受胎能に悪影響が出ることが提唱されている(Merinoら、1995)。精液サンプルのマイクロバイオーム組成を調べたところ、無力精子症および乏精子症と診断された患者では、健康な対照群と比較して、独特のβ多様性があることが明らかになった(Yang et al.) 消化器系に存在する微生物叢は宿主との共生関係を維持し、免疫、代謝、腸管バリア機能など多くの機能を調節している。ある研究では、食事誘発性の微生物叢異常と精子形成不全との間に強い関連性があることが強調されており、その潜在的な原因因子として、エンドトキシンレベルの上昇、精巣遺伝子発現の調節異常、精巣上体における局所的炎症などが挙げられている(Ding et al.) 食事誘発性代謝異常のヒツジモデルでは、腸内細菌異常により胆汁酸レベルが低下していることが示された。この減少は、腸から精巣への脂溶性ビタミンAの輸送に影響を及ぼし、低レベルのビタミンAは精子形成を阻害する可能性がある(Zhangら、2022c)。我々の以前の研究では、METHが腸内細菌叢を擾乱し、糞便および血清のメタボロームを再構築する可能性があることが示された(Chenら、2021;Zhangら、2022a)。しかし、現在の知見では、腸内細菌叢が雄マウスのMETH誘発生殖毒性に寄与しているかどうかは明らかにされていない。
そこで我々は、METH誘発性腸内細菌異常症が雄マウスの生殖機能に及ぼす影響を解明することを目的とした実験を行った。我々の目的は、雄マウスの生殖器官に対するMETHの影響を評価し、生殖機能に対する腸内細菌叢の変化と関連した病態生理学的反響の可能性とメカニズムを調べることであった。
材料と方法
2.1. 動物および試薬
8週齢から10週齢の雄性BALB/cマウス40匹を中国広州市の南方医科大学実験動物センターから入手した。すべてのマウスは特定病原体フリー(SPF)条件下で飼育された。南方医科大学実験動物倫理委員会(Southern Medical University Experimental Animal Ethics Committee)は、本研究の倫理承認を与えた(コード:SMUL2021029)。本研究で使用した試薬を補足表S1に示す。
2.2. METH投与
ヒトのMETH乱用の消費パターンをシミュレートし、低用量から開始し、徐々に高用量に増加させる、以前に記載されたように(Chenら、2021、Liuら、2023)、漸増用量-複数回乱用METH投与モデルを採用した。SPF環境に1週間適応させた後、20匹のマウスを無作為に2群(生理食塩水群とMETH群)に分けた。各群4匹ずつを腸管透過性評価専用マウスとした。生理食塩水またはMETHを腹腔内注射で8日間投与した。METHは最初の6日間、1日1回、体重1kgあたりそれぞれ1.5、1.5、4.5、4.5、7.5、7.5mgを投与した。次の2日間は、METHを1日4回、毎回10 mg/kgの用量で投与した(図1A)。9日目にマウスを犠牲にし、精巣上体を解剖して精子を採取した。マウスの糞便は、マウスを無菌ケージに入れて採取し、液体窒素で急速凍結した後、-80℃で採便管に保存した。マウスは1%ペントバルビタールナトリウム(100 mg/kg)で腹腔内注射して深く麻酔し、頸椎脱臼により安楽死させた。精巣組織と大腸組織、および糞便を採取し、将来の解析のために、固定液中で保存するか、液体窒素中で瞬間凍結(-80℃で長期保存)した。
図1
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図1. METH曝露によるマウスの精子質低下、精巣障害、血清ホルモン異常。(A)実験手順の模式図。Figdrawによる。(B)生理食塩水群とMETH群の体重変化。(C)生理食塩水群とMETH群の精巣重量(g)。(D-F)生理食塩水群とMETH群の総精子数、精子運動率、正常精子比率の比較。(G)生理食塩水群の正常精子と、METH群の大きな頭部、細胞質液滴、二重尾を有する異常精子を示す高倍率画像。スケールバー=20μm。各群n=6マウス。(H) HE染色後の精巣組織像。スケールバー=100μm。(I) 1スライドにつき5フィールドにおける精巣精細管の厚さの分析。(J-N) ELISAを用いて測定したLH、FSH、T、DHTおよびE2の血清レベル。
2.3. 抗生物質治療と糞便微生物叢移植(FMT)
抗生物質治療とFMTは、先に述べたように行った(Liら、2023、Zhangら、2023b)。簡単に説明すると、20匹のマウスを無作為に2群(FMT-SとFMT-M)に分けた。腸内細菌叢を枯渇させるため、バンコマイシン(100mg/kg)、硫酸ネオマイシン(200mg/kg)、メトロニダゾール(200mg/kg)、アンピシリン(200mg/kg)からなる抗生物質混合物を1日1回、7日間経口投与した。生理食塩水群およびMETH群の糞便を採取し、0.1 gの糞便を1 mLのリン酸緩衝生理食塩水緩衝液(PBS)で希釈して糞便上清を調製した。これらの上清を微生物叢欠失マウスに1日1回7日間経口投与した(10 mL/kg体重)。すべてのマウスは、糞便採取または腸管透過性試験後に犠牲にし、サンプル採取手順は上記と同じであった。
2.4. 精子数、運動率、形態の測定
精子を放出させるため、両側精巣上体尾部を1mLのPBS(pH7.2)中で小片にスライスし、その後37℃で5分間インキュベートした(Dingら、2020)。総精子数(百万/mL)はノイバウアー血球計数管を用いて測定した。精子の運動性は、進行性運動性(PR)、非進行性運動性(NP)、および不動性(IM)に分類した。PRおよびNPを有する精子を運動精子とみなした(Blomberg Jensenら、2021;Varaら、2021)。精子運動率は、計数された全精子中の運動性精子(PRおよびNPを含む)の割合として表され、1サンプルあたり200精子の検査に基づいて算出された。精子塗抹標本をエオシンで染色した後、精子の形態を400倍の倍率で観察し、正常な形の精子の割合を算出した。精子数、運動率、形態計測の盲検分析は、専門の実験者が行った。
2.5. 腸管透過性の評価
フルオレセインイソチオシアネート-デキストラントレーサー(4 kDa、FD4)を用いて、既述のように腸管透過性を評価した(Wangら、2022a)。各群4匹のマウスを絶食させ、10時間絶水させてから犠牲にした。犠牲の4時間前にFD4(0.6mg/g)を経口投与した。採血後、遠心分離して血清を分離し、その血清を同量のPBSと混合した。蛍光強度は、励起波長485 nm、発光波長535 nmのマルチモードマイクロプレートリーダー(BioTek、USA)で測定した。PBSで連続希釈したFD4の標準曲線を用いて、血清中のFD4レベルを算出した。
2.6. 病理組織学的分析
精巣組織は、包埋前に修正ダビッドソン液で24時間固定した。我々の確立したプロトコール(Yangら、2023)に従い、5μmのパラフィン切片を作製し、ヘマトキシリン・エオジン(H&E)で染色した。この染色は、特に間質細胞と精原細胞の形態と数に注目し、精細管の形態を評価するために用いた。各群の4生物学的複製から無作為に20個の精細管を選び、側底膜から内腔までの距離を測定して定量分析を行った。
並行して、結腸組織を10%ホルマリンで24時間固定し、その後パラフィン包埋して5μmスライスに切片化した。大腸杯細胞をAB-PAS染色キット(CAS# DG0007, Leagene Biotechnology, China)を用いて染色し、腸管粘液バリアを評価した。各群4検体から12視野を解析し、絨毛の長さを測定し、陰窩の杯細胞を数えた。さらに、タイトジャンクションタンパク質ZO1とOccludinの免疫組織化学染色を行い、腸のメカニカルバリアの完全性を評価した(Liuら、2022)。使用した抗体とその希釈倍率は補足表S3に示した。各群について、3スライスから15視野を解析し、平均光学濃度(AOD)を測定・算出した。すべての画像は、Nikon DS-Fi3カラーカメラ(Nikon、日本)を搭載したNikon顕微鏡を用いて撮影し、結果はImageJソフトウェア(National Institutes of Health、米国)を用いて定量化した。
2.7. TUNEL染色
パラフィン包埋精巣切片のTUNELアッセイは、TUNEL検出キット(YEASEN, Shanghai, China)に付属の説明書に従って、以前に記載されたように行った(Liuら、2023)。画像はOlympus DP80蛍光顕微鏡で撮影した(倍率200倍)。アポトーシス核の定量化には、各切片から代表的な5視野以上のTUNEL陽性細胞を数えた。
2.8. 酵素結合免疫吸着測定法(ELISA)
ELISA は、製造業者の説明書(Jiangsu Meibiao Biotechnology Co.) 血清ホルモン検査には、マウス黄体形成ホルモン(LH)、卵胞刺激ホルモン(FSH)、テストステロン(T)、ジヒドロテストステロン(DHT)、エストラジオール(E2)ELISAキットを用いた。血清エンドトキシン濃度の検出には、マウスリポポリサッカライド(LPS)ELISAキットを用いた。血清および精巣上体の酸化ストレスレベルを検出するために、マウスマロンジアルデヒド(MDA)および活性酸素種(ROS)キットを採用した。精巣上体抗酸化酵素系の検出には、マウススーパーオキシドジスムターゼ(SOD)、カタラーゼ(CAT)、グルタチオン(GSH)キットを用いた。キットのカタログ番号情報を補足表 S2 に示す。光学濃度(OD)は、マルチモードマイクロプレートリーダー(BioTek, USA)を用いて450nmで測定し、サンプル濃度を算出した。
2.9. 16S rRNAの塩基配列決定と解析
E.Z.N.A®を使用して、糞便サンプルから微生物DNAを単離した。Mag-Bind® Stool DNA Kit (M4015, Omega Bio-Tek, USA)を使用した。抽出したDNAの完全性と濃度を1.0%アガロースゲル電気泳動で確認し、Nanodrop 2000分光光度計(Thermo Scientific, USA)を用いて定量した。ABI GeneAmp® 9700 PCRサーモサイクラー(ABI、米国)を用いて、プライマー338 F(5′-ACTCCTACGGGAGGCAGCAG-3′)および806 R(5′-GGACTACHVGGTWTCTAAT-3′)を用いて細菌の16 S rRNAのV3-V4領域を増幅した。得られたアンプリコンを精製し、等モル比でプールし、標準プロトコールに従ってIllumina PE300/PE250プラットフォーム(Illumina、米国)でペアエンドシーケンスに供した。Majorbio Bio-Pharm Technology Co. Ltd. (Ltd.(中国、上海)がシーケンスプロセスを促進し、その後のバイオインフォマティクス解析にはMajorbio Cloud(https://cloud.majorbio.com)を使用した。
2.10. トランスクリプトーム配列決定とデータ解析
精巣トランスクリプトーム配列決定は、我々の以前の方法(Li et al. 1.5倍以上の変化を示し(1.5倍以上または-1.5倍未満)、p値が0.05未満の遺伝子を有意差発現遺伝子(DEG)とみなした。その後、Gene Ontology (GO)機能濃縮およびKyoto Encyclopedia of Genes and Genomes (KEGG)パスウェイ解析を行い、トランスクリプトームバックグラウンド全体と比較して、GO用語およびKEGGパスウェイにおいて有意な過剰発現を示すDEGを同定した。この解析では、0.05 未満の p 値閾値(Bonferroni-corrected p value threshold)を採用した。
2.11. 非標的メタボローム解析
以前の研究(Zhang et al., 2023d)に記載されているように、約20 mgの精巣組織を凍結組織粉砕機を用いてホモジナイズした。ホモジネート(200 μL)を800 μLのメタノール:アセトニトリル(1:1、v/v)溶液と混合し、タンパク質を沈殿させた。遠心分離後、上清を回収し、凍結真空乾燥機を用いて蒸発乾固した。残渣を100μLのアセトニトリル:水(1:1、v/v)溶液に再溶解した。その後、サンプルを13000rpmで15分間遠心分離し、上清を超高速液体クロマトグラフィー-高分解能質量分析(UHPLC-HRMS)分析用のサンプルバイアルのライニングチューブに回収した。各サンプルの上清を合わせて品質管理(QC)サンプルを調製した。メタボロミクス分析は、島津Nexera X2システム(島津製作所、日本)とSCIEX X500R Triple TOF質量分析計(AB SCIEX、米国)を組み合わせて実施した。クロマトグラフィー分離は、40℃に保たれたC18カラム(HSS T3, 150 mm×2.1 mm, 3 μm, Waters, Guyancourt, France)を用いて行った。スキャン実験は、ポジティブおよびネガティブの両方のエレクトロスプレーイオン化(ESI)モードで実施した。代謝物のさらなるアノテーションは、MetDNA 2 (https://metdna.zhulab.cn) (Zhou et al., 2022) を用いて行った。さらに、偏最小二乗判別分析(PLS-DA)を利用して、サンプルの全体的な組成を特徴付けました。その後、投影における変数重要度(VIP)値、および相対発現レベル(VIP値>1、フォールド変化>2または<0.5、p値<0.05)を評価することにより、差分代謝物を同定した。さらに、代謝経路の解析は、MetaboAnalyst 5.0 (https://www.metaboanalyst.ca) (Pang et al., 2022)を利用して行った。
2.12. ウェスタンブロット解析
タンパク質抽出とウェスタンブロットの詳細は、我々の以前の研究(Zhang et al.) RIPAバッファー(1%PMSFおよび1%ホスファターゼ阻害剤を含む)を用いて、精巣組織から全タンパク質を単離した。タンパク質を10-15% SDSポリアクリルアミドゲル電気泳動で分離し、0.22μm PVDF膜(Millipore, USA)に転写した。膜は5%スキムミルクで2時間ブロックし、一次抗体とともに4℃で一晩インキュベートした。その後、膜をTBSTで洗浄し、適切な二次抗体と室温で2時間インキュベートした。PBSTで4回洗浄後、メンブレンをSuperKine™ West Femto Maximum Sensitivity Substrate(Abbkine、中国、BMU102-CN)でインキュベートし、ChemiDoc Touch Imaging system(Bio-Rad)で可視化した。ブロットのグレースケール定量はImage Jソフトウェアを用いて解析した。これらの実験に使用した抗体とそれぞれの希釈倍率を補足表S3に示す。
2.13. 統計解析
統計解析にはGraphPad Prism 8.0を用いた。両側スチューデントのt検定は、データセットが正規分布に従うと仮定して、2群間の格差を評価するために使用された。量的結果の表示には平均値±SEMを用いた。正規分布に従わないデータセットにはウィルコクソン検定を用いた。相関分析はスピアマンの方法で行った。統計的有意性は、p<0.05(*p<0.05、**p<0.01、***p<0.001)の値で判断し、p>0.05の値は有意ではない(ns)と判断した。
結果
3.1. METH曝露によるマウスの精子質低下、精巣障害、血清ホルモン異常の誘発
METH曝露の雄性生殖毒性を調べるため、我々はMETH乱用曝露の漸増用量を用いたモデルを確立した(図1A)。METH群のマウスは生理食塩水群と比較して、実験後半に体重の有意な減少を示した(図1B)。生理食塩水群とMETH群の精巣重量は同程度であった(図1C)。精子の質に関しては、精子数、運動率、形態の3つのパラメータが重要である。注目すべきは、METHを投与したマウスでは精子数が有意に減少し(図1D)、精子の運動性(図1Eおよび補足図S1A)、特にPRが減少したことである。精子の形態を解析したところ、METH群では形態学的に正常な精子の割合が低く(図1F)、精子の頭部、頸部、尾部に顕著な奇形が認められた(図1G)。大きな頭部、先体不在、細胞質液滴、尾部折れ、二重尾部、二重頭部など、精子の異常な特徴が観察された。これらの結果から、METH曝露はマウスの精子の質を低下させる。
雄の最も重要な生殖器官として、精巣の機能は精子とアンドロゲンの産生である。ヘマトキシリン・エオジン(H&E)染色により、METH群では生理食塩水群と比較して、精細管の厚みが有意に減少し、精細上皮の層が減少していることがさらに明らかになった(図1H、I)。METH群では、精原上皮の障害、空間の拡大、乱れ、精原核のピクノーシスが顕著であった(図1H)。生殖ホルモン濃度に対するMETH曝露の影響を調べるため、黄体形成ホルモン(LH)、卵胞刺激ホルモン(FSH)、テストステロン(T)、ジヒドロテストステロン(DHT)、エストラジオール(E2)の血清レベルを評価した。METH群では、LH(図1J)、FSH(図1K)、T(図1L)、DHT(図1M)のレベルが低下し、E2(図1N)のレベルが上昇した。さらに、METH群は生理食塩水群よりも精巣アンドロゲン受容体タンパク質の発現レベルが低かった(補足図S1B)。これらの所見は、METHが精巣の精細上皮と視床下部下垂体精巣軸を損傷し、それによって精巣での精子形成を損なう可能性があることを示唆している。
3.2. METH曝露はマウスの精巣トランスクリプトームを変化させ、アポトーシスとPI3K/Aktシグナル伝達経路を活性化した
精巣傷害のメカニズムを調べるため、生理食塩水群とMETH群から精巣サンプル6個を採取し、トランスクリプトームシークエンシングを行った。RNA-Seqデータに対して主成分分析(PCA)を行ったところ、グループ間で明瞭な分離が見られた(図2A)。P値<0.05、fold change≧1.5をスクリーニング基準として、537の発現差のある遺伝子(DEG)を同定した。METHグループは生理食塩水グループと比較して、235遺伝子の有意な発現増加と302遺伝子の有意な発現減少を示した(図2Bおよび補足図S1C)。
図2
ダウンロード 高解像度画像ダウンロード(795KB)
ダウンロード フルサイズ画像のダウンロード
図2. METH曝露はマウスの精巣トランスクリプトームを変化させ、アポトーシスとPI3K/Aktシグナル伝達経路を活性化した。(A)RNA-seqのPCA解析。(B)DEGのボルケーノプロット。赤は遺伝子発現のアップレギュレーション、緑はダウンレギュレーションを示す。(C) GO濃縮解析(BP)の折れ線付き棒グラフ。 (D) KEGGパスウェイ濃縮解析のバブルプロット(上位25の濃縮KEGGパスウェイ)。(E)TUNEL染色後のマウス精巣における造精細胞アポトーシスの代表画像。スケールバー=50μm。(F) 視野あたりのアポトーシス陽性細胞/核の数(200倍)。(G)マウス精巣におけるPI3K、p-PI3K、AKT、p-AKT、BAXおよびBCL2タンパク質の発現を示すウェスタンブロット。GAPDHをローディングコントロールとして用いた。(H-J)p-PI3K/PI3K、p-AKT/AKT、BAX/BCL2比の定量データ。
さらにメカニズムを調べるため、Gene Ontology(GO)とKyoto Encyclopedia of Genes and Genomes(KEGG)の濃縮解析を行った。GO生物学的過程(BP)カテゴリーで濃縮された用語は、同定されたDEGが生殖過程、生殖細胞発生、細胞周期に密接に関連していることを示した(図2C)。細胞質、核小胞、シナプトネマ複合体を含むGO細胞成分(CC)カテゴリーで濃縮された用語は、減数生殖過程と強く関連していた(補足図S1D)。さらに、分子機能(MF)カテゴリーで最も濃縮された用語は、ヒストン結合、修飾依存性タンパク質結合、メチル化依存性タンパク質結合、メチル化ヒストン結合であった(補足図S1E)。有意に濃縮された上位25のKEGGパスウェイは、レチノール代謝、薬物代謝-チトクロームP450、化学発がん、コレステロール代謝、およびPI3K-Aktシグナル伝達経路を含むバブルプロットで示されている(図2D)。
PI3K-Akt経路は、細胞のアポトーシスと細胞周期の制御において重要な役割を果たすことが知られている(Liuら、2019;Zhangら、2022b)。そこで、TUNEL染色を用いて、METH曝露が精巣の細胞アポトーシスをもたらしたかどうかを評価した。TUNEL染色によるアポトーシス細胞の定量化(緑色)により、METH投与マウスの精巣ではアポトーシス細胞数が有意に増加しており(図2E、F)、アポトーシス細胞の種類は精原細胞であった。さらに、精巣におけるPI3K、p-PI3K、AKT、p-AKT、BAX、BCL2の発現レベルを評価した。その結果、p-PI3K/PI3K比およびp-AKT/AKT比は生理食塩水群と比較してMETH群で有意に低下していたのに対し、BAX/BCL2比はMETH群で有意に高かった(図2G-J)。これらの結果から、METH曝露はPI3K-AKT経路を制御することによって精巣細胞のアポトーシスに影響を及ぼすと推察される。
3.3. METH曝露はマウスの腸内細菌叢のアンバランスを引き起こした
METHが雄マウスの腸内細菌叢組成に及ぼす影響を調べるため、16 S rRNA塩基配列決定を利用して細菌の存在量と群集組成を評価した。シャノン指数(図3A)とシンプソン指数(図3B)で示されるように、微生物群集の豊かさと均等性に群間で著しい格差が観察された。これらの所見は、METH曝露後の微生物α多様性の減少を示唆している。主座標分析(PCoA)を用いて調べたβ多様性は、生理食塩水群とMETH群の間で明瞭な分離を示し(図3C)、腸内細菌叢に対するMETHの影響をさらに立証した。METH曝露後の特定の細菌群の変化を特定するために、門および属レベルで群集組成を精査した(図3D、E、および補足図S2A-D)。属の分類学的レベルでは、METHグループは生理食塩水グループと比較して、Lachnospiraceae_NK4A136_groupが有意に多いことを示した(図3F)。METH曝露に関連する微生物叢を識別するために、門レベルから属レベルまで線形判別分析(LDA)を行った。図3Gに示すように、異なるグループには35種類の微生物が存在し、LDAスコアはすべて3.5を超えていた。また、腸内細菌叢の属と精子の質パラメーター(精子数、運動率、形態)との相関、および腸内細菌叢の属とホルモンレベル(LH、FSH、T、DHT、E2)との相関も分析した(図3H)。Lachnospiraceae_NK4A136_group、norank_f_Muribaculaceaeなどの属と生殖関連パラメータとの間に有意な相関関係があることが示された。これらの結果を総合すると、METHは腸内細菌叢の破壊を誘発し、この摂動はその後、雄の生殖機能を損なう可能性があることが示唆される。
図3
ダウンロード 高解像度画像ダウンロード(923KB)
ダウンロード フルサイズ画像のダウンロード
図3. METH曝露はマウスの腸内細菌叢の不均衡を引き起こした。(A)シャノン指数。(B)シンプソン指数。(C)β多様性のPCoA。(D)Lachnospiraceae_NK4A136_groupの相対存在量。(E) 門レベルの群集バープロット分析。(F) 属レベルでの群集バープロット解析。(G) LDAスコア。緑は生理食塩水グループ、赤はMETHグループ。LDAスコアが3.5以上のクラスターのみ表示。LDAスコアが高いほど、種の多さが差効果に与える影響が大きい。(H) 生殖関連指標と腸内細菌叢の存在量上位30属とのスピアマン相関ヒートマップ。
3.4. METH曝露はマウスの腸管バリア損傷と透過性亢進を引き起こした
METHが腸管透過性に及ぼす影響を評価するため、投与4時間後にフルオレセインイソチオシアネート-デキストラントレーサー(FD4)の血清濃度を測定した。METHを投与したマウスの血清中では、生理食塩水投与群と比べてFD4濃度の顕著な上昇が観察され、バリアの透過性が増大したことが示された(補足図S2E)。さらに、METHを投与したマウスは血清リポ多糖(LPS)濃度の有意な上昇を示した(補足図S2F)。AB-PAS染色を用いて病理組織学的変化を評価した。METH投与群ではコントロールマウスと比較して、結腸粘膜の萎縮と杯細胞数の減少が観察された(補足図S2G-I)。タイトジャンクションタンパク質(ZO-1とOccludin)の発現を測定する免疫組織化学的アッセイでは、生理食塩水投与群では陰窩と上皮表層膜の周囲にZO-1とOccludinが一様に発現していた。対照的に、METH曝露ではこれらのタイトジャンクションタンパク質の発現が減少し(補足図S2J-L)、結腸バリアの完全性が損なわれていることが示唆された。これらの所見から、METH曝露は腸管粘液および機械的バリアを破壊し、腸管透過性を亢進させ、細菌性内毒素の循環系への移行を促進することが示唆される。
3.5. METH曝露は精巣の代謝発現プロファイルを変化させた
代謝の変化を示唆するトランスクリプトミクスの証拠が得られたことから、化合物のイオン化にポジティブイオンモードとネガティブイオンモードの両方を用いて、精巣のアンターゲットメタボローム解析を開始した。MetaboAnalystを利用して部分最小二乗判別分析(PLS-DA)を実施し、異なるグループ間の代謝シフトを可視化した。どちらのモードでも、PLS-DAによりグループ内凝集とグループ間分離の傾向が示された(図4A、B)。VIP>1、p<0.05の基準を用いて、グループ間で有意に異なる代謝物(SDM)を同定した。データの前処理と代謝物の同定に続いて、正イオン化モードと負イオン化モードの両方で取得した生データから34のSDMを同定しました。これらのSDMをクラスタ化したヒートマップで示した(図4C)。34のSDMのKEGG濃縮パスウェイ解析により、アスコルビン酸とアルダラート代謝、フェニルアラニン、チロシン、トリプトファン生合成、リボフラビン代謝、不飽和脂肪酸の生合成、アミノアシルtRNA生合成、フェニルアラニン代謝、ペントースとグルクロン酸の相互変換を含む、7つのシグナル伝達経路が有意に濃縮された(図4D)。同定されたSDMと雄マウスの生殖表現型との関係をさらに理解するために、スピアマン相関解析を行った(図4E)。その結果、観察された精子の質の低下、性ホルモンの不均衡、および同定された精巣代謝異常の間に強い関連があることが示唆された。
図4
ダウンロード 高解像度画像のダウンロード(934KB)
ダウンロード フルサイズ画像のダウンロード
図4. METH曝露は精巣の代謝発現プロファイルを変化させた。(A)プラスイオンモードのPLS-DAスコアプロット。(B)マイナスイオンモードのPLS-DAスコアプロット。(C)発現量の異なる代謝物のクラスターヒートマップ。(D) KEGGパスウェイ濃縮解析のバブルプロット。(E)生殖関連指標とSDMの関係を表したスピアマン相関ヒートマップ。赤は正の相関、青は負の相関を示す。
3.6. METH曝露による酸化ストレス
精子形成が起こると、精子は精巣上体管を通って精巣上体に移動し、そこで成熟する。精子の成熟と貯蔵には、精巣上体の環境が極めて重要であることは否定できない。本研究では、血清または精巣上体組織中のMDA、ROS、SOD、CAT、GSHの含量をELISA法で検出し、酸化ストレスを評価した。METH群のMDAおよびROS含量は、血清および精巣上体ともに生理食塩水群よりも高く(補足図3A-D)、METH曝露マウスでは酸化ストレスが亢進していることが示された。酸化ストレス傷害からの保護に関与する主な細胞内抗酸化酵素として、SODとCATは上昇傾向を示したが、両群間に有意差はなかった(補足図3E, F)。抗酸化物質として、GSHは生理食塩水群よりMETH群で有意に低かった(補足図3G)。これらの結果から、METHは精巣上体の酸化ストレスを上昇させることが示唆された。
3.7. METH曝露マウスの腸内細菌叢は、レシピエントマウスにおいて精子の質の低下、精巣障害、血清ホルモン障害をもたらした
METH誘発雄性生殖毒性における腸内細菌叢の役割を探るため、糞便微生物叢移植(FMT)実験を行った。生理食塩水群またはMETH群の腸内細菌叢を、抗生物質カクテルを用いてあらかじめ腸内細菌叢を除去したレシピエントマウスに移植した(図5A)。2群のマウスの体重は同じであったが、FMT-M群のマウスは、試験終了時にはFMT-S群のマウスよりも有意に低い体重を示した(図5B)。興味深いことに、FMT-Mマウスでは精巣重量(図5C)、総精子数(図5D)、精子運動率(図5E)の顕著な低下が観察された。精子の進行性運動性はより影響を受けた(補足図S3H)。これは、正常な形態を示す精子の割合の著しい減少を伴っていた(図5F、G)。大きな頭部、先体不在、細胞質液滴、尾部折れ、二重尾部、二重頭部などの精子の異常な特徴が観察された。精巣断面をH&Eで染色したところ、FMT-M群マウスの精細管は、構造が乱れ、厚みが著しく減少するなど、形態学的損傷の徴候が認められた(図5H、I)。さらに、FMT-M群では精母細胞の核のピクノーシスが観察された。クロマチン凝集に起因する核クロマチンの暗青色は、細胞アポトーシスの重要な特徴である(図5H)。FMT-C群と比較すると、FMT-M群はLH(図5J)、T(図5L)、DHT(図5M)の血清中濃度が顕著に低かった。一方、E2値(図5N)は有意に上昇したが、FSH値(図5K)は有意差を示さなかった。これらの所見は、METH曝露によって観察された生殖ホルモンの異常と概ね一致している。これらの結果は、METH処理マウスの腸内細菌叢がホメオスタシスを破壊し、ホルモンバランスの乱れ、精子形成細胞の損傷、レシピエントマウスにおける精子の質の低下につながることを示している。
図5
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図5. METH曝露マウスの腸内細菌叢は、レシピエントマウスにおいて精子の質の低下、精巣の損傷、血清ホルモンの乱れをもたらした。(A)実験手順の模式図。Figdrawによる。(B)FMT-S群とFMT-M群の体重変化。(C)FMT-S群とFMT-M群の精巣重量。(D-F)FMT-S群とFMT-M群の総精子数、精子運動率、正常精子比率の比較。(G)FMT-S群の正常精子、FMT-M群の大きな頭部、先体不在、細胞質液滴、尾折れを有する異常精子を示す高倍率画像。スケールバー=20μm。各群n=6マウス。(H)HE染色後の精巣組織像。スケールバー=100μm。(I) 1スライドにつき5フィールドにおける精巣精細管の厚さの分析。(J-N)ELISAを用いて測定したLH、FSH、T、DHTおよびE2の血清レベル。
3.8. METH曝露マウスの腸内細菌叢は腸管バリアの損傷をもたらした
次に、採取した糞便の16 S RNAシークエンシングを行い、腸内細菌叢の組成を分析した。シャノン多様性指標(図6A)とシンプソン多様性指標(図6B)を用いて、2群間の腸内細菌叢のα多様性を調べたが、統計的に有意な差は見られなかった。しかし、PCoA分析によって、FMT-S群とFMT-M群の間に明確な分離が観察された(図6C)。分類学的解析により、門レベルと属レベルの両方で細菌群集組成が明らかになり、詳細な結果が図7D-Gに示された。優勢な細菌門はファーミキューテス(Firmicutes)とバクテロイデーテス(Bacteroidetes)であり(図6D、E)、属レベルではnorank_f_MuribaculaceaeとLachnospiraceae_NK4A136_groupが優勢であった(図6F、G)。これらの所見から、FMTレシピエントマウスの腸内細菌叢組成はドナーマウスのそれを忠実に反映していることが示された。腸粘膜バリアーの完全性は粘膜の恒常性維持に極めて重要であることから、次に腸内細菌叢の乱れが腸バリアーの低下につながるかどうかを評価した。FMT後の各群の結腸を形態学的に観察したところ、FMT-S群マウスでは健康な結腸が観察されたのに対し、FMT-M群マウスでは杯細胞の減少と粘膜萎縮が観察された(図6H-J)。重要なことに、FMT-M群では血清中のFD4(図6K)およびLPS(図6L)濃度が高く、腸管透過性の亢進と密接に関連する指標が検出された。この結果は、腸管バリアの機能不全と腸内細菌叢の乱れとの関連を示唆している。腸管バリアの損傷は、さらに細菌や内毒素の移行につながる可能性がある。
図6
ダウンロード 高解像度画像ダウンロード(1009KB)
ダウンロード フルサイズ画像のダウンロード
図6. METH曝露マウスの腸内細菌叢は腸管バリア障害をもたらした。(A)シャノン指数。(B)シンプソン指数。(C)β多様性のPCoA分析。(D, E)FMT-S群とFMT-M群の門レベルでの群集分析円グラフ。(F, G) FMT-S群とFMT-M群の属レベルでの群集分析パイプロット。(H)AB-PAS染色した大腸組織の代表的な画像。スケールバー=100μm。(I)大腸粘膜の絨毛長(μm)。各スライドについて3つの切片をカウントした。(J) 大腸陰窩あたりのAB-PAS陽性杯細胞の定量。各スライドにつき3つの陰窩をカウントした。(K) 血清中のFD4濃度の測定。(L)FMT-S群とFMT-M群の血清中LPS濃度。
図7
ダウンロード 高解像度画像ダウンロード(790KB)
ダウンロード フルサイズ画像のダウンロード
図7. METH曝露マウスの腸内細菌叢は精巣アポトーシスと精巣上体酸化ストレスを活性化した。(A)TUNEL染色後のマウスの精巣における造精細胞アポトーシスの代表画像。スケールバー=50μm。(B) 視野あたりのアポトーシス陽性細胞/核の数(倍率200倍)。(C)マウス精巣におけるPI3K、p-PI3K、AKT、p-AKT、BAXおよびBCL2タンパク質の発現を示すウェスタンブロット。GAPDHをローディングコントロールとして用いた。(D-F)p-PI3K/PI3K、p-AKT/AKTおよびBAX/BCL2の定量データ。(G, H) 血清中のマロンジアルデヒド(MDA)および活性酸素種(ROS)レベル。 (I, J) 精巣上体組織中のMDAおよびROSレベル。(K-M)FMT-S群およびFMT-M群の精巣上体組織におけるスーパーオキシドジスムターゼ(SOD)、カタラーゼ(CAT)およびグルタチオン(GSH)レベル;各群n = 6マウス。
3.9. METH曝露マウスの腸内細菌叢は精巣アポトーシスと精巣上体酸化ストレスを活性化した
組織切片のTUNEL染色(緑色)により、FMT-M群マウスの精巣ではTUNEL陽性が有意に増加し(図7A、B)、アポトーシス細胞型は精原細胞であった。その結果、PI3K-Akt経路の制御に対するMETH処理マウスの糞便微生物叢の影響を確認するために、ウェスタンブロッティングを用いて主要タンパク質の発現レベルを測定した。図7C-Eに示すように、FMT-MはPI3KとAKTのリン酸化レベルを有意に低下させた。同時に、FMT-Mはプロアポトーシスタンパク質Baxのレベルを増加させ、抗アポトーシスメンバーBCL2のタンパク質レベルを減少させ、Bax/BCL2比を増加させた(図7D、F)。これらの所見を総合すると、METH投与マウスの糞便微生物叢は、PI3K-Akt経路を調節することにより、細胞のアポトーシスを誘導し、精巣機能を障害することが示唆される。
さらに、FMT後の2群のマウスの血清および精巣上体における酸化ストレスレベルを検出した。その結果、FMT-M群はFMT-S群に比べて血清および精巣上体組織のMDAおよび活性酸素レベルが高かった(図7G-J)。SODおよびCATレベルの増加は統計学的に有意ではなかった(図7K、L)。さらに、FMT-S群と比較して、FMT-M群では精巣上体組織のGSH含量が有意に低かった(図7M)。このことから、METHによる腸内細菌叢異常は、全身および精巣上体において酸化ストレスを誘発し、これが精巣上体に貯蔵される精子の質を低下させる重要な原因である可能性が示された。
考察
本研究では、メタンフェタミン(METH)乱用投与量を漸増させたモデルマウスを用いた。研究の結果、METHへの曝露はマウスの精子の質と精巣機能の両方に悪影響を及ぼすことが示された。さらに、METHは腸内細菌叢に変化をもたらし、腸管バリアの完全性を損なった。糞便微生物叢移植(FMT)法を用いることで、METHに暴露されたマウスの腸内微生物叢が腸管バリアの完全性を損なうことを発見した。この機能不全は、細菌の内毒素と代謝産物の血液中への移行を助け、PI3K-ACT経路を通じて精子形成細胞のアポトーシスを引き起こした(図9)。本研究は、METHによる腸内細菌叢の異常と男性生殖機能の低下との相関関係について、新たな展望を提供するものである。さらに、今回の知見は、METHによる生殖毒性の基本的メカニズムに関する今後の研究に大きな展望を与えるものである。
男性の生殖機能の健康は主に精巣に依存しており、精巣は精子の生産とテストステロンの分泌を担っている。生存可能で健康な精子の発達に不可欠なステップは、精巣上体の成熟である。我々の知見は、METHが精子の運動性、形態、濃度に影響を与えることにより、精子の質に有害な影響を与えることを示している。これらの変化は、METHが誘発する精巣上体における酸化ストレスと関連している可能性がある。酸化ストレスは精子の運動性を低下させ、DNA、タンパク質酸化、脂質過酸化のレベルを上昇させることにより、精子の質を低下させる可能性がある(Aitkenら、1998;Kaltsas、2023;Storey、1997)。加えて、METH暴露は精子を産生する尿細管の萎縮と精細上皮の菲薄化をもたらした。これは、精巣組織内の精原細胞のDNA損傷誘発性アポトーシスの増加を伴い、精子形成を損なった。精巣のこれまでの形態学的研究は、ラットの精母細胞、精原細胞、および精子形成に対するMETHの悪影響を示しており、今回の知見を裏付けている(Saberi et al.) 我々はまた、E2の上昇とLH、FSH、T、DHTの減少を特徴とする血清生殖ホルモンレベルの変化を観察した。男性では、Tは規則正しい精子形成と生殖管機能の維持に重要であり、FSHとLHは精子の成熟とアンドロゲン産生に寄与する。テストステロンの減少は、ライディッヒ細胞の死、視床下部-下垂体軸の調節、ステロイド生成酵素またはその活性のmRNAと関連している(Jordanら、2003;Sharmaら、2022;Xieら、2022;Zirkin and Papadopoulos、2018)。LHとDHTの減少、E2の増加など、観察されたホルモンレベルの変化は、METHそのものによる直接的なものではなく、むしろ腸内細菌叢への影響によるものである可能性がある。具体的には、METH暴露は腸内細菌叢の組成を変化させ、酪酸、内毒素、活性酸素、炎症性サイトカインの産生を増加させる(Basovaら、2022、Laiら、2022)。これらの物質は、視床下部-下垂体-性腺軸に影響を与え、ホルモンの産生と調節を変化させる可能性がある(Shenら、2022)。例えば、酪酸はゴナドトロピン放出ホルモンの分泌に影響を与え(Chen et al., 2008)、LHとFSHレベルに影響を与えることが示されている。同様に、エンドトキシンレベルの上昇は、ライディッヒ細胞機能を抑制するサイトカインの放出を刺激し、DHT産生を減少させ、テストステロンをエストラジオールに変換するアロマターゼ活性を増加させ、E2レベルを上昇させる可能性がある(Li et al., 2024, Wang et al., 2020)。これらのホルモンの調節因子が乱れると、生殖細胞のアポトーシスが始まる(Sofikitisら、2008年)。まとめると、われわれの研究は、精子の質、精巣の形態、ホルモンバランスに焦点を当て、METHによる男性の生殖毒性を評価したものである。
腸内細菌叢と生殖の健康との関連を支持する証拠が増えている(Martinotら、2022;Wangら、2022b;Wang and Xie、2022)。我々の研究では、腸内細菌叢の多様性と組成はMETHへの曝露によって有意な影響を受けた。METH群ではnorank_f_MuribaculaceaeとBacteroidesの存在量が減少していることが観察され、これらはいずれも精子の質やアンドロゲンレベルと正の相関関係があった。これまでの研究で、ノランクフ_ムリバク科植物が抗炎症作用を持ち、病原性細菌を抑制し、腸粘膜組織における酸化ストレスを緩和することが実証されている(Xie et al.) バクテロイデスはプロバイオティクス効果と関連しており、宿主の健康を促進する役割を果たすと考えられている(Wangら、2021)。我々の研究から、METHに暴露されると、ファーミキューテス属の優占種であるLachnospiraceae_NK4A136_groupの相対量が増加する可能性があることが明らかになった。注目すべきことに、慢性アルコール摂取モデルにおいて、精子運動性の低下とLachnospiraceae_NK4A136_groupの存在量との間に有意な相関関係が観察された(Li et al.、2022)。新たな証拠は、アンドロゲンが腸内細菌叢を有意に変化させ(Haradaら、2016)、相互に、腸内細菌叢がアンドロゲン産生と代謝を制御することも示唆している(Colldénら、2019)。研究者らは、腸内細菌叢がアンドロゲンの代謝に重要な役割を果たしていることを発見した。具体的には、正常な腸内細菌叢組成を有するマウスと比較して、無菌マウスは遠位腸において高レベルのTおよびDHTを示すが、遊離DHTのレベルは非常に低い(Colldén et al.) テストステロンの強力な代謝産物として知られるDHTは、5αリダクターゼ1型という酵素によってテストステロンから変換される(Swerdloffら、2017)。この相互作用は、腸内細菌叢がホルモン代謝への影響を通じてアンドロゲンレベルに影響を及ぼし、アンドロゲンの生物学的利用能に影響を及ぼす可能性があることを示唆している。我々は、METH曝露マウスにおいて、腸管透過性と血清LPS濃度の上昇を観察したが、これは腸管粘膜および機械的バリアの悪化と一致していた。エンドトキシンの上昇は、全身性の炎症反応を引き起こす可能性があり、これには活性酸素の産生が伴う(Sebai et al.) これらの活性酸素は精巣環境において酸化ストレスを引き起こし、特に精母細胞に影響を及ぼす(Pengら、2023;Zhangら、2023c)。酸化ストレスは精母細胞の細胞構造を損傷し、精子形成障害につながることが知られている。さらに、炎症環境は、精巣のアンドロゲン産生を担うライディッヒ細胞(Inoue et al. その結果、精巣のアンドロゲンが減少する。われわれが知る限り、METHによる腸内細菌の破壊と男性の生殖能力の低下との機能的関連性を探ったのは、この研究が初めてである。
本研究のトランスクリプトーム解析により、METH曝露が生殖プロセス、生殖細胞の発達、細胞周期に関与する遺伝子の発現を撹乱することが明らかになった。生理食塩水群とMETH群のDEGsのうち、KEGGパスウェイ濃縮解析では、PI3K-Akt経路が有意に濃縮されていた。PI3K-Akt経路は、細胞の成長と増殖の促進に基本的に関与している。Aktが活性化されると、細胞の生存、細胞周期の進行、細胞増殖制御に関連する多数の基質の活性を制御する。しかしながら、PI3K-Akt経路の抑制はアポトーシスを誘発する可能性がある(Fresno Varaら、2004)。具体的には、PI3KまたはAktの阻害は、生存を促進する下流の標的のリン酸化を減少させ、アポトーシス過程の進行を可能にする。例えば、阻害はBaxのようなアポトーシス促進因子の活性化とBcl-2のような抗アポトーシス因子の不活性化をもたらす。PI3K/AktカスケードとMAPKカスケードの総合的な活性は、それぞれのリガンドによるBcl-2ファミリータンパク質の調節とともに、一般に細胞の生存に寄与している(Rondaら、2010、Vasconsueloら、2008)。しかし、PI3K/Akt経路の阻害は、これらの生存シグナルの減少につながり、アポトーシスを促進する(Dengら、2021年、Fresno Varaら、2004年)。我々の知見によると、METHはPI3KとAktのリン酸化を抑制し、アポトーシス促進タンパク質Baxのレベルを上昇させ、抗アポトーシスメンバーBCL2のタンパク質レベルを低下させた。
精巣のメタボロミクス分析により、METH群と生理食塩水群の間で代謝物の明確な変化が明らかになった。生殖表現型データと非標的メタボロミクスデータの相関を解析した結果、代謝産物の変化が精子の質に大きな影響を与えることが明らかになった。ホルモンの変化は精巣代謝の恒常性に相乗的に寄与している可能性がある。注目すべきは、明瞭に変化した代謝産物の大半が脂質とアミノ酸であり、METH群ではリボフラビン代謝経路の濃縮度が有意に低下していたことである。リボフラビンの代謝の障害は、エネルギー代謝のプロセスを阻害し、男性不妊につながる可能性があることが報告されている(Kuangら、2021)。この結果は、代謝に関連する異なる物質や経路が、マウスの精子の質の変動に関与している可能性を示している。しかし、この仮説を確認するためには、さらなる調査が必要である。
METHによる生殖毒性に対する微生物異常の影響の可能性をさらに検討するため、抗生物質投与マウスをレシピエントとしてFMT治療を行った。抗生物質を介した腸管枯渇プロトコールには限界があるが、費用対効果が高く、侵襲性の低い腸管浄化法であることに変わりはない(Amorimら、2022年)。我々の結果は、FMT処理によってレシピエントマウスの腸内細菌叢が再構築され、norank_f_MuribaculaceaeやLachnospiraceae_NK4A136_groupなどの優占細菌属が維持されていることを示した。その結果、METHに曝露されたマウスから得られた腸内細菌叢は、レシピエントマウスにおいて精子の質の低下、精巣障害、血清ホルモン障害を引き起こすことが観察された。同時に、METHに曝露されたマウスの腸内細菌叢は、腸管透過性と血清LPS濃度を上昇させた。動物モデルとヒトの研究の両方が、内毒素血症が精子の運動性低下をもたらすことを立証している(Caoら、2010、Collodelら、2015、Sahnounら、2017、Wangら、2019)。METH曝露マウスからのFMT後、レシピエントマウスの腸管バリアの完全性は損なわれ、細菌性エンドトキシンの全身拡散につながった。腸内細菌の移動は、精巣や精巣上体を含む遠隔組織にさらなるダメージを与えることが観察されている。この一連の現象は、PI3K-AKT経路を介して精子形成細胞のアポトーシスを誘発し、最終的には男性の生殖能力に有害な影響を及ぼす。我々の研究は、腸内細菌叢異常がMETH誘発性男性生殖毒性に関与している可能性を示唆している。
しかし、これは複雑な相互作用であり、我々の理解はまだ初期段階にあることを認識している。われわれが発見したMETH曝露マウスの腸内細菌叢と雄性生殖能への悪影響との関連については、さらなる検証が必要である。この研究はサンプル数が少なく、介入期間も短いので限界がある。我々の知見を確認し、その根底にあるメカニズムを理解するためには、より広範な研究が必要である。この最初の知見が、物質誘発性生殖健康問題における腸内細菌叢の役割に関するさらなる研究を促し、より効果的な予防・治療戦略の開発に役立つ可能性があることを期待している。
結論
我々の知見は、メタンフェタミン(METH)への曝露が男性の生殖の健康に悪影響を及ぼし、精子の質の低下や睾丸の機能低下をもたらす可能性があることを示唆している。さらに、腸内細菌叢の乱れがこれらの悪影響を媒介するようである。本研究は、METH乱用による生殖への悪影響の背後にあるメカニズムについて新たな展望を提供し、腸-精巣軸の研究にさらなる証拠を提供するものである。
研究助成
本研究は、中国国家自然科学基金会(82171877、82173474)および広東省基礎応用基礎研究基金会(2023A1515012476)の助成を受けた。
倫理声明
マウスを用いたすべての実験手順は、南医科大学実験動物倫理委員会(コード:SMUL2021029、日付:2021年3月12日)の承認を得ており、実験動物の飼育と使用の手引き(Guide for Care and Use of Laboratory Animals)に従っている。本研究は、現地の法律および施設要件に従って実施された。
CRediT著者貢献声明
Xiu-Wen Li:調査、データ管理。Jian-Zheng Yang: 可視化、データキュレーション。Clare Hsu:調査、データキュレーション。Xiao-Li Xie:監督、プロジェクト管理、資金獲得。王齊: ライティング-校閲・編集、リソース、資金獲得、構想。Jia-Li Liu: 原稿執筆、方法論、調査、形式分析。Long Chen: データキュレーション。Jia-Hao Zeng: データキュレーション。Jia-Hao Li: 可視化、形式分析。Kai-Kai Zhang: 可視化、形式分析。Li-Jian Chen: 原案執筆、方法論、調査、形式分析。Yi Liu: 検証、方法論。
利益相反宣言
著者らは、本論文で報告された研究に影響を及ぼすと思われる競合する金銭的利益や個人的関係はないことを宣言する。
謝辞
著者らは、言語校正サービスを提供してくれたHome for Researchers編集チーム(www.home-for-researchers.com)に感謝する。
付録A. 補足資料
すべての補足資料をダウンロードする
これは何ですか?
サムネイル
ダウンロード: 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード(239KB)
補足資料
サムネイル
ダウンロード 高解像度画像ダウンロード(3MB)
ダウンロード フルサイズ画像のダウンロード(307KB)
補足資料
サムネイル
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード(194KB)
補足資料
データ提供
データはリクエストに応じて提供する。
参考文献
エイトケンら、1998
R.J. Aitken、E. Gordon、D. Harkiss、J.P. Twigg、P. Milne、Z. Jennings、D.S. Irvine
ヒト精子の機能的コンピテンスとゲノムの完全性に及ぼす酸化ストレスの相対的影響
Biol. Reprod., 59 (5) (1998), 1037-1046頁, 10.1095/biolreprod59.5.1037
ScopusGoogle Scholarで見る
Allaeian Jahromiら、2022年
Z. Allaeian Jahromi、M.H. Meshkibaf、M. Naghdi、A. Vahdati、Z. Makoolati
メタンフェタミンは精子特異的カルシウムチャネルをダウンレギュレートする
Acs Omega, 7 (6) (2022), 5190-5196頁, 10.1021/acsomega.1c06242
スコープで見るGoogle Scholar
アモリムら、2022
N. Amorim, E. Mcgovern, A. Raposo, S. Khatiwada, S. Shen, S. Koentgen, G. Hold, J. Behary, E. El-Omar, A. Zekry
抗生物質による腸内汚染除去に成功した動物モデルにおける糞便微生物叢移植プロトコルの改良
Front Med(ローザンヌ), 9 (2022), Article 770017, 10.3389/fmed.2022.770017
スコープで見るGoogle Scholar
アジジら、2023年
S. アジジ、R.ハイランディッシュ、S.ダビリ、M.ラクザイー
メタンフェタミンの雄ラットの臓器への悪影響:病理組織学的および免疫組織化学的検討
イラン J. Basic Med Sci., 26 (5) (2023), pp.549-557, 10.22038/IJBMS.2023.68573.15055
スコープで見るGoogle Scholar
バソバら、2022年
L.V.バソヴァ、W.ヴィエン、N.ボルテル、J.A.ナヘラ、M.C.G.マーコンデス
メタンフェタミンは活性酸素種依存的にil1βとtnfαの転写をシグナルし、hiv-1 tatと相互作用して抗酸化防御機構を低下させる
Front Cell Neurosci., 16 (2022), Article 911060, 10.3389/fncel.2022.911060
スコープで見るGoogle Scholar
Blomberg Jensenら、2021年
M. Blomberg Jensen, C.H. Andreassen, A. Jørgensen, J.E. Nielsen, L. Juel Mortensen, I.M. Boisen, P. Schwarz, J. Toppari, R. Baron, B. Lanske, A. Juul
ランクルは男性の生殖機能を制御する
Nat. Commun., 12 (1) (2021), p. 2450, 10.1038/s41467-021-22734-8
スコープで見るGoogle Scholar
Cao et al.
D. Cao, Y. Li, R. Yang, Y. Wang, Y. Zhou, H. Diao, Y. Zhao, Y. Zhang, J. Lu
リポ多糖誘発性精巣上体炎は精巣上体β-ディフェンシン発現を破壊し、ラットの精子運動を阻害する。
Biol Reprod., 83 (6) (2010), pp.1064-1070, 10.1095/biolreprod.109.082180
スコープで見るGoogle Scholar
チェンら、2008
C. Chen、D. Wu、Z. Guo、Q. Xie、G.J. Reinhart、A. Madan、J. Wen、T. Chen、C.Q. Huang、M. Chen、Y. Chen、F.C. Tucci、M. Rowbottom、J. Pontillo、Y. Zhu、W. Wade、J. Saunders、H. Bozigian、R.S. Struthers
ヒトゴナドトロピン放出ホルモン受容体の強力かつ経口投与可能な非ペプチド性拮抗薬であるr-(+)-4-{2-[5-(2-フルオロ-3-メトキシフェニル)-3-(2-フルオロ-6-[トリフルオロメチル]ベンジル)-4-メチル-2,6-ジオキソ-3,6-ジヒドロ-2h-ピリミジン-1-イル]-1-フェニルエチルアミノ}酪酸ナトリウム(エラゴリックス)の発見
J. Med Chem., 51 (23) (2008), 7478-7485頁, 10.1021/jm8006454
スコープで見るGoogle Scholar
チェンら、2021
L. Chen, X. Zhi, K. Zhang, L. Wang, J. Li, J. Liu, L. Xu, J.S. Yoshida, X. Xie, Q. Wang
メタンフェタミンの反復投与による神経毒性発現と腸内細菌叢および糞便代謝産物の変化
Food Chem. Toxicol., 148 (2021), Article 111946, 10.1016/j.fct.2020.111946
PDFを表示記事を表示Scopusで表示Google Scholar
コルデンら、2019
H. コルデン、A.ランディン、V.ワレニウス、E.エレブリング、L.フェンドリクス、M.E.ニルソン、H.ライバーグ、M.プータネン、K.シェーグレン、L.バンデンプット、C.オールソン
腸内細菌叢は、腸内容物におけるアンドロゲン代謝の主要な制御因子である。
Am. J. Physiol. Metab., 317 (6) (2019), pp.E1182-E1192, 10.1152/ajpendo.00338.2019
Scopusで見るGoogle Scholar
コロデルら、2015
G. Collodel、E. Moretti、G. Brecchia、L. Kuželová、J. Arruda、E. Mourvaki、C. Castellini
細菌性リポ多糖で処理したウサギの精液サンプルにおけるサイトカイン放出と酸化状態
Theriogenology, 83 (7) (2015), pp.1233-1240, 10.1016/j.theriogenology.2015.01.008
PDFで記事を見るScopusで記事を見るGoogle Scholar
ダルソンら、2005
A. Darszon, T. Nishigaki, C. Wood, C.L. Treviño, R. Felix, C. Beltrán
精子生理学におけるカルシウムチャネルとca2+のゆらぎ
Int. Rev. Cytol., 243 (2005), pp. 79-172, 10.1016/S0074-7696(05)43002-8
PDFで記事を見るScopusで記事を見るGoogle Scholar
Dengら、2021年
C. Deng, M. Lv, B. Luo, S. Zhao, Z. Mo, Y. Xie
雄性生殖におけるπ3k/akt/mtorシグナル伝達経路の役割
Curr. Mol. Med, 21 (7) (2021), 539-548頁, 10.2174/1566524020666201203164910
スコープで見るGoogle Scholar
Dheinら、2018年
S. ダイン、K.シュメルマー、J.グエンター、A.サラメ
チューリンゲン州の青年および若年成人におけるメタンフェタミン乱用の諸相
Eur. Addict. Res, 24 (2) (2018), 98-105頁, 10.1159/000488141
スコープで見るGoogle Scholar
Ding et al.
N. Ding, X. Zhang, X.D. Zhang, J. Jing, S.S. Liu, Y.P. Mu, L.L. Peng, Y.J. Yan, G.M. Xiao, X.Y. Bi, H. Chen, F.H. Li, B. Yao, A.Z. Zhao
高脂肪食による腸内細菌異常が精子形成と精子運動に及ぼす影響
Gut, 69 (9) (2020), pp.1608-1619, 10.1136/gutjnl-2019-319127
Scopusで見るGoogle Scholar
フレスノ・ヴァラら、2004年
J.A.フレスノ・バラ、E.カサド、J.デ・カストロ、P.セハス、C.ベルダ・イニエスタ、M.ゴンサレス・バロン
Pi3k/aktシグナル伝達経路と癌
Cancer Treat. Rev., 30 (2) (2004), 193-204頁, 10.1016/j.ctrv.2003.07.007
スコープで見るGoogle Scholar
ゲリンおよびキム、2021年
A.A.ゲリン、J.H.キム
米国成人におけるコカインまたはメタンフェタミン使用における発症年齢とその関連因子:nhanes 2005-2018の結果
Int. J. Environ. Res. Public Health, 18 (22) (2021), p. 12259, 10.3390/ijerph182212259
スコープで見るGoogle Scholar
原田ら、2016
N. 原田直樹, 花岡里美, 花田和彦, 伊澤利彦, 乾裕之, 山路亮太
性腺機能低下症は雄マウスの糞便微生物叢を変化させる
腸内細菌, 7 (6) (2016), pp.533-539, 10.1080/19490976.2016.1239680
ScopusGoogle Scholarで見る
井上ら、2020
T. 井上、青山-石川、上村、山下、古賀、寺島、宇佐美、小谷、平田順子
リポ多糖誘発急性炎症状態におけるインターロイキン-18レベルとマウスleydig細胞アポトーシス
J. Reprod. Immunol., 141 (2020), Article 103167, 10.1016/j.jri.2020.103167
PDFで記事を見るScopusで記事を見るGoogle Scholar
Janphetら、2017年
S. ジャンペット、S. ヌドマムド-タノイ、S. タノイ
メタンフェタミン曝露後のラット精巣におけるカテコールアミン濃度の変化
Andrologia, 49 (2) (2017), 10.1111/and.12616
Google Scholar
ジャヤンティら、2021年
S. ジャヤンティ、A.P.ダイワイル、J.L.カデット
メタンフェタミンの神経毒性:主作用とメカニズム
Exp. Neurol., 344 (2021), Article 113795, 10.1016/j.expneurol.2021.113795
PDFを見る記事を見るScopusで見るGoogle Scholar
ヨルダンら、2003年
B.K. Jordan、J.H. Shen、R. Olaso、H.A. Ingraham、E. Vilain
Wnt4の過剰発現は、正常な精巣血管系を破壊し、ステロイド生成因子1/β-カテニンの相乗作用を抑制することにより、テストステロンの合成を阻害する。
Proc. Natl. Acad. Sci. USA, 100 (19) (2003), pp.10866-10871, 10.1073/pnas.1834480100
スコープで見るGoogle Scholar
ケーウーマンら、2018
P. ケウマン、S.ヌドマムド-タノイ、S.タノイ
メタンフェタミン曝露後のラット精巣におけるギャバ作動性変化
Int J. Med Sci., 15 (12) (2018), pp.1349-1354, 10.7150/ijms.27609
スコープで見るGoogle Scholar
Kaewmanら、2023年
P. Kaewman, S. Nudmamud-Thanoi, J. Thongleart, S. Charoenlappanit, S. Roytrakul, S. Thanoi
ギャバ受容体α1サブユニットとカルビンジンのタンパク質発現の違い
Plos One, 18 (1) (2023), Article e0273888, 10.1371/journal.pone.0273888
スコープで見るGoogle Scholar
カルタス, 2023
A. カルタス
酸化ストレスと男性不妊:抗酸化物質の保護的役割
Med. (Kaunas., Lith.), 59 (10) (2023), 10.3390/medicina59101769
グーグル奨学生
ケヴィルら、2019
C.G.ケヴィル、N.E.ゲーダーズ、M.D.ウーラード、M.S.ブイヤン、P.ドミニク、G.K.コルル、C.L.アーノルド、J.G.トレイラー、A.W.オアー
メタンフェタミン使用Cardiovasc. Dis. Arterioscler. Biol., 39 (9) (2019), pp.1739-1746, 10.1161/ATVBAHA.119.312461
スコープで見るGoogle Scholar
Kuangら、2021
W. Kuang、J. Zhang、Z. Lan、R.N.V.K. Deepak、C. Liu、Z. Ma、L. Cheng、X. Zhao、X. Meng、W. Wang、X. Wang、L. Xu、Y. Jiao、Q. Luo、Z. Meng、K. Kee、X. Liu、H. Deng、W. Li、H. Fan、L. Chen
Slc22a14は精子の酸化的リン酸化と男性の生殖機能に必要なミトコンドリアのリボフラビントランスポーターである。
Cell Rep., 35 (3) (2021), Article 109025, 10.1016/j.celrep.2021.109025
PDFで記事を見るScopusで記事を見るGoogle Scholar
ラボシエとハドランド、2022年
N.J.ラボシエ、S.E.ハドランド
青少年における覚せい剤の誤用
Curr. Probl. Pedia Adolesc. Health Care, 52 (9) (2022), Article 101265, 10.1016/j.cppeds.2022.101265
PDFを見る記事を見るScopusGoogle Scholarで見る
ライら、2022年
S. Lai, J. Wang, B. Wang, R. Wang, G. Li, Y. Jia, T. Chen, Y. Chen
腸内細菌叢の変化はマウスのメタンフェタミンに対する行動および炎症反応に影響する
Psychopharmacol. (Berl. ), 239 (8) (2022), pp.1-16, 10.1007/s00213-022-06154-0
グーグル奨学生
李ら、2022
H. Li、N. Li、Q. Lu、J. Yang、J. Zhao、Q. Zhu、S. Yi、W. Fu、T. Luo、J. Tang、Y. Zhang、G. Yang、Z. Liu、J. Xu、W. Chen、J. Zhu
慢性アルコールによる腸内細菌叢および腸内代謝産物の異常はマウスの精子の質を損なう
Front Microbiol, 13 (2022), Article 1042923, 10.3389/fmicb.2022.1042923
スコープで見るGoogle Scholar
李ら、2023年
J.H. Li, J.L. Liu, X.W. Li, Y. Liu, J.Z. Yang, L.J. Chen, K.K. Zhang, X.L. Xie, Q. Wang
シグマ1受容体ノックアウトマウスの腸内細菌叢はうつ病様行動を誘導し、camp/creb/bdnfシグナル伝達経路を調節する
Front Microbiol, 14 (2023), Article 1143648, 10.3389/fmicb.2023.1143648
スコープで見るGoogle Scholar
李ら、2024年
Y. Li、Y. Liu、Y. Chen、C. Yao、S. Yu、J. Qu、G. Chen、H. Wei
マウス精巣におけるテストステロン生合成と炎症に対するポリスチレンナノプラスティックとリポ多糖の複合効果
Ecotoxicol. Environ. Saf., 273 (2024), Article 116180, 10.1016/j.ecoenv.2024.116180
PDFを見る記事を見るScopusで見るGoogle Scholar
林ら、2014
J. Lin, Y. Lin, P. Liao, Y. Lin, T. Tsai, K. Chou, H. Chen, S. Tsai, T.I. Hwang
ラットにおけるメタンフェタミン連日投与による精巣障害の誘発
Chin. J. Physiol., 57 (1) (2014), 19-30頁, 10.4077/CJP.2014.BAB155
スコープで見るGoogle Scholar
リウら、2019
J. リウ、C.フオ、H.カオ、C.ファン、J.フー、L.デン、Z.ルー、H.ヤン、L.ユー、Z.モ、Z.ユー
アロペリンはπ3k/aktシグナル経路を介して肝細胞癌細胞にアポトーシスとg2/m細胞周期停止を誘導する。
Phytomedicine: Int. J. Phytother. Phytopharm., 61 (2019), Article 152843, 10.1016/j.phymed.2019.152843
PDFで記事を見るScopusで記事を見るGoogle Scholar
リュウら、2022年
J.L. Liu、Y.H. Zheng、L.J. Chen、K.K. Zhang、J.H. Li、J.Z. Yang、X.W. Li、D. Zhao、X.L. Xie、Q. Wang
火傷皮膚における生体反応の潜在的バイオマーカー同定のためのMrnaマイクロアレイ解析:予備的パイロット研究
法医学・病理学, 18 (3) (2022), 319-328頁, 10.1007/s12024-022-00474-5
グーグル奨学生
劉ら、2017
Y. リウ、ハオ、シー、シュエ、ワン、チェン、ザオ、ハオ
覚せい剤使用者の凶悪犯罪と法医学的精神鑑定のジレンマ
法医学研究, 2 (1) (2017), 11-17頁, 10.1080/20961790.2017.1287155
ScopusGoogle Scholarで見る
劉ら、2023年
Y. リュー、チェン、リー、ヤン、リュー、チャン、リー、ワン、シュー、ジー
メタンフェタミン誘発心毒性モデルマウスにおける腸内細菌叢の関与
Chem. Biol. Inter., 379 (2023), Article 110512, 10.1016/j.cbi.2023.110512
PDFで記事を見るScopusで記事を見るGoogle Scholar
マルティノら、2022年
E. Martinot、L. Thirouard、H. Holota、M. Monrose、M. Garcia、C. Beaudoin、D.H. Volle
腸内細菌叢は腸-精巣軸を規定する
Gut, 71 (4) (2022), 844-845頁, 10.1136/gutjnl-2021-324690
ScopusGoogle Scholarで見る
メリノら、1995年
G.メリノ、S.カランサ-リラ、S.ムリエタ、L.ロドリゲス、E.クエバス、C.モラン
不妊男性における細菌感染と精液の特徴
Arch. Androl., 35 (1) (1995), 43-47頁, 10.3109/01485019508987852
スコープで見るGoogle Scholar
Nudmamud-ThanoiおよびThanoi, 2011
S. ヌドマムド-タノイ、S. タノイ
メタンフェタミンは精子の形態異常、低濃度精子、および精子減少を誘発する。
Andrologia, 43 (4) (2011), pp.278-282, 10.1111/j.1439-0272.2010.01071.x
スコープで見るGoogle Scholar
Nudmamud-Thanoiら、2016年
S. Nudmamud-Thanoi、W. Sueudom、N. Tangsrisakda、S. Thanoi
メタンフェタミン曝露後のラット精巣における精子の質とホルモン受容体の変化
Drug Chem. Toxicol., 39 (4) (2016), pp.432-438, 10.3109/01480545.2016.1141421
スコープで見るGoogle Scholar
Pangら、2022
Z. Pang、G. Zhou、J. Ewald、L. Chang、O. Hacariz、N. Basu、J. Xia
グローバルメタボロミクスデータのlc-hrmsスペクトル処理、マルチオミクス統合、共変量調整にmetaboanalyst 5.0を使用
Nat. Protoc., 17 (8) (2022), 1735-1761頁, 10.1038/s41596-022-00710-w
スコープで見るGoogle Scholar
PeirouviおよびRazi, 2022
T. Peirouvi、M. Razi
精巣組織におけるメタンフェタミン誘発性障害の分子機構:酸化ストレス、オートファジーおよびアポトーシスの証拠
Andrologia, 54 (10) (2022), Article e14534, 10.1111/and.14534
スコープで見るGoogle Scholar
Pengら、2023年
H.X. Peng, F. Chai, K. Chen, Y. Huang, G. Wei, H. Yuan, Y. Pang, S. Luo, C. Wang, W. Chen
活性酸素種を介したマイトファジーと細胞アポトーシスは、gc-2spdにおける塩化アルミニウム暴露の毒性に関与している。
Biol. Trace Elem. Res (2023), 10.1007/s12011-023-03848-0
Google Scholar
ロンダら、2010
A.C.ロンダ、A.ヴァスコンスエロ、R.ボランド
骨格筋細胞における17β-エストラジオールの抗アポトーシス作用には、細胞外制御キナーゼとp38マイトジェン活性化プロテインキナーゼが関与している。
J. Endocrinol., 206 (2) (2010), 235-246頁, 10.1677/JOE-09-0429
スコープで見るGoogle Scholar
サベリら、2017
A. サベリ、G.セペリ、Z.サフィ、B.ラザヴィ、F.ジャハンダリ、K.ディヴサラー、E.サラーキア
成体雄ラットの精巣組織病理学および精子形成指標に対するメタンフェタミンの影響
Addict. Health, 9 (4) (2017), pp.
Google Scholar
サブールら、2017
M. Sabour、A. Khoradmehr、S.M. Kalantar、A.H. Danafar、M. Omidi、I. Halvaei、A. Nabi、S. Ghasemi-Esmailabad、A.R. Talebi
高用量のメタンフェタミン投与はマウスの精子パラメータとDNAの完全性に有害な影響を及ぼす
Int J. Reprod. Biomed., 15 (3) (2017), pp.
ScopusGoogle Scholarで見る
Sahnoun et al.
S. Sahnoun, A. Sellami, N. Chakroun, M. Mseddi, H. Attia, T. Rebai, S. Lassoued
ヒト精子toll様受容体4(tlr4)は、不妊男性における細菌性リポ多糖に対する先体反応、酸化ストレスマーカー、および精子パラメータを媒介する。
J. Assist Reprod. Genet, 34 (8) (2017), pp.1067-1077, 10.1007/s10815-017-0957-8
Scopusで見るGoogle Scholar
セバイら, 2009
H. Sebai、M. Ben-Attia、M. Sani、E. Aouani、N. Ghanem-Boughanmi
ラットの内毒素血症誘発急性期反応におけるレスベラトロールの保護効果
Arch. Toxicol., 83 (4) (2009), pp.335-340, 10.1007/s00204-008-0348-0
スコープで見るGoogle Scholar
シャルマら、2022
A. シャルマ、C.N.ジャヤセナ、W.S.ディロ
視床下部-下垂体-精巣軸の制御:性腺機能低下症の病態生理
Endocrinol. Metab. Clin. North Am., 51 (1) (2022), 29-45頁, 10.1016/j.ecl.2021.11.010
PDFを見る記事を見るGoogle Scholar
シェンら、2022
P. Shen、S. Ji、X. Li、Q. Yang、B. Xu、C.K.C. Wong、L. Wang、L. Li
Lps誘発全身性炎症によるmpoa-fsh/lh障害と精巣機能障害
Front Endocrinol. (ローザンヌ), 13 (2022), Article 886085, 10.3389/fendo.2022.886085
スコープで見るGoogle Scholar
ソフィキティスら、2008年
N. ソフィキティス、N.ギオティタス、P.ツウナピ、D.バルトギアニス、D.ジャンナキス、N.パルダリディス
精子形成と精子形成のホルモン制御
J. ステロイド生化学 Mol. Biol., 109 (3-5) (2008), 323-330頁, 10.1016/j.jsbmb.2008.03.004
PDFで記事を見るScopusで記事を見るGoogle Scholar
スタインバーグら、2011
J.K.スタインバーグ、C.E.グレラ、M.R.ブードフ、P.R.カーンド、C.M.カドルンカ
収容中の女性青年における覚せい剤使用とハイリスク性行動(性病と診断された場合
J. Urban Health: Bull. N. Y. Acad. Med., 88 (2) (2011), pp.352-364
〈https://doi.org/10.1007/s11524-011-9557-6〉
CrossRefView in ScopusGoogle Scholar
ストーレー, 1997
B.T. ストーリー
ヒト精子におけるリポパーオキシダメージの誘導と予防の生化学的研究
Mol. Hum. Reprod., 3 (3) (1997), 203-213頁, 10.1093/molehr/3.3.203
ScopusGoogle Scholarで見る
スワードロフら、2017年
R.S. Swerdloff、R.E. Dudley、S.T. Page、C. Wang、W.A. Salameh
ジヒドロテストステロン:生化学、生理学、および血中濃度上昇の臨床的意義
Endocr. Rev., 38 (3) (2017), 220-254頁, 10.1210/er.2016-1067
スコープで見るGoogle Scholar
ウールマンら、2014
S. ウールマン、K.デベック、A.シモ、T.カー、J.S.G.モンタネール、E.ウッド
ストリートに関与する青少年におけるクリスタルメタンフェタミンの開始
Am. J. Drug Alcohol Abus., 40 (1) (2014), pp.31-36, 10.3109/00952990.2013.836531
スコープで見るGoogle Scholar
ウノダック、2023年
Unodc, 2023. 世界薬物報告書2023年。国連出版。〈https://www.unodc.org/unodc/en/data-and-analysis/world-drug-report-2023.html〉.
Google Scholar
ヴァラら、2021年
C. Vara, A. Paytuví-Gallart, Y. Cuartero, L. álvarez-González, L. Marín-Gual, F. Garcia, B. Florit-Sabater, L. Capilla, R.A. Sanchéz-Guillén, Z. Sarrate, R. Aiese Cigliano, W. Sanseverino, J.B. Searle, J. Ventura, M.A. Marti-Renom, F. Le Dily, A. Ruiz-Herrera
染色体融合が生殖細胞系列における3dゲノムの折りたたみと組換えに与える影響
Nat. Commun., 12 (1) (2021), p. 2981, 10.1038/s41467-021-23270-1
スコープで見るGoogle Scholar
ヴァスコンスエロら、2008年
A. Vasconsuelo, L. Milanesi, R. Boland
17β-エストラジオールはエストロゲン受容体を介してマウス骨格筋細胞のアポトーシスを阻害する:ホスファチジルイノシトール3-キナーゼ/akt経路の役割
J. Endocrinol., 196 (2) (2008), 385-397頁, 10.1677/JOE-07-0250
Scopusで見るGoogle Scholar
Wangら、2021
C. Wang、J. Zhao、H. Zhang、Y. Lee、Q. Zhai、W. Chen
ヒトの健康と疾患における腸内バクテロイデスの役割
Crit. Rev. Food Sci. Nutr., 61 (21) (2021), pp.3518-3536, 10.1080/10408398.2020.1802695
スコープで見るGoogle Scholar
Wangら、2019
F. Wang、W. Liu、Q. Jiang、M. Gong、R. Chen、H. Wu、R. Han、Y. Chen、D. Han
マウスにおけるリポ多糖誘発精巣機能不全および精巣上体炎:腫瘍壊死因子α†の重要な役割
Biol. Reprod., 100 (3) (2019), pp.849-861, 10.1093/biolre/ioy235
スコープで見るGoogle Scholar
ワンら、2020年
G. Wang、S. Cheng、S. Zhang、Y. Zhu、Y. Xiao、L. Ju
Lpsはステロイド生成とRos代謝を障害し、ppar転写活性を誘導して精巣細胞におけるエストロゲン/アンドロゲン受容体の発現を阻害する。
Mol. Biol. Rep., 47 (2) (2020), 1045-1056頁, 10.1007/s11033-019-05196-6
スコープで見るGoogle Scholar
Wangら、2022a
L. Wang、L. Xu、L. Chen、K. Zhang、Q. Zhang、Y. Chen、J. Li、J. Liu、Q. Wang、X. Xie
メタンフェタミンはマウスの腸内細菌叢を変化させ、炎症を促進することにより腸管傷害を引き起こす
Toxicol. Appl. Pharm., 443 (2022), Article 116011, 10.1016/j.taap.2022.116011
PDFで記事を見るScopusで記事を見るGoogle Scholar
Wangら、2022b
N. Wang、L. Chen、K. Yi、B. Zhang、C. Li、X. Zhou
生殖の健康に対する微生物叢の影響:総説
Crit. Rev. Food Sci. Nutr. (2022), pp. 1-22, 10.1080/10408398.2022.2117784
スコープで見るGoogle Scholar
王と謝、2022年
Y. Wang, Z. Xie
男性の生殖における腸内細菌叢の役割を探る
Andrology, 10 (3) (2022), 441-450頁, 10.1111/andr.13143
スコープで見るGoogle Scholar
謝ら、2023
J. Xie, S. Tian, J. Liu, S. Huang, M. Yang, X. Yang, R. Xu, J. Lin, L. Han, D. Zhang
潰瘍性大腸炎に対するインジゴとインジルビンの併用療法による腸管バリア機能の強化
Oxid. Med Cell Longev., 2023 (2023), Article 2894695, 10.1155/2023/2894695
スコープで見るGoogle Scholar
謝ら、2022年
Q. Xie、Y. Kang、C. Zhang、Y. Xie、C. Wang、J. Liu、C. Yu、H. Zhao、D. Huang
視床下部-下垂体-性腺軸の制御と生殖におけるキスペプチンの役割
Front Endocrinol. (ローザンヌ), 13 (2022), Article 925206, 10.3389/fendo.2022.925206
スコープで見るGoogle Scholar
ヤンら、2020年
H. ヤン、チャン、シュエ、チャオ、レイ、ウェン、ドン、ヤン、チャン
異なるタイプの精子無力症患者の精液微生物叢における潜在的病原性細菌
Sci. Rep., 10 (1) (2020), p. 6876, 10.1038/s41598-020-63787-x
ScopusGoogle Scholarで見る
ヤンら、2023年
J.Z. Yang、K.K. Zhang、H.W. Shen、Y. Liu、X.W. Li、L.J. Chen、J.L. Liu、J.H. Li、D. Zhao、Q. Wang、C.S. Zhou
シグマ1受容体ノックアウトは腸内細菌叢を乱し、血清メタボロームをリモデリングし、イソプレナリン誘発性心不全を悪化させる。
Front Microbiol, 14 (2023), Article 1255971, 10.3389/fmicb.2023.1255971
スコープで見るGoogle Scholar
Zhangら、2021年
K. Zhang、H. Wang、D. Qu、L. Chen、L. Wang、J. Li、J. Liu、L. Xu、J.S. Yoshida、J. Xu、X. Xie、D. Li
ルテオリンはp53経路を介したアポトーシス、オートファジー、炎症を抑制することでメタンフェタミン誘発肝毒性を緩和する(ラット
Front Pharm., 12 (2021), Article 641917, 10.3389/fphar.2021.641917
スコープで見るGoogle Scholar
Zhangら、2023a
K. Zhang、L. Chen、J. Yang、J. Liu、J. Liu、Y. Liu、X. Li、L. Chen、C. Hsu、J. Zeng、X. Xie、Q. Wang
腸内細菌叢由来の短鎖脂肪酸は、sigmar-1受容体依存的にメタンフェタミン誘発性うつ病様行動および不安様行動を改善する。
Acta Pharm. Sin. B. (2023), 10.1016/j.apsb.2023.09.010
グーグル奨学生
Zhangら、2023b
K. Zhang、J. Yang、L. Chen、J. He、D. Qu、Zhang、Y. Liu、X. Li、J. Liu、X. Xie、Q. Wang
ポリスチレン・マイクロプラスティックによる肝障害に腸内細菌叢が関与し、腸-肝軸を調節していることを明らかにした。
Acs Nano, 17 (15) (2023), 15125-15145頁, 10.1021/acsnano.3c04449
スコープで見るGoogle Scholar
Zhangら、2022a
K.K.チャン、L.J.チェン、J.H.リー、J.L.リュー、L.B.ワン、L.L.シュー、J.Z.ヤン、X.W.リー、X.L.クシー、Q.ワン
メタンフェタミンは腸内恒常性を乱し、血清メタボロームを再構築し、マウスに神経毒性と異常行動を引き起こす
Front Microbiol, 13 (2022), Article 755189, 10.3389/fmicb.2022.755189
スコープで見るGoogle Scholar
Zhangら、2022b
M. Zhang、Y. Liu、Y. Yin、Z. Sun、Y. Wang、Z. Zhang、F. Li、X. Chen
Ube2sは、細胞周期とアポトーシスを制御するπ3k/akt/mtorシグナル伝達経路を促進することにより、卵巣がんの発生を促進する。
Mol. Med. (Camb., Mass. ), 28 (1) (2022), p. 62, 10.1186/s10020-022-00489-2
グーグル奨学生
Zhangら、2022c
T. Zhang、P. Sun、Q. Geng、H. Fan、Y. Gong、Y. Hu、L. Shan、Y. Sun、W. Shen、Y. Zhou
メタボリックシンドロームモデルにおける精子形成の障害:腸-精巣軸におけるビタミンa代謝の役割
Gut, 71 (1) (2022), 78-87頁, 10.1136/gutjnl-2020-323347
グーグル奨学生
Zhangら、2023c
X. Zhang、H. Hao、K. Ma、H. Pang、X. Li、T. Tian、S. Hou、X. Ning、H. Wu、Q. Hou、M. Li、Y. Sun、X. Song、M. Jin
メチル水銀によるマウス精母細胞生殖細胞-2細胞のアポトーシスにおけるunfolded protein responseシグナル伝達経路の役割とメカニズム
Environ. Toxicol., 38 (2) (2023), 472-482頁, 10.1002/tox.23684
スコープで見るGoogle Scholar
Zhangら、2017年
Z. Zhang、Q. Gong、X. Feng、D. Zhang、L. Quan
メタンフェタミン乱用者の大脳皮質におけるアストロサイトのクラスマトデンドローシス
法医学研究, 2 (3) (2017), pp.139-144, 10.1080/20961790.2017.1280890
グーグル・スカラー
Zhangら、2023d
Z. Zhang、X. Li、J. Li、Y. Pan、Z. Zhuang、X. Zhang、C. Chen、Y. Liu、L. Zhang、Y. Luo、F. Liu、H. Fan、Q. Luo、X. Chen
ポリスチレン・マイクロプラスチックとヒ素の複合毒性がゼブラフィッシュ胚に及ぼす影響。
Sci. Total Environ., 887 (2023), Article 164017, 10.1016/j.scitotenv.2023.164017
PDFを見る記事を見るScopusで見るGoogle Scholar
周ら、2022年
Z. Zhou、M. Luo、H. Zhang、Y. Yin、Y. Cai、Z. Zhu
知識誘導型多層代謝ネットワーキングによる既知から未知への代謝物アノテーション
Nat. Commun., 13 (1) (2022), p. 6656, 10.1038/s41467-022-34537-6
Scopusで見るGoogle Scholar
ZirkinおよびPapadopoulos, 2018
B.R.ジルキン、V.パパドプロス
ライディッヒ細胞:形成、機能、制御
Biol. Reprod., 99 (1) (2018), 101-111頁, 10.1093/biolre/ioy059
Scopusで見るGoogle Scholar
引用 (0)
1
Jia-Li LiuとLi-Jian Chenはこの研究に等しく貢献した。
© 2024 The Author(s). 発行:エルゼビア社
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当サイトではクッキーを使用しています。クッキー設定
このサイトのすべてのコンテンツ: 著作権 © 2024 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
この記事が気に入ったらサポートをしてみませんか?
