ベルベリンは、腸内細菌叢由来の尿毒症毒素の産生を抑制することで慢性腎臓病を改善する
アクタ・ファーマシューティカ・シニカB
13巻4号、2023年4月、1537-1553ページ
本論文
ベルベリンは、腸内細菌叢由来の尿毒症毒素の産生を抑制することで慢性腎臓病を改善する

著者リンク open overlay panelLibin Pan †, Hang Yu †, Jie Fu †, Jiachun Hu, Hui Xu, Zhengwei Zhang, Mengmeng Bu, Xinyu Yang, Haojian Zhang, Jinyue Lu, Jiandong Jiang, Yan Wang
もっと見る
概要
シェア
引用する
https://doi.org/10.1016/j.apsb.2022.12.010Get 権利と内容
クリエイティブ・コモンズ・ライセンスに基づく
オープンアクセス
アブストラクト
現在、慢性腎臓病に対する臨床的な介入は非常に限られており、ほとんどの患者さんは透析に頼って長く生命を維持しています。しかし、腸-腎臓軸に関する研究により、腸内細菌叢が慢性腎臓病の是正やコントロールに有効なターゲットとなる可能性があることが示されています。本研究では、経口摂取可能性の低い天然薬物であるベルベリンが、腸内細菌叢の組成を変化させ、p-クレゾールを含む腸由来の尿毒症毒素の産生を抑制することにより、慢性腎臓病を有意に改善することを明らかにしました。さらに、ベルベリンは、主にg_Clostridium_sensu_stricto_1の存在量を低下させ、腸内細菌叢のチロシン-p-クレゾール経路を阻害することにより、血漿中のp-クレゾール硫酸塩の含有量を低下させた。一方、ベルベリンは、酪酸産生菌と糞便中の酪酸含量を増加させ、腎毒性のあるトリメチルアミンN-オキシドを減少させた。これらのことから、ベルベリンは、腸-腎臓軸を介した慢性腎臓病の改善に大きな可能性を持つ治療薬となることが示唆された。
グラフの抄録
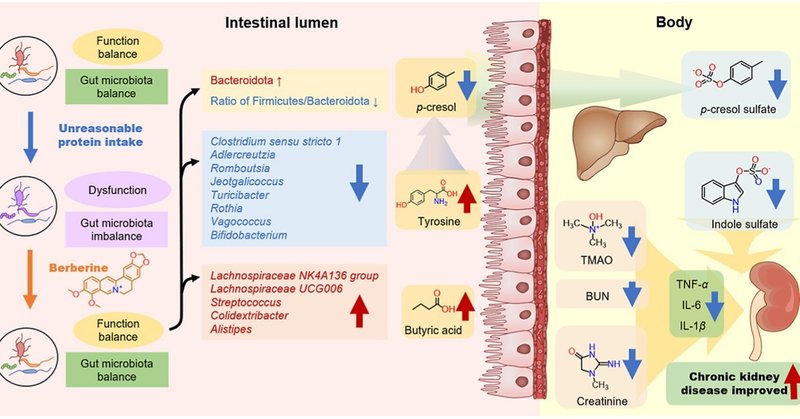
ベルベリンは、腸内細菌叢によるp-クレゾールなどのネフロトキシンの代謝を制御することで、腸-腎臓軸を介して慢性腎臓病を改善する。
ダウンロード 高解像度画像ダウンロード(334KB)
ダウンロード フルサイズ画像をダウンロードする
前の記事
次の記事
キーワード
慢性腎臓病
腸内細菌叢(ちょうないさいきんそう
ベルベリン
腸-腎臓軸
クロストリジウム
p-クレゾール
尿毒症の毒素
p-クレゾール硫酸塩
はじめに
腎臓病は世界的な公衆衛生問題であり、世界で7億5千万人以上の人々が罹患しています1。毎年、推定170万人が急性腎障害で死亡しています2。2015年の世界疾病負担調査によると、約120万人が慢性腎臓病(CKD)1により死亡し、2010年には200万人以上が透析を受けることができないために死亡しています。
腸内細菌叢とヒトの生理系との関連は、外的要因(食事摂取や薬物治療)による腸内環境の変化に依存しており3、腸内細菌叢と腎臓のクロストークを革新的に関連付ける「腸腎軸」仮説が20184年にモハン K. ライザダにより提唱されました。CKDは腸内細菌叢の組成と代謝活性の変化を誘発し、腎不全は栄養と内因性代謝物とともに腸内細菌叢を尿毒症毒素の産生を特徴とする臨床表現型に変化させる5。前述の変化は腸壁構造の変化と関連しており、その結果、腸壁のバリア機能が損なわれ、細菌の内因性代謝産物、細菌壁産物、生菌が血液循環に漏出するようになる6。したがって、腸内細菌叢は、尿毒症症状の緩和、腸内細菌叢の代謝変化の救済、心血管合併症の軽減、免疫異常の緩和など、CKDの予後を改善する新たな治療ターゲットとなることが期待されます7。
CKDの発症は、血中尿素窒素(BUN)やクレアチニンなど、健康な腎臓から排泄される様々な内因性代謝産物の血中濃度の上昇と関連しています8。大腸切除後のCKD患者9およびCKD無菌マウスを用いた研究の両方から、微生物由来の代謝物が尿毒症血清メタボロームに大きく寄与していることが示されています10。
腸内細菌由来の尿毒症毒素としては、p-クレゾール硫酸とインドキシル硫酸がよく知られている。p-クレゾール硫酸はタンパク質関連の尿毒症毒素である。腸内細菌叢は、チロシンやフェニルアラニンなどの腸管食餌性芳香族アミノ酸を代謝してp-クレゾールを生成し、後者は肝臓で吸収されてp-クレゾール硫酸に代謝される11。p-クレゾール硫酸は通常尿細管分泌により尿中に排出される。しかし、CKDでは、p-クレゾール硫酸が血漿中に蓄積し、心血管疾患や腎疾患の発症リスクを高める12,13。p-クレゾール硫酸は、白血球に酸化ストレスを与え14、内皮顆粒の放出を刺激して内皮障害を引き起こすとともに、レニン-アンジオテンシン-アルドステロン系/トランスフォーミング成長因子-β経路を刺激して上皮間葉様移行が起こり、腎障害と線維化が起こる15。CKD患者におけるp-クレゾール硫酸濃度の上昇は、予後の悪化と関連している16。
インドキシル硫酸は、腸内細菌叢によるトリプトファン代謝のもう一つの産物である。大腸に到達した食餌性トリプトファンは、腸内細菌叢によってインドールに変換され、全身循環に吸収され、肝臓でさらに代謝されてインドキシル硫酸となる5。腎機能が正常な被験者が高タンパク食を2週間摂取した場合、低タンパク食の被験者に比べてインドキシル硫酸の血清レベルおよび尿中排泄量が高かったことが報告されている17。インドキシル硫酸塩は血漿蛋白と結合し、その結合率は90%に近いため、インドキシル硫酸塩の透析挙動に影響を与え、そのクリアランス率を制限することになる18。また、インドキシル硫酸は一酸化窒素のバイオアベイラビリティを低下させるプロオキシダント効果を有し、インドキシル硫酸は内皮細胞および内皮前駆細胞の移動、再生、血管平滑筋細胞の増殖制御を変化させる。したがって、高濃度のインドキシル硫酸は内皮機能障害を引き起こし、CKD18における心血管疾患と死亡率に関与している。
トリメチルアミンN-オキシド(TMAO)は、腸内細菌が産生するトリメチルアミンに由来する別の尿毒症毒素である。CKD患者では、血漿中のTMAO濃度が上昇する19。血漿中のTMAO濃度の上昇は、尿細管間質線維化、コラーゲン沈着、腎障害のバイオマーカーの増加20と関連している。このように、尿毒症の毒素を除去することは、あらゆる段階のCKDの治療における主な困難であり課題である。そして、尿毒症毒素の生成メカニズムを解明し、「腸-腎臓軸」に基づいて尿毒症毒素の生成をいかに抑えるかが、CKD研究のホットスポットであり困難である。
CKDにおける腸内細菌叢の介入戦略には、糞便微生物叢移植、特定の腸内細菌叢を標的とした介入、プレバイオティクス、プロバイオティクス、または疾患進行を緩和または制御するための食事介入の使用などがあります21,22。特定のプロバイオティクスやプレバイオティクスのサプリメントは、特定の腸由来の尿毒症毒素の産生を減少させる。無作為化プラセボ対照クロスオーバー試験において、透析前のCKD成人患者を対象とした6週間のシンバイオティクス療法(プレバイオティクス粉末とプロバイオティクスカプセル)は、尿毒症毒素(p-クレゾール硫酸)の血漿濃度を有意に低下させました23。特定の表現型機能を持つ人工細菌は、宿主のCKD関連代謝物レベルを制御するための潜在的アプローチとなり得る。細菌のトリプトファナーゼを遺伝的に欠損させると、in vitroでインドール産生が消失することが報告されており、将来的にはCKD治療への応用が期待される24。
ベルベリン(BBR)は、漢方薬のCoptidis Rhizomaの主な有効成分の一つであり、現在、腸管感染症の治療薬として臨床で使用されている。近年、BBRが高脂血症、高血糖症などの代謝性疾患に対する治療効果を有することが報告されている25, 26, 27, 28, 29. BBRの構造的特性により、溶解度が低く、透過性が悪い(イオン性形態)。そして、P-糖タンパク質の基質として、BBRが吸収された後、著しい排出が起こり、BBRの低いバイオアベイラビリティをもたらす30。そして、このように、BBRは腸内に蓄積することができ、これはBBRが腸内細菌叢に作用する根拠となる。BBRは、様々な疾患モデル31, 32, 33, 34, 35, 36において、腸内フローラ構造および内因性腸内フローラ代謝物の濃度を変化させて薬効を発揮することができ、BBRの有効物質および治療機構に関する研究において新たなホットトピックとなっている。材料と方法
2.1. 化学物質と試薬
Berberine hydrochlorideは、J&K Scientific Co. (中国・北京)から購入した。トリメチルアミンオキシド、酪酸ナトリウム、アデニン、クレアチニン、トリプトファン、チロシン、4-ヒドロキシフェニル酢酸、4-ヒドロキシフェニルプロピオン酸、インドールおよびp-クレゾールは、Beijing Solarbio Biotechnology Co. (中国・北京)から購入した。インドキシル硫酸およびp-クレゾール硫酸は、Sigma-Aldrich(St.Louis, USA)より購入した。すべての標準物質の純度は98%以上であった。オキシテトラサイクリン、エリスロマイシン、およびセファドロキシルは、Beijing Solabio Biotechnology Co. (Ltd.(中国、北京)から購入した。クロマトグラフィーグレードのアセトニトリルおよびメタノールは、Fisher Scientific(Fairlawn、USA)から入手した。脱イオン水はHangzhou Wahaha Group Co, Ltd.から購入した。(中国、杭州)から購入した。その他の化学試薬は、Sinopharm Chemical Reagent Co, Ltd.から購入した。(中国、北京)から購入した。強化クロストリジウム培地(RCM)は、Beijing Solarbio Biotechnology Co. (北京、中国)から購入した。H&E染色キットは、Beijing Solarbio Biotechnology Co. (中国、北京)から購入した。クレアチニン検出キット、尿素窒素検出キット、炎症因子検出キット(TNF-α、IL-6、IL-1β)は、南京建成生物工学研究所(中国、南京市)から購入した。
Clostridium sporogenes(ATCC 19404)およびClostridium perfringens(ATCC 13124)は、Guangdong Huankai Microorganism Technology Co. (Guangzhou,China)から購入した。Lactobacillus rhamnosus(ATCC7469)は、American Type Culture Collection(ATCC)より購入した。
2.2. 動物
雄のSprague-Dawley(SD)ラット(180〜200g)は、Beijing Vitalriver Laboratory Animal Technology Co. (Ltd.(中国、北京)から提供された。すべての動物は、餌と水に自由にアクセスでき、12時間の明と12時間の暗を循環させる換気された部屋に収容された。温度は20-24℃、湿度は40%-60%に維持された。動物は実験前に12時間絶食させ、自由に水を飲ませることができた。本研究は、中国医学科学院および北京ユニオン医科大学の実験動物倫理委員会(第00003403号、承認日、2021年6月14日)の承認を受け、実験動物倫理委員会の組織指針および倫理指針の指示に厳格に従った。
2.3. 動物実験について
動物(200g雄性SDラット)を、対照群(Control)、CKDモデル群(Model)、BBR処理群(BBR)、抗生物質介入群(Antibiotic)、プロバイオティクス処理群(L. rhamnosus)および酪酸ナトリウム処理群(Sodium Butyrate)の6群、各群10名にランダムに分割した。CKDモデルは、当初、アデニンを0.25%(w/w)含むCKD誘発配合飼料を2ヶ月間投与したSDラットから確立した。モデル化中、血清クレアチニンとBUN値を測定した。モデルの確立に成功した後、薬物介入を1ヶ月間行った。実験終了後、麻酔後に動物を犠牲にし、さらなる研究のために血液、糞便、腎臓を採取した。
薬物介入の詳細は以下の通りであった: 1)コントロール群(Control):維持飼料を給与、2)モデル群(Model):0.25%(w/w)のアデノシン酸を含むCKD誘発配合飼料を給与。 25%(w/w)アデニン、3)BBR治療群(BBR):CKD誘発配合飼料を給与+BBR(100mg/kg/日)経口投与、4)抗生物質介入群(抗生物質):CKD誘発配合飼料給与+混合抗生物質(オキシテトラサイクリン300mg/kg/日、エリスロマイシン300mg/kg/日、セファドロキシル100mg/kg/日)のガベージを行う、5)プロバイオ治療群(L.rhamnosus):CKD誘発性配合飼料を給与+プロバイオティクス(1×1010CFU/日)の経口投与、6)酪酸ナトリウム投与群(Sodium Butyrate):CKD誘発性配合飼料を給与+酪酸ナトリウム(600mg/kg/日)の経口投与。
L. rhamnosus(ATCC7469)はATCCから購入し、MRSブロス培地で嫌気培養して適当な濃度にし、1×1010CFU/mLに希釈してドラッグデリバリーに用いた。
2.4. 腎臓のH&E染色
H&E染色は以下のように行った。まずパラフィン切片をキシレン(I)およびキシレン(II)で5分間脱脂し、エタノール勾配(無水エタノール5分、95%エタノール2分、80%エタノール2分、70%エタノール2分、その後蒸留水2分)で処理した。脱パラフィンした組織切片をヘマトキシリン染色液で20分間染色し、水道水でリンスした。分化液を30秒間塗布した後、組織試料を15分間水中に浸した。エオシン染色液で30秒間染色した後、流水で洗浄した。水に5分間浸した後、エタノールグラデーションで脱水し、キシレンで清拭し、中性接着剤で封をした。最後に、光学顕微鏡で観察・撮影した。
2.5. 血漿クレアチニン、血中尿素窒素、炎症性因子の検出
モデル化から2ヶ月後と介入終了時に、マウスを12時間絶食させてから血清試料を採取した。クレアチニン、BUN、炎症因子(TNF-α、IL-6、IL-1β)含有量の検出は、キットの説明書に従って実施した。
2.6. 糞便マイクロバイオーム16S rRNAの検出
処理1ヶ月後にラットの糞便を採取した。糞便サンプル中の微生物DNAは、E.Z.N.A. Soil DNA Kit (Omega Biotek, USA)を用いて説明書に従って抽出した。微生物16S rRNA遺伝子のV3-V4領域を、プライマー対338F(5′-ACTCCTACGGAGGCAGCAG-3′)および806R(5′-GGACTACHVGGTWTCTAAT-3′)で増幅した。その後、PCR産物を2%アガロースゲルから抽出し、AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, USA)を用いて精製した。精製したアンプリコンは、Illumina MiSeqを用いて塩基配列を決定し、各グループの動物糞便中の細菌群の多様性を解析した。
2.7. 血漿中腎機能関連代謝産物のLC-MS/MS法の確立
血漿中の腎機能関連代謝物の定量分析には、エレクトロスプレーイオン(ESI)源を備えたLC-MS/MS 8060質量分析計(島津製作所)を使用した。検出方法は、多重反応モード(MRM)に基づき確立した。質量分析パラメータは、以下のように設定した: 1)ネブライジングガス流量:2.7L/min、2)加熱ガス流量:9.9.8L/min、3)乾燥ガスフロー: 9.8 L/min;4)界面温度: 300 ℃; 5)DL温度:250 ℃; 6)加熱ブロックの温度: 400 °C. 代謝物の定量トランジションは以下の通りであった:インドキシル硫酸: MRM- 212.20 → 79.90 (CE: 22.0); およびp-クレゾール硫酸塩: MRM- 187.20 → 107.00 (CE: 25.0); TMAO: MRM+ 76.15 → 58.05 (CE: -23.0); クレアチニン: MRM+ 114.35 → 44.15 (CE: -18.0)となりました。
代謝物の分離には、Alltima C18 (150 mm × 4.6 mm, 5 μm, Grace, USA)を使用した。移動相は、水中0.05%アンモニア(A相)-アセトニトリル(B相)。溶出モードはグラジエント溶出とし、流速は0.4mL/分とした。そして、カラム温度は40℃に維持した。具体的なB相の勾配は次の通りであった: 0.01分:20%、2分:20%、6分:80%、8分:95%、8.01分:20%、そして12分:停止。
特異性、直線性、日内および日中の精度および正確さ、回収率および安定性の測定により、我々の以前の研究31に記載されているように、対応する方法論的検証を実施した。
2.8. 糞便中の腎機能関連代謝物のLC-MS/MS法の確立
糞便中の腎機能関連代謝物の定量分析には、ESI源を搭載したLC-MS/MS 8060質量分析計(島津製作所)を使用した。質量分析パラメータは以下のように設定した:1)ネブライジングガスフロー:2.7L/min、2)加熱ガスフロー: 9.8L/min、3)乾燥ガスフロー: 9.8 L/min、4)界面温度: 300 ℃、5)DL温度:250 ℃、6)加熱ブロック温度: 400 °C. 代謝物の定量遷移は以下の通り:トリプトファン:MRM- 203.35 → 115.90 (CE: 21.0); p-cresol: SIM- 107.15; インドール SIM- 116.05;チロシン: MRM- 180.30 → 163.20 (CE: 15.0);および酪酸: SIM- 87.10である。
代謝物の分離には、xSelect HSS PFP (100 mm × 2.0 mm, 1.8 μm, Waters, USA)を使用しました。移動相は、水(A相)-アセトニトリル(B相)中の0.05%アンモニアであった。溶出モードはグラジエント溶出で、流速は0.4mL/分であった。そして、カラム温度は40℃に維持された。具体的なB相の勾配は次の通りであった: 0.01分:10%、2分:10%、6分:99%、7.30分:99%、7.31分:10%、そして13分:停止。
特異性、直線性、日内および日中の精度および精度の測定、回収率および安定性については、以前の研究31に記載されているように、対応する方法論的検証を実施した。
2.9. 血漿および便のサンプル調製
採取した血漿サンプル50μLを、100ng/mLグリピジド(IS)を含む3倍量のメタノールに加え、代謝物の抽出とタンパク質の沈殿を行った。13,400×g、5分間の遠心分離後、10μLの上清を採取し、分析に供した。採取した新鮮な糞を3倍量の二重蒸留水に加え、混合してホモジネートを得、13,400×gで5分間遠心分離を行った。その後、上清100μLを100ng/mLグリピジドを含む3倍量のメタノールに添加した。ボルテックス後、13,400×gで5分間遠心分離し、上清10μLを注入して解析した。
2.10. BBRおよびSDラット腸内細菌叢のin vitroインキュベーション
6匹のSDラットを犠牲にした後、大腸内容物を採取し、滅菌した嫌気性培地を1.0g:20mLの割合で、穏やかに攪拌しながら添加した。濾過後、腸内フローラを含む培地(混合培地)をN2下に置き、37℃で30分間プレインキュベートしてから使用した。インキュベーションシステムは、コントロールとしてメタノール中のBBR(最終濃度:それぞれ50、100、200μg/mL、n=4)または純粋なメタノール10μLと混合培地990μLで構成されていた。インキュベーションは、振盪インキュベーター(Longyue Instrument Co., Ltd., Shanghai, China)を用いて、37℃、200rpmで行った。実験中、インキュベーションシステムは嫌気的な環境に維持された。0、6、12、24時間後にそれぞれ3倍量のメタノール(IS)中の100ng/mLグリピジドを添加し、反応を終了させた。そして、各サンプルを4℃の冷蔵遠心分離機で13,400×g、10分間遠心分離し、タンパク質を沈殿させた。上清5μLをLCMS-8060で分析し、培養系に含まれるp-クレゾール、インドール、チロシンおよびトリプトファンの含有量を検出した。
2.11. in vitroにおけるチロシン-p-クレゾール経路の代謝産物の検討
チロシン-p-クレゾール経路の一連の中間体を検出するための分析法を、ESI源を備えたLC-MS/MS 8060質量分析計(島津製作所)を用いて確立した。質量分析パラメータは、以下のように設定した: 1)ネブライジングガスフロー:2.7L/min;2)加熱ガスフロー: 9.8L/min、3)乾燥ガスフロー: 9.8 L/min;4)界面温度: 300 ℃、5)DL温度:250 ℃、6)加熱ブロック温度: 400 °C. 化合物の定量的なトランジションは以下の通りであった: 4-hydroxyphenylacetic acid: MRM- 151.00 → 93.20 (CE: 15.0); p-cresol: SIM- 107.15;4-hydroxyphenylpropionic acid: MRM- 165.25.00 → 121.00 (CE: 13.0); およびチロシン: MRM- 180.30 → 163.20 (CE:15.0)となった。
物質分離には、xSelect HSS PFP (100 mm × 2.0 mm, 1.8 μm, Waters, USA)を使用した。そして、移動相は、水(A相)-アセトニトリル(B相)中の0.05%アンモニアとした。溶出方法はグラジエント溶出で、流速は0.4mL/minとした。カラム温度は40 ℃に維持した。具体的なB相の勾配は以下の通りであった: 0.01分:10%、2分:10%、6分:99%、7.30分:99%、7.31分:10%、そして13分:停止。
特異性、直線性、日内および日中の精度および精度の測定、回収率および安定性については、以前の研究31に記載されているように、対応する方法論的検証を実施した。
2.12. BBR 分子仮想ドッキング解析
BBRとTyrB間のドッキング解析は、Discovery Studio Clientソフトウェア(v16.1.0.15350)を用いて実施した。TyrB 4WD2 の結晶構造は Protein Data Bank (PDB) データベースから取得し、BBR と TyrB 間のドッキングは、本ドッキング研究のドッキングアルゴリズムとして CDOCKER アプローチを使用して実施しました。ドッキングプロセスでは、タンパク質は硬いまま、リガンドは完全に柔軟なものとして扱い、最後の最小化ステップでドッキング位置を洗練させました。また、パラメータはデフォルト値に設定した。
2.13. 2つのClostridium株に対するBBRの阻害効果
Clostridium sporogenes(ATCC 19404)とClostridium perfringens(ATCC 13124)の2株は、広東華凱微生物技術有限公司から購入した。強化クロストリジウム培地(RCM)を用いて細菌を活性化した。そして、2つのクロストリジウム株をそれぞれ初期濃度1×106CFU/mLで展開した。阻害実験のために,異なる濃度のBBR(0,8,40および100μg/mL)を,これら2つのClostridium株とともに,嫌気性ボックス内で8時間培養した。OD600は,日本のShimadzu CorporationのUV分光光度計を使用して測定した。
2.14. 統計解析方法
データはPrism version 5.0 (GraphPad Software, La Jolla, CA, USA)を用いて解析した。符号を用いたクラスタリング相関ヒートマップは、OmicStudioツール(https://www.omicstudio.cn)を用いて実施した。図中のデータは平均値±標準偏差(S.D.)で表し、グループ間の差は両側t検定で分析した。0.05未満のP値は統計的に有意とした(*P<0.05、**P<0.01、****P<0.001)。結果
3.1. BBRはラットのアデニン誘発CKDを改善した
実験スキームを図 1A に示す。CKDモデル化には、0.25%アデニンを添加したラット飼育飼料を使用した。2ヶ月のモデル化後、1ヶ月間の薬物介入を行った。CKDに対するBBRの有効性における腸内細菌叢の役割を評価するために、抗生物質投与群を導入した。そして、我々の研究室で一般的に適用されている抗生物質の処方を用いて、擬似無菌状態を確立した31。さらに、我々の以前の研究により、BBRが腸内細菌叢37の短鎖脂肪酸、特に酪酸の産生を刺激し、後者は腎機能保護効果を持つことが報告されている38。酪酸は胃粘膜への刺激が強いため、酪酸ナトリウム群(酪酸ナトリウム、酪酸ナトリウム塩をラットに投与)を導入して、BBR関連短鎖脂肪酸のCKDへの影響を検討した。短鎖脂肪酸は腸内細菌叢の二次代謝産物であるため、CKDに対するプロバイオティクス介入には短鎖脂肪酸生産菌として菌株を選択することが可能である。これまでの研究で、5/6腎摘出マウスモデル39やシスプラチン誘発慢性腎毒性モデル40に対して、短鎖脂肪酸生産菌であるL. rhamnosusの腎保護作用が示されている。一方、パイロット実験では、L. rhamnosusはインドールやp-クレゾールといった典型的な尿毒症性毒素を産生しないことが示された。したがって、L. rhamnosusは、L. rhamnosusグループのCKDの治療のためのプロバイオティクスとして選ばれました。
ダウンロード 高解像度画像ダウンロード(943KB)
ダウンロード フルサイズ画像をダウンロードする
図1. BBRは0.25%アデニン誘発のラットのCKDを改善した。(A)実験グループ分けとスキーム。(B, C) CKDモデルラットの0.25%アデニン食摂取2ヶ月後のBUN (B) および血清クレアチニン値 (C). (D、E)0.25%アデニン誘発CKDモデルラットの投与4週間後の血清クレアチニン(D)およびBUN(E)値。データは平均値±S.D.で示し、***P<0.01、***P<0.001、n=10。(F)0.25%アデニン誘発CKDモデルラットの投与4週間後の腎臓のH&E染色結果。腎臓の損傷を示す境界のはっきりしない空胞を放射状の矢印で、糸球体を緑色の矢印で示した(スケールバー、100μm)。
実験中、重度の腎不全(むくみ体やゼラチン質に囲まれた腎臓が観察される)により死亡したのはモデル群2匹と抗生物質群2匹のみで、他の群では死亡した動物はいなかった。モデル化結果を図1BおよびCに示すが、0.25%アデニン補助食を与えて2ヶ月後、モデル群のBUNおよびクレアチニン値は有意に上昇した(*****P<0.001)。対照群に比べ、モデル群のBUN値は82.5%、クレアチニン値は669.4%増加し、CKDモデルの確立に成功したことが示されました。
薬物またはプロバイオティクスの介入を2週間および4週間行った後、血清サンプルのクレアチニンレベルを測定した。その結果を、Supporting Information Fig. S1A(2週間)およびFig. 1D(4週間)に示す。薬物またはプロバイオティクス介入2週間後(図S1A)、血清クレアチニン値は、モデル群に比べ、BBR群(15.6%減少、*P<0.05)およびL. rhamnosus群(14.9%減少、**P<0.001)で有意に低く、酪酸ナトリウム群では有意ではないがわずかに減少した(6.2%の減少)。CKDの進行は、抗生物質投与群でより深刻であった。血清クレアチニン値は、抗生物質投与群で14.0%上昇した。4週間の薬物またはプロバイオティクス介入後(図1D)、BBR群(29.5%減少、**P<0.01)、L. rhamnosus群(28.6%減少、**P<0.01)および酪酸ナトリウム群(29.8%減少、**P<0.001)ではモデル群と比較して血清クレアチニン値が著しく減少していました。また、抗生物質投与群では血清クレアチニン値が有意差なくわずかに低下したが、上記3つの介入による治療効果は同様であった。
次に、薬物またはプロバイオティクスを2週間および4週間継続投与した後の血清中のBUN値を分析し、その結果を図S1B(2週間)および図1E(4週間)に示した。薬物またはプロバイオティクス介入2週間後、BBR群(11.5%減少、∗P < 0.05)および酪酸ナトリウム群(10.7%減少、∗P < 0.05)はモデル群に比べBUN量が有意に減少したが、L. rhamnosus群ではBUN量は3.6%とわずかに低下し有意差はなかった。一方、抗生物質投与群とモデル群との間には有意な差は見られなかった。4週間の薬物またはプロバイオティクス介入後、BBR群、L. rhamnosus群および酪酸ナトリウム群のBUN量は、35.2%有意に減少した。 2%(***P<0.001)、29.1%(***P<0.001)、26.9%(***P<0.001)、モデル群に比べ、それぞれ有意に低下しました。また、抗生物質投与群とモデル群との間には有意な差は認められませんでした。
次に、CKDモデルラットの腎臓を切片化し、切片化後にH&E染色を行い、BBRの腎臓保護作用を評価した。その結果を図1Fに示す。Control群と比較して、Model群の腎臓では境界が不明瞭な空胞(赤矢印)が多数観察され、糸球体構造は完全に破壊され萎縮していた。BBRおよび酪酸ナトリウムの介入後、液胞の数は大幅に減少し、糸球体の構造は維持された(緑色の矢印)ことから、BBRおよび酪酸ナトリウムのCKDに対する保護効果が示された。一方、L. rhamnosus群では、境界のはっきりしない液胞が依然として存在したが、その数は少なくなり、糸球体の損傷は依然として確認されたが、その程度は小さかった。このように、L. rhamnosusの介入は依然として一定の腎保護効果を示し、全体的なダメージはモデル群とBBR群の間にあった。しかし、抗生物質投与群では、より大きな面積の空胞が観察され、糸球体構造は完全に破壊されたため、腎機能はより深刻なダメージを受けた。
血清中のTNF-α、IL-6、IL-1βなどの炎症因子を検出し、CKD関連の炎症進行を評価した。SupportingInformation図S9A-S9Cに示すように、モデル群のTNF-α(***P<0.001)、IL-6(***P<0.001)、IL-1β(**P<0.01)レベルはコントロール群に比べ有意に高値であった。一方、BBR群のTNF-α、IL-6、IL-1β量は、モデル群に比べ、それぞれ35.8%(**P<0.01)、40.2%(**P<0.01)、32.1%(**P<0.05 )と有意に減少した。抗生物質投与群では、抗炎症作用によりTNF-α、IL-6、IL-1βの含有量が減少することが確認されました。また、酪酸ナトリウム群およびL. rhamnosus群の炎症因子もモデル群に比べ低下したが、有意ではなかった(IL-6を除く、∗P < 0.05).
3.2. BBRはCKDラットの腸内細菌叢の組成を変化させる
CKD状態における腸内細菌叢の組成変化およびCKDモデルにおけるBBRの腸内細菌叢への影響をさらに検討し、腸内細菌叢のアンバランスと宿主疾患の関係を探るために、まず動物の糞を採取し、16S rRNA分析を行った。α-Diversityは、1つのサンプルに含まれる微生物の種数と各種の割合を示した。Chao1指数、Shannon指数、PD全木、Observed speciesは、α-diversityを測定するために最も使用される指数である。図2A、B、S2A、S2Bに示すように、モデル群のChao1 index、Shannon index、PD whole tree、Observed speciesはコントロール群に比べて減少しており、CKDモデル群の腸内フローラの種多様性と均一性が著しく乱れ、CKD進行に伴う腸内フローラの巨視的変化が起きていることが示された。抗生物質の投与により、動物の腸内細菌叢は著しく阻害され、抗生物質投与群のChao1 index、Shannon index、PD whole tree、観察種は著しく減少し、抗生物質投与下で腸内細菌叢の多様性が著しく低下していることが示された。BBR群でも同様の結果が得られ、BBRは天然の抗生物質であるため、BBR群のα-多様性は減少傾向を示している。注目すべきは、BBRのα-ダイバーシティの減少の程度は、抗生物質グループよりも緩やかであったことです。したがって、CKD状態における腸内細菌叢の制御におけるBBRと抗生物質の類似点と相違点を分析するためには、β-diversityなどのさらなる比較が必要である。最後に、モデル群に比べ、α-ダイバーシティが変化しないかわずかに改善したL. rhamnosus群と酪酸ナトリウム群では、α-ダイバーシティがコントロール群に近づき、L. rhamnosus群と酪酸ナトリウムの介入により、CKD状態の腸内フローラの乱れが一定程度回復することが示されました。
ダウンロード 高解像度画像ダウンロード(620KB)
ダウンロード フルサイズ画像をダウンロードする
図2. BBRはCKDモデルラットの腸内細菌叢の多様性を調節した。(A、B)BBRはCKDモデルにおける腸内細菌のα-多様性に影響を与えた:(A)Chao1指数;(B)Shannon指数。(C)CKDモデルラットにおけるBBR投与後の腸内細菌のβ-多様性(PCA)。 D)モデル群およびコントロール群の腸内細菌叢の属レベルでのボルケーノプロット解析。(E)CKDモデルにおける腸内細菌叢のヒートマップ(属レベル)。データは平均値±S.D.で示し、∗P < 0.05, ∗P < 0.01, ∗∗P < 0.001, n = 6.
β-ダイバーシティは、異なるサンプル間(特に異なるグループ間)の細菌群の組成の類似性を測定する、つまりサンプル間の細菌群の組成の違いを明らかにするために用いられる指標である。そこで、各群のβ-diversityを分析したのが図2Cである。PCA(主成分分析)の結果、図2Cでは、モデル群とコントロール群が効果的に区別され、モデル群とコントロール群の腸内フローラ構成がかなり異なることが示された。同時に、抗生物質投与群はモデル群やコントロール群から明確に分離されており、抗生物質投与により腸内フローラが大きく変化していることが確認されました。さらに、BBR群もControl群やModel群から離れた位置にありました。注目すべきは、BBR群が抗生物質群から大きく離れていたことで、BBRの腸内フローラを調整するユニークで複雑な能力が示され、BBRのCKDに対する治療効果のメカニズムに関連していると考えられる。最後に、酪酸ナトリウムの導入により、PCAにおいて酪酸ナトリウム群とコントロール群が接近し、L. rhamnosus群はコントロール群とモデル群の間に位置し、L. rhamnosusと酪酸ナトリウムの介入により、CKD状態での腸内フローラの乱れが一定程度回復したという状態が検証された。
さらに、CKD状態における腸内フローラの具体的な組成を分析するために、各群の腸内フローラを門レベルおよび属レベルで分析した。サポート情報Fig.S3は、門レベルでの腸内細菌叢の違いを示したものである。腸内細菌叢は、主にファーミキューテス門とバクテロイデーテス門の細菌で構成されています。抗生物質群を除けば、この2つのグループの合計が90%以上を占め、絶対的な優占株であった。そして、抗生物質投与群では、ファーミキューテスとバクテロイダスの存在量が著しく減少し、代わりにプロテオバクテリアの菌株が著しく濃縮されたことは注目に値する。次に、よく知られているFirmicutes/Bacteroidota比を分析した。これは、肥満患者で最初に研究され、Firmicutes/Bacteroidota比が低いほど健康な状態と相関していた41。図S4AおよびS4Bにおいて。Firmicutes/Bacteroidotaの比率は、Bacteroidota菌の存在量が有意に減少しているモデル群で有意に増加していたが、BBRはこの比率を有意に減少させた。BBRのこの機能は、主にバクテロイデーテス門の細菌の存在量を増加させることによって達成された。
さらに、存在量の差が大きい属をスクリーニングするために、検出されたすべての172の細菌属を分析した。フォールドチェンジが2以上、P値が0.05未満の属を選択し、ボルケーノマップの形で表示した。図2Dに示すように、青い点はモデル群とコントロール群の間で存在量に有意差がある細菌属を表しています。次に、全群で有意差のある上記細菌属の多様性を解析し、ヒートマップで示しました。その結果を図2Eに示す。Model群とControl群では、G_Turicibacter、G_Clostridium_sensu_stricto_1、G_Romboutsia、G_Corynebacterium、G_Adlercreutzia、G_Jeotgalicoccus、G_Bifidobacterium、G_Candidatus_SaccharimonasおよびG_Candidatus_Soleaferreaは有意に濃縮されていたことが確認される、 一方、モデル群では、g_UCG-009、g_Eubacterium_xylanophilum_group、g_NK4A214_group、g_Lachnospiraceae_NK4A136_group、g_Rothia、g_Lachnospiraceae_UCG-001、g_Vagococcus、g_Streptococcus、g_Lachnospiraceae_UCG-006、g_Callidextribacterおよびg_Alistipesは顕著な枯渇が見られた。上記の属のうち、様々な属がCKDの進行と密接に関係していることがわかった。g_Clostridium_sensu_stricto_1はCKDモデルで非常に濃縮されており、4-hydroxyphenylacetic acid decarboxylaseをコードする遺伝子を発現し、後者はp-クレゾール42の生産を媒介できることが報告された。尿毒症毒素吸着剤AST-120は、g_Clostridium_sensu_stricto_1の存在量と糞便中のp-cresol含量を減少させることができる42。g_Romboutsiaは、典型的尿毒症毒素である循環TMAOと正の相関があることが報告されている43。g_Adlercreutziaは、血漿フェニル硫酸と正の相関があることが報告されており、フェニル硫酸と蛋白尿の間には有意な相関があり、フェニル硫酸産生の抑制により糖尿病マウスの蛋白尿を減少させることができる44。 g_Jeotgalicoccusは、腎臓シュウ酸カルシウム結晶と関連があることが報告されている。BBRの介入により、上記のg_Clostridium_sensu_stricto_1の存在量は有意に減少した(∗∗P < 0.01, Fig. 5B)、g__Adlercreutzia(∗P < 0.01、図5C)、g__Romboutsia(∗P < 0.05、図S5A)、g__Jeotgalicoccus(∗P < 0.05 、図S5B)。BBRは腎毒素産生物質の存在量を調節することで、体内の腎毒素を調節し、BBRの腎保護効果を促進する可能性があると推察されます。
3.3. BBRはin vivoで腸管由来の尿毒症毒素産生を減少させた
BBRは腸内細菌叢の潜在的な腎毒素生産者を制御していることから、BBRの腎毒素制御能を評価することが必要であると考えられた。LC-MS/MSを用いて、血液試料中のクレアチニン、TMAO、インドキシル硫酸、p-クレゾール硫酸の高感度分析法および糞便試料中のトリプトファン、p-クレゾール、インドール、チロシンの分析法を確立しました。すべての分析法は方法論的に検証されている(Supporting Information Table S1-S3, S5, S6, Figs.S10 and S11)。図3Aは、Control群とModel群の糞便試料中のインドールおよびp-クレゾールのマススペクトルを示しており、Control群の糞便試料中のp-クレゾールの含有量は極めて少なかった。
ダウンロード 高解像度画像ダウンロード(712KB)
ダウンロード フルサイズ画像をダウンロードする
図3. BBRはCKDモデルSDラットにおいて腸内細菌叢の代謝物量を調節した。(A)糞便試料中のp-クレゾールおよびインドールの質量分析クロマトグラム(黒曲線:コントロール群、赤曲線:モデル群;コントロール群の糞便試料中のp-クレゾールの含有量は極めて低い)。(B)チロシン-p-クレゾール-p-クレゾール硫酸およびトリプトファン-インドール-インドキシル硫酸の生成経路を模式的に示す図。(C)BBR投与4週間後のCKDラットの糞便中のトリプトファンの含有量。(D)BBR投与4週間後のCKDを有するラットの糞便中のインドール含有量。(E)BBR投与4週間後のCKDを有するラットの血漿中のインドキシル硫酸塩の含有量。(F)BBR投与4週間後のCKDラットの糞便中のチロシンの含量。(G)BBR投与4週間後のCKDのラットの糞便中のp-クレゾールの含量。(H)BBR処置4週間後のCKDを有するラットのp-クレゾール硫酸塩の血漿レベル。データは平均値±S.D.で示し、*P < 0.05, **P < 0.01, **P < 0.001, n = 10.
トリプトファン-インドール-インドキシル硫酸経路とチロシン-p-クレゾール-p-クレゾール硫酸経路は、図3Bに示されている。簡単に説明すると、腸内細菌叢によってトリプトファンからインドールが代謝され、インドールは体内に吸収され、肝臓でインドキシル硫酸に代謝される。そして、チロシンはp-クレゾールに代謝され、後者は肝臓の代謝作用でp-クレゾール硫酸に変化し続けることができます。0.25%アデニン補助飼料で2ヶ月間モデル化した後、上記の経路の代謝物が検出された(Supporting Information Figure S6A-S6G).モデル群の糞便中のトリプトファン濃度は、コントロール群に比べて有意に低下(59.1%減少、***P < 0.001, Fig. S6A)していました。一方、糞便中のインドール濃度も有意に増加(53.4%増加、***P<0.01、図S6B)しており、CKDモデルの腸内細菌の変化により、トリプトファンの利用率が高まり、インドールが多く生産されることが示されました。また、血漿中のインドキシル硫酸濃度が高いこと(941.2%増加、***P<0.001、図S6C)からも、CKD状態での腸内細菌叢によるインドールの生産が増加していることが確認されました。同時に、モデル群の糞便中のチロシン濃度も有意に低下(27.2%減少、*P<0.05、図S6D)し、チロシンの最下流代謝物である糞便中のp-クレゾール存在量は331.9%(**P<0.001、図S6E)と大幅に増加した。また、血漿中のp-クレゾール硫酸濃度も2552.2%(***P<0.001、図S6F)と有意に高く、CKDモデルの腸内細菌の変化により、チロシン-クレゾール-p-クレゾール硫酸経路の活性が上昇することが示された。さらに、血漿中の腎毒素TMAOも、モデル化2ヶ月後にControl群より高くなった(542.3%増加、***P<0.001、図S6G)。以上の結果は、CKDの腸内フローラが解糖系発酵から蛋白質分解系発酵に移行し45、アミノ酸の利用率を高め、生体に大きな影響を与えるという既報と一致するものでした。
薬物およびプロバイオティクス介入後、トリプトファン-インドール-インドキシル硫酸経路とチロシン-p-クレゾール-p-クレゾール硫酸経路を評価した。図3Cに示すように、介入4週間後、トリプトファンの糞便中含有量は、BBR群(*P<0.05)、抗生物質群(***P<0.001)で有意に高くなった。 001)、L. rhamnosus群(***P<0.001)、酪酸ナトリウム群(***P<0.001)で、モデル群に比べ、それぞれ有意に高い値を示しました。同時に、図3Fに示すように、4週間の介入後、チロシンの糞便中含有量は、BBR群(*****P<0. 001)、抗生物質群(***P<0.001)、L. rhamnosus群(***P<0.001)、酪酸ナトリウム群(***P<0.01)で、モデル群に比べ、有意に増加しました。したがって、BBR、L. rhamnosusおよび酪酸ナトリウムは、腸内細菌叢によるチロシンおよびトリプトファンの利用を有意に低下させることができると推察される。次に、トリプトファンおよびチロシンの下流代謝物であるインドールおよびp-クレゾールの含有量を測定した。図3Dに示すように、モデル群に比べ、BBR群、抗生物質群、L. rhamnosus群で糞便中のインドール濃度がわずかに低下したが、有意差はなかった。しかし、図3Gに示すように、投与4週間後、BBR群(**P<0.01)、抗生物質群(**P<0.001)、L. rhamnosus群(**P<0.05)、酪酸ナトリウム群(**P<0.01)のp-クレゾール含有量は、モデル群と比較して有意に減少した。中でも、BBR(54.0%減少)および抗生物質(96.3%減少)は、腸内細菌叢によるp-クレゾール産生抑制に最も有効であることが示されました。そして、相関試験の結果、糞便中のp-クレゾール含量は炎症因子(TNF-α, R2 = 0.3602, P = 0.0005, IL-6, R2 = 0.1892, P = 0.0163, IL-1β, R2 = 0.1950, P = 0.0146, 図S9D)と正相関しており、これはBBRのCKDに対する治療効果に一致していたことからBBRによって便中のp-クレゾール含量を抑制していると考えられた。また、投与4週間後に血漿中のインドキシル硫酸塩およびp-クレゾール硫酸塩の含量を検出した。図3Eに示すように、BBR(**P<0.01)、L. rhamnosus(**P<0.001)および酪酸ナトリウム(**P<0.001)の使用は、血漿中のインドキシル硫酸塩含有量を有意に減少したが、抗生物質群は明白な効果を示さなかった。そして、血漿試料中のp-クレゾール硫酸含量を図3Hに示した。モデル群に比べ、BBR群および抗生物質群のp-クレゾール硫酸含量は、それぞれ72.0%(**P<0.01)および87.1%(**P<0.001)と有意に低下していた。しかし、L. rhamnosusおよび酪酸ナトリウムは、p-クレゾール硫酸塩の減少に有意な効果を示さなかった。さらに、腎血管硬化や腎線維化に深く関わる血漿中のTMAO濃度は、モデル群に比べ、BBR群(29.8%減少、*P<0.05)および抗生物質群(42.9%減少、**P<0.001)で有意に減少した(援用図 S7A)。
このように、BBRは、尿毒症毒素、特にチロシン-p-クレゾール-p-クレゾール硫酸経路の制御における尿毒症毒素を減少させ、それによって血漿中のp-クレゾール硫酸濃度を減少させるという強い効果を示した。
3.4. BBRはin vitroで腸内細菌叢のチロシン-p-クレゾール経路を制御する
BBRはin vivoで腎毒素、特にチロシン-p-クレゾール-p-クレゾール硫酸経路を抑制する強い効果を示したことから、次にBBRと腸内細菌叢の直接的な相互作用、およびin vitroでの腸内細菌叢のチロシン-p-クレゾール経路に対するBBRの制御能に注目した。チロシン-p-クレゾール経路の高感度定量法を確立し、その解析方法は方法論的に検証されている(表S1、S4-S6、図S10、S11)。SDラット6匹を麻酔し、生け贄とした。混合大腸内容物を採取した後、BBRとラット腸内細菌を24時間一緒に培養し、培養系における尿毒症毒素合成経路の制御を0、6、12、24時間後にそれぞれ検出した。
サポート情報Fig.S8Aおよび4Bに示すように、培養系内のトリプトファンおよびチロシンは、培養時間の延長とともに腸内細菌叢によって消費され、24時間後にはほぼ完全に枯渇することが確認された(図S8Aおよび4B)。BBRを最終濃度100μg/mLで添加した後、腸内細菌によるチロシンの代謝は有意に阻害され(*P<0.05、図4B)、BBRは腸内細菌によるトリプトファン代謝にはほとんど影響を及ぼさなかった(図S8A)。さらに、図S8Bおよび図4Dに示すように、インドール(トリプトファンの代謝物)およびp-クレゾール(チロシンの代謝物)の濃度は徐々に増加した。そして、BBRは培養系におけるp-クレゾールの生成を有意に抑制したが(*P < 0.05, 図4C)、インドールの生成には明らかな影響はなく(図S8B)、これはin vivoの結果と一致した。
ダウンロード 高解像度画像ダウンロード(611KB)
ダウンロード フルサイズ画像をダウンロードする
図4. BBRはin vitroで腸内細菌関連尿毒症毒素の産生を調節した。 A)チロシン-p-クレゾール経路の模式図である。(B)SDラット結腸内容物(n = 4)におけるチロシン代謝に対するBBRの影響。(C)SDラット結腸内容物(n = 4)におけるp-クレゾール生成に対するBBRの効果。(D)異なる濃度のBBRは、SDラット結腸内容物中のチロシン代謝を用量依存的に阻害した(n=3)。(E)異なる濃度のBBRは、SDラット結腸内容物における4-ヒドロキシフェニル酢酸の産生を用量依存的に阻害した(n = 3)。(F)異なる濃度のBBRは、SDラット結腸内容物中のp-クレゾールの生成を用量依存的に阻害した(n = 3)。データは平均値±S.D.で示し、*P < 0.05, **P < 0.01, **P < 0.001.
次に、in vitroの培養系において、BBRはp-クレゾールの産生を有意に抑制し、インドールにはほとんど影響を及ぼさなかったことから、主にチロシン-p-クレゾール経路に対するBBRの調節効果に注目した。図4Aは、腸内細菌叢によるp-クレゾール生成経路を示したものである。簡単に説明すると、まずチロシンは芳香族アミノ酸アミノトランスフェラーゼ(Aat)によって4-ヒドロキシフェニルピルビン酸に異化され得る。そして、後者はフェレドキシン酸化還元酵素A(PorA)を含む一連の酵素の作用により、4-ヒドロキシフェニル酢酸に代謝される。4-ヒドロキシフェニルピルビン酸は、フェニル乳酸脱水素酵素(FldH)を含む一連の酵素の作用の下、ヒドロキシフェニルプロピオン酸に代謝されることもある。最後に、4-ヒドロキシフェニル酢酸は、ヒドロキシフェニル酢酸デカルボキシラーゼ(Hpd)の作用でp-クレゾールに代謝される。また、チロシンからp-クレゾールが直接切断される経路もp-クレゾールを生成する経路の一つである46。そこで、チロシン、4-ヒドロキシフェニル酢酸、4-ヒドロキシフェニルプロピオン酸、p-クレゾールのLC-MS/MSによる定量法を確立した。そして、様々なBBR濃度(最終濃度:0、50、100、200μg/mL)のin vitro腸内細菌培養系で、0、1、2、4、12時間後にそれぞれチロシン、4-ヒドロキシフェニル酢酸、4-ヒドロキシフェニルプロピオン酸およびp-クレゾールの濃度を分析した。図4D-Fに示すように、4-ヒドロキシフェニルプロピオン酸がin vitro腸内細菌培養系で検出されなかったことを除き、BBRは12時間後の腸内細菌叢によるチロシンの利用を著しく低下させ(*P < 0.05, 図4D)、用量依存性(50μg/mLでは119.3%、100μg/mLでは446.3%、200μg/mLでは579.2%の減少)が見られることがわかった。同時に、4-ヒドロキシフェニル酢酸の生成もBBRによって用量依存的に有意に抑制された(50μg/mLで14.5%、100μg/mLで36.4%、∗P < 0.05、200μg/mLで62.3%の減少、∗∗P < 0.001).また,最後に,p-クレゾールの含量は用量依存的に有意に減少した(50μg/mLで20.6%,100μg/mLで37.7%,*P<0.05,200μg/mLで65.2%,**P<0.01に減少した).
以上の結果から,BBRは用量依存的にp-クレゾールおよび4-ヒドロキシフェニル酢酸の生成を抑制し,チロシンの含量を増加させることが明らかとなり,BBRがin vitroでチロシン-p-クレゾール合成経路を制御することが改めて確認された。
3.5. 腸管由来の尿毒症毒素と腸内細菌叢の相関分析
次に、BBRはユニークな微生物スペクトルを示し、腎毒素の産生を制御していることから、腸内細菌叢と尿毒症毒素の関係やCKD治療においてBBRが果たす役割を明らかにする必要がある。そこで、検出された腎機能指標および複数の尿毒症性毒素と腸内細菌叢との相関解析を行った。その結果をFig.5Aに示す。その結果、g_Butyricicoccus、g_Proteus、g_Lactococcus、g_Eubacterium_oxidoreducens_group、g_Lachnospiraceae_NK4A136_group、g_Family_XIII_UCG-001、g_Shuttleworthia、g_Anaerovorax、g_Streptococcus、g_Lachnospiraceae_UCG-006、 g_Lachnospiraceae_UCG-008、g_Eubacterium_siraeum_group、g_Colidextribacter、g_Roseburiaは、血漿クレアチニン、血漿TMAO、血漿 p-cresol sulfate、血漿インドキシル硫酸と負の相関があった。注目すべきは、これらの菌株の中に、g_Butyricicoccus47、g_Lachnospiraceae_NK4A136_group48、g_Lachnospiraceae_UCG-00649、g_Lachnospiraceae_UCG-00849、g_Roseburia50といった多くの酪酸生産菌が見られたこと。そして、モデルグループと比較して、BBRは上記の属の存在量を増加させた(図5F)。
ダウンロード 高解像度画像ダウンロード(650KB)
ダウンロード フルサイズ画像をダウンロードする
図5 (A)尿毒症毒素と腸内細菌との属レベルでの相関解析のヒートマップ。(B)BBRは、CKDを有するSDラット(n = 6)において、g_Clostridium_sensu_stricto_1の存在比を減少させた。(C)BBRは、CKDを有するSDラット(n = 6)において、g_Adlercreutziaの存在比を減少させた。(D)BBR群とモデル群との間で腎毒素と正の相関を示す細菌属のフォールド変化(log2フォールド変化で表現)(n = 6)。(E)BBR投与4週間後のCKDを有するSDラットの糞便中の酪酸の含有量(n=10)。(F)BBR群とModel群との間の酪酸産生菌の倍数変化(-log2倍数変化で表す)(n=6)。データは平均値±S.D.で示し、*P<0.05、**P<0.01、***P<0.001である。
酪酸はCKD38の腎保護作用を有することが報告されており、BBRにより増加した酪酸産生菌はCKD尿毒症と負の相関があることから、糞便サンプル中の酪酸を検出した(図5E)。モデル群の糞便中の酪酸量は、コントロール群に比べ有意に減少した(*****P<0.001)。4週間の介入後、BBR群(***P<0.001)、L. rhamnosus群(***P<0.001)および酪酸ナトリウム群(***P<0.001)では、糞便中の酪酸量が有意に上昇する傾向がみられた。しかし、抗生物質投与群の糞便中の酪酸含量は、コントロール群の9.6%と非常に低く、モデル群のそれと比較して明らかな変化は見られませんでした。3.3節の結果と合わせると、抗生物質は尿毒症毒素に対して強い抑制効果を示すものの、酪酸のような有益な代謝産物の生産も抑制しており、これが抗生物質群で腎臓の損傷がより深刻になった理由と推察されます。しかし、BBRは、糞便中の酪酸産生をアップレギュレートするとともに、腎毒素をダウンレギュレートし、これはBBRのCKDに対する腎保護効果に関連すると考えられる。
一方、図5Aに示すように、g_Clostridium_sensu_stricto_1、g_Adlercreutzia、g_Faecalibaculum、g_Corynebacterium、g_Bifidobacterium、g_Candidatus_Soleaferreaが血漿クレアチニン、血漿TMAO、血漿 p-cresol sulfate、血漿 indoxyl sulfateと正の相関があることも明らかになった。そして、モデル群と比較して、BBRは上記の属の存在量を減少させた(図5D)。
2.2節の結果と合わせると、g_Clostridium_sensu_stricto_1はp-クレゾール43を、g_Adlercreutziaはフェノール44を生成することが報告されており、これはBBRが生体内および生体外の尿毒症毒素、特にチロシン-プレゾール-プレゾール硫酸経路を制御する効果と対応するものであった。一方、生体内実験では、モデル群にクロストリジウム属(Clostridium_sensu_stricto_1)とアドラークロイツア属(Adlercreutzia)が著しく濃縮されており、BBRはこれら2属を著しく枯渇させた(図5BおよびC)。このことから、クロストリジウム属(Clostridium_sensu_stricto_1)とAdlercreutziaはCKDに対する治療ターゲットとして利用可能性がある。BBRはチロシン-p-クレゾール-p-クレゾール硫酸経路の腎毒素を有意に制御することから、g_Clostridium_sensu_stricto_1はCKD治療におけるBBRの主要有効ターゲットであると推察される。
3.6. BBRは、腸内細菌叢におけるg_Clostridium_sensu_stricto_1の存在量を減少させた。
以上の実験から、BBRはチロシン-p-クレゾール-p-クレゾール硫酸経路をダウンレギュレートし、BBRはCKD動物糞便中のg_Clostridium_sensu_stricto_1の存在量を著しく減少させることができることが判明した。このことから、BBRはCKDの治療において、g_Clostridium_sensu_stricto_1が主な有効ターゲットとなる可能性があると考えられた。本節では、BBR の CKD 治療効果における g_Clostridium_sensu_stricto_1 の役割に主に着目した。
まず、腸内細菌叢の腎毒素経路に関する遺伝子機能量をPICRUStで評価した。 PICRUSt51は、マーカー遺伝子配列に基づき遺伝子機能量を予測するアルゴリズムである。PICRUSt1は、16Sハイスループットシーケンスデータのみを対象に機能予測を行う。KEGG (Kyoto Encyclopedia of Genes and Genomes) データベースの情報に従って、KEGG Orthology (KO) PathwayとEC情報を取得し、各機能カテゴリの遺伝子存在量を算出することができる。その結果を図6A、Bに示す。トリプトファン異化経路の遺伝子機能量は、モデル群で有意に濃縮され(***P < 0. 01)、BBR群(**P<0.01)、L. rhamnosus群(**P<0.01)、酪酸ナトリウム群(**P<0.01)のトリプトファン代謝経路は有意に枯渇していました。一方、チロシン代謝経路の遺伝子機能量も、モデル群(*P<0.05)で有意に濃縮され、BBR群(*P<0.05)、抗生物質群(*P<0.05)でチロシン代謝経路の遺伝子機能量も有意に濃縮された。 05)、抗生物質群(*P < 0.05)、L. rhamnosus群(*P < 0.05)、酪酸ナトリウム群(*P < 0.05)では有意に枯渇していた。次に、KOデータを解析し、トリプトファン代謝とチロシン代謝のキーとなる酵素を発見した。TnaA(トリプトファナーゼ、EC:4.1.99.1)は主にトリプトファンからのインドール生産を仲介する。TyrB (aromatic amino acid aminotransferase, EC: 2.6.1.57) は、主にチロシンから4-hydroxyphenylpyruvateを生成し、後者は一連の反応によりp-cresolを生成します。一方、各グループにおけるTnaAとTyrBの存在量予測値を調べた(図S7B、6C)。TyrBの予測存在量は、モデル群の糞便サンプルではコントロール群のそれと比較して高かったが(***P<0.01)、BBR群ではTyrB存在量が有意に減少した(図6C)。これは、BBRがTyrB酵素の制御によりチロシン-p-クレゾール経路に影響を与えることを示し、2.3節の結果とも一致した。次に、PDBデータベースからTyrBの結晶構造(PDB 4WD2)を取得し、仮想分子ドッキング解析を実施した。図6Dは、BBRとTyrBとの仮想分子ドッキングを示したものである。BBRをTyrBに接触させると、2つの分子は結合自由エネルギーが-18.65 kcal/molとなり、強いドッキング能力を発揮した。BBRがTyrBに結合する際の2次元模式図である。TyrBの活性部位には親水性結合(水素結合と引力電荷結合)が多数存在し、これがBBRとTyrB間の主な結合力となっている可能性がある。一方、TnaAの予測存在量は、Control群と比較してModel群の糞便サンプルで高かった(*P < 0.05, Fig. S7B)。これは、BBRがトリプトファン-インドール経路にほとんど影響を及ぼさないことと対応している。
ダウンロード 高解像度画像ダウンロード(884KB)
ダウンロード フルサイズ画像をダウンロードする
図6 (A、B)BBR介入下のCKDモデル(n = 6)におけるトリプトファン分解経路(A)およびチロシン分解経路(B)のKEGG予測値(A)。(C) BBR介入下のCKDモデル(n = 6)におけるチロシン代謝経路の主要酵素であるTyrBの存在量のKEGG予測値。(D)BBRとTyrBとの分子ドッキング原理と、BBRとTyrBとの結合の2次元模式図。(E)g_Clostridium_sensu_stricto_1とp-cresolの相関。(F)g_Clostridium_sensu_stricto_1とp-クレゾール硫酸塩の相関。(G) Clostridium sporogenesに対するBBRの抑制効果(n = 3)。(H)クロストリジウム・パーフリンゲンス(n=3)に対するBBRの抑制効果。データは平均値±S.D.で示し、*P < 0.05, **P < 0.01, **P < 0.001である。
次に、CKDモデルにおいて、g_Clostridium_sensu_stricto_1とp-cresolおよびp-cresol sulfateとの相関を解析した。その結果を図6EおよびFに示す。g_Clostridium_sensu_stricto_1は、糞便検体のp-クレゾール(P < 0.0001, r2 = 0.44)および血漿検体のp-クレゾール硫酸塩(P = 0.0067, r2 = 0.19)と有意な正の相関があった。次に,BBRがClostridium属の一般的な菌株の増殖抑制効果を有するかどうかを検討した。 Clostridium属の菌株でp-クレゾールを直接生産できるものはほとんど報告されていないため,Clostridium属の一般的な2種(Clostridium sporogenesとClostridium perfringens)を選択してさらに検討を行った。Clostridium sporogenesは、チロシンを代謝して4-hydroxyphenylpyruvate、4-hydroxyphenylacetic acid、4-hydroxyphenylpropionic acid52を生成する能力を持ち、このうち4-hydroxyphenylacetic acidはp-cresolの前駆体となることが報告されているClostridiumのモデル菌株として知られています。上記のクロストリジウム属2株を異なる濃度のBBR(0、8、40、100μg/mL)で培養した結果を図6GおよびHに示す。BBRはクロストリジウム・スポロゲネス(図6G)およびC. perfringens(図6H)の増殖を著しく阻害し、用量依存性を示し、これはin vivoの結果とも一致する。考察
CKDは、人間の健康に対する深刻な脅威です。CKDの進行に伴い、腎毒素はますます人体に蓄積され、腎臓から排泄されなくなる。これらの腎毒素の多くは、腸内細菌叢による食事中の主な栄養素の代謝に由来するものである53。一方、近年、腸-腎軸の概念が徐々に解明され、腸内フローラの代謝物と腎機能の変化との相関がより明らかにされてきている。したがって、腸内細菌叢に基づき、CKD患者の腎機能を改善することが可能である。腸内細菌叢を介入させたCKD治療の戦略としては、糞便微生物叢移植、プレバイオティクス、プロバイオティクス、食事介入、あるいは疾患進行を緩和する薬物介入などが挙げられる21。特に、CKDの治療に対する腸内細菌叢に基づく薬物介入は、現在の研究の新たな焦点となっている。例えば、AST-120(腸内細菌叢由来の腎毒素であるインドールを吸着する活性炭吸着剤)は、血中のインドキシル硫酸濃度を低下させることによりCKDを緩和することが報告されている17。本研究では、BBRがCKDの進行に対して有意な治療効果を示すことを確認した。BBRは、アデノシン誘発CKDモデルラットのBUNおよび血清クレアチニンを低下させ、CKDの進行を改善することができる。そして、BBRがCKDを改善するこのメカニズムは、腎毒素を産生する腸内細菌を制御することに関与しています。
タンパク質由来の腸管産尿毒症毒素の多くは、p-クレゾール(主にチロシンから生成)やインドール(主にトリプトファンから生成)などの芳香族アミノ酸の腸内細菌分解物であり、さらに血中に入り肝臓の代謝作用でp-クレゾール硫酸やインドキシル硫酸フェノールを生成する。腸内細菌の尿毒症毒素産生菌のうち、インドール産生株はBacteroides(グラム陰性)など様々な門派に広く分布している24。しかし、p-クレゾール産生株は比較的集中して分布しており、主に腸球菌科、クロストリジウム科、ブドウ球菌科、腸内細菌科に属している。これらの菌株は、チロシン由来のフェノールを生成するチロシンフェノールリアーゼをコードしていることが知られている54。また、p-クレゾール生産株の多くはグラム陽性菌に属している(グラム陰性菌である腸内細菌科の株を除く)。本研究では、主に腸内細菌叢のチロシン-p-クレゾール-p-クレゾール硫酸経路およびトリプトファン-インドール-インドキシル硫酸経路の制御に基づく、BBRのCKDに対する保護効果に焦点を当てた。我々のデータから、BBRはチロシン-p-クレゾール-硫酸-p-クレゾール経路に対してより大きな影響を与えるが、トリプトファン-インドール-インドキシル硫酸経路に対してはより弱い影響を与えることが示された。この現象は、BBRがグラム陽性菌に対してより感受性が高く、グラム陰性菌に対してより弱い効果を示すというBBRの抗菌スペクトルで説明することができる。本研究では、BBRはグラム陽性菌に属するCKDモデルにおけるクロストリジウム属菌の存在量を有意に減少させた。また、BBRはin vitroで直接クロストリジウム属菌の増殖を抑制することができ、これは抗菌スペクトルと一致する。しかし、BBRは、そのほとんどがグラム陰性菌に属するインドール産生菌の増殖に対しては、有意な阻害能を示さなかった。
BBRの抗菌スペクトルはユニークであることから,動物糞便中の腸内細菌叢の16S rRNA解析から,BBRが腸内細菌叢を有意に制御していることが明らかとなった。PCA解析では、BBR群の腸内フローラのクラスタリングは、Control群、Model群、Antibiotic群の中間であり、BBRによる腸内細菌叢の複雑な制御が示され、CKDの治療メカニズムに関連すると考えられる。一方、BBRの適用によりα多様性がわずかに低下することが確認され、これはBBRの抗生物質としての静菌作用の顕著な現れでもあった。しかし、BBRの静菌作用は、多くの抗生物質とは異なるものであった。一方、BBRは酪酸産生菌の存在量を増加させることが判明し、これは我々の先行研究37と一致した。
酪酸は、急性腎障害やCKDの腎機能障害において、炎症を抑制する役割を果たすことが報告されている38。同時に、酪酸は遺伝子発現を制御するヒストン脱アセチル化酵素を直接阻害することができ、後者の活性化と発現は、腎線維症、ループス腎炎の腎障害、糖尿病性腎症のポドサイト障害の進行を遅らせることに関連している55。また、酪酸はGタンパク質共役型受容体のアゴニストとして作用し、腎機能改善作用を発揮する38。短鎖脂肪酸や酪酸を豊富に含む糞便微生物叢の移植による疾患治療への直接効果を探る研究が行われている56。本研究でも、BBRアップした酪酸を直接導入することで、CKDに対する治療効果を得ることができました。そして、短鎖脂肪酸の枯渇がCKDの腎臓障害を悪化させることもわかった。抗生物質投与群では、腸内細菌叢の構造が完全に乱れていた。抗生物質の3剤併用により、腸内細菌叢によるp-クレゾール産生は減少したが、同時に酪酸の産生も著しく阻害されたため、抗生物質投与群の動物が腎機能を著しく低下させ死亡したものと思われる。したがって、腸内細菌叢に基づくCKD介入は、腸由来の尿毒症毒素を枯渇させながら、短鎖脂肪酸の産生を保護することに取り組む必要がある。
さらに、抗生物質自体にも神経毒性、凝固障害、腎毒性、低血糖、血液毒性などさまざまな副作用があることが示されている57。腎不全患者には消化管運動の低下や尿毒症性胃不全がしばしば認められるが、これは腸管初回通過代謝または薬剤の排出(P糖タンパク質が介在)が低下して、いくつかの薬剤の生体利用能が増加することを反映していると報告されている58、59。一方、腎不全患者は筋肉量や皮下脂肪が減少していることが多く、この両者が抗生物質の分布量を減少させることがある60。また、p-インドキシル硫酸塩のようなネフロトキシンは血清アルブミンを占有するため、抗生物質の腎クリアランスにさらに影響を及ぼす。そして腎不全は、肝臓、腸、腎臓の主要な酵素系を阻害することにより、抗生物質の代謝に影響を与える60。以上のことから、抗生物質の体内蓄積はさらに進み、CKDの病態生理を悪化させる可能性がある。したがって、CKDの経過における抗生物質の使用には、特別な注意が必要である。
腸内細菌叢に基づくCKDの介入において、プロバイオティクスの使用はしばしば予期せぬ効果をもたらすことがある。本研究では、宿主の免疫力を調節し、心血管の健康を改善することができるとよく報告されているプロバイオティクス株であるL. rhamnosusを主に使用した61, 62, 63. 主なメカニズムは、ほとんどが短鎖脂肪酸の産生に関連していた。L. rhamnosusを使用すると、CKDモデルの糞便中の酪酸含有量の減少が回復した。さらに、L. rhamnosusは、TMAOレベルおよびCD4+ T細胞誘導型I型炎症を制御することが報告されており、これはCKD63の発症を緩和することに寄与すると考えられている。また、L. rhamnosusは、Candida albicansの病原性を低下させることが報告されており、その際、C. albicansのエネルギー代謝が変化し、病原性関連遺伝子が異常制御されることが報告されている64。また、L. rhamnosusの導入により腸壁の完全性が改善され65、腎毒素の漏出がさらに減少すると考えられる。さらに、BBRと酪酸またはL. rhamnosusの組み合わせは、将来的にCKDの治療への介入となる可能性があります。
アミノ酸由来の尿毒症毒素は、腸内細菌のさまざまな酵素によって代謝される必要がある。Clostridiumは、フェノール産生菌の主要な属である52。Clostridiumの中には、アミノ酸を唯一の炭素源としてフェノールを生成することができるものがある。Clostridium属の主なチロシン最終生成物には、フェノール、p-クレゾール、4-ヒドロキシフェニル酢酸(p-クレゾールの前駆体)16がある。本研究では、BBRのクロストリジウム属菌に対する直接的な殺傷・抑制効果を示したほか、腸内細菌の培養系においてp-クレゾールおよび4-ヒドロキシフェニル酢酸などのp-クレゾール前駆体の生成を抑制したことから、BBRがアミノ酸由来の尿毒症毒素の生成を媒介する腸内細菌の代謝酵素にも影響を与えている可能性が考えられた。p-クレゾールの生成経路は、大きく分けて2つある。第一の経路は、チロシンからチロシンリアーゼ(ThiH)を介してp-クレゾールに直接代謝されることを指します。もう一つは、チロシンアミノトランスフェラーゼB(TyrB)、フェニル乳酸脱水素酵素(FldH)、フェニル乳酸脱水酵素(FldBC)などの酵素を経由し、チロシンが順次4-ヒドロキシフェニル酢酸に代謝され、最後にp-クレゾール52に代謝されます。クロストリジウムのp-クレゾール代謝は主に後者の経路に関与しており、BBRがp-クレゾールと4-ヒドロキシフェニル酢酸の生成を阻害することと対応する。PICRUStを用いて、BBRが腸内細菌叢におけるトリプトファン代謝経路およびチロシン代謝経路に関与する酵素の相対存在量を減少させることを明らかにした。そして、TyrB(主にチロシンを仲介して4-ヒドロキシフェニルピルビン酸を生成する)の相対量が、BBRの作用下で減少することが判明した。さらに、BBRとTyrBの仮想分子ドッキングにより、アミノ酸由来の尿毒症毒素の生成を媒介する腸内細菌の代謝酵素に対するBBRの効果が期待できることも証明された。
また、本研究では、BBRの介入により、腎毒素である血漿中TMAOが減少することを見出した。最近、TMAOも腸内細菌叢由来であることが判明した28,31。動物におけるBBRの経口投与は、腸内細菌叢のコリン-トリメチルアミンリアーゼおよびフラビン含有モノオキシゲナーゼの酵素/共酵素との相互作用を通じて、腸におけるTMAO生合成を低下させた。そして、この作用は、ジヒドロベルベリン(腸内細菌叢のニトロレダクターゼによるBBRの還元代謝物)により、コリン-TMA(トリメチルアミン)-TMAO生成経路をダウンレギュレートするビタミン様作用を介して行われていた。さらに、動脈硬化患者におけるTMAおよびTMAOは、BBR31を4ヶ月間摂取した後、糞便中で38%および29%、血漿中で37および35%減少した。
さらに、生体内ではBBR投与4週間後に糞便中のインドールの減少傾向がみられた。そして、血漿中のインドキシル硫酸の含量もBBRによってダウンレギュレーションされた。したがって、BBRはインドキシル硫酸の生成または排泄に影響を与え、BBRが腸内細菌叢のトリプトファン代謝酵素の存在量を減少させたことから、腸内細菌叢のトリプトファン-インドール-インドキシル硫酸経路に影響を与える可能性があると推察されます。インドキシル硫酸の制御に関するBBRのメカニズムを解明するためには、さらなる研究が必要である。
Rhizoma Coptidisは何千年も前から使用されており、BBRと同様にその安全性は証明されている。腸内フローラに対するそのユニークな作用機序は、古い薬剤の新たな利用、特に腸内フローラに基づく介入の開発に大きな可能性を与える。以上より、BBRの腸内細菌に対する強い調節作用に基づき、CKDにおけるBBR介入の可能性を提案した。BBR群、BBRが短鎖脂肪酸の産生を促進することが多くの研究で報告されている酪酸ナトリウム群37、プロバイオティクス糞便移植(CKDへの介入の可能性があり、L. rhamnosusは酪酸を産生すると報告されている)を設け、BBRのCKDに対する腎保護作用を評価した。BBRは、アミノ酸由来の尿毒症毒素、特にチロシン-p-クレゾール-硫酸-p-クレゾール経路の産生を有意に抑制することができます。また、BBRのユニークなスペクトルは、フェノール産生クロストリジウムの存在量を減少させ、短鎖脂肪酸産生菌の存在量を増加させた。g_Clostridium_sensu_stricto_1は、CKD治療におけるBBRの主要有効性ターゲットとなり得る。以上の結果から、BBRはCKDを改善する治療薬となる可能性が示唆された(図7)。また、BBRが腸-腎臓軸に作用するメカニズムを新たに発見したことは、難吸収性天然医薬品の研究に新たなヒントを与えると考えられる。
ダウンロード : 高解像度画像ダウンロード(693KB)
ダウンロード フルサイズ画像をダウンロードする
図7. BBRは、腸内細菌叢によるp-クレゾールなどのネフロトキシンの代謝を制御することにより、腸-腎臓軸を通じてCKDを改善することができます。結論
本研究では、CKDに対するBBRの治療効果について検討し、BBRがCKDにおいて腸管由来の尿毒症毒素を枯渇させ、腸内フローラの構造を改善することが明らかとなった。さらに、BBRは腸内細菌がチロシンを代謝してp-クレゾールを生成するのを抑制することができ、そのメカニズムはBBRによるClostridiumの増殖抑制に関係している可能性がある。以上のことから、本研究では、BBRが腸-腎臓軸を通じてCKDを改善することを初めて示し、BBRがCKDの治療に大きな可能性を持つことが示唆された。
謝辞
本プロジェクトは、中国国家重点研究開発プログラム(No.2022YFA0806400)、CAMS Innovation Fund for Medical Sciences(CIFMS;No.2022-I2M-JB-011、2022-I2M-2-002、2021-I2M-1-007、中国)、中国国家自然科学基金(No.82173888および81973290)、北京非臨床薬剤代謝・PK/PD試験重点実験室(Z1411020044062、中国)から支援されました。技術的な支援を受けた島津製作所(中国)有限公司に感謝したい。
著者貢献
Yan Wang, Jiandong Jiang: 概念化および方法論。Libin Pan, Hang Yu, Yan Wang:原案作成、執筆、レビュー、編集。Jie Fu、Mengmeng Bu:調査。Libin Pan, Hang Yu, Hui Xu, Zhengwei Zhang, Jiachun Hu, Xinyu Yang, Haojian Zhang, Jinyue Lu: Validation. Linbin Pan、Hang Yu、Yan Wang:形式分析。Yan Wang、Jiandong Jiang:監督。
利益相反
著者は利益相反がないことを宣言している。
付録A.補足データ
以下は、本記事のSupplementary dataです:
ダウンロード: アクロバットPDFファイル(1MB)ダウンロード
マルチメディアコンポーネント 1.
おすすめ記事
参考文献
1
H.D. Wang, M. Naghavi, C. Allen, R.M. Barber, Z.A. Bhutta, A. Carter, et al.
世界、地域、国の平均寿命、全死因死亡率、249の死因別死亡率、1980~2015年:世界疾病負担調査2015のための系統分析
Lancet, 388 (2016), pp.1459-1544
Google Scholar
2
T. Liyanage, T. Ninomiya, V. Jha, B. Neal, H.M. Patrice, I. Okpechi, et al.
末期腎臓病の治療への世界的アクセス:システマティックレビュー
Lancet, 385 (2015), pp.1975-1982
PDFを見る記事を見るScopusGoogle Scholarで見る
3
K. ランゲ、M.ブエルガー、A.シュタルマッハ、T.ブリュンス
抗生物質が腸内細菌叢に及ぼす影響
ダイジェスト・ディス, 34 (2016), pp.260-268
CrossRefView in ScopusGoogle Scholar
4
T. ヤン、E.M.リチャーズ、C.J.ペパイン、M.K.ライザダ
高血圧と慢性腎臓病における腸内細菌叢と脳腸腎臓軸の関係
Nat Rev Nephrol, 14 (2018), pp. 442-456
CrossRefView in ScopusGoogle Scholar
5
G.P.ホビー、O.カラドゥタ、G.F.デュシオ、M.シン、B.L.ジバイロフ、J.M.アルトゥール
慢性腎臓病と腸内細菌叢
Am J Physiol Renal Physiol, 316 (2019), pp.F1211-F1217
CrossRefView in ScopusGoogle Scholar
6
J. Rysz, B. Franczyk, J. Ławiński, R. Olszewski, A. Ciałkowska-Rysz, A. Gluba-Brzózka
CKDが尿毒症毒素と腸内細菌叢に与える影響について
トキシン、13(2021)、252頁
CrossRefView in ScopusGoogle Scholar
7
A. ラメザニ、D.S.ラジ
腸内細菌叢、腎臓病、そして標的介入
J Am Soc Nephrol, 25 (2014), pp.657-670.
ScopusGoogle Scholarで見る
8
D.Y.ガイトンデ、D.L.クック、I.M.リベラ
慢性腎臓病:発見と評価
Am Fam Physician, 96 (2017), pp.776-783.
Google Scholar
9
P.A. Aronov, F.J. Luo, N.S. Plummer, Z. Quan, S. Holmes, T.H. Hostetter, et al.
尿毒症性溶質に対する大腸の寄与
J Am Soc Nephrol, 22 (2011), pp.1769-1776
ScopusGoogle Scholarで見る
10
E. 三島、福田 聡、武川 慈、由利 敦、金光 洋一、松本 洋一、et al.
CE-TOFMSを用いたメタボローム解析による尿毒症性溶質蓄積に対する腸内細菌叢の影響評価
Kidney Int, 92 (2017), pp.634-645.
PDFを見る記事を見るScopusGoogle Scholarで見る
11
R. ヴァンホルダー、E・シェパース、A・プレティンク、E・V・ナグラー、G・グロリュウ
インドキシル硫酸およびp-クレジル硫酸の尿毒症毒性:システマティックレビュー
J Am Soc Nephrol, 25 (2014), pp.1897-1907
ScopusGoogle Scholarで見る
12
C. プラタ、C.クルス、L.G.セルバンテス、V.ラミーレス
腸内細菌叢と慢性腎臓病との関連性
Int Urol Nephrol, 51 (2019), pp.2209-2226
CrossRefView in ScopusGoogle Scholar
13
C. コソラ、M.T.ロケッティ、A.サバティーノ、E.フィアッカドリ、B.R.ディイオリオ、L.ゲシュアルド
CKDにおける微生物叢の問題:腸を標的としたアプローチはどれくらい有望か?
J Nephrol, 32 (2019), pp.27-37
CrossRefView in ScopusGoogle Scholar
14
A. Pletinck, G. Glorieux, E. Schepers, G. Cohen, B. Gondouin, M. Van Landschoot, et al.
タンパク質結合型尿毒症毒素は白血球と血管壁とのクロストークを刺激する
J Am Soc Nephrol, 24 (2013), pp.1981-1994
ScopusGoogle Scholarで見る
15
H. 渡辺秀樹、宮本雄一、本田大輔、田中秀樹、Q.Wu、遠藤誠、他。
p-クレジル硫酸は、NADPHオキシダーゼの活性化による酸化ストレスの誘導により、腎尿細管細胞障害を引き起こす。
Kidney Int, 83 (2013), pp.582-592
PDFを見る記事を見るGoogle Scholar
16
T. グリプ、R.ヴァンホルダー、M.ヴァネヒュッテ、G.グロリュウ
p-クレジル硫酸塩
トキシン』9号(2017年)、52頁。
CrossRefView in ScopusGoogle Scholar
17
K.P. Patel, F.J. Luo, N.S. Plummer, T.H. Hostetter, T.W. Meyer
ベジタリアンと雑食動物におけるp-クレゾール硫酸およびインドキシル硫酸の生成について
Clin J Am Soc Nephrol, 7 (2012), pp.982-988.
ScopusGoogle Scholarで見る
18
G.ラノ、S.ブルテイ、M.サレ
尿毒症性エンドテリオトキシンである硫酸インドキシル
トキシン、12(2020)、229頁
CrossRefView in ScopusGoogle Scholar
19
M. Posada-Ayala, I. Zubiri, M. Martin-Lorenzo, A. Sanz-Maroto, D. Molero, L. Gonzalez-Calero, et al.
進行期慢性腎臓病患者における尿メタボロームシグネチャーの同定
Kidney Int, 85 (2014), pp.103-111.
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る。
20
W. Zhang, A. Miikeda, J. Zuckerman, X. Jia, S. Charugundla, Z. Zhou, et al.
微生物叢依存性TMAO産生の抑制はマウスの慢性腎臓病を減衰させる
Sci Rep, 11 (2021), p. 518
Google Scholar
21
M. Chi, K. Ma, J. Wang, Z. Ding, Y. Li, S. Zhu, et al.
腎臓病における腸内細菌叢の免疫調節作用について
J Immunol Res, 2021 (2021), Article 5516035
ScopusGoogle Scholarで見る
22
X. Yang、D. Yu、L. Xue、H. Li、J. Du
プロバイオティクスは、微生物叢-腸-脳軸を調節し、老化したSAMP8マウスの記憶障害を改善する
Acta Pharm Sin B, 10 (2020), pp.475-487
PDFを見る記事を見るScopusGoogle Scholarで見る
23
M. ロッシ、D.W.ジョンソン、M.モリソン、E.M.パスコー、J.S.クームス、J.M.フォーブス、他。
シンバイオティクスは腸内細菌学の改善により腎不全を緩和する(シナジー):無作為化試験
Clin J Am Soc Nephrol, 11 (2016), pp.223-231.
ScopusGoogle Scholarで見る
24
A.S. Devlin, A. Marcobal, D. Dodd, S. Nayfach, N. Plummer, T. Meyer, et al.
腸内細菌叢の合理的な遺伝子操作による循環性尿毒症溶質の制御
Cell Host Microbe, 20 (2016), pp.709-715
PDFを見る記事を見るScopusGoogle Scholarで見る
25
M. イメンシャヒディ、H.ホセインザデ
ベルベリス・ブルガリスとベルベリン:アップデートレビュー
Phytother Res, 30 (2016), pp. 1745-1764
CrossRefView in ScopusGoogle Scholar
26
Y. Zhang, Y. Gu, H. Ren, S. Wang, H. Zhong, X. Zhao, et al.
ベルベリンとプロバイオティクスの2型糖尿病に対する腸内細菌関連効果(PREMOTE試験)。
Nat Commun, 11 (2020), p. 5015
ScopusGoogle Scholarで見る
27
W. Jing, S. Dong, X. Luo, J. Liu, B. Wei, W. Du, et al.
ベルベリンは、微生物のトリプトファン異化物によるAhR活性化をトリガーとして大腸炎を改善する
Pharmacol Res, 164 (2021), 記事 105358
PDFを見る記事を見るScopusGoogle Scholarで見る
28
X. Li, C. Su, Z. Jiang, Y. Yang, Y. Zhang, M. Yang, et al.
ベルベリンは腸内細菌叢を操作してトリメチルアミンおよびトリメチルアミン-N-オキシド産生を抑制することによりコリン誘発アテローム性動脈硬化症を減弱させる
NPJ バイオフィルム・マイクロバイオーム, 7 (2021), p. 36
Google Scholar
29
G. Tang, S. Li, C. Zhang, H. Chen, N. Wang, Y. Feng
糖尿病性腎症の治療と管理における漢方薬の臨床効果、基礎メカニズム、分子標的について
Acta Pharm Sin B, 11 (2021), pp.2749-2767
PDFを見る記事を見るScopusGoogle Scholarで見る
30
K. Wang, X. Feng, L. Chai, S. Cao, F. Qiu
ベルベリンの代謝とその薬理作用への寄与について
Drug Metab Rev, 49 (2017), pp. 139-157
CrossRefView in ScopusGoogle Scholar
31
S.R. Ma, Q. Tong, Y. Lin, L.B. Pan, J. Fu, R. Peng, et al.
ベルベリンは腸内細菌叢のコリン-TMA-TMAO産生経路を抑制するビタミン様作用によりアテローム性動脈硬化を治療する
Signal Transduct Target Ther, 7 (2022), p. 207
ScopusGoogle Scholarで見る
32
Y. Wang, Q. Tong, S.R. Ma, Z.X. Zhao, L.B. Pan, L. Cong, et al.
ベルベリン経口投与による腸内細菌叢の制御による脳内ドーパ/ドーパミンレベルの改善とパーキンソン病改善効果
Signal Transduct Target Ther, 6 (2021), p.77.
PDFを見る記事を見るGoogle Scholar
33
Y. Wang, Q. Tong, J.W. Shou, Z.X. Zhao, X.Y. Li, X.F. Zhang, et al.
ベルベリンによる腸内細菌叢を介した高脂血症の個別化治療法
Theranostics, 7 (2017), pp. 2443-2451
CrossRefView in ScopusGoogle Scholar
34
S. ハブテマリアム
ベルベリン薬理学と腸内細菌叢:隠された治療的関連性
Pharmacol Res, 155 (2020), Article 104722
PDFを見る記事を見るScopusGoogle Scholarで見る
35
Z. Xie, X. Liu, X. Huang, Q. Liu, M. Yang, D. Huang, et al.
ベルベリンによる腸内細菌叢のリモデリングはトリメチルアミンN-オキシド誘発血小板過敏反応と血栓形成を抑制する
Eur J Pharmacol, 911 (2021), Article 174526
PDFを見る記事を見るScopusGoogle Scholarで見る
36
H. 李、C.ファン、H.ルー、C.フェン、P.ヘ、X.ヤン、他。
腸管グリア細胞-腸管上皮細胞-免疫細胞の相互作用を調節することによる潰瘍性大腸炎に対するベルベリンの保護的役割
Acta Pharm Sin B, 10 (2020), pp.447-461
PDFを見る記事を見るScopusGoogle Scholarで見る
37
Y. Wang, J.W. Shou, X.Y. Li, Z.X. Zhao, J. Fu, C.Y. He, et al.
ベルベリンによる腸内細菌叢の生理活性代謝物のエネルギー代謝改善効果
メタボリズム』70号(2017年)、72-84頁
PDFを見る記事を見るCrossRefGoogle Scholar
38
L.-Z. リー、S.-B. Tao, L. Ma, P. Fu
腎臓疾患における短鎖脂肪酸の役割
Chin Med J, 132 (2019), pp.1228-1232
CrossRefView in ScopusGoogle Scholar
39
S. Tungsanga, P. Katavetin, W. Panpetch, K. Udompornpitak, W. Saisorn, K. Praditpornsilpa, et al.
Lactobacillus rhamnosus L34は、抗炎症分子の排泄を通じて5/6腎摘出マウスモデルにおける慢性腎臓病の進行を抑制する
Nephrol Dial Transpl, 37 (2022), pp.1429-1442
CrossRefView in ScopusGoogle Scholar
40
Y.S. Tsai, Y.P. Chen, S.W. Lin, Y.L. Chen, C.C. Chen, G.J. Huang
Lactobacillus rhamnosus GKLC1は、細胞の炎症とアポトーシスを抑制することによりシスプラチン誘発慢性腎毒性を改善する
Biomed Pharmacother, 147 (2022), Article 112701
PDFを見る記事を見るScopusGoogle Scholarで見る
41
P.J.ターンボー、R.E.レイ、M.A.マホワルド、V.マグリニ、E.R.マーディス、J.I. Gordon
エネルギー収穫の能力が向上した肥満関連腸内細菌叢
ネイチャー, 444 (2006), pp.1027-1031
CrossRefView in ScopusGoogle Scholar
42
E. 佐藤、細見和彦、関本明彦、三島英樹、大江裕子、三枝大介、他。
経口吸着剤AST-120の糞便中p-クレゾールおよびインドール濃度と腸内細菌叢組成に及ぼす影響
Biochem Biophys Res Commun, 525 (2020), pp.773-779.
PDFを見る記事を見るScopusGoogle Scholarで見る
43
C. Ji, Y. Li, Y. Mo, Z. Lu, F. Lu, Q. Lin, et al.
ルバーブ浣腸は慢性腎臓病ラットの腸内細菌叢の変化を伴う循環トリメチルアミンN-オキシドレベルの低下と腎線維症の改善をもたらす
Front Pharmacol, 12 (2021), Article 780924
ScopusGoogle Scholarで見る
44
K. 菊池紘一、三枝大輔、金光洋一、松本祐一、田内朋子、鈴木直樹、他.
糖尿病性腎臓病における腸内細菌由来のフェニル硫酸のアルブミン尿への寄与
Nat Commun, 10 (2019), p. 1835
ScopusGoogle Scholarで見る
45
S. 姜、謝、D. Lv、Y. Zhang、J. Deng、L. Zeng, et al.
酪酸産生種Roseburia spp.とFaecalibacterium prausnitziiの減少は、慢性腎臓病の進行と関連する
アントニー・ヴァン・レーウェンフック, 109 (2016), pp.1389-1396
CrossRefView in ScopusGoogle Scholar
46
Y. 齋藤、佐藤、野本、辻秀樹
チロシンおよびその代謝物を添加した培地によるフェノールおよびp-クレゾール産生腸内細菌の同定
FEMS Microbiol Ecol, 94 (2018), p. fiy125
ScopusGoogle Scholarで見る
47
T. Gryp, K. Faust, W. Van Biesen, G.R.B. Huys, F. Verbeke, M. Speeckaert, et al.
慢性腎臓病の進行期において、腸内細菌のプロファイリングによりButyricicoccusの存在量が少ないことが明らかになった。
J Personal Med, 11 (2021), p. 1118
CrossRefView in ScopusGoogle Scholar
48
L. Ma, Y. Ni, Z. Wang, W. Tu, L. Ni, F. Zhuge, et al.
スペルミジンは食事誘発性肥満マウスの腸管バリア完全性と腸内細菌叢機能を改善する
腸内細菌, 12 (2020), pp.1-19.
CrossRefGoogle Scholar
49
S. Facchin、N. Vitulo、M. Calgaro、A. Buda、C. Romualdi、D. Pohl、et al.
炎症性腸疾患患者における酪酸ナトリウムのマイクロカプセル化による微生物相の変化
Neurogastroenterol Motil, 32 (2020), Article e13914
ScopusGoogle Scholarで見る
50
K. Machiels, M. Joossens, J. Sabino, V. De Preter, I. Arijs, V. Eeckhaut, et al.
潰瘍性大腸炎患者における酪酸産生種Roseburia hominisおよびFaecalibacterium prausnitziiの減少が、ディスバイオシスを規定する
ガット, 63 (2014), pp. 1275-1283
CrossRefView in ScopusGoogle Scholar
51
G.M. Douglas, V.J. Maffei, J.R. Zaneveld, S.N. Yurgel, J.R. Brown, C.M. Taylor, et al.
メタゲノム機能予測のためのPICRUSt2
Nat Biotechnol, 38 (2020), pp.685-688
CrossRefView in ScopusGoogle Scholar
52
D. Dodd, M.H. Spitzer, W. Van Treuren, B.D. Merrill, A.J. Hryckowian, S.K. Higginbottom, et al.
腸内細菌経路が芳香族アミノ酸を代謝し、9種類の循環代謝産物に変化させる
ネイチャー, 551 (2017), pp.648-652
CrossRefView in ScopusGoogle Scholar
53
N.D. Vaziri, J. Wong, M. Pahl, Y.M. Piceno, J. Yuan, T.Z. DeSantis, et al.
慢性腎臓病は腸内細菌叢を変化させる
Kidney Int, 83 (2013), pp.308-315
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る。
54
H.Q. Zhu, X.L. Tang, R.C. Zheng, Y.G. Zheng
Morganella morganii由来チロシンフェノールリアーゼの精製と生化学的特性評価
Appl Biochem Biotechnol, 192 (2020), pp. 71-84
CrossRefView in ScopusGoogle Scholar
55
M.Y. Lin, M.R. de Zoete, J.P. van Putten, K. Strijbis
短鎖脂肪酸によるヒストン脱アセチル化酵素の阻害を介した上皮性免疫応答の再編成
Front Immunol, 6 (2015), p. 554
ScopusGoogle Scholarで見る
56
R. R. Chen, Y. Xu, P. Wu, H. Zhou, Y. Lasanajak, Y. Fang, et al.
短鎖脂肪酸と酪酸を豊富に含む糞便微生物群の移植は、腸内細菌叢を制御して脳虚血性脳卒中を治療する
Pharmacol Res, 148 (2019), Article 104403
PDFを見る記事を見るScopusGoogle Scholarで見る
57
F.A. マニアン、W.J. ストーン、R.H. アルフォード
腎不全に伴う抗生物質の副作用について
Rev Infect Dis, 12 (1990), pp.236-249
CrossRefView in ScopusGoogle Scholar
58
J. カッペル、P.カリッシ
腎臓内科:3.腎不全患者への安全な薬物処方のために
Can Med Assoc J, 166 (2002), pp.473-477.
ScopusGoogle Scholarで見る
59
V. ピシェット、F.A.ルブロン
慢性腎不全における薬物代謝
Curr Drug Metab, 4 (2003), pp.91-103
CrossRefView in ScopusGoogle Scholar
60
K.M. Chow, C.C. Szeto, A.C. Hui, P.K. Li
腎不全における抗生物質の神経毒性のメカニズム
Int J Antimicrob Agents, 23 (2004), pp.213-217.
PDFを見る記事を見るScopusGoogle Scholarで見る
61
M.C. Chiang, C.L. Chen, Y. Feng, C.C. Chen, R. Lien, C.H. Chiu
極早産児のプロバイオティクス療法に伴うLactobacillus rhamnosus敗血症:病態と臨床医へのレビュー
J Microbiol Immunol Infect, 54 (2021), pp.575-580.
PDFを見る記事を見るScopusGoogle Scholarで見る
62
L. Sapra, H.Y. Dar, A. Bhardwaj, A. Pandey, S. Kumari, Z. Azam, et al.
ラクトバチルス・ラムノサス菌はOvxマウスにおいてTreg-Th17細胞バランスを歪めることにより骨損失を減衰させ、骨の健康を維持する
Sci Rep, 11 (2021), p. 1807
ScopusGoogle Scholarで見る
63
J. Liu、T. Li、H. Wu、H. Shi、J. Bai、W. Zhao、et al.
Lactobacillus rhamnosus GG株は、TMAOレベルおよびCD4+ T細胞誘導型I炎症を制御することにより、高塩分食における閉塞性睡眠時無呼吸症候群誘発高血圧の発症を軽減した。
Biomed Pharmacother, 112 (2019), Article 108580
PDFを見る記事を見るScopusGoogle Scholarで見る
64
R. アロンソ-ロマン、A.ラスト、M.H.ミルハッカク、J.L.スプラグ、L.メラー、P.グロースマン、他。
Lactobacillus rhamnosusのコロニー形成は、病原性を損なう代謝的適応を強いることでCandida albicansと拮抗する
Nat Commun, 13 (2022), p. 3192
ScopusGoogle Scholarで見る
65
T.E. Riehl, D. Alvarado, X. Ee, A. Zuckerman, L. Foster, V. Kapoor, et al.
Lactobacillus rhamnosus GGは、リポテイコ酸の放出、マクロファージの活性化、間葉系幹細胞の移動を通じて、放射線障害から腸管上皮を保護する
Gut, 68 (2019), pp.1003-1013
CrossRefView in ScopusGoogle Scholar
引用元: (0)
中国医薬学会および中国医科学研究院マテリアメディカ研究所の責任において査読を行った。
†
これらの著者は、本作品に等しく貢献した。
© 2022 Chinese Pharmaceutical Association and Institute of Materia Medica, Chinese Academy of Medical Sciences. 制作とホスティングはElsevier B.V.が担当。
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告を出す
お問い合わせ・サポート
ご利用条件
個人情報保護方針
当社は、サービスの提供や強化、コンテンツや広告のカスタマイズのためにCookieを使用しています。継続することで、クッキーの使用に同意することになります。
著作権 © 2023 Elsevier B.V.またはそのライセンサーもしくは貢献者。ScienceDirect® は、Elsevier B.V. の登録商標です。
この記事が気に入ったらサポートをしてみませんか?
