神経変性疾患における腸内細菌メタボロームとディスバイオシス: 治療アプローチとしてのサイコバイオティクスと糞便微生物叢移植-包括的総説
MDPIオープンアクセスジャーナル
zoom_out_map検索メニュー
ジャーナル IJMS 24巻 17号 10.3390/ijms241713294
設定論文別刷り注文
オープンアクセス総説
神経変性疾患における腸内細菌メタボロームとディスバイオシス: 治療アプローチとしてのサイコバイオティクスと糞便微生物叢移植-包括的総説
https://www.mdpi.com/1422-0067/24/17/13294
by Sara Uceda 1,*ORCID,Víctor Echeverry-Alzate 1ORCID,Manuel Reiriz-Rojas 1ORCID,Esther Martínez-Miguel 2ORCID,Ana Pérez-Curiel 2ORCID,Silvia Gómez-Senent 2 andAna Isabel Beltrán-Velasco 3,*ORCID
1
ネブリハ大学生命自然科学部心理学科BRABEグループ、28240マドリード、スペイン
2
ネブリハ大学生命自然科学部保健学科、28240マドリード、スペイン
3
ネブリハ大学生命自然科学部心理学科、28240マドリード、スペイン
*
著者名:Int.
Int. J. Mol. Sci. 2023, 24(17), 13294; https://doi.org/10.3390/ijms241713294
受理:2023年7月31日 受理:2023年7月31日 / 改訂:2023年8月22日 / 受理:2023年8月25日 / 掲載:2023年8月27日
(この論文は、特集「脳と心の疾患における微生物叢-腸-脳軸の調節」に属しています。)
ダウンロード 図の閲覧 バージョン ノート
要旨
本研究で行った包括的な叙述的総説は、ヒト生物における分子レベルでのコミュニケーションと作用のメカニズムについて掘り下げている。この総説では、微生物叢-腸-脳軸に関与する複雑なメカニズムや、神経変性疾患患者における微生物組成の変化が意味するものを取り上げている。神経細胞の損失や死滅を伴う神経変性疾患の病態生理を分析するとともに、微生物叢-腸-脳軸を介した双方向コミュニケーションに関与する主要代謝産物の作用機序についても述べている。さらに、これらの病態における神経変性に関連した症状を軽減する機会として、糞便微生物叢移植による腸内微生物叢の再構築や、プレバイオティクスおよびプロバイオティクスであるサイコバイオティクスの使用を標的とした介入が評価されている。この総説は貴重な情報を提供し、神経変性疾患の治療において取り組むべき神経生物学的メカニズムの理解を促進するものである。
キーワード:神経変性疾患;微生物叢;ディスバイオシス;代謝産物;介入;プレバイオティクス;プロバイオティクス;サイコバイオティクス;糞便微生物移植
はじめに
1.1. 微生物叢と神経変性
神経変性疾患の分類の中には、少なくとも100の異なる病態があり、それらは特異的な症状を呈するが、最もよくみられるのはアルツハイマー病(AD)、パーキンソン病(PD)、筋萎縮性側索硬化症(ALS)、多発性硬化症(MS)である。アルツハイマー病の患者数は5,500万人以上と推定され、PDの有病率はここ数十年で著しく増加し、世界中で900万人近くが罹患している。MSは世界で約300万人が罹患している。ALSに関しては、一般人口における発症率は世界で10万人あたり5人である。これらのデータはすべて、神経変性疾患の影響がかなり大きくなっていることを示すとともに、生活の質が低下する年数も増加していることを示している[1,2,3]。
一方、微生物叢とそのさまざまな代謝過程への関与に関する理解は、長年にわたって科学界からの関心が高まっており、特にこれらの過程と神経変性疾患への関与に関する研究が注目されている。現在では、脳が視床下部-下垂体-副腎軸や自律神経系(ANS)と連動して腸の機能を調節していることが知られている[4,5]。さらに腸は、腸管ホルモンや神経活性化合物として、微生物叢が産生する様々な代謝産物が関与する中枢神経系(CNS)の特定の機能を調節し、腸神経系(ENS)、循環系、迷走神経、免疫系を伝播して脳に到達する [6,7]。このコミュニケーションの連鎖が、いわゆる微生物叢-腸-脳軸を形成しており、そこには1013~1014個の生きた微生物が存在すると推定されている。したがって、この微生物叢-腸-脳軸は、神経細胞、神経免疫、内分泌、代謝シグナルからなる双方向コミュニケーション経路である [8,9,10]。
この点に関して、微生物叢の組成の変化が、肥満、ある種の精神疾患、中枢神経系疾患、胃疾患、神経変性疾患などの複数の病態と関連していることが知られており、これらの患者では非常に特異的な微生物プロファイルが見られる [11] 。微生物由来の物質は、微生物叢-腸-脳軸に沿って自由に循環しており、有害物質の通過と、生体のさまざまな経路やシステムにおけるそれらの伝播を可能にしている。まさにこの軸を介した絶え間ないコミュニケーションにより、腸を保護し、調節軸への病原性物質の侵入を妨げることを目的として、微生物叢を治療の機会、神経変性疾患における介入の治療標的として考えることが可能になる [12] 。
したがって、この包括的な叙述的レビューの主な目的は以下の通りである: (i)神経変性疾患の病因における腸内細菌叢(GM)、そのディスバイオシス、および微生物メタボロームの役割を分析すること、(ii)治療アプローチとしてのサイコバイオティクスと糞便微生物叢移植の利用法を探ることである。
1.2. 検索方法
この文献レビューを行うために、この研究分野の最新情報を含むさまざまなデータベース、すなわちWoS(Web of Science)、PubMed、ScienceDirect、Cochrane(Wiley)、Scopusを参照した。検索は、各病態名(アルツハイマー病、パーキンソン病、多発性硬化症、筋萎縮性側索硬化症)に加え、本論文のキーワードである神経変性疾患、マイクロバイオータ、ディスバイオシス、代謝産物、介入、プレバイオティクス、プロバイオティクス、サイコバイオティクス、糞便微生物移植を用いて行った。MeSHガイドラインに従ったため、参照した文献の妥当性が確保された。検索期間は2000年から2023年の間に発表された論文に限定し、このレビューに含まれる情報の適時性と妥当性を保証した。とはいえ、この研究分野の研究の背景と初期データを提供する目的で、これらの日付以前の論文もごく少数含まれている。
著者らは、参照したすべての論文のタイトルと抄録を入念に校閲した。除外基準は、過去のレビュー [13,14,15] の手順に従って適用した:(i)分析対象期間外の研究、(ii)レビューの範囲外で発表されたテーマ、(iii)書籍、会議録、博士論文、抄録。科学的方法論基準に準拠し、本レビューのサブセクションから関連する情報を得た研究はすべて使用した。最も適切な論文が特定されると、著者は最も重要な結果を抽出するために個別に作業を開始した。情報の処理は総説の著者全員で行い、最終的に、選択された論文は、共有の視点をもって情報の厳密性を維持することができる本論的総説を書くために議論された。まさにこの目的のために、得られた知見がプールされ、情報が議論され、統合される会議が開催された。このチームワークのプロセスは、情報の統合を促進し、本研究におけるデータの一貫性を保証した。神経変性疾患における微生物叢-腸-脳軸: 微生物メタボロームの役割
2.1. エビオーシスとディスバイオシス
ヒトには非常に多くの微生物が存在し、ヒトの生体に不可欠な生態系を形成していることが知られている[16]。およそ1億の細菌と300以上の異なる種が存在し、生物が適切に機能するためのさまざまな機能を備えていると推定されている [8,17]。微生物が発生するのに理想的な組織は、皮膚、口腔、膣管などいくつかあるが、これらの細菌の95%が存在するのは消化管である [18]。これらの細菌は、栄養素を正しく吸収するために不可欠であり、腸粘液の防御バリアとして機能している。これにより、病原性細菌やウイルスが増殖しないようになっている [19,20] 。
腸内細菌叢に変化が生じたり、あるいは腸内細菌叢が消失したりすると、腸内細菌叢異常症と呼ばれる [21] 。このアンバランスは、炎症プロセス、自己免疫疾患、多量のタンパク質と低量の食物繊維を含む不健康な食事、慢性的なストレス状況、薬物乱用、メトホルミン、非ステロイド性抗炎症薬、オピオイド、スタチンなどの薬理学的治療などによって決定されることがある [22,23,24] 。抗生物質の使用は、生体の微生物叢を変化させ、遺伝子発現やタンパク質活性に影響を与えるだけでなく、内分泌系、代謝系、免疫系の機能をも変化させることを強調することは重要である [25,26] 。
ディスバイオーシスが現れると、必ずしも消化器系の症状とは限らないが、非常に多様な症状が観察される [27] 。最も頻度が高いのは、筋肉障害、関節障害、皮膚障害、頭痛や片頭痛、過敏性、睡眠障害、慢性疲労、消化器系の不快感(下痢の急性エピソード、胃ガス、腹部膨満感、脂肪性下痢、憩室炎、ビタミンB12欠乏症、過敏性腸症候群など)である [27,28] 。
腸内細菌叢の異常が疑われる場合は、腸内細菌叢を定量化するために、便培養による分析のために糞便サンプルを採取する必要がある [29] 。患者の微生物叢が健康であるか保たれている(eubiosis)場合、大腸菌、腸球菌属、乳酸桿菌属、ビフィズス菌、バクテロイデス属、プレボテラ属などの微生物が適切な濃度で観察される [30,31,32]。しかし、IMO(腸内メタン菌過繁殖)、LIBO(大腸内細菌過繁殖)、SIFO(小腸内真菌過繁殖)、LIFO(大腸内真菌過繁殖)など、罹患する腸の部位によって異なるタイプのディスバイオーシスが存在するが、これらはすべてSIBO(小腸内細菌過繁殖)として知られている[33]。上記の全てに共通するのは、例えば大腸から小腸への細菌の移動が、毒素や腸内ガスの出現を促進するということである [33,34,35] 。
近年、ヒトマイクロバイオームの研究が大きく進展している。この用語は、微生物とその遺伝子や代謝産物の集合を指す[36]。メタゲノミクスも同様で、バクテリアの遺伝物質を分析することで、生物学的サンプルを通してバクテリアの同定を可能にしている[37]。これらの進歩により、腸内細菌叢の30%とその遺伝子を同定できるようになったが、そのすべてが培養可能というわけではない。こうして現在では、ヒトの腸内細菌叢は1000種以上の微生物によって形成されており、その遺伝子数はヒトゲノムの150倍にも及ぶことが知られている。ヒトの腸内に生息するこの膨大な数の微生物の中で、最も注目すべきは、全体の約90%を占めるファーミキューテス門とバクテロイデーテス門の細菌である。その他、放線菌、プロテオバクテリア、ベルコミクレビアといった細菌も腸内細菌に含まれる。細菌以外にも、腸内細菌叢は古細菌、ウイルス、真菌、原生動物などの微生物で構成されている[40,41,42](図1参照)。
Ijms 24 13294 g001図1. 腸内細菌叢の組成。細菌、古細菌、真核生物、ウイルスを含む主な腸内細菌組成。
微生物叢に影響を与える要素はいくつかあり、遺伝と各人の食生活が決定要因となっている [43] 。ここ数十年、微生物叢の変化に関連する病態に関して大きな進歩があり、様々な病態におけるこの微生物叢異常の悪影響を決定することができるようになっている [44] 。微生物叢は免疫系の反応と密接な関係があり、微生物量の減少は先進社会の衛生習慣に影響されることも知られている [45,46] 。同様に、1型糖尿病、肥満、アレルギー、喘息などの炎症性疾患の発症率や有病率を研究する際にも、食事はこの反応を説明する上で重要な要素となる。脂肪と糖分に富み、食物繊維の少ない、いわゆる欧米型の食事は、微生物叢に変化をもたらすが [48]、最近の研究では、このような食事がマウスの微生物組成にどのような変化をもたらすかが、1日で明らかになった。これらのマウスでは、2週間で脂肪が増加し、代謝経路に変化が見られた。具体的には、ファーミキューテス属の増加とバクテロイデーテス属の減少が見られた [49,50]。一方、浸透圧性下剤を食事に混ぜても同じ結果が得られたことから、食物繊維を食事に取り入れることは、腸の通過速度に関連している可能性がある [51] 。
免疫および炎症反応に関しては、微生物叢は、リポ多糖類(LPS)、脂質、リポ蛋白質などの病原体関連分子パターン(PAMPs)と呼ばれる抗原を介して、適応機能を発揮する [52] 。PAMPsとパターン認識レセプターの相互作用は、免疫反応を活性化するインターフェロンやサイトカインの産生を促進する。この意味で、発展途上国の小児と先進国の小児の微生物叢は異なっており、後者ではアレルギーや喘息に関連する病態の診断が増加している一方、発展途上国の小児の微生物叢にはPAMPsが蓄積していないことが正当化されているようである[54]。
2.2. 神経変性疾患におけるディスバイオシス
遺伝子組換えは、上述のように消化管に直接関係する様々な疾患に影響を及ぼすだけでなく、ヒトのマイクロバイオームと精神病理を関連付ける科学的証拠もある。例えば、最近の研究では、気分障害、統合失調症、自閉症などの中枢神経系に関連する疾患や、アルツハイマー病(AD)、パーキンソン病(PD)、多発性硬化症(MS)、筋萎縮性側索硬化症(ALS)、ハンチントン病などの神経変性疾患の発症と維持に、腸内細菌叢が不可欠であることが示されている [55,56,57]。さらに現在では、リーキーガット症候群と呼ばれる腸管透過性の亢進が、病態の特定のマーカーに関係していることがわかっている [58]。
2.2.1. アルツハイマー病
アルツハイマー病(AD)は認知症の最も一般的な病型であり、その発症は、リン酸化タウタンパク質によって形成されるβアミロイドと神経原線維のもつれの蓄積と関連している [59,60] 。軽度行動障害(MBI)とADの関係は、ますます明らかになってきているようである。したがって、MBIは、細菌の多様性の低下、さまざまな有害代謝産物の産生、炎症性サイトカインの直接的活性化、腸管透過性の変化など、さまざまな代謝経路やプロセスによってADの発症に関与している可能性がある。これにより、様々な代謝産物が腸管関門を通過して脳に到達し、神経炎症と脳および海馬の機能障害を引き起こす [61,62,63] 。
現在、さまざまな細菌とADとの関係を強調する研究が数多く行われている。この意味で、AD患者では、プロテオバクテリア(Proteobacteria)およびバクテロイデーテス(Bacteroidetes)門が増加し、ファーミキューテス(Firmicutes)門およびアクチノバクテリア(Actinobacteria)門が減少する [64,65,66]。例えば、クラミジア・ニューモニエ、ボレリア・バーグドルフェリ、トレポネーマ・パリダム、ヘリコバクター・ピロリ、大腸菌、エシェリヒア・シゲラ、スピロヘータ、P. gingivalisなどの微生物が検出されている。gingivalisが一般集団よりもAD患者の脳や脳脊髄液(CSF)中に高い割合で検出される一方、他の菌種、例えばButyrivibrio、Eubacterium Clostridium sp、 Roseburia hominis、Faecalibacterium prausnitziiなどである。このように、ADでは、炎症性細菌の増加と抗炎症性細菌の減少によるGMのディスバイオーシスが見られ、そのすべてが、さまざまな代謝産物(例えば、LPS、トリメチルアミン-N-オキシド、または炎症性サイトカイン)の増加と、酪酸などの他の代謝産物の減少をもたらす。本節では、ADの発症に関与する主な微生物代謝産物について、中枢神経系の機能におけるそれらの作用に焦点を当てて要約する(図2参照)。
ADで変化する代謝産物
ADとトリメチルアミン-N-オキシド
トリメチルアミン-N-オキシド(TMAO)は、コリン、l-カルニチン、ベタインなどの細菌由来代謝物であり、ADの発症に関係している[69,70]。そのため、例えばAD患者では脳脊髄液中のTMAO濃度が高かった。さらに、この体液中にTMAOが存在することは、この代謝物が中枢神経系に到達する能力を持ち、そのため中枢神経系の機能に影響を及ぼす可能性があることを示している [71]。
TMAOの合成には、GMと肝臓の関与が必要である。したがって、最初のステップは、微生物叢がコリン、l-カルニチン、またはベタインからトリメチルアミン(TMA)を合成することである。最後に、肝臓でTMAの酸化によりTMAOが合成される[72,73]。TMAを多く産生する系統には、クロストリジウム属、エシェリヒア属、プロテウス属(ファーミキューテス属とプロテオバクテリア属)があり、これらの細菌が多く存在すると、認知症やADに関連する可能性のあるTMAOが多くなる可能性がある[74,75]。
Vogtら(2018)による最近の研究では、このTMAOとADの関係が分析され、AD患者ではTMAOのレベルが上昇し、神経細胞死と関連していることが判明した[69]。この研究で著者らは、AD患者424人のCSF中のTMAOレベルを分析し、包括的な神経心理学的バッテリーを用いて、患者の認知状態を分析した。その結果、TMAO濃度はAD認知症および認知機能障害の高さと関連していることがわかった。さらに、TMAOレベルとp-tauおよびp-tau/Aβ42との間には正の関係が認められたが、アミロイドバイオマーカーとの間には認められなかった。さらに、TMAOとt-tau(軸索傷害)には関係があるが、ニューロフィラメント軽鎖(NFL、樹状突起傷害)には関係がないことから、TMAOは軸索傷害には関係があるが樹状突起傷害には関係がないようであることがわかった[69,76]。
観察されたTMAOの負の効果は、異なるメカニズムによって説明できる。この意味で、TMAOはホルモンと脂質のホメオスタシスを変化させ、血小板の過剰反応を引き起こし、ステロールとコレステロールの代謝を変化させることによってコレステロール輸送を減少させ、あるいはNLRP3インフラマソームを活性化させて内皮機能障害を生じさせるようである。さらに、IL-1βやIL-18などの炎症性サイトカインの放出を誘導し、神経老化を引き起こし、酸化ストレスを引き起こし、ミトコンドリア機能を障害し、mTORシグナル伝達を阻害し、CD68発現(認知症に関連する細胞マーカー)を誘導し、マクロファージスカベンジャーレセプターをアップレギュレートする。さらに、マウスでは、TMAOはアテローム性動脈硬化症と関連しており、それは認知症とも関連している [69,77,78,79,80]。
最後に、コリンなどのTMAO前駆体は、神経毒性を持つホモシステインレベルの低下などを通じて、適切な脳機能と関連していることに留意すべきである [81]。実際、コリンレベルの増加(食事など)は、CNSにおけるコリン機能による利点と、TMAO合成による欠点の両方をもたらす可能性がある。しかし、少なくとも若く健康な個体では、食事によるTMAO前駆体の増加は、血漿TMAOレベルの増加とは関連していなかった [81,82] 。したがって、TMAOと認知機能障害との関係は複雑なようであるが、GMが重要な役割を果たしている可能性がある [83]。
ADとリポ多糖
ADに関与する可能性のあるもう一つの微生物叢産物は、グラム陰性膜タンパク質であるリポ多糖(LPS)であり、実験動物において炎症を引き起こす内毒素である [84] 。LPSは炎症促進作用があるとされており、AD患者では対照群と比較して高いレベルで検出された。さらに、LPSはAD患者のアミロイド斑や血管内に見いだされている [85,86]。
Marizzoniら(2020年)が行った関連研究では、LPSとアミロイド病態との関係の可能性が分析されている[87]。この研究では、LPSはADの危険因子となりうる。著者らは、血漿中のLPS濃度の上昇と、調査したすべての大脳領域におけるアミロイド病態の拡大との間に関連があることを発見した。他の著者らは、LPSを分泌するP. gingivalis(ヒトでは歯周病の原因)が、ADだけでなく、脳内Aβ負荷の上昇とも関連していることを明らかにした[88,89]。さらに、高濃度のLPSは、IL-1β、NLRP3、CXCL2、IL-18などの炎症性サイトカインの血中濃度が高いことと関連していた。
ADにおけるLPSのこの効果を説明しうるメカニズムはさまざまである。例えば、in vitroの実験では、LPSはAβ線維の形成を増加させ、ラットに投与(脳室に注射)すると、炎症とADに関連する他の病態を引き起こした[64]。さらに、LPSとAβは、血液脳関門(BBB)を通過する白血球の内皮移行を調節するICAM-1とPECAM-1の発現を増加させるため、内皮シグナル伝達カスケードの最初のステップとなり、神経炎症を加速させる可能性がある [90]。このように、LPSは炎症反応を引き起こした。例えば、ヒト初代脳細胞をLPSにさらすと、炎症因子NF-κB(p50/p65)複合体の転写が活性化され、AD脳における炎症性神経変性が誘発される[91]。最後に、LPSがミクログリアのTLR4受容体と結合すると、AD患者のミクログリアで観察されるのと同様の免疫応答が生じる。
ADにおけるSCFAの影響の可能性を分析した著者もいるが、その結果は賛否両論である。伝統的に、SCFAは神経保護特性を有する代謝産物として提唱されてきた [93]。SCFAは、代謝エネルギーの基質として機能し、ヒストン脱アセチル化酵素を阻害し、腸内分泌シグナル伝達を誘導し、迷走神経を活性化し、抗炎症特性を有し、脳内のミクログリアの正しい機能に関与していることから、ADを抑制する可能性がある。例えば、プロピオン酸と酪酸はヒストン脱アセチル化酵素を阻害し、その結果、遺伝子発現を変化させ、最終的には腫瘍形成と炎症シグナル伝達を減少させた。しかし、Marizzoniら(2020年)は、酪酸と内皮の完全性との間に正の関係があることを発見した。実際、Clostridium butyricumのような酪酸を産生する生物種は、AD症状を改善した [87,97]。さらに、この研究では酢酸塩と酒石酸塩がアミロイド沈着と正の関係を示した。著者らは、酢酸塩が腸管細胞におけるサイトカイン(IL-6、CXCL1、CXCL2)の産生を上昇させ [98] 、アミロイド凝集と内皮機能障害に重要な役割を果たしている可能性があるという仮説を立てた。したがって、異なる研究で観察されたこれらの相反する効果を考慮すると、ADにおける各特異的SCFAの影響をさらに研究する必要がある。
ADとアミロイド
GM中の細菌の中にはアミロイドを合成する能力を持つものがある。これらのタンパク質は自己凝集特性を持ち、蓄積すると細胞の劣化を引き起こす [68,99]。大腸菌(curli)、枯草菌(TasA)、サルモネラ・チフス菌(CsgA)、シュードモナス・フルオレッセンス(FapC)、黄色ブドウ球菌(フェノール可溶性モジュリン)などがその例である。アミロイドは、細菌同士が結合してバイオフィルムを形成し、物理的なダメージや免疫からの攻撃に対してより抵抗力を持つようにする [100]。これらのタンパク質は、Aβ線維や他のオリゴマーのミスフォールディングに関連している [68]。従って、GMによって産生されるアミロイドは、少なくとも三次形態においては、脳に存在する他のアミロイドと非常に類似しているようである [101] 。従って、細菌アミロイドはプリオンタンパク質として作用し、分子模倣によって、タンパク質に病原性形態(βシート構造など)をとらせる可能性がある [100]。この意味で、フェノール可溶性モジュリンはクロスα構造を持ち、ADに関連するクロスβフィブリルを形成する [102] 。curliのサブユニットであるCsgAは、Aβ42と形状が似ており、脳内にプラークの沈着を誘導する [103]。さらに著者らは、ある種の細菌性アミロイドの存在が、免疫系の活性化と炎症性サイトカイン(IL-17A、IL-22、IL-6、TNF)の産生の増加、および抗炎症性サイトカイン(IL-10)の減少と関連していることを発見した。この効果は、脳内のアミロイドの産生によって誘発される可能性がある [104]。
ADと神経伝達物質
遺伝子組み換え細菌の中には、ヒトの生理機能に関連する神経伝達物質を合成する能力を持つものがある [105]。例えば、エシェリヒア属細菌はノルエピネフリンなどのカテコールアミンを合成し [106]、バチルス属細菌はドーパミンとノルエピネフリンを合成し [107]、エシェリヒア属細菌とラクトバチルス属細菌はGABAを産生する [108]。
グルタミン酸は神経伝達物質であり、認知や中枢神経系の機能に重要な役割を果たしている。実際、グルタミン酸は哺乳類の中枢神経系における主要な興奮性神経伝達物質であり [109]、正常なグルタミン酸シグナル伝達の障害は、ADや他の多くの神経変性疾患(パーキンソン病、ハンチントン病、多発性硬化症、統合失調症など)と関連している [110,111]。実際、AD患者では、脳脊髄液中のグルタミン酸レベルが低下している [112]が、ADで観察される神経変性は、エキソサイトーシスによるシナプス内のグルタミン酸レベルの上昇と関連している。このグルタミン酸の作用は、細胞内の過剰なCa2+の侵入によって媒介されるようである [113,114]。
最近の研究では、D-グルタミン酸、N-メチル-D-アスパラギン酸、D-アラニン、D-グルタミンなどのいくつかのD-アミノ酸もメッセンジャー分子として機能する可能性が示唆されている [115]。実際、D-グルタミン酸は、いくつかの細菌の細胞壁の成分であり、ピリドキサール5′-リン酸(PLP)依存性グルタミン酸ラセマーゼによって合成される [116,117]。さらに、D-グルタミン酸のレベルは、ADまたは軽度認知障害のある人の認知機能と関連しているようである [118]。様々な証拠が、D-グルタミン酸の血漿レベルと認知機能低下の程度を関連付けている。その結果、ADまたは軽度認知障害の患者は血漿中のD-グルタミン酸濃度が低く、MMSEやアルツハイマー病評価尺度認知サブスケール(ADAS-cog)などの認知評価ツールの成績と相関していた[118,119]。D-グルタミン酸の適切な濃度が十分な認知能力のために必要であり、その濃度が低下すると認知障害につながる可能性があることは明らかである。
グルタミン酸の食事からの摂取は可能であるが(例:コーヒー、チーズ、魚、野菜、果物など)、異なる種がこの神経伝達物質を合成する能力を持つため、GMが重要な役割を担っている。食品発酵中にグルタミン酸を合成する能力を持つ細菌には、以下のようなものがある: 一方、コリネバクテリウム・グルタミカム、ブレビバクテリウム・ラクトファーメンタム、ブレビバクテリウム・アビウム、マイコバクテリウム・スメグマティス、バチルス・サブチリスなど、L-グルタミン酸からD-グルタミン酸を生成できる細菌もいる[122,123]。グルタミン酸がCNSに到達すると、様々なトランスポーターが登場し、BBBを通過しやすくなる。例えば、内腔膜ではグルタミン酸の輸送が促進されるが、外腔膜ではNa+依存性のグルタミン酸輸送が存在する [124]。
ヒトにおいて顕著な抑制性神経伝達物質であるGABAは、グルタミン酸と密接に関連している。ラクトバチルス・ブレビス(Lactobacillus brevis)やビフィドバクテリウム・デンティウム(Bifidobacterium dentium)などのある種の細菌は、グルタミン酸からGABAを産生する [125]。さらに、腸内におけるGABAの合成は、中枢神経系におけるGABAの増加に関係しており [59]、GABAを産生する菌種が減少すると、中枢神経系におけるGABAレベルが低下する可能性がある。この事実は、認知障害やADと関連している [126]。これに対応して、AD患者の脳の死後検査では、前頭葉、頭頂葉、側頭葉のGABA濃度の低下が認められた [126,127]。
ヒスタミンにはいくつかの役割があり、その主な機能は細胞増殖、アレルギー反応への関与、脳内での神経伝達物質としての機能である [128] 。ヒスタミンのもう一つの重要な役割は、免疫機能への関与であり、ヒスタミンは炎症促進代謝産物としても抗炎症代謝産物としても働く可能性があるようである。したがって、脳内では、ヒスタミンはIL-1a、IL-1b、IL-6、ケモカインなどの炎症性サイトカインの上昇を誘発することにより、アレルギー性の炎症を引き起こす可能性がある。逆に、H4R受容体との相互作用は、特に中枢神経系で重要な抗炎症反応を引き起こした [129]。他の著者は、L.ロイテリが(少なくともin vitroで)ヒスタミンを産生し、単球(TLR-2活性化)における炎症性サイトカインTNFの産生を阻害することを発見した。この阻害は、ヒスタミン受容体H2の活性化を通じて起こり、最終的にTNF遺伝子の転写を制御する。さらに他の著者らは、L. saerimneriが免疫調節代謝産物として働くヒスタミンを合成する能力を持っていることを発見した [130]。
ヒスタミンとADおよび神経変性との関係に焦点を当てると、またしても議論の余地のあるデータがある。ヒスタミンレベルの増加は、血管性痴呆のラットにおけるヒスタミン作動性シグナル伝達のレベル低下とは反対に、一酸化窒素レベルの上昇の結果としての神経炎症の増加 [131] に起因するとして、この病気との関連が指摘されている [132] 。神経変性やADの治療薬としてのヒスタミンの可能性を探るとともに、ヒスタミンの役割についてさらに研究を進める必要がある。
セロトニンは、ADと関係のある必須神経伝達物質である。側頭葉や前頭葉、脳脊髄液中のセロトニン濃度の低下は、ADと関連している [133,134] 。したがって、セロトニン再取り込み阻害薬はADの症状を改善し、セロトニンがこの疾患の病因において重要な役割を果たしていることを示している [135]。
この神経伝達物質は、コリネバクテリウム属、ストレプトコッカス属、大腸菌(少なくとも培養では)など、様々な細菌によって直接合成される [136] 。セロトニンはトリプトファンから合成され、GMは様々なトリプトファン代謝産物の生産に必須である [137] 。GMによってトリプトファンが産生された後、セロトニン合成の約90%が腸内のエンテロクロマフィン細胞内で(TPH酵素によって)行われる[138]。脳にもセロトニンを合成する能力があるが、微生物叢はTPH1の発現の増加により、エンテロクロマフィン細胞でのセロトニン合成を増加させる能力を持っているようである。このように、微生物叢は生体内のセロトニンレベルを調節する[139]。無菌(GF)ラットを用いた研究では、セロトニンの循環レベルおよび海馬など一部の大脳領域における減少が示されている [140]。
末梢のセロトニンにはBBBを通過する能力がないことは注目に値する。しかしながら、利用可能なトリプトファンの減少、SCFAの産生を介したTPH1の転写誘導 [141] 、迷走神経に沿ったセロトニン受容体の活性化 [142,143] など、様々な経路を通じて中枢のセロトニン産生に影響を与える可能性がある。AD患者の脳で観察されるセロトニンの減少は、GMとトリプトファンと疾患との間のこの関連性を支持している [144]。トリプトファンの摂取量が増加すると、海馬と前頭皮質におけるセロトニンレベルが増加し、記憶力が改善され [145]、トランスジェニックADマウスにおけるAβ沈着が減少することが示されている [146]。
Ijms 24 13294 g002図2. 神経変性病態におけるディスバイオシス。ユビオシスにおける主な腸内細菌叢組成(存在量の多いものから少ないものへ)[147]と神経変性病態のディスバイオシスで観察される主な変化の表現。矢印は、文献によると健常対照と比較して増加または減少していることを示す。略号 5-HT:5-ヒドロキシトリプタミン(セロトニン);GABA:γ-アミノ酪酸;IL:インターロイキン;LPS:リポ多糖;NAM:ニコチンアミド;ROS:活性酸素種;TMAO:トリメチルアミン-N-オキシド。
2.2.2. パーキンソン病
PDは最も一般的なタイプのパーキンソニズムである。パーキンソン病患者の80%以上がこの病態に罹患している。疫学的データによると、世界中で約1,000万人が罹患する病態であり、罹患人口の約1%が60歳以上の成人であり、約5%が85歳以上である。世界的な有病率は人口10万人あたり200〜300人で、罹患率はすべてのライフステージで約2%である。1.5対1の割合で、女性よりも男性が多く罹患する疾患である [148,149] 。
この神経変性および全身性の疾患は、神経細胞の相体にα-シヌクレインが沈着し、中脳の黒質に神経細胞が減少し、レビー小体が形成されることに関係している [150] 。これにより、徐脈、安静時振戦(通常、片側性で3~6Hzの周波数振幅で起こる)、その他の平衡障害や歩行障害など、この疾患に現れる核運動症状が引き起こされる。しかし、気分障害、認知症、無嗅覚症、便秘などの消化器系の障害などの非運動症状も生じる [151] 。
PDの神経変性過程の起源については、ここ数十年の間に広範な研究がなされ、患者においていくつかの一致したパターンが見つかっている。メペリジンの合成から生成されるMPTP(1-メチル-フェニル,6-テトラヒドロピリジン)によって調節されるパーキンソニズムを引き起こすメカニズムと同様に、電子伝達鎖の複合体Iの活性の低下とともに、病態を理解する上で基本的な役割を果たすミトコンドリアの機能障害があることが知られている[152,153]。
PDは、腸に発生し脳に広がるものも含め、これらの変化に基づいて研究されてきた。すべての患者において、ENSと副交感神経の変化と関連するENSと虫垂におけるα-シヌクレインの増加を観察することが可能である [154] 。同様に、これらの患者では呼気検査により小腸での細菌の過剰増殖が観察されている。ヘリコバクター・ピロリの有病率が高く、PD症状の悪化と直接的な関係が観察された [155,156] 。
近年、メタゲノミクスのような先進的な研究メカニズムを導入することで、この疾患をより深く理解するための多大な科学的努力がなされている。メタゲノミクスとは、研究対象の環境から作物の土壌サンプルを抽出し、分析することによって、単離されたヌクレオチド配列の機能と構造を研究することである。遺伝物質が得られ、サンプルの塩基配列が決定される。このようにして、細菌ファミリーを特定し、それらがどのような機能を果たしているのか、また分類学的組成を特定することが可能となり、あらゆる領域での探索が可能となる。PDを対象とした最初のメタゲノム研究は2015年に行われ [157] 、そこではプレボテラ科の細菌の減少と、腸内細菌科の存在量と運動表現型、特に歩行困難や姿勢不均衡との正の相関が観察された。1年後、同じ内容の研究が行われ、PD患者では腸内細菌科が多く、プレボテラ科が少ないことが判明した [158] 。また、プロテオバクテリア(Proteobacteria)、特にブルクホルデリア(Burkholderiales)属、腸内細菌(Enterobacteria)属、ラクノスピラ科(Lachnospiraceae)およびペプトストレプトコッカス科(Peptostreptococcaceae)の細菌が増殖している証拠も見つかった(図2および補足資料参照)。
プレボテラ科はバクテロイデス目の細菌で、LPSを含む外細胞壁を持つ。厳格なグラム陰性嫌気性細菌であり、通常は感染症に関与しない。PDとの関連では、最近の研究で、便サンプル中のこの細菌ファミリーが対照群と比較してほぼ80%減少していることが示されている [159] 。これにより、PD患者が罹患している便秘の重症度がほぼ70%の感度で区別された。これらのデータは、この細菌ファミリーと自閉症などの中枢神経疾患との関係を分析した先行研究とも一致していた。Prevotellaceaeは大腸に生息する常在微生物で、その機能は植物性多糖類の分解、腸粘膜層の糖タンパク質の分解、身体の免疫系との相互作用である [160,161] 。
微生物叢におけるプレボテラ科の腸型は、神経活性SCFAのレベル上昇、葉酸とチアミンの生合成能力、PD患者の表現力との間に関係があることを示している [162] 。さらに、これらの患者では腸の透過性が高く、これはムチンの合成を妨げるプレボテラ科細菌の減少と一致している。便秘はPDによくみられる症状であり、通常、運動症状の何年も前に現れるため、早期診断が困難である [163] 。
腸内細菌科の増加は、PDに特徴的な姿勢不安定と歩行障害(PIGD)の症状と関連している。腸内細菌科は、Enterobacterales目に属するグラム陰性菌で、その形態は桿菌または球菌である。大腸菌群に属する [163,164] 。この細菌群は、硝酸塩を亜硝酸塩に還元することができ、嫌気性であり、一部は鞭毛によって移動することができる [165] 。
腸内細菌科細菌の過剰繁殖は、PDの運動症状を説明する。腸内細菌は、姿勢の不安定性、歩行障害、静止障害を伴う。腸内細菌科の細菌が産生するLPSは、βアミロイドの生成を誘導する。これは、活性化されたβ細胞の核因子κ軽鎖(NF-қB)を増強することにより、脳の神経炎症を促進する [166,167] 。
上記で説明したように、プロテオバクテリア(Proteobacteria)集団、特にブルクホルデリア(Burkholderiales)属、エンテロバクテリア(Enterobacteria)属、ラクノスピラ科(Lachnospiraceae)およびペプトストレプトコッカス科(Peptostreptococcaceae)の細菌の増殖にも証拠が見つかっている [168]。最近の研究では、PDと診断された患者では、対照群と比較してこれらのプロテオバクテリアの増殖が高いことが示されている。 プロテオバクテリアの増殖は炎症を助長し、腸管透過性を高める [169,170]。
しかし、これらの研究が常に同じ結果を得ているわけではないことは興味深い。例えば、最近の研究では、PD患者の微生物叢プロフィールの結果に違いが見られた。ある研究では、PD患者において、Tissierellaceae、Paraprevotellaceae、Prevotellaceae、Lachnospiraceae、Bifidobacterium pseudolongum、Roseburiaが減少し、Oxalobacteraceaeが増加していた [171] 。これらの結果はPietrucciらによる研究 [172] と一致しており、病理に影響を及ぼす20以上の細菌ファミリーが同定された。健常者ではTissierellaceaeとParaprevotellaceaeが増加し、Oxalobacteraceaeが減少した。しかし、Lachnospiraceae、Prevotellaceae、Clostridiaceae、Staphylococcaceaeでは異なる結果が得られ、最初の研究ではPD患者における濃度レベルが高いと思われたが、Del Chiericoらの研究では低いレベルであった [171] 。微生物叢の変化が疾患の経過とともに起こることは明らかであるようだが、これがPDの病因の起源なのか原因なのかはまだ断定できない [171,172] 。
まとめると、PDに関連する微生物叢の全体的なプロフィールはまだ不明であるということが重要である。この線に沿った研究は、これらの患者で見られる微生物の修飾の結果を限定しようと試みられている。その影響が慢性的なものなのか、あるいは元に戻すことができるのか、また、病気の経過や症状の悪化に直接関係しているのかどうかはまだわかっていない。
この病態に関する仮説のひとつに、腸に起源があり、迷走神経を介した両系統の相互作用によって脳に到達するというものがある [8,173] 。最近の研究では、迷走神経の切除や両側迷走神経切開がPD発症リスクを低下させることが示されている。動物実験では、胃内ロテノンでPDを誘発したマウスでは、迷走神経背側核の脳幹にレビー小体が発生することが示されている [174,175] 。しかし、迷走神経を切離したところ、交信ができなくなったため、脳幹への病態の拡大は阻止された [176]。
一方、病態を決定するマーカーは、ENSに発生するレビー小体の存在であり、これは腸管透過性の亢進と関連していることが知られている [58] 。リーキーガット症候群は、有害物質の取り込みを促進するためにこの組織の損傷を促し、腸管透過性を変化させ、その結果炎症性反応の発生を促進するような腸内細菌異常症の存在と関連している [177,178] 。この炎症性反応は、TLR4などの受容体と相互作用する内毒素を産生する細菌の変化により、全身的なものとなり、病気の蔓延を促進する [177,179]。これらの受容体は、自然免疫系に見られるタンパク質ファミリーに属する。マウスを用いた研究により、これらの受容体をノックダウンすることで、細菌の変質が抑制されることが示されており、PD拡大の病理学的メカニズムを阻止する試みにおいて、このことはさらに検討されるべき研究分野の一つである[180]。
最後に、IL-10(インターロイキン-10)もPDに関連する炎症過程と関連して研究されている。この遺伝子は抗炎症性サイトカインIL-10をコードしている。このシグナル伝達経路の障害は、腸内炎症の発症を予防する重要な経路として近年注目されており、したがってこの病態における薬理学的治療との関連も注目されている [181,182]。抗炎症機能においては、Tリンパ球やマクロファージによる炎症性サイトカインの合成を阻害することができる [183]。黒質における活性ミクログリアの存在は、インターロイキン-1β(IL-1β)、インターロイキン6(IL-6)、一酸化窒素の過剰産生を通じて神経毒性因子を誘導する役割に関して研究されている。
PDで変化する代謝産物
神経変性病態はそれぞれ異なり、独特の臨床症状を呈するが、いずれも腸管透過性が高く、神経炎症が特徴的である。実際、多くの研究により、PDが腸に現れる可能性が指摘されている。この疾患の患者の高い割合が、この疾患の最も特徴的な運動症状が現れる前から消化管障害を呈しているからである [184] 。
いくつかの研究から、これらの患者では代謝や細胞の変化が起こっており、それが迷走神経を通じてα-シヌクレインタンパク質によって伝播され、脳に運ばれることが示されている [185] 。このタンパク質は、腸管ニューロンや粘膜下ニューロンで見つかっている [186] 。この疾患は黒質では発症しないが、最初の病態生物学的過程、すなわち、グルタチオンレベルの低下、鉄の増加、神経メラニン、カルシウムレベルのバランス、酸化ストレスに関与するドーパミン作動性ニューロンにおける特異的過程のトリガータンパク質の凝集によって影響を受ける。このように、PDにおけるドパミン欠乏は、黒質の細胞喪失と関連しており、黒質変性につながる [187,188] 。
PDの研究では、常染色体優性遺伝パターンが同定される場合、α-シヌクレイン蛋白の変異(Ala53ThrとAla30Pro)が存在する。このタンパク質はシナプス前末端に存在し、アルツハイマー病などの他の神経変性病態における神経斑の非アミロイド化合物の前駆体である [189,190]。さらに、DJ-1タンパク質の変異はPDの常染色体劣性変異型に関連しており、その機能は遺伝子発現、mRNA標的化、がん原性形質転換、シャペロン活性、酸化ストレスへの応答である [191,192]。PINK-1遺伝子は、早期発症PDの発症に関係しているが、その特異的な機能についてはまだ詳しく研究されていない [193]。
PDとポリフェノール
主な神経変性疾患は、細胞内において共通の細胞的・分子的特徴を有している。中でも重要なのは、タンパク質凝集体の沈着、酸化ストレス、炎症、神経細胞のアポトーシスである [194]。ポリフェノールとPDとの関連では、レスベラトロール、オキシレスベラトロール、ケルセチン、バイカレイン、ヘスペリジン、ケンフェロール、ウコン、エピガロカテキンガレートなどが研究されている。後者の場合、鉄キレート機能と保護抗酸化酵素の調節に関連した神経変性病態に対する保護効果があるようである [195]。
レスベラトロール [196]は、動物モデルにおけるドーパミン作動性ニューロンの損失の抑制と関連している。レスベラトロールは、黒質におけるTNF-αのシクロオキシゲナーゼ-2(COX-2)のレベルおよびmRNAのレベルを低下させることにより、神経の炎症プロセスを抑制することができる。さらに、オキシレスベラトロール誘導体は、SIRT1レベルを増加させ、カスパーゼ-3発現とc-Junを負に調節することにより、SH-SY5Y細胞の損傷を減少させる [197,198]。
酸化ストレスは、PDの病因における基本的要素である。これらの患者では、複合体Iの阻害によるミトコンドリア呼吸鎖の変化がみられる [199,200,201]。活性酸素種(ROS)の大きな供給源は、ドーパミンの酸化的代謝であり、これはドーパミン作動性変性症に不可欠なプロセスである [202,203] 。ドーパミンの少なくとも90%はシナプス前小胞に存在するが、ごく一部はモノアミン酸化酵素B(MAO-B)によって分解される[204,205]。長引く神経炎症も活性酸素の原因であり、これらの患者では髄液中の炎症性サイトカイン濃度が上昇している。
フラボノイドのようなポリフェノールを豊富に含む食事や非ステロイド性抗炎症薬(NSAIDs)による介入は、NF-ⅳBシグナル伝達経路を調節することができるため、神経変性疾患や加齢に伴うその他の病態の発症において保護的な役割を果たし、注目すべき治療的可能性がある [206,207,208]。
PDとLPS
上述のように、PD患者では腸内細菌叢の異常が頻繁に起こる。LPSやいくつかの細菌の産生、およびそれらを産生する遺伝子がPDの病因の始まりなのか結果なのかはまだわからないが、この微生物叢が変化し、器質的な炎症状態を好むことが研究で示されている [209,210,211]。さらに、ミクログリア細胞は神経変性疾患に伴う炎症過程において重要な役割を果たしている。これらの細胞の慢性的な活性化は神経細胞損傷を促進し、有害な長期的影響を及ぼす炎症過程を生み出す [212,213]。神経毒性反応は反応性ミクログリオーシスと呼ばれる。グラム陰性菌の外膜の内毒素であるLPSは、リンパ球やマクロファージを活性化する細胞性炎症プロセスである敗血症の発症に関与している [212,214] 。さらに、これらの患者では、尿検査などで腸の透過性が亢進している [215] 。このことは、上記で説明したように、ある種の有害物質が微生物叢-腸-脳軸を通じて自由に循環し、PD患者のニューロンに対する毒性を助長していることを示している可能性がある。
PDとSCFA
短鎖脂肪酸とトリプトファンの代謝産物は、腸関門を通過して血流に乗り、BBBを越えて上流のシグナル伝達トリガー機能を果たす [8,216] 。これらの代謝産物は、局所および中枢神経系レベルで免疫系を制御し、炎症性環境を作り出す。動物モデルでは、副腎皮質刺激ホルモンとコルチコステロン産生の増加と神経栄養レベルの低下を観察することが可能であり、腸内細菌叢のバランスが整うと正常化する [144,217] 。特に、PDメタゲノミクスの研究では、これらの患者の粘膜でより炎症性のプロファイルが観察された [218,219] 。同様に、水素産生菌のレベルの低下と細菌のリポ多糖結合タンパク質のレベルの低下が観察されており、腸管透過性がより高いことが好ましいとされている [220,221,222] 。
他の研究では、一部の軸索の数の変化が、これらの患者における認知プロフィールの悪化、感情プロフィールの悪化、睡眠障害と関連していること、また運動症状の悪化と関連していることを発見した [223,224] 。これは、異種生体物質の代謝に関与する細菌代謝経路の作用が変化し、この病態の特異的治療に悪影響を及ぼす可能性があるため、関連性がある [225] 。
2.2.3. 多発性硬化症および筋萎縮性側索硬化症
先に述べたように、GMが関与している可能性のある他の神経認知障害には、MSとALSがある。MSは慢性的な自己免疫疾患であり、ヒトの免疫系がミエリン鞘を攻撃して破壊し、神経インパルスの正常な伝播に影響を及ぼす。さらに、ミエリン鞘の変化は神経炎症と擦り傷形成を引き起こす。これらの変化は身体的、認知的障害を引き起こし、最終的には麻痺とBBBの破壊に至る [226,227] 。
ALSは、下部および上部運動ニューロンの変性によって引き起こされる神経変性疾患である [228]。神経細胞の死によって、神経筋の脱力、消耗、けいれん、筋しゅくが生じる。この疾患は、EUおよびヨーロッパでは、年間10万人あたり1~2人の患者が新たに診断されている [229,230]。
MS患者では、健康な対照群と比較して、バクテロイデス科(Bacteroidaceae)とフェカリス菌科(Faecalibacterium)に分類される操作分類単位(OTU)が有意に少なく、ルミノコッカス属(Ruminococcus)のOTUが多い。特に関連性が高いのは、酪酸産生における役割から炎症状態の軽減に関連するFaecalibacteriumが、MS患者では全体的に少ないという事実である [231] 。SCFA産生は神経保護作用があることが示されており、プレボテラ菌など、その産生を担う有益な細菌の一部は、多発性硬化症などの病的状態では減少している [232] 。
他の研究では、ALS患者では対照群と比較してバクテロイデーテス(Bacteroidetes)属の相対量が有意に増加し、ファーミキューテス(Firmicutes)属の相対量が有意に減少している。さらに、著者らはALS患者において代謝経路に関連する遺伝子機能の低下を観察し、微生物種レベルおよび関連代謝産物における微生物相の相違を示した(図2および補足資料参照)[233,234]。
腸管バリアの機能不全は、炎症性消化管病態や神経病理において重要な役割を果たしている。中枢神経系の細胞、アストロサイトやミクログリア細胞は、腸内共生物質に由来するさまざまな代謝産物によって制御されている。これらの化学物質の経路は、実験的自己免疫性脳脊髄炎(EAE)モデルにおける神経変性と神経炎症を抑制した。腸内細菌叢だけでなく、消化管からの低分子代謝産物がBBBを介して中枢神経系に到達すると、ALSの発症に重要な役割を果たすという考えを支持する確かな証拠がある。G93A-SOD1トランスジェニックマウスを用いたALSの動物モデルでは、ALSの進行にタイトジャンクションと腸管上皮が関与していることが明らかになった。同様に、プロバイオティクスの摂取と必須代謝産物の補充が、これらのマウスの運動能力を改善したという証拠もある [235]。これらのマウスでは、病気の進行とともにA. muciniphilaのレベルがゆっくりと低下した後、A. muciniphilaによる治療が病気の経過と重症度を良好に調節した[236]。
同様に、バクテロイデーテス(Bacteroidetes)のような潜在的に保護的な微生物群と、シアノバクテリア(Cyanobacteria)のような潜在的に神経毒性または炎症活性を持つ微生物群との間の不均衡も示されている [237]。
前述のように、微生物叢は腸内の免疫細胞も制御しており、トリプトファン、フェニルアラニン、分岐鎖アミノ酸(ロイシン、イソロイシン、バリン)などの必須アミノ酸の代謝においても重要である。微生物叢の組成には個人間のばらつきが大きいにもかかわらず、その代謝作用はより安定しており、これらの代謝機能は宿主の異なる微生物群集によって果たされる可能性が示唆されている [232,237,238] 。
メタボロームの安定性と微生物叢の変動性を比較すると、腸内代謝産物の一部はCSFに移行する可能性があり、そこで毒性作用を発揮して疾患の経過に影響を及ぼす可能性があるという仮説に基づいて、健康状態および疾患状態におけるメタボロームの特徴に注目する必要がある。これらの知見に基づくと、有益な作用を持つ細菌と有害な作用を持つ細菌のバランスが変化することで、神経保護代謝産物が枯渇し、それと並行して神経毒性化合物が蓄積する可能性があると考えるのが妥当である [232,239] 。
MSもALSもメタボロミクスの変化と関連している。メタボロミクスは、MSやALS患者を他の神経疾患と区別する能力を持つだけでなく、これらの疾患の病態生理学をより深く理解し、診断や予後のバイオマーカーを通じて疾患の病期分類や進行のモニタリングのための予測モデルを構築することを可能にするかもしれない[234,240]。
MSの診断と進行・予後の両方のバイオマーカーを同定する必要性は明らかであり、これは疾患の後期段階において極めて重要である [241] 。近年、メタボロミクスは、MSにおける可能性のあるバイオマーカーを同定するための有用なツールとして位置づけられており、治療に対する反応性の改善をサポートする個別化介入を統合するための重要な情報を提供している [242] 。
健常対照者とMSおよびALS患者の血漿および髄液サンプルを対象としたメタボローム解析は、神経毒性代謝産物の同定に役立つ可能性がある。代謝経路を研究し、一貫した代謝異常を同定することは、治療介入の潜在的標的を確立するのに役立つであろう [239,243] 。
MSおよびALSで変化する代謝産物
多発性硬化症
微生物叢はGFマウスにおけるMSのミエリン合成調節に関連している。腸-脳コミュニケーションは、トリプトファンやフェニルアラニン異化のフェノール誘導体やインドール誘導体など、微生物由来の代謝産物によって媒介される可能性があり、MSにおいて神経毒性を誘発する可能性がある [244,245] 。これらの代謝産物は血流や髄液を介して中枢神経系に到達し、髄液中の神経毒性代謝産物の量は神経変性のバイオマーカーや脳容積と相関する。MS患者の血漿中におけるLPSおよびLPS結合タンパク質のレベルの上昇は、炎症性サイトカインのレベルの上昇と関連しており、BBBの完全性の悪化につながり、MSの病原性を永続させることを強調することは重要である [246] 。
MSとトリプトファン
多発性硬化症におけるある種のトリプトファン誘導体は、グリア細胞上のアリール炭化水素受容体に直接結合し、抗炎症作用を示すことが示されている [232] 。メタボローム評価により、MS患者では対照群と比べてトリプトファン濃度が低いことが示されている [242,244] 。また、進行性多発性硬化症では、対照群や再発寛解型MS(RRMS)と比較して、トリプトファン代謝の違いが認められている [243,247] 。
トリプトファンはセロトニンに代謝されることもあるが、その代謝の最大95%を担う主要な経路はキヌレニン経路(KP)であり、MS患者のKPに関する最初の主要な知見は、他のいくつかの研究でも裏付けられたが、これらの患者の髄液中および血清中のトリプトファン濃度が有意に低いということであった[248]。
MSの病因におけるキヌレニンの中心的な役割は、動物モデルとヒト被験者の両方で、神経変性プロセスに関連して、十分に確立されている。MS患者の髄液や血清中の濃度が低いということは、疾患中にKPが測定可能なほど活性化されていることを意味する。KPのバランスを取り戻すことを目的とした戦略は、MSの神経変性を遅らせる上で有用な治療アプローチとなりうる [248,249]。
いくつかの評価では、キヌレン酸(KYNA)濃度は急性再発時に上昇し、寛解期には低下することが証明されている。また、進行性の疾患経過やRRMS患者では、健常対照群と比べてKYNAの割合が低いことも判明している [232] 。KYNAは中枢神経系の強力な抗酸化物質であり、in vivoとin vitroの両方の証拠から、KYNAは第一に脂質過酸化を阻止し、第二に活性酸素のスカベンジャーとして働き、神経保護能力をさらに高めることが示されている [248,250,251] 。MSにおけるKYNAの神経保護的役割に基づき、KYNAは病気の経過を予測するための高感度(最大91%)モデルの予測因子として組み込まれている [252] 。
キノリン酸(QUIN)もまた、RRMS患者のCSFにおける有用な神経炎症および神経変性のバイオマーカーとして評価されている。QUINは、ニューロフィラメントやネオプテリンと並んで、MS患者の血清中では対照群と比べて上昇しており、疾患の重症度を予測する最良の因子の一つである。
EAEラットにおける酵素キヌレニン3-モノオキシゲナーゼ(KMO)のアップレギュレーションは、脊髄におけるQUIN産生をより高い神経毒性レベルで引き起こす。逆に、KMOを阻害すると、神経毒性分子のレベルが低下し、KYNAレベルが上昇する [254,255]。高いKMO活性がEAEラットの血管周囲、脳下垂体、脳下垂体のマクロファージで見つかっていることから、神経毒性キヌレニン代謝産物の供給源として、BBBによって許容されている末梢細胞が寄与していることがわかる [256]。
ラットの線条体をQUINに慢性的に曝露すると、あるいはヒトのニューロンを病態生理学的用量のQUINでin vitro処理すると、それぞれ認知機能障害とアポトーシスが誘発された [257,258]。
QUINは、細胞内の活性酸素やその他のフリーラジカルの中和を阻害し、グルタチオンの酸化還元電位を変化させ、スーパーオキシドジスムターゼ活性を枯渇させる可能性があるため、ミトコンドリアの機能を著しく破壊し、神経変性や細胞死を誘発する[259,260]。したがって、QUINは強力な神経毒であり、マクロファージで産生され、ミクログリアでもそれほどではないが産生される。両細胞は、BBBの損傷による活動期のMS病変の特徴であり、CNSへのマクロファージの侵入を可能にしている[261]。
マクロファージとミクログリアの両方が炎症性サイトカインを定常的に放出し、QUINや他の有毒なKP代謝産物を増加させることは関連性がある。このようにして確立された正のフィードバックループの結果として、神経細胞の傷害と死が起こる [262]。
インドキシル硫酸(IS)は、大腸微生物によるトリプトファンの分解に由来し、その相対量は、対照群と比較してRRMSおよび二次性進行性MS(SPMS)患者の髄液中で高いことが判明している。この代謝産物は、培養ニューロンにおいて、神経毒性作用によりニューロン機能を低下させるのに十分であるようであり、これはミトコンドリア呼吸や酸化ストレスへの影響に依存しない [263] 。ISは、CSF中の神経変性のよく知られたバイオマーカーであるNFLレベルと有意な相関があることから、神経毒性化合物として検証されている [232,264]。
MSとフェノール
フェニルアラニンの異化/誘導体については、進行性MS患者とRRMS患者の代謝の違いに加え、MS患者では対照群と比べてフェニルアラニンが有意に減少することが、様々な研究で示されている [243,263,264]。フェノール由来の代謝産物は、神経細胞の生理機能を直接障害し、培養神経細胞をこれらの代謝産物の高濃度に慢性的に暴露すると、ミトコンドリア機能障害や酸化ストレスとは無関係に、誘導性軸索損傷からなる用量依存性の神経毒性作用が生じることが示されている。
微生物叢-腸-脳軸は、ミエリン関連遺伝子と髄鞘形成プロセスを制御することが示されている。具体的には、4-エチルフェニル硫酸やp-クレゾールなどの微生物由来のフェノール化合物は、神経細胞軸索の髄鞘形成の機能不全を誘導する [265,266] 。これらの所見を支持する他の結果としては、これらのフェノール代謝物(例えば、硫酸p-クレゾールやN-フェニルアセチルグルタミン)のレベルは、皮質体積のMRI測定値と逆相関し、ニューロフィラメント軽鎖レベルと直接相関することが明らかにされている [232]。
MSと分岐鎖アミノ酸
メタボローム評価により、MS患者では対照群と比較して乳酸レベルが高く、バリンおよびチロシンレベルが低いことが示されている。ミトコンドリア機能障害を伴うメタボローム不均衡は、健常対照群と比較して、MS患者では乳酸レベルが高く、トリプトファン、チロシン、バリンレベルが低いことで検出されている [244] 。バイオマーカーとして、グルコースとバリンはMSと対照群を区別することができ、他の代謝物はMSともう一つの炎症性脱髄疾患である視神経脊髄炎(NMO)を区別することができる。具体的には、スキロ-イノシトールとグルタミンはMSで高く、酢酸、グルタミン酸、乳酸、リジンはNMOで高い [243] 。再発と寛解の状態を特徴づけるための別の解析では、MS寛解と比較してMS再発ではイソロイシンとバリンの発現が低下していることが示された [267] 。
筋萎縮性側索硬化症
腸内細菌叢がALSの病因に積極的に関与している可能性を示す証拠が増えつつある。ALSでは、実験的動物モデルでもヒトの研究でも、マイクロバイオームプロファイルが善玉菌の減少と腸内炎症の上昇にシフトしていることが報告されており、マイクロバイオータに大きな影響を与える抗生物質の反復使用でさえ、ALSのリスク上昇と関連している [268] 。ALSの動物モデルには、細菌叢の異常を伴う様々なものがある。さらに、異なる代謝産物や抗生物質を使用することで、症状を変化させたり調節したりすることができる。これらの結果は、ALSで観察される運動障害や神経炎症を、遺伝子組み換え食品が修正する能力を持っていることを示している[269,270]。
ALSにおける神経炎症は、活性酸素の増加、免疫系の活性化の増加、炎症性サイトカインの放出の増加など、さまざまなメカニズムによって病気の悪化に寄与している [236]。さらに、この炎症はまず腸で起こり、次に全身レベルで起こる [240]。
トランスジェニックALS動物はGMが変化している。例えば、G93Aマウスでは、コントロールマウスと比較して、酪酸を産生する細菌だけでなく、ブチリビブリオ・フィブリオソルベン、大腸菌、フェルミカスなどの種の量が少ない。このことは、GMがALSの発症と進化に重要な役割を果たしている可能性を示している[236]。
ALS患者もまた、健常対照者とは異なるGMを持っている。16s rDNA法により、ALS患者は健常対照群と比較してバクテロイデーテス(Bacteroidetes)属が多く、ファーミキューテス(Firmicutes)属とメガモナス(Megamonas)属が減少していることが明らかになった[271,272]。また、γ-グルタミルフェニルアラニンが発症の危険因子と考えられることが示されており、ALS患者ではいくつかのメタボローム経路の遺伝子機能が低下していることも示されている[273]。
別の研究では、ALS患者の便サンプルを分析し、これまでの研究と同様に、ALS患者はGMの多様性が失われていると結論づけた。さらに、患者の大多数が高い腸内炎症(LPSのような代謝産物の存在によって測定される)を起こしていることもわかった[274]。したがって、プレバイオティクス、プロバイオティクス、あるいは代謝産物(例えば、プレボテラ属菌や酪酸代謝の変化など)を用いた治療がALSの治療に有用である可能性がある[275]。
ALSとSCFA 酪酸
前述したように、微生物叢によるSCFAの産生は、栄養素の吸収など様々なプロセスに影響を与え、エネルギー代謝において重要な役割を果たしている。酪酸(主要なSCFAの一つ)は、ALSマウスモデルだけでなく、ヒトの腸管上皮細胞においても、変異タンパク質の蓄積を減少させる役割を担っているようだ。さらに、ALSの動物モデルでは、ディスバイオシスにより酪酸を産生する細菌の多様性が減少しており [234]、最近の研究では、ALS患者と健常対照者において、酪酸を産生する細菌を含む15種の細菌に違いがあることが明らかになった [276]。
ALSモデルマウスにおいて、酪酸産生菌(例えば、Butyrivibrio fibrisolvens、Roseburia intestinalis、Eubacterium rectale)のGMの減少は発症の2ヶ月前に観察された。ALS患者では健常対照群と比較して酪酸の総量が減少していた [236,274]。最後に、酪酸ナトリウムを治療薬として用いると、マウスのALS症状が軽減した。このように、酪酸ナトリウムを投与したマウスは、投与しなかったマウスよりも健康状態が良好であった。具体的には、治療を受けた動物は腸のバリア機能が改善し、体重減少が50日、死亡が38日遅れた [254]。
ALSとトリプトファン
ALSで変化する他の代謝物は、トリプトファン・ニコチンアミド(NAM)経路に関連するものである。例えば、髄液中のNAM濃度はALS患者では健常対照群よりも低いようである。微生物叢はさまざまな代謝産物を産生することによって、この経路を変化させる能力がある。GMのいくつかの種は、アストロサイトとミクログリアの活性化に重要な役割を果たすトリプトファンを産生する。これらの結果から、微生物叢によって合成される代謝産物の中には、ALS患者にみられる神経炎症の制御に関連する性質を持つものや、非運動性の認知や行動の変化など、ALSにみられるいくつかの症状の制御に役立つものさえあることが示唆される [236,277,278]。
ALS患者で発現低下または発現上昇する他のGM代謝産物には、NOやGABA、そしてADなどの他の神経変性疾患と同様に、ALSマウスの結腸や小腸で増加するLPSがある[236]。LPSは腸の恒常性、炎症、透過性を変化させ、いくつかの免疫細胞を活性化して炎症性サイトカインを産生させ、これがBBBを通過して神経炎症と神経細胞死につながる可能性がある [279,280]。腸内細菌叢を通じて症状を改善する介入
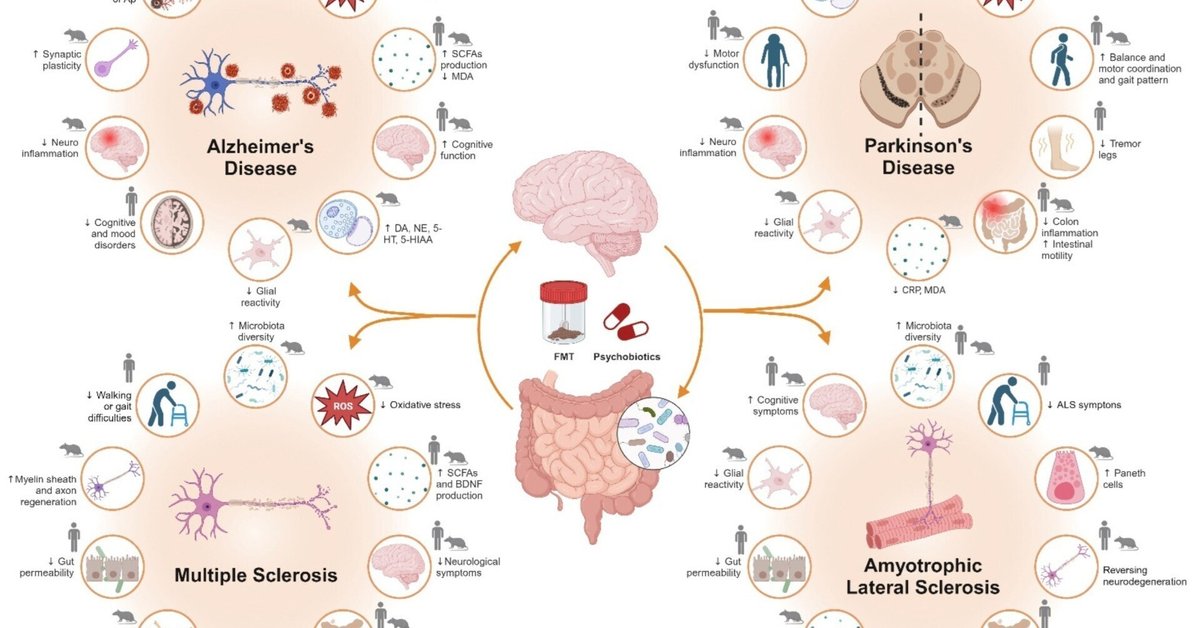
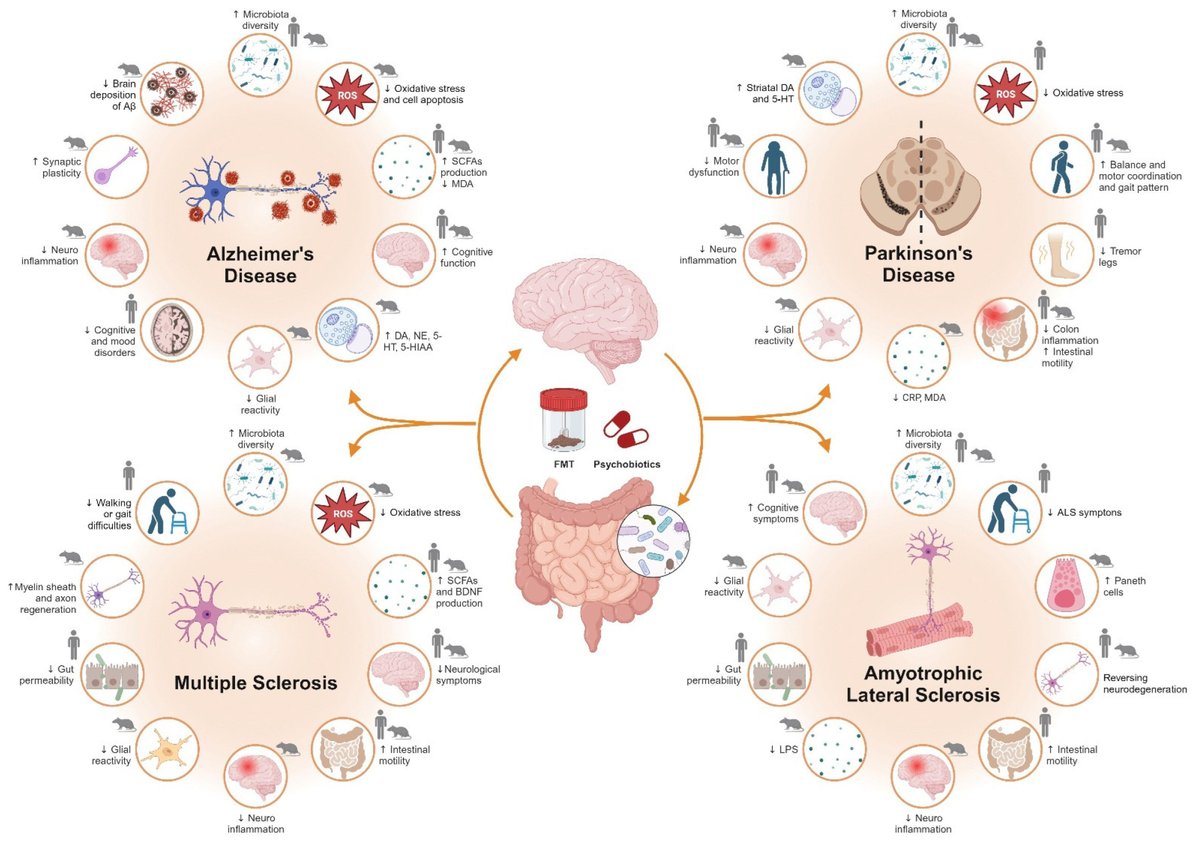
腸内細菌叢の組成や存在量には、健常者と神経疾患患者との間で有意な差が認められ、腸内細菌叢が代謝に及ぼす影響を確認することができた。一般的な神経疾患の病因において、微生物によるディスバイオーシスが重要な役割を果たしており、腸内細菌叢の調節を目的とした戦略は、大きな治療的可能性を示している [281] 。微生物叢の構成には、食事や身体活動など複数の要因が影響する。しかし、本総説では、制御された微生物集団を被験者に直接提供することで、被験者のマイクロバイオームを再プログラムしようとする戦略に焦点を当てる(図3参照)。
Ijms 24 13294 g003図3. 神経変性疾患における腸内細菌叢介入の有益性。AD、PD、MS、ALSにおける糞便微生物叢移植とサイコバイオティクス(プレバイオティクスとプロバイオティクス)の使用の動物およびヒト研究における有益な効果。矢印は文献によると、健常対照と比較した増減を示す。略語 5-HIAA:5-ヒドロキシインド酢酸、5-HT:5-ヒドロキシトリプタミン(セロトニン)、Aβ:アミロイドβタンパク質、ALS:筋萎縮性側索硬化症、CRP:C反応性タンパク質、DA:ドーパミン、FMT:フェカリスロマイシン、FMT:フェカリスロマイシン: ドーパミン;FMT:糞便微生物叢移植;LPS:リポ多糖;MDA:マロンジアルデヒド;NE:ノルエピネフリン;ROS:活性酸素種;SCFA:短鎖脂肪酸。
微生物叢は、さまざまな作用機序によって調節することができる。プレバイオティクスは、「宿主微生物によって選択的に利用され、健康上の利益をもたらす基質(炭水化物ベースのポリフェノールおよび多価不飽和脂肪酸)」である [282] 。このように、プレバイオティクスは、胃腸系に存在する細菌の働きを強化することで、健康的な微生物叢を維持するのに役立つ。プロバイオティクスは、食品サプリメントや医薬品として経口投与可能な生きた微生物(最も使用されている乳酸菌やビフィズス菌など[283])であり、適切な量を使用すると宿主に健康上の利益をもたらす[284,285]。ポストバイオティクス製品は、プロバイオティクス微生物によって産生され、生物に有益な効果をもたらす物質と定義されている。サイコバイオティクスには、プレバイオティクスやプロバイオティクスが含まれ、摂取されると精神疾患や心理疾患に関連する中枢神経系症状を改善する [286]。
糞便微生物叢移植(FMT)は、腸内細菌叢を再プログラムする方法であり、健康なドナーの糞便をレシピエントに移植し、腸内細菌叢集団の組成と機能を正常化することを目的とする。FMTは、レシピエントの腸内細菌叢異常を是正する目的で、「健康な」個体から疾患個体の消化管に腸内細菌叢を移植するものであり[287]、現在、経鼻・腸管移植、経口カプセル移植、内視鏡的噴霧の3つの形態で利用可能である。
FMTは、クロストリジウム・ディフィシル(Clostridium difficile)感染症の治療に60年近く使用されており、その顕著な有効性から、他の消化器疾患の治療にも使用されるようになってきている [288] 。FMTは、再発性のクロストリジウム・ディフィシル感染症の治療において90%近い成功率を示しており、他の消化器疾患の治療への応用も拡大している [289,290] 。最近では、FMTを腸内細菌異常症に関連する他の病態、特に機能性疾患や神経変性疾患にも適用することへの関心が高まっている [291] 。
WHO(世界保健機関)およびFAO(国際連合食糧農業機関)によると、プロバイオティクスとは、適切な量(106~108コロニー形成単位(CFU)/g以上、または108~1010CFU/生細胞量以上)を摂取すると、宿主に有益な効果をもたらす生きた微生物由来の製品である。プロバイオティクスは、微生物叢の変化を引き起こす可能性のある抗生物質治療の後などに、恒常性の回復を目的として使用されることが多い [292]。
迷走神経とENSの神経伝達物質の相互作用によるコルチゾールレベルの調節、脳由来神経栄養因子(BDNF)または神経栄養因子系、CNSの化学作用による行動と認知機能、免疫系、内分泌系への関心に加えて、ここ15年間で、プロバイオティクスの研究とCNSの機能調節におけるその役割に対する科学界の関心は著しく高まっている [293,294]。
3.1. アルツハイマー病
3.1.1. 糞便微生物叢移植
いくつかの研究では、ADの病因、進行、重症度における腸内細菌叢の関与を実証するために、よく特徴づけられた疾患モデルマウスを用いて、FMTが用いられている。例えば、5xFADマウスから野生型(WT)レシピエントへのFMTは、記憶機能を有意に低下させ、海馬の神経新生を減少させ、レシピエントの脳と大腸における炎症を増加させた [295]。Fujiiらは、ヒトAD患者からWTマウスへのFMTがマウスの行動に顕著な影響を及ぼすことを観察し、ヒト化マウスモデルを作成した。さらに、これらの動物の糞便中に、神経系に関連する代謝産物(すなわち、γ-アミノ酪酸、タウリン、バリン)の低下が認められた[296]。Dodiyaたちは、AβアミロイドーシスのAPPSWE/PS1L166P(APPPS1-21)マウスモデルを用いて、抗生物質を投与していない年齢をマッチさせたAPPPS1-21雄性マウスから抗生物質を投与したAPPPS1-21雄性マウスへのFMTによって、腸内微生物叢が復活し、Aβ病理学とミクログリアの形態学が部分的に回復することを示した[297]。同様に、Wangら(2021)は、16ヶ月齢のAPPSWE/PS1ΔE9マウスからFMTを行う前に、3ヶ月齢のAPPSWE/PS1ΔE9マウスを抗生物質カクテルで処理し、レシピエントマウスにおけるAβ斑の有意な増加を示した[298]。
主にマウスで実施されたが、ヒトでも実施された最近の研究では、FMTがAD被験者にプラスの影響を与えることが判明している。Sunら(2019)は、WTマウスからAPPSWE/PS1ΔE9トランスジェニックマウスにFMTを行い、認知障害の有意な改善をもたらし、Aβの脳沈着を減少させた。さらに彼らは、FMT処置がシナプス可塑性を増加させ、神経炎症を緩和し、腸内細菌叢とSCFA(酪酸)の変化を逆転させたことを観察した[299]。WTマウスから別のADトランスジェニックモデルマウス(ADLPAPTマウス)へのFMTは、Aβ斑と神経原線維もつれ、グリア反応性、認知機能障害の形成を改善した。さらに、興味深い研究では、老齢(30~32週齢)の5xFADマウスを、若齢(10~12週齢)または年齢をマッチさせた(30~32週齢)WTドナーマウスのFMTで治療した。老齢の5xFADレシピエントマウスでは、空間記憶と学習の改善、およびアミロイドプラーク負荷の有意な減少が観察された。さらに、若いドナーからFMTを受けた老齢の5xFADマウスが最も強固な変化を示し、FMTの有効性におけるドナーの年齢の重要な役割が強調された [301]。
ヒトを対象とした研究では、2つの事例で有望な結果が得られた。最初の研究では、82歳の男性患者が、再発性のクロストリジウム・ディフィシル感染を治療するために、85歳の妻からFMTを受けた。AD症状(気分、記憶、認知機能)の改善は、FMTの2ヵ月後という早い時期に認められ、6ヵ月後の追跡調査でも持続した [302] 。2例目の研究では、ADで重度のクロストリジウム・ディフィシル感染を有する90歳の女性が、健康な27歳の男性(ドナー)からFMTを受けた。認知機能、微生物叢の多様性、およびSCFA産生の改善が観察された [303]。
3.1.2. プレバイオティクスとプロバイオティクス
動物モデルを用いた研究では、強迫性障害(OCD)や自閉症スペクトラム障害(ASD)といった特定の精神病理に関連する行動や、記憶や注意といったより高い能力の改善に、プロバイオティクスの使用が有効であることが示されている。しかしながら、ADにおけるプレバイオティクスとプロバイオティクスの使用に関する証拠はまだほとんどない [304,305,306]。
最近の研究では、これらの製品が腸内細菌叢を変化させ、神経伝達物質受容体や神経調節物質の発現を通じて認知機能を改善することが示されている [307]。具体的には、動物モデルを用いた研究で、酸化ストレスと細胞アポトーシスの抑制が示された。また、ミトコンドリアの膜電位を回復させることにより、代謝プロセスを改善することも確認されている [8,308]。
動物モデルでオリゴ糖モリンダ・オフィシナリス(OMO)を用いた研究では、この製品を摂取したグループは、細胞の形態が改善され、ドーパミン、ノルアドレナリン、5-ヒドロキシトリプタミン(5-HT)、5-ヒドロキシインドール酢酸(5-HIAA)のレベルも高かった。摂取群では、ADの神経変性のメカニズムと関連するマロンジアルデヒド(MDA)産生の抑制が見られた。さらに、OMOは抗炎症性サイトカインのレベルを増加させる [309,310,311]。
動物モデルを用いた他の研究では、短鎖脂肪酸を産生し、酸化ストレスを軽減できるイヌリンの作用機序が取り上げられている [312,313]。Pistollatoら(2016)による研究では、イヌリンの摂取により、短鎖脂肪酸の産生に関連するプレボテラの増殖が促進されることが示された。この同じ研究は、この製品が海馬における代謝産物スキロ-イノシトールの増加と、脱髄やグリア細胞の増殖と関連しているミオ-イノシトールの減少と関連していることを示している[314]。
プロバイオティクスに関しては、ADに関連した研究で、ディスバイオシスの減少が及ぼす影響が観察されている。15×109CFUのラクトバチルス・アシドフィルス、ビフィドバクテリウム・ビフィダム、ビフィドバクテリウム・ロンガムの摂取は、ラットの記憶と可塑性を改善した。ADラットにラクトバチルス・アシドフィルス菌、ラクトバチルス・ファーメンタム菌、ビフィドバクテリウム・ラクティス菌、ビフィドバクテリウム・ロンガム菌を介入させると、記憶と学習が改善し、Aβ斑の大きさと数も減少した [315,316]。
一方、L. plantarumは、神経細胞保護因子として機能するだけでなく、脳内の化学的メカニズムに関与する代謝産物の産生にも関係している。具体的には、MTCC1325株は海馬と大脳皮質でアセチルコリンを産生し、行動と記憶の改善を説明する [317]。
ヒトにおいて、ADとプロバイオティクスの使用に関する最初の研究では、ラクトバチルス・アシドフィルス、ラクトバチルス・カゼイ、ビフィドバクテリウム・ビフィダム、ラクトバチルス・ファーメンタムを2×109 CFU/gの用量で使用し、Mini Mental State Examinationを用いて認知機能への影響を評価した。研究者らは、評価した機能の改善とMDAの減少を見出した[315,317,318,319](図3参照)。
3.2. パーキンソン病
3.2.1. 糞便微生物叢移植
腸内微生物の変化がPDの誘発と進行に重要な役割を果たすことを示す知見の中に、FMTに関する研究がある。Sampsonら(2016)は、PDのマウスモデルである遺伝的に感受性の高いASO(αシヌクレイン過剰発現)マウスにPD患者からFMTを行うと、健常ドナーからFMTを受けたマウスに比べて運動障害が増強することを明らかにした。さらに、PD患者からのFMTを受けたマウスでは、SCFAsプロファイルの変化が認められ、酢酸の濃度が低く、プロピオン酸と酪酸が増加していた [320]。
FMTがPDの有望な代替療法であることを支持する動物実験がいくつかある。MPTP(1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン)誘発のPDマウスにおいて、Sunらは、健常マウスからのFMTが身体障害を緩和し、腸内微生物のディスバイオシスを減少させ、ファーミキューテス(Firmicutes)とクロストリジウム(Clostridiales)の存在量を増加させる一方で、プロテオバクテリア(Proteobacteria)、ツリシバクテラリウム(Turicibacterales)、および腸内細菌(Enterobacteria)の存在量を減少させることを見出した。FMTは、PDマウスにおいて糞便中のSCFAを減少させ、線条体のDAと5-HTレベルを増加させ [321]、ミクログリアの活性化と神経炎症を抑制した [321,322]。また、抗生物質カクテルで前処置したMPTP誘発PDマウスに、食事療法を模倣した絶食で正常マウスからFMTを投与したところ、DAレベルの上昇が認められた [323]。最近、MPTPマウスを用いた別の研究で、健常マウスからのFMTがPDマウスの運動機能障害を有意に改善したことが報告された。さらに、FMTは、MPTPマウスにおいて、黒質と同様に結腸の炎症を減少させ、腸内細菌叢の組成を再構築した [324]。
ヒトでは、PDを治療するためのFMTに関する最初の症例研究が、PDと便秘を有する71歳の男性患者において、26歳の男性から採取した便を用いて実施された。FMT後、便秘の症状は改善した。下肢の振戦はFMT治療後1週間でほぼ消失したが、2ヵ月後に右下肢に徐々に再発した[325]。Segalら(2021)が発表したケースシリーズでは、6人のPDと便秘の患者がFMTで治療され、FMTの4週間後に5人の患者で運動、非運動、便秘の改善が報告された。副作用がみられた患者は1人だけであった [326] 。運動症状、非運動症状、便秘症状に関する同様の結果は、11人のPD患者を対象とした研究 [327] でも認められ、FMT後にBlautia属とPrevotella属が増加する一方、Bacteroidetes属が有意に減少することが観察された。
Xueら(2020)によって実施された研究では、15人のPD患者がFMTの1ヵ月後に運動症状と非運動症状の改善を示した。患者のうち10人は大腸内視鏡によるFMTを受け、5人は経鼻-空腸チューブによるFMTを受けた。3ヵ月後の追跡調査では3例が継続を拒否し、有害事象は軽度であった(5例)。興味深いことに、大腸FMTは経鼻腸管FMTに比べて有意な改善を示し、有効性の維持期間も長かったことから、FMTの有効性における投与経路の重要性が強調された [328] 。最近、週2回、12週間にわたって経口投与された凍結乾燥FMTを用いた二重盲検プラセボ対照パイロット試験で、PD患者における自覚的な運動症状および非運動症状、腸管通過性、腸管運動、便秘の改善が報告された。さらに、FMT後、ファーミキューテス門内の選択科の割合が有意に増加し、プロテオバクテリアの割合が有意に減少した[329]。
3.2.2. プレバイオティクスとプロバイオティクス
最近の研究では、文献は限られているものの、PDに関連する症状に対するこれらの製品の摂取のプラスの効果が実証されている。具体的には、Tamtajiら(2019)は、ラクトバチルス・アシドフィルス、ビフィドバクテリウム・ビフィダム、ラクトバチルス・ロイテリ、ラクトバチルス・ファーメンタムを含むプロバイオティクスの投与に対する反応を研究した。12週間摂取した結果、対照群とプロバイオティクス摂取群との間に有意差が認められた。C反応性蛋白質とマロンジアルデヒドの濃度が低下し、グルタチオン濃度が上昇したため、酸化ストレスのレベルが改善した。プロバイオティクスを摂取した患者は、介入後、PDに関連する症状を評価するための統一尺度であるMovement Disorders Society-Unified Parkinson's Disease Rating Scaleのスコアが改善した[330]。
プレバイオティクスと併用したプロバイオティクスの摂取後に改善するもう一つの症状は、PDによくみられる胃腸症状である便秘である。黒質のドーパミン作動性ニューロンにおけるプロバイオティクスの神経保護機能を評価した動物モデルの研究では、プロバイオティクスを摂取したマウスにおいて運動機能の改善が認められた。具体的には、神経保護作用により、バランス、運動協調性、歩行パターンが改善された [330]。
認知機能障害に関しては、2016年のJiaらの研究で、ある種の甲殻類の殻から得られるキトサンオリゴ糖(COS)の神経保護作用が観察された。キトサンの酸化ストレス抑制能は良好な結果を示し、血中脂質濃度を低下させた。さらに、スーパーオキシドジスムターゼとグルタチオンペルオキシダーゼの酵素活性が高くなり、酸化ダメージの軽減につながった。COSはまた、炎症性サイトカインの放出を抑えることにより、炎症反応を抑制した [331]。
これらの結果は、代替介入への出発点となる。しかしながら、PDにおけるプロバイオティクスとプレバイオティクスの効果をさらに研究する必要がある。現在までに行われた研究では、通常、病態に伴う消化器症状に対するこれらの製品の効果を分析し、生体の様々なシステムにおける神経保護および神経調節効果を確認している [332] (図3参照)。
3.3. MSとALS
3.3.1. 糞便微生物叢移植
さまざまな動物実験が、主にMSの臨床症状や病態生理学的特徴をシミュレートできる実験的自己免疫性脳脊髄炎(EAE)モデルを用いて、MSにおけるFMTの使用を検討してきた。Bererら(2017)は、ヒトMS不和一卵性双生児由来の微生物叢または健常双生児由来の微生物叢を、自然発生脳自己免疫のトランスジェニックマウスモデルに移植し、MS罹患双生児由来の腸内細菌叢が、健常双生児由来の微生物叢よりも有意に高いCNS特異的自己免疫の発生率を誘導することを観察した[333]。別の研究では、MS患者から無菌マウスへのFMTは、健常対照マウスからのFMTを受けたマウスと比較して、EAEのより重篤な症状を引き起こした [334]。驚くべきことに、Liuたちは、EAEマウス(EAE発症のピーク時)から、EAEを誘発するように処置されたナイーブマウスへのFMTが、健康なナイーブマウスからのFMTと比較して、レシピエント動物の疾患を改善することを発見した。この効果はマイクロRNA(miR)依存的であった。具体的には、ピーク時のEAEおよび未治療のMS患者の糞便中にmiR-30dが濃縮されていることが示された。したがって、miR-30dの増加は、アッカーマンシア・ムチニフィラの存在量の増加を誘導し、EAE症状を抑制する制御性T細胞の能力を増加させた [335]。
他の研究では、MS治療のアプローチとしてFMTが用いられている。Liら(2020)は、正常対照マウスからEAEマウスへのFMTが、EAEマウスにおける腸内細菌叢の変化をある程度まで是正することを発見した。さらに、FMTを投与したマウスは、臨床症状の緩和、EAEの発症遅延、ミクログリアとアストロサイトの活性化の抑制、BBB、ミエリン、軸索の保護を示した[336]。同様の臨床結果がWangら(2021年)によって観察され、FMTを投与したEAEマウスでは、脊髄の浸潤細胞数が減少し、遺伝子発現が調節されて炎症が改善した [337]。
MS患者における症例研究もいくつか発表されている。Borodyら(2011)は、便秘のためにFMTを受けた3人のMS患者の観察を報告している。これら3人の患者を含む研究では、30歳の男性が5回のFMT注入を受け、便秘とMSに良好な結果を得た(少なくとも15年間再発なし)。29歳男性と80歳女性の2人の「非定型」MS患者は、それぞれ10回と5回のFMT注入を受けた。FMT後に神経症状の進行性改善が観察され、少なくとも3年間(男性)と2年間(女性)維持された [338] 。同様の結果が、MSと再発性クロストリジウム・ディフィシル感染症の患者を対象とした2つの症例研究でも得られている。二次性進行性MSの61歳女性は、FMTを1回受けただけで、拡大障害状態尺度(EDSS)がすぐに安定し、その後10年間、機能システムのスコアが最小限に改善した [339] 。RRMSの52歳の女性は、凍結乾燥FMTを経口投与され、1年後に筋力とEDSSスコアが改善した[340]。
Engenら(2020年)は、RRMSの48歳男性の症例研究を発表し、12ヵ月にわたって評価を繰り返した(2回のFMT介入)。FMTは、Faecalibacterium prausnitzii(酪酸産生菌)やSCFAの増加、血清BDNF値の上昇、歩行/歩行の測定基準の改善と関連していた[341]。最近、Alらは、9人のRRMS患者を対象とした臨床試験において、FMTが安全で忍容性が高いことを報告した。この試験は早期に中止されたが、著者らは、FMTが腸管透過性の上昇を正常化し、これらの患者の腸内細菌叢を有益に変化させる可能性があるとも結論づけている[342]。
現在のところ、ALSとFMTに関する動物実験の報告はない。しかし、42人のALS患者(FMT治療群28人、プラセボ群14人)を対象とした臨床試験(NCT03766321)が進行中である。試験期間は患者一人当たり12ヵ月である [343]。さらに、最近の症例報告がLuらによって発表された(2023年)。この症例では、ALSで中等度から重度の便秘を有する48歳の女性が、FMTの改良法である洗浄微生物叢移植(WMT)によって治療された。WMTにより便秘は改善し、ALSの症状はプラトーになった。数ヵ月後、頭皮の外傷のため抗生物質治療を受け、ALSが悪化した。WMTによる救済は、急速に改善し、病気の進行を止めることに成功した。WMT後、患者の腸内細菌叢の多様性と組成は、健康なドナーのものに近づいた[344]。
3.3.2. プレバイオティクスとプロバイオティクス
プロバイオティクスLactobacillus farciminisの投与は、MSにおける腸管透過性亢進を抑制することが示されている。具体的には、EAEラットモデルを用いた研究で、神経炎症活性が低下し、視床下部-下垂体-副腎系の反応も低下することが示された。Faecalibacterium prausnitziiは、酪酸の産生と抗炎症作用を持つ微生物分子の放出を通じて、抗炎症作用を持つ [345,346]。
この研究における最初の科学的証拠は、末梢寛容とEAEの関係に関する研究によって得られた。腸管毒素原性大腸菌をワクチン接種したマウスは、軽度のEAEの症例で完全に回復した。これらの研究から、予防接種を受けた動物は灰白質における炎症性浸潤の数が少なく、T細胞の発現が減少していることが示された。同様に、FoxP3+ Treg細胞の刺激により、IL-4、IL-10、IL-13、TGF-βの分泌による抗炎症作用が増強された [347,348,349]。
他の研究では、嫌気性グラム陰性桿菌であるB. fragilis PSAのMSにおける役割の解析に焦点が当てられている。この化合物は、Th1/Th2レベルを調節し、腸の炎症を防ぐことによって、特定の免疫系メカニズムに関与している。Ochoa-Repárazらによる研究(2010年)では、以前に精製したPSAを投与し、EAEに対する保護・治療効果を示した。これらの著者らは、B. fragilis PSAが疾患の改善を可能にするメカニズムを制御していることを提唱した [350]。
ビフィドバクテリウム・アニマリス(Bifidobacterium animalis)株 [351] や乳酸菌株の組み合わせによる研究も、EAEを誘発したマウスで行われており、ALSに対する治療効果の可能性が示されている。例えば、腸間膜リンパ節においてFoxP3+ Treg、IL-4、IL-10の増加が認められた。しかし、分離したプロバイオティクス株は、疾患マウスにおいて治療効果をもたらさなかった[352]。ラクトバチルス、ビフィドバクテリウム、ストレプトコッカスを含む別のプロバイオティクスの組み合わせの効果は、この化合物の作用機序がビフィドバクテリウム・アニマリスと類似しており、T細胞を介したTh1/Th17の極性化を阻害することを示した [353]。
ALSにおけるプロバイオティクスとプレバイオティクスの影響については、少数の研究が実施されている。L. rhamnosus HA-114の影響を分析した臨床試験では、このサプリメントが視床下部の認知機能を改善し、ALSの神経変性を逆転させることが示された。L. rhamnosus HA-114の作用機序のひとつは、腸関門の透過性を改善することで、代謝性内毒素血症を減少させることであろう [354]。ALS患者にプロバイオティクスサプリメント(5種類の乳酸菌の混合物)を投与した前向き縦断研究では、腸内細菌組成はプロバイオティクスの影響を受けた。しかし、GMの生物多様性が対照群の生物多様性に近づくことはなかった。
G93Aトランスジェニックマウス(ALSモデル)を用いた興味深い研究では、2%酪酸塩の投与によりGMの恒常性が回復し、腸内環境が改善され、動物の寿命が延びた。さらに、酪酸塩を投与した動物では、異常なパネス細胞が有意に減少した [355](図3参照)。ポリフェノールはALSにおける神経保護作用の可能性があるもう一つの化合物であり [356]、さらなる研究が必要である。
まとめると、現在、神経変性疾患の最も特徴的な症状を改善するために、多くの新規介入が実施されている。プレバイオティクス、プロバイオティクス、およびサイコバイオティクスの使用は、これらの患者に大きな利益をもたらすことが報告されている治療法である。その証拠は、過去10年間に発表された様々な実験的研究に見出すことができる。これらの研究はすべて、これらの病態に使用する最良の手段に対する一般の認識を促進することを目的としている。より具体的には、科学界や医療界を対象としており、彼らは、関連症状の改善において十分な成功の保証がある個別の介入案を作成するために、最新の進歩や経験的証拠を出発点としなければならない。結論
微生物叢-腸-脳軸は、生活習慣(例えば、食事や身体活動)によって影響を受けたり、糞便微生物叢移植やプレバイオティクスおよびプロバイオティクスサプリメントの使用など、腸内細菌叢に焦点を当てた介入によって調節されたりする、活発で双方向のコミュニケーションを維持している。微生物プロファイルに生じる変化が、それぞれの神経変性疾患の症状の原因であるか結果であるかを確認することはできないが、微生物叢の改変は、これらの病態の治療標的として示唆されている。
神経変性疾患に関する研究の多くは、疾患の臨床段階において実施されているため、微生物叢の機能に関連する因果関係を決定することは現在のところ困難である。しかしながら、神経変性疾患の発症と進行における微生物叢の役割を指摘するエビデンスは存在する(例えば、糞便微生物叢移植の研究により、微生物叢の変化が健常動物における神経変性病態の特徴的な症状を誘発することが示されている)。
本総説は、神経変性過程における治療標的としての微生物叢の利用について、以下のような本質的結論を導き出した:
神経変性疾患の発症と進行が腸内細菌叢によって部分的に調節されていることを支持する証拠が増えつつある。AD、PD、MS、ALSを対象とした動物およびヒトの研究では、腸内細菌叢の組成とその代謝産物の変化が示されている。
AD、PD、MS、ALSでは、神経毒(すなわちLPS)の存在、いくつかの神経伝達物質(例えばGABAやセロトニン)や抗炎症性サイトカイン(例えばIL-10やIL-22)の減少、炎症性サイトカインの増加、SCFA(特に酪酸の減少)のような異なる代謝産物のアップレギュレーションやダウンレギュレーションなど、いくつかの共通の代謝産物変化がある。さらに、これらの変化は微生物叢の調節によって緩和される。
好結果が得られた介入による微生物叢のリプログラミングのうち、糞便微生物叢移植とサイコバイオティクスが、AD、PD、MS、ALSにおける潜在的な治療手段として紹介されている。
神経変性疾患の治療に統合的に取り組むためには、腸内細菌叢とその代謝産物の作用機序に関する深い知識が不可欠である。これは、認知レベルと神経生理学的レベルの両方において、疾患の進行と症状の改善を意味する。研究の限界
本研究は包括的な叙述的レビューであるが、考慮すべきいくつかの限界が確認された:
これは発展途上の研究分野である。つまり、病態によっては、発見されたデータを統合した多くの研究を見つけることがまだできない。
分析された研究は、サンプルやモデル(ヒトと動物)が異なるだけでなく、研究手法も異なっている。これは、代表的な結果を確立するための制限となりうる。しかし、近年の論文数の増加により、傾向や関係を確立することができる。
セクション4で示したように、神経変性病態に関連する症状の原因が微生物によるものなのか、それとも結果なのかを判断できない場合もある。しかし、この相互作用は、微生物叢-腸-脳軸がこれらの疾患における治療標的として使用される可能性があることを示している。
補足資料
以下の補足資料は、https://www.mdpi.com/article/10.3390/ijms241713294/s1。
著者貢献
構想、A.I.B.-V.、S.U.およびV.E.-A.、方法論、全執筆者、執筆-原案作成、全執筆者、執筆-査読および編集、可視化、全執筆者、監督、A.I.B.-V.、S.U.およびV.E.-A.、プロジェクト管理、A.I.B.-V.およびS.U.。
資金提供
本研究は外部資金援助を受けていない。
施設審査委員会声明
該当なし。
インフォームド・コンセント
該当なし。
データ利用可能性に関する声明
該当なし。
謝辞
図は2023年7月21日にBioRender.comで作成した。
利益相反
著者らは利益相反はないと宣言している。
参考文献
Scheltens, P.; De Strooper, B.; Kivipelto, M.; Holstege, H.; Chételat, G.; Teunissen, C.E.; Cummings, J.; van der Flier, W.M. Alzheimer's disease. Lancet 2021, 397, 1577-1590. [Google Scholar] [CrossRef] [PubMed].
アルツハイマー病の疫学(The Epidemiology of Alzheimer's Disease Modifiable Risk Factors and Prevention)。J. Prev. Alzheimers Dis. 2021, 8, 313-321. [Google Scholar] [CrossRef].
神経変性疾患のバイオマーカー。Nat. Med. 2021, 27, 954-963. [Google Scholar] [CrossRef].
健康と病気における微生物叢の役割。Environ. Sci. Pollut. Res. 2021, 28, 36967-36983. [Google Scholar] [CrossRef] [PubMed].
Pascale, A.; Marchesi, N.; Marelli, C.; Coppola, A.; Luzi, L.; Govoni, S.; Gazzaruso, C. Microbiota and metabolic diseases. Endocrine 2018, 61, 357-371. [Google Scholar] [CrossRef].
Tong, Y.; Marion, T.; Schett, G.; Luo, Y.; Liu, Y. Microbiota and metabolites in rheumatic diseases. Autoimmun. Rev. 2020, 19, 102530. [Google Scholar] [CrossRef] [PubMed].
循環微生物叢と代謝産物:心血管疾患への洞察. J. Clin. Lab. anal。2022, 36, e24779. [Google Scholar] [CrossRef] [PubMed].
また、このような研究は、日本ではまだあまり行われていない。Physiol. Rev. 2019, 99, 1877-2013. [Google Scholar] [CrossRef].
Allison, J.; Kaliszewska, A.; Uceda, S.; Reiriz, M.; Arias, N. Targeting DNA Methylation in the Adult Brain through Diet. 栄養素2021、13、3979。[Google Scholar] [CrossRef].
ヒト疾患における腸内細菌叢の役割とメカニズム。Front. Cell. Infect. Microbiol. 2021, 11, 625913. [Google Scholar] [CrossRef].
微生物叢-脳-腸軸と神経変性疾患. Curr. Neurol. Neurosci. Rep. 2017, 17, 94. [Google Scholar] [CrossRef] [PubMed].
微生物叢-腸-脳軸:新たな治療機会. Annu. Rev. Pharmacol. Toxicol. 2020, 60, 477-502. [Google Scholar] [CrossRef].
Clemente-Suárez, V.J.; Beltrán-Velasco, A.I.; Ramos-Campo, D.J.; Mielgo-Ayuso, J.; Nikolaidis, P.A.; Belando, N.; Tornero-Aguilera, J.F. 身体活動とCOVID-19。COVID-19パンデミック時の効率的な介入の基礎。Physiol. 2022, 244, 113667. [Google Scholar] [CrossRef]。
Clemente-Suárez, V.J.; Martínez-González, M.B.; Benitez-Agudelo, J.C.; Navarro-Jiménez, E.; Beltran-Velasco, A.I.; Ruisoto, P.; Diaz Arroyo, E.; Laborde-Cárdenas, C.C.; Tornero-Aguilera, J.F. The Impact of the COVID-19 Pandemic on Mental Disorders. 批判的レビュー。Int. J. Environ. Res. Public Health 2021, 18, 10041. [Google Scholar] [CrossRef].
Reiriz, M.; Donoso-González, M.; Rodríguez-Expósito, B.; Uceda, S.; Beltrán-Velasco, A.I. 青少年と脆弱な集団におけるCOVID-19監禁のメンタルヘルスへの影響: 広範なナラティブ・レビュー。Sustainability 2023, 15, 3087. [Google Scholar] [CrossRef].
過敏性腸症候群における微生物叢を介した病態の分子メカニズム.Int. J. Mol. Sci. 2020, 21, 8664. [Google Scholar] [CrossRef] [PubMed].
Rangan、P.; Choi、I.; Wei、M.; Navarrete、G.; Guen、E.; Brandhorst、S.; Enyati、N.; Pasia、G.; Maesincee、D.; Ocon、V.; et al. 断食模倣食は微生物叢を調節し、炎症性腸疾患の病態を軽減するために腸管再生を促進する。Cell Rep. 2019, 26, 2704-2719.e6. [Google Scholar] [CrossRef].
Walter, J.; Armet, A.M.; Finlay, B.B.; Shanahan, F. 腸内マイクロバイオームの因果関係の確立または誇張: ヒト微生物叢関連げっ歯類からの教訓。Cell 2020, 180, 221-232. [Google Scholar] [CrossRef].
Yan、D.; Cao、L.; Zhou、M.; Mohimani、H. TransDiscovery: メタゲノムとメタボロームデータの統合によるヒト微生物叢からの生物変換の発見。Metabolites 2022, 12, 119. [Google Scholar] [CrossRef].
Docimo、G.; Cangiano、A.; Romano、R.M.; Pignatelli、M.F.; Offi、C.; Paglionico、V.A.; Galdiero、M.; Donnarumma、G.; Nigro、V.; Esposito、D.; et al. 内分泌学におけるヒト微生物叢: 甲状腺疾患における病態生理、治療、予後への示唆。Front. Endocrinol. 2020, 11, 586529. [Google Scholar] [CrossRef].
健康および疾患における微生物叢。Signal Transduct. Target. Ther. 2022, 7, 135. [Google Scholar] [CrossRef] [PubMed].
Sarkar、A.; Yoo、J.Y.; Valeria Ozorio Dutra、S.; Morgan、K.H.; Groer、M. 幼少期の腸内細菌叢と長期的な健康と疾患との関連性。J. Clin. Med. 2021, 10, 459. [Google Scholar] [CrossRef] [PubMed].
Segovia-Rodríguez, L.; Echeverry-Alzate, V.; Rincón-Pérez, I.; Calleja-Conde, J.; Bühler, K.M.; Giné, E.; Albert, J.; Hinojosa, J.A.; Huertas, E.; Gómez-Gallego, F.; et al. 腸内細菌叢と自発的アルコール摂取。Transl. Psychiatry 2022, 12, 146. [Google Scholar] [CrossRef]。
Calleja-Conde, J.; Echeverry-Alzate, V.; Bühler, K.M.; Durán-González, P.; Morales-García, J.; Segovia-Rodríguez, L.; Rodríguez de Fonseca, F.; Giné, E.; López-Moreno, J.A. アルコール摂取と腸内細菌叢からみた免疫系。Int. J. Mol. Sci. 2021, 22, 7485. [Google Scholar] [CrossRef] [PubMed].
統合失調症を治療するための非薬物的アプローチによる腸内細菌多様性の調節。Int. J. Mol. Sci. 2022, 23, 2625. [Google Scholar] [CrossRef].
抗生物質と高脂肪・高糖質食に関連した機能異常の喪失。ISME J. 2019, 13, 1379-1390. [Google Scholar] [CrossRef].
Rajilic-Stojanovic, M.; Figueiredo, C.; Smet, A.; Hansen, R.; Kupcinskas, J.; Rokkas, T.; Andersen, L.; Machado, J.C.; Ianiro, G.; Gasbarrini, A.; et al. 系統的レビュー: 健康と疾患における胃微生物叢。Aliment. Pharmacol. Ther. 2020, 51, 582-602. [Google Scholar] [CrossRef].
Sánchez-Tapia, M.; Tovar, A.R.; Torres, N. Diet as Regulator of Gut Microbiota and its Role in Health and Disease. Arch. Med. Res. 2019, 50, 259-268. [Google Scholar] [CrossRef].
Brüssow, H. Problems with the concept of gut microbiota dysbiosis. Microb. Biotechnol. 2020, 13, 423-434. [Google Scholar] [CrossRef].
Khan、A.; Ding、Z.; Ishaq、M.; Bacha、A.S.; Khan、I.; Hanif、A.; Li、W.; Guo、X. 非アルコール性脂肪肝疾患に対する腸内細菌叢異常症の影響の理解とプロバイオティクスの役割の可能性: 最近の最新情報。Int. J. Biol. Sci. 2021, 17, 818-833. [Google Scholar] [CrossRef].
腸内細菌叢、食事、ヒト疾患の相互作用。FEBS J. 2020, 287, 833-855. [Google Scholar] [CrossRef] [PubMed].
腸内細菌叢の異常が脳機能に及ぼす影響: システマティックレビュー。Porto Biomed. Google Scholar] [CrossRef] [PubMed].
腸内細菌叢異常症の定義と宿主免疫と疾患への影響. Cell. Microbiol. 2014, 16, 1024-1033. [Google Scholar] [CrossRef].
Salguero、M; Al-Obaide、M; Singh、R; Siepmann、T; Vasylyeva、T. グラム陰性腸内細菌叢のdysbiosisと関連する血清リポ多糖は、慢性腎臓病を有する2型糖尿病患者の炎症を悪化させる。Exp. Ther. Med. 2019, 18, 3461-3469. [Google Scholar] [CrossRef].
腸内細菌異常症と日本人2型糖尿病患者の血中「生きた腸内細菌」の検出. Diabetes Care 2014, 37, 2343-2350. [Google Scholar] [CrossRef].
Barko, P.C.; McMichael, M.A.; Swanson, K.S.; Williams, D.A. The Gastrointestinal Microbiome: The Gastrointestinal Microbiome: A Review. J. Vet. J. Vet. Intern. Med. 2018, 32, 9-25. [Google Scholar] [CrossRef].
Blaser, M.J. The microbiome revolution. J. Clin. Investig. 2014, 124, 4162-4165. [Google Scholar] [CrossRef]。
Gilbert, J.A.; Blaser, M.J.; Caporaso, J.G.; Jansson, J.K.; Lynch, S.V.; Knight, R. Current understanding of the human microbiome. Nat. Med. 2018, 24, 392-400. [Google Scholar] [CrossRef] [PubMed].
Qin, J.; Li, R.; Raes, J.; Arumugam, M.; Burgdorf, K.S.; Manichanh, C.; Nielsen, T.; Pons, N.; Levenez, F.; Yamada, T.; et al. メタゲノム配列決定によって確立されたヒト腸内細菌遺伝子カタログ。Nature 2010, 464, 59-65. [Google Scholar] [CrossRef].
Dingeo, G.; Brito, A.; Samouda, H.; Iddir, M.; La Frano, M.R.; Bohn, T. 腸内微生物群集の修飾因子としてのフィトケミカル。Food Funct. 2020, 11, 8444-8471. [Google Scholar] [CrossRef].
ヒトマイクロバイオームプロジェクトコンソーシアム。Structure, function and diversity of the healthy human microbiome. Nature 2012, 486, 207-214. [Google Scholar] [CrossRef].
Marć, M.A.; Jastrząb, R.; Mytych, J. Is the Gut Microbial Metabolome Really Matter? GUTメタボロームと神経疾患の関連性。栄養素2022、14、3967。[Google Scholar] [CrossRef]。
Skowron, K.; Bauza-Kaszewska, J.; Kraszewska, Z.; Wiktorczyk-Kapischke, N.; Grudlewska-Buda, K.; Kwiecińska-Piróg, J.; Wałecka-Zacharska, E.; Radtke, L.; Gospodarek-Komkowska, E. ヒト皮膚マイクロバイオーム: ヒト皮膚マイクロバイオーム:皮膚微生物叢に及ぼす内在的および外在的要因の影響。Microorganisms 2021, 9, 543. [Google Scholar] [CrossRef].
腸内細菌叢と免疫系の相互作用。Microorganisms 2020, 8, 1587. [Google Scholar] [CrossRef] [PubMed].
Ballini、A.; Dipalma、G.; Isacco、C.G.; Boccellino、M.; Di Domenico、M.; Santacroce、L.; Nguyễn、K.C.D.; Scacco、S.; Calvani、M.; Boddi、A.; et al. 口腔微生物叢と免疫系のクロストーク: トランスレーショナル・リサーチ。Biology 2020, 9, 131. [Google Scholar] [CrossRef] [PubMed].
Tang, T.W.H.; Chen, H.C.; Chen, C.Y.; Yen, C.Y.T.; Lin, C.J.; Prajnamitra, R.P.; Chen, L.L.; Ruan, S.C.; Lin, J.H.; Lin, P.J.; et al. Loss of Gut Microbiota Alters Immune System Composition and Cripples Postinfarction Cardiac Repair. Circulation 2019, 139, 647-659. [Google Scholar】【CrossRef】。
Teixeira, P.J.P.; Colaianni, N.R.; Fitzpatrick, C.R.; Dangl, J.L. Beyond Pathogens: 植物免疫系と微生物叢の相互作用。Curr. Opin. Microbiol. 2019, 49, 7-17. [Google Scholar] [CrossRef].
Chang, C.S.; Kao, C.Y. Current understanding of the gut microbiota shaping mechanisms. J. Biomed. Sci. 2019, 26, 59. [Google Scholar] [CrossRef].
Duncan, S.H.; Lobley, G.E.; Holtrop, G.; Ince, J.; Johnstone, A.M.; Louis, P.; Flint, H.J. Human colonic microbiota associated with diet, obesity and weight loss. Int. J. Obes. 2008, 32, 1720-1724. [Google Scholar】【CrossRef】【PubMed
ヒトの腸内細菌叢に対する食事の影響: ヒト化グノトビオティックマウスにおけるメタゲノム解析。Sci. Transl. Med. 2009, 1, 6ra14. [Google Scholar] [CrossRef]。
Kolodziejczyk, A.A.; Zheng, D.; Elinav, E. Diet-microbiota interactions and personalized nutrition. Nat. Rev. Microbiol. 2019, 17, 742-753. [Google Scholar] [CrossRef] [PubMed].
栄養と免疫システム: 地中海食から微生物叢を介した栄養補助食品へ。Crit. 2021, 61, 3066-3090. [Google Scholar] [CrossRef]。
Salzman、N.H.微生物と免疫系の相互作用: 不安な同盟。Curr. Opin. Microbiol. 2011, 14, 99-105. [Google Scholar] [CrossRef].
Ancona, G.; Alagna, L.; Lombardi, A.; Palomba, E.; Castelli, V.; Renisi, G.; Dondossola, D.; Iavarone, M.; Muscatello, A.; Gori, A.; et al. The Interplay between Gut Microbiota and the Immune System in Liver Transplant Recipients and Its Role in Infections. Infect. Immun. 2021, 89, e0037621. [Google Scholar] [CrossRef].
Konjevod、M.; Nikolac Perkovic、M.; Sáiz、J.; Svob Strac、D.; Barbas、C.; Rojo、D. 神経変性および精神疾患における微生物叢-腸-脳軸のメタボロミクス解析。J. Pharm. Biomed. Anal. 2021, 194, 113681.
腸内細菌叢、プロバイオティクスとメンタルヘルス: メチニコフから現代の進歩まで: 臨床試験への収束。Gut Pathog. 2013, 5, 4. [Google Scholar] [CrossRef].
腸内細菌叢の調節が不安症状に及ぼす影響: 系統的レビュー。Gen. Psychiatry 2019, 32, e100056. [Google Scholar] [CrossRef] [PubMed].
Guo, T.T.; Zhang, Z.; Sun, Y.; Zhu, R.Y.; Wang, F.X.; Ma, L.J.; Jiang, L.; Liu, H.D. Sodium Butyrate by Restoring Gut Microbiota and Inhibiting TLR4 Signaling in Mice with MPTP-Induced Parkinson's Disease. Nutrients 2023, 15, 930. [Google Scholar] [CrossRef].
Hu, X.; Wang, T.; Jin, F. Alzheimer's disease and gut microbiota. Sci. China Life Sci. 2016, 59, 1006-1023. [Google Scholar] [CrossRef].
アルツハイマー病の疫学的・経済的負担: Alzheimer's Disease of Epidemiological and Economic Burden of Alzheimer's Disease: A Systematic Literature Review of Data across Europe and the United States of America. J. Alzheimer's Dis. 2014, 43, 1271-1284. [Google Scholar] [CrossRef].
腸内細菌叢、免疫の発達と機能。Pharmacol. Res. 2013, 69, 87-113. [Google Scholar] [CrossRef]。
金属曝露とアルツハイマー病発症。J. Struct. Biol. 2006, 155, 45-51. [Google Scholar] [CrossRef].
神経疾患における腸内細菌叢. Arch. Immunol. Ther. Exp. 2019, 67, 375-383. [Google Scholar] [CrossRef].
Asti, A.; Gioglio, L. Can a Bacterial Endotoxin be a Key Factor in the Kinetics of Amyloid Fibril Formation? J. Alzheimer's Dis. 2014, 39, 169-179. [Google Scholar] [CrossRef] [PubMed].
アルツハイマー病患者におけるAPOE-ε4キャリアの状態と腸内細菌叢の異常。Front. Neurosci. 2021, 15, 619051. [Google Scholar] [CrossRef] [PubMed].
Kountouras, J.; Boziki, M.; Gavalas, E.; Zavos, C.; Deretzi, G.; Grigoriadis, N.; Tsolaki, M.; Chatzopoulos, D.; Katsinelos, P.; Tzilves, D.; et al. アルツハイマー病における脳脊髄液ヘリコバクター・ピロリ抗体の増加. Int. J. Neurosci. 2009, 119, 765-777. [Google Scholar] [CrossRef] [PubMed].
Haran, J.P.; Bhattarai, S.K.; Foley, S.E.; Dutta, P.; Ward, D.V.; Bucci, V.; McCormick, B.A. Alzheimer's Disease Microbiome Is Associated with Dysregulation of the Anti-Inflammatory P-Glycoprotein Pathway. mBio 2019, 10, e00632-19. [Google Scholar] [CrossRef].
Shabbir, U.; Arshad, M.S.; Sameen, A.; Oh, D.H. Crosstalk between Gut and Brain in Alzheimer's Disease: 腸内細菌叢調節戦略の役割。Nutrients 2021, 13, 690. [Googleスカラー] [参照] [PubMed].
Vogt, N.M.; Romano, K.A.; Darst, B.F.; Engelman, C.D.; Johnson, S.C.; Carlsson, C.M.; Asthana, S.; Blennow, K.; Zetterberg, H.; Bendlin, B.B.; et al. 腸内細菌叢由来の代謝物トリメチルアミンN-オキシドはアルツハイマー病で上昇する。Alzheimers Res. Ther. 2018, 10, 124. [Google Scholar] [CrossRef].
Arrona-Cardoza, P.; Spillane, M.B.; Morales-Marroquin, E. Alzheimer's disease and gut microbiota: トリメチルアミンN-オキシド(TMAO)は役割を果たしているか?Nutr Rev. 2022, 80, 271-281。[Google Scholar] [CrossRef]。
Del Rio, D.; Zimetti, F.; Caffarra, P.; Tassotti, M.; Bernini, F.; Brighenti, F.; Zini, A.; Zanotti, I. The Gut Microbial Metabolite Trimethylamine-N-Oxide Is Present in Human Cerebrospinal Fluid. Nutrients 2017, 9, 1053. [Google Scholar] [CrossRef].
コリンのトリメチルアミンへの微生物変換にはグリシルラジカル酵素が必要である。Proc. Natl. Acad. Sci. USA 2012, 109, 21307-21312. [このような研究は、日本ではほとんど行われていない。
また、このような研究は、日本ではまだほとんど行われていないようである。Nature 2011, 472, 57-63. [Google Scholar] [CrossRef]。
栄養、腸内細菌叢、アルツハイマー病。Front. Psychiatry 2021, 12, 712673. [Google Scholar] [CrossRef] [PubMed].
腸内細菌叢組成は食事からのコリンバイオアベイラビリティとプロアテローム代謝産物トリメチルアミン-N-オキシドの蓄積を調節する。[Google Scholar] [CrossRef] [PubMed].
コリントリメチルアミンリアーゼのキャラクタリゼーションがグリシルラジカル酵素の化学を拡張する。ACS Chem. Biol. 2014, 9, 1408-1413. [Google Scholar] [CrossRef].
Seldin, M.M.; Meng, Y.; Qi, H.; Zhu, W.; Wang, Z.; Hazen, S.L.; Lusis, A.J.; Shih, D.M. Trimethylamine N-Oxide Promotes Vascular Inflammation Through Signaling of Mitogen-Activated Protein Kinase and Nuclear Factor-κB. J. Am. Heart Assoc. [Google Scholar] [CrossRef].
Trimethylamine-N-Oxide Induces Vascular Inflammation by Activating the NLRP3 Inflammasome Through the SIRT3-SOD2-mtROS Signaling Pathway. J. Am. Heart Assoc. 2017, 6, e006347. [Google Scholar] [CrossRef] [PubMed].
Li, D.; Ke, Y.; Zhan, R.; Liu, C.; Zhao, M.; Zeng, A.; Shi, X.; Ji, L.; Cheng, S.; Pan, B.; et al. トリメチルアミン-N-オキシドはマウスの脳の老化と認知機能障害を促進する。Aging Cell 2018, 17, e12768. [Google Scholar] [CrossRef].
Koeth, R.A.; Wang, Z.; Levison, B.S.; Buffa, J.A.; Org, E.; Sheehy, B.T.; Britt, E.B.; Fu, X.; Wu, Y.; Li, L.; et al. 赤身肉の栄養素であるl-カルニチンの腸内細菌叢代謝はアテローム性動脈硬化症を促進する。Nat. Med. 2013, 19, 576-585. [Google Scholar] [CrossRef]。
Lemos, B.S.; Medina-Vera, I.; Malysheva, O.V.; Caudill, M.A.; Fernandez, M.L. Effects of Egg Consumption and Choline Supplementation on Plasma Choline and Trimethylamine-N-Oxide in a Young Population. J. Am. Coll. Nutr. 2018, 37, 716-723. [Google Scholar] [CrossRef].
Berge, R.K.; Ramsvik, M.S.; Bohov, P.; Svardal, A.; Nordrehaug, J.E.; Rostrup, E.; Bruheim, I.; Bjørndal, B. Krill oil reduces plasma triacylglycerol level and improves related lipoprotein particle concentration, fatty acid composition and redox status in healthy young adults-A pilot study. Lipids Health Dis. 2015, 14, 163. [Google Scholar] [CrossRef] [PubMed].
アルツハイマー病におけるジェロバイオティクスによる微生物叢の変化と調節: 良い心のための腸-健康軸。Biomed. Pharmacother. 2022, 153, 113430. [Google Scholar] [CrossRef].
アルツハイマー病における腸脳軸、腸内細菌組成、プロバイオティクス介入の役割。生命科学、2021、264、118627。[Google Scholar] [CrossRef].
リポ多糖はアルツハイマー病脳におけるアミロイド斑、神経細胞、オリゴデンドロサイトと会合する: 総説。Front. Aging Neurosci. 2018, 10, 42. [Google Scholar] [CrossRef] [PubMed].
Zhan, X.; Stamova, B.; Jin, L.W.; DeCarli, C.; Phinney, B.; Sharp, F.R. Gram-negative bacterial molecules associated with Alzheimer disease pathology. Neurology 2016, 87, 2324-2332. [Google Scholar] [CrossRef] [PubMed].
Marizzoni、M.; Cattaneo、A.; Mirabelli、P.; Festari、C.; Lopizzo、N.; Nicolosi、V.; Mombelli、E.; Mazzelli、M.; Luongo、D.; Naviglio、D.; et al. Alzheimer's Diseaseにおける腸内細菌異常症とアミロイド病理の間のメディエーターとしての短鎖脂肪酸とリポ多糖。J. Alzheimer's Dis. 2020, 78, 683-697. [Google Scholar] [CrossRef].
慢性歯周炎とアルツハイマー病リスクとの関連性: レトロスペクティブ、集団ベース、マッチドコホート研究。Alzheimers Res. Ther. 2017, 9, 56. [Google Scholar] [CrossRef].
Kamer、A.R.、Pirraglia、E.、Tsui、W.、Rusinek、H.、Vallabhajosula、S.、Mosconi、L.、Yi、L.、McHugh、P.、Craig、R.G.、Svetcov、S.、ら。 歯周病は、正常高齢者における高い脳アミロイド負荷と関連する。Neurobiol. Aging 2015, 36, 627-633. [Google Scholar] [CrossRef].
Lipopolysaccharide Causes an Increase in Vitro and In Vivo intestinal Tight Junction Permeability by Inducing Enterocyte Membrane Expression and Localization of TLR-4 and CD14. Am. J. Pathol. 2013, 182, 375-387. [Google Scholar] [CrossRef].
Lukiw, W.J. Bacteroides fragilis Lipopolysaccharide and Inflammatory Signaling in Alzheimer's Disease. Front. Microbiol. 2016, 7, 1544. [Google Scholar] [CrossRef] [PubMed].
CD14は単球のS100A9誘導性炎症反応におけるTLR4の共受容体である。PLoS ONE 2016, 11, e0156377. [Google Scholar] [CrossRef] [PubMed].
腸-脳コミュニケーションにおける腸内細菌叢由来の短鎖脂肪酸の役割. Front. Endocrinol. 2020, 11, 25. [Google Scholar] [CrossRef].
アルツハイマー病診断のための脳脊髄液バイオシグネチャー。Braz. J. Psychiatry 2019, 41, 467-468. [Google Scholar] [CrossRef] [PubMed].
Zilberter, Y.; Zilberter, M. The vicious circle of hypometabolism in neurodegenerative diseases: 代謝補正の方法とメカニズム。J. Neurosci. Res. 2017, 95, 2217-2235. [Google Scholar] [CrossRef].
Den Besten, G.; van Eunen, K.; Groen, A.K.; Venema, K.; Reijngoud, D.J.; Bakker, B.M. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism. J. Lipid Res. 2013, 54, 2325-2340. [Google Scholar] [CrossRef]。
酪酸代謝産物および腸内細菌叢の制御によるアルツハイマー病におけるミクログリア介在性神経炎症に対するクロストリジウム・ブチリカムの効果。Mol. Nutr. Food Res. 2020, 64, 1900636. [Google Scholar] [CrossRef].
短鎖脂肪酸は腸管上皮細胞のGPR41およびGPR43を活性化し、マウスにおける炎症反応を促進する。Gastroenterology 2013, 145, 396-406.e10. [Google Scholar] [CrossRef].
腸内細菌アミロイドはマウスにおけるαシヌクレインの凝集と運動障害を促進する。[Google Scholar] [CrossRef].
神経変性における微生物アミロイドの役割。PLoS Pathog. 2017, 13, e1006654. [Google Scholar] [CrossRef].
Dua, P.Z.Y. Microbial Sources of Amyloid and Relevance to Amyloidesis and Alzheimer's Disease (AD). J. Alzheimers Dis. Park. 2015, 5, 177. [Google Scholar] [CrossRef].
Yao, Z.; Cary, B.P.; Bingman, C.A.; Wang, C.; Kreitler, D.F.; Satyshur, K.A.; Forest, K.T.; Gellman, S.H. Use of a Stereochemical Strategy To Probe the Mechanism of Phenol-Soluble Modulin α3 Toxicity. J. Am. Chem. Soc. 2019, 141, 7660-7664. [Google Scholar] [CrossRef] [PubMed].
神経炎症と腸内細菌叢: 神経炎症と腸内細菌叢:アルツハイマー病に対抗する代替治療標的の可能性?Front. Aging Neurosci. 2019, 11, 284. [Google Scholar] [CrossRef] [PubMed].
Cattaneo, A.; Cattane, N.; Galluzzi, S.; Provasi, S.; Lopizzo, N.; Festari, C.; Guerra, U.P.; Paghera, B.; Muscio, C.; Bianchetti, A.; et al. 認知機能障害高齢者における脳アミロイドーシスと炎症性腸内細菌分類群および末梢炎症マーカーとの関連。Neurobiol. Aging 2017, 49, 60-68. [Google Scholar] [CrossRef].
Doifode、T.; Giridharan、V.V.; Generoso、J.S.; Bhatti、G.; Collodel、A.; Schulz、P.E.; Forlenza、O.V.; Barichello、T. アルツハイマー病の病態生理における微生物叢-腸-脳軸の影響。薬理学的研究(Pharmacol. 2021年、164、105314。[Google Scholar] [CrossRef].
Shishov, V.A.; Kirovskaia, T.A.; Kudrin, V.S.; Oleskin, A.V. 大腸菌K-12の培養におけるアミンニューロメディエーター、その前駆体、および酸化生成物。Prikl. Biokhim. Mikrobiol. 2009, 45, 550-554. [Google Scholar] [CrossRef]。
Tsavkelova, E.A.; Botvinko, I.V.; Kudrin, V.S.; Oleskin, A.V. 高速液体クロマトグラフィーを用いた微生物中の神経伝達物質アミンの検出。Dokl. Biochem. 2000, 372, 115-117. [Google Scholar]
Siragusa, S.; De Angelis, M.; Di Cagno, R.; Rizzello, C.G.; Coda, R.; Gobbetti, M. Synthesis of γ-Aminobutyric Acid by Lactic Acid Bacteria Isolated from a Variety of Italian Chees. Appl. Microbiol. 2007, 73, 7283-7290. [Google Scholar] [CrossRef] [PubMed].
神経系におけるグルタミン酸作動性神経伝達の概要. 薬理学。Biochem. Behav. 2012, 100, 656-664. [Google Scholar] [CrossRef].
アルツハイマー病におけるグルタミン酸とNMDA受容体の役割。J. Alzheimers Dis. 2017, 57, 1041-1048. [Google Scholar] [CrossRef].
Bleich, S.; Römer, K.; Wiltfang, J.; Kornhuber, J. グルタミン酸とグルタミン酸受容体システム: 薬物作用の標的。Int. J. Geriatr. Psychiatry 2003, 18 (Suppl. 1), S33-S40. [Google Scholar] [CrossRef].
アルツハイマー病と血管性痴呆における脳脊髄液と血清中のアミノ酸濃度。J. Neural Transm. 公園。Dis。Dement. 1993、6、1-9。[Google Scholar] [CrossRef].
グルタミン酸神経毒性のイオン依存性。J. Neurosci. 1987, 7, 369-379. [Google Scholar] [CrossRef]。
エプスタイン、F.H.;リプトン、S.A.;ローゼンバーグ、P.A.神経障害の最終共通経路としての興奮性アミノ酸。N. Engl. 1994, 330, 613-622. [Google Scholar] [CrossRef].
Mothet、J.P.; Snyder、S.H. 脳内D-アミノ酸:神経調節物質の新しいクラス。Amino Acids 2012, 43, 1809-1810. [Google Scholar] [CrossRef].
D-アミノ酸の概要.Amino Acids 2017, 49, 1521-1533. [Google Scholar] [CrossRef] [PubMed].
ピリドキサールリン酸非依存性アミノ酸ラセマーゼであるグルタミン酸ラセマーゼの反応機構.J. Biochem. 1992, 112, 139-142. [Google Scholar] [CrossRef].
D-グルタミン酸、D-セリン、D-アラニンはアルツハイマー病や軽度認知障害患者の認知機能低下における役割が異なる。Pharmacol. Biochem. Behav. 2019, 185, 172760. [Google Scholar] [CrossRef].
Lin, C.H.; Yang, H.T.; Chiu, C.C.; Lane, H.Y. Blood levels of D-amino acid oxidase vs. D-amino acids in reflecting cognitive aging. Sci. Rep. 2017, 7, 14849. [Google Scholar] [CrossRef].
Sanchez, S.; Rodríguez-Sanoja, R.; Ramos, A.; Demain, A.L. Our microbes not only produce antibiotics, they also overproduce amino acids. J. Antibiot. 2017, 71, 26-36. [Google Scholar] [CrossRef] [PubMed].
コリネバクテリウム・グルタミカム(Corynebacterium glutamicum)機械感受性チャンネル: アミノ酸生産のための「グルタミン酸排出」の解明に向けて。Biophys. Rev. 2018, 10, 1359-1369. [Google Scholar] [CrossRef].
部位特異的7-ヒドロキシクマリンアミノ酸を含む新規グルタミン酸ラセマーゼの生合成: 原子レベルで明らかになった酵素-リガンドの多様性。ACS Cent. Sci. 2015, 1, 364-373. [Google Scholar] [CrossRef].
d-グルタミン酸ラセマーゼをコードするBrevibacterium lactofermentum ATCC 13869由来murI遺伝子の単離。FEMS Microbiol. Lett. 1999, 175, 193-196. [Google Scholar] [CrossRef].
Fotiadis, D.; Kanai, Y.; Palacín, M. アミノ酸トランスポーターのSLC3とSLC7ファミリー。Mol. Aspects Med. 2013, 34, 139-158. [Google Scholar] [CrossRef] [PubMed].
ヒト腸内細菌によるγ-アミノ酪酸産生. J. Appl. Microbiol. 2012, 113, 411-417. [Google Scholar] [CrossRef].
Lanctôt, K.L.; Herrmann, N.; Mazzotta, P.; Khan, L.R.; Ingber, N. アルツハイマー病におけるGABA作動性機能: アルツハイマー病におけるGABA作動性機能:機能障害の証拠と認知症の行動・心理症状の治療標的としての可能性。Can. J. Psychiatry 2004, 49, 439-453. [Google Scholar] [CrossRef] [PubMed].
アルツハイマー病における治療の選択肢: GABAの話。Curr. Pharm. Des. 2015, 21, 4960-4971. [Google Scholar] [CrossRef] [PubMed].
Naddafi, F.; Mirshafiey, A. The Neglected Role of Histamine in Alzheimer's Disease. Am. J. Alzheimer's Dis. Other Dement. 2013, 28, 327-336. [Google Scholar] [CrossRef].
ヒスタミンH4受容体はT制御細胞の頻度を最適化し、中枢神経系内での抗炎症反応を促進する。J. Immunol. 2012, 188, 541-547. [Google Scholar] [CrossRef] [PubMed].
ヒスタミン受容体2は腸内ヒスタミン分泌微生物に対する免疫反応に重要な影響を及ぼす。J. Allergy Clin. Immunol. 2014, 134, 744-746.e3. [Google Scholar] [CrossRef].
Alvarez、X.A.; Franco、A.; Fernández-Novoa、L.; Cacabelos、R. 軽度から中等度のアルツハイマー病患者におけるヒスタミン、IL-1β、TNF-αの血中濃度。Mol. Chem. Neuropathol. 1996, 29, 237-252. [Google Scholar] [CrossRef] [PubMed].
Stasiak, A.; Mussur, M.; Unzeta, M.; Lazewska, D.; Kiec-Kononowicz, K.; Fogel, W.A. 血管性痴呆モデルラットにおける中枢ヒスタミンレベル。J. Physiol. Pharmacol. 2011, 62, 549-558. [Google Scholar]
アルツハイマー型認知症患者における脳脊髄液中のセロトニンとその関連物質の濃度. Neurosci. Lett. 1992, 141, 9-12. [Google Scholar] [CrossRef].
アルツハイマー病における前頭葉と側頭葉のモノアミン神経支配。Brain Res. 1987, 401, 231-238. [Google Scholar] [CrossRef] [PubMed].
ロドリゲス、J.J.; Noristani、H.N.; Verkhratsky、A. 老化とアルツハイマー病におけるセロトニン作動性システム。Prog. Neurobiol. 2012, 99, 15-41. [Google Scholar] [CrossRef].
Lyte, M.; Freestone, P.P.E. (Eds.) . Microbial Endocrinology; Springer: New York, NY, USA, 2010. [Google Scholar].
Cutuli, D.; Giacovazzo, G.; Decandia, D.; Coccurello, R. 高齢者におけるアルツハイマー病とうつ病: 腸内細菌叢とセロトニンシグナル伝達をつなぐ軌跡。Front. Psychiatry 2022, 13. [Google Scholar] [CrossRef] [PubMed].
セロトニンの前駆体である5-HTPの産生と末梢での役割. Int. J. Tryptophan Res. 2009, 2, IJTR.S1022. [Google Scholar] [CrossRef].
. Strandwitz, P. Neurotransmitter modulation by the gut microbiota. Brain research 2018, 1693, 128-133. [Google Scholar] [CrossRef].
Crumeyrolle-Arias, M.; Jaglin, M.; Bruneau, A.; Vancassel, S.; Cardona, A.; Daugé, V.; Naudon, L.; Rabot, S. 腸内細菌叢の欠如は、ラットの急性ストレスに対する不安様行動と神経内分泌反応を増強する。Psychoneuroendocrinology 2014, 42, 207-217. [Google Scholar] [CrossRef].
Reigstad、C.S.; Salmonson、C.E.; Rainey、J.F.; Szurszewski、J.H.; Linden、D.R.; Sonnenburg、J.L.; Farrugia、G.; Kashyap、P.C. 腸内微生物は、エンテロクロマフィン細胞に対する短鎖脂肪酸の効果を介して大腸セロトニン産生を促進する。FASEB J. 2015, 29, 1395-1403. [Google Scholar] [CrossRef].
Roth, W.; Zadeh, K.; Vekariya, R.; Ge, Y.; Mohamadzadeh, M. Tryptophan Metabolism and Gut-Brain Homeostasis. Int. J. Mol. Sci. 2021, 22, 2973. [Google Scholar] [CrossRef] [PubMed].
Lukić, I.; Ivković, S.; Mitić, M.; Adžić, M. うつ病におけるトリプトファン代謝産物: 腸内細菌叢による調節。Front. Behav. Neurosci. 2022, 16, 987697. [Google Scholar] [CrossRef] [PubMed].
呉玲子(Wu, L.; Han, Y.; Zheng, Z.; Peng, G.; Liu, P.; Yue, S.; Zhu, S.; Chen, J.; Lv, H.; Shao, L.; et al. 無記名性軽度認知障害とアルツハイマー病における腸内細菌代謝産物の変化: 宿主と微生物の相互作用におけるシグナル。Nutrients 2021, 13, 228. [Google Scholar] [CrossRef] [PubMed].
高トリプトファン食で処理した高齢ラットの前頭皮質と海馬におけるセロトニン(5-HT)と脳由来神経栄養因子(BDFN)の発現の変化。Brain Res. Bull. 2015, 119 Pt A, 12-18. [Google Scholar] [CrossRef].
Noristani、H.N.; Verkhratsky、A.; Rodríguez、J.J. 高トリプトファン食は、アルツハイマー病のトリプルトランスジェニックマウスモデルにおけるCA1ニューロン内βアミロイドを減少させる。Aging Cell 2012, 11, 810-822. [Google Scholar] [CrossRef]。
Álvarez, J.; Fernández Real, J.M.; Guarner, F.; Gueimonde, M.; Rodríguez, J.M.; Saenz de Pipaon, M.; Sanz, Y. Microbiota intestinal y salud. Gastroenterol. Hepatol. 2021, 44, 519-535. [Google Scholar] [CrossRef].
Bloem, B.R.; Okun, M.S.; Klein, C. Parkinson's disease. Lancet 2021, 397, 2284-2303. [Google Scholar] [CrossRef].
Tolosa、E.; Garrido、A.; Scholz、S.W.; Poewe、W. パーキンソン病の診断における課題。Lancet Neurol. 2021, 20, 385-397. [Google Scholar] [CrossRef].
Bidesi, N.S.R.; Vang Andersen, I.; Windhorst, A.D.; Shalgunov, V.; Herth, M.M.: The role of neuroimaging in Parkinson's disease. J. Neurochem. 2021, 159, 660-689. [Google Scholar] [CrossRef].
Alzheimer's Disease Clinical Spectrum. Med. Clin. N. Am. 2019, 103, 263-293. [Google Scholar] [CrossRef].
Carey, G.; Görmezoğlu, M.; Jong, J.J.A.; Hofman, P.A.M.; Backes, W.H.; Dujardin, K.; Leentjens, A.F.G.: Neuroimaging of Anxiety in Parkinson's Disease: 系統的レビュー。Mov. Disord. 2021, 36, 327-339. [Google Scholar] [CrossRef] [PubMed].
Dirkx, M.F.; Bologna, M. パーキンソン病振戦の病態生理学。J. Neurol. Sci. 2022, 435, 120196. [Google Scholar] [CrossRef].
Dowling, L.R.; Strazzari, M.R.; Keely, S.; Kaiko, G.E. 腸神経系と腸上皮による腸脳軸の制御。J. Allergy Clin. Immunol. 2022, 150, 513-522. [Google Scholar] [CrossRef].
パーキンソン病における消化管機能障害: パーキンソン病における消化管機能障害:分子病理学と腸内細菌叢、プロバイオティクス、糞便微生物叢移植の意義。J. Neurol. 2022, 269, 1154-1163. [Google Scholar] [CrossRef].
パーキンソン病における消化管の関与: 病態生理、診断、管理。NPJ Park. Dis. 2022, 8, 31. [Google Scholar] [CrossRef].
短鎖脂肪酸と腸内細菌叢はパーキンソン病患者と年齢をマッチさせた対照患者で異なる。公園。Relat。Disord. 2016, 32, 66-72. [Google Scholar] [CrossRef] [PubMed].
Scheperjans, F.; Aho, V.; Pereira, P.A.B.; Koskinen, K.; Paulin, L.; Pekkonen, E.; Haapaniemi, E.; Kaakkola, S.; Eerola-Rautio, J.; Pohja, M.; et al. 腸内細菌叢はパーキンソン病と臨床表現型に関連している。Mov. Disord. 2015, 30, 350-358. [Google Scholar] [CrossRef].
Kang、D.W.、Park、J.G.、Ilhan、Z.E.、Wallstrom、G.、LaBaer、J.、Adams、J.B.、Krajmalnik-Brown、R. Autistic Childrenの腸内細菌叢におけるプレボテラおよびその他の発酵菌の発生率の低下。PLoS ONE 2013, 8, e68322. [Google Scholar] [CrossRef].
パーキンソン病における炎症と免疫機能障害。Nat. Immunol. 2022, 22, 657-673. [Google Scholar] [CrossRef].
腸内細菌叢と大うつ病性障害: 系統的レビューとメタアナリシス。J. Affect. Disord. 2020, 266, 1-13. [Google Scholar] [CrossRef] [PubMed].
腸内細菌叢とパーキンソン病との関連、メタアナリシス。Front. Aging Neurosci. 2021, 13, 636545. [Google Scholar] [CrossRef].
Lai,F.、Jiang,R.、Xie,W.、Liu,X.、Tang,Y.、Xiao,H.、Gao,J.、Jia,Y.、Bai,Q. Methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine (MPTP) Mouse Model of Parkinson's Diseaseにおける腸管病理と腸内細菌叢の変化。Neurochem. Res. 2018, 43, 1986-1999. [Google Scholar] [CrossRef].
Baiano, C.; Barone, P.; Trojano, L.; Santangelo, G. Prevalence and Clinical Aspects of Mild Cognitive Impairment in Parkinson's Disease: メタアナリシス。Mov. Disord. 2020, 35, 45-54. [Google Scholar] [CrossRef].
Gaig,C.、Compta,Y.、Heidbreder,A.、Marti,M.J.、Titulaer,M.J.、Crijnen,Y.、Högl,B.、Lewerenz,J.、Erro,M.E.、Garcia-Monco,J.C.、他。 抗IgLON5疾患における運動障害の頻度と特徴。Neurology 2021, 97, 1367-1381. [Google Scholar] [CrossRef].
パーキンソン病における腸管粘膜αシヌクレイン発現と粘膜微生物叢の変化。Appl. Microbiol. Biotechnol. 2023, 107, 1917-1929. [Google Scholar] [CrossRef].
Li,Y.、Xia,Y.、Yin,S.、Wan,F.、Hu,J.、Kou,L.、Sun,Y.、Wu,J.、Zhou,Q.、Huang,J.、他。 パーキンソン病におけるミクログリアα-シヌクレイン/TLRs/NF-κB/NLRP3インフラマソーム軸の標的化。Front. Immunol. 2021, 12, 719807. [Google Scholar] [CrossRef].
腸内異常胆汁酸異常はパーキンソン病の脂質代謝を説明するかもしれない。医学書院 仮説2020, 134, 109436. [Google Scholar] [CrossRef].
Matheoud, D.; Cannon, T.; Voisin, A.; Penttinen, A.M.; Ramet, L.; Fahmy, A.M.; Ducrot, C.; Laplante, A.; Bourque, M.J.; Zhu, L.; et al. 腸内感染がPink1-/-マウスのパーキンソン病様症状を誘発する。Nature 2019, 571, 565-569. [Google Scholar] [CrossRef].
Schneider,M.M.、Gautam,S.、Herling,T.W.、Andrzejewska,E.、Krainer,G.、Miller,A.M.、Trinkaus,V.A.、Peter,Q.A.E.、Ruggeri,F.S.、Vendruscolo,M.、他。 Hsc70解離機構はαシヌクレイン線維末端からモノマーユニットを直接除去する。Nat. Commun. 2021, 12, 5999. [Google Scholar] [CrossRef].
パーキンソン病患者の体重減少に対する腸内細菌叢の影響: パイロット研究。Future Microbiol. 2020, 15, 1393-1404. [Google Scholar] [CrossRef].
Pietrucci, D.; Teofani, A.; Unida, V.; Cerroni, R.; Biocca, S.; Stefani, A.; Desideri, A. 腸内細菌叢はパーキンソン病の良い予測因子となり得るか?機械学習によるアプローチ。Brain Sci. 2020, 10, 242. [Google Scholar] [CrossRef] [PubMed].
脳疾患における迷走神経刺激: 治療応用と生物学的メカニズム。Neurosci. Biobehav. 神経科学. Biobehav. Rev. 2021, 127, 37-53. [Google Scholar] [CrossRef].
腸に播種されたα-シヌクレイン線維は、高齢マウスにおいて腸機能障害と脳病理を特異的に促進する。Nat. Neurosci. 2020, 23, 327-336. [Google Scholar] [CrossRef] [PubMed].
Kim、S.; Kwon、S.H.; Kam、T.I.; Panicker、N.; Karuppagounder、S.S.; Lee、S.; Kulkarni、S.; Pasricha、P.J.; Lee、G.; Pomper、M.G.; et al. 病的α-シヌクレインの腸から脳への経神経伝播はパーキンソン病をモデル化する。Neuron 2019, 103, 627-641.e7. [Google Scholar] [CrossRef] [PubMed].
Yu, X.; Persillet, M.; Zhang, L.; Zhang, Y.; Xiuping, S.; Li, X.; Ran, G.; Breger, L.S.; Dovero, S.; Porras, G.; et al. 実験的シヌクレイン症における伝播経路としての血流の評価。Neurobiol. Dis. 2021, 150, 105255. [Google Scholar] [CrossRef] [PubMed].
楊 玲(Yang, L.; Zhou, R.; Tong, Y.; Chen, P.; Shen, Y.; Miao, S.; Liu, X. LPS誘発神経炎症におけるジヒドロテストステロンによる神経保護作用。Neurobiol. Dis. 2020, 140, 104814. [Google Scholar] [CrossRef].
Perez-Pardo、P.; Dodiya、H.B.; Engen、P.A.; Forsyth、C.B.; Huschens、A.M.; Shaikh、M.; Voigt、R.M.; Naqib、A.; Green、S.J.; Kordower、J.H.; et al. パーキンソン病の腸脳軸におけるTLR4の役割: 男性からマウスへのトランスレーショナル研究。Gut 2019, 68, 829-843. [Google Scholar] [CrossRef].
Zhao, Z.; Li, F.; Ning, J.; Peng, R.; Shang, J.; Liu, H.; Shang, M.; Bao, X.Q.; Zhang, D. 新規化合物FLZは、微生物叢-腸-脳軸を介してTLR4/MyD88/NF-κB経路を抑制することにより、ロテノン誘発PDマウスモデルを緩和する。Acta Pharm. Acta Pharm. B 2021, 11, 2859-2879. [Google Scholar] [CrossRef].
Abgアブドワハブ、D.Y.; ガウ、C.H.; ザカリア、R.; ムトゥカルパン、M.K.; アラビ、B.S.; アブドラ、Z.; アラフィア、A.; アブドラ、J.M.; ムトゥラジュ、S. 運動行動の媒介における線条体と小脳の神経伝達物質と神経炎症のクロストークに関する総説。Biomed. Res. Int., 2019, 1767203. [Google Scholar] [CrossRef].
Thompson, A.I.; Lees, C.W. Genetics of ulcerative colitis. Inflamm. Bowel Dis. 2011, 17, 831-848. [Google Scholar] [CrossRef] [PubMed].
Tatton-Brown, K.; Murray, A.; Hanks, S.; Douglas, J.; Armstrong, R.; Banka, S.; Bird, L.M.; Clericuzio, C.L.; Cormier-Daire, V.; Cushing, T.; et al. ウィーバー症候群とEZH2遺伝子変異: 臨床表現型の解明。Am. J. Med. Genet. A 2013, 161, 2972-2980. [Google Scholar] [CrossRef] [PubMed].
Fink, J.; Fuhrmann, R.; Scharnweber, T.; Franke, R.P. 単球とマクロファージの刺激: 表面粗さの影響の可能性。Clin. Hemorheol. 2008, 39, 205-212. [Google Scholar] [CrossRef] [PubMed].
Costa, H.N.; Esteves, A.R.; Empadinhas, N.; Cardoso, S.M. Parkinson's Disease: 多系統疾患。Neurosci. Bull. 2023, 39, 113-124. [Google Scholar] [CrossRef] [PubMed].
パーキンソン病におけるスフィンゴ糖脂質と神経炎症。Mol. Neurodegener. 2020, 15, 59. [Google Scholar] [CrossRef]。
パーキンソン病におけるToll様受容体と神経炎症の役割。J. Neuroinflammation 2022, 19, 135. [Google Scholar] [CrossRef]。
Jennings, D.; Huntwork-Rodriguez, S.; Henry, A.G.; Sasaki, J.C.; Meisner, R.; Diaz, D.; Solanoy, H.; Wang, X.; Negrou, E.; Bondar, V.V.; et al. パーキンソン病に対するLRRK2阻害剤DNL201の前臨床および臨床評価。Sci. Transl. Med. 2022, 14, eabj2658. [Google Scholar] [CrossRef].
PINK1/Parkin Mediated Mitophagy, Ca2+ Signalling, and ER-Mitochondria Contacts in Parkinson's Disease. Int. J. Mol. サイエンス2020, 21, 1772. [Google Scholar] [CrossRef].
パーキンソン病の細胞生物学。J. Cell Biol. 2021, 220, e202012095. [Google Scholar] [CrossRef].
α-シヌクレインのミスフォールディングと凝集: パーキンソン病発症における意義。Biochim. Biophys. Acta (BBA) Proteins Proteom. 2019, 1867, 890-908. [Google Scholar] [CrossRef].
Wang, Y.; Liu, W.; He, X.; Zhou, F. パーキンソン病関連DJ-1変異は、Akt/GSK-3β経路を通じてタウタンパク質の異常リン酸化を増加させる。J. Mol. Neurosci. 2013, 51, 911-918. [Google Scholar] [CrossRef].
パーキンソン病関連タンパク質DJ-1の変異は、DJ-1の二量体化のエネルギーを変化させる。J. Chem. Inf. Model. 2019, 59, 1497-1507. [Google Scholar] [CrossRef] [PubMed].
呉 聡(Wu, S.; Lei, L.; Song, Y.; Liu, M.; Lu, S.; Lou, D.; Shi, Y.; Wang, Z.; He, D. ホップ1およびピンク1の変異は線虫の神経毒性の脆弱性を減弱させる: パーキンソン病におけるミトコンドリア関連膜タンパク質の役割。Exp. Neurol. 2018, 309, 67-78. [Google Scholar] [CrossRef].
Rostami, J.; Mothes, T.; Kolahdouzan, M.; Eriksson, O.; Moslem, M.; Bergström, J.; Ingelsson, M.; O'Callaghan, P.; Healy, L.M.; Falk, A.; et al. アストロサイトとミクログリア間のクロストークは、α-シヌクレインとアミロイドβ凝集体の分解の増加をもたらす。J. Neuroinflammation 2021, 18, 124. [Google Scholar] [Ref]。
. Mossine, V.V.; Waters, J.K.; Sun, G.Y.; Gu, Z.; Mawhinney, T.P. Microglia Signaling Pathway Reporters Unveiled Manganese Activation of the Interferon/STAT1 Pathway and Its Mitigation by Flavonoids. Mol. Neurobiol. 2023, 60(8), 4679-4692. [Google Scholar] [CrossRef].
Griñán-Ferré, C.; Bellver-Sanchis, A.; Izquierdo, V.; Corpas, R.; Roig-Soriano, J.; Chillón, M.; Andres-Lacueva, C.; Somogyvári, M.; Sőti, C.; Sanfeliu, C.; et al. 認知機能低下とアルツハイマー病病態におけるレスベラトロールの多面的神経保護効果: 抗酸化物質からエピジェネティック治療へ。Ageing Res. Rev. 2021, 67, 101271. [Google Scholar] [CrossRef] [PubMed].
また、「臓器移植によるパーキンソン病発症の予防における微生物叢の保護的役割」と題して、臓器移植によるパーキンソン病発症の予防における微生物叢の保護的役割について、臓器移植によるパーキンソン病発症の予防における微生物叢の保護的役割について、臓器移植によるパーキンソン病発症の予防における微生物叢の保護的役割について、臓器移植によるパーキンソン病発症の予防における微生物叢の保護的役割について、臓器移植によるパーキンソン病発症の予防における微生物叢の保護的役割について発表した。Food Funct. 2023, 14, 4647-4661. [Google Scholar] [CrossRef].
Su, C.F.; Jiang, L.; Zhang, X.W.; Iyaswamy, A.; Li, M. Resveratrol in Rodent Models of Parkinson's Disease: 実験研究の系統的レビュー。Front. Pharmacol. 2021, 12, 644219. [Google Scholar] [CrossRef].
Nandi, A.; Yan, L.J.; Jana, C.K.; Das, N. Role of Catalase in Oxidative Stress- and Age-Associated Degenerative Diseases. Oxid. Med. 細胞。Longev. 2019, 2019, 9613090. [Google Scholar] [CrossRef] [PubMed].
Wang, X.; Zhou, Y.; Gao, Q.; Ping, D.; Wang, Y.; Wu, W.; Lin, X.; Fang, Y.; Zhang, J.; Shao, A. The Role of Exosomal microRNAs and Oxidative Stress in Neurodegenerative Diseases. Oxid. Med. Cell. Longev. 2020, 2020, 3232869. [Google Scholar] [CrossRef].
Trist, B.G.; Hare, D.J.; Double, K.L. Oxidative stress in the aging substantia nigra and the etiology of Parkinson's disease. Aging Cell 2019, 18, e13031. [Google Scholar] [CrossRef].
Arab, H.H.; Safar, M.M.; Shahin, N.N. Targeting ROS-Dependent AKT/GSK-3β/NF-κB and DJ-1/Nrf2 Pathways by Dapagliflozin Attenuates Neuronal Injury and Motor Dysfunction in Rotenone-Induced Parkinson's Disease Rat Model. ACS Chem. Neurosci. 2021, 12, 689-703. [Google Scholar] [CrossRef].
パーキンソン病におけるミトコンドリアのサーチュイン。Neurochem. Res. 2022, 47, 1491-1502. [Google Scholar] [CrossRef] [PubMed].
パーキンソン病およびパーキンソン病性疾患におけるドパミントランスポーターSPECTイメージング。Turk. J. Med. Sci. 2021, 51, 400-410. [Google Scholar] [CrossRef] [PubMed].
ラティフ、S.;Jahangeer、M.;マクヌーンRazia、D.;Ashiq、M.;Ghaffar、A.;アクラム、M.;エルアラム、A.;Bouyahya、A.;Garipova、L.;アリShariati、M.;らパーキンソン病におけるドーパミン。Clinica Chimica Acta 2021, 522, 114-126. [Google Scholar] [CrossRef].
Aryal, S.; Skinner, T.; Bridges, B.; Weber, J.T. The Pathology of Parkinson's Disease and Potential Benefit of Dietary Polyphenols. Molecules 2020, 25, 4382. [Google Scholar] [CrossRef] [PubMed].
神経変性疾患におけるオリーブオイルポリフェノール. Adv. Exp. Med. Biol. 2020, 1195, 77-91. [Google Scholar].
パーキンソン病におけるNF-κBを介した神経炎症とポリフェノールの潜在的治療効果。Neurotox. Res. 2020, 37, 491-507. [Google Scholar] [CrossRef] [PubMed].
腸-脳軸を介したパーキンソン病の引き金となりうる腸内微小環境の変化. J. Biomed. Sci. 2022, 29, 54. [Google Scholar] [CrossRef].
パーキンソン病の新たな治療標的となる腸内細菌叢: パーキンソン病の新規治療標的。Front. Immunol. 2022, 13, 937555. [Google Scholar] [CrossRef].
パーキンソン病と腸内細菌叢. Ann. Nutr. Metab. 2021, 77 (Suppl. 2), 28-35. [Google Scholar] [CrossRef].
神経変性疾患における神経炎症: 神経変性疾患における神経炎症:ミクログリアとアストロサイトの役割。神経変性疾患における神経炎症:ミクログリアとアストロサイトの役割。Neurodegener. 2020, 9, 42. [Google Scholar] [CrossRef].
神経変性疾患におけるミクログリア細胞と相互作用するアストロサイトの神経免疫学的役割. Int. J. Mol. Sci. 2023, 24, 1599. [Google Scholar] [CrossRef].
アギルマン、G.; ユー、K.B.; シャオ、E.Y. 腸脳軸を横断するシグナル伝達炎症。Science 2021, 374, 1087-1092. [Google Scholar] [CrossRef]。
Sochocka, M.; Donskow-Łysoniewska, K.; Diniz, B.S.; Kurpas, D.; Brzozowska, E.; Leszek, J. The Gut Microbiome Alterations and Inflammation-Driven Pathogenesis of Alzheimer's Disease-A Critical Review. Mol. Neurobiol. 2019, 56, 1841-1851. [Google Scholar] [CrossRef] [PubMed].
Eicher, T.P.; Mohajeri, M.H. Overlapping Mechanisms of Action of Brain-Active Bacteria and Bacterial Metabolites in the Pathogenesis of Common Brain Diseases. 栄養素2022、14、2661。[Google Scholar] [CrossRef].
腸内細菌代謝産物による一般的な神経疾患の制御。Exp. Mol. Med. 2021, 53, 1821-1833. [Google Scholar] [CrossRef] [PubMed].
パーキンソン病患者における短鎖脂肪酸の糞便中および血漿中濃度と腸内細菌叢および臨床的重症度との関連。Neurology 2022, 98, 848-858. [Google Scholar] [CrossRef] [PubMed].
パーキンソン病のメタゲノム解析から、複数の疾患メカニズムに腸内細菌叢が関与していることが示唆された。Nat. Commun. 2022, 13, 6958. [Google Scholar] [CrossRef] [PubMed].
Vascellari, S.; Palmas, V.; Melis, M.; Pisanu, S.; Cusano, R.; Uva, P.; Perra, D.; Madau, V.; Sarchioto, M.; Oppo, V.; et al. パーキンソン病に関連する腸内細菌叢とメタボロームの変化. [Google Scholar] [CrossRef].
Qian, Y.; Yang, X.; Xu, S.; Huang, P.; Li, B.; Du, J.; He, Y.; Su, B.; Xu, L.M.; Wang, L.; et al. パーキンソン病の潜在的バイオマーカーとしての腸内メタゲノミクス由来遺伝子。Brain 2020, 143, 2474-2489. [Google Scholar] [CrossRef].
様々な神経疾患の発症における腸内細菌叢の役割。Neurologia 2022, 37, 492-498. [Google Scholar] [CrossRef].
パーキンソン病の初期病理過程としてのドーパミン作動性軸索変性の証拠。Park. Relat. Disord. 2018, 56, 9-15. [Google Scholar] [CrossRef] [PubMed].
パーキンソン病で失われた黒質線維を、臨床にヒントを得た設計基準に基づいて回復させる。Brain Res. Bull. 2021, 175, 168-185. [Google Scholar] [CrossRef] [PubMed].
α-シヌクレインの凝集は神経筋接合部変性を通じて筋萎縮を引き起こす。J. Cachexia Sarcopenia Muscle 2023, 14, 226-242. [Google Scholar] [CrossRef].
Dopkins, N.; Nagarkatti, P.S.; Nagarkatti, M. The role of gut microbiome and associated metabolome in regulation of neuroinflammation in multiple sclerosis and its implications in attenuating chronic inflammation in other inflammatory and autoimmune disorders. Immunology 2018, 154, 178-185. [Google Scholar] [CrossRef] [PubMed].
中枢神経系と神経疾患に対する微生物叢の影響: 腸脳軸。J. Neuroinflammation 2019, 16, 53. [Google Scholar】【CrossRef】。
Hardiman, O.; Al-Chalabi, A.; Chio, A.; Corr, E.M.; Logroscino, G.; Robberecht, W.; Shaw, P.J.; Simmons, Z.; van den Berg, L.H. Amyotrophic lateral sclerosis. Nat. Rev. Dis. Primers 2017, 3, 17071. [Google Scholar] [CrossRef].
Oskarsson, B.; Gendron, T.F.; Staff, N.P. Amyotrophic Lateral Sclerosis: An. 2018年のアップデート。Mayo Clin. Proc. 2018, 93, 1617-1628. [Google Scholar] [CrossRef].
Niedermeyer, S.; Murn, M.; Choi, P.J. Respiratory Failure in Amyotrophic Lateral Sclerosis. Chest 2019, 155, 401-408. [Google Scholar] [CrossRef].
Cantarel, B.L.; Waubant, E.; Chehoud, C.; Kuczynski, J.; DeSantis, T.Z.; Warrington, J.; Venkatesan, A.; Fraser, C.M.; Mowry, E.M. 多発性硬化症における腸内細菌叢: 多発性硬化症における腸内細菌叢:免疫調節薬の影響の可能性。J. Investig. Med. 2015, 63, 729-734. [Google Scholar] [CrossRef].
Ntranos, A.; Park, H.J.; Wentling, M.; Tolstikov, V.; Amatruda, M.; Inbar, B.; Kim-Schulze, S.; Frazier, C.; Button, J.; Kiebish, M.A.; et al. 多発性硬化症脳脊髄液および血漿中の細菌性神経毒性代謝産物。Brain 2022, 145, 569-583. [Google Scholar] [CrossRef].
Cox、L.M.;Calcagno、N.;Gauthier、C.;Madore、C.;Butovsky、O.;Weiner、H.L.筋萎縮性側索硬化症モデルにおいて、微生物叢が神経変性ミクログリアを抑制する。Microbiome 2022, 10, 47. [Google Scholar] [CrossRef]。
筋萎縮性側索硬化症患者における腸内細菌叢と代謝の変化。(1)筋萎縮性側索硬化症患者における腸内細菌叢と代謝の変化. [Google Scholar] [CrossRef].
Carabotti, M.; Scirocco, A.; Maselli, M.A.; Severi, C. 腸脳軸: 腸内細菌叢、中枢神経系、腸神経系の相互作用。Ann. Gastroenterol. 2015, 28, 203-209. [Google Scholar].
筋萎縮性側索硬化症における腸の感覚: Microbiome of Mice and Men. Front. Cell. Infect. Microbiol. 2022, 12, 839526. [Google Scholar] [CrossRef].
脳発達と神経変性疾患におけるマイクロバイオームの役割。Molecules 2022, 27, 3402. [Google Scholar] [CrossRef]。
Di Gioia, D.; Bozzi Cionci, N.; Baffoni, L.; Amoruso, A.; Pane, M.; Mogna, L.; Gaggìa, F.; Lucenti, M.A.; Bersano, E.; Cantello, R.; et al. 筋萎縮性側索硬化症における微生物組成に関する前向き縦断研究。BMC Med. 2020, 18, 153. [Google Scholar] [CrossRef].
Lee,H.;Lee,J.J.;Park,N.Y.;Dubey,S.K.;Kim,T.;Ruan,K.;Lim,S.B.;Park,S.H.;Ha,S.;Kovlyagina,I.;他。 選択的に脆弱な運動ニューロンサブタイプのマルチオーム解析から、ALSにおける脂質代謝の変化が示唆された。Nat. Neurosci. 2021, 24, 1673-1685. [Google Scholar] [CrossRef]。
神経疾患における腸内細菌叢の役割とその治療的意義。J. Clin. Med. 2023, 12, 1650. [Google Scholar] [CrossRef].
多発性硬化症の理解を深めるための有望なツールとしてのメタボロミクス: 最近の進歩のレビュー。Biomed. J. 2022, 45, 594-606. [Google Scholar] [CrossRef].
Bogie、J.F.J.; Haidar、M.; Kooij、G.; Hendriks、J.J.A. CNS障害の進行と解決における脂肪酸代謝。Adv. Drug Deliv. Rev. 2020, 159, 198-213. [Google Scholar] [CrossRef].
Bhargava, P.; Anthony, D.C. Metabolomics in multiple sclerosis disease course and progression. Mult. Scler. J. 2020, 26, 591-598. [Google Scholar] [CrossRef].
グラチラマー酢酸塩による治療を受けた多発性硬化症患者における12ヵ月間の前向きPentraxin-3およびメタボローム評価。J. Neuroimmunol. 2020, 348, 577385. [Google Scholar] [CrossRef].
多発性硬化症におけるバイオマーカーの現状と将来。Int. J. Mol. Sci. 2022, 23, 5877. [Google Scholar] [CrossRef].
神経疾患における内因性リポ多糖の役割。Cells 2022, 11, 4038. [Google Scholar] [CrossRef].
Rival, M.; Galoppin, M.; Thouvenot, E. 初期の多発性硬化症における生物学的マーカー: Radiologically Isolated Syndromeへの道。Front. Immunol. 2022, 13, 866092. [Google Scholar] [CrossRef].
多発性硬化症における神経変性: 多発性硬化症における神経変性:サイレントプログレッションの症状、バイオマーカー、神経保護療法-キヌレニンが重要な役割を果たす。Molecules 2021, 26, 3423. [Google Scholar] [CrossRef].
Di Majo, D.; Cacciabaudo, F.; Accardi, G.; Gambino, G.; Giglia, G.; Ferraro, G.; Candore, G.; Sardo, P. 多発性硬化症における神経炎症に対抗するツールとしてのケトジェニックおよび修正地中海食: 栄養学的示唆。栄養素2022、14、2384。[Googleスカラー] [クロスリーフ]。
Lovelace, M.D.; Varney, B.; Sundaram, G.; Franco, N.F.; Ng, M.L.; Pai, S.; Lim, C.K.; Guillemin, G.J.; Brew, B.J. 多発性硬化症におけるトリプトファン代謝のキヌレニン経路の役割に関する現在の証拠。Front. Immunol. 2016, 7, 246. [Google Scholar] [CrossRef].
Joisten, N.; Ruas, J.L.; Braidy, N.; Guillemin, G.J.; Zimmer, P. 慢性疾患におけるキヌレニン経路: 慢性疾患におけるキヌレニン経路:代償機構か駆動力か?Trends Mol. Med. 2021, 27, 946-954. [Google Scholar] [CrossRef].
Lim,C.K.;Bilgin,A.;Lovejoy,D.B.;Tan,V.;Bustamante,S.;Taylor,B.V.;Bessede,A.;Brew,B.J.;Guillemin,G.J. Kynurenine経路メタボロミクスは、多発性硬化症の進行を予測し、そのメカニズム的洞察を提供する。Sci. Rep. 2017, 7, 41473. [Google Scholar] [CrossRef].
Rajda, C.; Galla, Z.; Polyák, H.; Maróti, Z.; Babarczy, K.; Pukoli, D.; Vécsei, L. Cerebrospinal Fluid Neurofilament Light Chain Is Associated with Kynurenine Pathway Metabolite Changes in Multiple Sclerosis. Int. J. Mol. Sci. 2020, 21, 2665. [Google Scholar] [CrossRef].
(1)多発性硬化症におけるキヌレニン経路の変化(2)多発性硬化症におけるキヌレニン経路の変化(3)多発性硬化症におけるキヌレニン経路の変化(4)多発性硬化症におけるキヌレニン経路の変化(5)多発性硬化症におけるキヌレニン経路の変化(6). Acta Pharm. Sin. B 2021, 11, 373-393. [Google Scholar] [CrossRef].
Lee,J.M.、Tan,V.、Lovejoy,D.、Braidy,N.、Rowe,D.B.、Brew,B.J.、Guillemin,G.J.筋萎縮性側索硬化症の神経病態におけるキノリン酸の関与。Neuropharmacology 2017, 112, 346-364. [Google Scholar] [CrossRef].
Lamb, Y.N. Ocrelizumab: 多発性硬化症におけるレビュー。Drugs 2022, 82, 323-334. [Google Scholar] [CrossRef].
Banati, R.B.; Newcombe, J.; Gunn, R.N.; Cagnin, A.; Turkheimer, F.; Heppner, F.; Price, G.; Wegner, F.; Giovannoni, G.; Miller, D.H.; et al. 多発性硬化症における脳内末梢ベンゾジアゼピン結合部位。Brain 2000, 123, 2321-2337. [Google Scholar] [CrossRef].
Parravicini,C.、Lecca,D.、Marangon,D.、Coppolino,G.T.、Daniele,S.、Bonfanti,E.、Fumafalli,M.、Raveglia,L.、Martini,C.、Gianazza,E.、他。 反復的創薬パイプラインによる初のin vivo GPR17リガンドの開発: 多発性硬化症の新規疾患修飾戦略。PLoS ONE 2020, 15, e0231483. [Google Scholar] [CrossRef].
Mey, G.M.; Mahajan, K.R.; DeSilva, T.M. 多発性硬化症における神経変性。WIREs Mech. Dis. 2023, 15, e1583. [Google Scholar] [CrossRef].
Lassmann, H. Multiple Sclerosis Pathology. Cold Spring Harb. Perspect. Med. 2018, 8, a028936. [Google Scholar] [CrossRef].
Bargiela, D.; Chinnery, P.F. Mitochondria in neuroinflammation-Multiple sclerosis (MS), Leber hereditary optic neuropathy (LHON) and LHON-MS. Neurosci. Lett. 2019, 710, 132932. [Google Scholar] [CrossRef]。
進行性多発性硬化症における病理学的メカニズム。Lancet Neurol. 2015, 14, 183-193. [Google Scholar] [CrossRef] [PubMed].
Rothhammer,V.、Mascanfroni,I.D.、Bunse,L.、Takenaka,M.C.、Kenison,J.E.、Mayo,L.、Chao,C.C.、Patel,B.、Yan,R.、Blain,M.、他。 I型インターフェロンとトリプトファンの微生物代謝産物は、アリル炭化水素受容体を介してアストロサイトの活性と中枢神経系の炎症を調節する。Nat. Med. 2016, 22, 586-597. [Google Scholar] [CrossRef] [PubMed].
インドキシル硫酸およびp-クレゾール硫酸の慢性腎臓病への影響とAST-120の緩和効果。Toxins 2018, 10, 367. [Google Scholar] [CrossRef] [PubMed].
Needham,B.D.、Funabashi,M.、Adame,M.D.、Wang,Z.、Boktor,J.C.、Haney,J.、Wu,W.L.、Rabut,C.、Ladinsky,M.S.、Hwang,S.J.、他。 腸由来の代謝産物がマウスの脳活動と不安行動を変化させる。Nature 2022, 602, 647-653. [Google Scholar] [CrossRef].
Laudani、S; Torrisi、S.A.; Alboni、S; Bastiaanssen、T.F.S.; Benatti、C; Rivi、V; Moloney、R.D.; Fuochi、V; Furneri、P.M.; Drago、F; et al. 腸内細菌叢の変化は、p-クレゾール誘発性ドーパミン作動性機能障害に関連した外傷性ストレス感受性を促進する。Brain Behav. Immun. 2023, 107, 385-396. [Google Scholar] [CrossRef].
多発性硬化症および視神経脊髄炎スペクトラム障害における髄液の核磁気共鳴法によるメタボロームプロファイリング。PLoS ONE 2017, 12, e0181758. [Google Scholar] [CrossRef].
Luo, S.; Ma, C.; Zhu, M.Q.; Ju, W.N.; Yang, Y.; Wang, X. Application of Iron Oxide Nanoparticles in the Diagnosis and Treatment of Neurodegenerative Diseases With Emphasis on Alzheimer's Disease. Front. Cell Neurosci. 2020, 14, 21. [Google Scholar] [CrossRef].
ヒト運動ニューロン疾患における腸炎と腸内細菌異常症。Physiol. Rep. 2017, 5, e13443. [Google Scholar] [CrossRef].
オートファジーをモニタリングするためのアッセイの使用と解釈のためのガイドライン(第3版)。Autophagy 2016, 12, 1-222. [Google Scholar] [CrossRef].
マウスの筋萎縮性側索硬化症の進行を遅らせるための標的代謝物。Metabolites 2022, 12, 1253. [Google Scholar] [CrossRef].
Spielman, L.J.; Gibson, D.L.; Klegeris, A. 不健康な腸、不健康な脳: 神経変性疾患における腸内細菌叢の役割。Neurochem. Int. 2018, 120, 149-163. [Google Scholar] [CrossRef].
Hong, D.; Zhang, C.; Wu, W.; Lu, X.; Zhang, L. Modulation of the gut-brain axis via the gut microbiota: 筋萎縮性側索硬化症の治療における新時代。Front. Neurol. 2023, 14, 1133546. [Google Scholar] [CrossRef].
下肢発症型ALSの緩徐進行性亜型と典型的なALSとの鑑別は、疾患の進行時期と表現型に依存する。Front. Neurol. 2022, 13, 872500. [Google Scholar] [CrossRef] [PubMed].
Druml, W. Intestinaler Crosstalk. Med. Klin. Intensivmed. Notfmed. 2018, 113, 470-477. [Google Scholar] [CrossRef].
Niccolai, E.; Di Pilato, V.; Nannini, G.; Baldi, S.; Russo, E.; Zucchi, E.; Martinelli, I.; Menicatti, M.; Bartolucci, G.; Mandrioli, J.; et al. ALSにおける腸内細菌叢-免疫軸: ALSにおける腸内細菌叢-免疫軸:疾患の不均一性を読み解く役割?Biomedicines 2021, 9, 753. [Google Scholar] [CrossRef].
MIFの免疫生物学: MIFの免疫生物学:機能、遺伝学、精密医療への展望。Nat. Rev. Rheumatol. 2019, 15, 427-437. [Google Scholar] [CrossRef].
Huang, S.; Wang, Z.; Zhou, J.; Huang, J.; Zhou, L.; Luo, J.; Wan, Y.Y.; Long, H.; Zhu, B. EZH2阻害剤GSK126は、骨髄由来抑制細胞の産生を促進することにより抗腫瘍免疫を抑制する。Cancer Res. 2019, 79, 2009-2020. [Google Scholar] [CrossRef].
Tinkov, A.A.; Martins, A.C.; Avila, D.S.; Gritsenko, V.A.; Skalny, A.V.; Santamaria, A.; Lee, E.; Bowman, A.B.; Aschner, M. Mn誘発神経毒性における潜在的なプレーヤーとしての腸内細菌叢。Biomolecules 2021, 11, 1292. [Google Scholar] [CrossRef]。
慢性炎症におけるリポ多糖誘導細胞シグナルの役割。慢性ストレス2022, 6, 247054702210763. [Google Scholar] [CrossRef] [PubMed].
シャーウィン、E.; ダイナン、TG; クライアン、J.F. 脳の健康と病気における腸内細菌叢の役割を理解するための最近の進展。Ann. N. Y. Acad. Sci. 2018, 1420, 5-25. [Google Scholar] [CrossRef] [PubMed].
Gibson,G.R.、Hutkins,R.、Sanders,M.E.、Prescott,S.L.、Reimer,R.A.、Salminen,S.J.、Scott,K.、Stanton,C.、Swanson,K.S.、Cani,P.D.、他、専門家コンセンサス文書: プレバイオティクスの定義と範囲に関する国際プロバイオティクス・プレバイオティクス科学協会(ISAPP)のコンセンサス・ステートメント。Nat. Rev. Gastroenterol. Hepatol. 2017, 14, 491-502. [Google Scholar] [CrossRef] [PubMed].
サイコバイオティクスと細菌-腸-脳シグナルの操作。Trends Neurosci. 2016, 39, 763-781. [Google Scholar] [CrossRef] [PubMed].
プレバイオティクス、プロバイオティクス、シンバイオティクスのうつ病に対する効果: メタアナリシスの結果。BMC Psychiatry 2023, 23, 477. [Google Scholar] [CrossRef] [PubMed].
呉 鍾(Wu, J.; Wang, K.; Wang, X.; Pang, Y.; Jiang, C. 代謝性疾患における腸内細菌叢とその代謝産物の役割。Protein Cell 2021, 12, 360-373. [Google Scholar] [CrossRef].
Ma, L.; Tu, H.; Chen, T. Postbiotics in Human Health: A Narrative Review. Nutrients 2023, 15, 291. [Google Scholar] [CrossRef].
Ooijevaar, R.E.; Terveer, E.M.; Verspaget, H.W.; Kuijper, E.J.; Keller, J.J. 便微生物移植の臨床応用と可能性。Annu. Rev. Med. 2019, 70, 335-351. [Google Scholar] [CrossRef].
Sun, Y.; Baptista, L.C.; Roberts, L.M.; Jumbo-Lucioni, P.; McMahon, L.L.; Buford, T.W.; Carter, C.S. The Gut Microbiome as a Therapeutic Target for Cognitive Impairment. J. Gerontol. Ser. A 2020, 75, 1242-1250. [Google Scholar] [CrossRef] [PubMed].
新生児から分離した乳酸菌株の潜在的な精神生物学的効果と健康なマウスモデルにおける腸内細菌叢と回腸トランスクリプトームへの影響に関する学際的かつ比較的研究。Front. Cell. Infect. Microbiol. 2019, 9, 269. [Google Scholar] [CrossRef].
Liao,J.F.、Cheng,Y.F.、You,S.T.、Kuo,W.C.、Huang,C.W.、Chiou,J.J.、Hsu,C.C.、Hsieh-Li,H.H.、Wang,S.、Tsai,Y.C. ラクトバチルス・プランタラムPS128は、1-メチル-4-フェニル-1, 2, 3, 6-テトラヒドロピリジン誘発パーキンソン病モデルマウスにおける神経変性進行を緩和する。Brain Behav. Immun. 2020, 90, 26-46. [Google Scholar] [CrossRef].
神経変性疾患の治療における糞便微生物叢移植の役割: 総説。Int. J. Mol. Sci. 2023, 24, 1001. [Google Scholar] [CrossRef].
Sampaio, K.B.; Fusco, V.; Alves, J.L.d.B.; de Souza, E.L. Probiotics: 概念、進化、およびアプリケーション。In Probiotics for Human Nutrition in Health and Disease; Elsevier: Amsterdam, The Netherlands, 2022; pp. [Google Scholar].
Adıgüzel、E.; Çiçek、B.; Ünal、G.; Aydın、M.F.; Barlak-Keti、D. プロバイオティクスとプレバイオティクスは、自閉症の出生前VPA誘発げっ歯類モデルにおける行動障害、炎症反応、および腸内細菌異常を緩和する。Physiol. 2022, 256, 113961. [Google Scholar] [CrossRef] [PubMed].
大腸がん患者におけるプロバイオティクスの補充: ランダム化比較試験のシステマティックレビュー。Nutr. 2021, 80, 22-49. [Google Scholar] [CrossRef] [PubMed].
アルツハイマー病モデルマウス由来の腸内細菌叢の移植はC57BL/6マウスの記憶機能と神経新生を障害する。Brain Behav. Immun. 2021, 98, 357-365. [Google Scholar] [CrossRef] [PubMed].
アルツハイマー病患者の腸内細菌叢を移植したグノトビオティックマウスの糞便代謝産物. Biosci. Biotechnol. Biochem. 2019, 83, 2144-2152. [Google Scholar] [CrossRef].
Dodiya, H.B.; Kuntz, T.; Shaik, S.M.; Baufeld, C.; Leibowitz, J.; Zhang, X.; Gottel, N.; Zhang, X.; Butovsky, O.; Gilbert, J.A.; et al. Sex-specific effects of microbiome perturbations on cerebral Aβ amyloidosis and microglia phenotypes. J. Exp. Med. 2019, 216, 1542-1560. [Google Scholar】【CrossRef】。
Wang, M.; Cao, J.; Gong, C.; Amakye, W.K.; Yao, M.; Ren, J. Exploring the microbiota-Alzheimer's disease linkage using short-term antibiotic treatment followed by fecal microbiota transplantation. Brain Behav. Immun. 2021, 96, 227-238. [Google Scholar] [CrossRef].
このような研究は、アルツハイマー病の発症予防に有効であると考えられている。Transl. Psychiatry 2019, 9, 189. [Google Scholar] [CrossRef].
Kim, M.S.; Kim, Y.; Choi, H.; Kim, W.; Park, S.; Lee, D.; Kim, D.K.; Kim, H.J.; Choi, H.; Hyun, D.W.; et al. 健康な微生物叢の移入は、アルツハイマー病動物モデルにおけるアミロイドおよびタウ病理を軽減する。Gut 2020, 69, 283-294. [Google Scholar】【CrossRef
糞便微生物叢移植はアルツハイマー病モデルマウスの病理を軽減し、認知機能を改善する。Cells 2022, 12, 119. [Google Scholar] [CrossRef].
Hazan, S. 糞便微生物叢移植後のアルツハイマー病症状の急速な改善: 症例報告。J. Int. Med. Res. 2020, 48, 030006052092593. [Google Scholar] [CrossRef].
Park、S.H.; Lee、J.H.; Shin、J.; Kim、J.S.; Cha、B.; Lee、S.; Kwon、K.S.; Shin、Y.W.; Choi、S.H. アルツハイマー型認知症患者における糞便微生物叢移植後の認知機能改善: 症例報告。Curr. Med. Res. Opin. 2021, 37, 1739-1744. [Google Scholar] [CrossRef].
ソカワ、K.; ドボシェフスカ、U.; ソパ、A.; セレフコ、A.; ウウォダルチク、M.; ジエリンスカ、A.; ポレザック、E.; フィチュナ、J.; ウラシュ、P. 精神神経疾患における微生物叢-腸-脳軸の役割。薬理学。2021年、172、105840。[Google Scholar] [CrossRef] [PubMed].
Mörkl, S.; Butler, M.I.; Holl, A.; Cryan, J.F.; Dinan, T.G. Probiotics and the Microbiota-Gut-Brain Axis: Focus on Psychiatry. Curr. Nutr. Rep. 2020, 9, 171-182. [Google Scholar] [CrossRef] [PubMed].
Navarro-Tapia、E.; Almeida-Toledano、L.; Sebastiani、G.; Serra-Delgado、M.; García-Algar、Ó.; Andreu-Fernández、V. 不安障害と摂食障害における微生物叢の不均衡の影響: 新規治療アプローチとしてのプロバイオティクス。Int. J. Mol. Sci. 2021, 22, 2351. [Google Scholar] [CrossRef] [PubMed].
アルツハイマー病における腸内細菌叢の影響: A Narrative Review. J. Integr. Neurosci. 2023, 22, 38. [Google Scholar] [CrossRef].
Cryan、J.F.; O'Riordan、K.J.; Sandhu、K.; Peterson、V.; Dinan、T.G. 神経疾患における腸内マイクロバイオーム。Lancet Neurol. 2020, 19, 179-194. [Google Scholar] [CrossRef].
モリンダオフィシナリス由来オリゴ糖は、主要な微生物叢-代謝産物ペアを制御することにより、老化マウスの進行を遅らせる。Evid. Based Complement. Altern. Med. 2019, 2019, 9306834. [Google Scholar] [CrossRef].
Deng, S.; Lu, H.; Chi, H.; Wang, Y.; Li, X.; Ye, H. Neuroprotective Effects of OMO within the Hippocampus and Cortex in a D-Galactose and A β25-35-Induced Rat Model of Alzheimer's Disease. Evid. Based Complement. Altern. Med. 2020, 2020, 1067541. [Google Scholar] [CrossRef].
楊 淳(Yang, J.; Yang, J.; Lai, G.; Yong, T.; Tang, X.; Shuai, O.; Zhou, G.; Xie, Y.; Wu, Q. Prebiotic Effect of Fructooligosaccharides from Morinda officinalis on Alzheimer's Disease in Rodent Models by Targeting the Microbiota-Gut-Brain Axis. Front. Aging Neurosci. 2017, 9, 403. [Google Scholar] [CrossRef].
灌流マウス脳における血液脳関門透過性測定法: 野生型マウスおよびアルツハイマー病Tg2576マウスにおけるアミロイドβペプチドへの応用。J. Neurosci. Methods 2004, 138, 233-242. [Google Scholar] [CrossRef].
Bourasset, F.; Ouellet, M.; Tremblay, C.; Julien, C.; Do, T.M.; Oddo, S.; Laferla, F.; Calon, F. トランスジェニックアルツハイマー病モデルマウスにおける脳血管容積の減少。Neuropharmacology 2009, 56, 808-813. [Google Scholar] [CrossRef]。
Pistollato, F.; Sumalla Cano, S.; Elio, I.; Masias Vergara, M.; Giampieri, F.; Battino, M. アミロイド形成とアルツハイマー病の発症における腸内細菌叢と栄養素の役割。Nutr. Rev. 2016, 74, 624-634. [Google Scholar] [CrossRef].
Alzheimer's disease-induced rat brain in membrane-bound transport ATPases system in Lactobacillus plantarum MTCC1325 Role of Lactobacillus plantarum MTCC1325 in membrane-bound transport ATPases system in Alzheimer's disease-induced rat brain. BioImpacts 2016, 6, 203-209. [Google Scholar] [CrossRef].
アルツハイマー病における酸化ストレス。Neurosci. Neurosci. 2014, 30, 271-281. [Google Scholar] [CrossRef] [PubMed].
Nimgampalle、M.; Kuna、Y. プロバイオティクス、Lactobacillus plantarum MTCC 1325のアルツハイマー病誘発アルビノラットにおける抗アルツハイマー病特性。J. Clin. Diagn. Res. 2017, 11, KC01-KC05. [Google Scholar] [CrossRef] [PubMed].
乳酸菌とビフィズス菌はβ-アミロイド(1-42)注射ラットにおける記憶・学習障害と酸化ストレスを改善する。Appl. Physiol. Metab. 2018, 43, 718-726. [Google Scholar] [CrossRef] [PubMed].
Rezaei Asl, Z.; Sepehri, G.; Salami, M. Probiotic treatment improves the impaired spatial cognitive performance and restores synaptic plasticity in an animal model of Alzheimer's disease. Behav. Brain Res. 2019, 376, 112183. [Google Scholar] [CrossRef].
Sampson, T.R.; Debelius, J.W.; Thron, T.; Janssen, S.; Shastri, G.G.; Ilhan, Z.E.; Challis, C.; Schretter, C.E.; Rocha, S.; Gradinaru, V.; et al. 腸内細菌叢はパーキンソン病モデルにおける運動障害と神経炎症を制御する。Cell 2016, 167, 1469-1480.e12. [Google Scholar] [CrossRef].
Sun,M.F.;Zhu,Y.L.;Zhou,Z.L.;Jia,X.B.;Xu,Y.D.;Yang,Q.;Cui,C.;Shen,Y.Q. MPTP誘発パーキンソン病マウスに対する糞便微生物叢移植の神経保護効果: 腸内細菌叢、グリア反応、TLR4/TNF-αシグナル経路。Brain Behav. Immun. 2018, 70, 48-60. [Google Scholar] [CrossRef].
Zhong, Z.; Chen, W.; Gao, H.; Che, N.; Xu, M.; Yang, L.; Zhang, Y.; Ye, M. Fecal Microbiota Transplantation Exerts a Protective Role in MPTP-Induced Parkinson's Disease via the TLR4/PI3K/AKT/NF-κB Pathway Stimulated by α-Synuclein. Neurochem. Res. 2021, 46, 3050-3058. [Google Scholar] [CrossRef].
Zhou, Z.L.; Jia, X.B.; Sun, M.F.; Zhu, Y.L.; Qiao, C.M.; Zhang, B.P.; Zhao, L.P.; Yang, Q.; Cui, C.; Chen, X.; et al. Fasting Mimicking Diet on MPTP-Induced Parkinson's Disease Mice via Gut Microbiota and Metabolites. Neurotherapeutics 2019, 16, 741-760. [Google Scholar] [CrossRef] [PubMed].
Zhang, T.; Wang, T.; Chen, X.; Zhao, Z.; Chen, Z. Gut microbiota relieves inflammation in the substantia nigra of chronic Parkinson's disease by protecting the function of dopamine neurons. Exp. Ther. Med. 2021, 23, 52. [Google Scholar] [CrossRef] [PubMed].
Huang, H.; Xu, H.; Luo, Q.; He, J.; Li, M.; Chen, H.; Tangm, W.; Nie, Y.; Zhou, Y. 便秘を伴うパーキンソン病を治療するための糞便微生物叢移植。Medicine 2019, 98, e16163. [Google Scholar] [CrossRef].
Segal, A.; Zlotnik, Y.; Moyal-Atias, K.; Abuhasira, R.; Ifergane, G. Fecal microbiota transplant as a potential treatment for Parkinson's disease-A case series. Clin. Neurol. 2021, 207, 106791. [Google Scholar] [CrossRef] [PubMed].
パーキンソン病の便秘症例における糞便微生物移植の評価。Microb. Cell Fact. 2021, 20, 98. [Google Scholar] [CrossRef].
Xue, L.J.; Yang, X.Z.; Tong, Q.; Shen, P.; Ma, S.J.; Wu, S.N.; Zheng, J.L.; Wang, H.G. パーキンソン病に対する糞便微生物叢移植療法: 予備的研究。Medicine 2020, 99, e22035. [Google Scholar] [CrossRef].
パーキンソン病に対する糞便微生物叢移植療法:無作為化反復投与プラセボ対照臨床パイロット試験。Front. Neurol. 2023, 14, 1104759. [Google Scholar] [CrossRef].
Tamtaji、O.R.;Heidari-soureshjani、R.;Mirhosseini、N.;Kouchaki、E.;Bahmani、F.;Aghadavod、E.;Tajabadi-Ebrahimi、M.;Asemi、Z. プロバイオティクスとセレンの共同補充、およびアルツハイマー病における臨床的、代謝的、遺伝的状態に対する効果: 無作為化二重盲検比較試験。Clin. Nutr. 2019, 38, 2569-2575. [Google Scholar】【CrossRef】。
Jia, S.; Lu, Z.; Gao, Z.; An, J.; Wu, X.; Li, X.; Dai, X.; Zheng, Q.; Sun, Y. Chitosan oligosaccharides alleviate cognitive deficits in an amyloid-β1-42-induced rat model of Alzheimer's disease. Int. J. Biol. Macromol. 2016, 83, 416-425. [Google Scholar] [CrossRef].
Akbari、E.; Asemi、Z.; Daneshvar Kakhaki、R.; Bahmani、F.; Kouchaki、E.; Tamtaji、O.R.; Hamidi、G.A.; Salami、M. アルツハイマー病における認知機能と代謝状態に対するプロバイオティクス補給の効果: 無作為二重盲検比較試験。Front. Aging Neurosci. 2016, 8, 256. [Google Scholar] [CrossRef].
Berer, K.; Gerdes, L.A.; Cekanaviciute, E.; Jia, X.; Xiao, L.; Xia, Z.; Liu, C.; Klotz, L.; Stauffer, U.; Baranzini, S.E.; et al. 多発性硬化症患者由来の腸内細菌叢は、マウスの自然発症自己免疫性脳脊髄炎を可能にする。Proc. Natl. Acad. Sci. USA 2017, 114, 10719-10724. [Google Scholar] [CrossRef] [PubMed].
Cekanaviciute、E.; Yoo、B.B.; Runia、T.F.; Debelius、J.W.; Singh、S.; Nelson、C.A.; Kanner、R.; Bencosme、Y.; Lee、Y.K.; Hauser、S.L.; et al. 多発性硬化症患者の腸内細菌はヒトT細胞を修飾し、マウスモデルで症状を悪化させる。Proc. Natl. Acad. Sci. USA 2017, 114, 10713-10718. [Google Scholar] [CrossRef] [PubMed].
劉 聡(Liu, S.; Rezende, R.M.; Moreira, T.G.; Tankou, S.K.; Cox, L.M.; Wu, M.; Song, A.; Dhang, F.H.; Wei, Z.; Costamagna, G.; et al. MS患者の糞便からのmiR-30dの経口投与は、Akkermansia muciniphilaを拡大することによりマウスのMS様症状を抑制する。Cell Host Microbe 2019, 26, 779-794.e8. [Google Scholar] [CrossRef] [PubMed].
多発性硬化症モデルマウスにおける糞便微生物叢移植の保護(Protection of Fecal Microbiota Transplantation in a Mouse Model of Multiple Sclerosis)。Mediat. Inflamm. 2020, 2020, 2058272. [Google Scholar] [CrossRef].
Wang, S.; Chen, H.; Wen, X.; Mu, J.; Sun, M.; Song, X.; Lui, B.; Chen, J.; Fan, X. 実験的自己免疫性脳脊髄炎における糞便微生物叢移植の有効性: トランスクリプトームと腸内細菌叢プロファイリング。J. Immunol. Res. 2021, 2021, 4400428. [Google Scholar] [CrossRef].
Borody、T.J.; Campbell、J. 糞便微生物叢移植: 現状と今後の方向性。Expert Rev. Gastroenterol. Hepatol. 2011, 5, 653-655. [Google Scholar] [CrossRef].
SPMS患者における糞便微生物叢移植と10年間の安定性。Neurol. Neuroimmunol. Neuroinflammation 2018, 5, e459. [Google Scholar] [CrossRef].
Garcia-Rodriguez, V.; Ali, S.I.; Dupont, A.W. S2314 Fecal Microbiota Transplantation Associated With Disease Stabilization in a Patient With Multiple Sclerosis. Am. J. Gastroenterol. 2020, 115, S1224. [Google Scholar] [CrossRef].
Engen、P.A.、Zaferiou、A.、Rasmussen、H.、Naqib、A.、Green、S.J.、Fogg、L.F.、Forsyth、C.B.、Raeisi、S.、Hamaker、B.、Keshavarzian、A. 多発性硬化症における糞便微生物叢移植の単群、非無作為化、時系列、単一被験者研究。Front. Neurol. 2020, 11, 978. [Google Scholar] [CrossRef].
Al、K.F.、Craven、L.J.、Gibbons、S.、Parvathy、S.N.、Wing、A.C.、Graf、C.、Parham、K.A.、Kerfoot、S.M.、Wilcox、H.、Burton、J.P.、他 多発性硬化症患者における糞便微生物叢移植は安全で忍容性が高い: パイロット無作為化比較試験。Mult. Scler. J. Exp. Clin. 2022, 8, 205521732210866. [Google Scholar] [CrossRef].
Mandrioli、J.; Amedei、A.; Cammarota、G.; Niccolai、E.; Zucchi、E.; D'Amico、R.; Ricci、F.; Quaranta、G.; Spanu、T.; Masucci、L. FETR-ALS試験プロトコル: 筋萎縮性側索硬化症における糞便微生物移植の無作為臨床試験。Front. Neurol. 2019, 10, 1021. [Google Scholar] [CrossRef] [PubMed].
Lu,G.、Wen,Q.、Cui,B.、Li,Q.、Zhang,F.洗浄微生物叢移植は筋萎縮性側索硬化症の悪化を止めた: 最初の症例報告とナラティブレビュー。J. Biomed. J. Biomed. Res. 2023, 37, 69. [Google Scholar] [CrossRef] [PubMed].
Fleck、A.K.、Schuppan、D.、Wiendl、H.、Klotz、L. 炎症性疾患活動を調節する可能性としての腸-中枢-軸-多発性硬化症への示唆。Int. J. Mol. Sci. 2017, 18, 1526. [Google Scholar] [CrossRef] [PubMed].
このような背景のもとで、日本では、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」、「食の安全」の3つのテーマについて、研究を行っている。Glycoconj. J. 2019, 36, 39-55. [Google Scholar] [CrossRef] [PubMed].
多発性硬化症モデルマウスにおける腸内細菌叢の変化によるNKT細胞依存的改善.Am. J. Pathol. 2008, 173, 1714-1723. [Google Scholar] [CrossRef].
J. Immunol. 2008, 181, 954-968. [Google Scholar] [CrossRef].
プロテオ脂質タンパク質特異的制御性T(Treg)細胞のバイスタンダー媒介刺激は、TGF-βを介して実験的自己免疫性脳脊髄炎(EAE)に対する保護を与える。J. Neuroimmunol. 2012, 245, 39-47. [Google Scholar] [CrossRef].
Ochoa-Repáraz、J.; Mielcarz、D.W.; Wang、Y.; Begum-Haque、S.; Dasgupta、S.; Kasper、D.L.; Kasper、L.H. ヒト常在菌Bacteroides fragilis由来の多糖類は、中枢神経系脱髄疾患を予防する。Mucosal Immunol. 2010, 3, 487-495. [Google Scholar] [CrossRef].
Ezendam, J.; De Klerk, A.; Gremmer, E.R.; Van Loveren, H. Bifidobacterium animalisを授乳期に投与した場合のげっ歯類におけるアレルギー反応および自己免疫反応への影響。Clin. Exp. Immunol. 2008, 154, 424-431. [Google Scholar] [CrossRef].
Lavasani, S.; Dzhambazov, B.; Nouri, M.; Fåk, F.; Buske, S.; Molin, G.; Thorlacius, H.; Alenfall, J.; Jeppsson, B.; Weström, B. A Novel Probiotic Mixture Exert an Therapeutic Effects on Experimental Autoimmune Encephalomyelitis mediated by IL-10 Producing Regulatory T Cells. PLoS ONE 2010, 5, e9009. [Google Scholar] [CrossRef].
Kwon、H.K.、Kim、G.C.、Kim、Y.、Hwang、W.、Jash、A.、Sahoo、A.、Kim、J.E.、Nam、J.H.、Im、S.H. プロバイオティクス混合物による実験的自己免疫性脳脊髄炎の改善は、Tヘルパー細胞免疫応答のシフトによって媒介される。Clin. Immunol. 2013, 146, 217-227. [Google Scholar] [CrossRef] [PubMed].
パーキンソン病の齧歯類モデルにおいて、プロバイオティクスの投与が海馬依存性認知を改善する。Microorganisms 2020, 8, 1661. [Google Scholar] [CrossRef] [PubMed].
筋萎縮性側索硬化症の病態進行を緩和する腸内細菌叢のターゲット(Zhang, Y.g.; Wu, S.; Yi, J.; Xia, Y.; Jin, D.; Zhou, J.; Sun, J.). Clin. Ther. 2017, 39, 322-336. [Google Scholar] [CrossRef].
Caruso, G.; Torrisi, S.A.; Mogavero, M.P.; Currenti, W.; Castellano, S.; Godos, J.; Ferri, R.; Galvano, F.; Leggio, G.M.; Grosso, G.; et al. ポリフェノールと神経保護: 認知機能低下に対する治療的意味合い。Pharmacol. Ther. 2022, 232, 108013. [Google Scholar] [CrossRef] [PubMed].
免責事項/出版者注:すべての出版物に含まれる声明、意見およびデータは、著者および寄稿者個人のものであり、MDPIおよび/または編集者のものではありません。MDPIおよび/または編集者は、コンテンツで言及されたアイデア、方法、指示、製品に起因する人または財産の損害について、一切の責任を負いません。
著者による© 2023。ライセンシー MDPI, Basel, Switzerland. 本論文は、クリエイティブ・コモンズ 表示(CC BY)ライセンス(https://creativecommons.org/licenses/by/4.0/)の条項および条件の下で配布されるオープンアクセス論文である。
共有と引用
MDPIおよびACSスタイル
Uceda, S.; Echeverry-Alzate, V.; Reiriz-Rojas, M.; Martínez-Miguel, E.; Pérez-Curiel, A.; Gómez-Senent, S.; Beltrán-Velasco, A.I. 神経変性疾患における腸内細菌メタボロームとディスバイオシス: 治療アプローチとしてのサイコバイオティクスと糞便微生物叢移植-包括的総説。Int. J. Mol. Sci. 2023, 24, 13294. https://doi.org/10.3390/ijms241713294
AMAスタイル
Uceda S, Echeverry-Alzate V, Reiriz-Rojas M, Martínez-Miguel E, Pérez-Curiel A, Gómez-Senent S, Beltrán-Velasco AI. 神経変性疾患における腸内細菌メタボロームとディスバイオシス: サイコバイオティクスと治療アプローチとしての糞便微生物叢移植-包括的総説。国際分子科学ジャーナル。2023; 24(17):13294. https://doi.org/10.3390/ijms241713294
シカゴ/トゥラビアンスタイル
Uceda, Sara, Víctor Echeverry-Alzate, Manuel Reiriz-Rojas, Esther Martínez-Miguel, Ana Pérez-Curiel, Silvia Gómez-Senent, and Ana Isabel Beltrán-Velasco. 2023. 「神経変性疾患における腸内細菌メタボロームとディスバイオシス: Psychobiotics and Fecal Microbiota Transplantation as a Therapeutic Approach-A Comprehensive Narrative Review" International Journal of Molecular Sciences 24, no. 17: 13294. https://doi.org/10.3390/ijms241713294
他のスタイルを探す
出版社名、ジャーナル名、書式名を入力してください。
なお、2016年創刊号より、本誌はページ番号の代わりに論文番号を使用しています。詳細はこちらをご覧ください。
論文指標
引用
この記事の引用は見つかりませんでしたが、Google Scholarで確認することができます。
論文アクセス統計
記事アクセス統計
記事閲覧数
27. 8月
28. 8月
29. 8月
30. 8月
31. 8月
9月
0
100
200
300
400
500
600
ジャーナル統計の詳細については、こちらをクリックしてください。
同一IPアドレスからの複数のリクエストは1ビューとしてカウントされます。
Int. J. Mol. Sci., EISSN 1422-0067, MDPI発行 RSSコンテンツアラート
詳細情報
論文処理料金
請求書の支払い
オープンアクセスポリシー
MDPIへのお問い合わせ
MDPIの求人
ガイドライン
著者の方へ
査読者の方へ
編集者の方へ
ライブラリアンの方へ
出版社の方へ
学会の方へ
学会主催者の方へ
MDPIの取り組み
サイフォーラム
MDPI書籍
Preprints.org
サイリット
サイプロファイルズ
百科事典
JAMS
プロシーディングスシリーズ
MDPIをフォローする
LinkedIn
フェイスブック
ツイッター
MDPIジャーナルからの発行通知やニュースレターを購読する
オプションを選択
メールアドレスを入力してください
購読する
© 1996-2023 MDPI (スイス、バーゼル) 特に断りのない限り免責事項 ご利用規約 プライバシーポリシー
トップ
この記事が気に入ったらサポートをしてみませんか?
