腸内細菌叢と宿主免疫系の制御における栄養戦略の役割
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
139
総閲覧数
3
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは1
OPINION記事
Front. 微生物学, 2023年12月07日
Sec.脊椎動物の消化器系における微生物
第14巻 - 2023年|https://doi.org/10.3389/fmicb.2023.1238822
この論文は次の研究テーマの一部です
腸内細菌叢と宿主免疫系の制御における栄養戦略の役割
全19記事を見る
疾患と治療のメカニズム解明のための腸内細菌叢の免疫相互作用の解読
Qiang Yang1 Ying Cai1,2 Sifan Guo2 Zhibo Wang1,2 Yan Wang2 Xiaodan Yu2 Wanying Sun2 Shi Qiu2* Aihua Zhang2*†.
1Good Agricultural Practices Center and Graduate School, Heilongjiang University of Chinese Medicine, Harbin, China
2国際先端機能オミックスプラットフォーム、科学実験センター、中国伝統医学・現代医学国際共同研究センター、海南省主要疾患生物試料資源工学研究センター(海南医科大学第一付属病院)、海南省熱帯循環器疾患研究重点実験室、海南医科大学、海口、中国
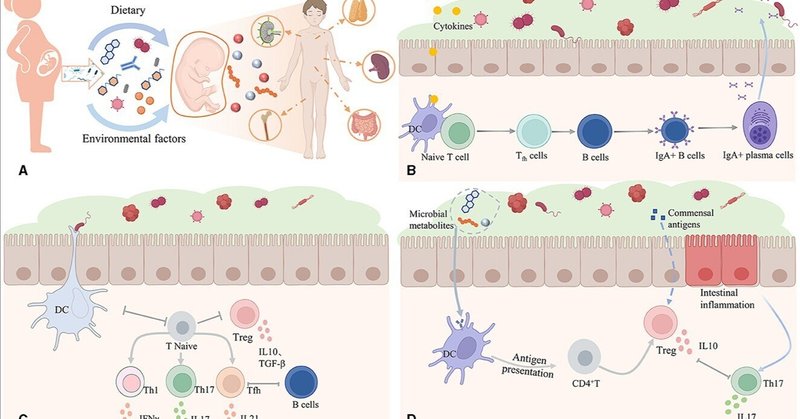
最近、腸内微生物と体の免疫の関係について、NatureやScienceなどの一連の論文に腸内微生物に関する研究がいくつか発表されている(Bousbaineら、2022年;Lyuら、2022年;Mirjiら、2022年;Hanら、2023年;Tianら、2023年)。以上の研究から、腸内細菌叢は宿主の免疫恒常性の調節に関与する重要な免疫器官として働くことができる。腸内細菌叢は、免疫系の早期発達を促進し、免疫寛容を改善し、関連代謝産物を分泌することで免疫系と腸のコミュニケーションを正常に保つことができる(図1)。これらの研究は、腸内細菌叢と免疫系との本質的な関係を示しており、腫瘍の診断、予後、治療に好ましく利用できる。
図1
www.frontiersin.org
図1. 腸内細菌叢と免疫系の本質的な関係。(A)食事や環境因子は腸内細菌叢を変化させ、代謝、免疫、内分泌経路を制御し、影響を及ぼし、さらに胎児の成長と発育に影響を及ぼす可能性がある。(B)微生物の刺激に応答して、宿主の自然免疫細胞は炎症性サイトカインとケモカインを分泌する。(C)腸内細菌叢はTリンパ球の分化を標的にして制御し、免疫自己寛容機構の改善を促進することができる。(D)腸内微生物は様々な物質を分泌して腸管バリアを構築し、免疫系に接触する。すべての画像はBioRenderで作成された図を入手した。
人体最大の免疫器官である腸は、ビタミンの合成を促進し、有益な代謝産物、発酵炭水化物を産生し、腸の蠕動運動を促進し、胆汁酸を調節し、病原性細菌と競合し、腸管バリアの完全性を維持し、免疫系の連絡と形成に関与することができる(Qiuら、2023a)。重要な免疫参加者として、腸内細菌叢は様々な方法でヒトの免疫系の安定性を維持している(Qiu et al.) 微生物叢と免疫系の関係をさらに深く理解することで、免疫チェックポイント阻害薬(ICB)やその他の治療戦略における微生物叢の役割を理解することが可能になる。
腸内細菌叢は、食事やアレルゲンのような未知の環境暴露に関する情報を身体に送り、それらに対する耐性を促進し、免疫系が常在細菌を認識し、病原性細菌を排除するのを助ける。免疫系の原始的な発達には、脾臓や胸腺などの免疫器官の発達を促したり、固有層内の免疫細胞の数を増やしたり、腸粘液中の免疫グロブリンA(IgA)の産生を促進したりするなど、腸内細菌叢の協力が必要であることが、数多くの研究で示されている。Tianら(2023)は、幼少期の抗生物質への曝露が、成人期における腸内細菌叢の多様性と存在量の減少と関連していることを発見した。腸肝軸の影響を受けた肝細胞相互作用ネットワークは、肝常在NK(LrNK)の成熟と機能の制御に重要な役割を果たしており、これは免疫系の早期発達の鍵となる可能性がある。生後間もない時期は、腸内細菌叢と宿主免疫の相互作用にとって重要な時期である。幼児期は腸内細菌叢の発達にとって重要な時期であり、免疫系の成熟にとって重要な窓口の時期でもある。免疫系の発達には、腸内細菌叢の恒常性を維持し、様々な免疫疾患への感受性を低下させるために、腸内微生物の協力が必要である。
腸内細菌叢は、様々なシグナル伝達メカニズムを通じて、ほとんど全ての宿主臓器やシステムの機能に影響を与えることができる。粘液中の自然免疫細胞が病原性細菌と接触すると、これらの細胞は炎症性サイトカインやケモカインを分泌し、より多くの自然免疫細胞をリクルートし、樹状細胞を活性化し、腸内常在菌を許容し病原性細菌を攻撃するように免疫系を訓練する。微生物叢や病原体による継続的なコロニー形成は、免疫細胞が支配する免疫系の障害を引き起こす可能性がある。Lyuら(2022年)は、自然リンパ球(ILC3)の免疫細胞が腸内微生物耐性において重要な役割を果たしており、免疫耐性の確立と維持が宿主の健康を守る鍵であることを明らかにした。
腸内細菌叢は、Tリンパ球の抗原攻撃性エフェクターT細胞または抗原寛容性制御性T細胞への分化を制御し、免疫自己寛容機構の改善を促進する可能性がある。Bousbaineら(2022)は、腸内常在細菌によって発現されるβ-ヘキソサミニダーゼ(β-hex)が、バクテロイデスの保存抗原としてCD4 T細胞に認識され、それによってCD4+CD8α+上皮内リンパ球への分化を促進することを発見した。腸内微生物の一部は、ペプチドやサイトカインを分泌することによって、前膜のエフェクターT細胞を調節し、それによって影響を受けた腸領域でサイトカインや炎症メディエーターを放出する。
腸内細菌叢は、短鎖脂肪酸、多糖類を分泌し、その他の代謝産物を産生することができる。これらの代謝産物は、重要なシグナル伝達因子やエネルギー基質として機能し、腸管バリアの確立を促進し、腸管と免疫系との間の継続的なコミュニケーションを促進し、大腸腫瘍の発生や転移に影響を及ぼす。腸内微生物は自然免疫応答および適応免疫応答を制御することができ、腸内微生物由来の代謝産物と腫瘍免疫応答との間には密接な関係がある。炎症性代謝産物であるトリメチルアミンオキシド(TMAO)は、腫瘍の免疫浸潤とエフェクターT細胞の活性化を増加させ、ICBに反応する膵管腺がん(PDAC)を増強することが明らかになった(Mirjiら、2022年)。すべての腸内微生物が産生する低分子代謝産物、分子標的、およびそれらの生物学的意義を包括的に理解することは、この分野における極めて重要な方向性であり続けている。Hanら(2023)は、ラクトバチルス・ロイテリの代謝産物であるインドール-3-乳酸(ILA)が、IL-17細胞の分化を阻害し、転写因子RORγtの転写活性を阻害することにより、抗腫瘍効果を発揮することを発見した。上記の論文ではさらに、腫瘍やがんの予防・治療戦略を補完するものとして腸内細菌叢の代謝産物について論じ、腸内細菌叢の代謝産物と宿主免疫の新たな関係について分析している。
腸内細菌叢と免疫の相互作用は比較的不明瞭で複雑である。まず、腸内細菌叢は常在菌を許容するよう免疫系を誘導することで、栄養素や抗原を認識することができる。一方、腸内細菌叢は免疫認識を通じて細菌の侵入や感染を防ぐこともできる。現代の研究では、腸内細菌叢と身体の免疫は相互に依存していることが示されている。一部の自己免疫疾患患者では、腸内細菌叢の多様性と存在量が著しく損なわれている。その他にも、食事、薬物、精神衛生、環境因子など、腸内細菌叢を収縮させる可能性のある数多くの要因があり、腫瘍や癌の治療において注目される。腸内細菌叢についての予備的理解はあったが、腸内細菌叢が抗腫瘍免疫応答をどのように構成しているかはまだ予測できない。腸内細菌叢を変化させる実用的で実行可能な治療法の選択は、豊富な臨床試験に守られながら行われる必要がある。特に、腸内細菌叢の変化を調節・維持する方法は、前臨床モデルや臨床試験の中で確立されるべきである。腸内細菌叢の調節を最適化し、抗腫瘍免疫と全免疫を増強することで、免疫監視とがん治療を強化する機会となる。
著者貢献
QY、YC、SG、ZW、YW、XY、WSは試験デザインに参加し、方法開発に貢献し、資金を獲得し、原稿を執筆した。SQとAZは方法開発の助言を行い、原稿作成に貢献した。すべての著者が論文に貢献し、提出された原稿を承認した。
資金提供
著者らは、国家自然科学基金プログラム(助成金番号:81973745、82104733、81302905)、海南省南海新星科技創新人材プロジェクト(NHXXRCXM202317)、国際科学技術創新協力研究プロジェクト(助成金番号:2023CEMP0423)からの多大な支援に感謝する。2023CEMP0423および2023CEKP0501)、中国中医薬学会人材育成工程プロジェクト(QNRC2-B06)、黒龍江省自然科学基金(YQ2019H030)、プロジェクト支援基金(助成金番号82104733)。
謝辞
BioRenderおよびMetaboAnalystに感謝する。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
参考文献
Bousbaine, D., Fisch, L. I., London, M., Bhagchandani, P., de Castro, T. B. R., Mimee, M., et al. 保存されたバクテロイデス抗原が抗炎症性腸Tリンパ球を誘導する。科学 377, 660-666.
PubMedアブストラクト|全文|Google Scholar
Han,J.-X.、Tao,Z.-H.、Wang,J.-L.、Zhang,L.、Yu,C.-Y.、Kang,Z.-R.、他(2023)。微生物叢由来のトリプトファン異化物は、大腸がんに対するスタチンの化学予防効果を媒介する。Nat. Microbiol. 8, 919-933. doi: 10.1038/s41564-023-01363-5
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lyu,M.、Suzuki,H.、Kang,L.、Gaspal,F.、Zhou,W.、Goc,J.、他(2022)。ILC3は微生物特異的制御性T細胞を選択し、腸における寛容を確立する。Nature 610, 744-751. doi: 10.1038/s41586-022-05141-x
PubMed要旨|全文|Google Scholar
Mirji, G., Worth, A., Bhat, S. A., Sayed, M. E., Kannan, T., Goldman, A. R., et al. 微生物由来の代謝産物TMAOは、膵臓癌における免疫活性化を促進し、免疫チェックポイント阻害に対する反応を高める。Sci Immunol. 7, eabn0704. doi: 10.1126/sciimmunol.abn0704
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Qiu, S., Cai, Y., Yao, H., Lin, C., Xie, Y., Tang, S., et al. 低分子代謝物:バイオマーカーと治療標的の発見。Signal Transduct. Target Ther. 8, 132. doi: 10.1038/s41392-023-01399-3
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Qiu, S., Wang, Z., Yang, Q., Cai, Y., Xie, Y., Tang, S., et al. 統合的マルチオミクスにより、腸内微小環境におけるマイクロバイオームの代謝的・機能的多様性が明らかになった。Front. Microbiol. 14, 1168239.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tian,P.,Yang,W.,Guo,X.,Wang,T.,Tan,S.,Sun,R.,他(2023)。幼少期の腸内細菌叢は、酪酸-IL-18軸を介して肝臓常在ナチュラルキラー細胞の成熟を維持する。Nat. Commun. 14, 1710.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
キーワード:免疫系、腸内細菌叢、代謝産物、診断、治療戦略
引用 楊Q, 蔡Y, 郭S, 王Z, 王Y, 于X, 孫W, 邱S, 張A (2023) 疾患と治療のメカニズム解明のための腸内細菌叢の免疫相互作用の解読。Front. Microbiol. 14:1238822.
受理された: 2023年6月12日;受理:2023年11月21日;
発行:2023年12月07日
編集者
Caihong Hu, 浙江大学, 中国
査読者
Qiuhe Lu, クリーブランドクリニック, 米国
Copyright © 2023 Yang, Cai, Guo, Wang, Yu, Sun, Qiu and Zhang. これは、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Aihua Zhang, aihuatcm@163.com; Shi Qiu, qiushihnyx@163.com
†ORCID: Aihua Zhang orcid.org/0000-0002-3784-4472
免責事項:本論文で表明されたすべての主張は、あくまでも著者らのものであり、必ずしもその関連組織、あるいは出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または承認されるものではありません。
こんな人も見ています
複雑な生体試料からの代謝物の局在解析-質量分析イメージングの最新分析技術
楊強、蔡英、郭思帆、王志波、邱世、張愛華
Ralstonia solanacearumに対する植物の誘導防御戦略
Haoqi Shi、Yong Liu、Anming Ding、Weifeng Wang、Yuhe Sun
湖沼水域における石油化学プラスチックおよび生分解性プラスチックの微生物コロニー形成パターンと生分解:フィールド実験からの考察
フランチェスカ・ディ・ピッポ、ヴァレリオ・ボッチ、ステファノ・アマルフィターノ、シモーナ・クログナーレ、カテリーナ・レヴァンテージ、ロリス・ピエトレッリ、ヴァレリオ・ディ・リシオ、アンドレア・マルティネッリ、シモーナ・ロセッティ
Bacillus velezensis TS5の完全ゲノム解析とマウスにおけるプロバイオティック菌株としての可能性
陳紅昊、周毅、段麗霄、貢秀梅、劉星梅、潘康成、曾東、倪雪琴、曾燕
全ゲノム解析から明らかになったジャガイモの拮抗活性を持つ内生菌Bacillus halotolerans Q2H2の生長促進および生物防除メカニズム
王玉虎、孫振起、趙前乾、楊祥東、李雅慧、周紅玉、趙明敏、鄭紅麗
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
