肝臓の代謝経路の変化が、MASLDマウスモデルにおける食事と微生物の併用による治療介入の有効性を示す
本文へスキップ記事へスキップ
エルゼビアロゴ
分子代謝学
オンラインで入手可能 2023年10月14日, 101823
In Press, Uncorrected Proofこれは何ですか?
原著論文
肝臓の代謝経路の変化が、MASLDマウスモデルにおける食事と微生物の併用による治療介入の有効性を示す
https://www.sciencedirect.com/science/article/pii/S2212877823001576
著者リンク オーバーレイパネルを開くValeria Iannone 1 12, Ambrin Farizah Babu 1 2 12, Johnson Lok 1, Carlos Gómez-Gallego 1, Giuseppe D'Auria 3 4, Ruben Vazquez-Uribe 5, Troels Holger Vaaben 5, Mareike Bongers 5, Santtu Mikkonen 6、 マイヤ・ヴァイッティネン 1、イダ・ティッカネン 1、ミッコ・ケットゥネン 7、アントン・クロヴス 2、ラティカ・セーガル 1、ドロタ・カミンスカ 1 8、ユッシ・ピヒラヤマキ 1 9、カティ・ハンヒネヴァ 1 2 10 13、ハニ・エル・ネザミ 1 11 13、モーテン・オットー・アレクサンダー・ゾンマー 5 13、マルユッカ・コレマイネン 1 13
もっと見る
大会概要
シェア
引用
https://doi.org/10.1016/j.molmet.2023.101823
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
アルダフェルミン産生微生物治療薬がマウスでMASLD緩和効果を示す
介入により肝脂肪症、体重、MASLD血漿バイオマーカーが改善した。
肝アミノ酸・脂質代謝が介入により影響を受ける。
代謝経路の変化により、インスリン抵抗性と酸化ストレスの緩和が明らかになった。
概要
目的
以前は非アルコール性脂肪性肝疾患(NAFLD)として知られていた代謝機能障害関連脂肪性肝疾患(MASLD)は、世界的に最も罹患率の高い肝疾患であるが、未だ治療法は承認されていない。腸内ホルモンFGF19の人工アナログであるアルダフェルミンを発現させた大腸菌Nissle 1917と食生活の改善との併用によるMASLDの治療効果を検討した。
方法
C57BL/6J雄性マウスにアメリカ生活習慣病誘発肥満症候群食によりMASLDを誘導し、その後標準的なチャウ食に切り替えて7週間飼育した。食餌の変更に加えて、介入群にはアルダフェルミンを発現する遺伝子組み換え大腸菌Nissleを投与し、対照群には大腸菌Nissleのビヒクルまたは無処置のいずれかを投与した。MASLD関連の血漿バイオマーカーは、自動臨床化学分析装置を用いて測定した。肝脂肪症は、組織学的検査とFiji(ImageJ)ソフトウェアを用いた生体画像解析により評価した。肝臓における介入の効果は、RNA配列決定と液体クロマトグラフィーを用いたノンターゲットメタボロミクス解析によっても評価した。Ingenuityパスウェイ解析を用いて、トランスクリプトミクスの結果から得られた差次的発現遺伝子とメタボロミクスの結果から得られた代謝物を統合し、パスウェイ濃縮研究を行った。
結果
介入後、アルダフェルミンを発現した大腸菌Nissleは、食事の変化とともに、対照2群と比較して体重、肝脂肪症、血漿中アスパラギン酸アミノトランスフェラーゼ、血漿中コレステロール値を減少させた。トランスクリプトミクスとノンターゲットメタボロミクス解析の統合により、肝脂肪症およびインスリン抵抗性の軽減に潜在的に関与するアミノ酸代謝および関連受容体シグナル伝達経路のダウンレギュレーションが明らかになった。さらに、脂質代謝に関連する経路のダウンレギュレーションとアミノ酸関連経路の変化から、肝臓における酸化ストレスの全体的な軽減が示唆された。
結論
これらのデータは、MASLDの管理に人工微生物治療薬を食事療法と組み合わせて用いる可能性を支持するものである。
グラフィカル抄録
画像1
ダウンロード 高解像度画像ダウンロード(189KB)
ダウンロード フルサイズ画像のダウンロード
キーワード
代謝機能障害関連脂肪性肝疾患非アルコール性脂肪性肝疾患遺伝子組換え大腸菌Nissle 1917Aldaferminトランスクリプトミクスノンターゲットメタボロミクスオミクス統合
略語
MASLD
代謝機能障害関連脂肪性肝疾患
NAFLD
非アルコール性脂肪性肝疾患
IR
インスリン抵抗性
ナッシュ
非アルコール性脂肪性肝炎
FGF19
線維芽細胞増殖因子19
HFD
高脂肪食
ALT
アラニンアミノトランスフェラーゼ
AST
アスパラギン酸アミノトランスフェラーゼ
大腸菌
大腸菌
EcNA
アルダフェルミンを発現する大腸菌Nissle 1917の飼料変更
ALIOS
米国生活習慣病誘発性肥満症候群
EcN
ホルモン産生を伴わない大腸菌Nissle 1917の介入
CTRL
大腸菌Nissle 1917を投与しない対照介入
CFU
コロニー形成単位
ELISA
酵素結合免疫吸着測定法
RSD
相対標準偏差
D比
分散比
FPKM
マップされた100万フラグメントあたりの転写産物1キロベースあたりのフラグメント数
BH
Benjamin-Hochberg調整済み
HDL-C
高密度リポタンパク質
LDL-C
低比重リポ蛋白
LPC
リゾホスファチジルコリン
LPE
リゾホスファチジルエタノールアミン
LXR
肝臓X受容体
RXR
レチノイドX受容体
Nrf2
核内因子E2関連因子2
AHR
アリール炭化水素受容体
高脂肪
高フルクトース・高コレステロール食、HFFCD
活性酸素
活性酸素種
はじめに
代謝機能障害に伴う脂肪性肝疾患(MASLD)は、以前は非アルコール性脂肪性肝疾患(NAFLD)として知られており、世界で最も一般的な肝疾患である [1] 。MASLDは世界的に最も多い肝疾患であるにもかかわらず、その治療法はまだ承認されていない。
さらに、現在も研究が続けられているにもかかわらず、MASLDの病態に関する理解は限られている [2]。簡単に述べると、インスリン抵抗性(IR)が肝臓の脂肪蓄積を増悪させ、疾患発症に関与することはよく知られている [3]。さらに、肝臓における過剰な脂肪酸酸化 [4] とトリグリセリド蓄積の障害 [5,6] は、毒性脂質の蓄積に重要な役割を果たしている [2,6]。その結果、脂質毒性は酸化ストレスなどの有害な影響を引き起こし、MASLDから代謝機能障害関連脂肪肝炎(MASH;以前は非アルコール性脂肪肝炎、NASHとして知られていた)へと進行する一因となる[2]。MASLD患者ではしばしば、肝臓における脂質およびエネルギー代謝の調節因子である腸管線維芽細胞増殖因子19(FGF19)の産生障害がみられる [7] [8]。これまでの研究で、高脂肪食(HFD)を与えたマウスにFGF19を投与すると、代謝表現型が改善されることが示されている [9] 。しかしながら、FGF19には腫瘍原性があるため [10]、FGF19の非腫瘍原性アナログであるアルダフェルミンの使用が、MASLDに対するより安全な代替治療として推奨されている [10,11]。MASH患者では、アルダフェルミンの介入により、肝脂肪蓄積、血漿中のアラニンアミノトランスフェラーゼ(ALT)やアスパラギン酸アミノトランスフェラーゼ(AST)などの肝酵素値、血清中の胆汁酸値の低下などの有益な効果が観察されている [12] 。しかし、MASLDの初期段階におけるアルダフェルミンの効果とその作用機序については、まだ研究されていない。
腸内細菌叢は、MASLDの発症と進行に重要な役割を果たすと認識されつつある[[13]、[14]、[15]]。プロバイオティクス、プレバイオティクス、その他の介入により腸内細菌叢を標的とすることが、MASLDの治療アプローチとして有望であることが、新たな研究から示唆されている[15]。実際、非病原性のグラム陰性大腸菌であるニッスル1917は、MASLDの治療候補として浮上しており、ラットにおけるMASLDの進行抑制において有望な結果を示している [16] 。プログラムされた治療活性を発現するように操作されたプロバイオティクスである高度微生物治療薬の使用は、MASLDやその他の代謝性疾患を管理するための有望な戦略である。実際、最近の研究では、肥満を含む代謝障害に有益な効果をもたらす生理活性分子を送達するために、遺伝子操作された大腸菌Nissle 1917が用いられている [17,18] 。
本研究では、アルダフェルミンを発現する遺伝子組み換え大腸菌Nissleを利用したマルチターゲットインターベンションと食生活の改善(EcNA)を組み合わせることで、MASLDに誘発される症状を管理する効果的なアプローチを提供できるかもしれないという仮説を立てた。トランスクリプトミクスおよびノンターゲットメタボロミクス技術を用いて、MASLDモデルマウスにおけるEcNAの影響を研究した。その結果、EcNAの投与により肝代謝および遺伝子に大きな変化が見られ、MASLDの革新的な治療薬としての可能性が示された。
材料と方法
2.1. アルダフェルミンを発現させるための大腸菌Nissle 1917株の工学的作製
アルダフェルミンは、Schantzetta ライブラリー[19]にある最強のプロモーターを用いて、マウス消化管で安定発現するように設計された大腸菌 Nissle 由来の pMUT-1 ベースのプラスミドで構成的に発現させた。簡単に説明すると、アルダフェルミン遺伝子はgBlock(Integrated DNA Technologies)として注文し、Phusion U Hot Start DNA Polymerase(ThermoFisher, Waltham, Massachusetts, United States, Cat No.F555S)を用いてウラシル含有プライマーで増幅した。精製したポリメラーゼ連鎖反応断片を、1×Cut Smartバッファー(NEB)中、0.5μLのUSER酵素(NEB)で処理し、その後サーモサイクラーで37℃で30分間、室温で1時間インキュベートした。次に、2μLのUSER混合物を用いて、供給者の指示に従い、One ShotTM TOP10 Chemically Competent E. coli(サーモフィッシャー社、マサチューセッツ州ウォルサム、米国)を形質転換した(One ShotTM TOP10 Thermo Fisher, Waltham, Massachusetts, United States)。形質転換細胞を選択培地にプレーティングし、コロニーをコロニーポリメラーゼ連鎖反応とその後のシークエンシングで確認した。陽性コロニーを50μg/mLカナマイシンを加えた2mLのルリアベルタニに接種し、16時間培養した後、NucleoSpin Plasmid EasyPure抽出キット(Macherey Nagel)を用いてプラスミドを抽出した。精製したプラスミドを用い、大腸菌Nissle(Tn7:sfGFP+、StrepR)のエレクトロコンピテント細胞をエレクトロポレーションにより形質転換した。sfGFPはゲノム中の2672041位から2672355位のattTn7付着部位に組み込まれ、BBa_J23101プロモーターから発現した(Additional file: Supplemental Figure S1)。大腸菌Nissle株は、いかなるネイティブpMUT1プラスミドに対しても、以前に培養済みである。
2.2. 試験管内生産および菌株の特性解析
各株について、個々のコロニーを100μg/mLのストレプトマイシンと50μg/mLのカナマイシンを含む3mLのルリアベルタニ培地に接種し、37℃で一晩、200rpmのシェーカーで培養した。翌日、培養物をルリアベルタニ、100μg/mLストレプトマイシン、50μg/mLカナマイシンを含むGreiner CELLSTAR 96ウェルマイクロタイタープレート(Sigma-Aldrich製品番号M0812)で100倍に希釈し、最終容量を200μLとした。プレートをBreathEasyフィルム(Sigma-Aldrich, St.Louis, MO, USA)で密封し、Synergy H1プレートリーダー(BioTek, Winooski, VT, USA)で37℃、1000rpmでインキュベートした。発酵終了後、培養液のアリコートを集め、10,000×gで5分間遠心した。上清を回収し、-20℃で保存して後の分析に備えた。サンプルは、製造元のプロトコール(Abcam: ab230943, Cambridge, United Kingdom)に従って、酵素結合免疫吸着測定法(ELISA)によるFGF19/アルダフェルミン分析に供した。
大腸菌の増殖速度を測定するため、ルリアベルタニ培地で37℃で一晩培養したものから1:100を100μLの液体ルリアベルタニ培地に接種した。培養は96ウェルマイクロタイタープレートで、37℃、365cpm(2mm)のオービタルシェイクで行った。マイクロタイターリーダー(BioTek ELx800)を用いて、5分毎に光学密度600nm(OD600)で細胞密度を測定した。成長率は、対数OD測定値を対数相でプロットし、r2値が1に最も近い対数相の時点の傾きを決定することによって計算した。計算には少なくとも24時点(2時間間隔)を使用した。
2.3. ゼラチンキューブ中の大腸菌Nissle 1917株の調製
大腸菌Nissle 1917株(アルダフェルミン発現の有無に関わらず)を、 100 μg/mLストレプトマイシン+50 μg/mLカナマイシンを添加したLuria-Bertaniブロス中 で、37 ℃、200 rpmで一晩培養した。翌日、細胞を4000rpmで10分間遠心し、ペレットを3mLの0.9%生理食塩水で2回洗浄した。一晩培養した100μLをルリアベルタニ寒天平板(抗生物質なし)に加え、37℃で一晩培養した。翌日、水道水に溶かした10%甘味料("Hermesetas Crunchy"、チューリッヒ、スイス)1mLをプレートに加え、細菌を採取した。ゼラチンキューブを調製するために、"Dr. Oetker Gelatinpulver"(ドイツ、ビーレフェルト)のゼラチン20%を "Hermesetas Crunchy"(スイス、チューリッヒ)の甘味料に混ぜた。Dr. Oetker Vanilla aroma」(ドイツ、ビーレフェルト)のバニラ香料を70:5の割合で加えた。最後に、細菌培養物75μLを96ウェルプレート中のゼラチンストック75μLと混合し、プレートを大腸菌ニッスル投与まで4℃で保存した。翌日、50μg/mLストレプトマイシン+50μg/mLカナマイシンを添加したルリアベルタニ寒天培地プレートにプレーティングし、大腸菌ニッスルの濃度が1立方体あたり109コロニー形成単位(CFU)であることを確認した。
2.4. 動物実験
マウスモデルを用いた実験プロトコールは、フィンランドの動物実験に関する国家倫理委員会(ライセンス番号:ESAVI/21371/2019)により承認され、科学的目的に使用される動物の保護に関する欧州連合の規制および要件に適合した。5~8週齢のC57BL/6J雄性マウスを繁殖させ、東フィンランド大学(フィンランド、クオピオ)の動物飼育施設に収容し、20.6℃(±0.2℃)、湿度55%(±0.8%)で12/12時間の光サイクルのもと、個別換気ケージ(1~4匹/ケージ)内で特定病原体を含まない条件下で飼育した。マウスの取り扱いは、フィンランドの法律および科学目的での脊椎動物の使用に関する欧州理事会条約ETS123に従った。群あたりのマウス数は、前述[21]と同様に "G∗Power "プログラム[20]を用いて計算した。18匹のマウスに、Tetriらの記述[22]に従って、MASLD誘発のために、アメリカンライフスタイル誘発性肥満症候群(ALIOS)食、HFD(TD06303、Harlan Teklad、Madison、WI)および高フルクトースコーンシロップ相当量(重量で45%のグルコースと55%のフルクトース)を42g/Lの飲料水中で与えた。14週後、すべてのMASLD誘導マウスを標準齧歯類チャウ対照飼料(2016 Teklad global 16%タンパク質齧歯類飼料、Harlan Teklad、Madison、WI)に切り替え、7週間ランダムに3群に分けた。この7週間の間、マウスは、アルダフェルミンを発現する大腸菌ニッスル(キューブあたり109 CFUの濃度)を含むゼラチンキューブ(EcNA、n = 6)とホルモンを発現しない大腸菌ニッスル(EcN、n = 6)を毎日自発的に摂取するように訓練された。さらに、6匹のマウスは細菌治療を受けず、食餌の変更(CTRL)のみに頼った(図1A)。
図1
ダウンロード 高解像度画像ダウンロード(2MB)
ダウンロード フルサイズ画像のダウンロード
図1. EcNAの介入は肝脂肪症と体重を減少させた。A) 動物実験の介入を示す。B) 介入7週間後のH&E染色とORO染色の代表写真。H&E染色ではn = 6匹/群、スケールバー200μm、対物レンズ4倍。ORO染色では、赤い液滴は肝臓切片に染色され蓄積した脂肪滴を示した。n = 6匹/群、8回/マウス、スケールバー100μm、10×対物レンズ。C)各組織切片の総脂肪に占める肝臓脂肪滴の割合の定量化 10×解析, n = 6 mice/group, 8 acquisitions/mouse, scale bar 100 μm, 10×対物レンズ. D) n = 6マウス/全群。肝脂肪滴の定量と体重増加率のグラフは平均値で示した。異なる群間の統計的有意性はアスタリスクを用いて示した(*p≦0.05および*p≦0.01)。H&E:ヘマトキシリン・エオジン;ORO:オイルレッドO。
2.5. 検体採取
ペントバルビタール(「Mebunat vet」、Orion Pharma、Espoo、フィンランド)の腹腔内注射(2 mL/kgマウス体から開始)による終末麻酔の前に、マウスを2時間絶食させた。心臓穿刺と心臓灌流による血液抽出を行った。血漿サンプルは、製造者の指示に従い、Microtainerチューブを用いて全血から直ちに分離し(分類番号:365986、Becton, Dickinson and Company, Franklin Lakes, NJ, USA)、液体窒素で凍結した後、-80℃で保存した。マウスの犠牲の前日に糞便サンプルを採取し、EcNA群およびEcN対照群における生きた大腸菌Nissle 1917株の存在を評価した。体重および肝臓重量は、それぞれ毎週およびサンプル採取中に測定した。EcNA群とCTRL群およびEcN群との比較は、Rソフトウェアバージョン3.6.3およびGraphPad Prism(バージョン9.2.0)を用いて、群間の一対比較のためのKruskal-Wallis検定およびDunn post-hoc 検定を用いて行った。
2.6. 磁気共鳴画像法
MASLD 誘発マーカーである肝臓の脂肪蓄積の程度を確認するため、14 週間の ALIOS 食後、磁気共鳴画像法を前述 [21] と同様に実施し、適合させた(データは示さず)。EcNA(n=3/群)、EcN(n=3/群)、CTRLマウス群(n=5/群)において、EcNAの有効性を評価するために、7週間の介入後の試験終了時に磁気共鳴画像法を再度実施した。マウスはイソフルラン(Piramal、オランダ)で麻酔した(5%導入、1.5%維持)。Rソフトウェアバージョン3.6.3でKruskal-Wallis検定およびDunn post-hoc検定を用い、GraphPad Prismソフトウェア(バージョン9.2.0)を用いてグラフィックを作成し、EcNA群における肝臓脂肪蓄積の2つの時点間の差の割合をCTRL群およびEcN群と比較した。
2.7. 生化学的パラメータ
血漿サンプルを全血から分離し、液体窒素で凍結し、-80℃で保存し、0.9%NaClで1:3に希釈し、ALT、AST、総コレステロール、HDL-C、LDL-C、トリグリセリド、グルコースの濃度を自動臨床化学分析装置Konelab Prime 60(サーモフィッシャーサイエンティフィック、ウォルサム、マサチューセッツ州、米国)で測定した。EcNA群の生化学的パラメータは、Rソフトウェアバージョン3.6.3において、Kruskal-Wallis検定およびDunn post-hoc 検定を用いてCTRL群およびEcN群と比較し、グラフはGraphPad Prismソフトウェア(バージョン9.2.0)を用いて作成した。
2.8. 組織学
左側肝葉を採取し、ヘマトキシリン・エオジン染色を行った[21]。簡単に説明すると、組織はダルベッコのリン酸緩衝生理食塩水1×(Thermo Fisher, Waltham, Massachusetts, United States, PBS)中4%パラホルムアルデヒド(VWR, Belgium, PFA)で4℃で一晩固定し、処理まで4℃で70%エタノール中に保存した。サンプルはパラフィンブロックに包埋し、5μmの切片に切り出した。オイルレッドO染色(Sigma-Aldrich, Saint Louis, Missouri, USA)用の肝臓サンプルは、PBS 1×中4%PFAで2時間固定し、PBS 1×中スクロース(Thermo Fisher, Waltham, Massachusetts, United States)スケール(10%と20%を40分間と30%)で一晩凍結保護し、OCT包埋培地(Thermo Fischer Scientific, Waltham, Massachussets, United States)に含ませ、凍結し、-80℃で保存した。サンプルを8μm厚の切片に切り出し、-80℃で保存した。ヘマトキシリン(Bio-Optica, イタリア、ミラノ)&エオシン(Bio-Optica, イタリア、ミラノ)およびオイルレッドO(Sigma-Aldrich, 米国、ミズーリ州セントルイス)染色をすべてのマウス群で行い、オリンパスBX51顕微鏡(オリンパス、東京、日本)を用いて画像を取得した。EcNA群の肝脂肪含量は、Fiji(ImageJ)ソフトウェア(バージョン1.52p)および学習可能なWeka Segmentationプラグイン[23]を用いて定量化し、Rソフトウェアバージョン3.6.3およびGraphPad Prismソフトウェア(バージョン9.2.0)を用いて、Kruskal-Wallis検定およびDunnポストホック検定を用いて対照群と比較した。
2.9. RNA配列解析
すべてのマウスから肝臓組織を採取し、RNA安定化溶液(RNAprotect Tissue Reagent、Qiagen、ドイツ)に浸し、液体窒素で凍結し、-80℃で保存した。肝臓をBuffer RLT(Cat.No./ID:79216, Qiagen, Germany)でホモジナイズし、RNeasy minikit(Qiagen, Germany)で抽出した。RNase-free DNase I (Qiagen, Germany)処理を行い、ゲノムDNAのコンタミを除去した。RNAの純度はNanoPhotometer® spectrophotometer (IMPLEN, CA, USA)を用いてチェックした。RNA の完全性と定量は Bioanalyzer 2100 system (Agilent Technologies, CA, USA) の RNA Nano 6000 Assay Kit を用いて評価した。RNAの純度(OD260/280≧2.0、OD260/230≧1.8)および品質(RIN≧8.60)に基づいて、各群5匹のマウスをトランスクリプトームシークエンシング解析用に選択した。シーケンスライブラリー調製には、NEBNext® UltraTM RNA Library Prep Kit for Illumina® (NEB, USA)を用い、メーカーの推奨に従ってサンプルあたり1μgのRNAを調製した。その後、Qubit® 2.0 (Thermo Fisher, Waltham, Massachusetts, United State)とリアルタイムPCRを用いてライブラリーを定量し、Agilent Bioanalyzer 2100システムでライブラリーの質を評価した。インデックスコードされたサンプルのクラスタリングは、PE Cluster Kit cBot-HS (Illumina)を用いたcBot Cluster Generation Systemで、メーカーの指示に従って行った。クラスター生成後、ライブラリー調製物をIlluminaプラットフォームNovaseq 6000でシーケンスし、150ノンストランドペアエンドリードを生成した。
2.10. RNAシーケンスのデータ処理
FASTQフォーマットの生リードをまずfastpで処理した。アダプター汚染、ポリN配列、低品質ヌクレオチド(Base Quality 5以下)、低不確実ヌクレオチド(N > 10%)を含むリードは除去された。同時に、クリーンデータのQ20、Q30、GC含量を計算した。すべての下流解析は、高品質なクリーンデータに基づいて行われた。参照ゲノムと遺伝子モデルのアノテーションファイルは https://www.ensembl.org/index.html からダウンロードした。Paired-end clean readsは、Spliced Transcripts Alignment to a Referenceソフトウェア[24]を用いてマッピングした。RパッケージSubread [25]とFeatureCounts [26]ソフトウェアを用いて、各遺伝子にマッピングされたリード数をカウントした。DESeq2[27]を用いてサンプル間(条件ごとに5生物学的複製)の比較のための差次的発現解析を行った。差分発現解析には、GLM係数の近似事後推定(apeglm)[28]を適用した。p値<0.05の遺伝子が有意に差次的に発現しているとみなされた。
2.11. ノンターゲットメタボローム解析
非標的メタボロミクス解析はKlåvusら[29]に従って実施した。肝臓サンプルの凍結切片(n = 6/グループ)を、80% v/v 水性 HPLC グレードメタノール(サンプル 100 mg あたり 500 μL)中で Bead Ruptor 24 Elite ホモジナイザー(6 m/秒、0 ± 2 °C で 30 秒間)を用いてホモジナイズした後、頂点破砕、遠心分離(10 分間、4 °C で 20,000 × g)、ろ過(Captiva ND フィルタープレート 0. 2μm)で遠心分離(5分間、4℃、700×g)し、分析まで4℃で保存した。液体クロマトグラフィー質量分析法は、2つのシステムを用いて行った。逆相液体クロマトグラフィーには、Vanquish Flex UHPLC システム(Thermo Scientific, Bremen, Germany)と高分解能オービトラップ質量分析装置(Q Exactive Focus, Thermo Scientific, Bremen, Germany)を用いた。親水性相互作用液体クロマトグラフィーは、1290 Infinity Binary UPLC と 6540 UHD Accurate-Mass 四重極 243 飛行時間型 MS(Agilent Technologies、米国カリフォルニア州)を組み合わせて実施した。どちらの分析セットアップでも、ポジティブおよびネガティブエレクトロスプレーイオン化モードでデータを取得しました。分析の最後に、各モードでデータ依存 MS2 を取得した。品質管理のため、分析開始時および12検体ごとにプールした肝臓検体を注入した。液体クロマトグラフィー質量分析装置のセットアップと MS/MS 分析の詳細については、既報[21]を参照。自動ピークピッキングとアライメントにはMS-DIAL(バージョン4.60)[30]を使用した。データの前処理と統計解析はRソフトウェアバージョン3.6.3で行った。特徴量は分析ドリフトのために正規化した。欠損値の数が少なく(品質管理サンプルの20%以上に存在)、相対標準偏差∗(RSD∗)が20%未満、分散比∗(D-ratio∗)が40%未満の特徴量については、ランダムフォレストインピュテーションを用いて欠損値をインプットした。さらに、RSD∗またはD-ratio∗のいずれかが閾値を超えている場合、古典的なRSD、RSD∗、および基本的なD-ratioがすべて10%以下であれば、その特徴は保持された。RSD∗とD-ratio∗は、RSDとD-ratioのロバストでノンパラメトリックな代替であり、平均と標準偏差の代わりに中央値と中央値絶対偏差に基づいている。その他の特徴は、フラグを立て、値 0 でインプットし、統計解析のために破棄した。研究グループ間の特徴ごとのWelchのt検定が計算された。未処理p値<0.05、MS/MSスペクトル、およびサンプル全体の平均ピーク面積が10,000を超えるすべてのフィーチャーは、前述のようにアノテーションされた[21]。さらに、Rソフトウェアバージョン3.6.3およびGraphPad Prismソフトウェア(バージョン9.2.0)を使用し、Kruskal-Wallis検定およびDunnポストホック検定を使用して、EcNAにおける特定の注釈付き代謝物の存在量をCTRLおよびEcNと比較した。
2.12. トランスクリプトミクスおよびメタボロミクスデータの統合
FPKM(fragments per kilobase of transcript per million fragments mapped)遺伝子値と、各群5生物学的複製(すなわち、EcNA、EcN、CTRL)から得られた良質な代謝物特徴を用いて、Rソフトウェアバージョン3.6.3で主成分分析を行った。トランスクリプトミクスおよびメタボロミクスデータの倍数変化とp値のボルケーノプロットは、VolcaNoseR [31]を使用して作成した。Ingenuity Pathway Analysis ソフトウェア(Qiagen, Hilden, Germany, https://digitalinsights.qiagen.com/IPA)を用いて、2 つの比較(EcNA vs CTRL および EcNA vs EcN)から得られた差次的に発現した遺伝子およびすべてのレベル 1 およびレベル 2 の注釈付き代謝物の正準パスウェイ濃縮を行った。入力トランスクリプトミクスデータは、遺伝子記号、(各比較の)遺伝子の倍数変化値、および対応するp値で構成される。メタボロミクスデータの場合、入力は代謝物 ID(HMDB、KEGG、Pubchem CID、CAS 登録番号)、(各比較について)6 つの複製からの存在量の倍数変化値、および対応する p 値から構成される。各遺伝子シンボルおよび代謝物 ID は、Ingenuity Knowledge Base 遺伝子 + 内在性化学物質データベースの対応する遺伝子および代謝物オブジェクトにマップした。各データセットについてコア解析を行い、カノニカルパスウェイを同定した。さらに、2 つのデータセット間で比較解析を行った。得られたヒートマップは、Benjamini-Hochberg調整(BH)p-value <0.05およびz-score閾値1.5を用いて、canonical pathwayレベルでフィルタリングされた。さらに、一方の比較では一意に差 別されたが、他方の比較ではBH p-value<0.05の閾値を通過したパスウェイも選択した(表S1)。さらに、個々のパスウェイに関与する遺伝子と代謝物を、Ingenuity Target Explorer (QIAGEN, Inc.) を用いて手作業でチェックした。
結果
3.1. アルダフェルミン産生大腸菌Nissleは、野生型に比べて増殖率が低下していた。
MASLDに対する先進的な微生物治療薬を開発するため、アルダフェルミン遺伝子を構成的プロモーター下でクローニングし、マウス消化管およびin vitro条件下で強固に発現させた[19]。大腸菌Nissle株によるアルダフェルミンの産生を補足図S2Aに示す。さらに、菌株の増殖挙動とアルダフェルミンの産生を相関させるために、アルダフェルミンを発現している大腸菌Nissleの増殖速度を、細胞の体力の間接的な尺度として測定した。前述のコンストラクトでアルダフェルミンを過剰発現させた結果、コントロールの大腸菌Nissleビヒクルと比較して55%の増殖欠損が見られた(補足図S2B)。
3.2. EcNAの介入は、肝脂肪症、体重、AST、および血漿中のコレステロール値を減少させた
MASLDの改善における先進微生物治療薬の影響を評価するため、アルダフェルミンを発現する大腸菌NissleをMASLDモデルマウスに7週間、食事の変更とともに投与した(図1A)。マウスの糞便サンプルから、腸内に生きた大腸菌Nissle株が存在することが確認された。大腸菌ニッスル株(アルダフェルミンの発現の有無にかかわらず)は、すべてのマウスの糞便サンプルから104〜108 CFU/gの範囲で回収された。
肝臓の形態を評価し、肝脂質含量を定量化するために、組織学的検査を行った。EcNA投与は、ホルモン産生を伴わない大腸菌ニッスル(EcN)および細菌を全く含まない(CTRL)と組み合わせた食餌変更を受けた対照群と比較して、肝脂肪症を改善した(図1B)。ヘマトキシリン・エオジン染色による観察では、EcNA群では、CTRL群およびEcN群と比較して、脂質脂肪滴がなく、肝臓組織の健全な構造が保たれていた(図1B)。ヘマトキシリン・エオジン染色の観察結果は、オイルレッドO染色によってさらに確認された(図1B)。組織切片における肝脂肪滴の割合を定量的に分析したところ、CTRLおよびEcN群と比較して、EcNA群では脂肪含量が有意に減少していた(図1C)。組織学的検査は、磁気共鳴画像分析によってさらに確認された。その結果、CTRL群と比較してEcNA群では、磁気共鳴画像脂肪指数差の割合が有意に増加した(p = 0.0306)(補足図S3AおよびB)。肝臓における脂肪蓄積の減少に伴い、EcNAはCTRL群(p = 0.0064)およびEcN群(p = 0.0055)と比較して体重を効果的に減少させたが(図1D)、肝臓重量には有意な変化は認められなかった(補足図S3CおよびD)。
MASLDの改善におけるEcNAの有効性を評価するため、いくつかの一般的な疾患バイオマーカーを測定した。EcNAの介入は、CTRL(p = 0.0116)およびEcN(p = 0.0258)と比較して血漿中のASTレベルを有意に低下させたが(図2A)、ALTレベルは低下させなかった(補足図S3E)。EcNA群はまた、CTRL(p = 0.0007)およびEcN(p = 0.0227)と比較して、血漿総コレステロール値の減少を示した(図2B)。具体的には、高比重リポ蛋白(HDL-C)および低比重リポ蛋白(LDL-C)の両者とも、CTRL(HDL-Cについてはp=0.0019、LDL-Cについてはp=0.0012)およびEcN(HDL-Cについてはp=0.0350、LDL-Cについてはp=0.0040)と比較して、EcNAの7週間投与後に血漿レベルの有意な減少を示した(図2C,D)。血漿グルコースレベルは、EcNA、CTRL、EcNの間に有意差は認められなかった(補足S3F)。EcNAはCTRLよりも高い血漿トリグリセリドレベルを示したが(p = 0.0418)、EcNと比較して有意差は認められなかった(補足図S3G)。
図2
ダウンロード 高解像度画像ダウンロード(388KB)
ダウンロード フルサイズ画像のダウンロード
図2. EcNA介入により、介入7週間後に血漿生化学マーカーが減少した。A)AST、B)総コレステロール、C)HDL-C、D)LDL-C、n=6マウス/全群。結果は平均値で示した。エラーバーはSDを示す。異なる群間の統計的有意性はアスタリスクを用いて示した(*p≦0.05、*p≦0.01、**p≦0.001)。AST:アスパラギン酸アミノトランスフェラーゼ;HDL-C:高比重リポ蛋白;LDL-C:低比重リポ蛋白。
3.3. EcNA介入は肝トランスクリプトームおよびメタボロームプロファイルを変化させた
EcNA介入の有効性は、RNAシークエンシングと非標的メタボロミクスアプローチによってさらに評価された。これらの解析により、EcNA介入により代謝のいくつかの領域で、対照群と比較して変化が認められた(図3A,B、補足表1-3)。遺伝子発現レベルでは、Mgst3、Gclc、Cpt2などのグルタチオン代謝、酸化ストレス、脂肪酸酸化に関与する遺伝子に有意な変化が認められた(図3A,Bおよび補足表2)。代謝物レベルでは、介入によりアミノ酸(トリプトファン、イソロイシン、バリンなど)、ペプチド(グルタチオンなど)、アミノ酸由来の腸内細菌叢および微生物-宿主共代謝産物(キヌレン酸、インドールプロピオン酸、ヒプリン酸など)のレベルが低下した。一方、メタボローム解析から、リゾホスファチジルコリン(LPC)、リゾホスファチジルエタノールアミン(LPE)、リゾホスファチジルイノシトール、アシルカルニチン、一次胆汁酸、脂質由来の腸内細菌叢および微生物宿主共代謝産物であるLPC(15: 0)および二次胆汁酸は、EcNおよびCTRL群と比較してEcNA群で増加した(図3B、補足表3)。さらに、EcN群ではCTRL群と比較して遺伝子発現および代謝物レベルの有意な変化が観察され、大腸菌Nissleの宿主への影響が強調された(補足図S4)。
図3
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図3. EcNAの介入により肝臓のトランスクリプトームおよびメタボロームプロファイルが変化した。A) i) EcNA vs CTRL ii) EcNA vs EcN(n=5/群)の比較のための発現差遺伝子のボルケーノプロット。全遺伝子のデータは、生のp値の負の対数に対するlog 2(fold-change)としてプロットされている。B) i) EcNA vs CTRL、ii) EcNA vs EcN (n = 6/グループ)の比較のためのアノテーションされた代謝物のボルケーノプロット。すべての代謝物のデータは、生のp値の負の対数に対するlog 2(fold-change)としてプロットされている。C) アンターゲットメタボロミクス解析による良質な代謝物特徴とトランスクリプトミクス解析による生のFPKM値の主成分分析(n = 5/グループ)。D) Ingenuity pathway analysis (IPA)を用いた(EcNA vs CTRL)と(EcNA vs EcN)の比較解析のヒートマップ。ACar-アシルカルニチン、LPC-リゾホスファチジルコリン、LPE-リゾホスファチジルエタノールアミン、LPI-リゾホスファチジルイノシトール、PC-ホスファチジルコリン。
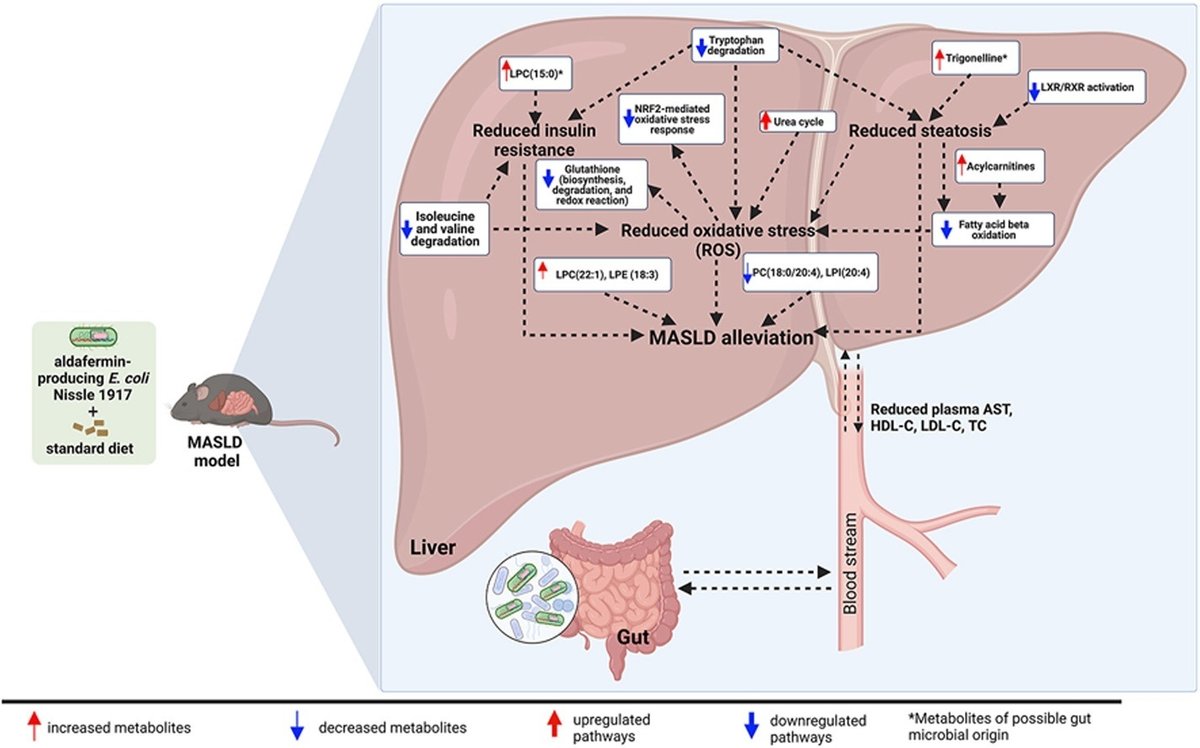
その後、トランスクリプトミクスとメタボロミクスデータを統合することにより、主成分分析を用いて、EcNAグループとCTRLグループおよびEcNグループの明確な分離が観察された(図3C)。さらに、トランスクリプトミクスとメタボロミクスの両データを統合し、CTRL群およびEcN群と比較してEcNA群で得られた発現量の異なる遺伝子および代謝産物についてカノニカルパスウェイ解析を行ったところ、尿素サイクルのアップレギュレーションと、アミノ酸代謝(イソロイシン、バリン、トリプトファン分解)に関連するパスウェイのダウンレギュレーションが明らかになった、 脂質代謝(脂肪酸β酸化Iおよびゲラニルゲラニルリン酸生合成Iのスーパー経路)、および肝X受容体(LXR)-レチノイドX受容体(RXR)活性化、核因子E2関連因子2(Nrf2)-仲介酸化ストレス応答シグナル伝達経路、アリール炭化水素受容体(AHR)シグナル伝達経路などの関連受容体シグナル伝達経路(図3、図4、図5、補足Fig. S5、Supplemental Table S1)。
図4
ダウンロード 高解像度画像ダウンロード(1007KB)
ダウンロード フルサイズ画像のダウンロード
図4. CTRL(1)、EcN(2)と比較したEcNAグループのアミノ酸代謝に関連するパスウェイ。アノテーションされたすべての遺伝子と代謝産物が図に示されている。四角は遺伝子、菱形は遺伝子複合体、丸は代謝物を示す。青色はダウンレギュレーション、赤色はアップレギュレーション、灰色は未同定の遺伝子または代謝物を示す。細い線はパスウェイからの副産物を示す。パスウェイにおける遺伝子と代謝物の直接的および間接的な関連は矢印で示されている。
図5
ダウンロード 高解像度画像ダウンロード(540KB)
ダウンロード フルサイズ画像のダウンロード
図5. CTRL(1)、EcN(2)と比較したEcNA群の脂質代謝に関連するパスウェイ。アノテーションされたすべての遺伝子と代謝産物が図に表されている。四角は遺伝子、菱形は遺伝子複合体、丸は代謝物を示す。青色はダウンレギュレーション、赤色はアップレギュレーション、灰色は未同定の遺伝子または代謝物を示す。細い線はパスウェイからの副産物を表す。パスウェイにおける遺伝子と代謝物の直接的および間接的な関連は矢印で示す。
考察
本研究は、MASLDマウスモデルにおいて、アルダフェルミンを発現する新規の遺伝子組換え大腸菌Nissle 1917を、食事の変化と組み合わせて、この疾患に対する非侵襲的な先進微生物治療薬として使用したことを報告する初めての研究である。
MASLD誘発後、7週間のEcNA介入は、食事療法またはEcN単独よりも効果的に肝脂肪症、体重、AST、血漿コレステロール値(総コレステロール、HDL-C、LDL-C)を減少させた。肝臓におけるトランスクリプトームおよびメタボローム・プロファイリングとそれらの組み合わせにより、酸化ストレスの軽減とインスリン抵抗性(IR)の改善が、観察されたこれらの生理学的変化に寄与している可能性が示された。アルダフェルミンは、コレステロールからの胆汁酸合成を阻害するFGF19のアナログであるが [11]、EcNAは肝臓における胆汁酸代謝に特異的な影響を及ぼさなかった。
血漿コレステロール値を低下させるというEcNAの介入による有益な効果は、肝臓におけるゲラニルゲラニルジホスフェート生合成のスーパーパスウェイのダウンレギュレーションによって支持された。この経路は肝臓でのコレステロール産生に必須であり、この経路のダウンレギュレーションは、血漿へのコレステロール流出の減少を説明できるかもしれない。さらに、LXR/RXR経路の活性化は、EcNA群におけるトリゴネリン濃度の上昇と同様に、コレステロール排出を促進し[32]、脂肪症[33]を誘発することが示されていることから、これらの結果はLXR/RXR経路のダウンレギュレーションによっても支持された。
血漿コレステロール値の低下に加えて、生物活性分子を産生する遺伝子組み換え大腸菌ニッスル [12] またはアルダフェルミン単独 [11] を利用したこれまでの介入でも、脂肪症、体重、血漿ASTの減少が報告されており、肝疾患に対処するためのこの新しいEcNAモダリティの可能性が強調されている。実際、グルカゴン様ペプチド1のような他の生理活性分子を発現する大腸菌ニッスルを利用した研究では、HFDを摂取させたマウスにおいて、体重と肝脂肪症の減少が報告されている[17]。さらに、N-アシルホスファチジルエタノールアミンを産生する遺伝子組み換え大腸菌Nissleは、HFDを摂取させたマウスの脂肪症を予防し、体重を増加させた[18]。同様に、Zhouらは、高脂肪・高フルクトース・高コレステロール食(HFFCD)誘発非アルコール性脂肪肝炎マウスにアルダフェルミンを投与したところ、肝脂肪症と体重が減少したことを報告している[11]。この研究では、マウスが高脂肪食から標準食に移行したため、体重の減少はすべての試験群で予想された。全群で体重が減少したのは、高脂肪食と標準食のエネルギー含量が有意に異なるためと考えられる。さらに、体重を減少させるFGF19の能力は、食物摂取量に有意な変化を与えることなく脂肪組織の代謝率を増加させる効果に起因している[9,34]。したがって、EcNA介入後に観察された特異的な体重減少は、おそらくエネルギー消費量の増加に起因していると推測される。しかし、食物摂取量の測定による確認ができなかったことは、本研究の限界である。
MASLDの多因子性と代謝障害との密接な関連から、本研究では微生物治療薬と食事介入を組み合わせて検討した。観察された脂質およびアミノ酸代謝の変化は、それらに関連する受容体シグナル伝達経路とともに、酸化ストレス、ステアトーシス、およびIRの軽減におけるEcNA介入による有益な効果の可能性を支持するものとなった。注目すべきは、EcNAの介入によりβ酸化経路が有意に減少したことで、おそらく肝臓における脂肪蓄積が減少したためと考えられる [35]。実際、MASLD中は肝臓に脂質が過剰に蓄積し、脂肪酸の酸化と活性酸素種(ROS)の産生が亢進し、炎症と酸化ストレスが活性化される [36]。さらに、炎症の亢進は、細胞外マトリックスタンパク質の産生・分泌の亢進と脂肪酸酸化を含むミトコンドリア活性を特徴とするプロフィブロティック肝星細胞の活性化と関連している [37] 。しかしながら、活性化した肝星状細胞が静止したような健康な表現型に反転することは、ミトコンドリア活性の低下と関連している [37] 。したがって、EcNAの介入は、おそらくβ酸化を減少させることにより、MASLDに関連した酸化ストレスを軽減し、おそらく異なる肝細胞型の生体エネルギーシグネチャーに影響を与える可能性がある。
β酸化との関連では、EcNA介入を受けたマウスの肝臓において、アシルカルニチンの大部分が有意に増加していることも本研究で観察された。アシルカルニチンは、脂肪酸をミトコンドリアへ輸送し、その後のβ酸化に利用する担体としての役割を担っている [38]。MASLD患者の血清中アシルカルニチン濃度の上昇が報告されている [39]。しかし、この研究でEcNA群の肝臓で観察されたいくつかのアシルカルニチンの増加は、アシルカルニチンをカルニチンに変換してβ酸化過程に入るCpt2の発現が有意に減少したことに起因している可能性があり、β酸化経路のダウンレギュレーションをさらに裏付けている。したがって、これらの結果は、活性酸素を減少させ、酸化ストレスを緩和するEcNAの潜在的役割を支持するものである。
酸化ストレスの軽減は、尿素サイクルに関与する遺伝子と代謝産物のアップレギュレーションによってさらに支持された。この経路は、アンモニアなどの有毒化合物の解毒において重要な役割を果たしている。高濃度のアンモニアは活性酸素の産生を亢進させ、MASLDの進行にさらに拍車をかける [40]。実際、MASLD患者では、尿素サイクルに関与する遺伝子やタンパク質の発現が低下しており、アンモニアの蓄積を引き起こしている。本研究では、EcNAの介入により尿素サイクルがアップレギュレーションされ、おそらく尿素の形でアンモニアの排泄が促進され、活性酸素の産生が減少した。
活性酸素を減少させる可能性のあるEcNA介入の有益な効果は、グルタチオンの減少、酸化ストレス反応に関連する主要遺伝子(Mgst3、Gclc、Nqo2)の発現低下 [42]、グルタチオン関連経路およびNRF-2を介した酸化反応シグナル伝達経路のダウンレギュレーションによって、さらに証明された。酸化ストレスはMASLDの病理学的特徴であるため、MASLDではグルタチオンレベルとNRF2が上昇する [43,44] 。これらの経路の発現低下が観察されたことは、肝臓における酸化ストレス状態の低下を示唆している可能性がある。さらに、マウスにおけるグルタチオンの枯渇は、食事誘発性肥満を予防し、インスリン感受性を改善し、エネルギー代謝を調節することが示されている [45]。グルタチオンレベルの低下とグルタチオン関連経路のダウンレギュレーションは、IRに対する改善を示唆している。
イソロイシン、バリン、トリプトファン分解経路のダウンレギュレーションは、いくつかの主要遺伝子の発現低下とこれらの経路における代謝物の存在量の低下とともに、インスリン感受性の向上と活性酸素産生の減少をさらに裏付けるものとなった。トリプトファンと分岐鎖アミノ酸(すなわち、ロイシン、イソロイシン、バリン)、および肝臓と循環におけるそれらの代謝に関与する遺伝子のレベルの増加は、MASLDにおいてもIRの発症と同様に報告されている[[46]、[47]、[48]、[49]、[50]、[51]]。さらに、トリプトファンの代謝産物であるキヌレニンの増加レベルは、肝内脂質蓄積の増加と関連しており [52]、それに続くAHRシグナルの活性化により、マウスの体重増加、脂肪症、高血糖を引き起こす [53]。さらに、高フルクトース-HFDを摂取させたマウスにトリプトファンを投与すると、活性酸素産生が誘導されることも知られている [48]。さらに、分岐鎖アミノ酸は、ミトコンドリアの呼吸とATP合成に密接に関連し、活性酸素の生成に寄与するトリカルボン酸サイクルを収容する、ミトコンドリアを燃料とするグルコース合成に関与する重要な経路に関与する肝臓のIRを誘導することが示されている [47]。したがって、EcNA介入後に観察されたトリプトファン経路と分岐鎖アミノ酸経路のダウンレギュレーションは、MASLDにおいて有益な効果をもたらすかもしれない。
インスリン分泌を誘導し、グルコースレベルを低下させることで糖尿病からの保護をもたらす腸内細菌由来の代謝産物である可能性のあるLPC (15:0)[54]のレベルが、HFD飼育マウス[21]では低下していることから、本研究ではIRの減少がさらに示唆され、それによってMASLDの進行が抑制された可能性がある。加えて、インドールプロピオン酸やヒプリン酸を含む他の腸由来代謝産物レベルの減少は、EcNA介入後の腸-肝臓軸ホメオスタシスおよびMASLD緩和の調節を示唆するかもしれない。他のグリセロリン脂質における変化、例えば、HFDを摂取させたマウスで減少することが知られているLPC(22:1)のレベルの上昇 [55]、および肥満被験者の血漿で増加するリゾホスファチジルイノシトール(20:4)の減少 [56]などは、MASLDにおけるEcNAの有益な効果をさらに支持している。さらに、EcNAの介入は、ラットにおけるエチオナミド誘発性肝脂肪症を予測する潜在的なバイオマーカーであるPC(18:0/20:4)を減少させた [57]。とはいえ、LPE (17:0)、LPE (17:1)、LPE (18:0)など、有意に変化した他の脂質の役割については、MASLDとの関連でさらに調査する必要がある。脂質の網羅性を高めることを目的としたパスウェイ解析ツールの改良により、同定された脂質を生物学的に重要な異なるパスウェイにマッピングすることが可能になるかもしれない。
我々の研究では、in vitroでアルダフェルミンの生産に成功したが、血漿検体で検出する際に限界に直面した。FGF19の半減期が短い(30分未満)ため [58]、ペプチドが急速に分解されたか、あるいはそのレベルが ELISAキットの検出限界以下であったのではないかと推測される。これは、われわれの採血方法が心臓穿刺によるもので、アルダフェルミンの検出には理想的でなかったためかもしれない。今後の研究では、高速液体クロマトグラフィー [59] や、腸内容物、肝臓、門脈からのアルダフェルミン濃度の測定など、より感度の高いアプローチを検討すべきである。しかし、門脈から血液を採取すると、血液サンプルの量が著しく少なくなる可能性があり、他の分析を実施する上でさらに問題が生じる可能性がある。したがって、アルダフェルミンの血漿レベルは、腸と肝臓の軸の間の直接的なリンクを予測し、EcNA介入の有効性を示す重要なマーカーとなる可能性があるため、これは我々の研究におけるギャップを意味する。とはいえ、このような技術的限界にもかかわらず、我々のアプローチは、マウスの様々な組織におけるアルダフェルミンの下流効果を直接調べることができ、MASLDの緩和におけるアルダフェルミンの影響をさらに検証することができたと考えている。
結論
本研究では、アルダフェルミンを発現する大腸菌 Nissle 1917 株を用いた MASLD 治療に、 食餌療法を併用するという新たなアプローチを採用した。その結果、本治療によりマウスの体重、肝脂肪症、血漿総コレステロール、LDL-C、HDL-CおよびASTが減少した。トランスクリプトミクスとメタボロミクス解析により、MASLDマウスモデルにおける肝脂肪症、酸化ストレス、IRの改善と関連するアミノ酸代謝と脂質代謝、および関連する受容体シグナル伝達経路における有益な変化が明らかになった。介入はまた、腸内微生物由来の可能性のある代謝産物に対しても有益な効果を示した。本研究の有望な結果は、MASLDの進行を抑制するだけでなく、他の多因子疾患の治療候補としてのEcNAの可能性を強調するものである。さらなる研究により、EcNAは複雑な代謝疾患に取り組む新世代の微生物治療薬への道を開く可能性がある。
資金提供
本研究は、ITN Marie Curie BestTreat-Building a Gut Microbiome Engineering Toolbox for In Situ Therapeutic Treatments for Non-alcoholic Fatty Liver Disease(助成金番号813781)、The Cell2Eat(Research Council of Finland決定番号339184)、Novo Nordisk Foundation、NNF助成金番号NNF20CC0035580、NNF21OC0070455、NNF22OC0081058の支援を受けた。KHはフィンランドアカデミー(助成金番号321716)およびERA-NET NEURON(助成金番号334814)の支援を受けている。
著者貢献
本論文への貢献は以下の通りである: V.I.、J.L.、C.G.G.、R.V.U.、T.H.V.、M.B.、M.O.A.S.、M.Kolehmainen、H.N. データ収集: V.I.、J.L.、A.F.B.、C.G.G.、I.T. 結果の解析と解釈: V.I.、A.F.B.、C.G.G.、G.D.、J.L.、M.Kettunen、A.K.、S.K.、R.S.、D.K.、J.P.、R.V.U.、M.O.A.S.、K.H.、H.N.、M.Kolehmainen。原稿作成: C.G.G.、K.H.、H.N.、M.Kolehmainenの指導のもと、V.I.とA.F.B.が第1版の原稿を作成した。著者全員が最終原稿を読み、査読し、承認した。
引用されていない文献
[60].
競合利益宣言
著者らは、本論文で報告された研究に影響を及ぼすと思われる競合する金銭的利益や個人的関係がないことを宣言する。
謝辞
Flavia Scoyniは、RNAの前処理を手伝ってくれた。Atte Lihtamoはバイオインフォマティクス解析に感謝する。本研究の一部は、フィンランド、クオピオにあるUniversity of Eastern FinlandのKuopio Biomedical Imaging Unit(Finnish Biomedical Imaging Node, EuroBioImagingの一部)の支援を受けて実施した。補足図S5およびグラフ抄録はBioRender(BioRender-biorender.com)を用いて作成した。
付録A. 補足データ
すべての補足ファイルをダウンロードする
これは何ですか?
本論文の補足データです:
ダウンロード ワード文書ダウンロード (1MB)
マルチメディア・コンポーネント1.
ダウンロード カンマ区切り値ファイルのダウンロード (3KB)
マルチメディア部品2.
ダウンロード カンマ区切り値ファイルのダウンロード(3MB)
マルチメディアコンポーネント 3.
ダウンロード カンマ区切り値ファイルのダウンロード(120KB)
マルチメディアコンポーネント 4.
データの利用可能性
RNA配列データはNCBIのGene Expression Omnibusにアクセッション番号GSE232030で寄託されている。メタボロミクスデータの処理および統計解析に使用したRコードはオンラインで入手可能です。
参考文献
[1]
D.G. Tiniakos、M.B. Vos、E.M. Brunt
非アルコール性脂肪性肝疾患:病理学と発症機序
Annu Rev Pathol Mech Dis, 5 (1) (2010), pp. 145-171, 10.1146/annurev-pathol-121808-102132
スコープで見るGoogle Scholar
[2]
S.L. Friedman、B.A. Neuschwander-Tetri、M. Rinella、A.J. Sanyal
NAFLD発症のメカニズムと治療戦略
Nat Med, 24 (7) (2018), 908-922頁, 10.1038/s41591-018-0104-9
Scopusで見るGoogle Scholar
[3]
Z. チェン、R.ユー、Y.ション、F.ドゥ、S.朱
非アルコール性脂肪性肝疾患におけるインスリン抵抗性と炎症の悪循環
Lipids Health Dis, 16 (1) (2017), p. 203, 10.1186/s12944-017-0572-9
Google Scholar
[4]
Z. チェン, ティエン, シェー, カイ, リー.
非アルコール性脂肪性肝疾患の病態における酸化ストレスの役割
Free Radic Biol Med, 152 (2020), 116-141頁, 10.1016/j.freeradbiomed.2020.02.025
PDFで記事を見るScopusで記事を見るGoogle Scholar
[5]
K. 山口和彦、L. Yang、S. McCall、J. Huang、X.X. Yu、S.K. Pandey、他。
非アルコール性脂肪性肝炎の肥満マウスにおいて、トリグリセリド合成阻害は肝脂肪症を改善するが、肝障害と線維症を悪化させる。
Hepatology, 45 (6) (2007), 1366-1374頁, 10.1002/hep.21655
スコープで見るGoogle Scholar
[6]
P. ヒルソワ、S.H.イブラビム、G.J.ゴアズ、H.マルヒ
肝細胞における脂肪毒性致死および亜致死ストレスシグナル:NASH発症との関連性
J Lipid Res, 57 (10) (2016), 1758-1770頁, 10.1194/jlr.R066357
PDFを見る記事を見るScopusで見るGoogle Scholar
[7]
T.C.M.A. Schreuder, H.A. Marsman, M. Lenicek, J.R. van Werven, A.J. Nederveen, P.L.M. Jansen, et al.
非アルコール性脂肪性肝疾患およびインスリン抵抗性患者では、FGF19に対する肝反応が障害されている。
Am J Physiol Gastrointest Liver Physiol, 298 (3) (2010), pp.G440-G445, 10.1152/ajpgi.00322.2009
スコープで見るGoogle Scholar
[8]
C. デジロラモ、C.サッバ、A.モスケッタ
内分泌性線維芽細胞成長因子FGF19、FGF21およびFGF23の治療可能性
Nat Rev Drug Discov, 15 (1) (2016), 51-69頁, 10.1038/nrd.2015.9
ScopusGoogle Scholarで見る
[9]
L. 傅、L.M.ジョン、S.H.アダムス、X.X.ユー、E.トムリンソン、M.レンツ、他。
線維芽細胞増殖因子19は代謝率を増加させ、食事性糖尿病およびレプチン欠乏性糖尿病を逆転させる。
内分泌学, 145 (6) (2004), 2594-2603頁, 10.1210/ja.2003-1671
スコープで見るGoogle Scholar
[10]
M. Zhou, X. Wang, V. Phung, D.A. Lindhout, K. Mondal, J.-Y. Hsu, et al.
内分泌ホルモンFGF19の胆汁酸調節活性から腫瘍性を分離する
Cancer Res, 74 (12) (2014), pp.3306-3316, 10.1158/0008-5472.CAN-14-0208
スコープで見るGoogle Scholar
[11]
M. Zhou、R.M. Learned、S.J. Rossi、A.M. DePaoli、H. Tian、L. Ling
人工FGF19は胆汁酸毒性と脂質毒性を除去し、マウスにおける脂肪肝炎と線維症の解消につながる: Zhouら
Hepatol Commun, 1 (10) (2017), pp.1024-1042, 10.1002/hep4.1108
スコープで見るGoogle Scholar
[12]
S.A. Harrison, G. Neff, C.D. Guy, M.R. Bashir, A.H. Paredes, J.P. Frias, et al.
非アルコール性脂肪性肝炎患者を対象とした無作為化二重盲検プラセボ対照試験における、人工FGF19アナログであるアルダフェルミンの有効性と安全性
Gastroenterology, 160 (1) (2021), pp.219-231.e1, 10.1053/j.gastro.2020.08.004
PDFで記事を見るScopusで記事を見るGoogle Scholar
[13]
S. ラング、B. シュナーブル
微生物叢と脂肪肝疾患-既知、未知、そして未来
Cell Host Microbe, 28 (2) (2020), pp.233-244, 10.1016/j.chom.2020.07.007
PDFで記事を見るScopusで記事を見るGoogle Scholar
[14]
J. Aron-Wisnewsky, C. Vigliotti, J. Witjes, P. Le, A.G. Holleboom, J. Verheij, et al.
腸内細菌叢とヒトNAFLD:代謝異常から微生物シグネチャーを切り離す
Nat Rev Gastroenterol Hepatol, 17 (5) (2020), 279-297頁, 10.1038/s41575-020-0269-9
スコープで見るGoogle Scholar
[15]
V. カスティーヨ、F.フィゲロア、K.ゴンサレス-ピサロ、P.ジョピア、C.イバカチェ-クイロガ
非アルコール性脂肪性肝疾患に対する戦略としてのプロバイオティクスとプレバイオティクス、ナラティブレビュー
Foods, 10 (8) (2021), p. 1719, 10.3390/foods10081719
スコープで見るGoogle Scholar
[16]
N.M. Hany, S. Eissa, M. Basyouni, A.H. Hasanin, Y.M. Aboul-Ela, N.M.A. Elmagd, et al.
非アルコール性脂肪性肝疾患管理におけるMutaflor®プロバイオティクスによる肝星状細胞のモジュレーション
J Transl Med, 20 (1) (2022), p. 342, 10.1186/s12967-022-03543-z
スコープで見るGoogle Scholar
[17]
J. Ma, C. Li, J. Wang, J. Gu
GLP-1アナログを分泌する遺伝子組み換え大腸菌Nissle 1917は、高脂肪食誘発肥満マウスにおいて潜在的な抗肥満効果を示す
肥満, 28 (2) (2020), 315-322頁, 10.1002/oby.22700
スコープで見るGoogle Scholar
[18]
Z. 陳(Z. Chen)、郭(L. Guo)、張(Y. Zhang)、ウォルツェム(R. L. Walzem)、ペンダーガスト(J.S. Pendergast)、プリンツ(R.L. Printz)、他。
治療的に改変された細菌を腸内細菌叢に組み入れると肥満が抑制される
J Clin Investig, 124 (8) (2014), pp.3391-3406, 10.1172/JCI72517
スコープで見るGoogle Scholar
[19]
J. Armetta, M. Schantz-Klausen, D. Shepelin, R. Vazquez-Uribe, M.I. Bahl, M.F. Laursen, et al.
マウス腸内で一貫して発現する大腸菌プロモーター
ACS Synth Biol, 10 (12) (2021), 3359-3368頁, 10.1021/acssynbio.1c00325
スコープで見るGoogle Scholar
[20]
F. Faul, E. Erdfelder, A. Buchner, A.-G. ラング
G∗Power 3.1を用いた検出力分析:相関分析と回帰分析の検定
行動研究法, 41 (4) (2009), pp.1149-1160, 10.3758/BRM.41.4.1149
スコープで見るGoogle Scholar
[21]
V. Iannone, A.F. Babu, C. Gómez-Gallego, R.M. Willman, V.M. Koistinen, A. Klåvus, et al.
米国生活習慣病誘発性肥満症候群食負荷マウスにおける肝遺伝子発現の変化とNAFLD発症および進行における代謝変化との関連性
J Nutr Biochem (2023), Article 109307, 10.1016/j.jnutbio.2023.109307
PDFを見る記事を見るScopusで見るGoogle Scholar
[22]
L.H.テトリ、M.バサラノグル、E.M.ブラント、L.M.イェリアン、B.A.ノイシュワンダー-テトリ
トランス脂肪酸と高フルクトースコーンシロップ等価物を摂取させたマウスにおける肝壊死炎症性変化を伴う重症NAFLD
Am J Physiol Gastrointest Liver Physiol, 295 (5) (2008), pp.G987-G995, 10.1152/ajpgi.90272.2008
スコープで見るGoogle Scholar
[23]
I. Arganda-Carreras, V. Kaynig, C. Rueden, K.W. Eliceiri, J. Schindelin, A. Cardona, et al.
学習可能なWekaセグメンテーション:顕微鏡画素分類のための機械学習ツール
Bioinformatics, 33 (15) (2017), pp.2424-2426, 10.1093/bioinformatics/btx180
スコープで見るGoogle Scholar
[24]
A. Dobin, C.A. Davis, F. Schlesinger, J. Drenkow, C. Zaleski, S. Jha, et al.
STAR:超高速ユニバーサルRNA-seqアライナー
バイオインフォマティクス, 29 (1) (2013), 15-21頁, 10.1093/bioinformatics/bts635
スコープで見るGoogle Scholar
[25]
Y. Liao, G.K. Smyth, W. Shi
RNAシーケンシングリードのアライメントと定量化において、Rsubreadパッケージはより簡単で、より速く、より安価で、より優れている。
Nucleic Acids Res, 47 (8) (2019), 10.1093/nar/gkz114
e47-e47
Google Scholar
[26]
Y. リャオ、G.K.スマイス、W.シー
featureCounts:配列リードをゲノムの特徴に割り当てるための効率的な汎用プログラム
Bioinformatics, 30 (7) (2014), pp.923-930, 10.1093/bioinformatics/btt656
スコープで見るGoogle Scholar
[27]
M.I.ラブ、W.フーバー、S.アンダース
DESeq2によるRNA-seqデータのフォルドチェンジと分散のモデレート推定
Genome Biol, 15 (12) (2014), p. 550, 10.1186/s13059-014-0550-8
スコープで見るGoogle Scholar
[28]
A. 朱、J.G.イブラヒム、M.I.ラブ
配列数データのための重尾部事前分布:ノイズを除去し、大きな違いを保存する
Bioinformatics, 35 (12) (2019), pp.2084-2092, 10.1093/bioinformatics/bty895
スコープで見るGoogle Scholar
[29]
A. Klåvus, M. Kokla, S. Noerman, V.M. Koistinen, M. Tuomainen, I. Zarei, et al.
「Notame":ノンターゲットLC-MS代謝プロファイリング用ワークフロー
Metabolites, 10 (4) (2020), p. 135, 10.3390/metabo10040135
スコープで見るGoogle Scholar
[30]
H. 津川英樹、T. Cajka、T. Kind、Y. Ma、B. Higgins、池田和典、他。
MS-DIAL:包括的メタボローム解析のためのデータ非依存MS/MSデコンボリューション
Nat Methods, 12 (6) (2015), pp.523-526, 10.1038/nmeth.3393
スコープで見るGoogle Scholar
[31]
J. Goedhart, M.S. Luijsterburg
VolcaNoseRは火山プロットを作成、探索、ラベル付け、共有するためのウェブアプリです。
Sci Rep, 10 (1) (2020), Article 20560, 10.1038/s41598-020-76603-3
スコープで見るGoogle Scholar
[32]
S.D.リー、P.トントノズ
脂質代謝とアテローム形成の交差点における肝臓X受容体
アテローム性動脈硬化症、242(1)(2015)、29-36頁、10.1016/j.atherosclerosis.2015.06.042
PDFを見る記事を見るGoogle Scholar
[33]
S.B. Ahn、K. Jang、D.W. Jun、B.H. Lee、K.J. Shin
肝X受容体の発現は、非アルコール性脂肪性肝疾患患者における肝内炎症および線維化と相関する。
Dig Dis Sci, 59 (12) (2014), pp.2975-2982, 10.1007/s10620-014-3289-x
スコープで見るGoogle Scholar
[34]
P.J. Antonellis, B.A. Droz, R. Cosgrove, L.S. O'Farrell, T. Coskun, J.W. Perfield, et al.
FGF19の抗肥満効果はUCP1依存的な熱発生を必要としない
Mol Metabol, 30 (2019), 131-139頁, 10.1016/j.molmet.2019.09.006
PDFで記事を見るScopusで記事を見るGoogle Scholar
[35]
Y. Ma、G. Lee、S.-Y. Heo, Y.-S. ロー
酸化ストレスは非アルコール性脂肪性肝疾患の発症における重要な調節因子である
抗酸化物質, 11 (1) (2021), p. 91, 10.3390/antiox11010091
Google Scholar
[36]
A. Zisser, D.H. Ipsen, P. Tveden-Nyborg
NASH-線維症における肝星状細胞の活性化と不活性化-治療標的としての役割?
Biomedicines, 9 (4) (2021), p. 365, 10.3390/biomedicines9040365
スコープで見るGoogle Scholar
[37]
P. Gajendiran, L.I. Vega, K. Itoh, H. Sesaki, M.R. Vakili, A. Lavasanifar, et al.
ミトコンドリア活性の上昇は、線維化性肝星状細胞を区別し、分裂促進ドキソルビシンによる選択的阻害に感作する。
J Cell Mol Med, 22 (4) (2018), 2210-2219頁, 10.1111/jcmm.13501
スコープで見るGoogle Scholar
[38]
M.G.シューンマン、F.M.ヴァズ、S.M.ホーテン、M.R.ソータース
アシルカルニチン
糖尿病, 62 (1) (2013), pp.1-8, 10.2337/db12-0466
スコープで見るGoogle Scholar
[39]
K. 榎邑圭司, 中川博之, 藤原直樹, 近藤正樹, 南俊哉, 星田祐子, et al.
血清アシルカルニチンプロファイルの変化は、非アルコール性脂肪性肝疾患(NAFLD)およびNAFLD関連肝細胞癌の病態と関連する。
Sci Rep, 9 (1) (2019), Article 10663, 10.1038/s41598-019-47216-2
Scopusで見るGoogle Scholar
[40]
R. Jalan, F. De Chiara, V. Balasubramaniyan, F. Andreola, V. Khetan, M. Malago, et al.
アンモニアはヒト肝星状細胞に病理学的変化をもたらし、門脈圧亢進症の治療標的である。
J Hepatol, 64 (4) (2016), pp.823-833, 10.1016/j.jhep.2015.11.019
PDFを見る記事を見るScopusで見るGoogle Scholar
[41]
F. De Chiara, S. Heebøll, G. Marrone, C. Montoliu, S. Hamilton-Dutoit, A. Ferrandez, et al.
非アルコール性脂肪性肝疾患における尿素サイクル調節障害
J Hepatol, 69 (4) (2018), 905-915頁, 10.1016/j.jhep.2018.06.023
PDFで記事を見るScopusで記事を見るGoogle Scholar
[42]
S. Cazanave, A. Podtelezhnikov, K. Jensen, M. Seneshaw, D.P. Kumar, H.-K. Min, et al.
非アルコール性脂肪性肝疾患の疾患発症と進行のトランスクリプトームシグネチャー
Sci Rep, 7 (1) (2017), Article 17193, 10.1038/s41598-017-17370-6
スコープで見るGoogle Scholar
[43]
S. Yang, H. Zhu, Y. Li, H. Lin, K. Gabrielson, M.A. Trush, et al.
肥満に関連した酸化ストレスに対するミトコンドリアの適応
Arch Biochem Biophys, 378 (2) (2000), pp.259-268, 10.1006/abbi.2000.1829
PDFで記事を見るScopusで記事を見るGoogle Scholar
[44]
A. Mohs、T. Otto、K.M. Schneider、M. Peltzer、M. Boekschoten、C.H. Holland、他。
肝細胞特異的NRF2活性化は、脂肪肝炎における線維形成と発癌を制御する。
J Hepatol, 74 (3) (2021), 638-648頁, 10.1016/j.jhep.2020.09.037
PDFで記事を見るScopusで記事を見るGoogle Scholar
[45]
H.M. Findeisen, F. Gizard, Y. Zhao, H. Qing, K.L. Jones, D. Cohn, et al.
グルタチオン枯渇は食事誘発性肥満を予防し、インスリン感受性を高める
肥満, 19 (12) (2011), 2429-2432頁, 10.1038/oby.2011.298
スコープで見るGoogle Scholar
[46]
T. Chen, X. Zheng, X. Ma, Y. Bao, Y. Ni, C. Hu, et al.
トリプトファンは将来の2型糖尿病リスクを予測する
PLoS One, 11 (9) (2016), Article e0162192, 10.1371/journal.pone.0162192
スコープで見るGoogle Scholar
[47]
N.E. Sunny, S. Kalavalapalli, F. Bril, T.J. Garrett, M. Nautiyal, J.T. Mathew, et al.
非アルコール性脂肪性肝疾患では分岐鎖アミノ酸と肝ミトコンドリアのクロストークが損なわれている。
Am J Physiol Endocrinol Metab, 309 (4) (2015), pp.E311-E319, 10.1152/ajpendo.00161.2015
スコープで見るGoogle Scholar
[48]
Y. 大沢洋一、金森博之、関英一郎、星正人、大滝秀典、安田祐樹、他。
l-トリプトファンを介した非アルコール性脂肪性肝疾患感受性の亢進は、哺乳類ラパマイシン標的タンパク質に依存する。
J Biol Chem, 286 (40) (2011), pp.34800-34808, 10.1074/jbc.M111.235473
PDFで記事を見るScopusで記事を見るGoogle Scholar
[49]
V.D. Mello, R. Sehgal, V. Männistö, A. Klåvus, E. Nilsson, A. Perfilyev, et al.
NASHに関連する血清芳香族アミノ酸と分岐鎖アミノ酸は、血清脂質と異なる関連を示す。
Liver Int, 41 (4) (2021), 754-763頁, 10.1111/liv.14743
Google Scholar
[50]
A.D. Lake, P. Novak, P. Shipkova, N. Aranibar, D.G. Robertson, M.D. Reily, et al.
進行性ヒト非アルコール性脂肪性肝疾患における分岐鎖アミノ酸代謝プロファイル
アミノ酸, 47 (3) (2015), 603-615頁, 10.1007/s00726-014-1894-9
ScopusGoogle Scholarで見る
[51]
A.A. Toye, M.E. Dumas, C. Blancher, A.R. Rothwell, J.F. Fearnside, S.P. Wilder, et al.
インスリン抵抗性マウスにおける食事誘発性脂肪肝感受性は、代謝および肝臓遺伝子の転写の微妙な変化によるものである。
Diabetologia, 50 (9) (2007), 1867-1879頁, 10.1007/s00125-007-0738-5
スコープで見るGoogle Scholar
[52]
G.スイ、L.ジャ、D.クアン、N.ザオ、G.ヤン
非糖尿病成人における腸内細菌-キヌレニン-肝軸の活性化は非アルコール性肝脂肪症の発症に寄与する。
Aging, 13 (17) (2021), 21309-21324頁, 10.18632/aging.203460
スコープで見るGoogle Scholar
[53]
I.Y. Rojas, B.J. Moyer, C.S. Ringelberg, O.M. Wilkins, D.B. Pooler, D.B. Ness, et al.
マウスにおけるキヌレニン誘導性アリール炭化水素受容体シグナル伝達は、体重増加、肝脂肪症、高血糖を引き起こす。
肥満, 29 (2) (2021), 337-349頁, 10.1002/oby.23065
スコープで見るGoogle Scholar
[54]
V.D.デ・メロ、T.セランダー、J.リンドストローム、J.トゥオミレト、M.ウシトゥパ、K.カアルニランタ
フィンランド糖尿病予防研究参加者におけるプラズマローゲンおよび脂肪酸代謝物の血清レベルと網膜微小血管症との関連性
栄養素, 13 (12) (2021), p. 4452, 10.3390/nu13124452
スコープで見るGoogle Scholar
[55]
L. Cheng、S. Zhang、F. Shang、Y. Ning、Z. Huang、R. He、他。
エモジンは褐色脂肪組織を活性化し、白色脂肪組織の褐色化を誘導することにより、肥満マウスの糖・脂質代謝障害を改善する。
Front Endocrinol, 12 (2021), Article 618037, 10.3389/fendo.2021.618037
スコープで見るGoogle Scholar
[56]
J.M. Moreno-Navarrete, V. Catalán, L. Whyte, A. Díaz-Arteaga, R. Vázquez-Martínez, F. Rotellar, et al.
l-α-リゾホスファチジルイノシトール/GPR55システムとヒト肥満におけるその潜在的役割
糖尿病, 61 (2) (2012), pp.281-291, 10.2337/db11-0649
スコープで見るGoogle Scholar
[57]
K. 牟田和彦, 齋藤和彦, 剣持由紀子, 増山哲也, 小林彰宏, 齋藤祐子, et al.
ホスファチジルコリン(18:0/20:4)は、エチオナミドによるラット肝脂肪症を予測するバイオマーカーとなりうる。
J Appl Toxicol, 42 (9) (2022), pp.1533-1547, 10.1002/jat.4324
スコープで見るGoogle Scholar
[58]
C.G. Avalos-de León, M.B. Jiménez-Castro, M.E. Cornide-Petronio, J. Gulfo, F. Rotondo, J. Gracia-Sancho, et al.
非ステトーシス性およびステトーシス性肝移植における線維芽細胞増殖因子15シグナリングの心循環死からの影響
Cells, 8 (12) (2019), p. 1640, 10.3390/cells8121640
スコープで見るGoogle Scholar
[59]
J.W.オナー
ガスクロマトグラフィー質量分析
M.J. Wheeler, J.S.M. Hutchinson (Eds.), Hormone assays in biological fluids, Humana Press, Totowa, NJ (2006), pp.53-74
CrossRefView in ScopusGoogle Scholar
[60]
R. エドガー
遺伝子発現オムニバス: NCBI遺伝子発現およびハイブリダイゼーションアレイデータリポジトリ
Nucleic Acids Res, 30 (1) (2002), pp.207-210, 10.1093/nar/30.1.207
スコープで見るGoogle Scholar
引用 (0)
12
同等の貢献。
13
平等な貢献。
© 2023 Elsevier GmbH発行。
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイト上のすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
PDF
ヘルプ
フィードバック
