
異なるタイプの分尿に関連する尿中微生物叢シグネチャー:比較研究
本文へスキップ
トップバーナビゲーション
細胞・感染微生物学の最前線
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
47
総閲覧数
7
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは1
オリジナル研究論文
フロント Cell. Infect. 微生物学、2024年01月03日
Sec.腸内マイクロバイオーム
第13巻 - 2023年|https://doi.org/10.3389/fcimb.2023.1302870
この記事は研究トピックの一部です
マイクロバイオーム研究の新技法-第2巻-「メタオミクス」技術を用いた宿主-マイクロバイオーム相互作用
全15記事を見る
異なるタイプの分尿に関連する尿中微生物叢シグネチャー:比較研究
https://www.frontiersin.org/articles/10.3389/fcimb.2023.1302870/full?utm_source=dlvr.it&utm_medium=twitter
Yuchao Liu1,2,3† Jingcheng Zhang2,3† Haotian Chen2,3† Wentao Zhang2,3 Ailiyaer Ainiwaer2,4 Shiyu Mao2,3 Xudong Yao1,2,3* Tianyuan Xu2,3* Yang Yan1,2,3* 1泌尿器科学部門
1同済大学上海第十人民医院崇明分院泌尿器科(中国、上海市
2同済大学上海第十人民医院泌尿器科(中国、上海市
3同済大学医学部泌尿器腫瘍研究所(中国・上海市
4中国新疆ウイグル自治区カシュガル市カシュガル県第二人民病院泌尿器科
背景 根治的膀胱摘除術と尿路転換術(UD)は、非転移性筋層浸潤性膀胱癌に対するゴールドスタンダードである。同所性新膀胱(またはStuder)、回腸導管(またはBricker)、皮膚尿管吻合術(CU)が主流のUDである。UD後の尿微生物学的変化についてはほとんど知られていない。
方法 本研究では、前述のUD術を受けた健常ボランティアおよび膀胱がん患者から尿サンプルを採取した。サンプルのマイクロバイオームを16SリボソームRNA遺伝子配列決定法を用いて解析し、微生物の多様性、分布、機能を調べ、グループ間で比較した。
結果 尿中微生物の豊富さと多様性が最も高かったのは健常対照群で、次いでStuder患者、特に水腎症や残尿のない患者で、そのα多様性指数はBricker群やCU群よりも顕著に高かった。スチューダーUDタイプは、尿微生物多様性に有利な唯一の独立因子であった。Studer群の尿微生物叢構造は健常人のそれと最も類似していたが、CU群のそれは最も類似していなかった。Studer患者と健常人ボランティアは多くの類似した尿微生物機能を共有していたが、Bricker群とCU群は正反対の特徴を示した。
結論 本研究は、UD患者の尿中微生物ランドスケープを初めて提示し、同所性新膀胱の微生物学的優位性を実証した。微生物叢は、UD管理の最適化のための潜在的なツールとなるかもしれない。
1 はじめに
膀胱がんは一般的な泌尿器科悪性腫瘍であり、中国では毎年91,893人が新たに膀胱がんに罹患し、42,973人が死亡している(Siegelら、2022年)。腫瘍浸潤の深さにより、非筋肉浸潤性膀胱癌(NMIBC)と筋浸潤性膀胱癌(MIBC)に分類される。非転移性MIBCの治療には、転移のリスクと致死率を考慮すると、根治的膀胱切除術(RC)とリンパ節切除術が推奨され、このような症例では必然的に尿路転換術(UD)が最後の、しかし極めて重要な手術ステップとなる。UDには通常、胃、回腸、S状結腸などの消化管が用いられ、同所性UD(または新膀胱、ONB)、回腸導管(IC)、皮膚尿管吻合術(CU)がUDの主流である(Lenisら、2020)。ONBは、RC後の外科的膀胱再建術のゴールドスタンダードと考えられているが、他のUDタイプに比べると施行頻度は低い(Janssenら、2021)。最も一般的な同所性尿路変向術であるStuderでは、それぞれ92%までの日中コンティニュアンス率が得られている。ONBの主な利点は、膀胱癌の根治切除を基礎として、正常な泌尿器系の解剖学的構造をほぼシミュレートできることである。ONB法は基本的に正常な生理学的・解剖学的状態を維持するため、術後の患者は外付けストーマを必要とせず、採尿バッグを携行する必要もない。また、この手術がもたらす心理的な刺激も受け入れやすい。Studerは最も一般的なONB術式であり、日中の失禁率は最大92%である(Sheybaee Moghaddamら、2022年)。失禁UD術としては、Brickerが最も代表的なIC術式として位置づけられており、ONBと比較して手術時間が短く、合併症が少ないという利点がある。ロボット手術の出現により、体腔内UDを伴うロボットRCの施行件数が増加するのに比例して、ICまたはBrikerの利用も増加している(Janssen et al., 2021)。長期的に見れば、失禁CUに対するBrickerの利点は、ステントを定期的に交換する必要がないため、感染や腎不全の可能性が減少し、患者のQOLが向上することである。とはいえ、CUは術中の外傷が比較的限定的であるため、特に高齢者や虚弱な患者に適用される範囲が広い(Korkes et al., 2022)。UDの種類を調整する際には、意思決定の共有と患者中心のアプローチを用いるべきである。
ヒトの微生物については、腸、口腔、皮膚、気管支、生殖管、臓器組織などに広く分布している(Hou et al.) 近年、微生物の理解が進むにつれ、ヒトの悪性腫瘍に対する微生物の寄与率は20%にも上ることが分かってきた(Garrett, 2015)。最も顕著な例として、胃がんに関連するヘリコバクター・ピロリや、子宮頸がんに関連する高リスク型ヒトパピローマウイルスが挙げられる(van Elsland and Neefjes, 2018)。微生物と宿主との相互作用は極めて複雑であり、腫瘍の発生、腫瘍の進行、抗がん剤治療への反応に影響を及ぼす様々な分子メカニズムが想定される。微生物はまた、腫瘍発生の背景となる慢性炎症を誘発したり、がんの免疫監視を混乱させる免疫抑制反応を引き起こしたりすることもある(Zitvogel et al.) 最後に、宿主の代謝産物、食物成分、または異物の微生物代謝は、有害な化合物を産生する可能性があり、離れた身体部位の腫瘍の発生を促進する可能性さえある(Roy and Trinchieri, 2017)。研究によると、マイクロバイオームの異常が、切迫性尿失禁、間質性膀胱炎、過活動膀胱、尿路悪性腫瘍などの様々な泌尿器科疾患の原因であることが明らかになっている(Bhide et al.) 間違いなく、UD処置は尿中マイクロバイオームの本来の組成を変化させ、私たちの身体の上皮バリア表面に生息する細菌、真菌、寄生虫、ウイルスの共生集合体の影響を受ける可能性がある。
UDに関するこれまでの、あるいは現在の研究は、主に手術手技や術後の機能的転帰に焦点が当てられてきた。しかし、UDを伴うRC後の尿中微生物学的変化については明らかにされていない。ここでは初めて、異なるUDタイプの患者の尿中微生物叢シグネチャーを同定し、機能的転帰との関連を予備的に解析することを目的とする。
2 方法
2.1 研究対象者と尿サンプル採取
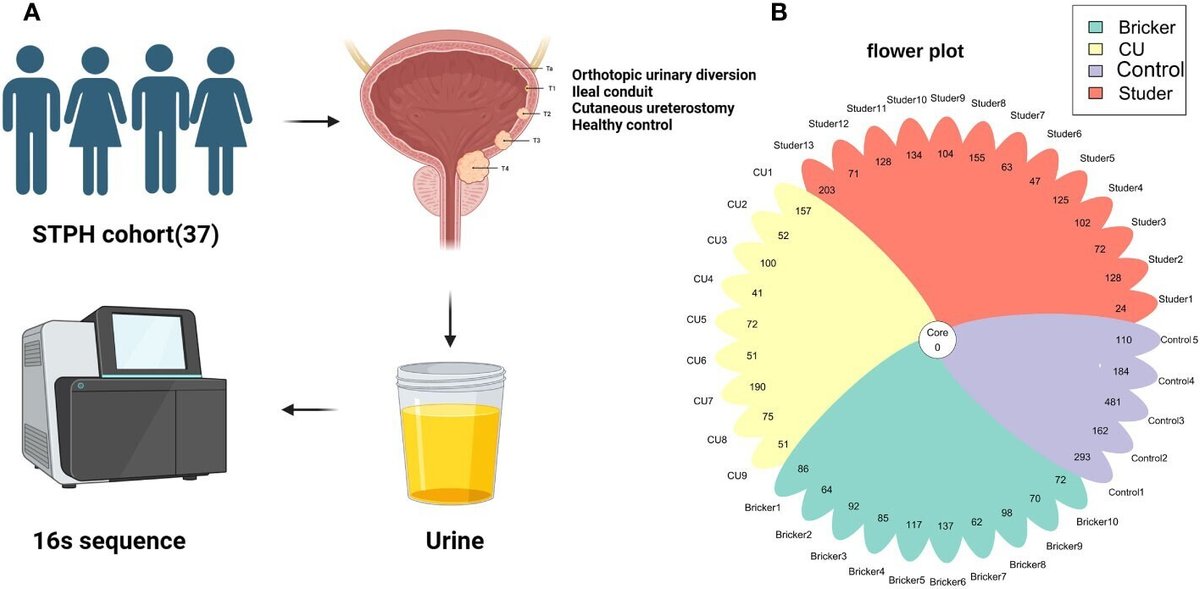
施設審査委員会の承認後、上海第十人民病院で2023年1月から5月にかけて、以前にUDでRCを受けた患者と健常対照者を本研究のために募集した。サンプル採取およびその他の手順やプロトコールについては、各参加者から文書によるインフォームド・コンセントを得た。すべてのUD症例は、RCで組織学的に尿路上皮癌と確定されていた。性感染症の既往がある者は除外した。最近の尿路感染や全身感染、抗生物質やプロバイオティクスの使用(2ヵ月以内)も除外した。対照群として、尿感染症や泌尿器疾患の既往のない健康な人が志願した。参加者全員から50mlのクリーンキャッチ中流尿サンプルを、厳格な無菌的手順の下で採取した。IC群とCU群については、それぞれ無菌の尿管ステントとカテーテルを用いて尿サンプルを抜き取り、採取した。専門のバイオテクノロジストの指導のもと、尿サンプルから微生物叢分析用の画分を16,000gで10分間遠心分離し、上清を分注して-80℃で保存した。一方、すべての参加者は、社会人口統計学的特性に関する情報を収集するために、構造化されたアンケートに回答するよう求められた。UD症例については、血清クレアチニンを検出し、超音波検査で尿路機能(残尿、水腎症など)を評価した。さらに、臨床病理学的特徴も電子カルテデータベースから抽出した(図1A)。データ収集はヘルシンキ宣言に概説された原則に従った。
図1
www.frontiersin.org
図1 (A)実験過程;(B)37検体におけるアンプリコン配列の変異数。
2.2 DNA抽出と16SリボソームRNA(rRNA)遺伝子アンプリコン配列決定
細菌DNAは、DNeasy PowerSoilキット(Qiagen, Hilden, Germany)を用いて、製造元の指示に従って尿サンプルから単離した。DNA濃度と完全性は、それぞれNanoDrop 2000 spectrophotometer(Thermo Fisher Scientific, Waltham, MA, USA)とアガロースゲル電気泳動で測定した。細菌16S rRNA遺伝子のV3-V4超可変領域のPCR増幅は、ユニバーサルプライマーペア(343F:5′-TACGGRAGGCAGCAG-3′;798R:5′-AGGGTATCTAATCCT-3′)を用いて25μlの反応で行った。増幅中のコンタミネーションを除外するために、鋳型DNAを含まないPCR陰性コントロールを処理した。アンプリコンの品質はゲル電気泳動を用いて可視化した。PCR産物はAgencourt AMPure XP beads (Beckman Coulter Inc., Brea, CA, USA)で精製し、Qubit dsDNA assay kit (Invitrogen, Life Technologies, Grand Island, NY, USA)を用いて定量した。その後、2×Phanta Max Master Mix 25μl、フォワードプライマー(10μM)2μl、リバースプライマー(10μM)2μl、ddH2O 50μl、鋳型DNAでPCR増幅を並行して行った。PCRは以下の条件で行った: 95℃で3分間;95℃で30秒間、55℃で30秒間、72℃で30秒間を25サイクル;そして72℃で5分間の最終伸長。その後、濃度を調整してシークエンシングを行い、Illumina NovaSeq6000を用い、250塩基ずつのペアエンドリードサイクルを2回行った(Illumina Inc.)
2.3 バイオインフォマティクス解析
生のシーケンスデータはFASTQ形式であった。ペアエンドリードをcutadaptソフトウェアで前処理し、アダプターを検出・切断した。トリミング後、ペアエンドリードは、QIIME2(Bolyen et al.、2019)のデフォルトパラメータでDADA2(Callahan et al.、2016)を使用して、低品質配列のフィルタリング、ノイズ除去、マージ、キメラリードの検出とカットを行った(2020.11)。最後に、代表リードとアンプリコン配列バリアント(ASV)のアバンダンステーブルをエクスポートした。各ASVの代表リードはQIIME2パッケージを用いて選択した。すべての代表リードは、デフォルトのパラメータでq2-feature-classifierを使用して、Silvaデータベースバージョン138(またはUnite)(16s/18s/ITS rDNA)に対してアノテーションおよびブラストを行った。尿中サンプルの微生物多様性は、abundance-based coverage estimator (ACE)、系統的多様性全木、Chao1、Shannon (Chao and Bunge, 2002)、観察種、Simpson (Hill et al., 2003)などのα-多様性指標を用いて推定した。QIIMEソフトウェアで実行したUnifrac距離行列は,重み付けなしのUnifrac主座標分析(PCoA)と系統樹構築に使用した。
2.4 統計分析
データは平均値±標準偏差(SD)で表した。臨床的特徴を表す連続変数の統計的比較は、データが正規分布している場合はStudentのt検定を用いて行った。カテゴリー変数にはカイ二乗検定を用いた。細菌量の解析では、まずデータを正規化し、属の相対存在量の有意差については単変量分散分析またはクラスカル・ワリス検定を用いた。Studer群、Bricker群、CU群における代謝産物量の差はStudent t-testで解析した。ロジスティック回帰を用いて、臨床病理学的因子と尿微生物多様性との関連を解析した。P<0.05を統計学的に有意とみなし、P値はBenjamini-Hochberg FDRで補正した。
3 結果
3.1 被験者の特徴
本研究では、5名の健常ボランティアと、Studers 13名、Bricker 10名、CU 9名を含む、RCおよびUDを受けた32名の患者から採取した清浄な中流尿検体について、16S rRNA遺伝子の塩基配列決定を行った。4群の臨床的および人口統計学的特徴とUD症例の腫瘍学的特徴を表1に示す。これら4群間で年齢、性別、BMI、代謝性合併症に統計学的有意差はなかった。UD群に関しては、RC時の病理学的T期、再発の割合ともに有意差はなかった。RCから尿サンプル採取までの平均期間はStuder群で48ヵ月であり、他の2つのUD群(Bricker群:40ヵ月、CU群:40ヵ月、P = 0.052)より有意に長かった。
表1
www.frontiersin.org
表1 各群の臨床病理学的特徴。
3.2 健常対照者とUD患者の尿微生物多様性
全サンプルの16S rRNAアンプリコンのV3-V4超可変領域のイルミナシーケンスにより、78108の生リードと前処理後の81970のリードが得られた(図1A)。サンプルあたりのシーケンスカウントは24~481リードでした。合計で2543個のASVが検出され、尿サンプルの平均ASVはグループ間で異なり、Studer、Bricker、CU被験者、健常対照でそれぞれ104、88、88、246であった(図1B)。ASVのデータ量とカテゴリー情報は、グループ間で有意差があることを示した(表S1)。尿検体の微生物多様性を評価した結果、ACE、Chao1、Shannon、観察された種、Simpson indexには4群間で統計学的に有意な差は認められなかった。しかし、これらのα-多様性指標は、対照群で一致して顕著な高値が観察され、次いでスチューダー病患者が他のUD型患者よりも健康なボランティアに近い値であった(図2)。さらに、ShannonおよびChao1指標の多変量回帰分析において、Studer UD型がUD患者の尿中微生物多様性に有利な唯一の独立した臨床病理学的因子であることがわかった(表2、S2)。興味深いことに、尿微生物多様性とStuder ONB機能との関連も解析した。補足図S1に示すように、水腎症や残尿のないStuder被験者の尿サンプルは、健常対照者のサンプルに近い高いα多様性指数を示した。
図2
www.frontiersin.org
図2 Studer、Bricker、皮膚尿管吻合症サンプルおよび健常対照サンプルのα-およびβ-多様性指標。(A)存在量ベースのカバー率推定指数、(B)Chao1指数、(C)Shannon指数、(D)観察種指数、(E)Simpson指数、(F)Adonis検定に基づく主座標分析(点は各サンプルを表す;F = 2.53, P < 0.001)。* p <0.05、** p <0.01、*** p <0.001。
表2
www.frontiersin.org
表2 尿分画サンプルのα多様性(シャノン指数)に関するロジスティック回帰分析。
本研究では、PCoAを用いて尿検体の微生物群集組成の類似性も比較した。図2Fに示すように、Studer群と健常人またはBricker群を比較した場合、細菌の分布に明らかな差は認められなかったが、Bricker群と健常対照群では比較的顕著な差が認められた。CU被験者に関しては、彼らの尿中細菌分布は、対照群はおろか、Studer群およびBricker群のいずれとも有意に異なっていた。全体として、PERMANOV検定は、観察された差が統計的に有意であることを示した(Adonis検定、Binary-Jaccard、F=1.4795、P<0.001)。同様に、StuderコホートにおけるONB機能に基づくPCoAでも、水腎症や残尿のない人の尿サンプルの微生物群集組成が対照群とより類似しているというβ多様性の有意な結果が示された(補足図S1E、F)。
3.3 健常対照群とUD者の尿中微生物群集分布
UD後の微生物シグネチャーの変化を調べるため、異なるグループにおける分類群の相対的存在量を評価した。門レベルでは、プロテオバクテリア(Studer:35.9%、Bricker:50.9%、CU:67.9%、対照:15.5%)、ファーミキューテス(Studer:30.5%、Bricker:31.0%、CU:23.2%、対照:41.8%)、バクテロイデー タ(Studer:26.4%、Bricker:11.9%、CU:4.8%、対照:31.2%)が優勢であった。一般細菌レベルでは、Enterococcus属(Studer:13.1%、Bricker:14.4%、CU:24.0%、対照:3.7%)、Escherichia-Shigella属(Studer:18.4%、Bricker:12.7%、CU:14.4%、対照:0.1%)、Barnesiella属(Studer:14.4%、Bricker:5.3%、CU:1.3%、対照:10.2%)の3種が優勢であった。注目すべきは、Escherichia-Shigella属が3つのUD群で頻繁に検出されたが、対照群ではほとんど検出されなかったことである。対照的に、Barnesiella属は健常ボランティアとStuder被験者の尿サンプルで2番目に多く、BrickerとCU被験者のサンプルよりもはるかに多かった。クラス、目、科、種レベルでの異なるグループの尿微生物群集をそれぞれ図3C-Fに示す。全体として、主な尿微生物叢構造は異なるUDタイプ間で同等であったが、Studer群とCU群はそれぞれ健常対照群と最も類似しており、最も類似していなかった。
図3
www.frontiersin.org
図3 棒グラフで表した主要分類群の平均相対存在量。(A)門;(B)属;(C)綱;(D)目;(E)科;(F)種。各色枠は細菌分類群を表し、色枠の高さは尿サンプル内のその細菌の相対的存在量を表す。相対存在量が1%未満の細菌属、または分類されていない細菌属は「その他」としてグループ分けされている。
UDタイプに関連する特定の分類群を同定するために、線形判別分析の効果量(LEfSe)をさらに実施した。図4に示すように、放線菌科、ソロバクテリウム属、ステノトロフォモナス属、キサントモナデス属、フラボバクテリウム属は、ブリッカーグループで有意に濃縮された。アグレガチバクター属、プロテウス属、プロビデンシア属、うどんこ病菌はCU群で相対的に増加していた。健常対照群では、一般細菌レベルでStreptococcus属、Muribaculaceae属、Gardnerella属、Bacteroides属が豊富であった。Studer群では、バクテロイデス門のポルフィロモナド科に属するBarnesiella属のみが豊富であり、対照群でも最も豊富であった。
図4
www.frontiersin.org
図4 分尿患者および対照群の尿サンプルに関連する微生物分類群。(A)分尿患者と対照者の尿サンプルに関連する尿微生物分類群のクラドグラム表示。(B)線形判別分析の効果量による、特定の尿微生物群分類群と異なるグループとの関連。
3.4 UDタイプに関連する微生物機能変化
微生物群集プロファイルから機能的経路を推定するために、未観測状態の再構築による群集の系統的調査(PICRUSt)が使用され、Kyoto encyclopedia of genes and genomes(KEGG)解析を用いてUD患者と健常対照の微生物機能的差異が調査された。このようにして、図5Aに示すように、Studer群、Bricker群、CU群、対照群を明確に区別することができる。Studerグループで有意に濃縮されると予測された微生物遺伝子は、糖鎖分解、N-グリカン生合成、スフィンゴ脂質代謝、リソソーム、スフィンゴ脂質生合成、さらにネオマイシン、カナマイシン、ゲンタマイシンの生合成に関与していた(図5B)。重要なことは、KEGG解析のクラスター化ヒートマップに基づくと、スチューダー患者と健常ボランティアは、異なるレベルで同様の尿微生物遺伝子機能を共有していたことである(図5C、D)。(図5C、D)。例えば、Studer群と対照群では、発育に関連する微生物遺伝子が有意に濃縮されていたが、Bricker群とCU群ではダウンレギュレーションされていた。対照的に、感染症や薬剤耐性に関連する負の機能遺伝子は、Studer群と対照群では発現が低かったが、Bricker群とCU群ではともに濃縮されていた(図5D)。
図5
www.frontiersin.org
図5 グループ間で異なるKEGG機能。(A) KEGG機能の差の箱ひげ図: 1.その他の糖鎖分解、2.ネオマイシン、カナマイシン、ゲンタマイシンの生合成、3.スフィンゴ脂質代謝、4.リソソーム、5.スフィンゴ糖脂質の生合成-グロボシリーズとイソグロボシリーズ、6.様々なタイプのN-グリカン生合成、7. 糖スフィンゴ糖脂質生合成-ガングリオシリーズ、8. N-グリカン生合成、9. タンパク質消化・吸収、10. 減数分裂-酵母、(B) 上位差分KEGG機能の棒グラフ、(C, D) KEGG結果のレベル1および2クラスタリングヒートマップ。
さらに、Cluster of orthologous groups of proteins (COG)データベースを検索して、遺伝子の機能アノテーションを行った。最初の10個の差分COGが示され、各グループにおける最初の6個の差分COGの平均存在量も示された。COG差分結果のクラスターヒートマップに基づき、我々はまた、Studer患者と健常ボランティアが多くの類似した尿微生物遺伝子を共有しており、それらはBricker群とCU群で逆に発現していることを見出した(図6A-C)。
図6
www.frontiersin.org
図6 グループ間で異なるタンパク質のオーソロググループのクラスター。(A,B)タンパク質のオーソロググループの上位の差分クラスターの箱ひげ図と棒グラフ、(C)タンパク質のオーソロググループの差分クラスターのクラスタリングヒートマップ。
4 考察
微生物の多様性の低下は、潰瘍性大腸炎、クローン病、大腸がんなどの腸疾患の特徴として認識されている(Lepage et al.) しかし、このような一貫した微生物所見は泌尿器疾患では確認されなかった。切迫性尿失禁では微生物多様性の増加が観察され、間質性膀胱炎と過活動膀胱では減少したが、膀胱がんでは有意差は認められなかった(Zhang et al.) 現在までのところ、膀胱がんのUDを受けている患者の尿微生物群集は、膀胱がんの尿微生物叢シグネチャーと比較して十分に研究されていない。ここでは、16s rRNA解析とバイオインフォマティクス解析を行い、UD患者における尿中微生物ランドスケープと潜在的な機能的影響を包括的に特徴付けた。全体として、尿中微生物の多様性に関して、UD患者の3群間に有意差はなく、いずれも健常者よりも著しく少ないレベルを示した。しかし、Studer手術またはONB手術は、これらの患者において尿中微生物の多様性を促進する因子であることが判明し、対照群に最も近似した尿中微生物叢シグネチャーを示した。PCoA分析では、Studer群と健常者の尿中細菌分布が最も類似していたのに対し、CU群では全く異なる尿中微生物特性を示した。UDのタイプは、個々の尿微生物叢を決定する重要な因子であると推測される。腹部ストーマを有する尿失禁UDアプローチは、外来微生物の影響を受けやすく、これはCU患者の長期尿管ステント留置によって悪化した。ONB法は、閉鎖された生理的な配置を模倣するだけでなく、微生物環境を本来の泌尿器系に最も近づけるため、より良好な機能的転帰をもたらす。
プロテオバクテリアは、病原能力を持つ腸内共生細菌と考えられている(Puri, 2019)。腸内プロテオバクテリアの増加は、大腸炎に関連した大腸がんで報告されている(Quaglioら、2022年)。プロテオバクテリアはまた、膀胱がんの発症にも重要な役割を果たしている可能性がある(Liuら、2019年)。したがって、Proteobacteriaの上昇は好ましくない生態学的不協和と考えられる可能性があり、Studerアプローチよりも元のアライメントとの類似性が低いBrickerグループとCUグループにおいてより顕著であった。ファーミキューテス類とバクテロイデーテス類は、年齢、食事の質、環境要因によって変化する健康指標である。低い細菌叢比率は、肥満、炎症性腸疾患、心血管疾患、大腸がんと関連している可能性がある(Sun and Kato, 2016; Singh et al., 2017; Klement and Pazienza, 2019)。我々の分析によると、健常人の尿中細菌の73%をファーミキューテスとバクテロイデーテスが占め、Studer群では57%、Bricker群では43%、CU群では28%であった。これらの主要なプロバイオティクスの分布は、ONBが自然腔に最も近い手順として、微生物的に明らかに有利であることも示している。対照的に、Escherichia-Shigellaは腸内感染を引き起こす病原体の一つであり(Yacoubaら、2022)、尿中Escherichia-Shigellaに関しては、膀胱がん患者において相反する結果が報告されている(Liuら、2019;Husseinら、2021)。Escherichia-Shigellaの存在量はStuder群で他の群より高かった。マクロファージと上皮細胞へのEscherichia-Shigella感染は、強い炎症反応とマクロファージ死を誘導する(Kotloff, 2022)。UD患者におけるEscherichia Shigellaの明確な役割は、さらに評価されるべきである。
この研究は、尿生態学的障害を特徴づけるための属の変化に基づいており、UDコホートと健常対照は完全に分離することができた。今回のサンプル数では、性別、年齢、BMI、初期の腫瘍ステージ、現在のクレアチニン値、UD後の期間によってグループ化されたサブ集団間で、αまたはβ多様性の統計学的有意差は観察されなかった。興味深いことに、尿機能に基づいてStuder対象者を二分した結果、水腎症や残尿のない対象者は、これらの微生物指標において健常者に近かったことから、尿微生物叢がUD機能と関連する可能性が示唆された。我々の予備的知見を検証し、関連する微生物メカニズムを明らかにするために、さらなる研究を行う必要がある。
われわれの研究では、LEfSe分析により、Studer患者ではBarnesiellaceaeからBarnesiellaの系統に沿った細菌群が濃縮されていることが示された。このような細菌叢の特異的な機能については、まだ解明されていない。Bricke群とCU群では、病原性細菌群の明らかな増加がみられ、その結果、術後尿路感染症の可能性が高くなり、機能的転帰が最適でなくなった。ソロバクテリウムは日和見病原体であり、主に口腔疾患を引き起こす口腔微生物の重要な一員であると考えられている(Barrakら、2020)。Staphylococcus moskiiは、血液感染や手術創感染など、さまざまな感染症を引き起こすことが報告されている(Zhengら、2010;Vancauwenbergheら、2013)。ブリッカー群では、このような細菌叢のレベルが高いことから、術後感染のリスクが高いことが示唆される。腸内細菌科の一員であるプロテウスは、一般に腸内の低存在共生細菌と考えられており、臨床的には尿路感染症の原因として最もよく挙げられている(Hamilton et al.) CU群ではプロテウスが有意に増加しており、必然的に感染症のリスクが高いことが示唆された。全体として、尿中のこれらの微生物叢は、UD管理を最適化するためのバイオマーカーまたはツールとなる可能性がある。
われわれの研究にはいくつかの限界がある。まず、サンプル数が比較的少なかったことである。Studer手術は男性に多く行われているため、本研究では男性のONB患者のみを対象とした。また、本研究はレトロスペクティブなデザインに限られており、マイクロバイオームとUD後の回復との因果関係を明らかにすることはできなかった。したがって、より大規模なコホートでの前向き研究が必要である。さらに、微生物叢のシグネチャーを特徴付け、交絡微生物による汚染を除外するには、ONBまたはIC粘膜を用いるのがよいだろう。基礎研究は、UD後のさまざまな段階におけるマイクロバイオームの役割の解明に役立つかもしれない。
5 結論
今回初めて、UD患者の包括的な尿微生物ランドスケープを提示し、尿微生物の特徴と機能転帰との関連を予備的に明らかにした。UD症例の中で、Studer型は尿中微生物の多様性に有利な唯一の独立した臨床病理学的因子であり、Studer型患者、特にONB機能が完全な患者は、健常人に最も近似した尿中微生物叢の特徴を示した。UD機能の調節に関連する微生物メカニズムを明らかにするために、さらなる研究を実施すべきである。
データの利用可能性に関する声明
本研究で発表されたデータは、NCBI-Sequence Read Archive(SRA)(アクセッション番号PRJNA1048651)に寄託されている。
倫理声明
ヒトを対象とした研究は、上海第十人民病院の倫理委員会により審査され、承認された。患者/参加者は、本研究への参加について書面によるインフォームド・コンセントを提供した。
著者貢献
YL:原稿執筆。JZ:データ管理、執筆-校閲・編集。HC:執筆-校閲・編集。WZ:執筆-校閲・編集。AA: 執筆-校閲・編集。SM: 執筆-校閲・編集。XY: 執筆-校閲・編集。TX: 執筆-校閲・編集。YY:構想、調査、ソフトウェア、執筆-校閲・編集。
資金提供
著者は、本論文の研究、執筆、および/または発表のために金銭的支援を受けたことを表明する。本研究は、上海市科学技術委員会実験動物基金(第201409004000号)、中国国家自然科学基金(第81702507号)、上海市第十人民病院登山人材プロジェクト(2018SYPDRC046号)の支援を受けた。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本論文で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
補足資料
本論文の補足資料は、https://www.frontiersin.org/articles/10.3389/fcimb.2023.1302870/full#supplementary-material。
補足図1|コントロールとStuderサンプルのα-およびβ-ダイバーシティ指数。(A-C)対照サンプル、水腎症の有無にかかわらずStuderサンプルのα-およびβ-多様性指数;(D-F)対照サンプル、残尿の有無にかかわらずStuderサンプルのα-およびβ-多様性指数。
略号
ACE、abundance-based coverage estimator;ASV、amplicon sequence variant;COG、cluster of orthologous groups of proteins;CU、cutaneous ureterostomy;IC、ileal conduit;KEGG、Kyoto gene and genome encyclopedia;LEfSe、linear discriminant analysis effect size;MIBC、muscle invasive bladder cancer;NMIBC、non-muscle invasive bladder cancer; ONB、同所性新膀胱、PCoA、主座標分析、PERMANOV、並べ替え多変量分散分析、PICRUSt、未観測状態の再構築によるコミュニティの系統的調査、QIIME、微生物生態学の定量的洞察、RC、根治的膀胱切除術、rRNA、リボソームRNA、UD、尿路分岐。
参考文献
Ahn, J., Sinha, R., Pei, Z., Dominianni, C., Wu, J., Shi, J., et al. ヒト腸内細菌叢と大腸がんリスク。J.Natl.がん研究所105, 1907-1911.doi:10.1093/jnci/djt300。
PubMedアブストラクト|全文|Google Scholar
Barrak, I., Stájer, A., Gajdács, M., Urbán, E. (2020). 口臭やその他のヒト感染症におけるSolobacterium mooreiの重要性。口臭におけるSolobacterium mooreiの重要性。
パブコメ抄録|全文|Google Scholar
Bhide, A., Tailor, V., Khullar, V. (2020). 間質性膀胱炎/膀胱痛症候群と再発性尿路感染症および尿中マイクロバイオームの潜在的役割。Post. Reprod. doi: 10.1177/2053369120936426
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bolyen, E., Rideout, J. R., Dillon, M. R., Bokulich, N. A., Abnet, C. C., Al-Ghalith, G. A., et al. QIIME 2を用いた再現可能、インタラクティブ、スケーラブル、拡張可能なマイクロバイオームデータサイエンス Nat. Biotechnol. 37, 852-857. doi: 10.1038/s41587-019-0209-9
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Callahan, B. J., McMurdie, P. J., Rosen, M. J., Han, A. W., Johnson, A. J., Holmes, S. P. (2016). DADA2:イルミナアンプリコンデータからの高分解能サンプル推定。Nat. Doi: 10.1038/nmeth.3869.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chao, A., Bunge, J. (2002). 確率的豊度モデルにおける種数の推定。バイオメトリクス 58, 531-539.
パブコメ抄録|クロスリファレンス全文|Google Scholar
ギャレット, W. S. (2015). がんと微生物叢。科学 348, 80-86.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gevers, D., Kugathasan, S., Denson, L. A., Vázquez-Baeza, Y., Van Treuren, W., Ren, B., et al. 新規発症クローン病における治療歴のないマイクロバイオーム。細胞宿主微生物15, 382-392.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Hamilton, A. L., Kamm, M. A., Ng, S. C., Morrison, M. (2018). 推定消化管病原体としてのプロテウス属菌。Clin. Microbiol. 31, e00085-17. doi: 10.1128/CMR.00085-17.
パブコメ要旨|全文|Google Scholar
Hill, T. C., Walsh, K. A., Harris, J. A., Moffett, B. F. (2003). 細菌群集を用いた生態学的多様性測定の使用。FEMS Microbiol. Ecol. 43, 1-11. doi: 10.1111/j.1574-6941.2003.tb01040.x.
パブコメ抄録|全文|Google Scholar
Hou, K., Wu, Z. X., Chen, X. Y., Wang, J. Q., Zhang, D., Xiao, C., et al. 健康と疾患における微生物叢。Signal Transduct Target Ther. 7, 135. doi: 10.1038/s41392-022-00974-4
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hussein, A. A., Elsayed, A. S., Durrani, M., Jing, Z., Iqbal, U., Gomez, E. C., et al. 尿中マイクロバイオームと膀胱がんとの関連を調べる: 探索的研究。Urol. Oncol. 39, 370.e9-370.e19. doi: 10.1016/j.urolonc.2020.12.011.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Janssen, G. W. B., Ramkumar, R. R., Lee, B. H., van der Heijden, A. G. (2021). 膀胱癌に対する根治的膀胱摘出術後の同所性導尿:過去10年間の教訓。Curr. Opin. Urol. 31, 580-585. doi: 10.1097/MOU.000000000909
パブコメ抄録|全文|Google Scholar
Klement, R. J., Pazienza, V. (2019). 異なるタイプの食事が腸内細菌叢プロファイルとがん予防・治療に及ぼす影響。Medicina (Kaunas) 55, 84. doi: 10.3390/medicina55040084
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Knippel, R. J., Drewes, J. L., Sears, C. L. (2021). がんマイクロバイオーム:最近のハイライトと知識のギャップ。Cancer Discovery 11, 2378-2395.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Korkes, F., Fernandes, E., Gushiken, F. A., Glina, F. P. A., Baccaglini, W., Timóteo, F., et al. 膀胱癌に対する根治的膀胱摘出術後のブリッカー回腸導管対皮膚尿管吻合術:系統的レビュー。Int. Braz. J. Urol. 48, 18-30. doi: 10.1590/s1677-5538.ibju.2020.0892
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
コトロフ、K. L. (2022). 細菌性下痢症。Curr. Opin. 小児科 34, 147-155.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lane,G.、Gracely,A.、Bassis,C.、Greiman,S. E.、Romo,P. B.、Clemens,J. Q.、他(2022年)。神経因性下部尿路機能障害患者における尿細菌マイクロバイオームの鑑別的特徴。J. Urol. doi: 10.1097/JU.000000002274.
パブコメ抄録|全文|Google Scholar
Lenis, A. T., Lec, P. M., Chamie, K., Mshs, M. D. (2020). 膀胱がん: 総説。Jama 324, 1980-1991. doi: 10.1001/jama.2020.17598.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lepage, P., Häsler, R., Spehlmann, M. E., Rehman, A., Zvirbliene, A., Begun, A., et al. 潰瘍性大腸炎患者の微生物叢と粘膜との相互作用の喪失を示す双生児研究。消化器内科 141, 227-236.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Liu, F., Liu, A., Lu, X., Zhang, Z., Xue, Y., Xu, J., et al. 膀胱がん組織における微生物プロファイルのディスバイオーシス・シグネチャー。Cancer Med. 8, 6904-6914. doi: 10.1002/cam4.2419.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Puri, A. W. (2019). メチル栄養プロテオバクテリアからの特殊な代謝産物。Curr. Issues Mol. 生物 33, 211-224.
抄録|全文|Google Scholar
Quaglio, A. E. V., Grillo, T. G., De Oliveira, E. C. S., Di Stasi, L. C., Sassaki, L. Y. (2022). 腸内細菌叢、炎症性腸疾患および大腸がん。World J. Gastroenterol. 28, 4053-4060. doi: 10.3748/wjg.v28.i30.4053
パブコメ要旨|全文|Google Scholar
Roy, S., Trinchieri, G. (2017). Microbiota: a key orchestrator of cancer therapy. Nat. がん研究 17, 271-285.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Sheybaee Moghaddam, F., Ghoreifi, A., Djaladat, H. (2022). 異なる同所性導尿の比較成績。Curr. Opin. Urol. 32, 554-560.
パブコメ要旨|全文|Google Scholar
Siegel, R. L., Miller, K. D., Fuchs, H. E., Jemal, A. (2022). がん統計、2022年。CA Cancer J. Clin. 72, 7-33. doi: 10.3322/caac.21708.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Singh, R. K., Chang, H. W., Yan, D., Lee, K. M., Ucmak, D., Wong, K., et al. 食事が腸内細菌叢に及ぼす影響とヒトの健康への影響。J. Transl. Med. 15, 73. doi: 10.1186/s12967-017-1175-y
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sun, J., Kato, I. (2016). 腸内細菌叢、炎症および大腸がん。Genes Dis. 3, 130-143. doi: 10.1016/j.gendis.2016.03.004.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Vancauwenberghe, F., Dadamio, J., Laleman, I., Van Tornout, M., Teughels, W., Coucke, W., et al. 口腔内の悪臭におけるSolobacterium mooreiの役割。呼吸の研究 7, 046006.
パブコメ要旨|全文|Google Scholar
van Elsland, D., Neefjes, J. (2018). 細菌感染とがん。EMBO Rep. 19, e46632. doi: 10.15252/embr.201846632.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Yacouba, A., Tidjani Alou, M., Lagier, J. C., Dubourg, G., Raoult, D. (2022). 尿中微生物叢と膀胱がん: システマティックレビューと泌尿器病原体への注目。Semin. doi: 10.1016/j.semcancer.2021.12.010.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhang,W.、Yang,F.、Mao,S.、Wang,R.、Chen,H.、Ran,Y.、他(2023)。膀胱がん関連微生物叢: 最近の進歩と将来の展望。doi: 10.1016/j.heliyon.2023.e13012.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zheng, G., Summanen, P. H., Talan, D., Bennion, R., Rowlinson, M. C., Finegold, S. M. (2010). 創傷感染患者から分離されたSolobacterium mooreiの表現型および分子学的特徴。J. Clin. Microbiol. 48, 873-876. doi: 10.1128/JCM.01381-09.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Zitvogel, L., Daillère, R., Roberti, M. P., Routy, B., Kroemer, G. (2017). マイクロバイオームとその産物の抗がん作用。Nat. Rev. Microbiol. 15, 465-478. doi: 10.1038/nrmicro.2017.44
PubMed Abstract|クロスリファレンス全文|Google Scholar
キーワード:膀胱癌、尿路転換、微生物叢、新膀胱、Studer
引用 Liu Y, Zhang J, Chen H, Zhang W, Ainiwaer A, Mao S, Yao X, Xu T and Yan Y (2024) 異なるタイプの分尿に関連する尿中微生物叢シグネチャー:比較研究。Front. Cell. Infect. Microbiol. 13:1302870.
受理:2023年9月27日 27 September 2023; Accepted: 2023年11月17日;
発行:2024年01月03日
編集:Tao Lin, Baylor College:
タオ・リン(ベイラー医科大学、米国
査読者
Kai Marius Till Sauerwein, 免疫外来クリニック, オーストリア
矢島修吾、国立がん研究センター東病院、日本
Copyright © 2024 Liu, Zhang, Chen, Zhang, Ainiwaer, Mao, Yao, Xu and Yan. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文である。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Yang Yan, yanyang-tongji@outlook.com; Tianyuan Xu, xvtianyuan@126.com; Xudong Yao, yaoxudong1967@163.com.
これらの著者は本研究に等しく貢献している。
免責事項:本論文で表明されたすべての主張は、あくまでも著者らのものであり、必ずしもその関連組織、あるいは出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではありません。
こんな人たちも見ています
蚊媒介ウイルスの経気道感染:系統的レビュー
サンゲータ・ジャンジョター、ディヴィア・カタリア、マヒマ・ヤダヴ、ニシャ・ダヒヤ、ニーラム・セーラワット
次世代シーケンサーを用いたインフルエンザA(H1N1)pdm09ウイルスパンデミック時の下気道感染症の疫学調査
李暁丹、劉楊、李敏哲、卞静、宋徳明、劉朝英
豊胸術における自家脂肪移植後のコリネバクテリウム・ボビス感染:症例報告
シン・ユー、ヤオ・ヤオ、ガオ・ジアンホア、リャオ・ユンジュン
肝細胞癌の予後と化学療法に対する反応における上皮細胞の単一細胞レベルでの洞察
斉文謙、張倩
チリ中央部(南緯29°)の半乾燥アンデスにおける完新世後期の環境動態を復元するためのマルチプロキシーのアプローチ
アレハンドラ・マルテル・シーア,アントニオ・マルドナード,マリア・エウジェニア・デ・ポラス,プラクセデス・ムニョス,ノラ・マイダナ,ジュリエタ・マッサフェロ,カルステン・シテック
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2024 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
ご利用条件
この記事が気に入ったらサポートをしてみませんか?
