微生物に基づく治療法の免疫学的影響
53
総閲覧数
記事の altmetric スコアは 2 です。
レビュー記事
Front. Immunol.、2023年1月12日
Sec. 粘膜免疫
https://doi.org/10.3389/fimmu.2022.1046472
この記事は、Research Topicの一部です。
腸管界面における免疫判断チェックポイント
すべての記事を見る
微生物に基づく治療法の免疫学的影響
Md Zahidul Alam, Jeffrey R. Maslanka, Michael C. Abt*
米国ペンシルベニア大学ペレルマン医学部微生物学科
ヒトの体内および体外に生息する微小生物の複雑なネットワークは、マイクロバイオームと総称され、私たちの健康を形成するさまざまな生理活性分子を産生する。マイクロバイオームの破壊は、がん、糖尿病、アレルギー、肥満、感染症など、さまざまな疾患の発症につながる。これらの疾患に対して、細菌または細菌由来の副産物を疾患者に移植し、レシピエントのマイクロバイオームをリセットして健康を回復させる、次世代のマイクロバイオームによる一連の治療法が開発されています。マイクロバイオーム移植療法は、日常的な治療の選択肢となるにはまだ初期段階にあり、いくつかの注目すべき例外を除いて、臨床試験での成功は限られている。このレビューでは、免疫系とマイクロバイオームによる治療薬の相互作用に焦点を当て、これらの治療法を導入して病気を治療することの成功例と課題を紹介します。マイクロバイオーム移植を受ける患者の移植前の免疫活性化状態は、細菌の生着支援に重要な役割を担っている。生着後、マイクロバイオーム移植由来のシグナルが免疫機能を調節し、疾患を改善する可能性があります。新規のマイクロバイオーム治療薬が開発されるにつれ、移植物が免疫系とどのように相互作用するかを考慮することが、マイクロバイオーム移植が意図した治療効果を引き出せるかどうかを判断する重要な要素となるでしょう。
第1節:はじめに 微生物を利用した治療と免疫の健康
数百万年にわたるマイクロバイオームと哺乳類宿主との共進化は、相互作用とホメオスタシスをもたらしてきた(1)。何兆もの微生物が協調して宿主の健康を支えるため、微生物の多様性は健康なマイクロバイオームの特徴である(2, 3)。しかし、この相互依存関係は、抗生物質の使用や食生活の変化などの環境要因によって破られ、細菌の多様性が低下したり、細菌種の相対的な存在量が偏ったりすることがあります(4-6)。このようなマイクロバイオーム組成の変化を総称して、微生物学的ディスバイオーシスと呼びます(7)。一貫して、腸内細菌群集の変化または「ディスバイオシス」は、がん、糖尿病、アレルギー、肥満、神経疾患、感染症などの疾患状態と関連しています(8-15)。これらの関連は動物実験でも再現されており、微生物による腸内環境の悪化がどのように病気の進行を促すのか、そのメカニズムが理解されつつある。バイオメディカルコミュニティは、微生物異常と疾病を結びつける数多くの観察結果から、健康な個体から採取した細菌組成でマイクロバイオームをリセットすれば健康を取り戻せるという仮説を立てました(16-18)。この仮説を裏付けるように、多くの動物実験では、宿主の腸に直接マイクロバイオームを移植すると病気が治ることが実証されています(19-24)。しかし、ヒトにおいては、疾患を治療するためのマイクロバイオーム療法の有効性は一貫していない(25)。マイクロバイオーム療法を成功に導くための複雑な課題は、常在菌と宿主免疫系の多面的かつ双方向の相互作用によって例証されている(7)。
定常状態では、腸内細菌は宿主免疫系の重要な制御因子であり、免疫教育、免疫寛容、病原体に対する抵抗力を促進する(15)。例えば、内在性マイクロバイオームの異なる種は、腸内のCD4+ Tヘルパー(TH)細胞の分化および機能に直接影響を与える。常在する分節化糸状菌(SFB)は小腸上皮に付着し、腸管バリアの完全性を維持するために不可欠なCD4+ TH17細胞の分化を促進する(26, 27)。SFBのコロニー形成は、IL-22、IL-23、および血清アミロイドAタンパク質(SAA)タンパク質を介して小腸の抗原特異的TH17細胞を誘導し、CD4+ T細胞依存性および独立した機構を介して腸内細菌病原体に対する宿主防御を促進する(26, 28, 29)。同様に、Bacteroides fragilisは、その莢膜多糖体A(PSA)によりTH1細胞の分化やリンパ系器官の形成に寄与している。B. fragilisから産生されたPSAを無菌マウスにコロニー形成すると、IL-12/STAT4特異的な方法で抗原提示を行い、脾臓のIFN-γ産生CD4+ T細胞を回復させる(30)。さらに、B. fragilisは、TH1/TH2バランスの維持に役立ち、PSAを介してCD4+制御性T細胞(Treg)の生成を誘導する(30、31)。また、ファーミキューテス属、特にクロストリジウム属に属する細菌は、短鎖脂肪酸(SCFA)と二次胆汁酸の産生を介して腸内のTreg細胞の分化を促進し、定常状態における免疫恒常性を促進する(32-39)。これらの研究や、定常状態における免疫とマイクロバイオームの相互作用を調べた他の多くの研究(40、41)から得られた知見は、マイクロバイオームを、免疫系を再調整し病気を治療するために個人に投与できる治療薬として利用するための基礎を築いたと言える。
マイクロバイオームの集団は、宿主の生理機能を形成するシグナル伝達分子を合成する能力を持つことから、腎臓や肝臓に匹敵する別個の器官系として言及されてきた(42)。マイクロバイオームが正しく機能しなくなることは、臓器系の障害と類似しています(43)。同様に、マイクロバイオームによる移植は、細菌による「臓器」移植と考えることができ、生物学的に「機能しない臓器」を健康な臓器に置き換えることを目的としています。腎臓移植と同様に、ドナーのマイクロバイオーム「臓器」と宿主との間には複雑な分子間相互作用があり、移植がうまくいくか拒絶されるかを決定する。マイクロバイオーム移植と宿主免疫系のクロストークは、移植の成否を決める重要な役割を担っており、この総説の焦点となっている。
セクション2:ディスバイオーシスと疾患
腸内細菌叢のディスバイオーシスが病態の原因なのか結果なのかを判断するのは、しばしば困難なことである。慢性的な腸内細菌の異常は、様々な慢性炎症性疾患の特徴である炎症性メディエーターの発現上昇と関連している(7, 41)。例えば、炎症性腸疾患(IBD)患者の腸内細菌叢は、ファーミキューテス菌が著しく減少し、バクテロイデット菌とプロテオバクテリアが増加していることが特徴的である(44)。腸のTreg細胞集団と免疫寛容を促進する多様なFirmicutesに富むマイクロバイオームではなく(34、35、45)、IBD患者のdysbiotic microbiomeは、腸の病原性CD4+17型Tヘルパー(TH17)細胞を支持しています。多様なマイクロバイオームの状況下でバリアー保全性を維持する常在菌によって誘導されるTH17細胞集団とは対照的に、ディスバイオティクス条件下で生じるTH17細胞は炎症性サイトカインを放出し、腸管障害を引き起こします(46-48)。炎症性TH17細胞は、回腸と結腸の両方でIBD患者の腸管病変に蓄積しています(49, 50)。いくつかの研究は、IBDにおける腸内細菌叢の異常が、大腸の免疫変化を開始させる原因物質であることを裏付けている。例えば、Brittonらは、IBD患者から得たマイクロバイオームを移植した無菌マウスは、健康なドナーから得たマイクロバイオームを移植した無菌マウスと比較して、大腸においてTH17およびTH2細胞の数が増加し、RORγt+ Treg細胞が減少することを示している(51)。大腸炎のT細胞移植モデルを用いて、このグループは、IBDマイクロバイオームが、健康なマイクロバイオームと比較して、より重度のCD4+T細胞媒介性大腸炎を引き起こすことを実証した(51)。抗生物質治療などの外部からの擾乱によるディスバイオーシスは、宿主の炎症性メディエーターの活性化にもつながり、それがマイクロバイオームへのフィードバックとなり、潜在的な病原性腸内細菌の拡大を促進することがある。Byndlossらは、抗生物質による酪酸産生菌の枯渇が、腸管上皮におけるペルオキシソーム増殖剤活性化受容体γ(PPAR-γ)の発現を低下させ、NOS2の誘導につながり、結腸内の硝酸レベルが増加することを見いだした(52)。宿主由来の硝酸塩は、腸内の結核菌Escherichia/Shigellaや侵入菌Samonellaによって呼吸性電子受容体として利用されることがあります(53, 54)。どちらの例でも、抗生物質によるマイクロバイオーム異常は、腸管免疫恒常性の破壊につながり、宿主は疾患促進菌のコロニー形成に対してより脆弱な状態に置かれることになる。
腸内細菌叢が免疫応答の異常を引き起こすのと逆に、宿主の炎症が腸内細菌叢の異常を引き起こすこともある。感染症やIBDによる過剰な腸の炎症が、腸管内腔の微生物集団を変化させることがいくつかの研究で示されている(55, 56)。腸粘膜炎症の結果として、活性酸素種や活性窒素種誘導体のような炎症副産物は、炎症に敏感な(例えば、ビフィズス菌)有益菌よりも炎症に耐性のある大腸菌(例えば、ガンマプロテオバクテリア)に増殖優位性を与えることによって腸内細菌叢を変えることができる(53, 57, 58)。例えば、Toxoplasma gondiiに感染すると、大腸でマクロファージ由来のNO副産物が増加し、大腸菌の嫌気性呼吸をサポートすることにより、免疫主導の顕著な腸内環境異常になる(59)。同様に、Clostridioides difficile感染症の再発患者では、腸管炎症の増加は、腸管内のEscherichia/Shigellaの豊富さと関連している(60, 61)。遺伝子組み換えマウスや免疫賦活剤を投与して免疫活性化を開始させたマウスを用いた研究は、免疫活性がディスバイオーシスを引き起こす可能性があることを示している。免疫活性化によって引き起こされた腸内細菌叢の異常は、宿主を重症大腸炎に罹患させやすくする(62-64)。これらの研究を総合すると、免疫系とディスバイオーシスの双方向の影響力が証明される。
ディスバイオーシス関連疾患では、変化したマイクロバイオームが病原性免疫反応を促進しているのか、逆に免疫の調節異常が微生物のディスバイオーシスを促進しているのかを判断することは困難である。現実には、マイクロバイオームの異常と免疫系の異常の両方がフィードフォワードして、マイクロバイオーム異常と免疫病理を強化するという相互関係が存在します。マイクロバイオームを用いた治療法は、マイクロバイオームを「健康」な状態にリセットすることで、このサイクルを断ち切ろうとするものである。このような治療法を成功させるためには、その免疫学的影響を考慮する必要がある。
セクション3:マイクロバイオーム関連療法の種類
マイクロバイオーム治療薬は、宿主上あるいは宿主内に存在する健全な微生物集団と、マイクロバイオームが指令する下流の代謝ネットワークを回復させようとするものである。大きく分けて、マイクロバイオーム療法は5つのアプローチに分類されます。それらは、プレバイオティクス、糞便微生物叢移植(FMT)、プロバイオティクス、ライブバイオセラピューティック、そしてポストバイオティクスである(表1)。
表1
www.frontiersin.org
表1 微生物による治療法のカテゴリー
3.1 プレバイオティクス
プレバイオティクスとは、宿主によって消化されないが、腸内微生物の一部の属の活性と増殖を選択的に刺激することによって宿主の健康に有益な影響を与える非生物的な食品成分である(65, 77)。現在のプレバイオティクスは主に炭水化物系であるが、多価不飽和脂肪酸やポリフェノールなど、他の物質もプレバイオティクス効果を発揮する(65)。理想的なプレバイオティクスは、腸内の酸、胆汁酸、その他の加水分解酵素の作用に耐え、上部消化管で非吸収性であり、有益な腸内細菌Fecal microbiota transplantation(FMT)により発酵させることができるものである (77). 多くのプレバイオティクスの中でも、イヌリンやその加水分解物であるオリゴフルクトース、(トランス)ガラクトオリゴ糖などの難消化性オリゴ糖は、これらの条件をすべて満たしている(65、66)。プレバイオティクスは、腸内有機酸を増加させることにより内腔のpHレベルを下げ、侵入してきた病原体と栄養を奪い合う常在菌の安定した個体群を確立することにより、病原体の増殖を防ぐ(78-80)。しかし、プレバイオティクス治療の有効性は、宿主内に既に存在する有益な微生物に依存しており、この条件は、ディスバイオーシスでは満たされていない可能性がある。したがって、より直接的な微生物に基づく治療法が必要である。
3.2 糞便微生物叢移植法(Fecal Microbiota Transplantation
FMTはバクテリオセラピーとも呼ばれ、健康な人から糞便を採取し、その糞便スラリーを患者の腸管に導入する方法である。FMTは、レシピエントの消化管内細菌の多様性とメタボロームと呼ばれる細菌由来の代謝産物を回復させることができる(81、82)。FMTは、移植用接種物がしばしば不定な微生物の混合物であるため、生きたマイクロバイオームベースの治療の最も粗い形態と考えられている。糞便の治療利用に関する最初の記述は、4世紀の中国で、下痢を含む人間の病気の治療のために葛洪が行ったものである(83)。しかし、糞便が特定の病気の治療に制御された形で使用されるようになったのは、20世紀半ばになってからのことである。1958年、Eisenmenたちは初めてFMTで偽膜性大腸炎を治療した(84)。最近では、C. difficile 感染症の再発を治療するための FMT が、この微生物ベースの治療法の最も広く使用されている応用例です。二重盲検比較試験において、FMTはC. difficile感染症の再発予防に89%以上の有効性があることが証明されています(85)。C. difficile 感染症では、患者の大腸で SCFAs と二次胆汁酸が減少します(60、86)。FMT後、患者の臨床的改善は、ドナー微生物の生着、SCFAsと二次胆汁酸の回復、結腸の炎症の解消と直接関連している(82, 87, 88)。細菌間の相互作用と常在菌のコロニー形成抵抗性の回復が、C. difficile感染症を解決するためのFMTの主要な作用機序であると考えられている。この有力な理論と一致して、SCFAおよび二次胆汁酸代謝産物は、C. difficileの増殖を直接阻害することができる(89、90)。しかし、以下のセクションで説明するように、FMTは宿主免疫系とのシグナル伝達を介して間接的に作用する可能性もある。
FMTは、IBDのような非感染性腸疾患(91)だけでなく、免疫チェックポイント阻害剤(ICI)がん免疫療法(92)、代謝障害、神経精神疾患(93)などの腸管外疾患の治療にも研究されています。これらの疾患の治療にFMTを使用した臨床試験は、再発性C. difficile感染症の治療にFMTを使用した場合と比較して、より多様な成功を収めています。潰瘍性大腸炎(UC)の治療に対する FMT の有効性を評価した系統的メタアナリシスで、Narula らは、FMT 後に活動性 UC の臨床的寛解に進んだ患者が 28% であることを明らかにしました。これは、プラセボ群における9%の寛解に比べ顕著な改善であったが、それでもFMTを受けた患者の大多数はFMTによる治療効果を経験していないことが示された(94)。FMTの動物実験とヒト実験の両方が、治療法として未定義の細菌コンソーシアムを使用することの実現可能性と潜在的な危険性を実証しています(95)。この懸念から、標準的な治療法としての粗製FMTの採用が遅れ、より洗練されたFMTの形態が模索されている。健康なドナーから採取した純粋に分離された腸内細菌をきれいに混合したものを「定義された腸内細菌生態系成分」と呼び、従来の抗生物質療法を数コース行っても病原体を除去できなかった2人の患者からC. difficileを効果的に除去した(96, 97)。この定義されたFMTのアプローチは、より安全で、より制御され、より受け入れられる方法である可能性がある。しかし、この定義されたFMTアプローチの有効性を判断するためには、今後、大規模なランダム化比較試験が必要である。以下に述べる次世代のマイクロバイオームベースの治療法は、FMTに特有のドナーのばらつきをさらに改善し、取り除くことを目的としている。
3.3 プロバイオティクス
プロバイオティクスは、主に乳酸菌、ビフィズス菌、サッカロミセスなどの生きた微生物で、哺乳類の宿主には本来存在しないが、投与されると健康に良い影響を与えるものである(98)。ヨーグルトや発酵乳などの発酵食品には、健康上の利点を持つ細菌の混合物が含まれていることが発見され、現代のプロバイオティクスの開発につながった。これらの細菌は単離され、培養され、投与量を制御して投与することができる。プロバイオティクスは、抗菌ペプチドの産生、粘液産生の増強、粘膜免疫機能の調節など、いくつかのメカニズムを通じて健康上の利点をもたらすことができる(65)。いくつかの研究では、マウスモデルにおいて、プロバイオティクスが大腸炎を緩和する抗炎症作用を持つことが示されている (69-71)。動物実験では有望視されているが、患者における炎症性疾患の治療におけるプロバイオティクスの効果は、十分に確立されていない。乳酸菌とビフィズス菌のプロバイオティクス治療は、IBD患者においてTNF-αの減少やIL-10の発現の増加をもたらすことができなかった(99)。しかし、いくつかの臨床研究は、プロバイオティクスの組み合わせがUC患者に何らかの利益をもたらすことを実証している(100)。IBD患者にプロバイオティクスを投与した22の無作為化対照試験を含むDerwaらによるメタ解析を伴う系統的レビューでは、プラセボ群と比較して、活動性UCの寛解を誘導するプロバイオティクスの治療効果は示されなかった(101)。同じメタアナリシスでは、プロバイオティクスの効果は、一般的に使用されている抗炎症薬である5-アミノサリチル酸(5-ASA)と同様であり、UCの再発を予防するものであった。また、活動性クローン病(CD)の寛解導入、静止性CDの再発予防には、プロバイオティクスの効果は認められなかった。C. difficile感染症では、プロバイオティクスであるSaccharomyces boulardiiの投与が再発防止に有望であることが示された。McFarlandら(102)は、標準的な抗生物質療法にS. boulardiiを4週間経口投与すると、C. difficile関連疾患の再発が、プラセボ群(64.7%)に比べて有意に減少することを見いだしました(34.6%)。別の研究(103)では、S. boulardiiは、高用量のバンコマイシン(2グラム/日)と共に投与した場合にのみ再発を減少させる効果があり(16.7%)、高用量バンコマイシン群(50%)のプラセボと比較しました。いずれの試験でも、S. boulardiiは抗生物質療法と同時に有効であった。プロバイオティクス治療の限界は、プロバイオティクス細菌がディスバイオティクス腸管にコロニー形成して定着し、マイクロバイオームの多様性を安定的に回復できないことに起因している可能性がある。
3.4 生きたバイオ治療薬
プロバイオティクスとは異なり、生きたバイオセラピューティックは、腸に定着することのできる単一の細菌種または選択された細菌の組み合わせであり、特定の疾患に対して臨床的利益をもたらすよう設計されています(104)。生きたバイオセラピューティックは、多くの場合、糞便中の細菌集団から同定・分離されます。それらは、C. difficileやIBDのような疾患を、異種糞便移植混合物よりも精緻に治療するための「次世代」マイクロバイオーム療法製品と考えられています。一連の心強い臨床試験により、このより洗練されたマイクロバイオーム療法アプローチの可能性が実証されています。Seres Therapeutics社が開発した精製Firmicutes芽胞のコンソーシアムは、第3相臨床試験において、標準的な抗生物質と比較してC. difficile再発のリスクを低減する効果がありました(105)。さらに、Vedanta Biosciences社が開発したVE303と名付けられた8つの細菌の集合体も、再発性C. difficile感染症の治療に対して第2相臨床試験で有望視されています(88)。同様に、Firmicutes芽胞の経口製剤であるSER-287は、軽度から中等度のUCの寛解を目的とした第1相臨床試験で有望な結果を示した(106)。微生物と宿主との相互作用は複雑であるため、FMTに匹敵する治療効果をもたらす単一または少数の細菌種の組み合わせを同定することは、困難である。しかし、上記の研究は、開発中の生きたバイオ治療薬が、ディスバイオシスに関連する幅広い疾患を治療する能力を持ち、FMTに代わるより安全な方法として使用できることを示している。
3.5 ポストバイオティクス
ポストバイオティクスとは、微生物細胞の可溶性成分やその代謝産物で、治療効果をもたらすことができるものである(107)。SCFAsと二次胆汁酸は、よく研究されている微生物由来の代謝物の2つの例であり、治療効果について活発に試験されています。SCFAは、大腸内の複雑な繊維を細菌が発酵させる際に生成される一群の分子から構成されている(108)。SCFAsの投与はマウスの大腸炎を軽減するが(45, 109)、ヒトのIBD試験においては一貫した結果が得られていない(110)。さらに、二次胆汁酸は免疫細胞に対して抗炎症作用を示し、大腸炎モデルマウスにおいて腸の炎症を緩和させる(111)。二次胆汁酸であるウルソデオキシコール酸のIBDにおける治療効果に関する臨床試験が進行中である(NCT03724175)。注目すべきは、生理的濃度の高い二次胆汁酸は、上皮における酸化ストレスとDNA損傷を通じて大腸腫瘍の発生を促進することである(112, 113)。ポストバイオティクス治療の目標は、マイクロバイオームの有益な細菌が産生する下流エフェクター代謝産物を同定・分離し、これらの分子を投与して有害な副作用なしに疾患を治療することである。ポストバイオティクス治療薬は、オフターゲットの相互作用を減らし、オンターゲットの治療効果を高めるための化学修飾の可能性を提供する。
セクション4:マイクロバイオーム治療の結果を形成する免疫系の役割
マイクロバイオーム移植前のレシピエントの免疫状態は、疾患治療のためのマイクロバイオーム療法の生着、機能、そして最終的には有効性を形成します(図1)。マイクロバイオーム移植を受ける患者の免疫状態は、感染症、遺伝、既存のディスバイオーシスによって影響を受け、その結果、宿主に定着しようとする微生物コンソーシアムにとって敵対的または受容的な腸内微小環境が形成される可能性があります。私たちの研究グループでは、マイクロバイオーム移植の成否を決定するマイクロバイオーム治療前の免疫成分の特定に着手しています。FMTによるC. difficile感染の解消のマウスモデルでは、B細胞とT細胞を欠くFMTレシピエントRag1-/-マウスは、免疫担当の同腹のコントロールマウスと比較して、移植した細菌を取り込めず、セカール二次胆汁酸レベルを回復せず、C. difficile感染を解消することができなかった(114)。CD4+T細胞、特にTreg細胞は、Treg細胞の枯渇によりC. difficile感染マウスがFMT療法に反応しなくなったことから、FMTの成功を支える重要な適応免疫細胞タイプであった。注目すべきは、非感染のRag1-/-マウスはFMT細菌コンソーシアムを容易に移植したことで、FMTの移植を阻害するためには、免疫不全と感染駆動性の炎症の両方が必要であることが示されたことである。腸のTreg細胞コンパートメントは、胸腺由来と末梢で誘導されたTreg細胞の異種サブセットで構成されている(115-118)。これらのTreg細胞サブセットは、IL-10およびTGF-βの分泌、IL-2の隔離、ならびに共抑制分子CTLA-4、ICOSおよびPD-1の発現などの抗炎症メカニズムの多様なレパートリーを通じて、組織のホメオスタシスを促進している。Treg細胞を介した制御がない場合、腸内環境は炎症環境へと移行し、炎症に耐性のある細菌種に増殖の利点を与える炎症メディエーターの発現が上昇し、ドナー由来の炎症に敏感な細菌よりもこれらの細菌種を好むように微生物の生着が偏る可能性がある(54、119、120)。炎症が一部の細菌を選択的に増殖させることが知られていますが(54)、マイクロバイオーム移植の細菌種を生着させるために、どの特定の分子経路を標的とすることができるかを特定するための研究がさらに必要とされています。

図1
www.frontiersin.org
図1 微生物-免疫細胞の相互作用が、マイクロバイオーム療法(MBT)の失敗と成功を左右する。 A)ディスバイオーシスに伴う炎症が、MBTの生着に不利な腸内環境を作っている(セクション4)。(B)MBTは、投与後の免疫制御により治療効果を促進することができる(セクション5)。MBTの移植が成功すると、マイクロバイオーム全体の多様性が増加する。SCFAsや2°胆汁酸を含むポストバイオティクスや流入する細菌が産生する代謝産物は、炎症を抑え、大腸の免疫恒常性を回復させるCD4+ Treg細胞を誘導することができる。
FMT前の宿主の炎症状態を評価する臨床研究は、移植生着における免疫状態の重要性、ひいてはこのような治療法の有効性をさらに浮き彫りにしている。例えば、便中カルプロテクチン値で測定されるように、FMT前に腸の炎症が強い再発C. difficile患者は、感染を解決するためにFMTを繰り返し投与する必要がある可能性が高いです(121)。さらに、IBDを基礎疾患とするC. difficile感染症の再発患者では、FMT治療後の有益な効果が減少しています(122)。両方の疾患が粘膜バリア破壊と粘膜免疫の調節障害を増幅する可能性があるため、IBDの基礎疾患を持つ患者における再発性C. difficile感染の微生物ベースの治療は、難しい臨床課題となっています。臨床メタデータと大腸内視鏡を用いて患者のIBD状態を診断した大規模なレトロスペクティブ研究において、IBDを併発した患者の74.4%がFMTの単回注入後2カ月でC. difficileを消失したのに対し、IBDを併発していない患者の92.1%は消失しませんでした(122)。既存の免疫主導の炎症がFMTの効果を損なうというさらなる証拠は、IBDのフレアをコントロールするために高用量の薬剤レジメンを使用している活動中のIBD患者、つまりこの患者サブセットではより攻撃的な炎症があることを示していますが、C. difficile感染の再発治療のためにFMTを投与すると、成功率が下がることを発見した研究によって得られました(123)。さらに、IBD患者は、FMT後に腸のフレアを経験する可能性が高いが、これらのフレアの促進要因は、基礎となるIBD状態の進行、C. difficileの再発またはFMT自体である可能性がある(124)。マイクロバイオーム移植を受けた患者の腸の炎症状態が活発なフレア期にあるのか、維持期にあるのかに関するデータは、マイクロバイオーム移植の失敗や成功を理解する上で極めて重要であると思われます。現在、試験結果を報告する際にこの要因を考慮した臨床研究は非常に限られています。活動性UC患者を対象とした小規模な研究では、免疫抑制剤を服用している人は、免疫抑制剤を服用していないUC患者(27人中4人)に比べて、FMT後の奏効率が高かった(11人中5人)(125人)。同じ試験で、FMTは慢性疾患の患者(18%)に比べ、最近UCと診断された患者(75%)でより有効であることが示され、持続的な慢性炎症がFMTに抵抗性の腸内微小環境を形成していることが示唆されました(125)。
第5節 免疫系に作用する微生物療法
マイクロバイオーム療法は、内在する微生物群集の構成を再構築し、健康を回復させることを目的としている。これらの療法がその有益な特性を引き出すメカニズムの一つは、免疫系の刺激によるものです。大まかに言えば、マイクロバイオーム移植は、免疫寛容機構を促進して炎症を抑制したり(図1)、免疫系を活性化してエフェクター活性を高めたり(図2)することができます。
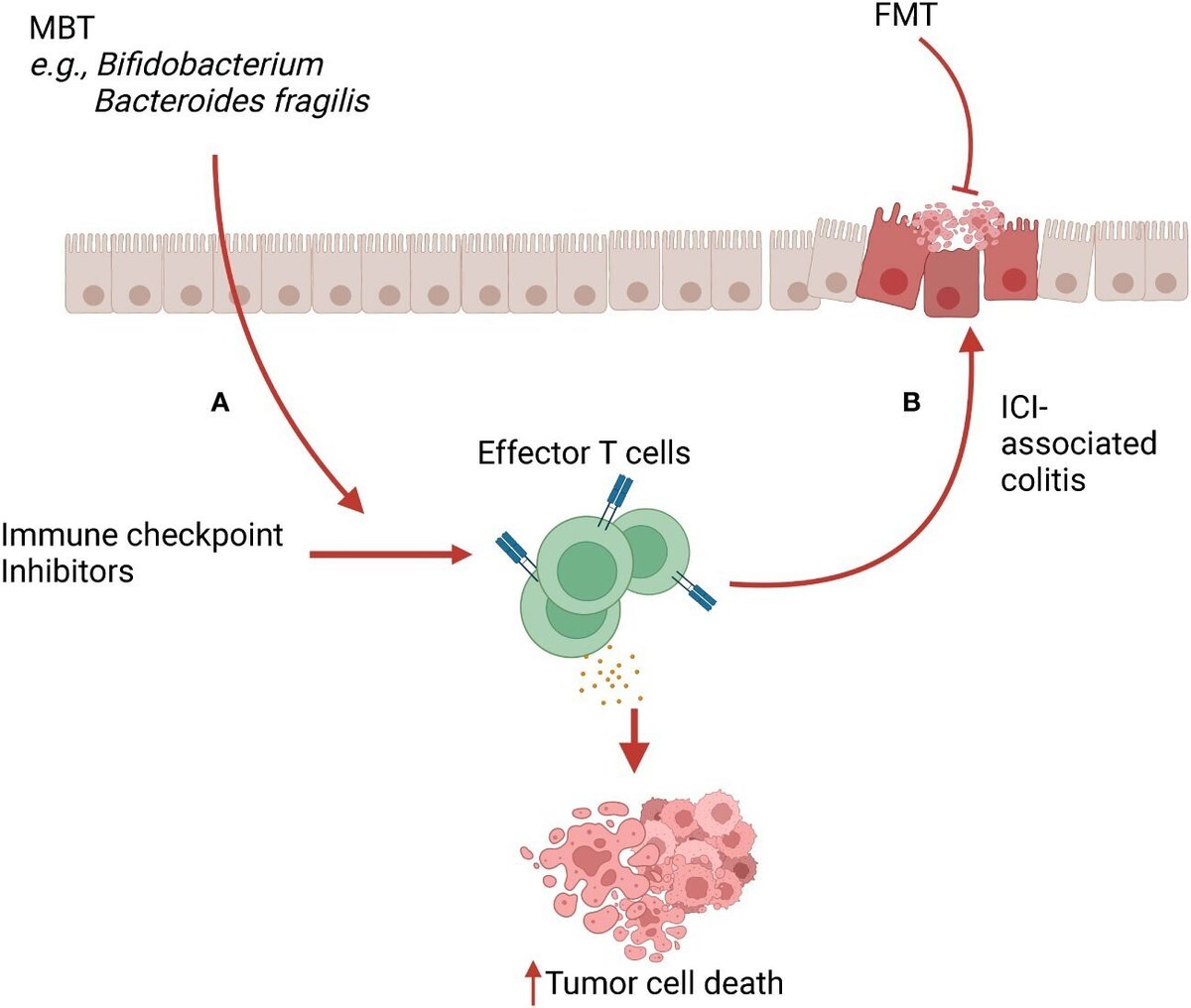
図2
www.frontiersin.org
図2 免疫チェックポイント阻害剤(ICI)療法およびICI関連大腸炎におけるマイクロバイオーム療法(MBT)。(A)ビフィズス菌やバクテロイデス・フラジリスなどのMBTはICIと協力し、腫瘍微小環境(TME)においてエフェクターT細胞の浸潤と活性化を増加させる。このメカニズムにより、ICI療法の抗腫瘍活性が増強される。(B)ICI療法により誘導された活性化T細胞とその放出サイトカインは、標的外炎症を引き起こし、ICI関連大腸炎を引き起こします。FMTは、免疫制御性を誘導することで、このICI関連大腸炎を緩和することができる。
5.1 腸管疾患における免疫制御を促進する微生物ベースの治療法
5.1.1 IBD
IBD に対するマイクロバイオーム治療の動物および臨床研究では、治療後に患者の腸内微生物群およびその由来代謝産物が回復するかどうかを評価することに焦点が当てられている。微生物を用いた治療が宿主の免疫反応に与える影響に焦点を当てた研究はあまり多くありません。デキストラン硫酸ナトリウム(DSS)誘発大腸炎マウスモデルにおいて、FMTはマウスの大腸でIL-10発現CD4+T細胞および不変性NK T細胞を誘導することにより、大腸炎症を抑え、粘膜免疫健康を向上させる(126)。さらに、FMTは、大腸のマクロファージと好中球の数を減らし、T細胞への抗原提示能力を弱めるが、これは、誇張された炎症を制御するのに重要である(126)。Weiらの研究では、DSS誘発大腸炎において、FMTがマウス大腸のアリール炭化水素受容体、IL-10、トランスフォーミング成長因子β(TGF-β)の発現を上昇させ、DSS誘発大腸炎の抑制に好ましい治療効果を与えることが明らかにされている(127)。興味深いことに、上記の研究とは逆に、マイクロバイオームによる大腸炎を自然に発症したIl10-/-マウスは、回腸切除とその後のFMT投与により、大腸の炎症性サイトカインの増加や大腸炎の増悪を示し(129)、FMTはIL-10の欠如で治療効果を失うことが示唆された。これらの研究は、マウスの大腸炎に対する FMT の治療効果に、IL-10 シグナルが重要な役割を果たすことを示唆している。FMT によって活性化される特定の免疫経路を特定することは、FMT の治療効果を決定する上で重要であろう。
FMTと同様に、生きたバイオ治療用細菌は、大腸の免疫応答を調節することにより、マウス大腸炎モデルにおいて保護作用を示す。例えば、Roundらは、著名な常在菌であるB. fragilisを無菌マウスにコロニー形成させると、Treg細胞の機能とTreg細胞集団からの抗炎症サイトカイン放出が誘導されることを示した(72)。B. fragilisのこの免疫調節効果は、PSAによって、CD4+ T細胞のIL-10を産生するFoxP3+ Treg細胞への分化を誘導するものであった。B. fragilis 由来の PSA をポストバイオティクス療法として単独で投与すると、免疫調節効果があり、TNBS 誘発大腸炎を予防・改善したマウスが得られた。17種類のClostridia常在菌の定義されたコンソーシアムの経口投与も、Tregを介した免疫調節効果によってマウスの大腸炎を緩和した(38)。メカニズム的には、これらの17種類のクロストリジア菌はSCFAを産生し、マウス大腸内のTGF-β濃度を上昇させ、ICOSを発現しIL-10を産生する大腸Treg細胞を増加させることにつながった。その後の研究でも、これら 17 種類のクロストリジア菌が SCFA を産生することが証明された (73)。Zhuらによって報告された別の定義された細菌のコンソーシアムもまた、IL-10に関連した有益な効果を見出した。このプロバイオティクスカクテルは、3つのビフィドバクテリウムと7つのラクトバチルスサブストレインの等しい混合物で、DSS誘発大腸炎の兆候と症状を著しく減少させ、血清中のIL-10の増加と炎症性サイトカインの減少に関連した(74)。大腸炎の改善はまた、上皮のタイトジャンクションタンパク質の発現の増加と関連しており、低下したバリア機能の回復を示唆するものであった。これらの観察から、マイクロバイオーム移植が炎症を抑制する治療効果を発揮するメカニズムとして、IL-10依存性の経路が重要であることが示唆された。
SCFAs などの共存菌由来の代謝産物も、マウス大腸炎モデルでの治療の可能性について研究されている。TNBS誘発大腸炎モデルにおいて、Chenらは、飲料水を通して酪酸を投与すると、大腸の炎症反応を抑制し、腸管バリアの完全性を改善することにより、マウスを重症大腸炎から保護することを発見した(130)。GPR109a欠損マウスでは、酪酸による保護作用が完全に失われたことから、酪酸のこの保護作用はGPR109a受容体を介したものであることがわかった。他のいくつかの動物実験でも、Treg細胞を増加させ、結腸の炎症性サイトカインを減少させることにより、実験的大腸炎に対してSCFAが保護的な役割を果たすことが示されている(131, 132)。同様に、二次胆汁酸は、免疫細胞に対する抗炎症作用を示し、大腸炎モデルマウスにおいて腸の炎症を緩和する(111)。3-oxoLCAおよびisoalloLCAなどの二次胆汁酸誘導体は、Treg細胞の分化を促進し、TH17細胞を抑制することができる(36、37、39)。
数多くの臨床マイクロバイオーム移植研究が、IBDにおける移植後の移植片の免疫パラメータの変化を報告しています。Vaughnらによる活動性CDに関するパイロット研究では、単回の大腸FMT注入により、12週目に大腸のTreg細胞が増加した。しかし、Treg細胞集団は、FMTを受けた患者のうち、FMTに反応した患者と反応しなかった患者の両方で増加した(67)。20人の活動性UC患者を対象とした別の前向き非盲検試験では、大腸内視鏡送達FMTの単回投与後4週間で大腸のTreg細胞とTH1細胞が減少し、TH2細胞とTH17細胞には差がなかった(68)。VSL#3と名付けられた乳酸菌強化プロバイオティクスを投与された患者は、プラセボ群と比較して、活動性UCに対して治療効果を示した。VSL#3は、大腸の樹状細胞(DC)に対して免疫調節効果を示した。具体的には、患者から採取した直腸生検の免疫プロファイリングにより、大腸DCからのIL-12の減少とIL-10の産生が増加することが示されました。プロバイオティクスは、DC集団を調節し、結腸の炎症反応を低下させ、UC患者の臨床的改善に寄与することができる(133)。5-ASA治療と同時にラクトバチルス・カゼイを経口投与すると、5-ASA治療単独と比較して、UC患者の臨床転帰を有意に改善した(134)。この臨床的な改善は、結腸の免疫的な変化と関連していた。大腸のS状結腸の生検では、L. caseiプロバイオティクスの恩恵を受けた患者の結腸では、IL-1βとTLR-4の発現が減少し、IL-10のレベルが上昇していた。SCFAはまた、患者のIBDを治療するためのポストバイオティクス療法として試験されています。Luhrsらは、酪酸塩で治療したUC患者は、非酪酸塩治療群と比較して、有意な臨床的改善を示したと報告している(135)。組織学的には、酪酸投与群では粘膜炎症が少なく、大腸固有層の好中球やリンパ球の浸潤が減少し、マクロファージにおけるNF-κBシグナルの活性化が減少していた。他の臨床研究でも、好中球の浸潤を減少させ(75)、大腸の粘膜炎症を抑制することで、UC患者におけるSCFAの免疫介在性の有益な効果が実証されている(76)。
5.1.2 ICI-大腸炎
免疫チェックポイント阻害剤(ICI)は、免疫系の内在性断端を除去することにより、T細胞のエフェクター機能を高める働きをします(136)。ICI使用による重大な副作用として、過剰に活性化した免疫反応による大腸炎があり、これはIBDに類似しており、生命を脅かす可能性があります。最近の研究では、ICI関連大腸炎の発症は腸内細菌叢の異常と相関しており、細菌群を回復させることで動物および患者におけるICI関連大腸炎を緩和できることが示唆されている(137)(図2)。
マウス研究では、抗CTLA-4治療とDSS投与を組み合わせて、重症のICI関連大腸炎をモデル化した。ビフィズス菌の経口投与は、抗CTLA-4免疫療法の抗腫瘍活性に明らかな影響を与えることなく、Treg細胞依存的にマウスを大腸炎から救助した(138)。その後の研究において、このグループは、ビフィドバクテリウムがミトコンドリア体力と腸内Treg細胞のIL-10活性を高め、ICI誘発大腸炎を制限することを見出した(139)。同様に、ラクトバチルス・ロイテリ投与は、飲料水にDSSを投与し、抗CTLA-4および抗PD-1免疫療法を行ったマウスにおいて、ICI関連大腸炎の進行を抑制する(140)。L. reuteriの大腸炎予防効果は、L. reuteriを投与していないマウスと比較して、腸組織における白血球の浸潤が減少し、血清中のTNF-α、IFN-γ、IL-6などの炎症性サイトカインレベルが減少することと関連していた。さらに、ICI関連大腸炎に対して治療効果を示す特定の細菌由来代謝物を同定した。微生物由来のトリプトファン代謝物であるインドール-3-カルボキシアルデヒド(3-IAld)を経口投与したマウスは、3-IAldを投与していないマウスと比較して、疾患の重症度、体重減少、大腸損傷が減少した(141)。この3-IAldの保護効果はAhRシグナルを介し、IL-22サイトカイン産生に依存し、大腸でのReg3γの発現を誘導することでマウスを保護した。
ヒトでは、ステロイド治療に難渋したICI関連大腸炎患者2名の症例報告で、FMTが大腸炎を見事に治療したことが判明した(142)。一人の患者では、臨床的な改善は、大腸CD8+T細胞の大幅な減少とそれに伴うTreg細胞の増加と関連していた。2番目の患者では、FMT後にすべてのT細胞サブタイプの減少が見られた。しかし、CD4+ T細胞集団はCD8+ T細胞に比べ比較的変化がなく、これは大腸粘膜におけるTreg細胞の残存と関連していた。別の最近の事例(143)では、口蓋悪性黒色腫に罹患した患者が、抗PD-1治療の3回目の投与後、重度のICI関連大腸炎を発症した。副腎皮質ステロイドによる治療がうまくいかなかった後、FMTが実施され、大腸炎の症状をうまく解決することができました。この患者の臨床結果は、糞便カルプロテクチンの低下と、うっ血して炎症を起こしていた大腸粘膜が正常レベルに近い状態に回復したことと関連していた(143)。これらの症例報告で報告された粘膜免疫の変化は、FMTが腸管免疫細胞集団を再構築し、ICI関連大腸炎に対する治療効果をもたらすシグナルであることを示唆している。しかし、ICI治療中にFMTが介在する免疫制御が、チェックポイント阻害療法の抗腫瘍活性を打ち消し、がんの進行を変化させるかどうかは不明である。例えば、Treg細胞はエフェクターT細胞の機能を抑制することにより、腫瘍の増殖に寄与している(144)。また、腫瘍微小環境におけるTreg細胞の増加は、様々な癌において予後不良と正の相関がある(145、146)。上記(142)のように、結腸におけるTreg細胞レベルの増加は、FMTを介したICI関連結腸炎の改善メカニズムの1つである可能性がある。したがって、今後の研究では、FMTによるTreg細胞がICIのがん進行抑制能に有害な影響を及ぼすかどうかを明らかにすることが重要であろう。ICI関連大腸炎を制限するためのマイクロバイオーム療法の有効性を調査する研究は、さまざまな種類のがんを持つ少数の患者を対象としている。大規模な無作為化試験が必要である。現在、泌尿器系がん患者におけるICI関連下痢または大腸炎を治療するためのFMTの使用に関する臨床試験が進行中である(NCT04038619)。
5.2 免疫活性化を促進する微生物療法
動物実験や臨床試験のデータからも、マイクロバイオームがICIの抗腫瘍反応を増強することが示されています(図2)。マウスでは、抗CTLA-4抗体投与により、特定病原体不使用(SPF)マウスではメラノーマや大腸がんの進行が抑制されるが、無菌マウスでは抑制されない。さらに、広域抗生物質で処理したSPFマウスでは、抗CTLA-4効果が損なわれたことから、細菌の活性な役割が支持された(24)。さらなる動物実験により、ICIの抗腫瘍効果を高める上で、マイクロバイオーム移植が治療的な役割を果たすことが実証された。Routyらは、ICIに反応したがん患者からFMTを受けた無菌マウスまたは抗生物質処理マウスは、ICI非反応者からFMTを受けたマウスと比較して、抗PD-1治療後の抗腫瘍活性が向上することを明らかにした(147)。この研究では、ICIの臨床的有用性とAkkermansia muciniphilaの相対的存在量との間の相関関係も示された。A. muciniphila の経口補給は、IL-12 依存的に CCR9+ CXCR3+ CD4+ T 細胞のマウス腫瘍への動員を増加させることによって、非応答性マウスにおける PD-1 ブロックの効力を回復させた。この研究は、がん治療中のICIの有効性を改善する上で、特定の生物治療用細菌種の明確な免疫介在性の役割を実証するものである。Tanoueらは、健康なヒトドナーから得た11の細菌株のコンソーシアムが、腫瘍微小環境におけるIFN-γ+ CD8+T細胞の浸潤を増加させることにより、マウスにおける腺癌およびメラノーマの成長を抑制する抗PD-1免疫療法の効果を高めることができることを示した(148)。興味深いことに、これらの11菌株は、通常、腸内細菌叢に存在する量は少ないが、腸管での増殖が可能になれば、ICIを介したがん治療に強い可能性を持つことになると考えられる。Sivanらによる別の研究では、ビフィズス菌を経口投与することで、抗PD-L1治療によるメラノーマ増殖抑制能が向上することが示された(23)。この効果は、腫瘍の微小環境へのCD8+ T細胞の浸潤を促進する抗原提示細胞の活性化によって媒介されるものであった。同様に、別のマウス研究では、B. fragilisは、マウスの腫瘍に対する抗CTLA-4効果を高めることが示された(24)。無菌マウスや抗生物質処理マウスにおける抗CTLA-4反応は、B. fragilisの経口投与、B. fragilisポリサッカライドによる免疫、あるいは記憶B. fragilis特異的TH1細胞の養子移入によって回復された。この免疫賦活効果は、腫瘍の進行を制御するIL-12依存性のTH1細胞応答によって媒介された。マウスの大腸癌とメラノーマに関する別の研究では、生きた乳酸菌ラムノサスの経口投与は、樹状細胞のIFN-β産生と腫瘍微小環境におけるCD8+T細胞の付随的な増加を誘発することによって、抗PD-1免疫療法の抗腫瘍活性を増強した(149)。これらの動物実験は、免疫チェックポイント阻害剤治療の抗腫瘍効果をサポートする微生物ベースの治療法が有望であることを示している。
抗がん作用を増強するために、マイクロバイオーム療法と免疫チェックポイント阻害剤を併用することは、臨床で活発に試験されており、いくつかの有望な結果が得られている。Baruchらは、ICI不応性メラノーマにおけるFMTの役割を検討した。この第I相臨床試験において、FMTは10人中3人の患者さんに、転移性メラノーマに対する抗PD-1療法の効果を向上させる効果を示しました。奏効例では、FMTによる治療は、IFN-γを介したシグナル伝達経路のアップレギュレーション、MHC-IIタンパク質発現、樹状細胞分化、TH1細胞反応、CD8+T細胞の浸潤増加など、腫瘍微小環境における好ましい免疫変化と関連していた(150)。Davarらによる別の研究でも、ICIに抵抗性の難治性メラノーマ患者に対するFMTの使用が有望であることが示された(92)。この研究では、以前にICI療法に反応したメラノーマ患者から糞便サンプルを採取し、非反応の患者に移植した。FMT後、抗PD-1治療と併用してFMT治療を行ったところ、15人中6人の患者が臨床的に恩恵を受けた。奏効した患者では、マイクロバイオームの多様性が増加し、CD8+T細胞の活性化が進み、腫瘍微小環境におけるIL-8発現骨髄系細胞が減少していた(92)。前述の2つの研究以外にも、消化器がん(NCT04130763)、腎細胞がん(NCT04758507)、前立腺がん(NCT04116775)など、さまざまな腫瘍に対するICI療法を改善するためにFMTの臨床試験がいくつか進行中である。
また、生きたバイオセラピューティックは、ヒトのがんにおけるICIの効果を向上させることが期待されています。転移性腎細胞がん患者に、CBM588(Clostridium butyricum含有)と抗PD-1免疫療法および抗CTLA-4免疫療法を投与したところ、臨床転帰が改善された(151)。CBM588療法後の臨床的改善は、患者の抗腫瘍性免疫の変化と関連していた。CBM588と抗PD-1および抗CTLA-4を併用した群では、抗PD-1および抗CTLA-4のみを併用した群と比較して、末梢血中のGM-CSF、IL-8、TNF-α、IFN-γ、MCP-1、IL-1RAのような炎症性サイトカインの高値とTreg細胞の低値が観察されました。エベロ・バイオサイエンス社が開発したビフィズス菌含有プロバイオティクス「EDP1503」は、ICIによる大腸がんおよび乳がんを対象としたフェーズI/II試験(NCT03775850)が進行中です。また、微生物由来のSCFAは、ヒトのがんに対するICI療法に対して良好な臨床転帰をもたらすことが分かっています。野村らの研究では、血中および糞便中のSCFA濃度が高い患者は、固形がんに対する抗PD1療法の有効性の改善と関連することがわかった(152)。また別の研究では、抗PD-1免疫療法を受けた非小細胞肺がん患者は、抗PD-1反応と糞便中のプロピオン酸および酪酸の高濃度の間に正の相関があることが示された(153)。これらの研究は、SCFAを患者に投与することとICIの有効性の向上との直接的な因果関係を示すものではなく、SCFAが患者の臨床的な改善をもたらすメカニズムも示していない。この点におけるポストバイオティクスの役割を明らかにするためには、今後、大規模な動物および臨床研究が必要である。
5.3 感染に対する免疫防御を調整する微生物ベースの治療法
5.3.1 C. difficile 感染症
先に詳述したように、FMT の実施で最も成功したのは、C. difficile 感染の解決である。FMTの作用機序を研究するほとんどの動物実験では、感染の解決につながる宿主-免疫の変化を促すマイクロバイオーム移植よりも、FMTとC. difficile間の細菌-細菌相互作用に焦点が当てられています。例えば、Clostridium scindensのような二次胆汁酸産生常在菌は、これらの二次胆汁酸の産生を通じてC. difficileの増殖を直接抑制します(90)。しかし、ヒトのFMT試験で、移植後にかなりの免疫変化が起こることが報告されている。あるパイロット研究では、再発性C. difficile感染に対するFMTの成功後、回腸で胆汁酸駆動FXR-FGFシグナルのアップレギュレーションが見られ、その結果、血清中の線維芽細胞増殖因子(FGF)-19が増加し、FGF-21が減少したことが判明しました(154)。この経路のアップレギュレーションは、患者の大腸における腸内マイクロバイオームと二次胆汁酸プロファイルの回復に関連していた。二次胆汁酸とFXRシグナルはともに免疫寛容の回復に関連している。二次胆汁酸はTreg細胞の分化を促進することによって、FXRシグナルは腸管バリアの完全性を改善することによってである(36、37、39、155)。したがって、FMT後の二次胆汁酸の回復(86)は、C. difficileの増殖を直接阻害する(90、156)に加えて、宿主を介してシグナル伝達し、C. difficile感染の解消を間接的にサポートする可能性がある。同様に、同じグループによる別の研究では、再発性C. difficile感染症患者はスクリーニング対照群と比較してFMT後に特定のマイクロRNA(miRNA)が増加することが示されました(157)。 miRNAは短い非コードRNA分子で、メッセンジャーRNA(mRNA)の3' UTR(3 prime untranslated region)内の相補配列に結合して標的遺伝子を翻訳的に抑制する結果が得られます(158)。FMT後の患者集団で観察された2つのmiRNA、miR-23aとmiR-150の増加は、FMTと再発性C. difficile感染症のマウスモデルを用いて確認された(157)。ターゲットスキャン予測解析と上皮細胞でのmiRNAの過剰発現により、miR-150とmiR-23aはそれぞれ、タイプ1炎症性免疫反応を促進する2つのサイトカイン、Il18とIl12bをターゲットにしていることがこの報告で明らかにされた。したがって、FMTによって増加したmiRNAは、C. difficile感染時の有害な炎症を抑制し、FMTからの炎症に敏感な微生物が腸に再コロニーできるように働く可能性があります。FMT後の免疫調節の変化もMarieらによって報告され、FMT後の大腸でIL-25レベルの上昇が観察された(61)。IL-25 は 2 型免疫を促進し、宿主の反応を病原性の炎症性反応から遠ざけることで、マウスの C. difficile 急性感染後に防御的である (159, 160)。同じ研究で、FMTは炎症性免疫反応を抑制し、大腸の上皮の発達と恒常性機能を促進するホメオボックスとラミニン遺伝子のファミリーの発現を増加させることが示された。さらに、末梢血中のTH17細胞は、FMT後に減少した(61)。TH17細胞の総数が減少する一方で、別の研究では、C. difficile毒素B特異的TH17細胞、ならびに毒素Aおよび毒素B特異的IgGおよびIgA抗体がFMT成功後に血中で増加したことが報告されました(161)。著者らは、C. difficile毒素特異的な適応免疫反応の増強が、FMTの作用機序である可能性を提唱した。FMT後に報告された免疫の変化を合わせると、FMTは、細菌同士の直接的な相互作用に加えて、C. difficile感染を除去するために宿主の免疫を高めることができるという概念を支持しています。
5.3.2 多剤耐性菌
再発性C. difficile感染症の治療におけるFMTの成功は、他の細菌感染症の治療に微生物を用いた治療法を適用するきっかけとなりました。バンコマイシン耐性腸球菌(VRE)、カルバペネム耐性腸球菌、メチシリン耐性黄色ブドウ球菌(MRSA)、拡張スペクトルβラクタマーゼ産生菌などの腸管の多剤耐性菌(MDROs)は、3種類以上の抗生物質に耐性があります(162, 163)。したがって、これらの菌に由来する感染症に対抗するための代替的な治療オプションが必要とされている。一般に、FMTは腸内細菌叢の抗生物質耐性遺伝子の存在比を低下させる(164)。いくつかの臨床研究で、MDROの腸内脱コロニーにFMTを使用することが述べられている(165、166)。腸内の MDROs の除染のために FMT を受けた 142 人の患者を含む 23 件の研究のメタ分析では、糞便サンプルと直腸スワブの微生物学的評価により、約 77.5% の患者が MDROs を除去している (167)。プロバイオティクスは、MDRO による感染症の予防と治療にも使用されている。例えば、2種類のLactobacillus株(Y74とHT121)の経口投与は、マウスの大腸におけるVREのコロニー形成を減少させた(168)。別の臨床試験では、Lactobacillus rhamnosusの経口投与により、腸のMRSAコロニー形成が減少した(169)。これらの例では、微生物ベースの治療は、免疫に依存しない細菌と細菌の直接的な相互作用を介して MDRO を標的としている。移植された細菌接種物の作用機序としては、資源に対する競争、バクテリオシンの産生、または病原性細菌に対して毒性を有する代謝副産物の産生が挙げられる。例えば、FMTまたはBlautia productaとClostridium bolteaeを含む定義された細菌コンソーシアムを投与すると、マウスの結腸における持続的なVREコロニー形成が解除された(170、171)。Kimらは、B. productaの特定株が産生するlantibioticがVREの除去に必要であることを明らかにした(172)。このグループは、B. productaとC. bolteaeのコンソーシアムを移植すると、重度の免疫不全マウス(Rag2/- Il2rg-/-)でもVREのコロニー形成が消失することを確認し、この微生物療法の作用機序が免疫に依存しないことを示している。この結果は、FMT治療の成否が宿主の免疫状態に依存することを観察したLittmanら(114)とは対照的である。これらの例は、本総説の焦点ではないが、微生物に基づく治療の免疫非依存的な利点は、それ自体が豊かな研究分野であることを示している(18)。微生物療法がどのような場合に免疫系に作用し、どのような場合に免疫系に依存しないのかを理解することは、微生物療法の設計がより洗練され、標的を絞るために重要な情報である。
5.3.3 ウイルス感染
微生物療法は、腸内および全身性のウイルス感染に対しても、領域を超えた保護作用を発揮することができる。いくつかのプロバイオティクス研究では、プロバイオティクス投与後、ウイルス感染の重症度や期間が減少したことを示している(173, 174)。プロバイオティクスの効果の中には、殺菌効果もあるバクテリオシンの産生(175、176)や宿主細胞へのウイルス付着の阻害(177)など、非免疫媒介型のメカニズムを介するものもある。マイクロバイオームはまた、侵入してきたウイルスに迅速に対応できるように、宿主の抗ウイルス免疫防御の活性化を誘導する(178-182)。いくつかのプロバイオティクス製剤は、I型およびII型のIFNシグナル伝達とナチュラルキラー細胞活性の増強と関連しており、ウイルス感染を制限している(183-185)。このことは、I型IFNを介した抗ウイルス防御経路を活性化し、腸内または全身性ウイルス感染に対する宿主の生存を改善した生きたバイオ治療細菌種を分離して移植したマウス研究によってさらに支持されている(181, 182)。Steedらは、FMTが微生物欠乏マウスをインフルエンザウイルス感染から保護できることを報告し、さらに、Clostridum orbiscindensがフラボノイド代謝によって生産する特定のポストバイオティクス、デサミノチロシンを投与すると、肺のIFN経路が増強されて致死的インフルエンザウイルス感染から保護できることを明らかにした(186)。微生物を利用した治療法は、適応的な抗ウイルス免疫も強化することができる。いくつかのプロバイオティクスは、分泌型IgA抗体産生を増強し、腸管ウイルスの侵入を制限することができる(187-189)。一方、B. fragilis由来のポストバイオティクスPSAを投与すると、致死的な単純ヘルペス脳炎の発症を抑えることができた。この治療効果は、PSAがIL-10産生を増加させることによってT細胞応答を抑制することによってもたらされた(190)。実際、プロバイオティクスは、SARS-CoV-2感染に関連するディスバイオシスを修正する治療レジメンの一部として提案されている(191、192)。
6 結論
マイクロバイオーム療法を使った病気の治療には、1960〜70年代に初めて心臓や肝臓の移植手術が行われたときと同じくらい、人間の生活を向上させる可能性が秘められています。しかし、同じマイクロバイオーム移植用接種物を複数の患者に投与した場合、臨床結果が不均一になることが多い(193)。レシピエントの長期生着は、食事、遺伝、または既存のマイクロバイオームなどの複数の要因によって決定される可能性があります(194-197)。したがって、50年前に臓器ドナーのマッチングと免疫抑制剤の規則が慎重な基礎科学研究によって体系的に解明されたのと同じように、この新しい分野の潜在力を利用するために、マイクロバイオーム移植の成功を決定するメカニズムを明らかにする必要がある。
著者による貢献
ZAが研究し、原稿を執筆した。JMは図のデザインを担当し、編集のフィードバックを行った。MAは原稿に目を通し、編集とフィードバックを行った。すべての著者が論文に貢献し、提出された原稿を承認した。
資金提供
この原稿の著者は、NIH NIAIDの資金援助を受けています(ZA、JM、MAにはR01 AI158830、MAにはR21 AI164385, R01 AI130115)。
謝辞
図はBioRender.comで作成した。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係のない状態で実施されたことを宣言する。
出版社からのコメント
本論文で述べられたすべての主張は、著者個人のものであり、必ずしもその関連組織のもの、あるいは出版社、編集者、査読者のものを代表するものではありません。本論文で評価される可能性のある製品,またはその製造元が主張する可能性のある主張は,出版社によって保証または承認されたものではない.
略語
FMT、糞便微生物叢移植、Treg、制御性T細胞、IBD、炎症性腸疾患、SCFA、短鎖脂肪酸、FXR、ファルネソイドX受容体、ICI、免疫チェックポイント阻害剤、DSS、デキストラン硫酸ナトリウム、SPF、特定病原体フリー、5-ASA- 5-アミノサリン酸、UC、潰瘍性大腸炎、MBT、微生物ベースセラピー。
参考文献
Huttenhower C, Gevers D, Knight R, Abubucker S, Badger JH, Chinwalla AT, et al. Structure, function and diversity of the healthy human microbiome(健常者マイクロバイオームの構造、機能、多様性)。ネイチャー (2012) 486:207-14.
PubMed Abstract|CrossRef Full Text|Google Scholar
腸内真菌叢:解析、環境との相互作用、消化器疾患における役割への洞察。Nat Rev Gastroenterol Hepatol (2019) 16:331-45. doi: 10.1038/s41575-019-0121-2.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Ruan W, Engevik MA, Spinler JK, Versalovic J. Healthy human gastrointestinal microbiome.健康なヒトの消化管マイクロバイオーム。10年間の探索の結果、組成と機能が明らかになった。DIG DIS SCI (2020) 65:695-705.論文番号: 10.1007/s10620-020-06118-4
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Houtman TA, Eckermann HA, Smidt H, de Weerth C. Gut microbiota and BMI throughout childhood: the role of firmicutes, bacteroidetes, and short-chain fatty acid producers.幼少期の腸内細菌叢とBMIの関係。サイ・レップ(2022)12:3140.doi: 10.1038/s41598-022-07176-6
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Stojanov S, Berlec A, Štrukelj B. 肥満と炎症性腸疾患の治療におけるプロバイオティクスがFirmicutes/Bacteroidetes比率に与える影響。マイクロオーガニズム(2020)8.doi:10.3390/microorganisms8111715
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Ley RE, Bäckhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI. 肥満が腸内細菌の生態系を変化させる。このような状況下において、「肥満」は「腸内細菌の生態系」を変化させる。
PubMed Abstract|CrossRef Full Text|Google Scholar
Levy M, Kolodziejczyk AA, Thaiss CA, Elinav E. Dysbiosis and the immune system.(レヴィM、コロジエジークAA、タイスCA、エリナブE)。Nat Rev Immunol (2017) 17:219-32. doi: 10.1038/nri.2017.7.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Sampson TR, Debelius JW, Thron T, Janssen S, Shastri GG, Ilhan ZE, et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of parkinson's disease.腸内細菌はパーキンソン病モデルにおいて運動障害と神経炎症を制御する。セル (2016) 167:1469-1480.e12. doi: 10.1016/j.cell.2016.11.018
PubMed Abstract|CrossRefフルテキスト|Google Scholar
カウ AL、アハーン PP、グリフィン NW、グッドマン AL、ゴードン JI. ヒトの栄養、腸内細菌叢、免疫系。ネイチャー (2011) 474:327-36.
PubMed Abstract|CrossRef Full Text|Google Scholar
Hartstra AV, Bouter KEC, Bäckhed F, Nieuwdorp M. Insights into the role of the microbiome in obesity and type 2 diabetes.(肥満と2型糖尿病におけるマイクロバイオームの役割に関する洞察)。Diabetes Care (2015) 38:159-65. doi: 10.2337/dc14-0769.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Gopalakrishnan V、Helmink BA、Spencer CN、Reuben A、Wargo JA. 腸内細菌ががん、免疫、がん免疫療法に及ぼす影響。キャンサーセル(2018)33:570-80. doi: 10.1016/j.ccell.2018.03.015
PubMed Abstract|CrossRef Full Text|Google Scholar
Duan M, Wang Y, Zhang Q, Zou R, Guo M, Zheng H. Characteristics of gut microbiota in people with obesity(肥満者の腸内細菌叢の特徴)。PloS One (2021) 16:e0255446. doi: 10.1371/journal.pone.0255446.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Das T, Jayasudha R, Chakravarthy S, Prashanthi GS, Bhargava A, Tyagi M, et al. Alterations in the gut bacterial microbiome in people with type 2 diabetes mellitus and diabetic retinopathy.2型糖尿病患者における腸内細菌群の変化。サイ・レップ(2021)11:2738.doi: 1038/s41598-021-82538-0
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Chen C, Liao J, Xia Y, Liu X, Jones R, Haran J, et al. Gut microbiota regulate alzheimer's disease pathologies and cognitive disorders via PUFA-associated neuroinflammation.腸内細菌はアルツハイマー病の病理と認知障害を制御する。Gut (2022) 71:2233-52. doi: 10.1136/gutjnl-2021-326269
PubMed Abstract|CrossRefフルテキスト|Google Scholar
鎌田直樹、Seo S-U、Chen GY、Núñez G. Role of the gut microbiota in immunity and inflammatory disease(免疫と炎症性疾患における腸内細菌叢の役割). Nat Rev Immunol (2013) 13:321-35. doi: 10.1038/nri3430
PubMed Abstract|CrossRef Full Text|Google Scholar
Bashiardes S, Tuganbaev T, Federici S, Elinav E. The microbiome in anti-cancer therapy.抗がん剤治療におけるマイクロバイオーム。セミン・イミュノール(2017)32:74-81. doi: 10.1016/j.smim.2017.04.001
PubMed Abstract|CrossRefフルテキスト|Google Scholar
フィッツギボンG、ミルズKHG. 微生物叢と免疫介在性疾患。治療介入のための機会。Eur J Immunol (2020) 50:326-37. doi: 10.1002/eji.201948322.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
ソルバラMT、パマーEG。微生物に基づく治療法。このような場合、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Buffington SA, Di Prisco GV, Auchtung TA, Ajami NJ, Petrosino JF, Costa-Mattioli M. Microbial reconstitution reverses maternal diet-induced social and synaptic deficits in offspring.(微生物再構成は、母親の食事によって誘発された子孫の社会的およびシナプス障害を逆転させる)。セル (2016) 165:1762-75. doi: 10.1016/j.cell.2016.06.001.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Hsiao EY, McBride SW, Hsien S, Sharon G, Hyde ER, McCue T, et al. Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders.(微生物叢は神経発達障害に関連する行動的・生理的異常を調節する). セル (2013) 155:1451-63.論文番号: 10.1016/j.cell.2013.11.024
PubMed Abstract|CrossRef Full Text|Google Scholar
このような状況下において、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」etc............................................. PloS Pathog (2012) 8:e1002995.doi: 10.1371/journal.ppat.1002995
PubMed Abstract|CrossRef Full Text|Google Scholar
Ridaura VK, Faith JJ, Rey FE, Cheng J, Duncan AE, Kau AL, et al. 肥満で不一致の双子からの腸内細菌叢は、マウスの代謝を調節する。サイエンス (2013) 341:1241214.
PubMed Abstract|CrossRef Full Text|Google Scholar
Sivan A, Corrales L, Hubert N, Williams JB, Aquino-Michaels K, Earley ZM, et al. Commensal bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy.(コメンサルビフィドバクテリウムは抗腫瘍免疫を促進し、抗PD-L1の効果を促進する。サイエンス (2015) 350:1084-9. doi: 10.1126/science.aac4255
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Vétizou M, Pitt JM, Daillère R, Lepage P, Waldschmitt N, Flament C, et al. CTLA-4 blockadeによる抗がん免疫療法は、腸内細菌叢に依存している。サイエンス (2015) 350:1079-84. doi: 10.1126/science.aad1329
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Mimee M, Citorik RJ, Lu TK. マイクロバイオーム治療学 - 進歩と課題。Adv Drug Delivery Rev (2016) 105:44-54. doi: 10.1016/j.addr.2016.04.032.
CrossRefフルテキスト|Google Scholar
Ivanov II, Atarashi K, Manel N, Brodie EL, Shima T, Karaoz U, et al. Induction of intestinal Th17 cells by segmented filamentous bacteria(セグメント化された糸状菌による腸管Th17細胞の誘導). Cell (2009) 139:485-98.
PubMed Abstract|CrossRef Full Text|Google Scholar
Goto Y, Panea C, Nakato G, Cebula A, Lee C, Diez MG, et al. Segmented filamentous bacteria antigens presented by intestinal dendritic cells drive mucosal Th17 cell differentiation. イミュニティ (2014) 40:594-607. doi: 10.1016/j.immuni.2014.03.005
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Sano T, Huang W, Hall JA, Yang Y, Chen A, Gavzy SJ, et al. IL-23R/IL-22 circuit regulates epithelial serum amyloid a to promote local effector Th17 responses.IL-23R/IL-22回路は、上皮血清アミロイドaを制御し、局所エフェクターTh17応答を促進する。セル (2016) 164:324. doi: 10.1016/j.cell.2015.12.047
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Woo V, Eshleman EM, Hashimoto-Hill S, Whitt J, Wu S-E, Engleman L, et al. Commensal segmented filamentous bacteria-derived retinoic acid primes host defense to intestinal infection.腸管感染症に対する宿主の防御を促進する。Cell Host Microbe (2021) 29:1744-1756.e5. doi: 10.1016/j.chom.2021.09.010
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Mazmanian SK、Liu CH、Tzianabos AO、Kasper DL。共生細菌の免疫調節分子は、宿主免疫系の成熟を誘導する。このような場合、「免疫力」を高めることが重要である。
PubMed Abstract|CrossRef Full Text|Google Scholar
Troy EB, Kasper DL. バクテロイデス・フラジリス多糖体の免疫系への有益な効果。このような場合、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。
PubMed Abstract|CrossRef Full Text|Google Scholar
Smith PM, Howitt MR, Panikov N, Michaud M, Gallini CA, Bohlooly YM, et al. 微生物の代謝物、短鎖脂肪酸は、大腸トレグ細胞のホメオスタシスを制御している。サイエンス (2013) 341:569-73.
PubMed Abstract|CrossRef Full Text|Google Scholar
Singh N, Gurav A, Sivaprakasam S, Brady E, Padia R, Shi H, et al. ナイアシンおよび常在代謝物酪酸の受容体であるGpr109aの活性化は、大腸炎症および発がんを抑制する。イミュニティ (2014) 40:128-39. doi: 10.1016/j.immuni.2013.12.007
PubMed Abstract|CrossRefフルテキスト|Google Scholar
古澤祐子、小幡祐子、福田慎一郎、遠藤太一、中藤剛、高橋大輔、他 コメンスル微生物由来の酪酸は大腸制御性T細胞の分化を誘導する。ネイチャー (2013) 504:446-50.
PubMed Abstract|CrossRef Full Text|Google Scholar
Arpaia N, Campbell C, Fan X, Dikiy S, van der Veeken J, deRoos P, et al. 常在菌が産生する代謝産物は、末梢制御性T細胞の生成を促進する。ネイチャー (2013) 504:451-5.
PubMed Abstract|CrossRef Full Text|Google Scholar
Hang S, Paik D, Yao L, Kim E, Trinath J, Lu J, et al. 胆汁酸代謝産物はT(H)17およびt(reg)細胞の分化を制御する。ネイチャー(2019)576:143-8. doi: 10.1038/s41586-019-1785-z
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Song X, Sun X, Oh SF, Wu M, Zhang Y, Zheng W, et al. 微生物の胆汁酸代謝産物は、腸内RORγ(+)制御性T細胞のホメオスタシスを調節する。Nature (2020) 577:410-5. doi: 10.1038/s41586-019-1865-0
PubMed Abstract|CrossRefフルテキスト|Google Scholar
また、このような研究成果を踏まえて、「日本学術振興会特別研究員奨励賞」、「日本学術振興会特別研究員奨励賞」、「日本学術振興会特別研究員奨励賞」、「日本学術振興会特別研究員奨励賞」、「日本学術振興会特別研究員奨励賞」、「日本学術振興会特別研究員奨励賞」、「日本学術振興会特別研究員奨励賞」を受賞しました。ネイチャー (2013) 500:232-6.
PubMed Abstract|CrossRef Full Text|Google Scholar
Campbell C, McKenney PT, Konstantinovsky D, Isaeva OI, Schizas M, Verter J, et al. 細菌による胆汁酸の代謝は、末梢性制御性T細胞の生成を促進する。Nature (2020) 581(7809):475-9. doi: 10.1038/s41586-020-2193-0
PubMed Abstract|CrossRef Full Text|Google Scholar
ベルカイドY、ハリソンOJ。恒常性免疫と微生物叢。免疫 (2017) 46:562-76. doi: 10.1016/j.immuni.2017.04.008.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Zheng D, Liwinski T, Elinav E. Interaction between microbiota and immunity in health and disease(健康と病気における微生物叢と免疫の相互作用)。Cell Res (2020) 30:492-506. doi: 10.1038/s41422-020-0332-7
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Baquero F, Nombela C. The microbiome as a human organ. 臨床微生物感染症(2012)18サプリ4:2-4。
PubMed Abstract|CrossRef Full Text|Google Scholar
DeGruttola AK, Low D, Mizoguchi A, Mizoguchi E. Current understanding of dysbiosis in disease in human and animal models.(ヒトおよび動物モデルにおける疾患におけるディスバイオーシスの現在の理解)。Inflammation Bowel Dis (2016) 22:1137-50. doi: 10.1097/MIB.0000000000000750.
クロスレフフルテキスト|Google Scholar
Clooney AG, Eckenberger J, Laserna-Mendieta E, Sexton KA, Bernstein MT, Vagianos K, et al. Ranking microbiome variance in inflammatory bowel disease: a large longitudinal intercontinental study(炎症性腸疾患におけるマイクロバイオームのばらつきの順位付け:大規模縦断的大陸間研究)。ガット(2021)70:499-510。
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Parada Venegas D, de la Fuente MK, Landskron G, González MJ, Quera R, Dijkstra G, et al. 短鎖脂肪酸(SCFAs)仲介の腸上皮および免疫調節と炎症性腸疾患への関連性。フロント・イミュノール(2019)10:277. doi: 10.3389/fimmu.2019.00277.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Reinisch W, Gasché C, Tillinger W, Wyatt J, Lichtenberger C, Willheim M, et al. Crohn's diseaseにおける血清インターロイキン6の臨床的関連性:シングルポイント測定、治療モニタリング、臨床再発の予知。邦題:クロ-ン病における血清インターロイキン6の臨床的意義:シングルポイント測定と治療モニタリングおよび臨床的再発の予測。
PubMed Abstract | CrossRef Full Text | Google Scholar
Omenetti S, Bussi C, Metidji A, Iseppon A, Lee S, Tolaini M, et al. 腸は機能的に異なる恒常性組織常在細胞および炎症性Th17細胞を保有する。イミュニティ(2019)51:77-89.e6. doi: 10.1016/j.immuni.2019.05.004
PubMed Abstract|CrossRef Full Text|Google Scholar
Lee J-Y, Hall JA, Kroehling L, Wu L, Najar T, Nguyen HH, et al. Serum amyloid a proteins induce pathogenic Th17 cells and promote inflammatory disease.血清アミロイドaタンパク質は、病原性Th17細胞を誘導し、炎症性疾患を促進する。Cell (2020) 183:2036-9. doi: 10.1016/j.cell.2020.12.008.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
炎症性腸疾患におけるインターロイキン17の発現亢進。Gut (2003) 52:65-70.論文番号: 10.1136/gut.52.1.65
PubMed Abstract | CrossRef Full Text | Google Scholar
Rovedatti L, Kudo T, Biancheri P, Sarra M, Knowles CH, Rampton DS, et al. 炎症性腸疾患におけるインターロイキン17およびインターフェロンガンマ産生の異なる調節機構。Gut (2009) 58:1629-36。
PubMed Abstract|CrossRef Full Text|Google Scholar
Britton GJ, Contijoch EJ, Mogno I, Vennaro OH, Llewellyn SR, Ng R, et al. 炎症性腸疾患のヒト由来の微生物が腸のTh17とRORγt(+)制御T細胞のバランスを変え、マウスの大腸炎を増悪させる。イミュニティ (2019) 50:212-224.e4. doi: 10.1016/j.immuni.2018.12.015
PubMed Abstract|CrossRef Full Text|Google Scholar
Byndloss MX, Olsan EE, Rivera-Chávez F, Tiffany CR, Cevallos SA, Lokken KL, et al. Microbiota-activated PPAR-γ signaling inhibits dysbiotic enterobacteriaceae expansion.(微生物が活性化するPPAR-γシグナルは、腸内細菌の拡大を抑制する)。サイエンス (2017) 357:570-5. doi: 10.1126/science.aam9949
PubMed Abstract|CrossRef Full Text|Google Scholar
Winter SE, Winter MG, Xavier MN, Thiennimitr P, Poon V, Keestra AM, et al. Host-derived nitrate boosts growth of e. coli in the inflamed gut.宿主由来の硝酸塩は、炎症を起こした腸内で大腸菌の増殖を促進する。サイエンス (2013) 339:708-11.
PubMed Abstract|CrossRef Full Text|Google Scholar
Winter SE, Thiennimitr P, Winter MG, Butler BP, Huseby DL, Crawford RW, et al. 腸の炎症はサルモネラ菌に呼吸電子受容体を提供する。Nature (2010) 467:426-9.
PubMed Abstract|CrossRef Full Text|Google Scholar
Stecher B, Robbiani R, Walker AW, Westendorf AM, Barthel M, Kremer M, et al. Salmonella Enterica serovar typhimurium exploits inflammation to compete with the intestinal microbiota.(腸内細菌叢と競合する炎症を利用するサルモネラ腸炎チフス菌)。PloS Biol (2007) 5:2177-89(英語) doi: 10.1371/journal.pbio.0050244
PubMed Abstract|CrossRef Full Text|Google Scholar
Lupp C, Robertson ML, Wickham ME, Sekirov I, Champion OL, Gaynor EC, et al. Host-mediated inflammuations disrupts the intestinal microbiota and promotes the overgrowth of enterobacteriaceae. Cell Host Microbe (2007) 2:204.
PubMed Abstract|CrossRef Full Text|Google Scholar
Chanin RB, Winter MG, Spiga L, Hughes ER, Zhu W, Taylor SJ, et al. 上皮由来の活性酸素種は、腸の炎症時にAppBCXを介した大腸菌の好気性呼吸を可能にする。Cell Host Microbe (2020) 28:780-788.e5. doi: 10.1016/j.chom.2020.09.005
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Scales BS、Dickson RP、Huffnagle GB。A tale of two sites: How inflammation can reshape the microbiomes of the gut and lungs.(2つの部位の物語:炎症が腸と肺のマイクロバイオームをどのように再構築するか)。J Leukoc Biol (2016) 100:943-50. doi: 10.1189/jlb.3MR0316-106R
PubMed Abstract|CrossRef Full Text|Google Scholar
Wang S, El-Fahmawi A, Christian DA, Fang Q, Radaelli E, Chen L, et al. 感染誘発性腸内ディスバイオシスは、マクロファージの活性化と硝酸塩の生成によって媒介される。 mBio (2019) 10. doi: 10.1128/mBio.00935-19
クロスレフフルテキスト|Google Scholar
Li X, Gao X, Hu H, Xiao Y, Li D, Yu G, et al. 再発性クロストリジウム・ディフィシル感染症の子どもに対する糞便微生物移植後の臨床効果およびマイクロバイオームの変化. フロント・マイクロバイオル(2018)9:2622. doi: 10.3389/fmicb.2018.02622
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Jan N, Hays RA, Oakland DN, Kumar P, Ramakrishnan G, Behm BW, et al. 便微生物移植は、再発性クロストリジウム・ディフィシル患者における大腸IL-25の増加と組織炎症の減衰をもたらす。 mSphere(2021)6:e0066921. doi: 10.1128/mSphere.00669-21.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Meisel M, Mayassi T, Fehlner-Peach H, Koval JC, O'Brien SL, Hinterleitner R, et al. Interleukin-15 promotes intestinal dysbiosis with butyrate deficiency associated with increased susceptibility to colitis.大腸炎に対する感受性の増加と酪酸欠乏を伴う腸内細菌症。ISME J (2017) 11:15-30. doi: 10.1038/ismej.2016.114.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
清原 浩、筋野 孝、寺谷 崇、宮本 圭、新井 正、野村 英夫、他 Toll-like receptor 7 アゴニストによる皮膚炎は、腸内マイクロバイオームと免疫細胞の変化により重症デキストラン硫酸ナトリウム大腸炎を引き起こす。Cell Mol Gastroenterol Hepatol (2019) 7:135-56. doi: 10.1016/j.jcmgh.2018.09.010.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Darnaud M, Dos Santos A, Gonzalez P, Augui S, Lacoste C, Desterke C, et al. Regenerating family member 3 alphaの腸管送達は腸内細菌叢を変化させ、大腸炎マウスの炎症を制御します。Gastroenterology (2018) 154:1009-1023.e14. doi: 10.1053/j.gastro.2017.11.003
PubMed Abstract|CrossRefフルテキスト|Google Scholar
サンダースME、メレンスタインDJ、リードG、ギブソンGR、ラスタルRA. 腸の健康と病気におけるプロバイオティクスとプレバイオティクス:生物学から臨床まで。Nat Rev Gastroenterol Hepatol (2019) 16:605-16. doi: 10.1038/s41575-019-0173-3.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Arnold JW, Roach J, Fabela S, Moorfield E, Ding S, Blue E, et al. 老化した腸に対するプレバイオティクス・ガラクトオリゴ糖のプレオトロピック効果. マイクロバイオーム(2021)9.doi: 10.1186/s40168-020-00980-0
クロスレフフルテキスト|Google Scholar
Vaughn BP, Vatanen T, Allegretti JR, Bai A, Xavier RJ, Korzenik J, et al. 活動性クローン病に対する便中微生物移植後の腸内細菌多様性の増加。Inflammation Bowel Dis (2016) 22:2182-90. doi: 10.1097/MIB.0000000000000893.
クロスレフフルテキスト|Google Scholar
Jacob V, Crawford C, Cohen-Mekelburg S, Viladomiu M, Putzel GG, Schneider Y, et al. 大腸内視鏡による高ダイバーシティ便微生物製剤の単一投与は、活動性潰瘍性大腸炎の微生物多様性を高める上で安全かつ効果的である。炎症 Bowel Dis (2017) 23:903-11. doi: 10.1097/MIB.000000001132
クロスレフフルテキスト|Google Scholar
Rodríguez-Nogales A, Algieri F, Garrido-Mesa J, Vezza T, Utrilla MP, Chueca N, et al. DSSマウス大腸炎における乳酸菌発酵物と乳酸菌サリバリウスの異なる腸内抗炎症効果:マイクロRNA発現および微生物叢組成への影響。Mol Nutr Food Res (2017) 61. doi: 10.1002/mnfr.201700144
クロスレフフルテキスト|Google Scholar
Jang YJ, Kim W-K, Han DH, Lee K, Ko G. Lactobacillus fermentum species ameliorate dextran sulfate sodium-induced colitis by regulating the immune response and altering gut microbiota.乳酸菌発酵種は、免疫反応を調節し、腸内細菌叢を変化させることでデキストラン硫酸ナトリウム誘発性大腸炎を改善する。腸内細菌 (2019) 10:696-711. doi: 10.1080/19490976.2019.1589281.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Zhou X, Liu H, Zhang J, Mu J, Zalan Z, Hegyi F, et al. デキストラン硫酸ナトリウム誘発マウス大腸炎に対する乳酸菌発酵物CQPC04の保護効果は、核因子κBシグナル伝達経路の調節に関連しています。J Dairy Sci (2019) 102:9570-85. doi: 10.3168/jds.2019-16840
PubMed Abstract|CrossRefフルテキスト|Google Scholar
ラウンドJL、マズマニアンSK. 腸内細菌叢の常在菌による誘導性Foxp3+制御性T細胞発生。
PubMed Abstract|CrossRef Full Text|Google Scholar
成島慎一郎、杉浦康弘、大島和彦、阿多羅志、服部正樹、末松正樹、他 制御性T細胞誘導性ヒト由来クロストリジウム17株の性状解析。腸内細菌 (2014) 5:333-9. doi: 10.4161/gmic.28572
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhu Y, Xu Y, Wang X, Rao L, Yan X, Gao R, et al. プロバイオティクスカクテルは、大腸炎マウスの腸内細菌叢および代謝産物の改善を通じて腸の炎症を緩和する。フロントセルインフェクトマイクロバイオロジー(2022)12:886061.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Scheppach W, Müller JG, Boxberger F, Dusel G, Richter F, Bartram HP, et al. 短鎖脂肪酸による灌流後の大腸粘膜の組織学的変化. Eur J Gastroenterol Hepatol (1997) 9:163-8. doi: 10.1097/00042737-199702000-00010
PubMed Abstract | CrossRef Full Text | Google Scholar
遠位型潰瘍性大腸炎における酪酸エネマズの大腸粘膜への影響。胃腸病学 (1992) 103:51-6.
PubMed Abstract|CrossRef Full Text|Google Scholar
Pandey KR, Naik SR, Vakil BV. プロバイオティクス、プレバイオティクス、シンバイオティクス-レビュー。J Food Sci Technol (2015) 52:7577-87. doi: 10.1007/s13197-015-1921-1
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Fooks LJ, Gibson GR. プロバイオティクスとプレバイオティクスがヒトの腸内病原体に与える影響のin vitro調査。このような場合、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。
PubMed Abstract|CrossRef Full Text|Google Scholar
Tzortzis G, Baillon M-LA, Gibson GR, Rastall RA. イヌ由来の乳酸菌における抗病原性活性の炭水化物増殖基質による調節。J Appl Microbiol (2004) 96:552-9. doi: 10.1111/j.1365-2672.2004.02172.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Gibson GR, McCartney AL, Rastall RA. プレバイオティクスと胃腸の感染症に対する抵抗力。このような場合、「食の安全」「食の安心」「食の安全」「食の安心」「食の安心」「食の安心」「食の安心」「食の安心」「食の安心」「食の安心」「食の安心」「食の安心」。
PubMed Abstract|CrossRef Full Text|Google Scholar
ウォーラーKMJ、レオンRW、パラモシーS.消化器疾患の治療のための便性微生物移植に関する最新情報。J Gastroenterol Hepatol (2022) 37:246-55. doi: 10.1111/jgh.15731.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Brown JR-M, Flemer B, Joyce SA, Zulquernain A, Sheehan D, Shanahan F, et al. Clostridioides difficile感染に対する便性微生物移植の成功における微生物叢組成、胆汁および脂肪酸代謝の変化. BMC Gastroenterol (2018) 18:131. doi: 10.1186/s12876-018-0860-5
PubMed Abstract|CrossRefフルテキスト|Google Scholar
グプタS、アレン-バーコE、ペトロフEO。糞便微生物移植:見通しで。セラップ・アドバンス・ガストロエンテロール(2016)9:229-39. doi: 10.1177/1756283X15607414
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Eiseman B、Silen W、Bascom GS、Kauvar AJ. 偽膜性腸炎の治療における補助手段としての糞便浣腸。を使用した。
PubMed Abstract|Google Scholar
Hui W, Li T, Liu W, Zhou C, Gao F. Fecal microbiota transplantation for treatment of recurrent c. difficile infection(再発性大腸菌感染症の治療に対する糞便微生物移植)。最新のランダム化比較試験メタアナリシス。PloS One (2019) 14:e0210016. doi: 10.1371/journal.pone.0210016.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Weingarden AR, Chen C, Bobr A, Yao D, Lu Y, Nelson VM, et al. Microbiota transplantation restores normal fecal bile acid composition in recurrent clostridium difficile infection.(微生物叢移植は、再発性クロストリジウム・ディフィシル感染症において、正常な糞便胆汁酸組成を回復させる。Am J Physiol Gastrointest Liver Physiol (2014) 306:G310-319. doi: 10.1152/ajpgi.00282.2013.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Baunwall SMD, Lee MM, Eriksen MK, Mullish BH, Marchesi JR, Dahlerup JF, et al. 再発性クロストリジウム・ディフィシル感染に対する糞便微生物叢移植術。最新のシステマティックレビューとメタアナリシス。EClinicalMedicine (2020) 29-30:100642. doi: 10.1016/j.eclinm.2020.100642.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Gilbert JA. 再発性クロストリジオイデスディフィシルに対するマイクロバイオーム療法。Lancet Microbe (2022) 3:e334. doi: 10.1016/S2666-5247(22)00096-9
PubMed Abstract|CrossRef Full Text|Google Scholar
Hryckowian AJ, Van Treuren W, Smits SA, Davis NM, Gardner JO, Bouley DM, et al. Microbiota-accessible carbohydrates suppress clostridium difficile infection in a murine model.(微生物がアクセスできる炭水化物は、マウスモデルにおいてクロストリジウム・ディフィシル感染を抑制する)。Nat Microbiol (2018) 3:662-9. doi: 10.1038/s41564-018-0150-6.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Buffie CG, Bucci V, Stein RR, McKenney PT, Ling L, Gobourne A, et al. 精密マイクロバイオーム再構成は、クロストリジウム・ディフィシルに対する胆汁酸媒介耐性を回復させる。ネイチャー(2015)517:205-8.doi: 10.1038/nature13828
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Costello SP, Hughes PA, Waters O, Bryant RV, Vincent AD, Blatchford P, et al. Effect of fecal microbiota transplantation on 8-week remission in patients with ulcerative colitis.便内細菌移植の潰瘍性大腸炎患者の8週間寛解に対する効果。無作為化臨床試験。JAMA (2019) 321:156-64. doi: 10.1001/jama.2018.20046.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Davar D, Dzutsev AK, McCulloch JA, Rodrigues RR, Chauvin J-M, Morrison RM, et al. メラノーマ患者における抗PD-1療法への耐性を克服する糞便微生物叢移植。サイエンス(2021)371:595-602.doi: 10.1126/science.abf3363
PubMed Abstract|CrossRef Full Text|Google Scholar
Xu M-Q, Cao H-L, Wang W-Q, Wang S, Cao X-C, Yan F, et al. Fecal microbiota transplantation broadening its application beyond intestinal disorders.便微生物移植は腸疾患以外にも適用される。World J Gastroenterol (2015) 21:102-11. doi: 10.3748/wjg.v21.i1.102
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Narula N, Kassam Z, Yuan Y, Colombel J-F, Ponsioen C, Reinisch W, et al. Systematic review and meta-analysis: 活動性潰瘍性大腸炎の治療に対する糞便微生物移植。炎症 Bowel Dis (2017) 23:1702-9. doi: 10.1097/MIB.0000000000001228
クロスレフフルテキスト|Google Scholar
DeFilipp Z, Bloom PP, Torres Soto M, Mansour MK, Sater MRA, Huntley MH, et al. 糞便微生物移植によって感染した薬剤耐性大腸菌血症. N Engl J Med (2019) 381:2043-50. doi: 10.1056/NEJMoa1910437.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Petrof EO, Gloor GB, Vanner SJ, Weese SJ, Carter D, Daigneault MC, et al. 便代替移植療法によるクロストリジウム・ディフィシル感染症の除菌療法: 腸の "再POOPulating"。マイクロバイオーム(2013)1:3.doi: 10.1186/2049-2618-1-3
PubMed Abstract|CrossRef Full Text|Google Scholar
Carlucci C, Jones CS, Oliphant K, Yen S, Daigneault M, Carriero C, et al. クロストリジウム・ディフィシレの病原性決定因子に対する定義された腸内細菌生態系構成要素の効果. サイ・レップ(2019)9:885.doi: 10.1038/s41598-018-37547-x
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Kerry RG, Patra JK, Gouda S, Park Y, Shin H-S, Das G. Benefaction of probiotics for human health(プロバイオティクスの健康への恩恵。レビュー。J Food Drug Anal (2018) 26:927-39. doi: 10.1016/j.jfda.2018.01.002.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Leccese G, Bibi A, Mazza S, Facciotti F, Caprioli F, Landini P, et al. Probiotic lactobacillus and bifidobacterium strains counteract adherent-invasive escherichia coli (AIEC) virulence and hamper IL-23/Th17 axis in Uslcerative colitis, but not in crohn's disease.潰瘍性大腸炎におけるプロバイオティクス乳酸菌およびビフィズス菌株の病原性対策は、クローン病では無効である。セルズ(2020)9.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Coqueiro AY, Raizel R, Bonvini A, Tirapegui J, Rogero MM. 炎症性腸疾患のためのプロバイオティクス:有望なアジュバント治療。Int J Food Sci Nutr (2019) 70:20-9. doi: 10.1080/09637486.2018.1477123.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Derwa Y, Gracie DJ, Hamlin PJ, Ford AC. メタ分析による系統的レビュー:炎症性腸疾患におけるプロバイオティクスの有効性。アリメント・ファーマコル・サー(2017)46:389-400. doi: 10.1111/apt.14203
PubMed Abstract|CrossRefフルテキスト|Google Scholar
McFarland LV, Surawicz CM, Greenberg RN, Fekety R, Elmer GW, Moyer KA, et al. クロストリジウム・ディフィシル病に対するサッカロミセス・ブラルディと標準抗生物質の併用の無作為プラセボ対照試験。JAMA (1994) 271:1913-8.
PubMed Abstract|Google Scholar
Surawicz CM, McFarland LV, Greenberg RN, Rubin M, Fekety R, Mulligan ME, et al. 再発性クロストリジウム・ディフィシル病に対するより良い治療法の探索:高用量バンコマイシンとサッカロマイセス・ブラルダイの併用の使用。臨床感染症(2000)31:1012-7。
PubMed Abstract|CrossRef Full Text|Google Scholar
O'Toole PW, Marchesi JR, Hill C. Next-generation probiotics: the spectrum from probiotics to live biotherapeutics.次世代プロバイオティクス:プロバイオティクスからライブバイオセラピューティックまでのスペクトル。ナット・マイクロバイオ(2017)2:17057.doi: 10.1038/nmicrobiol.2017.57
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Feuerstadt P, Louie TJ, Lashner B, Wang EEL, Diao L, Bryant JA, et al. SER-109, an oral microbiome therapy for recurrent clostridioides difficile infection.(再発性クロストリジウム・ディフィシル感染症に対する経口マイクロバイオーム療法). N Engl J Med (2022) 386:220-9. doi: 10.1056/NEJMoa2106516
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Henn MR, O'Brien EJ, Diao L, Feagan BG, Sandborn WJ, Huttenhower C, et al. スポアベースのマイクロバイオーム治療薬、SER-287の活動性の軽度~中等度潰瘍性大腸炎に対する第1b相安全性試験。Gastroenterology (2021) 160:115-127.e30. doi: 10.1053/j.gastro.2020.07.048
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Homayouni Rad A、Aghebati Maleki L、Samadi Kafil H、Abbasi A. Postbiotics.食物アレルギー治療における新規戦略。食物アレルギー治療における新規戦略。Crit Rev Food Sci Nutr (2021) 61:492-9. doi: 10.1080/10408398.2020.1738333.
PubMed Abstract|CrossRef Full Text|Google Scholar
マロットEK、アマトKR. 酪酸産生経路の存在量は、ヒトと非ヒト霊長類の腸内細菌群では類似している。このような場合、「酪酸産生経路はヒトと霊長類の腸内細菌の間で類似している。
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Zhang Z, Zhang H, Chen T, Shi L, Wang D, Tang D. Regulatory role of short-chain fatty acids in inflammatory bowel disease(短鎖脂肪酸の炎症性腸疾患における制御的役割)。Cell Commun Signal (2022) 20. doi: 10.1186/s12964-022-00869-5
クロスレフフルテキスト|Google Scholar
Russo E, Giudici F, Fiorindi C, Ficari F, Scaringi S, Amedei A. Immunomodulating activity and therapeutic effects of short chain fatty acids and tryptophan post-biotics in inflammatory bowel disease.炎症性腸疾患における短鎖脂肪酸とトリプトファンの治療効果. フロント・イミュノール(2019)10:2754. doi: 10.3389/fimmu.2019.02754
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Sinha SR, Haileselassie Y, Nguyen LP, Tropini C, Wang M, Becker LS, et al. Dysbiosis-induced secondary bile acid deficiency promotes intestinal inflammation(ディスバイオシスによる二次的胆汁酸欠乏は腸の炎症を促進する)。Cell Host Microbe (2020) 27:659-670.e5. doi: 10.1016/j.chom.2020.01.021
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Bernstein H, Bernstein C, Payne CM, Dvorakova K, Garewal H. Bile acids as carcinogens in human gastrointestinal cancers.ヒト消化器癌における胆汁酸の発癌性。Mutat Res (2005) 589:47-65.論文番号: 10.1016/j.mrrev.2004.08.001
PubMed Abstract|CrossRef Full Text|Google Scholar
Ajouz H, Mukherji D, Shamseddine A. Secondary bile acids: an underrecognized cause of colon cancer(二次胆汁酸:大腸癌の認識不足の原因)。ワールドJサージオンコル(2014)12:164.doi:10.1186/1477-7819-12-164
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Littmann ER, Lee J-J, Denny JE, Alam Z, Maslanka JR, Zarin I, et al. Host immunity modulates the efficacy of microbiota transplantation for treatment of clostridioides difficile infection.宿主免疫による微生物叢移植の有効性の調節。Nat Commun (2021) 12:755. doi: 10.1038/s41467-020-20793-x
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Zheng Y、Josefowicz S、Chaudhry A、Peng XP、Forbush K、Rudensky AY. Foxp3遺伝子の保存された非コード化DNA要素の制御性T細胞運命における役割。ネイチャー (2010) 463:808-12.
PubMed Abstract|CrossRef Full Text|Google Scholar
Whibley N, Tucci A, Powrie F. Regulatory T cell adaptation in the intestine and skin(腸と皮膚における制御性T細胞の適応)。Nat Immunol (2019) 20:386-96. doi: 10.1038/s41590-019-0351-z
PubMed Abstract|CrossRef Full Text|Google Scholar
Luu M, Steinhoff U, Visekruna A. Gut-resident regulatory T cellsの機能的異質性。Clin Transl Immunol (2017) 6:e156. doi: 10.1038/cti.2017.39
クロスレフフルテキスト|Google Scholar
Singh K, Hjort M, Thorvaldson L, Sandler S. Concomitant analysis of Helios and neuropilin-1 as a marker to detect thymic derived regulatory T cells in naïve mice.ナイーブマウスにおける胸腺由来制御性T細胞のマーカーとしてのヘリオスとニューロピリン-1の併用解析。サイ・レップ (2015) 5:7767. doi: 10.1038/srep07767
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Zhang S, Morgan X, Dogan B, Martin F-P, Strickler S, Oka A, et al. Mucosal metabolites fuel the growth and virulence of e. coli linked to crohn's disease.粘膜代謝産物は、クローン病に関連する大腸菌の増殖と毒性を促進する。JCI Insight (2022) 7. doi: 10.1172/jci.insight.157013
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Thiennimitr P, Winter SE, Winter MG, Xavier MN, Tolstikov V, Huseby DL, et al. Intestinal inflammation allows salmonella to use ethanolamine to compete with the microbiota.腸内炎症により、サルモネラはエタノールアミンを使って微生物叢と競合することができる。この論文では、サルモネラ菌が腸管でエタノールアミンを利用し、微生物と競合することを明らかにした。
PubMed Abstract|CrossRef Full Text|Google Scholar
クロストリジウム・ディフィシル感染症における糞便性カルプロテクチンと複数の微生物群移植輸液の必要性。J Gastroenterol Hepatol (2020) 35:1909-15. doi: 10.1111/jgh.15072
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Khoruts A, Rank KM, Newman KM, Viskocil K, Vaughn BP, Hamilton MJ, et al. 炎症性腸疾患は、再発性クロストリジウム・ディフィシル感染に対する糞便微生物移植の転帰に影響を与える。Clin Gastroenterol Hepatol (2016) 14:1433-8. doi: 10.1016/j.cgh.2016.02.018.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Hirten RP, Grinspan A, Fu S-C, Luo Y, Suarez-Farinas M, Rowland J, et al. 炎症性腸疾患のある患者とない患者におけるクロストリジウム・ディフィシルに対する便微生物移植の微生物生着と有効性. 炎症性腸疾患(2019)25:969-79. doi: 10.1093/ibd/izy398
クロスレフフルテキスト|Google Scholar
Kelly CR, Ihunnah C, Fischer M, Khoruts A, Surawicz C, Afzali A, et al. Fecal microbiota transplant for treatment of clostridium difficile infection in immunocompromised patients.(免疫不全患者におけるクロストリジウム・ディフィシル感染症治療のための糞便微生物移植)。Am J Gastroenterol (2014) 109:1065-71. doi: 10.1038/ajg.2014.133.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Moayyedi P, Surette MG, Kim PT, Libertucci J, Wolfe M, Onischi C, et al. Fecal microbiota transplantation induces remission in patients with active ulcerative colitis in a randomized controlled trial(無作為化比較試験において、腸内細菌叢移植が活動性潰瘍性大腸炎患者の寛解を誘発した。消化器病学(2015)149:102-109.e6. doi: 10.1053/j.gastro.2015.04.001
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Burrello C, Garavaglia F, Cribiù FM, Ercoli G, Lopez G, Troisi J, et al. Therapeutic faecal microbiota transplantation controls intestinal inflammation through IL10 secretion by immune cells.便微生物移植は、免疫細胞のIL10分泌を介して腸の炎症を制御する。Nat Commun (2018) 9:5184. doi: 10.1038/s41467-018-07359-8
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Wei Y-L、Chen Y-Q、Gong H、Li N、Wu K-Q、Hu W、et al. Fecal microbiota transplantation ameliorates experimentally induced colitis in mice by upregulating AhR.便内細菌叢移植はマウスの大腸炎を実験的に改善する。フロント・マイクロバイオル(2018)9:1921.doi: 10.3389/fmicb.2018.01921
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Kühn R, Löhler J, Rennick D, Rajewsky K, Müller W. Interleukin-10-deficient mice develop chronic enterocolitis. Cell (1993) 75:263-74.
PubMed Abstract|CrossRef Full Text|Google Scholar
Perry T, Jovel J, Patterson J, Wong G, Fedorak RN, Thiesen A, et al. 回腸切除後の糞便微生物移植はIL-10-/-マウスの回腸炎を軽減するが大腸炎は回復させる。Inflamm Bowel Dis (2015) 21:1479-90. doi: 10.1097/MIB.0000000000000383.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Chen G, Ran X, Li B, Li Y, He D, Huang B, et al. Sodium butyrate inhibits inflammation and maintaining epithelium barrier integrity in a TNBS-induced inflammatory bowel disease mice model. EBioMedicine (2018) 30:317-25. doi: 10.1016/j.ebiom.2018.03.030.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Pacheco RG, Esposito CC, Müller LCM, Castelo-Branco MTL, Quintella LP, Chagas VLA, et al. enema solutionにおける酪酸またはグルタミンの使用は実験転用大腸炎における炎症および線維化を減少させる。世界J Gastroenterol(2012)18:4278から87まで。
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhang M, Zhou Q, Dorfman RG, Huang X, Fan T, Zhang H, et al. Butyrate inhibits interleukin-17 and generates tregs to ameliorate colorectal colitis in rats.酪酸はインターロイキン17を抑制し、トレッグを生成し、ラットの大腸炎を改善する。BMC Gastroenterol (2016) 16:84. doi: 10.1186/s12876-016-0500-x
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Ng SC, Plamondon S, Kamm MA, Hart AL, Al-Hassi HO, Guenther T, et al. 急性潰瘍性大腸炎の治療におけるプロバイオティクス細菌およびステロイドのヒト腸管樹状細胞を介した免疫抑制効果。炎症性腸疾患(2010)16:1286-98。
CrossRef Full Text|Google Scholar
D'Incà R, Barollo M, Scarpa M, Grillo AR, Brun P, Vettorato MG, et al. Lactobacillus casei DGの直腸投与は、軽度潰瘍性大腸炎患者の大腸粘膜における細菌相組成およびtoll様受容体の発現を変化させた。DIG DIS SCI (2011) 56:1178-87.論文番号: 10.1007/s10620-010-1384-1
PubMed Abstract|CrossRef Full Text|Google Scholar
Lührs H, Gerke T, Müller JG, Melcher R, Schauber J, Boxberge F, et al. Butyrate inhibits NF-kappaB activation in lamina propria macrophages of patients with ulcerative colitis. 酪酸は潰瘍性大腸炎患者の辺縁部マクロファージにおけるNF-κBの活性化を抑制する。
PubMed Abstract|CrossRef Full Text|Google Scholar
Banday AH, Abdalla M. Immune Checkpoint inhibitors: 最近の臨床的進歩と将来の展望。Curr Med Chem (2022) 30. doi: 10.2174/0929867329666220819115849
クロスレフフルテキスト|Google Scholar
Pezo RC, Wong M, Martin A. Impact of the gut microbiota on immune checkpoint inhibitor-associated toxicities(腸内細菌叢の免疫チェックポイント阻害剤関連毒性への影響). セラップ・アドバンス・ガストロエンテロール(2019)12:1756284819870911. doi: 10.1177/1756284819870911
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Wang F、Yin Q、Chen L、Davis MM. ビフィズス菌は、CTLA-4遮断の文脈で腸管免疫病理を軽減することができる。プロック・ナトル・アカッド・サイ U.S.A. (2018) 115:157-61. doi: 10.1073/pnas.1712901115
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Sun S, Luo L, Liang W, Yin Q, Guo J, Rush AM, et al. Bifidobacterium alters the gut microbiota and modulates the functional metabolism of T regulatory cells in context of immune checkpoint blockade.ビフィズス菌は腸内細菌叢を変化させ、免疫チェックポイント遮断の文脈でT制御細胞の機能代謝を調節する。Proc Natl Acad Sci U.S.A. (2020) 117:27509-15. doi: 10.1073/pnas.1921223117.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Wang T, Zheng N, Luo Q, Jiang L, He B, Yuan X, et al. Probiotics lactobacillus reuteri abrogates immune checkpoint blockade-associated colitis by inhibiting group 3 innate lymphoid cells.プロバイオティクス乳酸菌は、グループ3自然リンパ系細胞を阻害することにより、免疫チェックポイント遮断関連性大腸炎を軽減する。フロント・イミュノール(2019)10:1235.doi: 10.3389/fimmu.2019.01235
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Renga G, Nunzi E, Pariano M, Puccetti M, Bellet MM, Pieraccini G, et al. 微生物のトリプトファン代謝物による免疫チェックポイント遮断の治療成績の最適化。J Immunother Cancer (2022) 10. doi: 10.1136/jitc-2021-003725
PubMed Abstract|CrossRef Full Text|Google Scholar
Wang Y, Wiesnoski DH, Helmink BA, Gopalakrishnan V, Choi K, DuPont HL, et al. 難治性免疫チェックポイント阻害剤関連大腸炎に対する便中微生物叢移植。ナットメッド(2018)24:1804-8. doi: 10.1038/s41591-018-0238-9
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Chen M, Liu M, Li C, Peng S, Li Y, Xu X, et al. Fecal microbiota transplantation effectively cure a patient with severe bleeding immune checkpoint inhibitor-associated colitis and a short review.糞便微生物移植は、重度の出血性免疫チェックポイント阻害剤関連大腸炎患者を効果的に治癒させた。フロントオンコル(2022)12:913217。
PubMed Abstract|CrossRef Full Text|Google Scholar
Saleh R, Elkord E. FoxP3(+) T regulatory cells in cancer: 予後バイオマーカーと治療標的。Cancer Lett (2020) 490:174-85. doi: 10.1016/j.canlet.2020.07.022
PubMed Abstract|CrossRef Full Text|Google Scholar
大腸がん患者における腫瘍内 CD8(+) T/FOXP3(+) 細胞比率は生存率予測マーカーである。Cancer Immunol Immunother (2010) 59:653-61・doi: 10.1007/s00262-009-0781-9
PubMed Abstract|CrossRef Full Text|Google Scholar
腎細胞癌患者における制御性 T 細胞の頻度および生存率との相関の検討。Cancer Immunol Immunother (2007) 56:1743-53.論文番号: 10.1007/s00262-007-0318-z
PubMed Abstract|CrossRef Full Text|Google Scholar
Routy B, Le Chatelier E, Derosa L, Duong CPM, Alou MT, Daillère R, et al. Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors.上皮性腫瘍に対するPD-1ベース免疫療法の効果に影響を及ぼす腸内細菌。サイエンス(2018)359:91-7. doi: 10.1126/science.aan3706
PubMed Abstract|CrossRef Full Text|Google Scholar
Tanoue T, Morita S, Plichta DR, Skelly AN, Suda W, Sugiura Y, et al. 定義されたコミュナルコンソーシウムはCD8 T細胞および抗がん性免疫を誘発する。ネイチャー(2019)565:600-5. doi: 10.1038/s41586-019-0878-z
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Si W, Liang H, Bugno J, Xu Q, Ding X, Yang K, et al. Lactobacillus rhamnosus GGはcGAS/STING-依存型I型インターフェロンを誘導し、免疫チェックポイント遮断に対する応答を改善する。Gut (2022) 71:521-33. doi: 10.1136/gutjnl-2020-323426
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Baruch EN, Youngster I, Ben-Betzalel G, Ortenberg R, Lahat A, Katz L, et al. Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients.便中微生物移植は、免疫療法不応性メラノーマ患者の反応を促進する。サイエンス (2021) 371:602-9. doi: 10.1126/science.abb5920
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Dizman N, Meza L, Bergerot P, Alcantara M, Dorff T, Lyou Y, et al. Nivolumab plus ipilimumab with or without live bacterial supplementation in metastatic renal cell carcinoma: a randomized phase 1 trial. Nat Med (2022) 28:704-12. doi: 10.1038/s41591-022-01694-6
PubMed Abstract|CrossRefフルテキスト|Google Scholar
野村美樹、長友亮、土井健一、清水順一、馬場和彦、斎藤哲也、他 固形がん腫瘍患者におけるニボルマブまたはペムブロリズマブによる治療に対する臨床反応と腸内マイクロバイオームにおける短鎖脂肪酸の関連性. JAMA Netw Open (2020) 3:e202895. doi: 10.1001/jamanetworkopen.2020.2895.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Botticelli A, Vernocchi P, Marini F, Quagliariello A, Cerbelli B, Reddel S, et al. 免疫療法治療中の非小細胞肺がん(NSCLC)患者の腸内メタボロミクスプロファイリング. J Transl Med (2020) 18:49. doi: 10.1186/s12967-020-02231-0
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Monaghan T, Mullish BH, Patterson J, Wong GK, Marchesi JR, Xu H, et al. ヒトの再発性クロストリジオイデスディフィシル感染に対する有効な糞便微生物移植は、胆汁酸-ファルネソイドX受容体-線維芽細胞増殖因子経路のシグナルの増加に関連しています。腸内細菌(2019)10:142-8. doi: 10.1080/19490976.2018.1506667
PubMed Abstract|CrossRef Full Text|Google Scholar
Gadaleta RM, van Erpecum KJ, Oldenburg B, Willemsen ECL, Renooij W, Murzilli S, et al. Farnesoid X receptor activation inhibits inflammation and preserves the intestinal barrier in inflammatory bowel disease.ファルネソイドX受容体活性化により、炎症性腸疾患において腸管バリアが維持される。Gut (2011) 60:463-72.論文番号: 10.1136/gut.2010.212159
PubMed Abstract|CrossRef Full Text|Google Scholar
Theriot CM, Bowman AA, Young VB. 抗生物質による腸内細菌叢の変化は、二次胆汁酸産生を変化させ、大腸におけるクロストリジウム・ディフィシルの芽胞発芽とアウトグロースを可能にする。 mSphere (2016) 1. doi: 10.1128/mSphere.00045-15
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Monaghan TM, Seekatz AM, Markham NO, Yau TO, Hatziapostolou M, Jilani T, et al. 再発性クロストリジオイデスディフィシル感染に対する便微生物叢移植は、循環マイクロRNAの機能変化と関連しています。胃腸病学(2021)161:255-270.e4. doi: 10.1053/j.gastro.2021.03.050
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Gebert LFR, MacRae IJ. 動物におけるマイクロRNAの機能制御。Nat Rev Mol Cell Biol (2019) 20:21-37. doi: 10.1038/s41580-018-0045-7
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Cowardin CA, Buonomo EL, Saleh MM, Wilson MG, Burgess SL, Kuehne SA, et al. バイナリー毒素CDTは、保護的な大腸好酸球を抑制することによってクロストリジウム・ディフィシレの病原性を高める。Nat Microbiol (2016) 1:16108. doi: 10.1038/nmicrobiol.2016.108.
PubMed Abstract|CrossRef Full Text|Google Scholar
Buonomo EL、Cowardin CA、Wilson MG、Saleh MM、Pramoonjago P、Petri WAJ.Buonomo、Cowardin CA、Saleh MM、Pramoonjago P、Petri WAJ. 微生物が制御するIL-25は、クロストリジウム・ディフィシル感染時に好酸球数を増加させ、保護を提供します。セルレップ(2016)16:432-43. doi: 10.1016/j.celrep.2016.06.007
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Cook L, Rees WD, Wong MQ, Peters H, Levings MK, Steiner TS.(クック・エル、リーズWD、ウォンMQ、ピーターズH、レビングスMK、スタイナーTS)。再発したクロストリジョイデスディフィシル感染に対する糞便微生物叢移植は、c difficile毒素bに対する適応免疫を強化する。 Gastroenterology (2021) 160:2155-2158.e4. doi: 10.1053/j.gastro.2021.01.009
PubMed Abstract|CrossRefフルテキスト|Google Scholar
van Schaik W. The human gut resistome. Philos Trans R Soc Lond B Biol Sci (2015) 370:20140087. doi: 10.1098/rstb.2014.0087.
PubMed Abstract|CrossRef Full Text|Google Scholar
Magiorakos A-P, Srinivasan A, Carey RB, Carmeli Y, Falagas ME, Giske CG, et al. 多剤耐性、広範囲薬剤耐性、パンドラッグ耐性菌:獲得耐性に関する暫定標準定義の国際専門家提案. 臨床微生物感染症(2012)18:268-81.doi: 10.1111/j.1469-0691.2011.03570.x.
PubMed Abstract|CrossRef Full Text|Google Scholar
Jouhten H, Mattila E, Arkkila P, Satokari R. 糞便微生物移植後の再発性クロストリジウム・ディフィシル感染症患者の腸内細菌叢における抗生物質耐性遺伝子の減少。Clin Infect Dis (2016) 63:710-1. doi: 10.1093/cid/ciw390
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Gopalsamy SN, Woodworth MH, Wang T, Carpentieri CT, Mehta N, Friedman-Moraco RJ, et al. 多剤耐性菌による腸内コロニー形成を除去するためのマイクロバイオーム回復治療薬の使用。Am J Med Sci (2018) 356:433-40. doi: 10.1016/j.amjms.2018.08.015
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Mahieu R, Cassisa V, Hilliquin D, Coron N, Pailhoriès H, Kempf M, et al. faecal microbiota transplantation on mouse digestive colonization with two extensively resistant bacteria.便内細菌移植の影響について。J Infect (2017) 75:75-7. doi: 10.1016/j.jinf.2017.04.008.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Gargiullo L, Del Chierico F, D'Argenio P, Putignani L. Gut microbiota modulation for multidrug-resistant organism decolonization(多剤耐性菌の除染のための腸内細菌叢の調節。現在と将来の展望。フロント・マイクロバイオル(2019)10:1704. doi: 10.3389/fmicb.2019.01704
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Li X, Song L, Zhu S, Xiao Y, Huang Y, Hua Y, et al. 2株の乳酸菌は、マウスモデルにおけるVREのコロニー形成を効果的に減少させる。Front Cell Infect Microbiol (2019) 9:6. doi: 10.3389/fcimb.2019.00006
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Eggers S, Barker AK, Valentine S, Hess T, Duster M, Safdar N. Effect of lactobacillus rhamnosus HN001 on carriage of staphylococcus aureus: results of the impact of probiotics for reducing infections in veterans (IMPROVE) study. BMCインフェクト・ディス(2018)18:129.doi:10.1186/s12879-018-3028-6
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Caballero S, Kim S, Carter RA, Leiner IM, Sušac B, Miller L, et al. Cooperating commensals restore colonization resistance to vancomycin-resistant enterococcus faecium.協力的な常在菌は、バンコマイシン耐性エンテロコッカス・フェシウムに対するコロニー形成耐性を回復させる。Cell Host Microbe (2017) 21:592-602.e4. doi: 10.1016/j.chom.2017.04.002
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Ubeda C, Bucci V, Caballero S, Djukovic A, Toussaint NC, Equinda M, et al. Barnesiella種を含む腸内細菌叢はバンコマイシン耐性腸球菌のコロニー形成を治す。インフェク ト・イミュン (2013) 81:965-73.
PubMed Abstract|CrossRef Full Text|Google Scholar
Kim SG, Becattini S, Moody TU, Shliaha PV, Littmann ER, Seok R, et al. Microbiota-derived lantibiotic restores resistance against vancomycin-resistant enterococcus.(マイクロバイオータ由来のランティバイオティックはバンコマイシン耐性腸球菌に対する耐性を回復させる。ネイチャー(2019)572:665-9. doi: 10.1038/s41586-019-1501-z
PubMed Abstract|CrossRef Full Text|Google Scholar
Sazawal S、Hiremath G、Dhingra U、Malik P、Deb S、Black RE. このような場合、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。Lancet Infect Dis (2006) 6:374-82(英語) doi: 10.1016/S1473-3099(06)70495-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Harper A, Vijayakumar V, Ouwehand AC, Ter Haar J, Obis D, Espadaler J, et al. Viral infections, the microbiome, and probiotics.ウイルス感染症、マイクロバイオーム、プロバイオティクス。Front Cell Infect Microbiol (2020) 10:596166.doi: 10.3389/fcimb.2020.596166
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Botić T, Klingberg TD, Weingartl H, Cencic A. A novel eukaryotic cell culture model to study antiviral activity of potential probiotic bacteria(潜在的プロバイオティクス細菌の抗ウイルス活性を研究するための新規真核細胞培養モデル). Int J Food Microbiol (2007) 115:227-34. doi: 10.1016/j.ijfoodmicro.2006.10.044.
PubMed Abstract|CrossRef Full Text|Google Scholar
Quintana VM, Torres NI, Wachsman MB, Sinko PJ, Castilla V, Chikindas M. Antiherpes simplex virus type 2 activity of the antimicrobial peptide subtilosin.(抗菌ペプチド・サブチロシンの単純ヘルペスウイルス2型に対する活性)。J Appl Microbiol (2014) 117:1253-9. doi: 10.1111/jam.12618.
PubMed Abstract|CrossRef Full Text|Google Scholar
Su Y, Zhang B, Su L. 乳酸菌から検出されたCD4は、乳酸菌とHIVの相互作用を理解するのに役立つ。このような場合、「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」「痒いところに手が届く」。
PubMed Abstract|CrossRef Full Text|Google Scholar
Wu S, Jiang Z-Y, Sun Y-F, Yu B, Chen J, Dai C-Q, et al. Microbiota regulates the TLR7 signaling pathway against respiratory tract influenza a virus infection(微生物が気道インフルエンザウイルス感染に対するTLR7シグナル経路を調節する)。Curr Microbiol (2013) 67:414-22. doi: 10.1007/s00284-013-0380-z
PubMed Abstract|CrossRef Full Text|Google Scholar
Ganal SC, Sanos SL, Kallfass C, Oberle K, Johner C, Kirschning C, et al. Nonmucosal mononuclear phagocytesによるナチュラルキラー細胞のプライミングには、常在菌の微生物叢からの指示的な信号が必要です。免疫 (2012) 37:171-86.
PubMed Abstract|CrossRef Full Text|Google Scholar
Abt MC, Osborne LC, Monticelli LA, Doering TA, Alenghat T, Sonnenberg GF, et al. Commensal bacteria calibrate the activation threshold of innate antiviral immunity. 免疫 (2012) 37:158-70.参照: 10.1016/j.immuni.2012.04.011
PubMed Abstract|CrossRef Full Text|Google Scholar
Winkler ES, Shrihari S, Hykes BLJ, Handley SA, Andhey PS, Huang Y-JS, et al. 腸内マイクロバイオームは胆汁酸型IFNシグナル軸を介してアルファウイルスの感染および拡散を抑制する。Cell (2020) 182:901-918.e18. doi: 10.1016/j.cell.2020.06.029
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Yang X-L, Wang G, Xie J-Y, Li H, Chen S-X, Liu W, et al. 腸内マイクロバイオームは、I型インターフェロンを介して腸内ウイルス全身感染に対する宿主自然免疫のプライミングを行う。 mBio (2021) 12. doi: 10.1128/mBio.00366-21.
クロスレフフルテキスト|Google Scholar
Aziz N, Bonavida B. プロバイオティクスによるナチュラルキラー細胞の活性化。For Immunopathol Dis Therap (2016) 7:41-55. doi: 10.1615/ForumImmunDisTher.2016017095
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Park M-K, Ngo V, Kwon Y-M, Lee Y-T, Yoo S, Cho Y-H, et al. Lactobacillus plantarum DK119 as a probiotic confers protection against influenza virus by modulating innate immunity.インフルエンザウイルスに対するプロバイオティクスとしての乳酸菌DK119は、自然免疫を調節することにより、インフルエンザウイルスに対する防御効果を発揮する。プロバイオティクスとしての乳酸菌DK119は、自然免疫を調節することでインフルエンザウイルスに対する防御効果を発揮する。
PubMed Abstract|CrossRef Full Text|Google Scholar
Kumova OK、Fike AJ、Thayer JL、Nguyen LT、Mell JC、Pascasio J、他 感染新生児の肺の転写無反応および初期インフルエンザウイルス制御の喪失は、経鼻乳酸菌ラムノサスGGにより防止される。PloS Pathog (2019) 15:e1008072. doi: 10.1371/journal.ppat.1008072.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Steed AL, Christophi GP, Kaiko GE, Sun L, Goodwin VM, Jain U, et al. 微生物代謝物デサミノチロシンは、I型インターフェロンを介してインフルエンザから保護される。サイエンス (2017) 357:498-502. doi: 10.1126/science.aam5336
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Wang Y, Liu L, Moore DJ, Shen X, Peek RM, Acra SA, et al. LGG由来タンパク質は、腸管上皮細胞におけるAPRIL発現のアップレギュレーションを通じてIgA産生を促進する。Mucosal Immunol (2017) 10:373-84. doi: 10.1038/mi.2016.57
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Song JA, Kim HJ, Hong SK, Lee DH, Lee SW, Song CS, et al. 乳酸菌ラムノサスM21の経口摂取は、インフルエンザウイルスに致死感染したマウスの生存率を向上させる。J Microbiol Immunol Infect (2016) 49:16-23. doi: 10.1016/j.jmii.2014.07.011
PubMed Abstract|CrossRef Full Text|Google Scholar
Holscher HD, Czerkies LA, Cekola P, Litov R, Benbow M, Santema S, et al. Bifidobacterium lactis Bb12 enhances intestinal antibody response in formula-fed infants: a randomized, double-blind, controlled trial.ビフィズス菌の腸管抗体反応は、粉ミルク育児児に有効である。JPEN J Parenter Enteral Nutr (2012) 36:106S-17S. doi: 10.1177/0148607111430817
PubMed Abstract | CrossRef Full Text | Google Scholar
Ramakrishna C, Kujawski M, Chu H, Li L, Mazmanian SK, Cantin EM. Bacteroides fragilis polysaccharide aは、ウイルス性脳炎を予防するIL-10分泌b細胞およびT細胞を誘導する。Nat Commun (2019) 10:2153. doi: 10.1038/s41467-019-09884-6
PubMed Abstract|CrossRef Full Text|Google Scholar
Nguyen QV、Chong LC、Hor Y-Y、Lew L-C、Rather IA、Choi S-B. COVID-19の管理におけるプロバイオティクスの役割。計算論的な視点。Nutrients (2022) 14. doi: 10.3390/nu14020274
PubMed Abstract|CrossRef Full Text|Google Scholar
Bottari B, Castellone V, Neviani E. Probiotics and covid-19. を用いた。
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Li SS, Zhu A, Benes V, Costea PI, Hercog R, Hildebrand F, et al. 糞便微生物叢移植後のドナー株とレシピエント株の耐久性のある共存状態。サイエンス (2016) 352:586-9. doi: 10.1126/science.aad8852
PubMed Abstract|CrossRef Full Text|Google Scholar
Smillie CS, Sauk J, Gevers D, Friedman J, Sung J, Youngster I, et al. Strain tracking reveals the determinants of bacterial engraftment in the human gut following fecal microbiota transplantation(株追跡により、糞便微生物移植後のヒト腸管における細菌移植の決定要因を明らかにする)。セルホストマイクロビー(2018)23:229-240.e5.doi:10.1016/j.chom.2018.01.003
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Moss EL, Falconer SB, Tkachenko E, Wang M, Systrom H, Mahabamunuge J, et al. 免疫不全患者における糞便微生物移植後のドナー細菌株からの長期分類学的および機能的分岐. PloS One (2017) 12:e0182585. doi: 10.1371/journal.pone.0182585.
PubMed Abstract|CrossRef Full Text|Google Scholar
Kootte RS、Levin E、Salojärvi J、Smits LP、Hartstra AV、Udayappan SD、他 メタボリックシンドロームにおけるリーンドナーフーズ後のインスリン感受性の改善は、ベースラインの腸内細菌叢組成によって駆動される。セルメターブ(2017)26:611-619.e6. doi: 10.1016/j.cmet.2017.09.008
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Zeevi D, Korem T, Zmora N, Israeli D, Rothschild D, Weinberger A, et al. 糖質反応予測によるパーソナライズされた栄養摂取。セル (2015) 163:1079-94. doi: 10.1016/j.cell.2015.11.001.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
キーワード:粘膜免疫、制御性T細胞、糞便微生物叢移植、プロバイオティクス、生きたバイオ治療製品、C. difficile、微生物を用いた治療法、免疫チェックポイント阻害剤
引用 Alam MZ, Maslanka JR and Abt MC (2023) Immunological consequences of microbiome-based therapeutics. Front. Immunol. 13:1046472。doi: 10.3389/fimmu.2022.1046472
Received: 2022年9月16日; Accepted: 2022年12月16日
公開:2023年1月12日
編集者
ケビン・マロイ、グラスゴー大学、イギリス
査読者:クラリッサ・キャンベル、オーストリア科学アカデミー、イギリス
クラリッサ・キャンベル オーストリア科学アカデミー(OeAW)、オーストリア
Katie L. Alexander, アラバマ大学バーミンガム校, アメリカ合衆国
Copyright © 2023 Alam, Maslanka and Abt. これは、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文である。原著者および著作権者のクレジットを記載し、本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製が許可されています。本規定に従わない使用・配布・複製は認めない。
*Correspondence: Michael C. Abt, Michael.abt@pennmedicine.upenn.edu
免責事項:本論文で表明されたすべての主張は,あくまでも著者のものであり,必ずしも所属機関のもの,あるいは出版社,編集者,査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはそのメーカーが行う可能性のある主張は、出版社によって保証または承認されるものではありません。
この人はこんな商品も見ています
生物防除剤Trichoderma stromaticumへの暴露は、マウスメラノーマを注射したマウスの癌の発生を増加させる
Uener R. dos Santos, Marliete C. Costa, Gustavo J. C. de Freitas, Flávia S. de Oliveira, Bianca R. Santos, Juno F. Silva, Daniel A. Santos, Adriana A. M. Dias, Luciana D. de Carvalho, Danillo G. AugustoおよびJane L. dos Santos
ヘテロ二量体IL-15(hetIL-15)は、TNBCの4T1マウスモデルにおいて、化学療法と手術を改善する循環腫瘍細胞と転移形成を減少させる
Vasiliki Stravokefalou, Dimitris Stellas, Sevasti Karaliota, Bethany A. Nagy, Antonio Valentin, Cristina Bergamaschi, Konstantinos Dimas 及び George N. Pavlakis
食用菌由来の生理活性タンパク質の免疫調節機能
Juan Xu, Dazhong Xu, Qiuhui Hu, Ning Ma, Fei Pei, Anxiang Su, Gaoxing Ma.
アッケシソウとその代謝物のマウス カンピロバクター症治療における重要な役割
ライ・ジャン、チュンチュン・ユアン、ウェンシン・イェ、チシン・ファン、ズオ・チェン、ウェンジ・ウー、リチュン・チアン
オミクロン時代およびプレオミクロン時代における小児の自然感染およびワクチン接種後のSARS-CoV-2に対する免疫期間。臨床的および免疫学的研究のシステマティックレビュー
ダニロ・ブオンセンソ、フランチェスカ・クセンツァ、ルクレツィア・パッサドーレ、フランチェスカ・ボナンノ、クラウディア・デ・グイド、スザンナ・エスポシト
この記事が気に入ったらサポートをしてみませんか?
