腸管再生を制御する間質ニッチシグナル
メインコンテンツへスキップメインメニューへスキップ
細胞分子消化器病学・肝臓病学
ログイン
メインメニュー
検索...
総説|第17巻、第5号、p679-685、2024年
全号ダウンロード
腸管再生を制御する間質ニッチシグナル
https://www.cmghjournal.org/article/S2352-345X(24)00031-6/fulltext?utm_medium=Social&utm_campaign=AGA-posts&utm_source=twitter
ヘレン・E・アブド
シャニカ・L・アマラシンハ
ダイアナ・ミカティ
ティエリー・ジャルデ オープンアクセス掲載:2024年02月08日DOI:https://doi.org/10.1016/j.jcmgh.2024.02.003
PlumXメトリクス
間質細胞集団は、腸上皮の維持、分化、機能を支えるシグナルを提供する上で中心的な役割を担っている。上皮細胞の挙動や運命は、幹細胞や前駆細胞のアイデンティティを維持したり、分化を促進したりする間質細胞の空間的組織化によって方向付けられる。単一細胞解析、マウスモデル、オルガノイド共培養アッセイを組み合わせることで、間質細胞から伝達されるシグナルの多様性についての知見が得られた。シグナル伝達の勾配は、陰窩-絨毛軸に沿ったシグナル伝達のアゴニストとアンタゴニストの発現によって確立され、微調整されている。上皮が傷害を受けると、間質細胞集団の存在量と構成に乱れが生じる。また、上皮のリモデリングに影響を与えるこれらの細胞から発信されるシグナルにも明確な変化がある。これらのシグナルがどのように協調して炎症性腸疾患における上皮の修復や組織傷害を維持するかが明らかになりつつある。これらのプロセスを理解することは、病態を改善する戦略として間質細胞集団を標的とする機会をもたらすかもしれない。
キーワード
腸
ニッチ
再生
幹細胞
間質細胞
毛細血管細胞
栄養細胞
本稿で使用した略語:
BMP(bone morphogenic protein)、DSS(dextran sulfate sodium)、EGF(epidermal growth factor)、GREM(gremlin)、IL(interleukin)、NRG1(neuregulin-1)、PDGFRA(platelet-derived growth factor receptor alpha)、RSPO(R-spondin)、scRNA-seq(single-cell RNA sequencing)。
概要
腸管は、未分化幹細胞、増殖性前駆細胞、および特定のドメインに組織化された特殊化分化細胞からなる、非常に動的な上皮単層によって裏打ちされている。上皮のターンオーバーは、陰窩の底部に存在する幹細胞集団によって促進され、細胞産生と分化のバランスが保たれるように、周囲のニッチ環境からのシグナルに依存している。ハンス・クレバース(Hans Clevers)の研究室で先駆的に行われた独創的な研究では、マウスの小腸において、幹細胞と直接接触しているパネス細胞が多くの制御分子の供給源であることが同定された2。上皮細胞の決定を調整する中核的なシグナル伝達経路は、WNT、NOTCH、骨形成タンパク質(BMP)、および上皮成長因子(EGF)/ノイレグリン-1(NRG1)シグナル伝達経路である。腸の上皮ライニングは内腔内容物と直接接触しており、損傷に対して非常に脆弱であるため、間質細胞とそれらが分泌するシグナルが、損傷後の組織を回復させるためにどのように適応するのかを解明することは、腸疾患の理解の鍵となる。特定の間質ニッチ集団とそれらが産生する因子を同定することは困難であった。なぜなら、間質マーカーは複数の細胞集団で発現され、細胞の表現型はその微小環境内のシグナルに影響され、傷害や疾患の状態は間質細胞集団に影響を与えるからである。高解像度組織イメージング、単一細胞解析、機能的研究を組み合わせることにより、間葉内の細胞の不均一性に関するより明確な像が明らかになりつつある。
間充織内の細胞からのシグナルが上皮細胞の運命を制御する
異なるニッチシグナルが協調して上皮細胞の運命を制御している。カノニカルWNTシグナルは、陰窩内で幹細胞と増殖細胞を維持するのに必須である。このことは、マウス小腸において、上皮内の主要な細胞内メディエーターであるCtnnb111とTcf412をノックアウトし、WNTの分泌を阻害することで証明されている9,13。WNT3はマウス腸管内のパネス細胞から分泌されるが、トランスジェニックマウスの腸管上皮細胞におけるWNT3の欠失は、腸管幹細胞の維持には必要ない。従って、WNTの主な供給源は間充織の上皮下細胞である14, 15, 16。WNTリガンドは、幹細胞や前駆細胞の細胞表面にあるFZDレセプターと相互作用する17。分泌型R-スポンジン(RSPO)シグナルは、幹細胞内に特異的に存在するLGR5レセプターと相互作用してWNTシグナルを増強し、幹細胞を未分化状態に維持するのに必要な高い閾値のWNTシグナルを生成する1,18、 19,20分泌型WNT阻害剤と活性化WNTリガンドおよび増強剤の組み合わせにより、WNTシグナル伝達の勾配は、陰窩基部で最も高く、分化細胞コンパートメント内で最も低くなる。
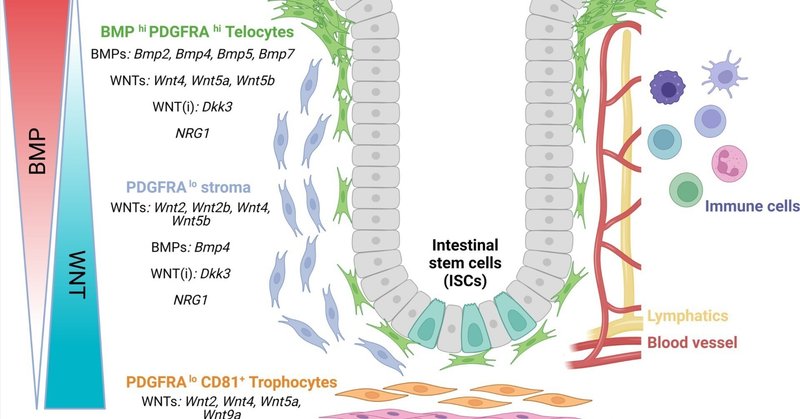
WNTとは対照的に、BMPシグナルは細胞増殖を抑制する。陰窩-絨毛軸に沿ったBMP経路成分の解析から、活性化因子と阻害因子の勾配がWNTとは逆であり、分化した上皮細胞のゾーンで最も高いシグナルが維持されていることが明らかになった(図1)。具体的には、NogginやGremlin 1(GREM1)などの間質ニッチ由来のBMP阻害分子は、陰窩底部でのBMPシグナル伝達を抑制し、幹細胞や前駆細胞の増殖を可能にするのに必要である。一方、BMP活性化因子であるBMP2、BMP4、BMP5、BMP7は、絨毛コンパートメントに位置する間質細胞によって産生され、場所依存的に腸細胞サブタイプの分化をサポートする22。
図サムネイルgr1
図1間葉ニッチにおける細胞集団の分布。間質細胞集団は陰窩-絨毛軸に沿って分布している。これにはBMPを発現する上皮下PDGRFAhiテロサイト、PDGFRAlo間質、WNT2BとRSPOを発現する深部クリプトPDGFRAlo、CD81+トロフォサイトが含まれる。免疫細胞、血管、リンパ管内皮などの他の細胞タイプも重要なシグナルを供給する。
図はBioRender.comで作成。
大きな画像を見るダウンロード 高解像度画像
細胞の決定を支配するもう一つの重要な経路はNOTCHシグナル伝達経路であり、これは上皮細胞内で側方阻害を介して作動し、細胞の運命を制御する。
最後に、EGFファミリーのリガンドから供給される増殖シグナルは、上皮の維持に不可欠である。
支持間質細胞における細胞組織とシグナル源
上皮は、成長因子や細胞外マトリックスを産生する間質細胞を含む数多くの細胞タイプによって支えられている(図1)。間質細胞集団の多様性は、高解像度顕微鏡、蛍光タグで細胞をマークするノックインマウスモデル、単一細胞RNA配列決定(scRNA-seq)によって特徴付けられてきた。これらの技術を組み合わせることで、ニッチの組織化に関する空間的・分子的理解が進みつつあるが、これらのアプローチにはそれぞれ限界がある。免疫染色は抗体の特異性に依存しており、単一細胞解析のための分離方法は、細胞に損傷を与えたり、発現プロファイルを変化させたりする可能性がある。ニッチ細胞とシグナルの機能的意義は、Creを介したノックアウト・マウス・モデルやオルガノイド共培養を用いて研究されてきた。これらの表現型は、Creドライバーの細胞特異性の限界や、一部の間質細胞のタモキシフェンに対する抵抗性によっても混乱することがある32。
このような課題にもかかわらず、形態、空間的位置、発現プロフ ァイルによって定義される様々な間葉系間質細胞集団を説明する ことができる(図1)。長い突起を持つ広範な細胞質を特徴とするテロサイトとして知られる重要な上皮下細胞集団は、Foxl1-cre駆動GFPシステムを用いて、陰窩の底部から絨毛の頂部まで可視化されている9,33。重要なことは、ジフテリア毒素受容体を介した細胞ノックアウトトランスジェニックマウスモデルを用いてFoxl1陽性細胞を切除したところ、陰窩と絨毛の長さが大きく減少し、幹細胞と増殖細胞がほぼ完全に消失するなど、腸管構造が劇的に変化したことである9。同様の表現型は、Foxl1陽性細胞で特異的にWNT分泌が阻害された場合にも観察された6,33。重要なことは、Foxl1の発現は、いくつかの異なる間質細胞集団と重複している可能性が高いことで、バルクRNA配列決定によってWNT活性化因子とBMP阻害因子の両方が同時に発現していることから明らかになった。したがって、毛細血管細胞の分子シグネチャーは、陰窩-絨毛軸に沿った位置によって規定されることが示唆された。
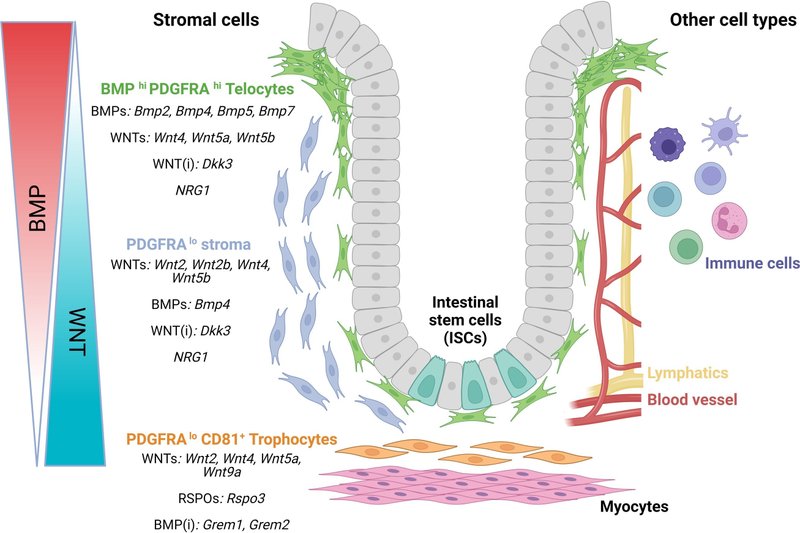
マウス腸管組織のscRNA-seq解析により、間質マーカー(血小板由来成長因子受容体α[PDGFRA])の差次的発現に基づいて、この細胞の不均一性を同定し、特徴付けることができた(図2A)。実際、PDGFRAの高発現によって定義されるテロサイトは、陰窩と絨毛の上部に集まり、いくつかのBMP、LGR5、非カノニカルWNT5Aを発現するが、WNT2B34はほとんど発現しない(図2C)。
図サムネイルgr2
図2恒常性と再生におけるニッチシグナルの発現。GSE130681,6マウス小腸GSE116514,25健常およびDSS処理結腸GSE114374.5からのマウスPDGFRA選別細胞および間葉系全体からのデータを統合した(A)PDGFRAおよびCD81レベルに基づく別個の細胞クラスターのUMAP可視化。DoubletFinder36を用いて潜在的なダブレットを除去し、CellMarkerDB37を用いて細胞のアノテーションを行った。PDGFRAとCD81レベルに基づくデータセットの分離。(C)DSS投与マウスと比較したコントロールにおける主要シグナルの相対発現。
大きな画像を見るダウンロード 高解像度画像
一方、PDGFRAlo細胞の1集団は固有層に存在するが、陰窩の深部、外膜筋の直上には、CD81で示されるPDGFRAloトロフォサイトが存在する8,21。トロフォサイトはWNT2B、GREM1、RSPO3を発現し(図2C)、生体外で共培養するとマウス小腸オルガノイドを維持する。PDGFRAlo間質細胞もまた、共培養でオルガノイドを支持することができるが、BMPに暴露されると、これらの細胞におけるRSPO3とGREM1の発現を低下させるため、これは阻害される。
ヒト腸管間葉系細胞集団のscRNA-seq解析でも、同様の間質細胞クラスターが同定されている7,28,38,39。40 PDGFRAlo CD81loおよびPDGFRAhigh集団内で発現するもう一つの重要なシグナルは、EGFファミリーメンバーであるNRG1である(図2B)。NRG1はマウスやヒトの腸管オルガノイド培養の成長と分化に影響を与えることが示されている28, 29, 30。
損傷後の細胞変化と主要シグナル
上皮の先端表面は、食品、細菌、細菌性副産物、毒素、機械的ストレスなどの複雑な環境にさらされている。これにより上皮は傷害を受けるが、幹細胞の活性により速やかに修復される。傷害を受けると、上皮バリアが破壊され、炎症が起 こり、微生物や毒素が流入し、腸上皮にさらなる傷害を引き 起こす。この回復メカニズムにはかなりの細胞可塑性が関与しており、Yes関連タンパク質のシグナル伝達と、胎児の初期化シグネチャーの再活性化に依存している。
この修復プロセスを仲介するニッチ細胞の役割が明らかになりつつあり、傷害と再生の時間経過におけるニッチ細胞の組成の変化と、上皮に影響を与えるシグナルが明らかになっている。
デキストラン硫酸ナトリウム(DSS)を介した急性損傷と修復期における異なるタイムポイントでのマウス結腸のscRNA-seq解析から、炎症、損傷、修復の過程で上皮細胞、間質細胞、筋線維芽細胞、グリア細胞の数が徐々に減少するなど、結腸微小環境の複雑なリモデリングが示唆されている37。驚くべきことに、間質細胞はシグナル伝達分子の主要な供給源であり、黄砂が介在する傷害と修復の間に様々な細胞集団と相互作用することから、これらの特殊な細胞は潜在的な細胞間情報伝達のハブであることが示唆される(図2C)37。同様に、潰瘍性大腸炎患者のヒト組織においても、炎症性間質サブセットの拡大や出現を含む間充織の細胞リモデリングが観察される7,51。炎症性間質サブセットはインターロイキン(IL)33、IL6、TNFSF14(LIGHT)を高発現しており、上皮幹細胞集団に影響を与えている可能性がある。また別の研究では、炎症関連線維芽細胞がIL11、IL24、IL13RA2を発現していることも発見された51。
WNTリガンド、WNT増強剤(RSPO)、BMP阻害剤、NRG1な ど、ニッチに由来する様々な必須シグナルが傷害に対 応して産生される(図2)。組織修復におけるこれらのシグナルの必要 性を示すために、トランスジェニックマウスモデルを 含むいくつかのアプローチが用いられてきた。例えば、間質WNTが存在しないマウスでは、放射線誘発 傷害後の腸上皮再生が損なわれる。同様に、DSS処理後のマウス大腸では間質Grem1の高レベルが検出され、Grem1の過剰発現によるBMPシグナル伝達の遺伝子操作は、効率的な組織修復をサポートする52。最後に、5-FUおよび放射線障害マウスモデルの両方において、Nrg1の発現はPDGRFA陽性間質細胞で誘導され、Nrg1の欠損は再生陰窩における増殖細胞および幹細胞の数を減少させる29。
炎症性腸疾患の新たな治療法開発への示唆
間質ニッチ微小環境のリモデリングとその分子ネットワークの再配線は、炎症性大腸組織の基本的特徴である。これらの過程を明らかにすることは、薬剤耐性のメカニズムを解明したり、新規治療法を開発したりするための重要なステップである。最近のこの分野の進歩により、潰瘍性大腸炎患者に特有な炎症関連間質細胞が、抗腫瘍壊死因子治療に耐性を示す患者に濃縮されていることが証明された51。さらに、抗腫瘍壊死因子抵抗性の遺伝子シグネチャーは、これらの特有な間質細胞のシグネチャーと正の相関がある51。同様に、複数の炎症性腸疾患治療における治療不応答の分子的特徴は、炎症性間質細胞に濃縮されている53。興味深いことに、LOX酵素の不可逆的阻害剤であるβ-アミノプロピオニトリルで治療した大腸炎マウスでは、酸化的損傷が減少し、病状が改善した。このことは、間質細胞を標的とすることが、腸疾患に対する新たな治療法開発のための有力な経路になりうるという考えを支持するものである7。
今後の方向性
大腸の炎症と修復における細胞リモデリングと細胞間情報伝達の深い理解から、間質細胞の特定の亜集団が介在する炎症を抑制すると同時に、他の線維芽細胞集団が介在する幹細胞や上皮の増殖を活性化することで組織の修復を促進する治療機会の可能性が明らかになった。間質細胞や上皮細胞に近接して存在し、再生に影響 を与えるシグナルを提供する他の多くの細胞タイプの役割につい ては、発展的な証拠がある。このような細胞には、免疫細胞、55、56内皮細胞、57リンパ系細胞、58、59、60神経細胞などが含まれる61。すべての異なる細胞タイプ間のクロストークの解析は、単一細胞の解像度で分子変化を定義できる空間技術56,62の最近の向上により、容易になると思われる。
CRediT著者による貢献
Helen E. Abud(概念化: リード;資金獲得: 執筆-原案: 執筆-原案:リード;執筆-校閲・編集:リード: リード)
Shanika L. Amarasinghe(方法論: 執筆-原案:支援: 執筆-原案:支援;執筆-校閲・編集:支援: サポート)
Diana Micati (執筆 - 原案: 執筆-原案作成:支援、執筆-校閲・編集:支援 ダイアナ・ミカティ (執筆-原案: 助手; 執筆-校閲・編集: 助手)
Thierry Jardé (資金獲得: 対等; 原案執筆: 執筆-原案:支援、執筆-校閲・編集:支援: 執筆-校閲・編集:支援)
参考文献
Clevers H.
幹細胞コンパートメントのプロトタイプである腸陰窩。
Cell. 2013; 154: 274-284
論文で見る
(850件)
PubMed
要旨
全文
全文PDF
グーグル奨学生
佐藤 崇
ヴァン・エスJ.H.
Snippert HJ, et al. 腸陰窩におけるLgr5幹細胞のニッチを構成するパネス細胞。
Nature. 2011; 469: 415-418
論文で見る
(1886年)
PubMed
クロス
グーグル奨学生
バークラフJ.
ブリトンR.J.
シングルセル・トランスクリプトミクスによる健康な成人ヒト小腸・結腸上皮の近位から遠位までの調査。
Cell Mol Gastroenterol Hepatol. 2022; 13: 1554-1589
論文で見る
抄録集(62)
PubMed
要旨
全文
全文PDF
グーグル奨学生
バスリンガーG.A.
ウーステンB.L.A.
ボグテA.
他
食道、胃、十二指腸のヒト消化管上皮を単一細胞分解能で解析。
Cell Rep.
論文で見る
スコープス (119)
PubMed
概要
全文
全文PDF
グーグル奨学生
デギルメンチB.
ヴァレンタ T.
ディミトリエヴァS.
et al.
GLI1を発現する間葉系細胞は、結腸幹細胞に必須のWnt分泌ニッチを形成する。
Nature. 2018; 558: 449-453
論文で見る
Scopus (238)
PubMed
クロス
グーグル奨学生
グレイシャスG.
カビリZ.
シグムンドソンK.
et al.
PDGFRalpha(+) pericryptal stromal cells are the critical source of Wnts and RSPO3 for murine intestinal stem cells in vivo.
Proc Natl Acad Sci U S A. 2018; 115: E3173-E3181
論文で見る
スコープス (210)
PubMed
クロス
グーグル奨学生
キンチェン J.
チェン・エイチエイチ
パリクK.
et al.
炎症性腸疾患におけるヒト大腸間充織の構造リモデリング。
Cell. 2018; 175: 372-386
論文で見る
スコープス (391)
PubMed
要旨
全文
全文PDF
グーグル奨学生
マッカーシーN.
マニエリ E.
ストーム E.E.
et al.
異なる間葉系細胞集団が、腸に不可欠なBMPシグナル勾配を形成している。
Cell Stem Cell. 2020; 26: 391-402
論文で見る
スコープス (177)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ショシュケス・カルメルM.
ワン Y.J.
Wangensteen K.J.
他
上皮下テロサイトは、腸陰窩を支えるWntsの重要な供給源である。
Nature. 2018; 557: 242-246
論文で見る
スコープス (337)
PubMed
クロス
グーグル奨学生
Stzepourginski I.
ニグロG.
ジェイコブJ.M.
et al.
CD34+間葉系細胞は、恒常性および傷害後の腸管幹細胞ニッチの主要な構成要素である。
Proc Natl Acad Sci U S A. 2017; 114: E506-E513
論文で見る
スコープス (229)
PubMed
クロス
グーグル奨学生
フェヴル T.
ロビーンS.
ルーヴァードD.
et al.
Wnt/β-カテニンは腸の恒常性と腸幹細胞の維持に必須である。
Mol Cell Biol.
論文で見る
スコープス (504)
PubMed
クロス
グーグル奨学生
ファン・エス J.H.
ヘーゲバルトA.
クヤラP.
他。
成体腸の恒常性自己再生におけるWntエフェクターTcf4の重要な役割。
Mol Cell Biol.
論文で見る
スコープス (201)
PubMed
クロス
グーグル奨学生
クナート F.
デイビスC.R.
ワンH.T.
他。
成体小腸および結腸の増殖におけるWntシグナルの必須要件は、Dickkopf-1のアデノウイルス発現によって明らかになった。
Proc Natl Acad Sci U S A. 2004; 101: 266-271
論文で見る
スコープス (525)
PubMed
クロス
グーグル奨学生
ファリン H.F.
ヴァン・エスJ.H.
クレバース H.
Wntの冗長な供給源が腸管幹細胞を制御し、パネス細胞の形成を促進する。
Gastroenterology. 2012; 143: 1518-1529
論文で見る
筑波大学
PubMed
要旨
全文
全文PDF
グーグル奨学生
カビリZ.
グレイシウス G.
マダンB.
et al.
ストロマは、上皮Wnts非存在下で腸管幹細胞ニッチを提供する。
Development. 2014; 141: 2206-2215
論文で見る
スコープス (264)
PubMed
クロス
グーグル奨学生
ヴァレンタ T.
デギルメンチB.
ムーアA.E.
ら
上皮下間葉系細胞から分泌されるWntリガンドは、腸管幹細胞の生存と腸の恒常性維持に必須である。
Cell Rep.
論文で見る
スコープス (187)
PubMed
概要
全文
全文PDF
グーグル奨学生
Xie L.
フレッチャー R.B.
バティア D.
et al.
Wntシグナル伝達のFZD特異的活性化による結腸上皮の頑健な再生と大腸炎の改善。
Cell Mol Gastroenterol Hepatol. 2022; 14: 435-464
論文で見る
スコープス (10)
PubMed
要旨
全文
全文PDF
グーグル・スカラー
ド・ラウW.
バーカー N.
ロー T.Y.
et al.
Lgr5ホモログはWnt受容体と会合し、R-スポンジンシグナル伝達を仲介する。
Nature. 2011; 476: 293-297
論文で見る
スコープス (1000)
PubMed
クロス
グーグル奨学生
キム・K.A.
柿谷真人
Zhao J.
et al.
腸上皮におけるヒトR-スポンジン1の分裂促進作用。
Science. 2005; 309: 1256-1259
論文で見る
スコープス (470)
PubMed
クロス
グーグル奨学生
ヤン K.S.
ジャンダ C.Y.
チャン J.
et al.
Lgr5(+)腸管幹細胞の自己再生におけるWntリガンドとR-スポンジンリガンドの非等価性。
Nature. 2017; 545: 238-242
論文で見る
スコープス (291)
PubMed
クロス
グーグル奨学生
クライチーJ.
マッカーシーN.
マラゴラE.
et al.
腸管陰窩構造内の段階的BMPシグナルは、Wnt分泌幹細胞ニッチの自己組織化を指示する。
細胞幹細胞。2023; 30: 433-449
論文で見る
スコパス (10)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ベルコバ L.
ファジラティ H.
ヤンQ.
et al.
絨毛先端腸細胞の終末分化は、異なるTgfβスーパーファミリーメンバーによって支配されている。
EMBO Rep.
論文で見る
哺乳類
PubMed
クロス
グーグル奨学生
フレS.
ユイゲM.
ムーリキスP.
et al.
ノッチシグナルは腸の未熟前駆細胞の運命を制御する。
Nature. 2005; 435: 964-968
論文で見る
筑波大学
PubMed
クロス
グーグル奨学生
ホルヴェイ K.
アブド H.E.
WntおよびNotchシグナルによる腸管幹細胞の制御。
2013; 786: 175-186
論文で見る
PubMed
クロス
グーグル奨学生
サンチョ R.
クレモナ C.A.
ベーレンス A.
哺乳類腸管における幹細胞と前駆細胞の運命: 恒常性と疾患におけるノッチと側方阻害。
EMBO Rep. 2015; 16: 571-581
論文で見る
スコープス (131)
PubMed
クロス
グーグル奨学生
アブド H.E.
チャン・W.H.
Jarde T.
腸管幹細胞におけるEGFリガンドファミリーの供給源と影響。
Front Cell Dev Biol.
論文で見る
スコープス (21)
PubMed
クロス
グーグル奨学生
バサック O.
Beumer J.
ヴィーブランズK.
et al.
腸管オルガノイドにおけるLgr5+幹細胞の誘導静止は、ホルモン産生腸内分泌細胞の分化を可能にする。
Cell Stem Cell. 2017; 20: 177-190
論文で見る
スコープス (221)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ホロウェイ E.M.
ツェルヴィンスキー M.
ツァイ Y.H.
et al.
ヒト腸管ニッチの発生を単一細胞レベルでマッピング。
Cell Stem Cell. 2021; 28: 568-580
論文で見る
スコープス (72)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ジャルデ T.
チャン・W.H.
ロッセロ F.J.
et al.
間葉系ニッチ由来のニューレグリン-1は、腸管幹細胞の増殖と損傷上皮の再生を促進する。
Cell Stem Cell. 2020; 27: 646-662
論文で見る
スコープス (66)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Lemmetyinen T.T.
ヴィイタラ E.W.
Wartiovaara L.
et al.
線維芽細胞由来のEGFリガンドであるニューレグリン1は、腫瘍性増殖を支持することなく、腸上皮の胎児様再プログラミングを誘導する。
Dis Model Mech. 2023; 16: Dmm049692
論文で見る
スコパス(2)
PubMed
クロス
グーグル奨学生
モラルC.
ギンナゴーR.
カラカシェワT.
他。
恒常性および炎症条件下における結腸組織からの上皮細胞および間質細胞の単離。
Bio Protoc. 2023; 13: e4825
論文で見る
日本学術振興会特別研究員
PubMed
クロス
グーグル奨学生
チー Y.C.
パーンケJ.
ブンテR.
ら。
腸管幹細胞ニッチにおける内在性異種物質耐性。
Dev Cell. 2018; 46: 681-695
論文で見る
スコープス (21)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ケストナー K.H.
腸管幹細胞ニッチ:Foxl1発現上皮下テロ細胞の中心的役割。
Cell Mol Gastroenterol Hepatol. 2019; 8: 111-117
論文で見る
スコープス (57)
PubMed
要旨
全文
全文PDF
グーグル奨学生
バハール・ハルパーンK.
マサルハ H.
ズウィックR.K.
他。
Lgr5+テロサイトは腸絨毛先端のシグナル伝達源である。
Nat Commun. 2020; 11: 1936
論文で見る
スコープス (88)
PubMed
クロス
グーグル奨学生
テッテ P.W.
バサックO.
ファリンH.F.
ら。
失われたLgr5陽性幹細胞の代替は、腸細胞系娘細胞の可塑性を介して行われる。
Cell Stem Cell. 2016; 18: 203-213
論文で見る
スコープ (394)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Tian H.
et al.
小腸の予備幹細胞集団は、Lgr5陽性細胞を不要にする。
Nature. 2011; 478: 255-259
論文で見る
筑波大学
PubMed
クロス
グーグル奨学生
Ho Y.T.
シンボ T.
ウィジャヤE.
et al.
縦断的単一細胞トランスクリプトミクスにより、マウス大腸炎モデルにおけるSerpina3nを介した炎症消失の役割が明らかになった。
Cell Mol Gastroenterol Hepatol. 2021; 12: 547-566
論文で見る
スコープス (22)
PubMed
要旨
全文
全文PDF
グーグル奨学生
エルメンタイトR.
ロス A.D.B.
ロバーツ K.
他。
発達中のヒト腸のシングルセルシーケンスにより、小児クローン病との転写の関連性が明らかになった。
Dev Cell. 2020; 55: 771-783
論文で見る
スコープス (122)
PubMed
要旨
全文
全文PDF
グーグル奨学生
エルメンタイトR.
熊坂 N.
ロバーツ K.
他。
ヒト腸管の細胞が時空を超えてマッピングされた。
Nature. 2021; 597: 250-255
論文で見る
スコープス (194)
PubMed
クロス
グーグル奨学生
ヒッキーJ.W.
ベッカーW.R.
ネビンスS.A.
他。
ヒト腸の単一細胞レベルでの組織化。
Nature. 2023; 619: 572-584
論文で見る
スコープス(30)
PubMed
クロス
グーグル奨学生
イェルゲンス A.E.
パービンルーS.
コッパーJ.
他。
上皮と微生物の相互作用と炎症性腸疾患。
Front Med(ローザンヌ)。2021; 8: 669913
論文で見る
スコパス(22)
PubMed
クロス
グーグル奨学生
マイルト S.J.
ジャルドT.
チルドレス K.O.
et al.
Clostridioides difficile感染はTcdBを介して大腸幹細胞にダメージを与え、上皮の修復と疾患からの回復を損なう。
Proc Natl Acad Sci U S A. 2020; 117: 8064-8073
論文で見る
スコープス (59)
PubMed
クロス
グーグル奨学生
ロジャース A.P.
マイルトS.J.
ライラスD.
腸内細菌感染症が上皮バリアに与える影響と、それを超えた影響。
Nat Rev Microbiol. 2023; 21: 260-274
論文で見る
スコパス (31)
PubMed
クロス
グーグル奨学生
アヤズ A.
クマール S.
サンジョルジB.
et al.
再生腸の単一細胞トランスクリプトームから、復活幹細胞が明らかになった。
Nature. 2019; 569: 121-125
論文で見る
スコープス (264)
PubMed
クロス
グーグル奨学生
ヌッセ Y.M.
サベージ A.K.
マランゴーニP.
他。
寄生蠕虫は腸管幹細胞ニッチにおいて胎児様復帰を誘導する。
Nature. 2018; 559: 109-113
論文で見る
スコープス (178)
PubMed
クロス
グーグル奨学生
ユイ・S.
アゾリンL.
マイメッツM.
et al.
大腸上皮のYAP/TAZ依存的リプログラミングは、ECMリモデリングを組織再生に結びつける。
Cell Stem Cell. 2018; 22: 35-49
論文で見る
スコープス (371)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ピクペウラ L.M.
ブレッサン・R.B.
Guiu J.
et al.
転写およびエピゲノムプロファイリングにより、腸管上皮成熟の重要な制御因子としてYAPシグナルが同定された。
Sci Adv. 2023; 9: eadf9460
論文で見る
日本学術振興会特別研究員
PubMed
クロスフィルム
グーグル奨学生
ブザッキ S.J.
ゼッキーニH.I.
ニコルソンA.M.
ら。
腸管ラベル保持細胞はLgr5を発現する分泌前駆細胞である。
Nature. 2013; 495: 65-69
論文で見る
スコパス (594)
パブコメ
クロス
グーグル奨学生
ホルヴェイ K.
ジャルデT.
カサグランダF.
et al.
Snai1は、マウス腸上皮における細胞系譜の割り当てと幹細胞の維持を制御している。
EMBO J. 2015; 34: 1319-1335
論文で見る
スコープス (46)
PubMed
クロス
グーグル奨学生
村田和彦
ジャダフ U.
マダ S.
他。
Ascl2依存的な細胞の脱分化は、切除された腸管幹細胞の再生を促進する。
Cell Stem Cell. 2020; 26: 377-390
論文で見る
筑波大学
PubMed
要旨
全文
全文PDF
グーグル奨学生
スミリーC.S.
ビトン M.
オルドバス-モンタネスJ.
他。
潰瘍性大腸炎におけるヒト大腸の細胞内および細胞間配線変更。
Cell. 2019; 178: 714-730
論文で見る
スコープス (599)
PubMed
要旨
全文
全文PDF
グーグル奨学生
コッペンス M.A.J.
デイビス H.
ヴァルブエナG.N.
ほか
Grem1による骨形成タンパク質経路拮抗作用は、腸管再生における上皮細胞の運命を制御する。
Gastroenterology. 2021; 161: 239-254
論文で見る
スコープス (23)
パブコメ
概要
全文
全文PDF
グーグル奨学生
フリードリッヒ M.
ポヒン M.
ジャクソン M.A.
他
IL-1駆動性の間質-好中球相互作用が、治療に反応しない炎症性腸疾患患者のサブセットを規定する。
Nat Med. 2021; 27: 1970-1981
論文で見る
スコープス (100)
PubMed
クロス
グーグル奨学生
リンデマンス C.A.
カラフィオーレM.
メルテルスマンA.M.
他。
インターロイキン22は腸管幹細胞を介した上皮再生を促進する。
Nature. 2015; 528: 560-564
論文で見る
スコープス (754)
PubMed
クロス
グーグル奨学生
プル S.L.
ドハティ J.M.
ミルズJ.C.
他。
活性化マクロファージは、傷害に対する再生反応に必要な大腸上皮前駆細胞ニッチの適応的要素である。
Proc Natl Acad Sci U S A. 2005; 102: 99-104
論文で見る
スコパス (508)
PubMed
クロス
グーグル奨学生
ガリード-トリゴ A.
コラリザ A.M.
ベニーM.
ら。
ヒト炎症性腸疾患におけるマクロファージと好中球の単一細胞空間分解能での不均一性。
Nat Commun. 2023; 14: 4506
論文で見る
スコパス (19)
PubMed
クロス
グーグル奨学生
タン C.
ノーデン P.R.
Yu W.
他。
内皮FOXC1とFOXC2は虚血再灌流障害後の腸管再生を促進する。
EMBO Rep.
論文で見る
スコパス (5)
クロスリファレンス
グーグル奨学生
ニエック R.E.
チュー T.
シェルンタナーM.
他。
リンパ管は、腸管幹細胞の活性を制御するシグナル伝達ハブとして機能する。
細胞幹細胞。2022; 29: 1067-1082
論文で見る
スコープス (43)
PubMed
要旨
全文
全文PDF
グーグル奨学生
後藤直樹
後藤慎一郎
今田慎一郎
et al.
リンパ管と線維芽細胞は、恒常性と傷害において腸管幹細胞をサポートする。
Cell Stem Cell. 2022; 29: 1246-1261
論文で見る
スコープ (31)
PubMed
要旨
全文
全文PDF
グーグル奨学生
パリクキB.
リスパルJ.
レイエス E.A.
ほか
細胞傷害後の適切な腸管修復には、リンパ管分泌シグナルが必要である。
細胞幹細胞。2022; 29: 1262-1272
論文で見る
スコパス(20)
PubMed
要旨
全文
全文PDF
グーグル奨学生
プザン M.
ホシッチ S.
ギオC.
他。
腸管幹細胞の分化と上皮単層機能の腸神経系制御。
サイレポ 2018; 8: 6313
論文で見る
スコープス (67)
PubMed
クロス
グーグル奨学生
パリジ S.M.
ラーションL.
ダス S.
ら。
損傷後の治癒マウス腸の空間的トランスクリプトーム景観。
Nat Commun. 2022; 13: 828
論文で見る
スコープス (35)
PubMed
クロス
グーグル奨学生
論文情報
出版履歴
オンライン公開 2024年02月08日
受理 2024年2月1日
受理:2024年2月1日 受理:2023年11月16日
脚注
利益相反 著者らは利益相反を公表していない。
助成:オーストラリア国立保健医療研究評議会助成金1188689(HEAおよびTJ)およびオーストラリア研究評議会助成金DP200103589。
身分証明書
DOI: https://doi.org/10.1016/j.jcmgh.2024.02.003
著作権
© 2024 The Authors. AGA Instituteの委託によりElsevier Inc.が発行。
ユーザーライセンス
クリエイティブ・コモンズ 表示 - 非営利 - 改変禁止 (CC BY-NC-ND 4.0) | 情報アイコンの再利用方法
サイエンスダイレクト
ScienceDirectでこの論文にアクセスする
図
図サムネイルgr1
図1間葉ニッチにおける細胞集団の分布。間質細胞集団は陰窩-絨毛軸に沿って分布している。これにはBMPを発現する上皮下PDGRFAhiテロサイト、PDGFRAlo間質、WNT2BとRSPOを発現する深部クリプトPDGFRAlo、CD81+トロフォサイトが含まれる。免疫細胞、血管、リンパ管内皮などの他の細胞タイプも重要なシグナルを供給する。
図はBioRender.comで作成。
図サムネイルgr2
図2恒常性と再生におけるニッチシグナルの発現。GSE130681,6マウス小腸GSE116514,25健康なマウス、およびDSS処理結腸GSE114374.5から得られたマウスPDGFRA選別細胞と間葉系全体から得られたデータを統合した(A)PDGFRAおよびCD81レベルに基づく別個の細胞クラスターのUMAP可視化。DoubletFinder36を用いて潜在的なダブレットを除去し、CellMarkerDB37を用いて細胞のアノテーションを行った。PDGFRAとCD81レベルに基づくデータセットの分離。(C)DSS投与マウスと比較したコントロールにおける主要シグナルの相対発現5。
関連記事
ホーム
発展途上国へのアクセス
論文・号外
最新号
最新号
アーカイブ
プレスリリース
特別号
トピックコレクション
CMGHについて
CMGHについて
アドバイザリーボード
連絡先
編集委員会
編集者
著者向け
図解FAQ
図表抄録
著者向けガイド
メディカルイラストレーションFAQ
投稿前チェックリスト
研究者アカデミー
原稿を投稿する
読者の皆様へ
オープンアクセスについて
広告主情報
再利用の許可
報道差し止め
メールマガジン登録
AGA
AGAホーム
AGAモバイル
AGAに参加する
ソーシャルメディア
フォローする
ユーチューブ
X (旧ツイッター)
フェイスブック
当サイトのコンテンツは医療従事者向けです。
当サイトでは、サービスの提供・向上やコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
このサイトのすべてのコンテンツ 著作権 © 2024 Elsevier Inc.
テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビア社に帰属します。
すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
プライバシーポリシー 利用規約 アクセシビリティ ヘルプ&コンタクト
RELX
この記事が気に入ったらサポートをしてみませんか?
