
腸管における恒常的・病的免疫-上皮相互作用を研究するツールとしてのオルガノイド
メインコンテンツへスキップ
医療従事者向け広告
オックスフォード・アカデミック
検索メニュー
インフォメーション
アカウント
メニュー
臨床・実験免疫学 英国免疫学会
論文ナビゲーション
論文訂正校正
腸管における恒常的・病的免疫-上皮相互作用を研究するツールとしてのオルガノイド
https://academic.oup.com/cei/advance-article/doi/10.1093/cei/uxad118/7637444?login=false
エマ・ホイモセ・クロマン、アイニゼ・ペーニャ・セアラ、ジョアナ・F・ネヴェス
Clinical and Experimental Immunology, uxad118, https://doi.org/10.1093/cei/uxad118
公開:2024年3月29日 記事履歴
pdfPDF
閲覧数
引用
許可 アイコン 許可
アイコンを共有する
要旨
腸は外来性抗原に絶えず曝されるため、体内で最大の免疫細胞コンパートメントを宿している。腸管バリアは、免疫細胞と腸管内腔を隔てる1層の上皮細胞によって形成されている。上皮と免疫コンパートメントとの双方向の相互作用は、感染を制限し、過剰な免疫活性化を防ぎ、組織修復過程を促進することによって、腸の恒常性を維持するために重要である。しかしながら、上皮と免疫の相互作用に関する理解は不完全であり、in vivoモデルは複雑であるためメカニズム研究の妨げになることがある。また、細胞培養モデルは腸の細胞不均一性を欠いており、初代細胞から樹立した場合は維持が困難である。この10年間で、オルガノイドは腸の信頼できるモデルとして登場し、本来の組織の主要な細胞的・構造的特徴を再現している。ここでは、腸管オルガノイドと免疫細胞の共培養が、腸管における免疫-上皮相互作用の理解を大きく前進させるに至った経緯について概説する。これにより、恒常性においても、慢性炎症、感染症、がんなどの疾患においても、上皮の維持と再生に対する免疫の寄与についての新たな発見が可能となった。オルガノイドはさらに、組織特異的な表現型を持つ免疫細胞を作製したり、疾患関連リスク遺伝子が腸管免疫環境に及ぼす影響を調べたりするのにも利用できる。従って、この総説は、免疫学研究における腸管オルガノイドの応用の多さと、トランスレーショナル・アプローチの可能性を示すものである。
免疫細胞、オルガノイド、腸、炎症、感染、大腸癌
問題のセクション 総説
はじめに
腸管粘膜は、宿主細胞と腸管内腔に存在する食事代謝産物、常在微生物、病原体などの環境因子との動的相互作用の場である。上皮細胞の単層が腸関門を構成し、その下に免疫細胞、線維芽細胞、その他の間質細胞が密に存在する緩やかな結合組織で、豊富な神経支配と血管支配を受ける前膜がある。バリアーの完全性は腸のホメオスタシスにとって不可欠であり、上皮と常在の免疫細胞との間の絶え間ない双方向のコミュニケーションによって守られている。堅牢なin vitro細胞培養システムは、この複雑な相互作用のネットワークを解明するために必要なツールであり、動物モデルの使用を補完するものである。間葉系フィーダー細胞層上で腸管上皮細胞を培養する初期の2Dモデルは、細胞の複雑性に限界があり、長期間の維持が不可能で、空間分解能が低いため、生理学的妥当性や生体内の腸内環境への移植性に限界がある [1]。そのため、腸管上皮内での免疫相互作用をモデル化するために、腸管「オルガノイド」、すなわち腸関門に酷似した幹細胞由来の3次元組織培養の開発が、免疫学者によって急速に取り上げられるようになった。ここでは、このオルガノイドを免疫細胞と共培養することで、恒常性維持、炎症、感染、がんにおける腸内の免疫と上皮の相互作用についての理解がどのように進んだかを概説する。
ヒト腸のモデルとしての腸オルガノイド
腸上皮は主に吸収性腸細胞からなり、パネス細胞、タフト細胞、杯細胞、腸内分泌細胞などの特殊な分泌細胞のサブセットが散在している。Lgr5+腸管幹細胞(ISC)は、腸管全体に沿った陥凹部に存在し、すべての上皮サブタイプを生み出し、上皮バリアを絶えず補充している [2]。2009年の画期的な研究で、単離された小腸陰窩や単一のLgr5+ ISCを細胞外マトリックス(ECM)リッチゲルに包埋し、成長因子で規定された培地で長期培養できることが発見された [3]。このような培養条件により、3D細胞クラスターが形成され、腸上皮の細胞不均一性と本来の腸の構造を忠実にモデル化する(図1A)。ここで分化した上皮細胞は、基底幹細胞の陰窩からオルガノイド中心部へと成長し、先端-基底極性を保持して、細胞クラスター内に密閉された管腔を形成する。その後、小腸の異なる部位から作られたオルガノイドは、その由来組織に典型的な形態と遺伝子発現を示すことが証明された。従って、十二指腸、空腸、回腸のオルガノイドをそれぞれ培養することで、特定の腸管区画を研究できるようになった [4, 5]。腸管オルガノイド培養はマウスを用いて最初に確立されたが、その後、ヒトの生検サンプルから小腸の「腸管オルガノイド」や大腸の「コロノイド」を作製するためのプロトコールが適応されるようになった [6]。
図1.
組織またはPSC由来の腸オルガノイドの作製と、報告されている免疫-オルガノイド共培養アプローチ。腸オルガノイドは主に2つのアプローチで作製される。(A)組織由来の腸オルガノイドは、単離された陰窩あるいは単一のLgr5 + ISCから増殖させ、上皮細胞のみの構造を作り出すことができる。(B)胚性幹細胞または人工多能性幹細胞を、内胚葉分化と腸管分化へと順次押し進め、上皮細胞と間葉細胞の両方のコンパートメントを持つPSC由来の腸オルガノイドを作製することができる。(C)オルガノイドはいくつかの異なる方法で免疫学的研究に用いることができる。サイトカインや免疫細胞調整培地の添加(1)、免疫細胞との共培養(2-4)、微生物成分の導入(5-7)、あるいは生来の免疫細胞を共発達させる気液界面オルガノイド(8)などである。図はBioRender.comで作成。
新しいタブで開くスライドをダウンロード
組織またはPSC由来の腸オルガノイドの作製と免疫オルガノイド共培養アプローチの報告。腸オルガノイドは主に2つのアプローチで作製される。(A)組織由来の腸オルガノイドは、単離された陰窩あるいは単一のLgr5 + ISCから増殖させ、上皮細胞のみの構造を作り出すことができる。(B)胚性幹細胞または人工多能性幹細胞を、内胚葉分化と腸管分化へと順次押し進め、上皮細胞と間葉細胞の両方のコンパートメントを持つPSC由来の腸オルガノイドを作製することができる。(C)オルガノイドはいくつかの異なる方法で免疫学的研究に用いることができる。サイトカインや免疫細胞調整培地の添加(1)、免疫細胞との共培養(2-4)、微生物成分の導入(5-7)、あるいは生来の免疫細胞を共培養する気液界面オルガノイド(8)などである。図はBioRender.comで作成。
初期発生についての理解が深まるにつれ、ヒト多能性幹細胞(PSC)から腸オルガノイドを作製することもできるようになった。得られた細胞構造は、支持ゲルマトリックスに封入され、培地組成に 応じて小腸または大腸の表現型になるように成熟される[7, 8]。PSC由来オルガノイドは間葉系細胞を発達させるので、組織由来オルガノイドよりも利点がある。間葉系細胞は上皮構造体の周囲に本来のECMを分泌し、さらに複雑なレイヤーを追加する。しかしながら、成熟を促進する方法として、機械的な手がかり [10]やISCニッチ因子の組み込み [9、11、12]などが報告されている。多系統オルガノイドは、コラーゲンマトリックス中で組織片を空気にさらしながら培養することにより、腸組織から誘導することもできる [13]。これらは、上皮と間葉の両方のコンパートメントを持つ初期のオルガノイド系を代表するが、気液界面オルガノイドはそれほど人気を博しておらず、主に癌研究に用いられている [14] 。
パネス細胞[15]、杯細胞[15]、腸内分泌細胞[16]などの特殊な上皮細胞を増やすプロトコールが確立され、特定の上皮サブセットと免疫の相互作用に関する研究が容易になった。さらに、管腔抗原を上皮バリアーを越えて下層の免疫細胞に伝達する能力を持つマイクロフォールド細胞は、Lgr5+ ISCに由来するが、サイトカインRANKLで処理したオルガノイドでのみ検出可能である [17]。その結果、過去10年間の進歩により、腸オルガノイド技術は、原理実証から、基礎研究やトランスレーショナルリサーチに大いに期待できる、堅牢でカスタマイズ可能なツールへと進歩した。
免疫学研究における腸オルガノイドの応用
腸オルガノイドは、腸における免疫相互作用を調べるための還元論的プラットフォームを提供する(図1Cおよび表1)。組換えサイトカインの添加は、特定の免疫メディエーターが腸管上皮に与える影響を調べるための簡便なアプローチであり、広く用いられている[18]。免疫細胞と腸管オルガノイドの共培養システムに関する最初の報告は、初代T細胞がマウス腸管オルガノイドとの長期培養に耐えることを示したものである [19]。その後、好中球[20, 21]、マクロファージ[21]、自然リンパ球(ILC)[22-24]などの自然免疫細胞との共培養をセットアップするためのプロトコールがいくつか確立された。これらの免疫細胞は、ECMリッチゲル内のオルガノイドの隣に埋め込むことで、接触依存的な相互作用を可能にする。あるいは、免疫細胞と上皮細胞のコンパートメントをトランスウェル インサートを用いて分離したり、免疫細胞培養の上清をオルガノイド培地に 混ぜたりして、これらの細胞から放出される可溶性メディエーターの影響 だけを調べることもできる。
表1.免疫-オルガノイド共培養の概要
免疫細胞またはバクテリア細胞の種類 オルガノイドの種類 読み出し 参照文献
上皮再生における免疫の影響の研究
脾臓CD4 + T細胞 マウス腸管ISCの再生と分化 Biton et al.
Jurkat T細胞 ヒトPSC由来小腸 オルガノイド増殖と上皮成熟 Jungら(2018年)
腸管固有層CD4+ T細胞 ヒト腸管オルガノイドの成長 Schreurs et al.
マウス腸管前膜ILC1
ヒトPSC由来小腸 オルガノイド陰窩出芽、ECMリモデリング Jowettら(2021)
腸間膜リンパ節 ILC2 マウス腸管小体 ゴブレット細胞の分化 Waddell et al.
脾臓CD4 + T細胞 マウス腸管オルガノイド 生存能力 Joly et al.
脾臓CD4 +およびCD8 + T細胞 マウス腸管オルガノイド オルガノイド損傷および上皮分化 Eriguchi et al.
末梢CD4 +およびCD8 + T細胞 マウス腸管オルガノイド
ヒト腸管オルガノイド Organoid outgrowth Takashima et al.
骨髄由来マクロファージ マウス腸管上皮抵抗性と透過性 Spalinger et al.
末梢T細胞 マウス腸管
ヒト腸管オルガノイド オルガノイド生存率 Matsuzawa-Ishimoto et al.
小腸上皮内リンパ球
末梢T細胞 マウス腸管
ヒト腸管オルガノイド 陰窩の出芽、生存率、 パネス細胞数 Matsuzawa-Ishimoto et al.
脾臓および大腸CD11c + 白血球、骨髄由来樹状細胞 マウス腸管オルガノイド オルガノイド形態および上皮分化 井原ら(2018)
腸管固有層リンパ球とILC3 マウス腸管オルガノイド 陰窩芽と増殖 Lindemans et al.
BMM由来樹状細胞 マウス腸管生存率 Jonesら(2019)
免疫細胞の挙動に対する上皮の影響の研究
末梢T細胞 マウス腸管T細胞の増殖と形態 Rogoz et al.
脾臓CD4 + T細胞 マウス腸管T細胞増殖 Biton et al.
骨髄または末梢 ILC 前駆体 マウス腸管
ヒトPSC由来小腸ILCの増殖、転写因子、表面マーカーおよびサイトカインの発現 Jowettら(2022年)
PSC由来単球 ヒトPSC由来小腸 マクロファージ形態、サイトカイン分泌 鶴田ら(2022)
単球由来マクロファージ ヒト腸管単層マクロファージ形態 Noel et al.
末梢性多形核好中球 ヒト腸管単層細胞 表面マーカー発現およびサイトカイン産生 Lemme-dumit et al.
宿主と微生物の相互作用の研究
CD11c+DCとUC照射乳酸菌またはL. reuteri調整培地 マウス大腸菌 IL-10産生 Engevikら(2021)
マクロファージおよびラクトバチルス・ムリヌス マウス腸管単層 LDHレベルおよびタイトジャンクションタンパク 質をコードする遺伝子の発現 Hu et al.
ヒト単球由来マクロファージと大腸菌 ヒト腸管単分子膜 単分子膜の完全性とサイトカイン産生 Noel et al.
多形核好中球と赤痢菌 ヒト腸管単層膜 PMN共培養モデルの開発 Lemme-Dumit et al.
上皮内 Ly6A + CCR9 + CD4 + T 細胞 マウス腸管 T 細胞共培養系の開発 Parsa et al.
大腸がん免疫学研究
腫瘍反応性T細胞 CRC患者由来腫瘍コロノイド 患者由来腫瘍オルガノイド-T細胞共培養系の開発 Dijkstra et al.
腫瘍浸潤リンパ球 マウスおよびCRC患者由来腫瘍コロノイド 気液界面(ALI)オルガノイドモデルの開発 Neal et al.
ネオアンチゲン発現を評価するための 人工マウスCRCオルガノイドの開発 Westcott et al.
上皮内リンパ球 マウス APC KO 腸管抗腫瘍免疫応答 Morikawa et al.
IL-2 活性化 NK 細胞調整培地 ヒト CRC 患者由来腫瘍コロノイド 腫瘍細胞のアポトーシス Parseh et al.
BMM調整培地 マウス腸管細胞 ISCsの自己複製と増殖 Saha et al.
新しいタブで開く
腸管における上皮と免疫の相互作用は、食事性因子や微生物の存在によって影響を受けるが、これらをオルガノイドモデルに含めることで、さらに複雑なレイヤーを追加することができる。オルガノイド内腔に代謝産物や生きた細菌をマイクロインジェクションすれば、生理学的に適切な局在でこれらの相互作用を研究できる大きな可能性がある。その代わりに、オルガノイド単層をトランスウェル・インサートで培養することで、基底免疫細胞と環境因子を管腔側にコンパートメント化することができる [20, 26]。インサイド・アウト型」腸管オルガノイドも代替法として存在し、オルガノイド全体の寸法を維持したまま、管腔表面にアクセスしやすくしている [27]。逆極性のオルガノイドは、組織由来のオルガノイドを懸濁液に移し、上皮バリアの完全性を保ちながら、上皮層のアピコ-基底極性を入れ替えることで簡単に作製できる[27]。これによって研究者は、培養液に内腔因子を加えるだけで、上皮に対する内腔因子の直接的な影響を調べることができる。したがって、アピカルアウト・オルガノイドは、栄養摂取、薬物吸収、代謝の研究を可能にし、消化管関連疾患に関連する上皮バリア機能や宿主-病原体相互作用の研究に有用な、別のin vitroモデルを提供する。
腸オルガノイドを用いた組織特異的免疫細胞の作製
腸管オルガノイドと免疫細胞との共培養の重要な利点は、アクセスしにくい組織に存在する免疫細胞の組織特異性に関する知見を得ることができる点である。腸オルガノイドと免疫細胞の共培養に関する最初の報告では、マウス末梢血T細胞が膜突起を獲得し、腸管ホーミングマーカーを発現し、上皮内に統合されることが明らかになった [19]。同様に、好中球、マクロファージ、ILCなど、様々なタイプの自然免疫細胞においても、組織特異的な表現型の発達が観察されている [20, 24, 28, 29]。
ILCは粘膜組織に存在する組織常在性の免疫細胞集団であり、恒常性維持や感染における防御免疫やバリア保全におけるその役割が認識されている [30] 。循環しているILC前駆体を血液から単離し、試験管内で成熟ILCを生成するのに用いることができる [31]。これまでは、骨髄由来の間質フィーダー層を改良し、前駆体の分化を特定のILCサブセットに誘導するための特異的な刺激性サイトカインが必要であった [31, 32]。PSC由来の小腸オルガノイドを用いると、ドナーの年齢、遺伝、疾患の状態による変動が制限されるため、ILC前駆体は多様に拡大し、追加の刺激性サイトカインを必要とすることなく、成熟ヒト腸管ILCの転写因子、表面マーカー、サイトカインプロフィールを再現するILCに分化する [24]。驚くべきことに、最大限の増殖と腸管様ILCサブセット分布の達成には、間質コンパートメントではなく、オルガノイド上皮コンパートメントのみが必要であったことから、in vivoでのILC成熟は、これまで考えられていた以上に腸管上皮に依存していることが示された [24]。
これらの研究は、組織常在免疫細胞を生み出す腸オルガノイドの可能性を明らかにし始めた。免疫細胞の分化にオルガノイドベースのプラットフォームを用いることで、初代免疫細胞にアクセスするための侵襲的な手順への依存が軽減され、胸腺オルガノイドで研究されているように、実験目的や自己免疫細胞治療のために、希少な細胞集団を大量に生成することができる [33]。
腸管幹細胞ニッチにおける免疫細胞
ISCは腸管陰窩の底部に存在し、WntやNotchリガンドなど、幹細胞の 維持を促進するシグナル因子を局所的に供給する多細胞ニッチに囲まれて いる [34] 。マウスの小腸内では、CD4+ヘルパーT細胞が小腸陰窩内のLgr5+ ISCに隣接して見られる。ここで、細胞タイプ間の双方向コミュニケーションは、ISCの更新と分化の制御に重要な結果をもたらす。オルガノイド培養は、この現象がどのように起こるかについての理解を進める上で、重要な役割を果たしてきた。初期の共培養で、腸小胞の周りにT細胞が集まっていることが明らかになり [19]、ISCとT細胞間の相互作用の影響を調べるために、Bitonらによってこの系が利用された [35]。Bitonらは、マウス小腸オルガノイドと、異なる分極化されたlamina propria CD4+T細胞、またはそのカノニカルサイトカインを共培養することにより、炎症性ヘルパー1型T細胞(TH1)、TH2、およびTH17がISC集団を減少させる一方で、抗炎症誘導制御性T細胞が幹細胞の維持を促進することを観察した [35]。ISCによる主要組織適合性Ⅱ複合体(MHC-Ⅱ)の発現は、ヒトでもマウスでもよく知られているが、定常状態では小腸上皮に限られている。しかし、炎症を起こした腸で増加するインターフェロン-γ(IFNγ)が、ヒト腸管のMHC-II発現と抗原プロセシング能力を増加させることが、研究によって示されている[37]。T細胞を介した上皮成熟の役割も、オルガノイドモデルの結果として確立されている。PSC由来の腸オルガノイドのトランスクリプトーム解析から、これらの上皮コンパートメントは組織由来の腸オルガノイドよりも成熟しておらず [11]、むしろ胎児組織のそれに近いことが明らかになった [9]。しかしながら、Jurkat T細胞との共培養により、IL-2依存的に転写および機能的成熟が促進され、成体腸との類似性が高まった [11]。さらに、エフェクターメモリーCD4+ T細胞由来のTNF-αは、ヒト胎児組織由来の腸オルガノイドの上皮の発達を、用量依存的に制御することが示された [38]。
これらの研究を総合すると、ISC集団の維持における様々な免疫細胞の役割を解明するための、還元主義的in vitroシステムの能力が明らかになる。
腸管免疫ホメオスタシスに影響を及ぼす常在微生物および病原性微生物
腸内細菌叢と宿主との双方向の相互作用は、腸の恒常性維持に不可欠である [39] 。しかし、慢性炎症における微生物の多様性の低下や、広域抗生物質の投与による微生物の変化により、宿主は病原体のコロニー形成を受けやすくなる [40] 。常在微生物や病原性微生物が、宿主の免疫系やバリア機能にどのような影響を与えるかについての疑問は、依然として解決されていないため、オルガノイドは、そのような疑問を解決するために、様々な形態で用いられている(図1C)[41]。
乳酸菌は常在菌の一種であり、腸内恒常性の維持など、腸内における複数の有益なプロセスを促進する [42]。乳酸菌の保護作用のメカニズムとしては、抗炎症環境の促進が考えられる。最近の研究では、紫外線照射したラクトバチルス・ロイテリ菌、あるいはその調整培地をマウスの大腸にマイクロインジェクションしたところ、その存在によって、toll様受容体2を介した樹状細胞による抗炎症性サイトカインIL-10の産生が促進されることが明らかになった[43](図2A)。さらに、ラクトバチルス・ムリヌスで処理したマクロファージとオルガノイドを共培養すると、低酸素-再酸素傷害が抑制され、腸上皮の保護作用が誘発された [44](図2A)。
図2.
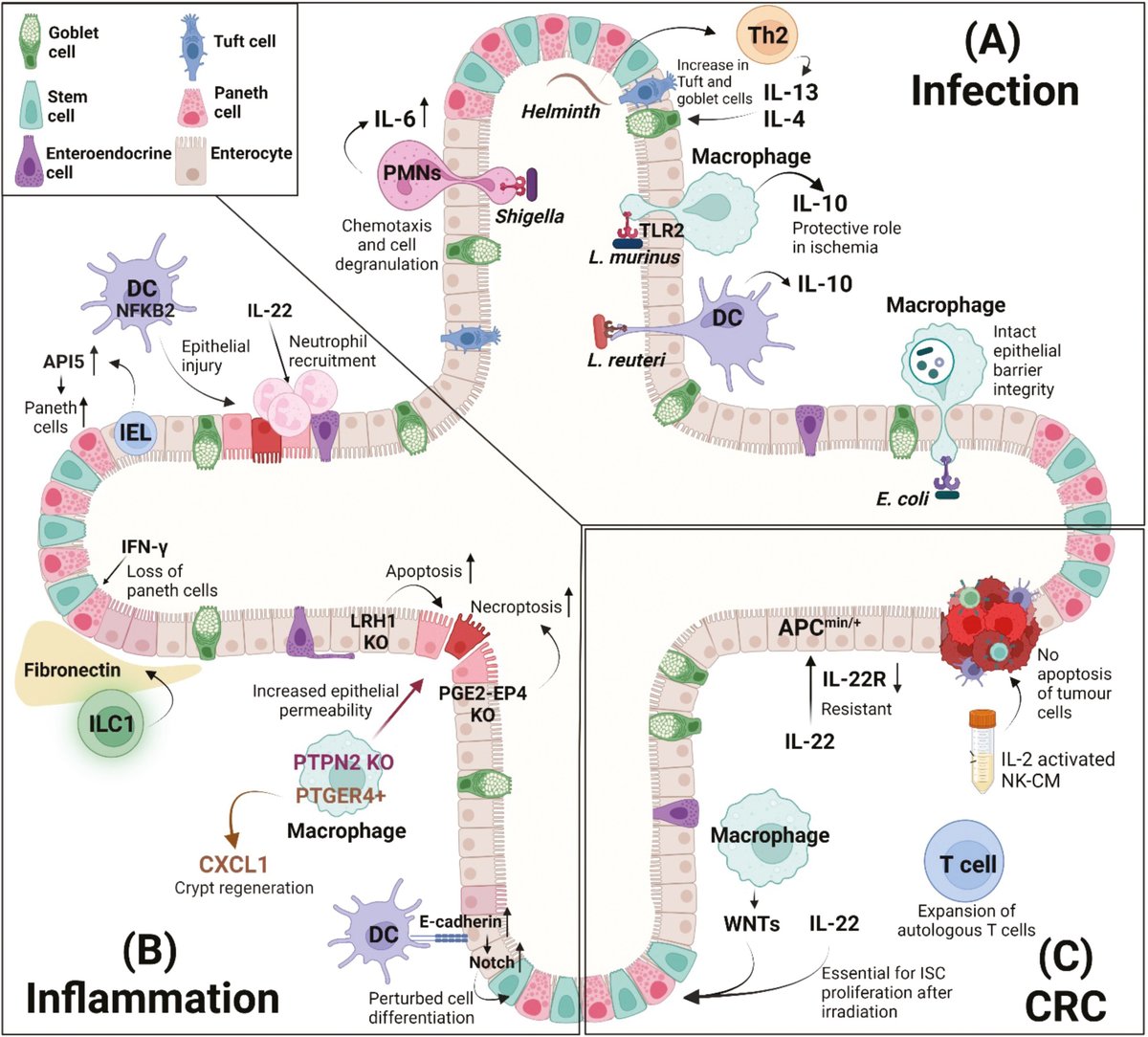
感染、炎症および大腸がん(CRC)モデルにおいて、腸オルガノイドと免疫細胞、細菌細胞またはサイトカインとのマウスおよびヒト共培養から得られたデータの概要。(A)感染研究では、トランスウェル細胞培養インサートで培養したオルガノイド単層が通常用いられる。ラクトバチルス・ムリヌス(Lactobacillus murinus)やラクトバチルス・ロイテリ(Lactobacillus reuteri)などの常在菌とオルガノイドを共培養すると、腸内のDCやマクロファージが抗炎症性IL-10を産生することが示された。蠕虫や、赤痢菌や大腸菌などの他の細菌の役割も、オルガノイド培養モデルで研究されている。(B)腸炎症発症に対する特定の遺伝子の寄与を研究するために、多くの研究が遺伝子改変マウスを用いて腸オルガノイド(LRH1とPGE2-EP4欠損上皮細胞)を作製したり、樹状細胞(NF-kB2 KO)やマクロファージ(PTPN2またはPTGER4 + KOマクロファージ)を含む遺伝子改変免疫細胞を得ている。また、オルガノイドをIL-22やIFN-γなどのサイトカインでチャレンジし、ILC1、樹状細胞、マクロファージ、上皮内リンパ球(IEL)などの免疫細胞と共培養することで、特定の細胞やサイトカインが上皮バリア機能にどのような影響を与え、それによって腸の炎症が促進されるかを解析した。(C)CRC研究では、通常ApcMin/+マウスモデルから樹立したオルガノイドと患者由来の腫瘍オルガノイドが適用される。IELやマクロファージなどの免疫細胞、サイトカイン(IL-22)、NK細胞由来の条件培地などを用いたオルガノイドの共培養系が報告されている。さらに、患者由来の腫瘍オルガノイドを用いた改良型T細胞共培養系が開発され、患者特異的腫瘍反応性細胞T細胞を生体外で増殖・選択することができる。図はBioRender.comで作成した。
新しいタブで開くスライドをダウンロード
感染、炎症、大腸がん(CRC)モデルにおいて、腸オルガノイドと免疫細胞、細菌細胞、サイトカインとのマウスおよびヒトでの共培養から得られたデータの概要。(A)感染研究では、トランスウェル細胞培養インサートで培養したオルガノイド単層が通常使用される。ラクトバチルス・ムリヌス(Lactobacillus murinus)やラクトバチルス・ロイテリ(Lactobacillus reuteri)などの常在菌とオルガノイドを共培養すると、腸内のDCやマクロファージが抗炎症性IL-10を産生することが示された。蠕虫や、赤痢菌や大腸菌などの他の細菌の役割も、オルガノイド培養モデルで研究されている。(B)腸炎症発症に対する特定の遺伝子の寄与を研究するために、多くの研究が遺伝子改変マウスを用いて腸オルガノイド(LRH1とPGE2-EP4欠損上皮細胞)を作製したり、樹状細胞(NF-kB2 KO)やマクロファージ(PTPN2またはPTGER4 + KOマクロファージ)を含む遺伝子改変免疫細胞を得ている。また、オルガノイドをIL-22やIFN-γなどのサイトカインでチャレンジし、ILC1、樹状細胞、マクロファージ、上皮内リンパ球(IEL)などの免疫細胞と共培養することで、特定の細胞やサイトカインが上皮バリア機能にどのような影響を与え、それによって腸の炎症が促進されるかを解析した。(C)CRC研究では、通常ApcMin/+マウスモデルから樹立したオルガノイドと患者由来の腫瘍オルガノイドが適用される。IELやマクロファージなどの免疫細胞、サイトカイン(IL-22)、NK細胞由来の条件培地などを用いたオルガノイドの共培養系が報告されている。さらに、患者由来の腫瘍オルガノイドを用いた改良型T細胞共培養系が開発され、患者特異的腫瘍反応性細胞T細胞を生体外で増殖・選択することができる。図はBioRender.comで作成。
感染に対する免疫応答もまた、腸上皮の分化を方向づけることができる。蠕虫の感染は強力な2型免疫応答を引き起こし、分泌房細胞や杯細胞の増加を促し、虫の排出を促進する[45-47](図2A)。マウス腸管モデルを用いた研究から、これらの作用は炎症性サイトカインであるIL-4とIL-13によって上皮に直接媒介されることが明らかになり[45-48](図2A)、分泌性上皮細胞の分化を促進する上で、傷害を受けた上皮細胞や間質細胞から放出されるIL-33のオートクライン的役割は除外された[46, 48]。その代わりに、IL-33は異種の腸間膜リンパ節免疫集団によるIL-13産生を促進し、それによって杯細胞の成熟を間接的に促進することがわかった[48]。
いくつかのウイルスや細菌が腸管に感染して胃腸炎を引き起こすことがある。これには腸管アデノウイルスも含まれ、感染すると腸管上皮にT細胞が急速に集積する [49] 。蛍光標識アデノウイルスに感染したマウス腸管の共培養により、上皮内CD4+ T細胞が感染細胞と直接相互作用し、ウイルスクリアランスを促進することが示された。上皮細胞は、アデノウイルス受容体を基底細胞側に発現しており、3次元構造体の外側に露出している。また、トランスウェルインサート上で腸管由来の2次元単層培養を行い、先端からアクセス可能な微生物と基底に位置する免疫細胞との共培養を可能にすることで、密閉されたオルガノイド内腔を病原体に対してよりアクセスしやすくすることもできる[50](図1C)。この2Dシステムを用いて、2つの異なる病原性大腸菌株が免疫-上皮相互作用に及ぼす影響を評価した。腸オルガノイドの先端側を細菌株にさらすと、マクロファージが炎症反応を起こし、上皮オルガノイド層を通して樹状突起を伸ばし、上皮の完全性を損なうことなく病原体のクリアランスを促進することがわかった [50](図2A)。その後、このシステムは病原性赤痢菌が多形核好中球に与える影響を評価するために利用された [20]。赤痢菌の添加は、好中球の走化性マーカーの発現を増加させ、その結果、細菌を排除するために、PMNが上皮バリアを横切って移動した(図2A)。
腸の免疫介在性障害
免疫細胞は上皮の維持調節や感染予防に重要であるが、移植片対宿主病(GVHD)[51, 52]、感染症[53]、炎症性腸疾患(IBD)[54]などで証明されているように、長引く炎症や異常な免疫反応によって、腸管組織に損傷を与えることもある。オルガノイドは、これらの病態を引き起こす免疫細胞と上皮の相互作用を解明する上で、重要な役割を果たしている。
造血幹細胞移植は、骨髄性白血病のような悪性腫瘍患者の救命に役立つ。しかし、ドナーのT細胞はしばしば宿主組織を異物として認識し、GVHDを引き起こす。GVHDに伴う罹患率や死亡率の多くは、消化管の損傷に起因している [55] 。組織由来のオルガノイドと非同種ドナーのT細胞との共培養は、in vitroでGVHDを効果的にモデル化するのに用いることができる [51, 52, 56]。同種T細胞移植を受けたマウスから単離された陰窩は、オルガノイド形成能に障害を示し、これはISCの適性が失われていることを示している [51]。これと同様に、同種T細胞をマウス腸管やコロノイドと共培養すると、LGR5+遺伝子の発現やオルガノイドの生存率が低下した [51, 57]。しかしながら、オルガノイド上皮の免疫認識は、T細胞介在性障害の必要条件ではないことが判明した。いったんT細胞の活性化が起こると、同種T細胞も同系T細胞もオルガノイドの形成と生存を損なう [51, 57]。
活性化された免疫細胞は、主にTNF-αやIFN-γなどの炎症性サイトカインの分泌を介して腸オルガノイドにダメージを与えることが示されている [4, 51, 56, 57]。これは、TNFやIFN-γによって誘発される上皮のアポトーシスに対して抵抗性を示したNF-κB2欠損マウス腸小体を用いて、NF-κB2シグナルによって部分的に媒介されることが判明した [4]。同様に、細菌性リポ多糖によって活性化された骨髄由来樹状細胞(BMDC)は、NK-κB2依存的にマウス腸管の生存率を低下させた [4](図2B)。Lgr5+ ISC [51, 57]の喪失を引き起こすことに加え、IFN-γは腸陰窩に存在する分泌性パネス細胞にも影響を与える [57, 58]。陰窩の安定性の重要な制御因子であるパネス細胞は、抗菌性化合物 [58] を分泌することで感染に対する免疫を付与し、腸の微生物組成の選択に役立ち [59]、ISC維持のためのシグナル伝達の合図を与える [34]。マウスの腸小胞をIFN-γで処理すると、抗菌ペプチドを含む顆粒が急速に放出され、続いてパネス細胞がアポトーシスし、オルガノイド内腔に押し出された [57, 58]。この結果、IFN-γ処理24時間後には、機能的なパネス細胞の大部分が消失した [58]。IFN-γはまた、上皮細胞-細胞接合部の切断を刺激することによって、マウス腸管の透過性を増加させることができる [60]。このように、オルガノイドは、炎症性シグナルが腸のバリア維持に広く影響することを実証している。
腸の慢性炎症は、クローン病(CD)と潰瘍性大腸炎(UC)を主症状とするIBDの特徴である。IBDの病因は未解明であるが、腸管免疫-上皮相互作用の機能不全が疾患の発症と進行に中心的な役割を果たしている。IBD患者では、複数の免疫細胞が腸の炎症を制御している。T細胞に加え、ILC1も、恒常性のある腸組織では少ない数であるが、CD患者の炎症腸内に蓄積している [61] 。PSC由来のオルガノイドを用いた研究で、ヒトのILC1がTGF-βを分泌して、上皮細胞と間葉細胞の両方の挙動を制御することが見いだされた [23]。これは、CD患者の炎症腸から単離されたILC1でのみ観察され、培養で過増殖し、炎症のない対照から単離されたILC1では観察されなかった。この研究に用いられたオルガノイドは、遺伝的、エピジェネティック、環境的に同一のものであったため、慢性炎症が、炎症環境から除去された後でも、免疫細胞の表現型に長期的な変化をもたらす能力があることが実証された [23]。ECMのリモデリングは、IBDに関連する多くの後遺症の根底にある。ILC1はオルガノイド関連線維芽細胞によるECM沈着を増加させることから、ILC1頻度の増加とIBD病態との間に機能的な関連があることが示された [23](図2B)。さらに、TGF-βの枯渇により、CD11c+ lamina propria leukocytesまたはBMDCsの腸管上皮との異常な相互作用も報告されている [62]。これらの接着性相互作用は、BMDCs上に発現したE-カドヘリンによって媒介され、次いで腸上皮でNotchシグナルが活性化され(図2B)、杯細胞を欠く未分化の嚢胞性腸小胞が形成された[54]。オルガノイドで得られた結果と同様に、E-カドヘリンを発現する食細胞は炎症促進性の表現型を示し、UC患者の炎症組織に集積し、上皮細胞への免疫付着を媒介する [54]。免疫細胞と同様に、上皮細胞もパターン認識受容体を発現しており、病原体や損傷に関連した分子パターンを検出し、インターフェロン制御因子(IRF)を含むシグナル伝達カスケードを活性化する。以前は、IRFは主に免疫細胞において、インターフェロン刺激遺伝子15(ISG15)として知られるタンパク質のアップレギュレーションを促進すると考えられていた。しかし、ヒト大腸細胞を用いた最近の研究で、免疫刺激物質であるポリ(I:C)とTNF-αにさらされた大腸細胞は、さらにISG15を産生することが判明した [63]。このことは、ISG15で刺激された白血球がIBD関連サイトカインを産生することから、IBDの発症における腸上皮の役割に重要な示唆を与える可能性がある [63]。
IBD患者の炎症組織では、サイトカインIL-22の発現も増加しており [64] 、IL-22シグナル伝達の下流で誘導される遺伝子も増加している [65] 。しかし、バリアホメオスタシスにおけるIL-22の役割についてはまだ議論の余地がある。初期の報告では、IL-22産生ILC3を腸オルガノイドと共培養し、単一のLGR5+ ISCをIL-22で処理すると、オルガノイドの形成と増殖が促進されることが示されている[66]。このことは、IL-22で前処理した単一LGR5 + ISCは、未処理の陰窩と比較して、ex vivo放射線照射後の生存率およびオルガノイド形成能の改善を示したことから、放射線障害に対する保護作用を示すことが示された[66](図2C)。IL-22はまた、既存のパネス細胞における上皮接合タンパク質の遺伝子発現[67]と抗菌因子の発現[65, 66]を増加させ、このサイトカインが腸の再生とバリア機能を促進する能力をさらに裏付けている。その後、いくつかの独立したグループによって、IL-22が介在する腸管サイズの増大は、オルガノイド形成効率の時間および用量依存的な低下と並行して進行することが明らかにされた[67-69]。これは、ISCの更新を維持することを犠牲にして、高度に増殖性の通過増幅細胞コンパートメントが増殖することに起因している[68, 69]。ホメオスタシスにおけるIL-22のポジティブな役割を示した最初の研究では、オルガノイドを作製するために小腸と大腸の組織を組み合わせて用いたが[66]、その後の実験では小腸腸管のみで行われた[67-69]ので、IL-22が小腸と大腸の領域に異なる影響を与えることは否定できない。IL-22が腸で果たす保護的役割とは別に、IL-22で処理したコロノイドの遺伝子発現解析では、小胞体(ER)ストレスの増加が示されており、これは炎症に対する感受性の増加と関連している[65]。このことは、IL-22の切除によって小胞体ストレス関連の転写物が減少し、炎症性腸疾患の微生物誘発マウスモデルにおいて組織学的疾患スコアが改善したことからも裏付けられる[65]。腸上皮に対するIL-22の多様な影響を証明するものとして、ヒト大腸オルガノイドへのサイトカイン投与は、IBDにおいて潜在的に有害な経路である好中球走化性分子の発現を増加させた[70, 71]。
全体として、これらの研究は、腸オルガノイドと免疫細胞やサイトカインとの共培養が、疾患メカニズムの理解を深め、潜在的な治療標的を見出すための優れたプラットフォームとなることを示している。
オルガノイドを用いた腸炎症の遺伝的危険因子の研究
腸管オルガノイドは、腸の上皮再生を制御する外因性因子の影響を調べるために広く用いられてきた。しかし、腸管オルガノイドは、内因性の遺伝子発現が腸管の恒常性にどのように寄与しているかを調べるための魅力的なプラットフォームでもある。ゲノムワイド関連研究では、腸の炎症やバリア機能障害に対する感受性を付与する遺伝子変異がいくつか指摘されている [72-74] が、これらの多型の機能的帰結を解読することは困難であることが判明している。
慢性腸炎は、遺伝的因子と非遺伝的因子の両方が疾患の発症と進行に寄与する多因子性であると考えられている。IBD患者では200以上のリスク遺伝子座が同定されており、腸炎に対する遺伝的素因の大部分は、NOD2、IRGM、ATG16L1などのオートファジー関連遺伝子をコードする遺伝子座の遺伝的変異に起因している [72-74] 。オートファジーは、細胞成分の秩序ある分解とリサイクルを媒介する広く保存されたプロセスである。IBD感受性の促進に加えて、オートファジー機構の欠損は、上皮細胞を感染や免疫介在性障害に対してより脆弱にする [53, 56, 75, 76]。上皮オートファジーの基本的要件は、腸上皮のAtg16l1を選択的に欠損させたマウスから作製した小腸オルガノイドによって強調されている。これらのオルガノイドは、免疫メディエーターが存在しない場合でも、生存率とパネス細胞数の減少を示す [75]。さらに、オートファジー欠損オルガノイドは、活性化T細胞とともに培養すると、野生型と比較してオルガノイドが小さくなり、生存率も低下することから、免疫介在性障害を受けやすくなる [56, 75, 77]。共通のCD関連ATG16L1T300A変異体のホモ接合体であるヒトドナーから作製された腸内小器官は、同様に炎症性刺激に対して脆弱であり [56]、マウスとヒトの両方において、腸の炎症時に上皮のオートファジーに依存することが保存されていることを示している。炎症刺激は、オートファジーの欠陥によってもたらされるオルガノイドのフィットネスの低下を悪化させるが、非従来型のγδ上皮内リンパ球は、抗アポトーシス因子API5を分泌することによって、Atg16l1欠損腸管の生存率とパネス細胞の割合を回復させることができる [75](図2B)。API5の効果は、IBDリスク対立遺伝子ATG16L1T300Aのホモ接合体由来のオルガノイドでさらに確認され、API5がオルガノイドの生存率とパネス細胞数を回復させた。オートファジー関連遺伝子の多型がIBDリスクを増加させる役割はよく知られているが、オルガノイド研究では、他のリスク遺伝子も上皮と免疫の相互作用に影響を与えることが証明されている。腸管上皮全体に発現する核内受容体をコードするマウス腸管オルガノイドのLrh1を欠損させると、オルガノイドの生存率が著しく低下し、オルガノイドにTNFを作用させるとアポトーシス感受性が上昇した [78] 。
免疫細胞内在性遺伝子発現の変動もまた、腸における免疫-上皮相互作用の異常を引き起こす可能性がある。PTPN2遺伝子の機能喪失変異は、いくつかの炎症性疾患の発症リスクを上昇させる [74]。疾患関連PTPN2多型を持つ患者の単球由来マクロファージと腸管を共培養することにより(Spalingerら、2020年)、このような機能喪失型変異は腸管上皮の透過性を亢進させ、その結果バリアの完全性を低下させることが示された[79](図2B)。同様に、PTGER4+マクロファージから分泌されるCXCL1は、増殖細胞数と陰窩の出芽効率を増加させることにより、マウス腸管の上皮再生に主要な役割を果たしていることが判明した[80]。この研究と同様に、PTGER4の機能喪失変異もまた、腸管バリア抵抗性の障害によるものと推定され、IBDに関連している [81]。
これらの研究から、腸管オルガノイドは、遺伝学的研究によって決定された感受性遺伝子を検証し、疾患に関連する遺伝的変異の機能的影響を調査するための優れたプラットフォームであることが実証された。
大腸癌における免疫相互作用を研究するためのオルガノイドモデル
大腸がん(CRC)は、腸の腫瘍性上皮細胞から発生し、最も一般的な腸の悪性腫瘍の一つであり、環境的、遺伝的な危険因子により罹患率が増加している [82] 。免疫回避はがんの特徴であり、CRCオルガノイドモデルは、腸がんにおいて免疫-上皮相互作用がどのように変化するかを示すことができる。例えば、CRCオルガノイドは、悪性患者組織サンプル [14, 83] から作製することもできるし、大腸癌患者で一般的に変異が認められる癌抑制遺伝子大腸腺腫症(APCmin/+)の対立遺伝子をマウスで不活性化することによって作製することもできる [84] 。
NK細胞を含む免疫細胞は腫瘍の免疫サーベイランスにおいて主要な役割を果たすが、CRCではそのエフェクター機能が低下することがある。したがって、オルガノイド系を用いて腫瘍の免疫サーベイランスを理解することは、新たな治療戦略を見出すための貴重な手段となっている。炎症性シグナルに対する上皮の感受性は常に報告されているが [4, 51, 56, 57]、患者由来のCRCオルガノイドは、IFN-γ、TNF、その他のプロアポトーシス分子を豊富に含むナチュラルキラー細胞のコンディショニング培地に曝されても、生存率が変化しないことを示した [83](図2C)。APCで切除されたオルガノイドはIL-22レセプターの発現も低下し、IL-22治療にも抵抗性であったことから[85]、CRCにおける免疫と上皮の相互作用に別の変化があることが示された(図2C)。
変異負荷の少ない腫瘍は、腫瘍特異的抗原の発現が少なく、免疫監視から逃れやすい。様々なレベルの腫瘍特異的抗原を持つCRCオルガノイドは、いくつかのCRCに典型的な変異を持つレンチウイルスウイルスでマウス大腸細胞を形質転換することによって作製された [86] 。変異したオルガノイドを生きたマウスの腸粘膜に注入すると、低抗原オルガノイドでは免疫応答が遅く、弱かった。これは、細胞傷害性CD8+T細胞のクロスプライミングが不十分で、疲弊してエフェクター機能を失ったためであった。
オルガノイドはCRCの治療アプローチにも役立つ。放射線はほとんどの固形癌に対する一般的な治療法であるが、周辺組織を傷つけるリスクがある。腸の恒常性維持における無傷のバリアの重要な役割を考慮すると、放射線障害後の損傷組織の修復は不可欠である。オルガノイドの研究から、傷害を受ける前の腸内にIL-22が存在することが、腸マクロファージによるWntの分泌と並んで、放射線照射後の上皮再生に中心的な役割を果たすことが証明されている [66] [87](図2C)。
悪性細胞に対する宿主の免疫応答を高める免疫療法は、従来の治療法に加えて有用であることが証明されている。患者由来のT細胞を培養して増殖させ、元の宿主に戻す養子T細胞療法は、現在採用されているがん免疫療法の一例である。最近の研究では、患者由来の腫瘍オルガノイドが、自己腫瘍反応性T細胞を選択的に増殖させることにより、治療を前進させることが実証されている [88, 89](図2C)。さらに、腫瘍上皮に加えて腫瘍浸潤免疫細胞と間質細胞の両方を含む複雑な患者由来オルガノイドを、気液界面法を用いて作製することもできる [14]。現在のところ、その寿命が限られているために制限されているが、これらのオルガノイドに腫瘍周囲の微小環境が含まれていることから、精密がん治療にとって魅力的な見込みがある。免疫-CRC共培養系に関するこの一連の研究を総合すると、がん研究のための生体外プラットフォームとして有望であることが示され、科学的発見の臨床への応用が促進される。
結論と今後の展望
腸管オルガノイドは、腸管における免疫-上皮相互作用をモデル化するための汎用性の高いプラットフォームであり、免疫細胞とそのメディエーターが腸管上皮に与える影響についての理解を大きく前進させた。患者やトランスジェニックマウスから採取した組織由来オルガノイドは、すでに疾患に関連した上皮欠損の研究に用いられており、最近では、UC患者から採取した再プログラム化線維芽細胞がエピジェネティックな刷り込みを保持し、疾患形質を持つPSC由来オルガノイドにつながることが発見された[90]。さらに、CRISPRベースの技術は、誘導されたPSC株のゲノム編集を可能にし[91]、最近では組織由来オルガノイドにおいて標的遺伝子の条件付きノックダウンや過剰発現を可能にするように最適化されている[92]。これらの発見は、疾患特異的なヒト腸オルガノイドの開発や、病理学における免疫-上皮相互作用をin vitroでモデル化するための新たな可能性を明らかにするものである。あまり研究されていないが、オルガノイドは腸管における免疫細胞の組織特異性についての知見も与えてくれる。このような疾患モデルが、上皮機能不全が免疫表現型に与える影響についての洞察を提供し、疾患関連免疫細胞をin vitroで作製するのに利用できる可能性があるかどうかが注目される。さらに、患者由来のオルガノイドも、操作が容易でヒトのCRC腫瘍をよく模倣していることから、CRCの背後にある遺伝学的、細胞的、分子的メカニズムを研究するための強力なモデルとして浮上している [93] 。しかしながら、CRCオルガノイドにおける上皮細胞の割合や機能に関する詳細な特徴付けが不十分であるため、結果の解釈を誤る可能性がある。さらに、新鮮な生検に存在する生存可能な腫瘍幹細胞の数が少ないことが、オルガノイド作製の妨げとなっている [94] 。このような限界はあるものの、オルガノイドを使用することで、患者が治療にどのように反応するかを明らかにできる可能性があり、それによってCRCの治療における個別化医療の実施が促進される [93] 。
オルガノイド培養に必要な特殊な装置がないため、多くの研究分野でこの技術の導入と応用が促進されている。その大きな可能性とは裏腹に、オルガノイド共培養研究から得られた知見は、オルガノイドが反映する腸管領域や発生段階にも大きく影響されることを心に留めておくことが重要である。このことが研究間の食い違いの一因になっている可能性があり、ある研究課題に対してどのタイプの腸オルガノイドが最も生理学的に適切なモデルであるかを検討する価値がある。市販の試薬が高価であったり、共培養が最適化されているために、研究グループ間で培地組成にばらつきがあることも、研究間の予期せぬばらつきの原因となるかもしれない。他の細胞培養系と同様、腸管オルガノイドも、生体内で観察される生化学的・生物物理学的手がかりの全領域を欠いている。そのため、この制限を克服するために、免疫不全マウス[9, 11]やヒト化マウス[95]の腎臓被膜下に腸管オルガノイドを移植した研究もある。移植されたオルガノイドには免疫細胞が浸潤し、リンパ系構造を形成するが [95]、in vitroの免疫-オルガノイド共培養によってもたらされた免疫-上皮相互作用へのアクセス性と制御性は、移植と同時に失われてしまう。一般的に使用されている動物由来のECMリッチゲルに代わるものとして、改変可能な合成ゲルマトリックスを用いて、in vitroでの生化学的手がかりや腸の物理的特性をモデリングできるように、最適化するための継続的な努力がなされている [23, 96, 97]。このような限界はあるものの、腸オルガノイドは現在、腸の最も正確なin vitroシステムを提供し、腸における免疫-上皮相互作用の還元論的研究を可能にしており、基礎研究とトランスレーショナルリサーチの両方のツールとして大きな可能性を示している。
謝辞
原稿を批判的に読んでくださったIsabelle Coales博士に感謝する。
利益相反
申告なし。
資金提供
著者らは、バスク政府およびMechanics of Life Leverhulme博士課程奨学金プログラムからの資金提供を表明している。E.H.K.は、キングス・カレッジ・ロンドンのMechanics of Life Leverhulme Doctoral Scholarship Programmeから博士課程の学生奨学金を、APCはバスク政府から博士研究員奨学金を授与された。
著者貢献
J.F.N.は原稿のテーマを構想した。原稿はJ.F.N.、E.H.K.、A.P.C.がデザインした。E.H.K.とA.P.C.は研究、原稿執筆、図表デザインを行った。著者全員が最終原稿を読み、編集し、承認した。
参考文献
Stallmach A, Hahn U, Merker HJ, Hahn EG, Riecken EO. ラット腸管上皮細胞の分化は、in vitroで器官型間葉系細胞により誘導される。Gut 1989, 30, 959-70.
Google ScholarCrossrefPubMedWorldCatBarker N, van Es JH, Kuipers J, Kujala P, van den Born M, Cozijnsen M, et al. マーカー遺伝子Lgr5による小腸および大腸の幹細胞の同定。Nature 2007, 449, 1003-7.
Google ScholarCrossrefPubMedWorldCatSato T, Vries RG, Snippert HJ, van de Wetering M, Barker N, Stange DE, et al. 単一のLgr5幹細胞は、間葉系ニッチを介さずにin vitroで陰窩-絨毛構造を構築する。Nature 2009, 459, 262-5.
Google ScholarCrossrefPubMedWorldCatJones LG, Vaida A, Thompson LM, Ikuomola FI, Caamano JH, Burkitt MD, et al. 腸管におけるNF-κB2シグナル伝達は、骨髄由来樹状細胞からの分泌因子に対する腸細胞の応答を調節する。Cell Death Dis 2019, 10, 896. doi:10.1038/s41419-019-2129-5
Google ScholarCrossrefPubMedWorldCatJattan J, Rodia C, Li D, Diakhate A, Dong H, Bataille A, et al. 食餌性TAG吸収、リポタンパク質合成、および腸におけるapoC-IIIの役割を研究するための初代マウス腸管腸管を使用する。J Lipid Res 2017, 58, 853-65. doi:10.1194/jlr.M071340.
Google ScholarCrossrefPubMedWorldCatSato T, Stange DE, Ferrante M, Vries RG, Van Es JH, Van den Brink S, et al. ヒト大腸、腺腫、腺癌およびバレット上皮からの上皮オルガノイドの長期拡張。Gastroenterology 2011, 141, 1762-72.
Google ScholarCrossrefPubMedWorldCatSpence JR, Mayhew CN, Rankin SA, Kuhar MF, Vallance JE, Tolle K, et al. ヒト多能性幹細胞をin vitroで腸組織へ誘導分化させる。Nature 2011, 470, 105-9.
Google ScholarCrossrefPubMedWorldCatMunera JO, Sundaram N, Rankin SA, Hill D, Watson C, Mahe M, et al. BMPシグナルの一過性の活性化を介したヒト多能性幹細胞の大腸オルガノイドへの分化。Cell Stem Cell 2017, 21, 51-64.e6. doi:10.1016/j.stem.2017.05.020
Google ScholarCrossrefPubMedWorldCatYu Q, Kilik U, Holloway EM, Tsai YH, Harmel C, Wu A, et al. 多内胚葉臓器アトラスとオルガノイドモデルを用いたヒト発生図の作成。細胞2021, 184, 3281-3298.e22. doi:10.1016/j.cell.2021.04.028
Google ScholarCrossrefPubMedWorldCatPoling HM, Wu D, Brown N, Baker M, Hausfeld TA, Huynh N, et al. in vivoにおけるヒト腸オルガノイドの機械的誘導による発生と成熟。Nat Biomed Eng 2018, 2, 429-42. doi:10.1038/s41551-018-0243-9
Google ScholarCrossrefPubMedWorldCatJung KB, Lee H, Son YS, Lee MO, Kim YD, Oh SJ, et al. Interleukin-2 induced the in vitro maturation of human pluripotent stem cell-derived intestinal organoids. Nat Commun 2018, 9, 3039. doi:10.1038/s41467-018-05450-8
Google ScholarCrossrefPubMedWorldCatHolloway EM, Czerwinski M, Tsai YH, Wu JH, Wu A, Childs CJ, et al. ヒト腸管ニッチの発達を単一細胞解像度でマッピング。細胞幹細胞 2021, 28, 568-580.e4. doi:10.1016/j.stem.2020.11.008
Google ScholarCrossrefPubMedWorldCatOotani A, Li X, Sangiorgi E, Ho QT, Ueno H, Toda S, et al. Wnt依存性幹細胞ニッチ内での持続的in vitro腸管上皮培養。Nat Med 2009, 15, 701-6.
Google ScholarCrossrefPubMedWorldCatNeal JT, Li X, Zhu J, Giangarra V, Grzeskowiak CL, Ju J, et al. 腫瘍免疫微小環境のオルガノイドモデリング。Cell 2018, 175, 1972-1988.e16. doi:10.1016/j.cell.2018.11.021
Google ScholarCrossrefPubMedWorldCatYin X, Farin HF, van Es JH, Clevers H, Langer R, Karp JM. Lgr5+腸管幹細胞とその子孫細胞のニッチ非依存的高純度培養。Nat Methods 2014, 11, 106-12.
Google ScholarCrossrefPubMedWorldCatZeve D, Stas E, de Sousa Casal J, Mannam P, Qi W, Yin X, et al. 腸管幹細胞からのヒト腸内分泌細胞の頑健な分化。Nat Commun 2022, 13, 261. doi:10.1038/s41467-021-27901-5
Google ScholarCrossrefPubMedWorldCatde Lau W, Kujala P, Schneeberger K, Middendorp S, Li VS, Barker N, et al. Lgr5(+)幹細胞由来のパイエル板M細胞はSpiBを必要とし、培養「ミニガット」中のRankLによって誘導される。Mol Cell Biol 2012, 32, 3639-47.
Google ScholarCrossrefPubMedWorldCat免疫学研究におけるオルガノイド。Nat Rev Immunol 2020, 20, 279-93.
Google ScholarCrossrefPubMedWorldCatT細胞と上皮細胞の相互作用を研究するための3次元腸管モデル。J Immunol Methods 2015, 421, 89-95. doi:10.1016/j.jim.2015.03.014.
Google ScholarCrossrefPubMedWorldCatLemme-Dumit JM, Doucet M, Zachos NC, Pasetti MF. ヒト腸管腸管好中球共培養モデルにおける上皮と好中球の相互作用と赤痢菌に対する協調反応。
Google ScholarCrossrefPubMedWorldCatStaab JF, Lemme-Dumit JM, Latanich R, Pasetti MF, Zachos NC. ヒト腸球菌/コロノイドと自然免疫細胞との共培養系。Curr Protoc Immunol 2020, 131, e113. doi:10.1002/cpim.113
Google ScholarCrossrefPubMedWorldCatRead E, Jowett GM, Coman D, Neves JF. マウス小腸上皮オルガノイドの自然リンパ球との共培養。J Vis Exp 2022. 3/23:(181). doi: 10.3791/63554
Google ScholarWorldCatJowett GM, Norman MDA, Yu TTL, Rosell Arevalo P, Hoogland D, Lust ST, et al. ILC1は腸上皮とマトリックスのリモデリングを促進する。Nat Mater 2021, 20, 250-9. doi:10.1038/s41563-020-0783-8
Google ScholarCrossrefPubMedWorldCatJowett GM, Read E, Roberts LB, Coman D, Vila Gonzalez M, Zabinski T, et al. オルガノイドは、マウスとヒトにおける組織特異的な自然リンパ球の発生を捉える。doi:10.1016/j.celrep.2022.111281.
Google ScholarCrossrefPubMedWorldCatWilson SS, Tocchi A, Holly MK, Parks WC, Smith JG. 非侵襲性腸管病原体-上皮細胞相互作用の小腸オルガノイドモデル。Mucosal Immunol 2015, 8, 352-61. doi:10.1038/mi.2014.72
Google ScholarCrossrefPubMedWorldCatNoel G, Baetz NW, Staab JF, Donowitz M, Kovbasnjuk O, Pasetti MF, et al. Erratum: a primary human macrophage-enteroid co-culture model to investigate mucosal gut physiology and host-pathogen interactions. Sci Rep 2017, 7, 46790.
Google ScholarCrossrefPubMedWorldCatCo JY, Margalef-Catala M, Li X, Mah AT, Kuo CJ, Monack DM, et al. 上皮極性の制御:宿主-病原体相互作用のためのヒト腸管モデル。Cell Rep 2019, 26, 2509-2520.e4. doi:10.1016/j.celrep.2019.01.108.
Google ScholarCrossrefPubMedWorldCat鶴田慎一郎、川崎哲也、町田真紀子、岩槻和彦、稲葉昭彦、柴田聡、他.腸管免疫応答モデルとしての組織マクロファージを常在させたヒト腸管オルガノイドの開発。Cell Mol Gastroenterol Hepatol 2022, 14, 726-729.e5. doi:10.1016/j.jcmgh.2022.06.006
Google ScholarCrossrefPubMedWorldCatMowat AM, Scott CL, Bain CC. バリア組織マクロファージ:環境的課題への機能的適応。Nat Med 2017, 23, 1258-70.
Google ScholarCrossrefPubMedWorldCatVivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, et al. 自然リンパ球:10年後。Cell 2018, 174, 1054-66. doi:10.1016/j.cell.2018.07.017.
Google ScholarCrossrefPubMedWorldCatLim AI, Li Y, Lopez-Lastra S, Stadhouders R, Paul F, Casrouge A, et al. 全身性ヒトILC前駆体は、組織ILC分化の基質を提供する。Cell 2017, 168, 1086-1100.e10. doi:10.1016/j.cell.2017.02.021
Google ScholarCrossrefPubMedWorldCatKokkinou E, Pandey RV, Mazzurana L, Gutierrez-Perez I, Tibbitt CA, Weigel W, et al. ヒト組織におけるCD45RA(+)CD62L(-)ILCsは、分化ILCs生成のための静止期局所リザーバーである。Sci Immunol 2022, 7, eabj8301.
Google ScholarCrossrefPubMedWorldCat多能性幹細胞の胸腺上皮細胞への分化と胸腺オルガノイドの作製:APECEDに対する治療戦略への応用。Front Immunol 2022, 13, 930963. doi:10.3389/fimmu.2022.930963. pmid: 35844523; pmcid: pmc9277542.
Google ScholarCrossrefPubMedWorldCatクリプトからの物語:腸管幹細胞に関する新たな洞察。Nat Rev Gastroenterol Hepatol 2019, 16, 19-34. doi:10.1038/s41575-018-0081-y
Google ScholarCrossrefPubMedWorldCatBiton M, Haber AL, Rogel N, Burgin G, Beyaz S, Schnell A, et al. Tヘルパー細胞サイトカインは、腸管幹細胞の再生と分化を調節する。Cell 2018, 175, 1307-1320.e22. doi:10.1016/j.cell.2018.10.008
Google ScholarCrossrefPubMedWorldCatHeuberger C, Pott J, Maloy KJ. なぜ腸管上皮細胞はMHCクラスIIを発現するのか?Immunology 2021, 162, 357-67.
Google ScholarCrossrefPubMedWorldCatWosen JE, Ilstad-Minnihan A, Co JY, Jiang W, Mukhopadhyay D, Fernandez-Becker NQ, et al. ヒト腸管エンテロイドは、腸上皮におけるMHC-IIのモデルである。Front Immunol 2019, 10, 1970. doi:10.3389/fimmu.2019.01970
Google ScholarCrossrefPubMedWorldCatSchreurs R, Baumdick ME, Sagebiel AF, Kaufmann M, Mokry M, Klarenbeek PL, et al. ヒト胎児TNFα-サイトカイン産生CD4(+)エフェクターメモリーT細胞は、腸の発達を促進し、生後早期の炎症を媒介する。Immunity 2019, 50, 462-76 e8.
Google ScholarCrossrefPubMedWorldCat炎症性腸疾患の病態における腸内細菌叢。Clin J Gastroenterol 2018, 11, 1-10. doi:10.1007/s12328-017-0813-5
Google ScholarCrossrefPubMedWorldCatAnanthakrishnan AN, Bernstein CN, Iliopoulos D, Macpherson A, Neurath MF, Ali RAR, et al. IBDにおける環境トリガー:進歩とエビデンスのレビュー。Nat Rev Gastroenterol Hepatol 2018, 15, 39-49. doi:10.1038/nrgastro.2017.136
Google ScholarCrossrefPubMedWorldCatMindaugas P, Pilar SV, Mastura N, Sina B, Organoids as a tool to study the impact of heterogeneity in gastrointestinal epithelium on host-pathogen interactions, Clin Exp Immunol 2024, uxae002, https://doi.org/10.1093/cei/uxae002
Google ScholarWorldCatSanders ME, Merenstein DJ, Reid G, Gibson GR, Rastall RA. 腸の健康と病気におけるプロバイオティクスとプレバイオティクス:生物学から臨床まで。Nat Rev Gastroenterol Hepatol 2019, 16, 605-16.
Google ScholarCrossrefPubMedWorldCatEngevik MA, Ruan W, Esparza M, Fultz R, Shi Z, Engevik KA, et al. ラクトバチルス・ロイテリ(Lactobacillus reuteri)表面成分と代謝産物による樹状細胞の免疫調節。Physiol Rep 2021, 9, e14719. doi:10.14814/phy2.14719.
Google ScholarCrossrefPubMedWorldCatHu J, Deng F, Zhao B, Lin Z, Sun Q, Yang X, et al. ラクトバチルス・ムリヌスは、toll様受容体2シグナルを介してM2マクロファージからのインターロイキン-10の放出を促進することにより、腸の虚血/再灌流障害を緩和する。doi:10.1186/s40168-022-01227-w
Google ScholarCrossrefPubMedWorldCatGerbe F, Sidot E, Smyth DJ, Ohmoto M, Matsumoto I, Dardalhon V, et al. 腸上皮房細胞は蠕虫寄生虫に対する2型粘膜免疫を開始する。Nature 2016, 529, 226-30. doi:10.1038/nature16527.
Google ScholarCrossrefPubMedWorldCatvon Moltke J, Ji M, Liang HE, Locksley RM. タフト細胞由来のIL-25は、腸管ILC2-上皮応答回路を制御する。Nature 2016, 529, 221-5. doi:10.1038/nature16161.
Google ScholarCrossrefPubMedWorldCatHowitt MR, Lavoie S, Michaud M, Blum AM, Tran SV, Weinstock JV, et al. 味覚化学感覚細胞であるタフト細胞は、腸内の寄生虫2型免疫を制御している。Science 2016, 351, 1329-33. doi:10.1126/science.aaf1648.
Google ScholarCrossrefPubMedWorldCatWaddell A, Vallance JE, Hummel A, Alenghat T, Rosen MJ. IL-33は、自然リンパ球IL-13分泌を介して間接的にマウス腸杯細胞の分化を誘導する。J Immunol 2019, 202, 598-607. doi:10.4049/jimmunol.1800292.
Google ScholarCrossrefPubMedWorldCatParsa R, London M, Rezende de Castro TB, Reis B, Buissant des Amorie J, Smith JG, et al. 新たに上皮内にリクルートされたLy6A(+)CCR9(+)CD4(+)T細胞は、腸管ウイルス感染から身を守る。Immunity 2022, 55, 1234-1249.e6. doi:10.1016/j.immuni.2022.05.001
Google ScholarCrossrefPubMedWorldCatNoel G, Baetz NW, Staab JF, Donowitz M, Kovbasnjuk O, Pasetti MF, et al. 粘膜腸生理学と宿主-病原体相互作用を調べるための初代ヒトマクロファージ-腸管共培養モデル。Sci Rep 2017, 7, 45270.
Google ScholarCrossrefPubMedWorldCat高島聡、Martin ML、Jansen SA、Fu Y、Bos J、Chandra D、et al. 免疫介在性腸管障害におけるT細胞由来インターフェロン-ガンマプログラム幹細胞死。Sci Immunol 2019, 4, eaay8556. doi:10.1126/sciimmunol.aay8556.
Google ScholarCrossrefPubMedWorldCatJoly AL, Deepti A, Seignez A, Goloudina A, Hebrard S, Schmitt E, et al. HSP90阻害剤17AAGは、腸管幹細胞ニッチを保護し、移植片対宿主病の発症を抑制する。Oncogene 2016, 35, 2948.
Google ScholarCrossrefPubMedWorldCatBurger E, Araujo A, Lopez-Yglesias A, Rajala MW, Geng L, Levine B, et al. パネス細胞オートファジーの喪失は、トキソプラズマ・ゴンディ媒介炎症に対する急性感受性を引き起こす。Cell Host Microbe 2018, 23, 177-190.e4. doi:10.1016/j.chom.2018.01.001
Google ScholarCrossrefPubMedWorldCat井原慎一郎、平田祐一郎、引羽雄一郎、山下明彦、坪井正明、畑正明、他.単核食細胞と腸上皮の接着性相互作用は、正常な上皮分化を阻害し、炎症性腸疾患の治療標的となる。J Crohns Colitis 2018, 12, 1219-31. doi:10.1093/ecco-jcc/jjy088
Google ScholarPubMedWorldCat移植片対宿主病。doi:10.1016/S0140-6736(09)60237-3.
Google ScholarCrossrefPubMedWorldCat松澤-石本祐子、Hine A、庄野陽一、Rudensky E、Lazrak A、Yeung F、他。T細胞を介した組織傷害に対する感受性を再現する腸オルガノイドベースのプラットフォーム。血液2020, 135, 2388-401.
Google ScholarCrossrefPubMedWorldCatEriguchi Y, Nakamura K, Yokoi Y, Sugimoto R, Takahashi S, Hashimoto D, et al. T細胞関連腸炎症におけるIFN-γの重要な役割. JCI Insight 2018, 3, e121886. doi:10.1172/jci.insight.121886.
Google ScholarCrossrefPubMedWorldCatFarin HF, Karthaus WR, Kujala P, Rakhshandehroo M, Schwank G, Vries RG, et al. パネス細胞の押し出しと抗菌産物の放出は、免疫細胞由来のIFN-γによって直接制御される。J Exp Med 2014, 211, 1393-405. doi:10.1084/jem.20130753.
Google ScholarCrossrefPubMedWorldCatSalzman NH. パネス細胞ディフェンシンとマイクロバイオームの制御:粘膜表面における緊張緩和。Gut Microbes 2010, 1, 401-6. doi:10.4161/gmic.1.6.14076
Google ScholarCrossrefPubMedWorldCatBardenbacher M, Ruder B, Britzen-Laurent N, Schmid B, Waldner M, Naschberger E, et al. 腸オルガノイドにおけるインターフェロンガンマ誘発バリア崩壊の透過性解析と三次元イメージング。Stem Cell Res 2019, 35, 101383.
Google ScholarCrossrefPubMedWorldCatBernink JH, Peters CP, Munneke M, te Velde AA, Meijer SL, Weijer K, et al. ヒト1型自然リンパ球は、炎症を起こした粘膜組織に集積する。Nat Immunol 2013, 14, 221-9.
Google ScholarCrossrefPubMedWorldCat井原慎一郎、平田祐一郎、芹沢高志、鈴木直樹、崎谷和彦、木下博之、他。樹状細胞におけるTGF-βシグナルは、上皮分化と管腔細菌叢を制御することにより、大腸の恒常性を支配する。J Immunol 2016, 196, 4603-13. doi:10.4049/jimmunol.1502548
Google ScholarCrossrefPubMedWorldCatOstvik AE, Svendsen TD, Granlund AVB, Doseth B, Skovdahl HK, Bakke I, et al. 潰瘍性大腸炎およびクローン病の活動期に、腸管上皮細胞は免疫調節性のISG15を発現する。J Crohns Colitis 2020, 14, 920-34. doi:10.1093/ecco-jcc/jjaa022
Google ScholarCrossrefPubMedWorldCatBrand S, Beigel F, Olszak T, Zitzmann K, Eichhorst ST, Otte JM, et al. IL-22は活動性クローン病で増加し、炎症性遺伝子の発現と腸上皮細胞の移動を促進する。Am J Physiol Gastrointest Liver Physiol 2006, 290, G827-38. doi:10.1152/ajpgi.00513.2005
Google ScholarCrossrefPubMedWorldCatPowell N, Pantazi E, Pavlidis P, Tsakmaki A, Li K, Yang F, et al. インターロイキン22は、大腸上皮細胞において病的な小胞体ストレス応答転写プログラムを編成する。Gut 2020, 69, 578-90. doi:10.1136/gutjnl-2019-318483.
Google ScholarCrossrefPubMedWorldCatLindemans CA, Calafiore M, Mertelsmann AM, O'Connor MH, Dudakov JA, Jenq RR, et al. インターロイキン-22は、腸管幹細胞を介した上皮再生を促進する。Nature 2015, 528, 560-4. doi:10.1038/nature16460
Google ScholarCrossrefPubMedWorldCatZwarycz B, Gracz AD, Rivera KR, Williamson IA, Samsa LA, Starmer J, et al. IL22は回腸オルガノイドモデルにおいて上皮幹細胞の増殖を阻害する。Cell Mol Gastroenterol Hepatol 2019, 7, 1-17. doi:10.1016/j.jcmgh.2018.06.008.
Google ScholarCrossrefPubMedWorldCatZhang X, Liu S, Wang Y, Hu H, Li L, Wu Y, et al. インターロイキン-22は、炎症時の腸上皮のホメオスタシスを制御する。Int J Mol Med 2019, 43, 1657-68. doi:10.3892/ijmm.2019.4092.
グーグルScholarPubMedWorldCatZha JM, Li HS, Lin Q, Kuo WT, Jiang ZH, Tsai PY, et al. インターロイキン22は、Wntおよびノッチシグナルの阻害を介して、Lgr5(+)幹細胞を枯渇させる一方で、トランジット増幅細胞を拡大する。Cell Mol Gastroenterol Hepatol 2019, 7, 255-74. doi:10.1016/j.jcmgh.2018.09.006
Google ScholarCrossrefPubMedWorldCatPavlidis P, Tsakmaki A, Pantazi E, Li K, Cozzetto D, Digby-Bell J, et al. インターロイキン22は潰瘍性大腸炎における好中球の動員を制御し、ウステキヌマブ療法に対する抵抗性と関連している。Nat Commun 2022, 13, 5820.
Google ScholarCrossrefPubMedWorldCatHe GW, Lin L, DeMartino J, Zheng X, Staliarova N, Dayton T, et al. 最適化されたヒト腸オルガノイドモデルにより、パネス細胞形成のインターロイキン22依存性が明らかになった。細胞幹細胞 2022, 29, 1333-1345.e6. doi:10.1016/j.stem.2022.08.002
Google ScholarCrossrefPubMedWorldCatHugot JP, Chamaillard M, Zouali H, Lesage S, Cezard JP, Belaiche J, et al. NOD2ロイシンリッチリピート変異体とクローン病感受性との関連。Nature 2001, 411, 599-603.
Google ScholarCrossrefPubMedWorldCatRioux JD, Xavier RJ, Taylor KD, Silverberg MS, Goyette P, Huett A, et al. ゲノムワイド関連研究により、クローン病の新たな感受性遺伝子座が同定され、疾患発症にオートファジーが関与していることが明らかになった。Nat Genet 2007, 39, 596-604.
Google ScholarCrossrefPubMedWorldCatウェルカム・トラスト・ケースコントロール・コンソーシアム。7つの一般的な疾患の14,000症例と3,000の共有対照のゲノムワイド関連研究。Nature 2007, 447, 661-78.
CrossrefPubMedWorldCat松澤-石本祐子、Yao X、小出明彦、Ueberheide BM、Axelrad JE、Reis BS、他。哺乳動物IELエフェクターAPI5は、パネス細胞死に対する遺伝的感受性を隠している。Nature 2022, 610, 547-54. doi:10.1038/s41586-022-05259-y
Google ScholarCrossrefPubMedWorldCatAden K, Tran F, Ito G, Sheibani-Tezerji R, Lipinski S, Kuiper JW, et al. ATG16L1は、cGAS-STINGを介して腸管上皮におけるインターロイキン-22シグナル伝達を制御する。J Exp Med 2018, 215, 2868-86. doi:10.1084/jem.20171029.
Google ScholarCrossrefPubMedWorldCatアクアポリン-9は小腸の粘液分泌性杯細胞サブセットに発現している。FEBS Lett 2003, 540, 157-62. doi:10.1016/s0014-5793(03)00256-4
Google ScholarCrossrefPubMedWorldCatBayrer JR, Wang H, Nattiv R, Suzawa M, Escusa HS, Fletterick RJ, et al. LRH-1は、上皮恒常性と細胞生存を維持することにより、腸炎症性疾患を軽減する。Nat Commun 2018, 9, 4055. doi:10.1038/s41467-018-06137-w
Google ScholarCrossrefPubMedWorldCatSpalinger MR, Hai R, Li J, Santos AN, Nordgren TM, Tremblay ML, et al. ヒト/マウス細胞におけるSARS-CoV-2感染の新規感受性マーカーの同定と、臨床的に承認されたJAK阻害剤によるリスク軽減。
Google ScholarWorldCatNa YR, Jung D, Stakenborg M, Jang H, Gu GJ, Jeong MR, et al. プロスタグランジンE(2)受容体PTGER4発現マクロファージは、炎症時に腸管上皮バリア再生を促進する。Gut 2021, 70, 2249-60. doi:10.1136/gutjnl-2020-322146
Google ScholarCrossrefPubMedWorldCatWu PB, Qian R, Hong C, Guo YT, Yu YJ, Zhang G, et al. 白人におけるPTGER4多型と炎症性腸疾患リスクとの関連:メタアナリシス。医学(Baltim)2020, 99, e19756. doi:10.1097/MD.000000019756
Google ScholarCrossrefWorldCatDekker E, Tanis PJ, Vleugels JLA, Kasi PM, Wallace MB. 大腸がん。Lancet 2019, 394, 1467-80. doi:10.1016/S0140-6736(19)32319-0
Google ScholarCrossrefPubMedWorldCatParseh B, Khosravi A, Fazel A, Ai J, Ebrahimi-Barough S, Verdi J, et al. 患者由来の大腸がんオルガノイドを用いた、活性化ナチュラルキラー細胞コンディショニング培地のアポトーシス誘導を研究するための3次元モデル。論文番号:Front Cell Dev Biol 2022, 10, 895284.doi:10.3389/fcell.2022.895284。
Google ScholarCrossrefPubMedWorldCat森川理恵子、根本泰典、米本祐一郎、田中慎一郎、武井祐一郎、大島慎一郎、他。上皮内リンパ球は、CD103/E-カドヘリンシグナルを介した細胞間接触により腸腫瘍の増殖を抑制する。Cell Mol Gastroenterol Hepatol 2021, 11, 1483-503.
Google ScholarCrossrefPubMedWorldCatChen Y, Vandereyken M, Newton IP, Moraga I, Nathke IS, Swamy M. Loss of adenomatous polyposis coli function renders intestinal epithelial cells resistant to the cytokine IL-22. PLoS Biol 2019, 17, e3000540. doi:10.1371/journal.pbio.3000540.
Google ScholarCrossrefPubMedWorldCatWestcott PMK, Sacks NJ, Schenkel JM, Ely ZA, Smith O, Hauck H, et al. 大腸癌における早期免疫逃避の背景には、低新生抗原発現とT細胞のプライミング不良がある。Nat Cancer 2021, 2, 1071-85. doi:10.1038/s43018-021-00247-z
Google ScholarCrossrefPubMedWorldCatSaha S, Aranda E, Hayakawa Y, Bhanja P, Atay S, Brodin NP, et al. マクロファージ由来の細胞外小胞パッケージ化WNTは、放射線損傷後の腸幹細胞をレスキューし、生存を増強する。Nat Commun 2016, 7, 13096.
Google ScholarCrossrefPubMedWorldCatDijkstra KK, Cattaneo CM, Weeber F, Chalabi M, van de Haar J, Fanchi LF, et al. 末梢血リンパ球と腫瘍オルガノイドの共培養による腫瘍反応性T細胞の生成。Cell 2018, 174, 1586-1598.e12. doi:10.1016/j.cell.2018.07.009
Google ScholarCrossrefPubMedWorldCatCattaneo CM, Dijkstra KK, Fanchi LF, Kelderman S, Kaing S, van Rooij N, et al. 腫瘍オルガノイド-T細胞共培養系。Nat Protoc 2020, 15, 15-39. doi:10.1038/s41596-019-0232-9
Google ScholarCrossrefPubMedWorldCatSarvestani SK, Signs S, Hu B, Yeu Y, Feng H, Ni Y, et al. 潰瘍性大腸炎患者由来の誘導オルガノイドは、大腸菌の反応性を再現する。Nat Commun 2021, 12, 262. doi:10.1038/s41467-020-20351-5
Google ScholarCrossrefPubMedWorldCatTian R, Gachechiladze MA, Ludwig CH, Laurie MT, Hong JY, Nathaniel D, et al. CRISPR interference-based platform for multimodal genetic screens in human iPSC-derived neurons. Neuron 2019, 104, 239-255.e12. doi:10.1016/j.neuron.2019.07.014
Google ScholarCrossrefPubMedWorldCatSun D, Evans L, Perrone F, Sokleva V, Lim K, Rezakhani S, et al. ヒト組織由来オルガノイドのための機能的遺伝子ツールボックス。Elife 2021, 10:e67886. doi:10.7554/eLife.67886.
Google ScholarCrossrefPubMedWorldCatVlachogiannis G, Hedayat S, Vatsiou A, Jamin Y, Fernandez-Mateos J, Khan K, et al. 患者由来オルガノイドは、転移性消化管がんの治療反応をモデル化する。Science 2018, 359, 920-6. doi:10.1126/science.aao2774.
Google ScholarCrossrefPubMedWorldCatYao Y, Xu X, Yang L, Zhu J, Wan J, Shen L, et al. 患者由来オルガノイドは局所進行直腸癌の化学放射線療法効果を予測する。Cell Stem Cell 2020, 26, 17-26.e6. doi:10.1016/j.stem.2019.10.010.
Google ScholarCrossrefPubMedWorldCatBouffi C, Wikenheiser-Brokamp KA, Chaturvedi P, Sundaram N, Goddard GR, Wunderlich M, et al. ヒト化マウスに移植したヒト腸管オルガノイドにおける免疫組織のin vivo発達。Nat Biotechnol 2023, 41, 824-31. doi:10.1038/s41587-022-01558-x
Google ScholarCrossrefPubMedWorldCatGjorevski N, Sachs N, Manfrin A, Giger S, Bragina ME, Ordonez-Moran P, et al. 腸管幹細胞およびオルガノイド培養のためのデザイナー・マトリックス。Nature 2016, 539, 560-4. doi:10.1038/nature20168.
Google ScholarCrossrefPubMedWorldCatGjorevski N, Nikolaev M, Brown TE, Mitrofanova O, Brandenberg N, DelRio FW, et al. Tissue geometry drives deterministic organoid patterning. Science 2022, 375, eaaw9021.
Google ScholarCrossrefPubMedWorldCat
© The Author(s) 2024. 英国免疫学会の委託によりオックスフォード大学出版局が発行。
本論文は、クリエイティブ・コモンズ 表示ライセンス(https://creativecommons.org/licenses/by/4.0/)の条件の下で配布されたオープンアクセス論文である。このライセンスは、原著が適切に引用されていることを条件に、いかなる媒体においても無制限の再利用、配布、複製を許可するものである。
引用
Dimensionsの総引用数は00。
閲覧数
611
アルトメトリック
記事のALTMETRICスコアは11
情報 その他のメトリクス情報
アラートメール
記事活動アラート
先行記事アラート
新刊アラート
オックスフォードアカデミックからの限定オファーや最新情報を受け取る
おすすめ記事
DOP34 健康状態と炎症性腸疾患における免疫-上皮相互作用を解読する
G M Jowettら、クローン病・大腸炎ジャーナル、2024年
IBDにおける宿主-微生物叢相互作用の役割を研究するためのオルガノイドベースのモデル
Martina Polettiら、クローン病・大腸炎ジャーナル、2021年
ヒト幹細胞由来腸管オルガノイドの炎症性腸疾患研究への利用の可能性
Isabella Dottiら、炎症性腸疾患、2018年
NLRP6インフラマソームに関する最新のブレークスルー
Runzhi Liら、Precision Clinical Medicine、2022年
自然免疫シグナル制御におけるMiRNAとlncRNA
イルギズ・ガレエフら、ノンコーディングRNA研究、2023年
ラブドシア・セラは、抗炎症作用、Th17/Tregバランスの調節、腸管バリアーの完全性の維持、腸内細菌叢の調節を通じて、マウスのデキストラン硫酸ナトリウム塩誘発性大腸炎を緩和する
Hongyi Liら、Journal of Pharmaceutical Analysis、2022年
搭載
論文の引用
グーグル・スカラー
最新
最も読まれている
最も引用された論文
再発寛解型多発性硬化症患者における脂質代謝異常ネットワークがT細胞機能を変調させる
ヒトのインプラント周囲炎および歯周炎病変における免疫細胞組成と炎症プロファイル
アレルギー性喘息患者の血中Th2およびTh17細胞において、アレルゲンがIL-18およびIL-18Rαの発現上昇を誘導する
腸管における恒常的・病的免疫-上皮相互作用を研究するツールとしてのオルガノイド
ヒトサイトメガロウイルス血清陽性と経口ロタウイルスワクチンの免疫原性への影響:HIVに暴露された未感染の乳児に対する特別な懸念
オックスフォードアカデミック
臨床医学免疫学医学と健康病理学書籍雑誌
医療従事者向け広告
広告を閉じる
Clinical & Experimental Immunologyについて
編集委員会
著者ガイドライン
図書館員に勧める
広告および企業サービス
ジャーナルキャリアネットワーク
臨床・実験免疫学
オンライン ISSN 1365-2249
著作権 © 2024 英国免疫学会
オックスフォードアカデミックについて
ジャーナルの出版
大学出版パートナー
出版について
新機能
オーサリング
オープンアクセス
購入
機関アカウント管理
権利と許可
アクセスに関するヘルプ
アクセシビリティ
お問い合わせ
広告掲載
メディアお問い合わせ
オックスフォード大学プレス
ニュース
オックスフォードの言語
オックスフォード大学
オックスフォード大学出版局は、オックスフォード大学の一部門です。オックスフォード大学出版局は、研究、学術、教育における卓越性というオックスフォード大学の目的を達成するために、世界規模で出版活動を行っています。
オックスフォード大学出版局
著作権 © 2024 オックスフォード大学出版局 クッキー設定 クッキーポリシー プライバシーポリシー 法的通知
PDF
ヘルプ
この記事が気に入ったらサポートをしてみませんか?
