低カロリーおよび非カロリー甘味料の腸内細菌叢への影響: 臨床試験と横断研究のレビュー
本文へスキップ記事へスキップ
エルゼビアのロゴ
栄養
117巻、2024年1月、112237
レビュー
低カロリーおよび非カロリー甘味料の腸内細菌叢への影響: 臨床試験と横断研究のレビュー
https://www.sciencedirect.com/science/article/pii/S0899900723002654
著者リンク オーバーレイパネルを開くEllie Gauthier M.Sc. a b, Fermin I. Milagro Ph.D. c d e, Santiago Navas-Carretero Ph.D. c d e
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.nut.2023.112237
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
低カロリー甘味料と非カロリー甘味料が腸内細菌叢に及ぼす影響に関する結果は異質である。
ベースライン時の腸内細菌組成は、低カロリー甘味料および非カロリー甘味料に対する微生物応答を媒介する可能性がある。
腸内細菌叢に対する甘味料の影響を確認するためには、より多くのヒトでの研究が必要である。
要旨
非栄養性甘味料(NNSs)の使用はここ数十年で世界的に増加している。しかし、前臨床試験から、甘味料の摂取は腸内細菌叢の変化を通じて耐糖能異常を誘発する可能性があることが示されており、公衆衛生上の懸念が生じている。ヒトを対象とした研究は不足しているため、このレビューの目的は、ヒトの腸内細菌叢に対するNNSsの影響に関する現在のエビデンスを収集し、要約することである。臨床試験と横断研究のみをレビューの対象とした。NNSs(すなわち、サッカリン、スクラロース、アスパルテーム、ステビア)に関しては、5件の臨床試験のうち2件のみが介入プロトコル後の腸内細菌叢組成に有意な変化を示した。これらの研究では、サッカリンとスクラロースは血糖耐性を損なうと結論づけている。4件の横断研究のうち3件では、NNSsと微生物組成との関連が観察された。ポリオール(キシリトールなど)に関する3つの臨床試験すべてで、腸内細菌叢に対するプレバイオティクス効果が認められたが、これらの試験には複数の制限(発表日、投与量、期間)があり、その妥当性を危うくしている。NNSs摂取に対する微生物反応は、ベースライン時の腸内細菌組成によって強く媒介される可能性がある。NNSs摂取に対する個別化された微生物応答の可能性が認められ、より長い介入プロトコル、より大規模なコホート、より現実的な甘味料の投与量を含むさらなる研究が、これらの知見を広げるために必要である。
前の記事次の記事
キーワード
スクラロース非栄養甘味料サッカリン耐糖能アスパルテーム精密栄養学
はじめに
心血管疾患(CVD)、2型糖尿病(T2D)、肥満、メタボリックシンドローム(MetS)の増加率は、ここ数十年で先進国の公衆衛生上の重要な関心事となっている[1]。砂糖の大量摂取がこれらの疾患の原因であることが明らかになり、食品業界は、消費者のエネルギー摂取量と特定の製品のグリセミック指数を低減するために、食品や飲料に非栄養性甘味料(NNS)を導入するようになった[2]。
代替甘味料は、カロリーをほとんど、あるいは全く含まず、ショ糖やブドウ糖果糖液糖の甘味を模倣したものである[3]。その多くは、欧州や国際的な当局によって安全であると判断されており [4,5]、その使用は多くの国々で時間の経過とともに増加している [3]。2009年から2012年にかけて米国で実施された調査によると、成人の約40%が代替甘味料の摂取を報告しており [6]、1999年から2000年にかけて実施された過去のデータ [7]と比較して54%増加している。しかし、甘味料の摂取が人体に有害な影響を及ぼさないかどうかは、まだ議論の余地がある。観察研究や前臨床研究では、代替甘味料の摂取と、耐糖能やインスリン抵抗性(IR)などの生理学的パラメータの変化との間に関連があることが示唆されている [8] 。代替甘味料摂取後の腸内細菌叢の変化が、これらの悪影響を媒介する可能性があることを示す証拠も増えている [8], [9], [10]。
代替甘味料は、清涼飲料水、乳製品、焼き菓子などの菓子類、キャンディーやチョコレート、ジャムやゼリー、チューインガムなどに添加されるのが一般的で、家庭や食堂、レストランでも卓上甘味料として使用されている [3]。これらは主に2つのカテゴリーに分類される: NNSsと低カロリー甘味料(LCSs)である[2,5]。より正確には、NNSsは甘味強度が高く、製品にほとんどカロリーを与えない。これらは人工甘味料(サッカリン、スクラロース、アスパルテーム、アセスルファム-K、アドバンテーム、ネオテーム)または天然甘味料(ステビオール配糖体[ステビア]、モンクフルーツ、タウマチン)である。LCSには、糖アルコールとも呼ばれるポリオールや、食卓糖よりもカロリーが低く(約半分から3分の1)、相対的な甘味度は砂糖の25%から100%で、体内でゆっくりとグルコースに変換されるその他の新しい甘味料が含まれる[2,11,12]。ポリオールの一般的な例としては、キシリトール、ソルビトール、エリスリトール、マンニトール、イソマルト、マルチトール、ラクチトールなどがある。食事用として認可されている低カロリー甘味料やノンカロリー甘味料(LNCS)は国によって異なるが、スクラロース、アスパルテーム、サッカリン、アセスルファム-K、ステビオール配糖体が世界的に最も消費されているようである [13]。
腸内細菌叢は、細菌、ウイルス、一部の真核生物など、腸管内に生息する数千もの微生物からなる重要な生態系である。バクテロイデーテス(Bacteroideta)とファーミキューテス(Bacillota)という2つの門が支配的で、微生物全体の90%以上を占め、プロテオバクテリア(Pseudomonadota)、フソバクテリア(Fusobacteria)、テネリキューテス(Mycoplasmatota)、放線菌(Actinomycetota)がそれに続く[10]。より正確には、腸内細菌は難消化性炭水化物を代謝し、宿主の健康維持に重要な短鎖脂肪酸(SCFA)などの代謝産物を産生することができる [10] 。腸内細菌叢は、宿主の免疫や骨の成長のサポート、食物の消化、腸内分泌機能の調節、病原体からの保護、神経シグナルの調節、必須化合物の生合成、その他まだ解明されていない機能など、人体における複数の生理的機能に関与している [10,14] 。多くの研究が、微生物量の低下と脂肪率、IR、炎症、脂質異常症の増加との関連性を示している [15]。遺伝、食事、抗生物質、出生様式、年齢など、さまざまな要因が微生物の豊かさを変化させる可能性がある。したがって、食事パターンは腸内細菌叢を調節し、その結果、代謝性疾患に関連する生理学的パラメータにプラスまたはマイナスの影響を与える [10]。
過去10年間、LNCSの摂取が腸内細菌叢に及ぼす影響が懸念されてきた。最近のレビューによると、主にin vitroおよび動物モデルで実施された研究では、NNSsのうち、サッカリン、スクラロース、ステビオール配糖体のみが腸内細菌叢を変化させるようであることが示されている[2,3,16]。LCSsに関しては、腸内細菌叢に及ぼす影響はまだ完全には解明されておらず、プレバイオティクス効果を持つものもある[2,3]。最近の実験的研究では、LNCSの補給によって微生物叢が変化した後、生理学的パラメータがどのように変化するかを調べたものがいくつかある。Suezら[9]による研究では、マウスにサッカリンを補給すると、グルコース対照群と比較して腸内細菌叢が変化し、その結果、耐糖能障害が誘発されることが示された。耐糖能障害が微生物叢の変化によるものかどうかを調べるため、著者らは無菌マウスに糞便移植を行った。サッカリン添加マウスの微生物組成の移植を受けた無菌マウスは、対照群の移植を受けなかった無菌マウスと比較して耐糖能異常を示した[9]。さらに、Liら[17]は、マウスにソルビトールを4週間摂取させた場合の影響を調査し、その結果、マイクロバイオーム構成成分の存在量と耐糖能に変化が認められた。微生物叢の変化と耐糖能の間に因果関係は確認されなかった。それでも、グルコースホメオスタシスに有益な細菌が減少する一方で、グルコースホメオスタシスを破壊する細菌が補充プロトコール後に増加することが観察された[17]。
これらの前臨床研究の例は、LNCSがヒトの腸内細菌叢を変化させ、個人の健康に影響を与える可能性を示唆しており、研究グループはこのテーマに関する臨床試験を実施するようになった。しかし、我々の知る限り、ヒトを対象とした研究はこれまでほとんど発表されておらず、明確な結論を導き出すことは困難である。このような背景から、本総説の目的は、甘味料がヒトの腸内細菌叢に及ぼす影響について、現在科学文献に掲載されているエビデンスを検証し、その妥当性について議論することである。
方法
検索戦略
OvidとPubMedの2つのオンラインデータベースで文献検索を行い、2023年3月までに完了した。検索の絞り込みには以下のキーワードを用い、タイトルまたは抄録のいずれかに記載されていることを条件とした:(微生物叢 OR マイクロバイオーム OR マイクロフローラ OR 微生物) AND (甘味料* OR "甘味料*" OR アスパルテーム OR ステビオス ORアスパルテーム ORステビオシド* ORシクラメート* ORマンニトール ORサッカリン ORソルビトール ORステビア ORスクラロース ORアドバンテーム ORキシリトール ORラクチトール ORイソマルト ORイソマルチトール ORマルチトール ORエリスリトール OR水添デンプン加水分解物* ORネオテーム ORアセスルファム-K ORタウマチン ORモグロシド*)。検索には、言語(英語)および種(ヒト)の追加フィルターも適用した。臨床試験と横断研究のみを対象としたため、検索には以下のキーワードを追加した: NOT (review[Publication Type]) NOT (review[Title])。
したがって、この検索戦略では、短期または長期のLNCS摂取が腸内細菌叢に及ぼす影響、あるいは横断研究の場合は両者の関連を調査した臨床試験および横断研究を検索することを目的とした。
除外基準
ヒトで実施された臨床試験または横断試験のみをレビューの対象とした。そのため、試験管内または試験管外での実験や動物を用いた研究は除外した。さらに、このレビューの理論的根拠は、LNCSの広範な使用と摂取が微生物叢に及ぼす影響を検討することであったため、健康な個人で実施された研究のみを対象とした。特定の健康問題を抱えている被験者を対象に行われた研究は、特定の医学的症状の治療に重点が置かれており、レビューの主要テーマから外れているため、選択されなかった。レビューに含めるためには、すべての研究が、1つ以上のLNCSの短期または長期の摂取による腸内細菌叢への影響を評価する必要があった。また、腸内細菌叢ではなく口腔内細菌叢に焦点を当てた研究や、介入プロトコールにおいて甘味料が他のプロバイオティクスと併用されている研究は除外された。
検索プロトコル
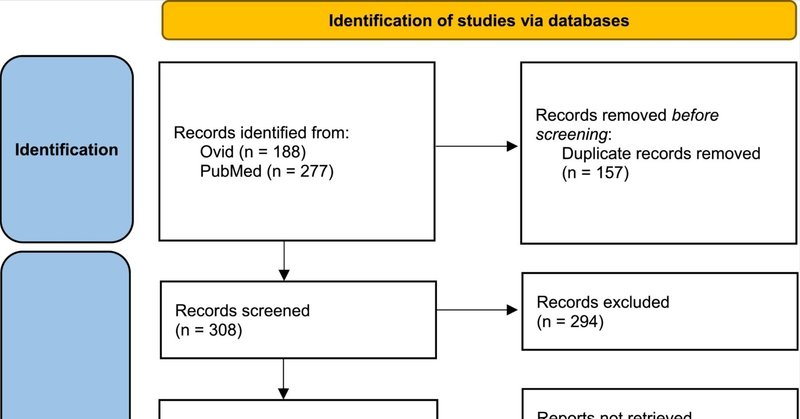
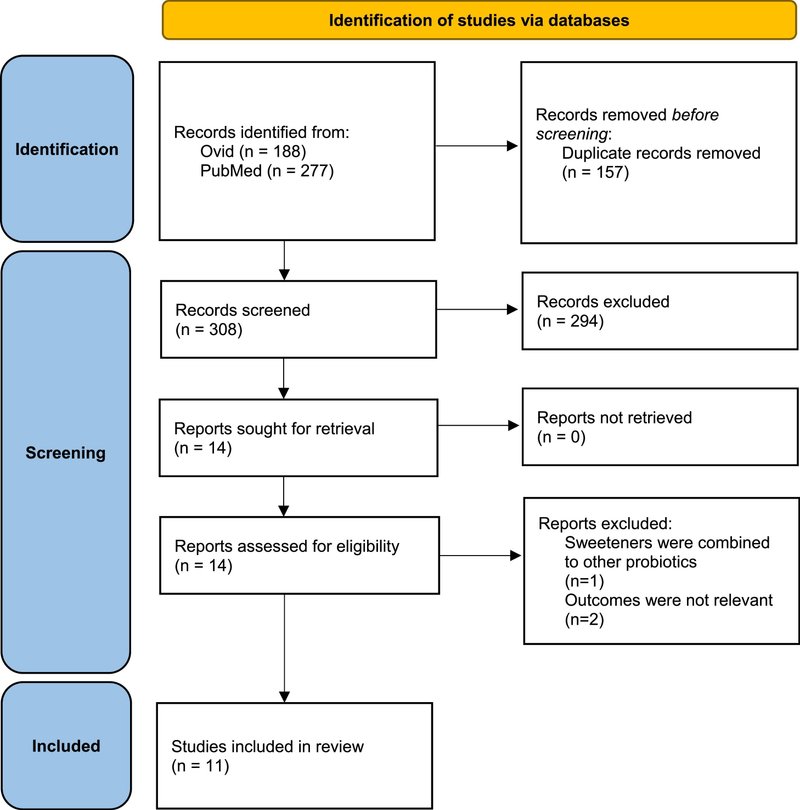
OvidとPubMedで見つかった465件の記録のうち(図1)、157件は重複しており、タイトルと抄録のスクリーニングが可能な研究は308件であった。タイトルと抄録の予備スクリーニングの結果、294件の論文が除外された。14の論文がフルテキストレビューの対象として選ばれた。これらの14の研究を修正した結果、3件は組み入れ基準に合致しなかった。より正確には、2つの研究の結果が関連していなかった:1つは、腸内細菌叢に対するポリオールの1急性用量の影響を研究し、もう1つは、腸内細菌叢に対するLNCS摂取の影響を研究していなかった。3番目の論文は、ポリオールとプロバイオティクスの併用による効果を研究したもので、組み入れ基準に合致しなかった。したがって、11の研究がレビューに含まれた。そのうち1件は、臨床試験と横断的調査の両方のプロトコールで構成されていた。
図1
ダウンロード 高解像度画像ダウンロード(554KB)
ダウンロード フルサイズ画像のダウンロード
図1. 収録論文の同定とスクリーニングのプロセスの図。
データ抽出
各研究について以下の情報を抽出した:著者名、出版物の種類、研究デザイン、臨床試験の介入プロトコール、横断研究の評価方法、サンプルサイズ、参加者のプロフィール、主要アウトカム。
結果
研究の特徴
表1に選択した研究の詳細を示す。研究デザインに関しては、8件が臨床試験 [9, [18], [19], [20], [21], [22], [23], [24] で、4件が横断研究 [9, [25], [26], [27] であった。] 全臨床試験のうち、6件はランダム化比較試験 [18], [19], [20], [21], [22], [23] 、1件はランダム化非対照試験 [23] 、1件はランダム化非対照試験 [9] であった。地理的な場所については、2つの研究が米国で実施され [19,25]、2つの研究がカナダで実施され [20,27]、2つの研究がヨーロッパで実施され [24,26]、2つの研究が英国で実施され [22,23]、1つの研究がチリで実施され [21]、3つの研究がイスラエルで実施された [9,18]。イスラエルで実施されたSuezらの2014年の研究[9]は、臨床試験と横断的調査の両方で構成されているため、2つの研究としてカウントされている。
表1. レビューに含まれる研究
参考文献 研究デザイン 甘味料/介入プロトコルまたは評価方法 サンプルサイズ 参加者のプロファイル 主な結果
臨床試験
Suez ら [18] 無作為化比較試験 アスパルテーム、サッカリン、スクラロース、ステビア
240 mg/日(ADI約8%), 180 mg/日(ADI約20%), 102 mg/日(ADI約34%), 180 mg/日(ADI約75%), 2週間* 120名(20名×6群) 健康な男女
年齢18-70歳
BMI 18-28 kg/m2 4種類のNNSはすべて腸内細菌叢に有意な影響を与えた。
サッカリンとスクラロースは血糖応答を有意に上昇させた。
ベースライン時の微生物組成が血糖反応に影響を与えた
Serranoら[19] 無作為化二重盲検プラセボ対照試験 サッカリン
最大ADI (800 mg/日)を2週間摂取 46 健常男女
年齢18-45歳
BMI≦25kg/m2純粋サッカリン補給後の微生物叢に変化なし
耐糖能に変化なし
無作為化二重盲検クロスオーバー対照臨床試験 アスパルテーム、スクラロース
アスパルテーム425mg/日(ADI14%)、次いでスクラロース136mg/日(ADI20%)。
14日間の介入期間を2回行い、4週間のウォッシュアウト期間を設けた。
年齢18-45歳
BMI 20~25 kg/m2 いずれの治療でも微生物叢に変化なし
耐糖能に変化なし
Thomsonら [21] 二重盲検ランダム化比較試験 スクラロース
780 mg/日、7日間(ADI 75%) 34名(各群17名) 健康な男性
年齢18-50歳
BMI 20-30 kg/m2 微生物叢に変化なし
グルコースコントロールおよびインスリン抵抗性に変化なし
ベースライン時の微生物組成はインスリン反応に影響した
Suez ら [9] 臨床試験 サッカリン
360 mg/日、7日間 健康な男女7名
年齢28-36歳
介入前後のマイクロバイオームは、反応者と非反応者で異なっていた。反応者は介入後に血糖応答が低下した個体であったが、非反応者の血糖応答は安定したままであった。
Beardsら[22] プラセボ対照無作為化二重盲検用量反応ヒト摂食試験 マルチトール
22.8g、34.2g、45.6gのチョコレートバーを各2週間、6週間摂取 40 健常男女
年齢20-40歳
BMI 18.5-24.9 kg/m2 介入は腸内細菌叢に有益な影響を与え、ビフィズス菌を増加させた。
Finney ら [23] 無作為化非対照縦断研究 ラクチトール
スクロースとラクチトールの比が10:0、5:5、0:10の甘味料10gを7日間摂取 75 健常男女
年齢18~24歳
BMI:男性22.80±3.01kg/m2;
女性 22.53 ± 2.88 kg/m2 低用量のラクチトール(比率0:10)は微生物叢に有益な影響を与え、ビフィズス菌とプロピオン酸および酪酸を増加させた。
Gotsner ら [24] 二重盲検、プラセボ対照、クロスオーバーデザイン イソマルト
30 g/日、4週間×2回 19 健康な男女
年齢21-53歳
BMI 20.8-30.2 kg/m2 イソマルトは微生物相に有益な影響を与え、ビフィズス菌を増加させた。
横断研究
フランケンフェルドら[25] クロスセクション アスパルテーム、アセスルファム-K
31 健康な男女
18歳以上
BMI24.3±4.1kg/m2微生物相存在量プロファイルおよび予測遺伝子機能は最近のNNS摂取とは関連せず、細菌多様性は消費者と非消費者で異なっていた。
Ramneら[26] 横断的 人工甘味料または天然甘味料入りの飲料
4日間の食物記録およびFFQ 1085 男女
年齢18-70歳
非ASB消費者のBMI:25.2±4.2kg/m2;
ASB摂取者:27.1±5.2kg/m2 NNS摂取と腸内細菌叢組成との間に有意な関連は観察されなかった。
あらゆる人工甘味料
FFQ 381 非糖尿病男女
年齢43.3±13.2歳
BMIの詳細なし 人工甘味料の摂取は、複数の分類学的 個体における変化および血糖反応の変化と 関連している
Laforest-Lapointe ら [27] 横断的 ASB
妊娠中のFFQ
生後3ヵ月と12ヵ月に採取した糞便サンプル 妊娠中の母親のASB摂取量に基づいて選択した100人の乳児(1歳
妊娠中の母親のASB消費量
(毎日摂取者50人、非摂取者50人
20.5~42.8歳、BMI 17.6~42.1kg/m2)妊娠中のASBへの曝露は、乳児の1つの微生物叢クラスター構造と関連していた。
ADIは1日摂取許容量、ASBは人工甘味料、BMIは肥満度、FFQは食物摂取頻度調査、NNSは非栄養性甘味料。
⁎
アスパルテーム、サッカリン、スクラロース、ステビアのADI: それぞれ50、15、5、4mg/kg。
臨床試験のうち、サッカリンのみが腸内細菌叢に及ぼす影響を調べたものが2件 [9,19]、スクラロースのみが1件 [21]、ポリオールが3件(マルチトール [22]、イソマルト [24]、ラクチトール [23])、複数のNNSに焦点を当てたものが2件(アスパルテーム、サッカリン、スクラロース、ステビアが1件 [18]、スクラロースとアスパルテームが1件 [20])。横断研究としては、人工甘味料飲料(ASB)摂取と微生物組成との関連を検証したものが2件 [26,27]、世界の人工甘味料消費量に焦点を当てたものが1件 [9]、アスパルテームとアセスルファム-Kの消費量に焦点を当てたものが1件 [25] であった。論文の発表日は2006年から2022年の間で、ポリオールに関する研究の発表日が最も古かった(2006~2010年)[22]、[23]、[24]。
臨床試験のサンプルサイズは7~120人と幅があり、50人以上を対象とした研究は2件のみであった[18,23]。横断研究のサンプルサイズは31人から1085人の間であった。12件の研究のうち、10件は健康な男女を対象に実施され [9, [18], [19], [20], [22], [23], [24], [25], [26] 、1件は健康な男性のみを対象に実施され [21] 、1件は1歳の乳児とその母親を対象に実施された [27] 。] 成人の年齢は18~70歳、体格指数(BMI)は17~32kg/m2であった。
臨床試験
サッカリン
各論文の主な結果を評価するために、まず同じ種類のLNCSを対象とした研究を比較した。Serranoらの研究[19]では、1日の最大摂取量(800mg)に相当するサッカリンを46人の健康な男女に2週間毎日補充したが、どの分類学的レベルにおいても腸内細菌叢に変化はみられなかった。一方、Suezらの2014年の研究[9]では、7人の健康な男女に1日360mg相当のサッカリンを7日間補給した後の耐糖能と微生物の変化について調査した。研究者らは、正常な血糖パラメーターを維持した人と比較して、補充前後で血糖反応が悪くなった人では、微生物組成が異なるクラスターを形成していることを発見した[9]。微生物叢の変化は、血糖応答が不良になった人ほど顕著であった(すなわち、バクテロイデス類が過剰発現し、クロストリジウム類が過小発現した [9])。Suezら[18]は、サッカリン180mg(1日摂取許容量[ADI]の20%)を毎日補給した場合の腸内細菌叢、血中メタボローム、耐糖能への影響を、20人ずつの対照群とNNSs補給群の5群と比較検討した。腸内細菌叢への影響に関しては、サッカリン補給は腸内細菌叢を有意に変化させ、Prevotella copriとBacteroides xylanisolvenのレベルを増加させた[18]。プレボテラ・コプリはベースライン時のブドウ糖負荷試験曲線下面積(GTT-iAUC)と正の相関を示したが、バクテロイデス・キシラニソルベンはこの曲線と負の相関を示した。著者らは、これらの変化が有害であることを示唆した [18]。酪酸も試験中に増加した。ほとんどの微生物トップローディングは、解糖およびグルコース代謝に関連していた [18]。
スクラロース
Thomsonら[21]は、高用量のスクラロース(780mg/日)を7日間摂取した場合、腸内細菌叢と代謝反応にどのような影響を及ぼすかを、34人の男性を介入群と対照群に分けて研究した。添加後の腸内細菌叢に変化は見られなかった。Ahmadらの研究では、4週間前にアスパルテーム補充介入プロトコールも実施した17人の患者を対象に、136mg/日を2週間投与した場合の効果を評価したが、微生物組成や糞便中のSCFAに変化は見られなかった [20] 。しかしながら、Suezら [18]では、20人に102mg/日のスクラロースを2週間補充したところ、腸内細菌叢が変化し、試験中にEubacteriumとDorea longicatenaが増加した。Eubacteriumはベースライン時のGTT-iAUCと正の相関を示したが、Dorea longicatenaは負の相関を示した。これらの変化は、著者らにより有害であることが示唆された [18]。ほとんどの微生物トップローディングはプリン代謝に関連していた。
アスパルテームとステビア
Ahmadらの研究[20]では、前述と同じ17人を対象にアスパルテーム425mg/日(ADIの14%)を2週間摂取させたが、腸内細菌叢に変化はみられなかった。Suezらの最新の研究[18]では、健康な20人を対象にアスパルテーム240mg/日(ADIの8%)を2週間摂取させたところ、腸内細菌叢に変化が見られた。より正確には、プロトコール期間中、Bacteroides fragilis、Bacteroides acidifaciens、Bacteroides coprocolaの存在量が増加し、多くの微生物トップローディングがポリアミン代謝に関連していた[18]。さらに、この介入では、180mg/日(ADIの75%)のステビア摂取も腸内細菌叢を変化させた:2つのPrevotella属が減少し、Bacteroides coprophilus、Parabacteroides goldsteinii、およびLachnospira属が曝露中に増加した。いくつかの微生物は脂肪酸の生合成に関連していた。このレビューの対象となった研究で、ステビアに焦点を当てたものは他にない。
ポリオール
本総説でポリオール(マルチトール、ラクチトール、イソマルト)に焦点を当てた研究の主な結果は、ポリオールが参加者の腸内細菌叢に有益な影響を与えることを示している [22], [23], [24]。実際、Gotsnerら[24]は、スクロース30g/日の4週間のプラセボ対照介入を追加したクロスオーバーデザインで、19人を対象にイソマルト30g/日の4週間の摂取の効果を試験した。プラセボと比較して、イソマルトはビフィズス菌を有意に増加させた。Finneyら[23]によると、75人を対象に7日間試験した低用量のラクチトール(10g/日)は、ビフィズス菌集団を増加させ、酢酸と乳酸の産生を増加させた。この事実は交差摂食の一因となり、他の細菌がプロピオン酸や酪酸を産生する可能性がある [23]。Beardsら[22]は、40人を対象にチョコレートバーによるマルチトールの漸進的補給を6週間にわたって試験し、45.6g/日に達した。このプロトコールは腸内細菌叢にも有益で、ビフィズス菌を増加させた。この3つの研究はすべて2006年から2010年の間に発表されたもので、ポリオールに関するヒトを対象とした最近の研究は、文献にはありませんでした。
横断研究
Frankenfieldら[25]は、31人のアスパルテームとアセスルファム-Kの摂取者と非摂取者を対象に、4日間の食事記録と5日目の糞便サンプルの分析を行った結果、微生物の多様性に差があると結論づけた。しかし、クラスや順序による細菌の相対的な存在量や予測される遺伝子の存在量については関連性は観察されず [25]、アスパルテームに関する臨床試験 [18] の結果とは対照的な所見であった。Suezら[9]は、食物摂取頻度調査票(FFQ)に回答した381人のうち無作為に抽出した172人の微生物叢を分析し、人工甘味料の摂取と腸内細菌科、デルタプロテオバクテリア綱、放線菌門などの複数の分類群との間に正の相関があることを見出した。さらに、スウェーデンとカナダの横断研究では、それぞれ人工甘味料または天然甘味料飲料の摂取 [26] とASBの摂取のみに焦点を当てた [27] 。これらの研究は、1085人の健康な男女[26]と、妊娠中の母親のASB摂取に基づいて選択された100人の乳児(生後12ヵ月)を対象として実施された[27]。スウェーデンの研究では、初診時に4日間の食事記録とFFQが用いられ、参加者は2回目に便サンプルを持ち帰る必要があった [26] 。対照的に、乳児とその母親を対象に実施されたカナダの研究では、妊娠中にFFQが使用され、乳児の便は生後3ヵ月と12ヵ月に採取された [27] 。スウェーデンの研究では、ASBの大量摂取と微生物叢の変化との間に、非摂取者と比較した多重検定補正後の関連は認められなかった [26]。カナダの研究では、母親のASB摂取は、乳児の1つのクラスター構造(バクテロイデス属の枯渇)および腸内細菌叢が産生する2つの代謝産物である尿中コハク酸およびスペルミジンと関連していた[27]。
耐糖能との関連
前述の論文の多くは、LNCSが耐糖能の変化と関連するかどうか、また腸内細菌叢がこれらの変化を媒介するかどうかも評価している。実際、2010年以降に発表された臨床試験はすべて、糖代謝に対するLNCSの影響を評価している。しかし、LNCSの摂取と耐糖能異常の発症との間に正の関連が認められたのは2件のみであった [9,18]。Suezらの研究[18]では、サッカリンとスクラロースの補給のみが参加者の血糖応答を変化させた。耐糖能異常を発症した人を「反応者」、発症しなかった人を「非反応者」と定義し、様々な細菌種のベースライン存在量レベルはGTT-iAUCと相関した[18]。NNSsによって誘導されたディスバイオーシスが耐糖能障害と因果関係があるかどうかを調べるために、最も極端な耐糖能反応を示した参加者のマイクロバイオームを無菌マウスに移植した。応答者のマイクロバイオームを移植されたマウスは、非応答者のマイクロバイオームを移植されたマウスよりも高い血糖応答を示した[18]。同様に、Suezらの先行研究では、健康な被験者7人のうち4人が、サッカリン補給後に耐糖能が有意に低下した [9]。彼らの腸内細菌叢は、補給の前後で非応答者とは異なっていた。2人の反応者と2人の非反応者の便を無菌マウスに移した。反応者の便を投与されたマウスは、他のマウスと比較して耐糖能障害を発症した[9]。
さらに、3つの臨床試験から、NNSに対する血糖応答は、ベースライン時の腸内細菌叢の個体間差によって部分的に左右されることが示唆されている [918,21]。例えば、Suezら [18]は、微生物叢のベースラインにおける種の存在量と、各NSs補充後の耐糖能の変化との間に相関関係を見出した。Suezら[9]による以前の研究では、7人がサッカリン補給プロトコールを受けた。介入後に血糖値反応が悪くなった人(反応者)の微生物叢は、血糖値パラメーターが変化しなかった人の微生物叢とはベースラインで異なっていた。一方、Thomsonら[21]は、スクラロースまたはプラセボの摂取とは無関係に、介入後に高いインスリン血症レベルを示した個体では、ベースライン時の微生物組成が異なっていたことを明らかにした。これらの結果は、甘味料摂取に対する個人の血糖応答がベースラインの微生物組成によって強く媒介される可能性を強調している。
考察
本総説では、代替甘味料の摂取が腸内細菌叢に及ぼす影響について、文献で現在得られている主なエビデンスを要約した。適格とされた全論文のデータを分析した結果、検索された8件の臨床試験のうち2件が、NNS(サッカリン、スクラロース、アスパルテーム、ステビア)の摂取が腸内細菌叢を変化させると結論づけていた [9,18] 。これら2つの研究では、マウスにおけるNNS摂取と耐糖能障害との間に因果関係があることも観察された[9,18]。ポリオールに関する3件の臨床試験では、ポリオールは腸内細菌叢に有益な影響を及ぼす可能性があると結論づけている [22], [23], [24]。また、4件の横断研究のうち3件では、代替甘味料の摂取と腸内細菌叢の有害な変化との関連が観察され [9,25,27]、耐糖能異常との関連が認められたのは1件のみであった [9]。このレビューの結果は、ベースライン時の微生物組成が、LNCS補給に対する微生物および血糖応答を部分的に調節しうることも示唆している。
研究数が少ないことに加え、NNSに関する研究間で主な結果が異質であることは、研究デザインの違いによって一部説明できるかもしれない。例えば、スクラロースが腸内細菌叢に及ぼす影響を調べた3つの臨床試験では、介入プロトコールが異なっていた。Suezらの研究 [18] では、健康な男女20人を対象にスクラロースを102mg/日、2週間摂取させた。この研究では、20人の他の5つのグループ(プラセボ、ブドウ糖、または他のNNSのいずれかを補充)と変化を比較した [18]。Ahmadら[20]は、以前にアスパルテームを摂取した17人の健康な男女を対象に研究を行った。これらの参加者は136mgのスクラロースを2週間摂取した [20]。Thomsonら[21]は、780mg/日のスクラロースを7日間摂取させ、34人の健康な男性の微生物叢に及ぼす影響を研究した。この研究では、月経周期に関連した変化がインスリン感受性に及ぼす潜在的な干渉を避けるために、男性のみが選択された [21]。このように、これらの研究は、スクラロースの投与量、介入期間、対照群の有無、参加者のプロフィール、性・年齢などの点で異なっていた。これらの違いが、スクラロース補給後の参加者の微生物および代謝反応に影響を与えた可能性がある。サッカリンとアスパルテームについても同様の観察が可能である [9,18,20]。ステビアについては、腸内細菌叢への影響を調査した臨床試験が1件しかないため、比較はできない[18]。
結果がまちまちであるもう一つの理由として考えられるのは、各臨床試験のサンプル数が比較的少なく、全部で7から120とばらつきがあることである。しかし、120人の参加者を対象に行われた研究では、4種類のNNSがテストされ、グループはわずか20人であった。コホートの規模からすると、腸内細菌叢に対するNNSsの効果が観察できなかったか、逆に正の相関が偶然観察された可能性がある。また、サンプルサイズが小さいと、研究の統計的検出力が低くなり、結果の妥当性が低下する [28]。例えば、2014年にSuezらによって実施された研究[9]は、7人の参加者を用いて実施され、短期間のサッカリン摂取が微生物叢を変化させ、耐糖能を損なうと結論づけている。しかし、統計的検出力が低いため、これらの結果の妥当性には疑問が残る。
結果の不均一性は、LNCSに対する微生物の反応の個人差によっても説明できるかもしれない。実際、結果のセクションで述べたように、3つの論文でベースラインの微生物組成がLNCSに対する微生物および血糖応答を媒介する可能性が示された[9,18,21]。したがって、LNCS介入後に変化した微生物叢と血糖応答を示しやすい個人の割合が、各研究のコホート間で異なり、そのため結果に異質性が生じた可能性がある。
サンプルサイズが比較的小さいことに加えて、このレビューに含まれる研究のもう一つの限界は、介入プロトコールの期間が1~2週間と短いことである。1~2週間という期間は腸内細菌叢の有意な変化を観察するには十分ではなく、したがって一般集団における長期的なLNCS摂取を代表するものではない可能性が高い。実際、食事、微生物叢、研究期間を分析した論文では、習慣的な食事は急性期の食事戦略よりも微生物組成に大きな影響を与える可能性があるという事実が指摘されている[29]。この分野でのさらなる研究は、より長期間の臨床試験への取り組みに焦点を当てるべきである。
さらに、研究でヒトに投与されたLNCSの用量は、特にサッカリン、スクラロース、ポリオールの場合、現実的でないことが多かった。商品化されたブランドSweet'N Lowの1袋が36mgのサッカリンを含むことを考えると、体重60kgの人は25袋でサッカリンのADIに達することになる[30]。このレビューにおけるサッカリンに関する臨床試験では、腸内細菌叢に対する180、360、800mgのサッカリンの影響(1日あたり5~22袋)が研究されており、これは比較的高い[9,18,19]。スクラロースに関する研究でも同じことが言える[18,20,21]。ポリオールに関する研究では、45g/日以下の量までテストされている [22]、[23]、[24]。このような量は、高LNCS摂取者であっても現実的ではなく、結果の妥当性に影響する可能性がある [31]。また、LNCSは多くの食品に含まれていることから、試験中に被験者が摂取するLNCSの正確な量を管理することが難しいという限界もある。この問題を解決する方法としては、LNCSを含む製品を避けるために、栄養表示の読み方を参加者に教えることであろう。
さらに、本総説における横断的研究の重要な限界は、LNCS摂取と腸内細菌叢組成との因果関係ではなく、関連性の観察しかできないことである。横断研究は、微生物組成がLNCS摂取に直接起因するかどうかを決定することはできない。横断的研究における過体重または肥満の人は、体重または血糖値をコントロールするためにLNCSを摂取する傾向が高いことはもっともである。実際、肥満は糞便細菌の多様性の低さと関連していることが実証されている [32] 。LNCSの摂取と微生物組成との正の関連が、肥満と微生物組成との関連に起因する(または影響を受ける)危険性がある。横断研究は、このテーマに関する最初の良い洞察を与えるが、LNCSが腸内細菌叢にどのように影響するかについては、臨床試験がより強力な証拠を提供する。
甘味料が微生物組成に影響を与える可能性のあるメカニズムは、まだ完全には解明されていない。しかし、専門家やLNCS摂取と宿主生理との関連性に関する最近の総説によって、潜在的な経路が示唆されている[33]。したがって、最初に示唆される潜在的なメカニズムは、グルコースと比較して腸で必ずしも完全に吸収されないLNCS [34,35]が、腸上皮の甘味受容体に結合し、ムチンの産生と腸のバリア機能に影響を与えるというものである。どちらの機能も微生物の組成に影響を与えることが報告されている [33]。実際、ムチン(消化管内部の上皮に含まれる粘液を構成するタンパク質)が微生物の組成に影響を与えることが報告されている [36]。第二に、いくつかのLNCSが細菌の細胞膜と細胞透過性を変化させ、ある種の細菌集団にシフトを生じさせる可能性があることが最近の証拠から示されている[33]。
ある種の微生物組成は、疾患の有病率の高さと関連しているが、それがこれらの疾患の原因なのか結果なのかは不明である。腸内細菌叢の健康的な組成に関するレビューによると、T2D患者はバクテロイーダ菌とバチロタ菌の比率が高いことが示されている [37,38] 。したがって、2014年に発表された論文で、Suezら[9]は、サッカリン補給後のヒトとマウスの両方で、バクテロイデス門のバクテロイデス類の過剰発現とクロストリジウム門の過小発現を観察した。Suezらの2022年の研究[18]の他のNNS群でも、バクテロイデス属が増加していた。T2D患者の腸内細菌組成とSuezらの研究におけるNNS補給後の微生物叢との間に、このようなわずかな類似性があることから、NNS補給が腸内細菌叢に悪影響を及ぼし、T2Dのリスクを高める可能性が示唆される。一方、酪酸濃度が高いほど、抗肥満作用、エネルギー消費調節作用、IR減少作用、脂質異常症減少作用があることが報告されている[39]。病的肥満者におけるNNSs、糞便微生物叢、およびSCFAsの関連を検証した研究では、NNSsの摂取が酪酸の低レベルと関連していることが判明した [40]。しかし、Suezら [18]は、サッカリン補給後の酪酸の増加を観察しており、血糖反応の変化とも矛盾している。
ポリオールに関する3件の臨床試験では、ポリオールは健康増進効果を持つビフィズス菌を増加させることで、腸内細菌叢に有益なプレバイオティクス作用を持つ可能性があると結論づけられた [41]。しかし、2010年以降、これらのLCSに関する最新の研究は発表されておらず、本稿でレビューした実際のエビデンスは、非現実的な用量でテストされたものである。ポリオールの過剰摂取が、健康な人に下剤や胃腸症状 をもたらす可能性を示す証拠もある[3,42]。したがって、ポリオールが腸内細菌叢に有益である可能性があるかどうかは、研究が不足しているため、まだ不明である。
LNCSの腸内細菌叢への影響に関する臨床試験と横断的研究のレビューから、この分野での研究結果の異質性と研究不足が浮き彫りになった。明確な結論を導き出すには結果が異質すぎるが、この結果は、個別化された微生物叢主導の作用が、代替甘味料の腸内微生物叢への影響を媒介する可能性も示唆している。したがって、ベースラインの微生物組成が、個人の微生物叢がLNCSにどのように反応するかに、部分的に影響を与える可能性がある。この分野の他の著者もこの仮説を支持している。Bourdeau-Julienら[43]は、カナダの平均的な食事と地中海食が腸内細菌叢に及ぼす影響を検証した。彼らは、ベースライン時の微生物多様性が高い個体ほど、食事変更後の微生物安定性が高いことを観察しており、これはベースライン時の微生物叢によって媒介されるLNCSに対する個別化された反応の理論的根拠を支持している。
結論
LNCSの摂取が腸内細菌叢にどのような影響を及ぼすかに関する結果は、不均一である。NNSs(サッカリン、スクラロース、アスパルテーム、ステビア)に関する5件の臨床試験のうち2件は、すべてのNNSs摂取が腸内細菌叢を変化させ、サッカリンとスクラロースだけがNNSsに対する血糖応答を変化させると結論づけている。4件の横断研究のうち3件で、NNSsと微生物組成との関連が観察された。現在のところ、ポリオールにはプレバイオティクス効果があることが示唆されているが、最近の研究が不足しているため、宿主の生理機能に対する真の効果についての理解は限られている。甘味料に対する微生物と血糖値の反応は、ベースライン時の個人の腸内細菌叢組成によって強く媒介される可能性がある。より長期間、より現実的な量の甘味料を用いて、より大規模なコホートで実施され、甘味料に対する個別化された微生物応答を考慮した研究が必要である。
競合利益宣言
著者らは、競合利益となりうる以下の金銭的利益/個人的関係を宣言する。
Santiago Navas-Carreteroの報告はUniversity of Navarraより提供された。
参考文献
[1]
AM Tsur, G. Twig
肥満の実際の負担-多疾患を考慮した場合
Lancet Diabetes Endocrinol, 10 (2022), pp.
PDFを見る記事を見るScopusGoogle Scholarで見る
[2]
J Plaza-Diaz、B Pastor-Villaescusa、A Rueda-Robles、F Abadia-Molina、FJ. ルイス-オヘダ
低カロリーおよび非カロリー甘味料と腸内細菌叢との生物学的相互作用の可能性:最近の研究のアップデート
栄養素, 12 (2020), p. 1153
CrossRefScopusで表示Google Scholar
[3]
FJルイス-オヘダ、Jプラザ-ディアス、MJサエズ-ララ、A.ギル
腸内細菌叢に対する甘味料の影響:実験研究と臨床試験のレビュー
Adv Nutr, 10 (suppl_1) (2019), pp.S31-S48
PDFを見る記事を見るCrossRefを見るScopusGoogle Scholarで見る
[4]
フェデリカ
低/カロリー甘味料に関する世界保健機関(WHO)ガイドラインに対する国際甘味料協会の回答
国際甘味料協会(2023年)
利用可能な場所
https://www.sweeteners.org/isa-response-to-who-guideline-on-low-no-calorie-sweeteners/
2023年10月8日アクセス
Google Scholar
[5]
米国FDA
食品中のアスパルテームおよびその他の甘味料
FDA(2023年)
https://www.fda.gov/food/food-additives-petitions/aspartame-and-other-sweeteners-food
10月8日アクセス
グーグル学者
[6]
AC Sylvetsky, Y Jin, EJ Clark, JA Welsh, Talegawkar SA RotherKI
米国における子供と成人の低カロリー甘味料の消費量
J Acad Nutr Diet, 117 (2017), pp.
e2
スコープで見るGoogle Scholar
[7]
AC Sylvetsky、JA Welsh、RJ Brown、MB. Vos
米国では低カロリー甘味料の消費が増加している
Am J Clin Nutr, 96 (2012), p. 6406
Google Scholar
[8]
J Suez, T Korem, G Zilberman-Schapira, E Segal, E. Elinav
ノンカロリー人工甘味料とマイクロバイオーム:知見と課題
腸内微生物, 6 (2015), p. 14955
Google Scholar
[9]
J Suez, T Korem, D Zeevi, G Zilberman-Schapira, CA Thaiss, O Maza, et al.
人工甘味料は腸内細菌叢を変化させることで耐糖能異常を引き起こす
ネイチャー, 514 (2014), p. 1816
グーグル学者
[10]
EZ. ゴマー
健康と疾患におけるヒト腸内細菌叢/マイクロバイオーム:総説
アントニー・ヴァン・レーウェンフック, 113 (2020), pp.
CrossRefView in ScopusGoogle Scholar
[11]
ハーバード公衆衛生大学院。低カロリー甘味料。https://www.hsph.harvard.edu/nutritionsource/healthy-drinks/artificial-sweeteners/。2023年10月8日アクセス。
Google Scholar
[12]
エールニューヘブン病院。最近砂糖を食べましたか?https://www.ynhh.org/services/nutrition/sugar-alcohol。2023年10月8日アクセス。
Google Scholar
[13]
C Schiano, V Grimaldi, M Scognamiglio, D Costa, A Soricelli, G.F Nicoletti, et al.
清涼飲料水と甘味料の摂取:メタボリックシンドロームと心血管疾患の発症に寄与する可能性。代替甘味料の有益または有害な作用?
Food Res Int, 142 (2021), Article 110220
PDFを見る記事を見るScopusGoogle Scholarで見る
[14]
SVリンチ、O.ペデルセン
健康と疾患におけるヒト腸内マイクロバイオーム
N Engl J Med, 375 (2016), 2369-2379頁
ScopusGoogle Scholarで見る
[15]
Y・ファン、O・ペダーセン
ヒトの代謝の健康と疾患における腸内細菌叢
Nat Rev Microbiol, 19 (2021), 55-71頁
CrossRefView in ScopusGoogle Scholar
[16]
S Del Pozo, S Gómez-Martínez, LE Díaz, E Nova, R Urrialde, A Marcos
スクラロースとサッカリンが腸内細菌叢に及ぼす潜在的影響:総説
栄養素, 14 (2022), p. 1682
CrossRefView in ScopusGoogle Scholar
[17]
CH Li, CT Wang, YJ Lin, HY Kuo, JS Wu, TC Hong, et al.
砂糖代替物ソルビトールの長期摂取は腸内細菌叢を変化させ、マウスの耐糖能異常を誘発する。
ライフサイ, 305 (2022), 第120770号
PDFで記事を見るScopusで記事を見るGoogle Scholar
[18]
J Suez, Y Cohen, R Valdés-Mas, U Mor, M Dori-Bachash, S Federici, et al.
ヒト耐糖能に対する非栄養性甘味料の個別化微生物駆動効果
細胞, 185 (2022), pp.
e19
スコープで見るGoogle Scholar
[19]
J Serrano, KR Smith, AL Crouch, V Sharma, F Yi, V Vargova, et al.
高用量のサッカリン補給は、健康なヒトおよびマウスにおいて腸内細菌叢の変化や耐糖能異常を誘発しない
マイクロバイオーム, 9 (2021), p. 11
スコープで見るGoogle Scholar
[20]
SY Ahmad、J Friel、D. Mackay
非栄養性人工甘味料であるアスパルテームとスクラロースが健康成人の腸内細菌叢に及ぼす影響:無作為化二重盲検クロスオーバー臨床試験の副次的結果
栄養素, 12 (2020), p. 3408
CrossRefGoogle Scholar
[21]
P・トムソン、R・サンティバニェス、C・アギーレ、JE・ガルガーニ、D・ガリード
スクラロース摂取が健康成人の代謝反応と腸内細菌叢に及ぼす短期的影響
Br J Nutr, 122 (2019), p. 85662
グーグル・スカラー
[22]
E・ビアーズ、K・トゥーヒー、G・ギブソン
菓子甘味料が腸内細菌叢組成に及ぼす影響を評価するためのヒトボランティア研究
Br J Nutr, 104 (2010), pp.
スコープで見るGoogle Scholar
[23]
M Finney、J Smullen、HA Foster、S Brokx、DM. ストーリ
低用量のラクチトールが糞便微生物叢、pH、短鎖脂肪酸および胃腸症状に及ぼす影響
Eur J Nutr, 46 (2007), pp.307-314
CrossRefView in ScopusGoogle Scholar
[24]
A Gostner, M Blaut, V Schäffer, G Kozianowski, S Theis, M Klingeberg, et al.
健康なボランティアにおける糞便微生物叢と大腸代謝に対するイソマルト摂取の影響
Br J Nutr, 95 (2006), pp.
スコープで見るGoogle Scholar
[25]
CL Frankenfeld、M Sikaroodi、E Lamb、S Shoemaker、PM. ジルベット
米国の成人を対象とした横断研究における高強度甘味料摂取と腸内細菌叢の内容および予測される遺伝子機能
Ann Epidemiol, 25 (2015), 736-742頁
e4
スコープで見るGoogle Scholar
[26]
S Ramne, L Brunkwall, U Ericson, N Gray, GGC Kuhnle, PM Nilsson, et al.
Malmö Offspring Studyにおける加糖飲料、砂糖入り飲料、人工甘味飲料の摂取量と腸内細菌叢組成の関係
Eur J Nutr, 60 (2021), pp.
CrossRefView in ScopusGoogle Scholar
[27]
I Laforest-Lapointe, AB Becker, PJ Mandhane, SE Turvey, TJ Moraes, MR Sears, et al.
妊娠中の母親の人工甘味料飲料摂取は、乳児の腸内細菌叢と代謝の変化、および乳児の肥満度上昇と関連している。
腸内細菌, 13 (2021), p. 115
Google Scholar
[28]
CC Serdar, M Cihan, D Yücel, MA. セルダル
サンプルサイズ、検出力、効果量の再検討:前臨床、臨床、実験室研究における簡略化された実践的アプローチ
Biochem Med, 31 (2021), Article 010502
Google Scholar
[29]
ER Leeming、AJ Johnson、TD Spector、C.I Le Roy
腸内細菌叢に対する食事の影響:介入期間の再考
栄養素, 11 (2019), p. 2862
CrossRefView in ScopusGoogle Scholar
[30]
アラバマ大学 人工甘味料-SHP-栄養トレンド。https://www.uab.edu/shp/nutritiontrends/recipes-food-facts/food-facts/artificial-sweeteners。2023年10月8日アクセス。
Google Scholar
[31]
Zheng, Y Xiao, L Ma, W Lyu, H Peng, X Wang, et al.
低用量のスクラロースがマウスの腸内細菌叢を変化させる
Front Nutr, 9 (2022), Article 848392
スコープで見るGoogle Scholar
[32]
CD. デイビス
腸内細菌叢と肥満におけるその役割
ニュートル・トゥデイ, 51 (2016), pp.
スコープで見るGoogle Scholar
[33]
ILリチャードソン、SA. フレッセ
非栄養性甘味料と腸内細菌叢および宿主生理への影響
Front Nutr, 9 (2022), Article 988144
スコープで見るGoogle Scholar
[34]
MD Pang、GH Goossens、EE. Blaak
人工甘味料が体重コントロールとグルコースホメオスタシスに及ぼす影響
Front Nutr, 7 (2021), Article 598340
グーグル学者
[35]
Lチェン、Bトゥオ、H.ドン
イオンチャネルとトランスポーターによる腸管グルコース吸収の制御
Nutrients, 8 (2016), p. 43
PDFを見る記事を見るGoogle Scholar
[36]
GC. ハンソン
ムチンとマイクロバイオーム
Ann Rev Biochem, 89 (2020), pp.
CrossRefScopusで見るGoogle Scholar
[37]
E Rinninella, P Raoul, M Cintoni, F Franceschi, GAD Miggiano, A Gasbarrini, et al.
健康な腸内細菌叢の構成とは?年齢、環境、食事、疾患を超えて変化する生態系
微生物, 7 (2019), p. 14
CrossRefScopusで見るGoogle Scholar
[38]
A Pascale, N Marchesi, C Marelli, A Coppola, L Luzi, S Govoni, et al.
微生物叢と代謝性疾患
内分泌, 61 (2018), 357-371頁
CrossRefView in ScopusGoogle Scholar
[39]
S Coppola, C Avagliano, A Calignano
肥満および肥満関連疾患に対する酪酸の保護的役割
分子, 26 (2021), p. 682
CrossRefView in ScopusGoogle Scholar
[40]
PGファラップ、Sライデルセン、J.ヴァレール
非栄養性甘味料は肥満誘発性があるか?病的肥満者における食事、糞便微生物叢、短鎖脂肪酸の関連性
J Obes, 2019 (2019), Article 4608315
スコープで見るGoogle Scholar
[41]
C Hidalgo-Cantabrana、S Delgado、L Ruiz、P Ruas-Madiedo、B Sánchez、A. Margolles
ビフィズス菌とその健康促進効果
微生物学スペクトラム, 5 (2017)
グーグル スカラー
[42]
A Lenhart, WD. チェイ
胃腸の健康と過敏性腸症候群に対するポリオールの効果の系統的レビュー
Adv Nutr, 8 (2017), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[43]
I Bourdeau-Julien, S Castonguay-Paradis, G Rochefort, J Perron, B Lamarche, N Flamand, et al.
食事は健康な集団において腸内細菌叢と宿主脂質メディエーターに迅速かつ異なる影響を与える
マイクロバイオーム, 11 (2023), p. 26
スコープで見るGoogle Scholar
引用者: (0)
本研究は、カナダ保健研究所のMichael Smith Foreign Study Supplements (2023)、およびCentro de Investigación Biomédica en Red de la Fisiopatología de la Obesidad y Nutrición (CIBEROBN)の支援を受けた。FMとSNCがレビューの構想を練った。EGは検索を行い、原稿を作成した。全著者が最終版の原稿を確認し、承認した。
© 2023 The Authors. 発行:エルゼビア社
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイトのすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
