d-アミノ酸:脳疾患のための新しい臨床パスウェイ
メインコンテンツへスキップ
広告
分子医学の動向
ログイン
検索...
レビュー|29巻12号1014-1028頁2023年12月
全号ダウンロード
d-アミノ酸:脳疾患のための新しい臨床パスウェイ
https://www.cell.com/trends/molecular-medicine/fulltext/S1471-4914(23)00216-2?utm_campaign=SfN%202023&utm_content=271486818&utm_medium=social&utm_source=twitter&hss_channel=tw-18477428
イシス・ネム・デ・オリヴェイラ・ソウザ
ロビン・ロイショードゥリ
ジャクリーヌ・ドゥ・ベレロッシュ5
ジャン=ピエール・モテ
脚注を表示する発行:2023年9月26日DOI:https://doi.org/10.1016/j.molmed.2023.09.001
PlumXメトリクス
ハイライト
d-アミノ酸(d-AAs)は、脳のホメオスタシスを制御する新規の重要なシグナル伝達分子群を形成している。
様々な脳疾患では、生体液や組織中のd-AAs濃度に異常が生じる。
d-AAsは病気の診断、予後、治療モニタリングのためのバイオマーカーとして利用できる。
d-AAシグナル伝達および代謝経路は、慢性および急性の神経病理に対する有望な治療標的である。
要旨
遊離d-アミノ酸(d-AAs)は、脳や内分泌系を含む多くの臓器において、新規かつ重要なシグナル伝達分子として浮上している。統合失調症(SCZ)、てんかん、アルツハイマー病(AD)、筋萎縮性側索硬化症(ALS)、薬物乱用、慢性疼痛など、さまざまな神経病態における重要性がますます認識されるようになり、これらの非定型メッセンジャーの基本的な役割に関する理解は大きく進展している。研究の結果、d-セリン、d-アスパラギン酸、そして最近ではd-システインが中枢神経系(CNS)の健全な発達と機能に不可欠であることが発見された。我々は、多くの生理学的プロセスに関する我々の見解を大きく変えた最近の進歩について論じるとともに、d-AAsが現在、ヒトのいくつかの疾患に対して、臨床の場でどのように治療効果が期待されているかを示す。
キーワード
神経変性疾患
神経疾患
シナプス
SNPs
代謝
創薬
遊離d-AAs:脳内メッセンジャーの新しいクラス
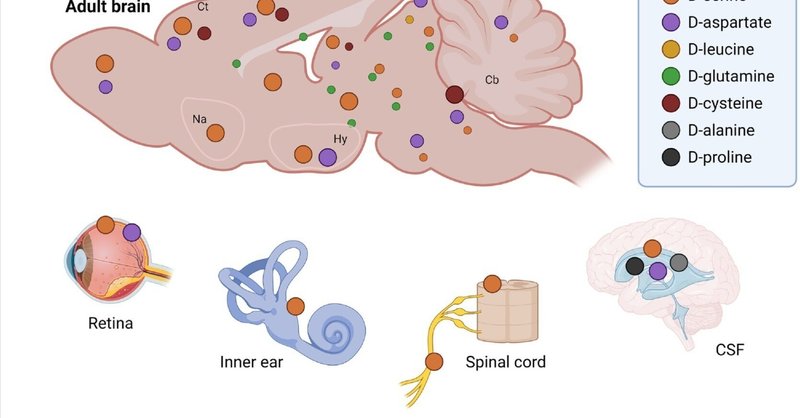
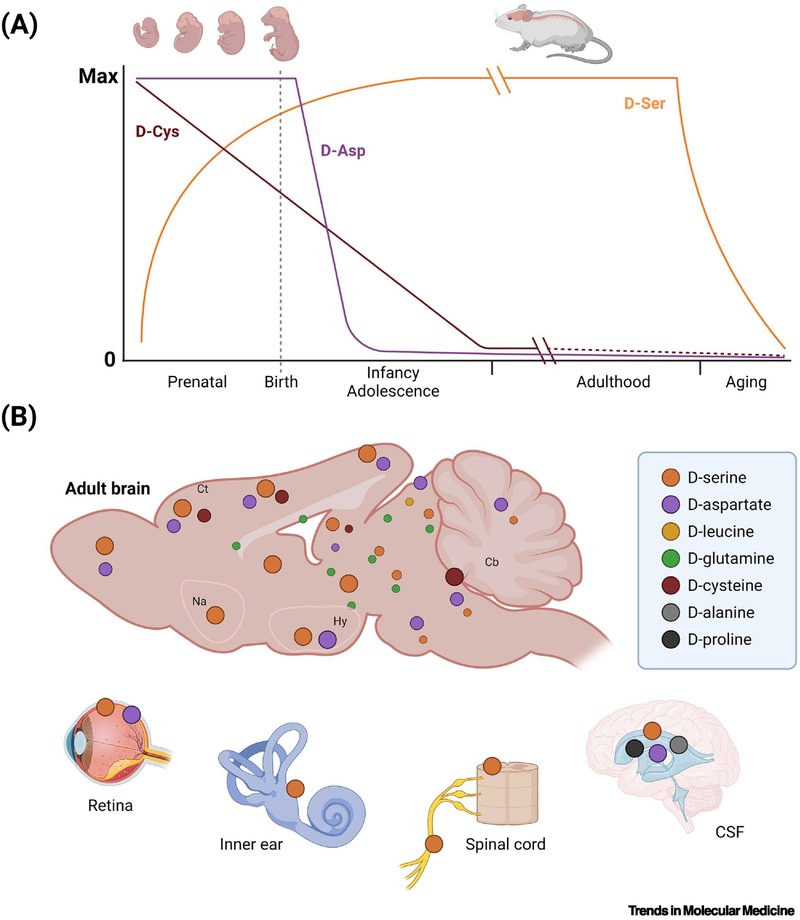
AAsはあらゆる生物学的プロセスにおいて重要な役割を果たしている。グリシンを除く一般的なAAsはキラル中心を示し、理論的にはl-AAとd-AAの立体異性体が存在する。しかし、d-AAsは長い間「不自然な」ものであり、微生物か無脊椎動物にしか存在しないと考えられてきた [1.]。それにもかかわらず、1990年代の精力的な観察により、ヒトを含む哺乳類の体液や臓器に様々なd-AAが存在することが明らかになった。その中でも、d-セリン(d-Ser)、d-アスパラギン酸(d-Asp)、そして新顔のd-システイン(d-Cys)は、現在では複数の臓器、特に神経系や感覚器官で見つかっている(図1)。そこでは、神経調節物質の新しいクラスが形成され [1.]、生物学の基本的な公理を覆し、生物医学、特に脳科学の分野を徐々に変革している。
図1
図1脳内d-アミノ酸(d-AAs)の時間的・空間的マッピング。
キャプション
大きな画像を見るダウンロード 高解像度画像
膨大な文献があるため、この総説ではすべての臓器におけるd-アミノ酸の様々な側面を取り上げることはしない。むしろ、健常脳と疾患脳におけるd-Ser、d-Asp、d-Cysの3つの特定のd-アミノ酸の相互に絡み合った役割について概観することを目的とする。その代謝経路がいかにダイナミックに制御され、他の生化学的過程と交差しているかを示し、その代謝障害がいかに発達や恒常性の変化を引き起こすかを論じ、その代謝酵素をコードする遺伝子の変異が主要な脳疾患の高いリスクをもたらすことを説明する。最後に、d-AAsに関する現在の知識を、適切な予後予測バイオマーカーや創薬ターゲットとして臨床に応用するための有望な方向性について概説する。
健康な神経系におけるd-AAs:どこで、どのように?
生理的条件下では、ほとんどのd-AAsは脳内に微量に存在するが、d-Ser、d-Asp、d-Cysは例外で、網膜や蝸牛などの感覚器官にも存在する [2.]。体液や組織におけるd-AAsの異常レベルは多くの病態で観察されており、d-AAsは疾患のモニタリングや治療のための有望なバイオマーカーとなっている [1.]。
脳のd-AAsは、部分的には食事や腸内細菌叢に由来することもあるが [4]、哺乳類の細胞は、d-Ser、d-Cys、d-Aspといったd-AAsの一部を合成する能力を獲得している(囲み記事1)。脳実質には他にもいくつかのd-AAが存在する(すなわち、d-Ala、d-Arg、d-Gln、d-Glu、d-allo-Ile、d-Leu、d-Lys、d-Met、d-Phe、およびd-Trp)[2]が、これらに対する特異的な生合成経路は今のところ同定されていない。これらのd-AAsは腸内細菌によって産生される可能性があり [5.]、また最近d-Alaについて実証されたように [6.]、食餌に由来する可能性もある。したがって、腸から吸収されたこれらのd-AAは、血液脳関門(BBB)を通過して脳実質に到達する必要があり、おそらくASC、y+L、X-c、LAT1、またはATB0,+のような、立体選択性に乏しいAAを輸送する溶質キャリアを介することになるであろう [7.]。したがって、ASC、LAT1、ATB0,+は、他のトランスポーターとともに脳細胞で高発現しており、末梢のd-AAsの脳への輸入と動員において重要な役割を果たしている可能性がある(図2)。d-AAsの生理的代謝分解は、ペルオキシソームに存在する2つの酵素、d-アミノ酸オキシダーゼ(DAAO)とd-アスパラギン酸オキシダーゼ(Ddo)によって保証されている [8.,9.](囲み記事2)。
ボックス1
図2
図2脳内d-アミノ酸(d-AAs)の輸送と代謝。
キャプション
大きな画像を見るダウンロード 高解像度画像
ボックス2
健康な神経系におけるd-アミノ酸:何に役立つのか?
多くのd-AAsの生理学的機能はまだ確立されていないが、d-Ser、d-Asp、およびd-Cysが脳回路の形成とダイナミクスにおいて重要な役割を果たしており、したがって高次認知機能にとって重要であることが明らかになっている[9,10]。
シナプスネットワークの発達と恒常性におけるd-AAsの役割
d-Ser、d-Cys、d-Aspは、神経細胞増殖、皮質形成、成体神経新生を制御することにより、神経回路の発達と機能のあらゆる段階に寄与していることを示す証拠が増えている [9.,10.,11.]。d-Serの生理学的役割の探求は、シナプスのN-メチル-D-アスパラギン酸(NMDA)受容体(NMDAR)のコアゴニストとして特に注目されている(用語集を参照)[12]。そうすることで、d-Serは樹状突起の統合 [13.]、多くの脳領域における成熟シナプスでのシナプス可塑性(図3、キー図) [14.,15.,16.,17.]、睡眠 [18.]を制御し、明らかに古典的なコアゴニストであるグリシンに取って代わる。それでも、NMDARのコ・アゴニストの正体は、グリシンからd-セリンへの切り替え [14.]、そしてシナプスのレジームによって決定される。驚くことではないが、セリンラセマーゼ(SR)欠損マウスは、振動ネットワーク活動と記憶障害を示す [19.,20.]。さらに、d-SerはGluD(またはGluRδ)受容体にも結合し、小脳平行線維プルキンエ細胞シナプスにおける長期抑圧(LTD)や、発達中のマウスにおける運動協調性 [21.]、皮質抑制性シナプスの形成 [22.]を制御する。CB1受容体 [23.]、コリン作動性受容体 [16.]、ドーパミン作動性受容体 [17.]の活性化は、シナプスにおけるd-Serの利用可能性を調節している。 ガス伝達物質であるH2Sとポリスルフィドもまた、SRの硫酸化を通じてシナプスにおけるd-Serの利用可能性を促進し、NMDAR依存性の長期増強(LTP)と記憶形成を増強する [24.]。H2SはDAAO-3-MPS経路によってd-Cysから生成されるため、脳内のd-CysはH2Sへの変換を介して、また部分的にはd-Serの代謝と機能を調節することによって、シナプス伝達を調節している可能性がある。
図3
図3重要な図。脳内d-アミノ酸(d-AAs)の生理学的および病理学的ランドスケープ。
キャプション
大きな画像を見るダウンロード 高解像度画像
成熟脳におけるd-Aspの生理的役割に関する情報はそれほど多くない。Ddo-nullマウスは加齢に伴うd-Aspの正常な減少を示さず(図1)、d-Aspは正常の10-25倍のレベルまで脳内に蓄積する [25.]。成体のDdo-nullマウスはグルーミング行動に変化を示し、NMDARを介した反応が亢進する [25.]。逆に、胎生期からDdoを過剰発現させ、幼少期にd-Aspを除去したノックインマウスでは、d-Aspが皮質介在ニューロンの生成を制御し、記憶能力を高め [9.]、L-AAsと脂質代謝を制御していることが明らかになった [26.]。
d-AAsの代謝における変化は、健康な加齢の間に認知機能の低下を引き起こし、恒常性維持因子としてのd-AAsの役割をさらに強固なものにしている。実際、げっ歯類の前脳では加齢に伴いd-Ser濃度が低下し、健康な被験者の血清d-Ser濃度と年齢との間の負の関連も報告されている [27.]。d-Serを慢性的に補給すると、ラットの認知柔軟性、脳の機能的結合性、神経細胞形態の加齢に伴う低下が回復する [28.]。逆に、Ddo-nullマウスに見られるように、d-Aspの持続的な増加は、加齢に伴うシナプス可塑性の低下を促進し、老齢マウスの学習と記憶を悪化させる [29.]。
疾患脳におけるd-AAs
d-AAsは脳生理学において重要な機能を担っているため、d-AAsの代謝、レベル、シグナル伝達における変化は、多くの神経疾患、神経変性疾患、精神疾患と関連しているようである(図3)[1]。
精神疾患におけるd-AAsの役割
SCZと自閉症スペクトラム障害(ASD)
最近のゲノムワイド関連研究(GWAS)やエクソーム研究によると、SCZのリスク遺伝子の30%がグルタミン酸作動性シナプスに集積するタンパク質をコードしており、最終的にNMDARの機能に影響を及ぼし、この疾患の病因におけるグルタミン酸作動性仮説の重要性を立証している [20]。
DAAO遺伝子とG72遺伝子(DAAO相互作用因子をコードする)の両方におけるいくつかの一塩基多型(SNP)変異は、世界中のコホートにおいて一貫してSCZ患者と関連している。DAAOの発現と活性の両方が、SCZ患者の死後の皮質組織と小脳組織で増加しており、DAAOとG72の血清レベルも上昇している [30,31.]。同様に、SR欠損変異マウスはSCZの多くの特徴を顕著に表現する [20.]。SRと他の蛋白質との間の有意な相互作用が前臨床モデルで発見された。そのうちのいくつかはSCZの重要な危険因子であり、例えばタンパク質相互作用性Cキナーゼ1(PICK1)やDISC-1 [32.]の多型は、その発現が患者の認知機能障害とも関連している [33.]。このような誤った相互作用の一部がSRの分解を促進するという予測は、SCZ患者の血漿中や死後の脳組織で認められるSRタンパク質の低レベルを説明するかもしれない [31.]。
12の研究のメタアナリシスでは、血中および血漿中のd-Serレベルの低下はSCZの臨床的特徴であるが、脳や髄液のレベルには影響がないと結論している [34]。さらに、血清d-Serの低下は、SCZ患者における実行機能の障害と相関している [35.]。同様に、血清d-Serの高値は、SCZ患者における認知トレーニング後の全般的認知機能の改善と有意に一致している [36]。これらのデータは、疾患重症度のバイオマーカーとしての血清d-Serの命題を強化するものである [37]。同様に、d-Aspも薬物治療を受けたSCZ患者の死後脳サンプルで減少している [38]。これは、酵素や代替代謝経路の遺伝的変化というよりも、むしろDdoの活性低下に関係しているようである [38.]。これらの所見を確認するためには、より大規模で薬剤未投与のコホートが必要であるが、将来的にはd-Aspが信頼できる疾患バイオマーカーであることが証明されるかもしれない [1]。
その結果、この疾患に対してd-AAsによる治療が提案されている。d-Serは高用量(2g/日)であってもヒトにおいて良好な安全性プロフィールを示すが(総説は[39.])、メタアナリシスでは、非クロザピン使用者に対する上乗せ薬としてのd-Serの使用において、陽性症状、陰性症状、認知症状における一般的な、しかしわずかな有益性が示されている [34.,40.]。最後に、SCZの治療では、DAAO阻害剤である食品保存料の安息香酸ナトリウムが刺激的な結果を示している(囲み記事3)[41]。このような結果を受けて、青年期および成人の治療抵抗性SCZ患者を対象とした大規模な二重盲検無作為化プラセボ対照第2相および第3相臨床試験が開始された(NCT01908192i、NCT03094429ii、ACTRN12621000327886iii)。同様に、ニューロクライン・バイオサイエンシズ社と武田薬品は最近、DAAO阻害薬Luvadaxistat(NBI-1065844/TAK-831iv)の限定的な成功を発表した。この薬剤については、2つの二重盲検無作為化プラセボ対照臨床第2相試験が登録されているが、2023年8月現在、結果は得られていない(NCT0359785vおよびNCT03382639vi)。
ボックス3
もう一つの神経発達障害であるASDは、SCZと共通の危険因子を有している。グルタミン酸作動性機能障害、特にNMDARの機能低下とASDとの間には強い関係があるにもかかわらず、4種類のASDモデルマウスの最近の分子評価では、Cntnap2-nullマウス、Shank3-nullマウス、16p11.2ヘテロ接合マウスの大脳組織と血清では、d-Serとd-Aspの代謝に変化がないことが報告されている[42]。しかし、特発性ASDのBTBR(black and tan, brachyury)マウスモデルでは、DdoのmRNAレベルの低下とともに、前頭前野、海馬、血清中のd-Asp含量の増加が認められる [42.]。この結果は、ASDにおけるd-Asp代謝の変化を支持するものであるが、同時にこの疾患の遺伝的動物モデルの限界にも光を当てている。ヒトのコホートにおける更なる研究が必要である。
大うつ病性障害(MDD)
グルタミン酸作動性システムにおける不均衡と、非競合性NMDAR拮抗薬である(R,S)-ケタミンの迅速かつ長時間持続する抗うつ効果により、MDDの病態生理学に関する新たな理論が生まれた [43.]。同様に、遺伝子操作、食事からのd-Ser補給、急性投与などによる全身的なd-Serレベルの増強は、動物モデルにおいて抗うつ薬に似た効果を示す [45]。さらに、DAAO阻害剤の安息香酸ナトリウムは、患者に有益な効果をもたらす [46.]。SRのmRNA発現レベルはMDD患者において変化しており [47.]、SR欠損マウスはうつ病様の表現型を示す [48.]。MDDとG72/30遺伝子との関連については、矛盾したデータしか得られていないため、このトピックに光を当てるためには、より大規模なコホートを用いた追加研究が必要である。
双極性障害(BD)
AAsの血漿レベルの変化は、BDの症状および重症度と関連している。臨床的に安定している患者では、d-Serの血清中濃度は有意に高いが、l-Serの血清中濃度は低い [49.]。実際、DAAO遺伝子のいくつかのSNPリスクハプロタイプは、d-Serに対する活性の低下と関連しており、BDの病因に関与していることが疑われている。BDとの有意な関連または関連を有する741遺伝子の最近のメタアナリシスによると、DAAO遺伝子のミスセンス変異体(DAOG130Vまたはrs768676371)が高リスクのトップスコア変異体であることが示されている [50.]。DAOG130Vを持たないマウスは、d-Serを分解できないために、より重篤なストレスに対する感受性が亢進する(あるいは回復力が低下する) [50.]。さらに、小脳組織のRNA配列決定から、DAOG130V発現によってシナプス機能をコードする遺伝子の発現が低下することが明らかになった。最後に、DAAO遺伝子に関する両義的なデータとは対照的に、G72/30遺伝子座とBDとの関連を示す有力な証拠がある。複数のコホートにおいて、異なる対立遺伝子やSNPが同定されている [51]。
物質使用障害(SUD)
SCZ患者における薬物乱用は、一般集団に比べて著しく高い。d-Aspとd-SerはともにSCZの病態に関連しており、NMDARは一貫してSUDに関与していることが証明されているため、研究では物質乱用の表現型とd-AA異常との関連性が検討されている。げっ歯類の受動的なコカイン摂取は、中毒行動の根底にある神経可塑的適応に関与する中皮質辺縁部におけるd-Serの代謝を変化させ、これが運動神経感作の発達に寄与している。SR欠損マウスは、コカインに対する快楽的な反応が鈍く、また運動神経の感作も減弱している [52.]。SR欠損マウスに皮質のd-Serレベルを正常化する用量である300mg/kg/日のd-Serを投与すると [52.]、野生型マウスで通常観察されるような消退時のコカイン選好性が回復する。父親のコカイン使用は、DAAO遺伝子のエピジェネティックなリモデリングを引き起こし、コカインと交配したオスの子孫の海馬で過剰発現させる。その結果、子孫は海馬のd-Serレベルが低下し、シナプス可塑性が損なわれ、空間ワーキングメモリーが損なわれる [53.]。海馬にd-Serを投与すると、すべての障害が逆転した [53.]。これらの観察を総合すると、d-SerのようなNMDARを調節する薬物が、コカイン誘発性再発の消滅のための有望な薬物療法となる可能性があることがさらに確認された [54.]。
同様に、特定の脳領域におけるNMDARの機能低下が、アルコール関連行動を反映していることを示す証拠も集まっている [55.]。d-Serを全身投与または側坐核(NAc)に直接投与すると、NMDAR遮断薬であるd-AP5と同様の方法で、強迫様飲酒を選択的に減少させる [56.]。DAAO阻害薬である安息香酸ナトリウムと閾値以下のd-Serを併用投与すると、強迫的飲酒が抑制され、アルコール使用障害に対する新たな介入となる [57]。コカインで実証されたように、アルコール乱用は物質に対する快楽的反応の低下から生じる場合があり、慢性的な使用によるd-AAsの代謝障害によって引き起こされるようである。このことは、公衆衛生に大きな影響を与えるニコチンなどの他の乱用物質にも当てはまるかもしれない。
神経疾患におけるd-AAsの役割
慢性疼痛
病理学的メカニズムは複数あるが、前臨床研究では、d-AAsが神経障害性疼痛に重要な役割を果たしていることが示されている。Ddo-nullマウスの高濃度のd-Aspは、機械的および熱的に誘発された疼痛条件下での侵害受容反応を、性特異的に悪化させる [58.]。雌雄ともにDdo-nullマウスでは、ホルマリンテストの後期炎症期において、脊髄神経活動の変化と関連して侵害受容反応がコントロールと比較して悪化する [58.]。逆説的ではあるが、脊髄神経損傷(SNI)術後1ヶ月間、飲料水中のd-Asp(20mM)を投与すると、機械的アロディニアと運動・認知障害が回復することから [59]、異なる疼痛メカニズムにおけるd-Aspの関連性と相反する役割がさらに明らかになった。内因性のd-Serは、侵害受容経路におけるグリオジェニックLTP [60]を制御しており、驚くことではないが、いくつかの疼痛状態にも関与している。慢性神経障害状態における脊髄シグマ-1受容体の病理学的活性化は、脊髄グリアにおけるSR発現を増加させ [61.]、脊髄d-Serは、神経細胞一酸化窒素合成酵素(nNOS)活性を活性化することにより、機械的アロディニアと痛覚過敏 [62.]に寄与し、最終的にプロテインキナーゼC(PKC)依存性GluN1リン酸化の増加につながる [63.,64.]。アミノグルテチミド [65.]によるCP-450の阻害や、プレガバリン [66.]によるGABA作動性伝達の増強は、脊髄のd-Ser量と表在性後角のNMDARを介したシナプス伝達を減弱させ、機械的アロディニアを緩和する。SRもDAAOも、現在では慢性疼痛のターゲットと考えられている [67.]。SR阻害剤は、げっ歯類のアロディニアを軽減することが繰り返し示されている [63,64.]。前臨床研究では、いくつかのDAAO阻害剤がマウスの系統依存的にホルマリン誘発強直性疼痛を逆転させることが示されている [68.]。興味深いことに、DAAO阻害剤CBIOの皮下注射は、マウスにおけるモルヒネ誘発性温熱痛覚過敏を予防する [69.]。d-Cysやd-Alaなど、あまり研究されていないd-AAsの役割だけでなく、中枢や脊髄のメカニズムを理解するためのさらなる研究は、今後数十年の間にこの分野を一変させる可能性を秘めている。
てんかん/片頭痛
d-Serがてんかんの病因と進行に関与していることを示す前臨床証拠が増えつつある。ピロカルピン側頭葉てんかん(pTLE)モデルにおいて、アストログリアのコネキシン43ヘミチャネルの薬理学的阻害は、通常けいれんを伴う細胞外のd-Serレベルを低下させることにより、けいれんから保護する[70]。同様に、化学的に誘発されたてんかん発作は、SRの薬理学的阻害によって減少する [71.]。このようなd-Serの意義は、TLE患者を対象とした遺伝学的研究でも最近確認された。3つのSRタグSNPが、TLEに対する感受性の低下と重症度の低下に関連していたのである [72.]。てんかんにおけるd-Serの正確な役割はまだ解明されていないが、TLEの動物モデルにおいて、d-Serを投与すると、神経細胞の減少とグリオーシスを抑制することにより、てんかんの発生を予防することができ [73.]、難治性TLEの治療薬として新たな希望をもたらしている。他のd-AAsもてんかんに関与している可能性がある。例えば、脳内の総ロイシンの16-20%を占めるd-Leu [2]がそうである。d-Leuは急性カイニン酸誘発てんかん発作を抑制し、発作発症後に投与しても暗期サイクル中の発作閾値を上昇させる [74]。
いくつかの先天性Ser生合成異常は、てんかん発作から難治性てんかんに至る神経障害を引き起こすことがある。中枢神経系における主要なセリントランスポーターであるASCT1の変異は、ノイ・ラクソバ症候群で観察されるものと同様の神経学的症状を呈する小児で最近報告されている [75]。最後に、非ケトン性高グリシン血症(NKH)は、CSF l-Serおよびd-Serの減少(後者でより顕著)を伴うが、これはおそらくd-Ser代謝の障害を反映している [76.]。グリシンはSRの最も強力な制御因子であり、病的なグリシンレベルはSR活性に持続的な阻害を及ぼすため、NKH患者ではd-Serの産生が鈍化する可能性がある [77.]。興味深いことに、Ser代謝とおそらくd-Serを調節するケトジェニック食は、程度の差はあれ、これらの代謝状態の治療に成功している [78.]。
最後に、てんかん患者は片頭痛のリスクが高いが、これは片頭痛と臨床的特徴や病態生理学的メカニズムを共有している。てんかん患者における片頭痛の生涯有病率を調べた研究では、酵素の転写に影響するSR多型rs4523957が片頭痛リスクの低下と有意に関連していることが明らかになった [79.]。再現が待たれるが、これらの観察結果は、d-Serによる異常なNMDAR活性化が片頭痛における重要な病態生理学的メカニズムであることを示唆している。
虚血状態
虚血性半月板は、細胞死経路を引き起こすNMDARの過剰活性化によって生じる。SRとd-Serは脳卒中の進行に重要な役割を果たしていることが分かっている。SRの欠失は、脳梗塞のマウス中大脳動脈閉塞(MCAO)モデルにおいて虚血障害を約50%減少させることが報告されており [80.]、これはNMDARの薬理学的遮断による保護に匹敵する。同様に、外傷性脳損傷(TBI)は、興奮毒性誘発性神経変性のため、組織喪失と神経機能障害を引き起こす。最近の研究では、マウスの軽度TBIによって、d-Serの細胞供給源が海馬のニューロンからグリアに切り替わることが示された [81.]。グリア由来のd-Serは、傷害を受けた海馬においてシナプス外GluN2B含有NMDARの活性化を通じて、TBI後の興奮毒性障害とシナプス機能障害を促進する [81.]。それにもかかわらず、DAAOの阻害による脳のd-Serの増強もまた、神経保護を提供し、TBI後の認知機能の回復を媒介する可能性がある [82.]。このようなd-Serの有益な効果が、d-Serの「神経細胞」機能の再確立によって引き起こされるのかどうかは不明である。
神経変性疾患におけるd-AAsの役割
ALS
ALSは、最も一般的な成人発症の神経筋疾患であり、非常に衰弱し、急速に進行する疾患で、発症後2~5年で致死的な麻痺に至る。ALSは、d-Serが発症に重要な役割を果たす神経変性疾患の中で、最も多く報告されている疾患である。d-Serレベルは、散発性/家族性ALS患者の脊髄やALSのSOD1G93Aマウスモデルにおいて上昇し、NMDARの過剰活性化を通じて運動ニューロンの変性を引き起こす[83. 自然発生変異DAAOG181Rを持つddY/DAAO-トランスジェニックマウス [83.]は、SOD1G93Aマウスモデルで観察されたような異常反射を示す。家族性(f-ALS)症例におけるミスセンスDAAOR199W置換の同定は、ALSにおけるDAOの関与を決定的にした [84.]。DAAOR199W変異を発現するトランスジェニックマウスは、脊髄におけるユビキチン化の亢進とともに、筋萎縮を伴う軸索変性を示し、また運動ニューロン変性に続発する筋緊張の低下による進行性の硬直性胸腰椎前弯を示す [84.]。野生型DAAOの過剰発現は、SOD1G93A変異を発現するトランスジェニックマウスの生存を有意に増強する。ALSに関連するDAAO変異は他にもいくつか報告されている [85.,86.]。散発性ALS患者を対象とした大規模なエクソームシークエンス研究では、DAAO遺伝子の多型のみが臨床転帰と関連しており、その結果生存率が低下することがわかった [87.]。ALSにおけるd-Ser/DAAO系の寄与は、RNAプロセシングの制御に関連するRNA結合タンパク質(RBP)の標的に関する研究でも示されている。RBPのhnRNP A2/B1を欠損すると、酵素活性が約6倍低下し、非常に不安定なDAAOアイソフォームが生じる [88.]。このような前臨床および臨床の知見がどのように治療薬に結びつくかは、まだ確定していない。
脳性失調症
脊髄小脳失調症は、稀な遺伝性進行性疾患の異質なグループを構成している。フリードライヒ失調症との類似性を示す顕著な感覚運動失調、心肥大、ミトコンドリア機能障害が、内皮特異的Cdh5プロモーターの制御下でDAAOを発現する化学遺伝学的トランスジェニックマウスで同定されている [89.]。患者を対象とした最近のエクソームシークエンス研究により、グルタミン酸受容体GluD2サブユニットをコードするGRID2遺伝子にホモ接合性のc.2128C>T, p.(Arg710Trp)ミスセンス変異があることが明らかになった [90.]。このAA置換は、GluD2の細胞外d-Ser結合ドメインの高度に保存された残基を変化させ、それによって受容体へのd-Ser結合を変化させるが、消失はさせない。これは、d-SerがGluD2に結合することで、正常な小脳の発達と機能に重要であるという考えを支持するものである [21.]。驚くべきことに、これらの観察結果は、SR欠損マウスに見られる全般的な皮質の萎縮 [20]や、DAAOの高選択的かつ強力な阻害剤であるLuvadaxistatが、d-Serレベルを増加させることにより、臨床的に有用であるという最近の証拠 [91]とも一致している。
ADと認知症
d-AAsとADの病態との関連は、患者や疾患モデル間で相反するデータが報告されているため、確立することが困難であった。年齢をマッチさせた健常者とAD患者の大規模コホートの分析によると、血清d-SerはADと正の相関があり、一方d-Aspレベルは変化しないことが示されており [92]、このデータは7つの研究の最近のメタアナリシスによって裏付けられた [93.]。d-Serとd-Aspに加えて、d-Ala、d-Leu、d-Glu、d-Phe、d-Proを含む他のd-AAsの血清レベルもADでは変化する可能性があり [94]、疾患の進行において異なる役割を果たす可能性が高い [95]。これらの変化は、患者のマイクロバイオームの変化を反映している可能性が高い。驚くことではないが、d-Ser代謝の変化は、AD発症のさまざまな節目で関与している [96.]。例えば、高血糖はAD発症の危険因子であり、脳のインスリンシグナル伝達障害はADで起こることが知られている。さらに、ADにおける低いインスリン応答はd-Ser代謝と関連しており [97,98.]、d-Serはまた、膵β細胞からのインスリン分泌を鈍らせることにより、NMDAR活性化を介して全身の糖代謝を制御している可能性がある [99.]。膵NMDARの阻害は、SRの欠損と同様に、インスリン分泌を減少させるが、この機序的関連はSNPs解析によって支持されている [99.]。
d-Serは、他の2つのシナリオを通して病態に関与している可能性がある。前臨床研究では、AβオリゴマーがSRの発現を促進し [100]、d-Serの産生を高めることによって神経病理学的転帰をもたらすという興奮毒性シナリオが有力視されている。 したがって、APPKi ADモデルマウスにおけるSRの欠失は、Aβオリゴマー誘発性の細胞消失を防ぐ [101]。DAAOの濃度は、AD患者だけでなく軽度認知障害者の血清中にも増加しており、認知障害の重症度と正の相関がある [102,103.]。同様に、G72/30遺伝子の変異は、認知機能低下の重症度とは非直線的な関連を示すものの [104.]、ADの発症年齢を変化させる [105.]。脳の好気的解糖能が障害されると、l-Serの産生が障害され、d-Serの合成が阻害されるため、シナプス可塑性と認知能力に影響を及ぼすという逆のシナリオもある [15.]。興味深いことに、3xTg-ADマウスで観察されたすべての症状は、l-Serまたはd-Serを食事または飲料水に補充することで完全に回復した [15.]。このようなd-Serの代謝とレベルのアップダウン制御は、発症の軌跡に沿った様々な段階で異なる関与をしている可能性があり、また性別に特異的である可能性もある [97.]。d-Ser/NMDARシステムの機能不全がADの引き金となる事象なのか、あるいは進行中の神経変性過程の結果なのかを明らかにするためには、さらなる研究が必要である。
パーキンソン病(PD)とジスキネジア
PDの病因におけるd-AAsの役割は最近明らかにされた。Ddo-nullマウスにおける非生理的な高濃度のd-Aspは、ドパミン脱神経とレボドパ(L-DOPA)慢性長期投与後にのみ動物で通常発現する皮質-線条体シナプス脱分化の消失を促進する。この結果、l-DOPA誘発性ジスキネジア(LID)の発現が早まる [106.]。アカゲザルの1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン塩酸塩(MPTP)投与は、被殻のd-Aspとd-Serを増加させるが、L-DOPAは両d-AAsのレベルを回復させる [107.]。逆に、ドパミン作動性脱神経は黒質における選択的なd-Serの減少と関連しており、MPTP-および6-OHDA-病変を有するげっ歯類の脳においてd-Serレベルが変化するという以前の前臨床観察を裏付けている [108.]。さらに、L-DOPAを投与していないPD患者の髄液ではd-Serレベルが低く [107.]、SRは患者におけるLRRK2-G2019Sの病原性を補完するPD遺伝的背景における感受性因子である可能性がある [109.]。
d-AAs:臨床への準備は整ったか?
脳疾患におけるd-AAsの使用に関する臨床試験は、学術的にも製薬会社によっても、最近終了したか、あるいは現在進行中である。d-Serの食事による補充は、SCZや気分障害、脳症、SUDなど、多くの精神疾患の治療においてすでに採用されている。d-Aspもまた、栄養補助食品としてヒトでの使用が承認されており、その経口投与は多発性硬化症における有望なアプローチである [110.]。しかしながら、他のd-AAsを用いた経口治療では、1kgあたり1日数グラムという高用量が必要であり、特に腎臓や肝臓に合併症を持つ患者においては、安全性に潜在的な懸念が生じる可能性がある [39.]。そのため、d-Serとd-Aspが関連する疾患を治療するための化合物を開発するために、精力的な創薬プログラムが実施されている(囲み記事1)。今のところ限定的ではあるが、d-AAに基づく新規薬物療法の開発は、近い将来、脳疾患の治療を再構築すると期待されている。
おわりに
本総説では、脳や体液だけでなく、他の臓器にも存在する謎めいたシグナル伝達分子の一群を形成するd-AAについて、いくつかの例を取り上げてきた。我々は、この分野における現在の進歩に注目し、それらを用いて、生理学および病態生理学におけるd-AAsの役割に関する我々の理解が、近年の基礎脳科学の分野にいかに革命をもたらしたか、また、現在我々が患者の治療をどのように考えているかを説明した。我々はd-AAsの重要性を認識しているが、それはd-AAsの制御不全が様々な脳疾患や代謝性疾患に関与していることが明らかになりつつあるためである。d-AAsを精密に検出・制御する革新的な技術の急速な導入と、新しいモデル生物の登場により、d-AAsの生理病理学的役割や、特に臓器間情報伝達における役割について、多くの新しい知見が得られることが期待される(臨床家のコーナー参照)。
臨床家のコーナー
未解決の問題
謝辞
本総説の目的にとって科学的に適切であったにもかかわらず、紙面の都合により引用しなかった著者にお詫びを申し上げる。I.N.O.S.はEMBOポスドクフェローシップALTF 981-2020の受給者である。J-P.M.はCNRSおよびUniversité Paris-Saclayの支援を受けた。
利害関係
著者らは、競合する利益はないと宣言している。
リソース
ihttps://classic.clinicaltrials.gov/ct2/show/NCT01908192
iihttps://classic.clinicaltrials.gov/ct2/show/NCT03094429
iiihttps://anzctr.org.au/Trial/Registration/TrialReview.aspx?id=381442
ivhttps://www.prnewswire.com/news-releases/neurocrine-biosciences-announces-top-line-results-from-phase-ii-interact-study-evaluating-luvadaxistat-nbi-1065844-for-the-treatment-of-negative-symptoms-and-cognitive-impairment-associated-with-schizophrenia-cias-301238086.html
vhttps://classic.clinicaltrials.gov/ct2/show/NCT03359785
vihttps://classic.clinicaltrials.gov/ct2/show/NCT03382639
参考文献
Liu Y.
et al.
疾患バイオマーカーとしてのキラル分子の検出と解析。
Nat. Rev. Chem. 2023; 7: 355-373
論文で見る
スコープス(2)
PubMed
クロス
グーグル奨学生
ウェザリー C.A.
他
灌流マウス脳組織および血液中のD-アミノ酸レベル:比較研究。
ACS Chem. Neurosci. 2017; 8: 1251-1261
論文で見る
スコープス (85)
PubMed
クロス
グーグル奨学生
Wang J.
et al.
哺乳類蝸牛におけるD-セリンの生理病理学的関連性。
Front. Cell. Neurosci. 2021; 15733004
論文で見る
スコパス(2)
クロス
グーグル奨学生
大崎玲子.
et al.
内因性D-セリンはセリンラセマーゼによる合成とは無関係に哺乳類の脳に存在する。
Biochem. Biophys. Res. Commun. 2023; 641: 186-191
論文で見る
スコープス (1)
PubMed
クロス
グーグル奨学生
川瀬毅.
et al.
マウスの腸内細菌叢は宿主の脳におけるアミノ酸代謝を比較的修飾する。
Br. J. Nutr. 2017; 117: 775-783
論文で見る
スコープス (72)
PubMed
クロス
グーグル奨学生
リー C.J.
et al.
ラット腸内細菌叢の分離微生物によるD-アラニン産生のプロファイリング。
FASEB J. 2022; 36e22446
論文で見る
スコープ (3)
クロスリファレンス
グーグル奨学生
ザラゴザR.
血液脳関門を通過するアミノ酸の輸送。
Front. 生理学 2020; 11: 973
論文で見る
スコープス (61)
PubMed
クロス
グーグル奨学生
ポッレジオーニL.
他
ヒトD-アスパラギン酸オキシダーゼ:D-アスパラギン酸代謝のキープレイヤー。
Front. Mol. Biosci. 2021; 8689719
論文で見る
スコープス (9)
クロスリファレンス
グーグル奨学生
ロンバルド B.
et al.
D-アスパラギン酸オキシダーゼ遺伝子の重複は、マウスの社会認識記憶障害とヒトの知的障害を引き起こす。
Transl. Psychiatry. 2022; 12: 305
論文で見る
スコパス (3)
PubMed
クロス
グーグル奨学生
セメンザ E.R.
他
D-システインは哺乳類脳における神経前駆細胞動態の内因性制御因子である。
Proc. Natl. Acad. Sci. U. S. A. 2021; 118e2110610118
論文で見る
スコパス (22)
クロスリファレンス
グーグル奨学生
Roychaudhuri R.
et al.
セリンラセマーゼは、脂肪酸代謝を介して脳室下帯の神経新生を仲介する。
Stem Cell Reports. 2023; 18: 1482-1499
論文で見る
(0件)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Mothet J.P.
他
NMDA受容体コアゴニスト機能の時空間プロファイリング。
J. Neurochem. 2015; 135: 210-225
論文で見る
スコープス (27)
PubMed
クロス
グーグル奨学生
Bohmbach K.
et al.
樹状突起の統合と空間学習の周波数依存的制御のためのアストロサイトシグナル伝達ループ。
Nat. Commun. 2022; 13: 7932
論文で見る
スコープ (0)
パブコメ
クロス
グーグル奨学生
ル・ベール M.
他
海馬におけるNMDA受容体コアゴニストの同定はシナプス特異的であり、発生学的に制御されている。
Proc. Natl. Acad. Sci. U. S. A. 2015; 112: E204-E213
論文で見る
スコープス (93)
PubMed
クロス
グーグル奨学生
ル・ドゥースJ.
他
アストロサイトにおける解糖由来のL-セリン産生の障害は、アルツハイマー病における認知障害に寄与する。
Cell Metab. 2020; 31: 503-517
論文で見る
スコープス (126)
PubMed
要旨
全文
全文PDF
グーグル奨学生
パプアンT.
et al.
中隔コリン作動性神経調節は、海馬NMDA受容体のアストロサイト依存的な覚醒へのゲーティングを調整する。
Neuron. 2017; 94: 840-854
論文で見る
スコープス (147)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ダレラックG.
ほか
ドパミン作動性神経による前頭前皮質活動の調節には、NMDA受容体コゴニストであるD-セリンが必要である。
Proc. Natl. Acad. Sci. U. S. A. 2021; 118e2023750118
論文で見る
スコパス (9)
PubMed
クロス
グーグル奨学生
Dai X.
et al.
ショウジョウバエ腸内のセリンラセマーゼによって作られるD-セリンは、睡眠において生理的な役割を果たす。
Nat. Commun. 2019; 10: 1986
論文で見る
スコープス (34)
PubMed
クロス
グーグル奨学生
アギラーD.D.
et al.
NMDA受容体機能低下遺伝モデルマウスにおける神経振動と行動の変化。
Sci. Rep. 2021; 11: 9031
論文で見る
スコパス (11)
PubMed
クロス
グーグル奨学生
コイルJ.T.
他
統合失調症研究の50年:グルタミン酸作動性シナプスの台頭。
Am. J. Psychiatry. 2020; 177: 1119-1128
論文で見る
スコープス (29)
PubMed
クロスフィルム
グーグル奨学生
エレヘールトJ.
et al.
シナプスオーガナイザー複合体内におけるGluD受容体の統合の構造的基盤。
Science. 2016; 353: 295-300
論文で見る
PubMed
クロス
グーグル奨学生
フォッサーティ M.
他
グルタミン酸受容体δ-1を介したシナプス横断シグナル伝達は、大脳皮質錐体ニューロンにおける抑制性シナプス形成を媒介する。
Neuron. 2019; 104: 1081-1094
論文で見る
スコープス (46)
PubMed
要旨
全文
全文PDF
グーグル奨学生
ロビン L.M.
他
アストログリアのCB1受容体は、シナプスのD-セリンの可用性を決定し、認識記憶を可能にする。
Neuron. 2018; 98: 935-944
論文で見る
スコープス (142)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Li Y.-L.
et al.
N-メチル-D-アスパラギン酸サブタイプグルタミン酸受容体依存性シナプス可塑性は、D-セリン利用能の増加を介して、活性依存的な硫酸化シグナルによって制御される。
Antioxid. Redox Signal. 2017; 27: 398-414
論文で見る
スコープス (23)
PubMed
クロス
グーグル奨学生
クラシア P.
et al.
D-アスパラギン酸の持続的上昇は、マウス黒質pars compactaドーパミンニューロンにおけるNMDA受容体を介した反応を増強する。
Neuropharmacology. 2016; 103: 69-78
論文で見る
スコープス (28)
PubMed
クロス
グーグル奨学生
グリマルディ M.
他
出生前および出生後早期の大脳d-アスパラギン酸欠乏は、l-アミノ酸経路、生体エネルギープロセス、および発達期の脳代謝に影響を及ぼす。
J. プロテオーム研究 2021; 20: 727-739
論文で見る
スコープス (5)
PubMed
クロス
グーグル奨学生
Leng L.
et al.
視床下部メニンは全身の老化と認知機能低下を制御する。
PLoS Biol.
論文で見る
(0件)
PubMed
クロスフィルム
グーグル奨学生
ナバ-ゴメスL.
et al.
加齢に伴う認知機能低下はD-セリンの補充によって回復する、eneuro. 2022; 9 (eneuro.0176)
論文で見る
グーグル奨学生
Punzo D.
et al.
D-アスパラギン酸オキシダーゼプロモーターのメチル化における加齢に伴う変化は、細胞外D-アスパラギン酸レベルを制御し、脳の老化に伴う早期の細胞死を防ぐ。
J. Neurosci. 2016; 36: 3064-3078
論文で見る
スコパス (0)
PubMed
クロス
グーグル奨学生
アキョル E.S.
他
統合失調症患者における血清G72タンパク質レベルの上昇:潜在的なバイオマーカー候補。
Acta Neuropsychiatr.
論文で見る
スコープス (11)
PubMed
クロス
グーグル奨学生
El-Tallawy H.
他
統合失調症患者におけるD-セリン代謝の臨床生化学的研究。
Neuropsychiatr. Dis. Treat. 2017; 13: 1057-1063
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
ヤコビ A.A.
他
神経セリンラセマーゼはDISC1およびDISC1凝集体に結合する。
Neurosci. 2019; 692: 107-114
論文で見る
スコープス (5)
PubMed
クロスフィルム
グーグル奨学生
チェン Y.T.
他
統合失調症患者におけるPICK1遺伝子変異と認知機能。
Sci. Rep. 2017; 7: 1889
論文で見る
スコープス (6)
PubMed
クロス
グーグル奨学生
Cho S.E.
他
統合失調症における低D-セリンレベル:系統的レビューとメタ解析。
Neurosci. 2016; 634: 42-51
論文で見る
スコープス (49)
PubMed
クロス
グーグル奨学生
ホンス J.
et al.
統合失調症患者におけるD-セリン血清濃度低下と関連した実行機能の障害。
Front. Psychiatry. 2021; 12514579
論文で見る
スコープス (6)
PubMed
クロス
グーグル奨学生
パニズッティR.
他
血清D-セリンの増加と統合失調症における集中的認知訓練による認知機能向上との関連。
Schizophr. Res. 2019; 207: 63-69
論文で見る
スコープス (23)
PubMed
クロス
グーグル奨学生
ムルタスG.
ポッレジオーニL.
新規血中バイオマーカーとしてのD-アミノ酸。
Curr. Med. Chem. 2022; 29: 4202-4215
論文で見る
スコープス (5)
PubMed
クロス
グーグル奨学生
Nuzzo T.
他
遊離d-アスパラギン酸レベルの低下は、統合失調症患者の背外側前頭前皮質におけるd-アスパラギン酸オキシダーゼ活性の亢進と関連している。
NPJ Schizophr. 2017; 3: 16
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
メフタA.
他
D-セリン:安全性のクロス種レビュー。
フロント。Psychiatry. 2021; 12726365
論文で見る
スコープス (13)
PubMed
クロス
グーグル奨学生
Goh K.K.
他
統合失調症におけるN-メチル-D-アスパラギン酸受容体モジュレーター増強の有効性:無作為化プラセボ対照試験のメタアナリシス。
J. Psychopharmacol. 2021; 35: 236-252
論文で見る
スコパス (19)
PubMed
クロス
グーグル奨学生
Lin C.H.
他
D-アミノ酸オキシダーゼ阻害薬である安息香酸ナトリウムを本剤に追加した統合失調症治療薬:無作為化二重盲検プラセボ対照試験。
Biol. Psychiatry. 2018; 84: 422-432
論文で見る
スコープス (83)
パブコメ
要旨
全文
全文PDF
グーグル奨学生
ヌッツォT.
et al.
特発性自閉症のBTBRマウスモデルにおけるD-アスパラギン酸代謝異常。
Biochim. Biophys. Acta Proteins Proteomics. 2020; 1868140531
論文で見る
スコープス (14)
クロスリファレンス
グーグル奨学生
Duman R.S.
他
うつ病における結合性の変化: GABAおよびグルタミン酸神経伝達物質の欠損と新規治療による逆転。
Neuron. 2019; 102: 75-90
論文で見る
スコープス(460)
PubMed
要旨
全文
全文PDF
グーグル奨学生
石渡 聡.
et al.
大うつ病性障害における脳脊髄液D-セリン濃度は、うつ病の重症度と負の相関を示す。
J. Affect. Disord. 2018; 226: 155-162
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
Chen Z.
et al.
D-セリンは、BDNFシグナル伝達経路の抑制と側坐核におけるシナプス適応の制御を介して、マウスに抗うつ様作用をもたらす。
Mol. Med. 2021; 27: 127
論文で見る
スコパス (5)
PubMed
クロス
グーグル奨学生
Lin C.H.
他
D-アミノ酸オキシダーゼ阻害薬である安息香酸ナトリウムが後期うつ病患者の知覚ストレスおよび認知機能に及ぼす影響:無作為化二重盲検セルトラリン・プラセボ対照試験。
Int. J. Neuropsychopharmacol. 2022; 25: 545-555
論文で見る
スコープス (0)
パブコメ
クロス
グーグル奨学生
Lin C.H.
et al.
大うつ病性障害患者のWBCにおけるN-メチル-D-アスパラギン酸受容体関連遺伝子のmRNA発現の変化。
J. Affect. Disord. 2019; 245: 1119-1125
論文で見る
スコープス (14)
PubMed
クロス
グーグル奨学生
Dong C.
et al.
セリンラセマーゼの欠失は、慢性的な社会的敗北ストレスに対するD-セリン依存的な回復力を与える。
Neurochem. Int. 2018; 116: 43-51
論文で見る
スコープス (14)
PubMed
クロス
グーグル奨学生
Pålsson E.
他
双極性障害患者と健常対照者の脳脊髄液および血清中のグルタミン酸シグナル伝達マーカー。
Eur. Neuropsychopharmacol. 2015; 25: 133-140
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
ハシン N.
他
双極性障害のリスクにNMDA受容体シグナル伝達と小脳遺伝子ネットワークが関与するまれな変異体。
Mol. Psychiatry. 2022; 27: 3842-3856
論文で見る
スコープス (1)
PubMed
クロス
グーグル奨学生
Ahmadi L.
他
統合失調症と双極性I型障害におけるDAOA遺伝子(rs947267とrs3918342)とCOMT遺伝子(rs165599とrs4680)の遺伝子変異。
Basic Clin. Neurosci. 2018; 9: 429-438
論文で見る
スコープス (8)
PubMed
クロス
グーグル奨学生
Puhl M.D.
他
N-メチル-d-アスパラギン酸受容体コアゴニストの利用可能性はコカインに対する行動および神経化学的反応に影響する:統合失調症と薬物乱用の併存に関する洞察。
Addict. Biol. 2019; 24: 40-50
論文で見る
スコープス (8)
PubMed
クロス
グーグル奨学生
Wimmer M.E.
他
父親のコカイン摂取は、男性の子孫においてエピジェネティックなリモデリングと記憶障害を誘発する。
モル。Psychiatry. 2017; 22: 1641-1650
論文で見る
スコープス (1)
PubMed
クロス
グーグル奨学生
Dakwar E.
他
N-メチル-D-アスパラギン酸受容体拮抗薬ケタミンによるコカイン自己投与の阻害:無作為クロスオーバー試験。
Mol. Psychiatry. 2017; 22: 76-81
論文で見る
スコープス (47)
PubMed
クロス
グーグル奨学生
ホップF.W.
特定のNMDA受容体サブユニットは嗜癖行動のゲートウェイとして働くか?
Genes Brain Behav. 2017; 16: 118-138
論文で見る
スコープス (47)
PubMed
クロス
グーグル奨学生
Seif T.
et al.
D-セリンとD-シクロセリンはラットの強迫的アルコール摂取を減少させる。
Neuropsychopharmacology. 2015; 40: 2357-2367
論文で見る
スコープス (59)
PubMed
クロス
グーグル奨学生
ウェグナー S.A.
他
強迫様飲酒を抑制する新規NMDA受容体ベースの介入。
Neuropharmacology. 2019; 157107681
論文で見る
スコープス (12)
PubMed
クロス
グーグル奨学生
Boccella S.
他
D-アスパラギン酸はマウスの炎症性疼痛および神経障害性疼痛状態において侵害受容特異的ニューロン活性と疼痛閾値を調節する。
Biomed. Res. Int. 2015; 2015905906
論文で見る
スコープス (24)
PubMed
クロス
グーグル奨学生
パラッツォE.
et al.
d-アスパラギン酸飲料水は神経障害マウスの痛みと認知障害を緩和する。
Amino Acids. 2016; 48: 1553-1567
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
クロンシュレーガー M.T.
他
神経膠原性LTPは侵害受容経路に広く広がっている。
Science. 2016; 354: 1144-1148
論文で見る
スコープス (112)
PubMed
クロス
グーグル奨学生
Choi H.S.
他
カラギーナン誘発鏡像痛における同側および対側脊髄アストロサイトD-セリンの関与の違い:σ1受容体とアストロサイトギャップ結合の役割。
Br. J. Pharmacol. 2018; 175: 558-572
論文で見る
スコープス (12)
PubMed
クロス
グーグル奨学生
ルフェーヴル Y.
et al.
神経因性疼痛はラットの脊髄NMDA受容体のd-セリン共活性化に依存する。
Neurosci. Lett. 2015; 603: 42-47
論文で見る
スコープス (28)
PubMed
クロス
グーグル奨学生
Choi S.R.
他
アストロサイトD-セリンは、末梢神経障害における機械的アロディニアの発症につながる神経細胞NOSの活性化を調節する。
Mol. Pain. 2019; 151744806919843046
論文で見る
スコープス (19)
PubMed
クロス
グーグル奨学生
Choi S.R.
et al.
脊髄D-セリンはPKC依存性GluN1リン酸化を増加させ、神経障害性疼痛モデルマウスにおけるシグマ-1受容体誘導性の機械的アロディニアの発現に寄与する。
J. Pain. 2017; 18: 415-427
論文で見る
スコープス (26)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Choi S.R.
他
神経障害性疼痛のマウスモデルにおいて、チトクロームP450の側鎖切断を阻害すると、脊髄のD-セリン産生が減少し、機械的アロディニアの発症が抑制される。
Front. Pharmacol. 2019; 10: 1439
論文で見る
スコパス (3)
PubMed
クロス
グーグル奨学生
加藤英明
et al.
神経因性疼痛マウスにおける脊髄D-セリン量とNMDA受容体を介したシナプス伝達に対するプレガバリンの効果。
Neurosci. Lett. 2017; 636: 270-275
論文で見る
スコパス (4)
PubMed
クロス
グーグル奨学生
ラクソーノ R.M.
他
セリンラセマーゼとN-メチル-D-アスパラギン酸受容体アンタゴニストとの相互作用から、慢性疼痛治療の代替ターゲットとなりうることが明らかになった。
J. J. Adv. Pharm. Technol. 2022; 13: 232-237
論文で見る
パブコメ
グーグル奨学生
Liu H.
et al.
DAAO阻害剤による抗侵害受容のマウス系統特異性。
Pharmacol. Res. Perspect. 2021; 9e00727
論文で見る
スコープス(1)
クロスリファレンス
グーグル奨学生
Ma S.
et al.
慢性モルヒネ誘発痛覚過敏に対する脊髄d-アミノ酸オキシダーゼの寄与。
J. Pharm. Biomed. Anal. 2015; 116: 131-138
論文で見る
スコープス (12)
PubMed
クロス
グーグル奨学生
Walrave L.
et al.
TAT-Gap19によるアストログリアのコネキシン43ヘミチャネルの阻害は、げっ歯類において抗けいれん作用を示す。
Glia. 2018; 66: 1788-1804
論文で見る
スコープス (1)
PubMed
クロス
グーグル奨学生
森秀樹.
et al.
新規セリンラセマーゼ阻害剤はin vivoで神経細胞の過剰活性化を抑制する。
Bioorg. Med. Chem. 2017; 25: 3736-3745
論文で見る
スコープス (10)
PubMed
クロス
グーグル奨学生
Tao H.
他
SRRイントロニック変異は隣接するSMG6遺伝子の発現を抑制し、側頭葉てんかんを予防する。
J. Cell. Mol. Med. 2018; 22: 1883-1893
論文で見る
スコープス (4)
PubMed
クロス
グーグル奨学生
ビーズリー S.
他
D-セリンは側頭葉てんかんに伴う細胞消失を緩和する。
Nat. Commun. 2020; 114966
論文で見る
スコープス (16)
クロスリファレンス
グーグル奨学生
ハートマン A.L.
他
D-ロイシンの強力な抗痙攣作用。
Neurobiol. Dis. 2015; 82: 46-53
論文で見る
スコープス (30)
PubMed
クロス
グーグル奨学生
ダムセー N.
他
脳内セリントランスポーターをコードするSLC1A4の変異は、発達遅延、小頭症、低髄鞘症に関連する。
J. Med. Genet. 2015; 52: 541-547
論文で見る
PubMed
クロスフィルム
グーグル奨学生
スワンソン M.A.
他
非ケトン性高グリシン血症における脳脊髄液アミノ酸グリシン、セリン、およびスレオニン。
J. 遺伝。Metab. Dis. 2022; 45: 734-747
論文で見る
スコープス (6)
PubMed
クロス
グーグル奨学生
ニーム S.
et al.
D-セリンとグリシンによるNMDA受容体の活性化は、アストロサイトのPhgdh依存性セリンシャトルによって制御されている。
Proc. Natl. Acad. Sci. U. S. A. 2019; 116: 20736-20742
論文で見る
スコープス (70)
PubMed
Crossref
グーグル奨学生
ガブリロビッチ C.
Rho J.M.
ケトジェニック療法が適応となる代謝性てんかん:適応、禁忌、および基礎メカニズム。
J. 遺伝。Metab. Dis. 2021; 44: 42-53
論文で見る
スコープス (0)
パブコメ
クロス
グーグル奨学生
ヴァン・デル・オーウェラ S.
他
D-セリンを介したNMDA(N-メチル-D-アスパラギン酸)受容体活性化による統合失調症の遺伝的リスクと片頭痛の逆相関。
Eur. Neuropsychopharmacol. 2016; 26: 1507-1515
論文で見る
スコープス (12)
PubMed
クロス
グーグル奨学生
ムスタファ A.K.
他
セリンラセマーゼ欠失は脳虚血と興奮毒性を予防する。
J. Neurosci. 2010; 30: 1413-1416
論文で見る
スコパス (87)
パブコメ
クロス
グーグル奨学生
ペレス E.J.
他
外傷性脳損傷後のシナプス障害にはアストロサイトのd-セリンの増加が関与している。
J. Clin. Invest. 2017; 127: 3114-3125
論文で見る
スコープス (78)
PubMed
クロス
グーグル奨学生
リラズ-ザルツマンS.
et al.
脳d-セリンの増強は外傷性脳損傷後の認知機能の回復を媒介する。
J. Neurotrauma. 2018; 35: 1667-1680
論文で見る
スコープス (13)
PubMed
クロス
グーグル奨学生
笹部淳一.
他
D-アミノ酸オキシダーゼはD-セリンを介して運動ニューロンの変性を制御する。
Proc. Natl. Acad. Sci. U. S. A. 2012; 109: 627-632
論文で見る
スコパス (164)
パブコメ
クロス
グーグル奨学生
Kondori N.R.
他
ALSに関連するD-アミノ酸オキシダーゼ変異のin vivo発現による病態の特徴:表現型と脊髄運動ニューロンの消失。
PLoS One. 2017; 12: 1-22
論文で見る
スコープス (9)
クロスリファレンス
グーグル奨学生
Mehta P.R.
et al.
家族性筋萎縮性側索硬化症における発症年齢の若さは、確認バイアスではなく、病原遺伝子変異の結果である。
J. Neurol. Neurosurg. Psychiatry. 2019; 90: 268-271
論文で見る
スコープス (24)
PubMed
クロス
グーグル奨学生
パディ A.K.
ハズラ S.
筋萎縮性側索硬化症におけるd-アミノ酸オキシダーゼ変異の役割に関する洞察。
J. Cell. Biochem. 2019; 120: 2180-2197
論文で見る
スコープス (8)
PubMed
クロス
グーグル奨学生
チルリ E.T.
et al.
筋萎縮性側索硬化症におけるエクソーム配列決定により、リスク遺伝子とパスウェイが同定された。
Science. 2015; 347: 1436-1441
論文で見る
PubMed
クロスフィル
グーグル奨学生
マルティネス F.J.
他
神経系における正常およびALS変異型HNRNPA2B1によって制御されるタンパク質-RNAネットワーク。
Neuron. 2016; 92: 780-795
論文で見る
スコープス (0)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Yadav S.
et al.
化学遺伝子導入マウスにおける神経血管酸化ストレスによる感覚失調と心肥大。
Nat. Commun. 2023; 14: 3094
論文で見る
(0件)
パブコメ
クロス
グーグル奨学生
アリ Z.
et al.
ホモ接合性GRID2ミスセンス変異は、GluD2のD-セリン結合ドメインのシフトを予測する。
BMC Med. Genet. 2017; 18: 144
論文で見る
スコープス (17)
PubMed
クロス
グーグル奨学生
Wang H.
他。
成人フリードライヒ失調症患者を対象としたルバダキシスタットの無作為二重盲検試験の結果。
Ann. Clin. Transl. Neurol. 2021; 8: 1343-1352
論文で見る
スコープス (5)
PubMed
クロス
グーグル奨学生
Piubelli L.
他
血清d-セリンレベルはアルツハイマー病の初期段階で変化する:早期のバイオマーカーに向けて。
Transl. Psychiatry. 2021; 11: 77
論文で見る
スコパス (29)
PubMed
クロス
グーグル奨学生
Chang C.H.
他
アルツハイマー病患者における脳脊髄液および血清d-セリン濃度:系統的レビューおよびメタ解析。
J. Clin. Med. 2020; 9: 3840
論文で見る
スコープス (9)
パブコメ
クロス
グーグル奨学生
Liu M.
et al.
血清中のキラルアミノ酸プロファイリングからアルツハイマー病の潜在的バイオマーカーが明らかになった。
J. Alzheimers Dis. 2023; 94: 291-301
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
Lin C.H.
他
D-グルタミン酸、D-セリン、D-アラニンはアルツハイマー病または軽度認知障害患者の認知機能低下における役割が異なる。
Pharmacol. Biochem. Behav. 2019; 185172760
論文で見る
スコープス (43)
PubMed
クロス
グーグル奨学生
Ni X.
森博之
AD脳におけるD-セリンレベルのダイナミックな変化の背後にある複雑なプロセス。
Curr. Alzheimer Res. 2022; 19: 485-493
論文で見る
スコープス (3)
PubMed
クロス
グーグル奨学生
マフィオーリ E.
他
ヒト海馬におけるアルツハイマー病の性特異的特徴としてのインスリンとセリン代謝。
Cell Rep.
論文で見る
スコパス (11)
PubMed
要旨
全文
全文PDF
グーグル奨学生
Zhou M.
et al.
小血管脳卒中とアルツハイマー病に対するインスリン抵抗性の因果関係:メンデルランダム化解析。
Eur. J. Neurol. 2022; 29: 698-706
論文で見る
スコープス (5)
PubMed
クロス
グーグル奨学生
Suwandhi L.
他
慢性的なD-セリン補給はインスリン分泌を障害する。
Mol. Metab. 2018; 16: 191-202
論文で見る
スコープス (23)
PubMed
クロス
グーグル奨学生
バル D.T.
et al.
アルツハイマー病における神経毒性アストロサイトのD-セリン合成酵素セリンラセマーゼ発現。
Neurobiol. Dis. 2019; 130104511
論文で見る
スコープス (43)
PubMed
クロス
グーグル奨学生
Ni X.
et al.
雄性AppNL-G-F/NL-G-Fマウスにおけるアルツハイマー病病態へのD-セリンの局所的寄与。
Front. Aging Neurosci. 2023; 151211067
論文で見る
スコープス (0)
クロス
グーグル奨学生
Lin C.H.
et al.
認知機能の老化を反映するD-アミノ酸オキシダーゼとD-アミノ酸の血中濃度。
Sci. Rep. 2017; 7: 14849
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
リン C.H.
レーン H.Y.
軽度認知障害者の血中D-アミノ酸オキシダーゼ濃度は認知機能の低下とともに上昇した:2年間の前向き研究。
Int. J. Neuropsychopharmacol. 2022; 25: 660-665
論文で見る
スコープス (6)
PubMed
クロス
グーグル奨学生
ベレス J.I.
他
DAOA の変異がPSEN1 E280A アルツハイマー病の発症年齢を修飾する。
Neural Plast. 2016; 20169760314
論文で見る
スコープス (22)
PubMed
クロス
グーグル奨学生
Lin C.H.
et al.
pLG72レベルはアルツハイマー病の初期には増加するが、後期には減少する。
Sci. Rep. 2019; 9: 13221
論文で見る
スコープス (11)
PubMed
クロス
グーグル奨学生
ディ・マイオ A.
他
セリンエナンチオマーのホメオスタシスは、死後のパーキンソン病患者の尾状被蓋と脳脊髄液において破綻している。
Neurobiol. Dis. 2023; 184106203
論文で見る
スコパス(3)
クロスリファレンス
グーグル奨学生
ヌッツォ T.
et al.
NMDA受容体コアゴニストであるD-セリンの濃度は、MPTP病変を有するサルの黒質およびパーキンソン病患者の脳脊髄液において低下している。
Sci. Rep. 2019; 9: 8898
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
エル・アルファーニ A.
他
パーキンソン病モデルラットにおける運動皮質および線条体のグルタミン酸作動性システムとd-セリンレベルの変化。
Neurochem. Int. 2015; 88: 88-96
論文で見る
スコープス (22)
PubMed
クロス
グーグル奨学生
ニッケルズ S.L.
et al.
セリン代謝障害は、PD患者におけるLRRK2-G2019Sの病原性を補完する。
Park. Relat. Disord. 2019; 67: 48-55
論文で見る
スコープス (0)
パブコメ
要旨
全文
全文PDF
グーグル奨学生
ローザ V.
et al.
D-アスパラギン酸によるミエリン損傷の抑制とミエリン修復の促進。
EMBO Mol. Med. 2019; 11e9278
論文で見る
グーグル・スカラー
ウォロスカー H.
d-セリンシグナル伝達の神経生物学。
Adv. Pharmacol. 2018; 82: 325-348
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
Ito T.
et al.
セリンラセマーゼはD-アスパラギン酸の生合成に関与する。
J. Biochem. 2016; 160: 345-353
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
権田恭子
他
アストロサイトd-アミノ酸オキシダーゼは後脳でd-セリンを分解する。
FEBS Lett.
論文で見る
筑波大学
PubMed
クロス
グーグル奨学生
ノタランジェロ F.M.
他
マウスにおけるD-トリプトファンからのキヌレニン経路代謝物の産生におけるD-アミノ酸オキシダーゼの役割。
J. Neurochem. 2016; 136: 804-814
論文で見る
スコープス (13)
PubMed
クロス
グーグル奨学生
セハトプールP.
他
統合失調症における神経可塑性に基づく聴覚学習の用量依存的増強:NMDAグルタミン酸受容体作動薬d-セリンの二重盲検プラセボ対照無作為化標的関与臨床試験。
Biol. Biol. 2023; 94: 164-173
論文で見る
(0件)
パブコメ
要旨
全文
全文PDF
グーグル奨学生
レーン H.Y.
他
統合失調症に対する安息香酸塩の上乗せ治療:D-アミノ酸オキシダーゼ阻害薬の無作為二重盲検プラセボ対照試験。
JAMA Psychiatry. 2013; 70: 1267-1275
論文で見る
スコープス (174)
PubMed
クロス
グーグル奨学生
レーン H.Y.
他
内因性抗酸化物質が予後を予測し、治療後に増加した:アルツハイマー病に対する安息香酸塩の用量探索、無作為化、二重盲検、プラセボ対照試験。
Psychiatry Clin. Psychiatry Clin. 2023; 77: 102-109
論文で見る
スコープス (6)
PubMed
クロス
グーグル奨学生
Szilágyi B.
et al.
開蓋型D-アミノ酸オキシダーゼ阻害剤の合成と生化学的評価。
Molecules. 2019; 24: 290
論文で見る
スコープス (0)
PubMed
クロス
グーグル奨学生
オドネル P.
et al.
D-アミノ酸オキシダーゼ阻害薬luvadaxistatは無作為化試験において統合失調症患者のミスマッチ陰性度を改善した。
Neuropsychopharmacology. 2023; 48: 1052-1059
論文で見る
スコープス (6)
PubMed
クロス
グーグル奨学生
Koulouris C.R.
他
ヒト由来セリンラセマーゼの小ドメインの構造柔軟性
Acta Crystallogr. Sect. F Struct. Biol. Commun. 2020; 76: 65-73
論文で見る
スコープス (3)
PubMed
クロス
グーグル奨学生
ラモス・デ・ディオス S.M.
他
ヒト由来セリンラセマーゼ(hSR)の13C/2H-同位体クロストークNMRアッセイにより、PLP-酵素の「パーティショニングフィンガープリント」が得られ、hSR阻害のケモタイプが明らかになった。
J. Am. Chem. Soc. 2023; 145: 3158-3174
論文で見る
スコープス (3)
PubMed
クロス
グーグル奨学生
Sacchi S.
他
オランザピンは、D-アスパラギン酸オキシダーゼ活性を阻害することにより、自由に動くマウスの前頭前野におけるグルタミン酸放出を増加させる。
Sci. Rep. 2017; 7: 46288
論文で見る
スコパス (38)
PubMed
クロス
グーグル奨学生
Katane M.
et al.
in-silicoスクリーニングによる新規D-アスパラギン酸オキシダーゼ阻害剤の同定とin vitroでの機能・構造解析.
J. Med. Chem. 2015; 58: 7328-7340
論文で見る
スコープス (17)
PubMed
クロス
グーグル奨学生
Mikou A.
他
Asc-1トランスポーター(SLC7A10):ホモロジーモデルと分子動力学法による輸送機構の第一段階への洞察。
Sci. Rep. 2020; 10: 3731
論文で見る
スコープス (8)
PubMed
クロス
グーグル奨学生
Ndaru E.
他
ヒドロキシホモセリンエステルを用いたアラニン・セリン・システイン・トランスポーター(ASCT)基質結合部位の特性のプローブ。
J. Phys. Org. Chem. 2022; 35e4347
論文で見る
スコープス (0)
パブコメ
クロス
グーグル奨学生
用語集
エクソーム研究
エクソーム研究とは、分子生物学的手法であるエクソームシークエンシングを用いて、あるゲノムからタンパク質をコードする遺伝子のみを同定する研究である。ヒトゲノムのうちタンパク質をコードしているのはごく一部であるため、全ゲノムシーケンスよりも迅速かつ安価な手法である。
ゲノムワイド関連研究(GWAS)
集団における遺伝的領域(遺伝子座)と形質(疾患を含む)との関連を同定するための無仮説手法。
GluD(またはGluRδ)受容体
イオン性グルタミン酸ゲート受容体(iGluR)のサブクラスで、小脳に多く存在するが、大脳皮質、海馬、線条体、視床、間脳、網膜を含むマウスの複数の脳領域にも低レベルながら存在する。これらの受容体はシナプスの維持とシナプス可塑性を制御している。
N-メチル-D-アスパラギン酸(NMDA)受容体(NMDARs)
グルタミン酸ゲート型イオノトロピック受容体(iGluR)のサブクラスで、シナプスの形成と様々なシナプス可塑性の誘導に重要な役割を果たす。これらの受容体は相同なサブユニットが結合してヘテロ四量体を形成する。7つのサブユニットが同定されており、3つのサブファミリーに分類される: GluN1、GluN2A-D、GluN3A-Bである。ネイティブNMDARは、2つのGluN1と2つの同一のGluN2(またはGluN3)を含むジヘテロマー、または2つのGluN1と2つの異なるGluN2(またはGluN2とGluN3の組み合わせ)を含むトリヘテロマーである。二異性体(GluN1/GluN3受容体を除く)または三異性体NMDARの活性化には、GluN2サブユニット上のグルタミン酸の結合と、GluN1サブユニット上のコアゴニスト、d-Serまたはグリシンの結合が必要である。
一塩基多型(SNP)
ある種の個体間におけるゲノムの一塩基対の変異。SNPはしばしば、個体間や集団間の薬物代謝や疾患感受性の違いに関連する。
シナプス可塑性
化学シナプスが特定のパターンに従って、時間とともにその活動を強めたり弱めたりし、その構造や生化学を適応させる能力。シナプス可塑性は学習と記憶に寄与すると考えられている。このような変化には、シナプス前とシナプス後の両方のメカニズムが関与している。
論文情報
出版履歴
オンライン公開 2023年9月26日
識別
DOI: https://doi.org/10.1016/j.molmed.2023.09.001
著作権
© 2023 Elsevier Ltd. 無断複写・転載を禁じます。
サイエンスダイレクト
ScienceDirectでこの記事にアクセスする
図
図1
図1脳内d-アミノ酸(d-AAs)の時間的・空間的マッピング。
図2
図2脳内d-アミノ酸(d-AAs)の輸送と代謝。
図3
図3重要な図。脳d-アミノ酸(d-AAs)の生理学的および病理学的ランドスケープ。
関連記事
広告
ライフ&メディカルサイエンスジャーナル
細胞
癌細胞
細胞化学生物学
細胞ゲノム学
細胞宿主と微生物
細胞代謝
細胞レポート
セルレポーツ医学
細胞幹細胞
細胞システム
カレントバイオロジー
発生細胞
免疫
医学
分子細胞
ニューロン
構造
アメリカン・ジャーナル・オブ・ヒューマン・ジェネティクス (パートナー)
生物物理学雑誌 (パートナー)
生物物理レポート (パートナー)
Human Genetics and Genomics Advances (パートナー)
分子植物 (パートナー)
分子療法 (パートナー)
分子治療法と臨床開発 (パートナー)
分子療法核酸 (パートナー)
分子療法腫瘍学 (パートナー)
Plant Communications (パートナー)
幹細胞レポート (パートナー)
生化学の動向
癌の動向
細胞生物学の動向
生態学と進化の動向
内分泌学・代謝学の動向
遺伝学の動向
免疫学の動向
微生物学の動向
分子医学の動向
神経科学の動向
寄生虫学の動向
薬理学の動向
植物科学の動向
物理科学・工学ジャーナル
セルレポート 物理科学
化学
化学触媒
デバイス
ジュール
物質
化学の動向
学際ジャーナル
セルリポーツ・メソッド
セルリポーツ・サステイナビリティ
Heliyon
アイサイエンス
ワン・アース
パターン
STARプロトコル
ネクサス(パートナー)
イノベーション(パートナー)
バイオテクノロジーの動向
認知科学の動向
著者
論文投稿
複数ジャーナル投稿
STARメソッド
プレビュー - プレプリント
査読者
査読者向け情報
ニュース&イベント
ニュースルーム
細胞シンポジウム
コンソーシアムハブ
ウェビナー
ラボリンク
マルチメディア
セルプレスポッドキャスト
セルプレスビデオ
カラーリングとコミック
フィギュア360
セル画ショー
研究篇
セルプレスについて
セルプレスについて
オープンアクセス
COVIDハブ
持続可能性
インクルージョンと多様性
コンタクト
お問い合わせ
ヘルプ&サポート
採用情報
セルプレス採用情報
サイエンティフィックジョブボード
アクセス
登録する
請求
今すぐ読む
司書に推薦する
出版アラート
コレクション
ベスト・オブ・セルプレス
セルプレスレビュー
セルプレスセレクション
Nucleusコレクション
スナップショット・アーカイブ
インフォメーション
広告主の皆様へ
リクルーターの方へ
図書館員の方へ
プライバシーポリシー
ご利用条件
アクセシビリティ
本サイトのコンテンツは、あらゆる分野の医療従事者および研究者を対象としています。
当サイトでは、サービスの提供・向上やコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
このサイトのすべてのコンテンツ: 著作権 © 2023 Elsevier Inc.
テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビア社に帰属します。
すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
プライバシーポリシー 利用規約 アクセシビリティ ヘルプ&サポート お問い合わせ
RELX
この記事が気に入ったらサポートをしてみませんか?
