腸内細菌病原体による自然リンパ球の変調
47総閲覧数
5ダウンロード
記事のインパクトを見る
ミニレビュー論文
Front. 免疫学、2023年7月6日
微生物免疫学
第14巻-2023年|https://doi.org/10.3389/fimmu.2023.1219072
腸内細菌病原体による自然リンパ球の変調

プラカシュ・サー、ローレン・A・ゼネヴィッチ*。
オクラホマ大学健康科学センター医学部微生物学・免疫学教室、オクラホマシティ、OK, アメリカ合衆国
自然リンパ球(ILC)は、組織の恒常性、炎症、感染に対する免疫の重要な調節因子である。ILCはサイトカイン、微生物叢、侵入病原体などの環境的な合図に素早く反応し、その機能と表現型を制御する。ILCはまれな細胞であるが、消化管などのバリア表面に豊富に存在し、病原体を排除する宿主の免疫反応にしばしば重要な役割を果たす。宿主と病原体の相互作用の一方で、病原性細菌はこれらの免疫応答を調節する手段も持っている。免疫細胞の操作や回避は、多くの場合、病原体に有利に、あるいは競合する微生物叢に不利に働く。病原体がどのように免疫を調節しているかに、特定の病原因子や毒素が関与している場合もある。本総説では、腸内細菌感染症における非細胞毒性ILCの役割、これらの病原体がどのように免疫応答を調節するのか、そしてこれらが感染症と闘う新たな治療法の開発にどのような意味を持つのかについて、最近の進歩を踏まえて考察する。
はじめに
自然リンパ球(ILC)は、主に組織に常在し、しばしば粘膜組織に存在する稀なリンパ球である。特異的抗原レセプターを持たないILCは、主にサイトカインによって活性化され、感染症に迅速に反応する。ILCは、いくつかの表現型と機能的特徴を共有することから、T細胞の生得的な対応物である(1)。ILCは4つの異なるサブセットに分類される: NK細胞、ILC1s、ILC2s、ILC3sであり、系統特異的転写因子(TF)、表面マーカー、エフェクター機能の発現に基づいている(2, 3)。NK細胞は何十年も前からよく認識され、研究されてきたので、ここではILCに焦点を当てることにする。ILC1はT-betを発現し、しばしばIFNγの産生を介して細胞内病原体から防御するが、一般に細胞傷害性はない(4)。ILC2は系統を規定するTF GATA3を発現し、2型サイトカインであるIL-5とIL-13を産生し、IL-4とIL-9の産生量は少ない。ILC2は、蠕虫やアレルゲンに対する免疫応答を仲介する鍵となることが多い(5)。ILC3の発達はTF RORγtに依存し、これらの細胞はIL-22を産生し、組織バリア機能を維持し、細胞外病原体から身を守る(5, 6)。さらに、ILCは細胞可塑性を持ち、サイトカインおよび/または環境環境に応じて他のILCサブタイプに分化することができる(3-5)。
消化管のような粘膜表面には、正常な微生物叢の一部として何十億もの微生物が生息しており、細菌性病原体に対する防御の第一線となっている。それにもかかわらず、多くの病原体が粘膜表面から宿主に侵入し、感染を引き起こす。免疫系は微生物叢との恒常性を維持しながら、病原体に対する抵抗力を提供するように進化してきた。ILCは粘膜表面に豊富に存在し、侵入してくる病原体に対する初期防御を組織している。ILC3は細胞外細菌感染に応答するILCであると考えられているが、ILC1とILC2もこれらの病原体に対する免疫応答に貢献することができる。病原体と闘うために研ぎ澄まされた免疫応答があっても、宿主の免疫応答が完璧でない場合がある。腸内細菌は、宿主細胞を標的とする多くの毒素やその他のエフェクター分子を産生し、アポトーシスを引き起こしたり、シグナル伝達経路を妨害したりする。
最近の研究では、感染時のILCの役割と、病原性細菌によるILC機能の調節が強調されている。感染性には病原性因子が必要であり、他の免疫細胞ではなくILCを特異的に標的とするツールには限界があるため、in vivoモデルでILCに対する病原性因子の正確な役割を検証することは困難であるが、さまざまな消化管(GI)細菌感染に対してILCがどのように応答するか、また病原体がこの応答にどのような影響を及ぼすかについては、多くのことが明らかにされている(図1)。ここでは、腸内細菌病原体による非細胞傷害性ILC機能の調節と、それがどのように病原体の発生や病原体に対する防御に関与しているのかについて、この分野の現状を紹介する。
図1
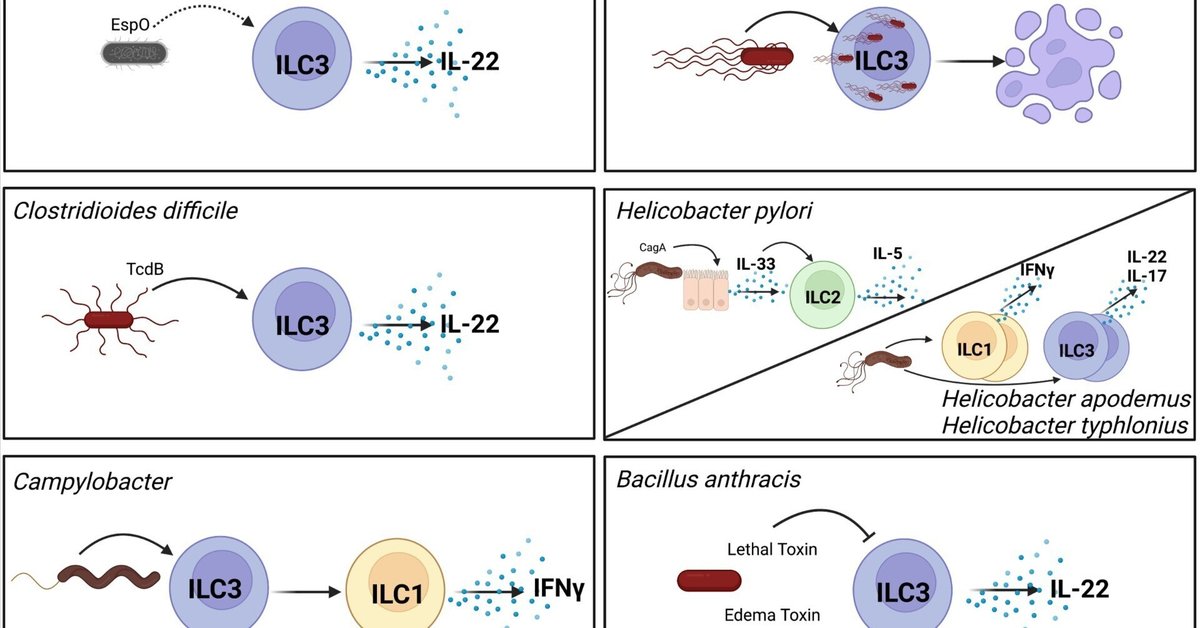
図1 病原性細菌はさまざまなメカニズムでILC機能を調節する。Citrobacter rodentiumは、間接的にILC3の活性化と分泌型IL-22の産生に寄与するEspOを産生する(7)。細胞内病原体であるサルモネラはILC3に侵入し、パイロプトーシスを誘導して消化管内の数を減少させる(8)。Clostridioides difficileが産生するトキシンB(TcdB)はILC3を直接活性化し、IL-22を産生させる(9)。ヘリコバクター・ピロリは、CagA依存的にIL-33を産生するように上皮細胞を活性化する。このIL-33は胃のILC2を活性化し、IL-5を産生させる(10, 11)。胃以外のヘリコバクター種は、サイトカインを産生するILC1とILC3の頻度を増加させる(12)。カンピロバクター感染は、IFNγを産生するILC3からILC1への転換を誘導する(13)。炭疽菌はILC3に対して相反する作用を持つ2つの毒素を分泌する。致死毒素はMAPKシグナルを阻害し、ILC3の活性化を阻害する(14)。対照的に、浮腫毒素はILC3を直接活性化してIL-22を産生させる(15)。直接的な相互作用を実線の矢印で、間接的な相互作用を破線の矢印で示す。BioRender.comで作成。
細菌病原体によるILC機能の調節
ネズミチフス菌
C. rodentiumはネズミのグラム陰性病原体で、ヒトの病原体である腸管病原性大腸菌(EPEC)のモデルとして広く用いられている(16)。EPECと同様、C. rodentiumは3型分泌系(T3SS)を介してエフェクターを腸管上皮細胞に分泌し、宿主細胞のプロセスを調節して感染を成立させる(17)。C. rodentium感染モデルの有用性は、細菌の病原性研究にとどまらず、粘膜免疫の基本的な側面を明らかにすることにまで及んでいる(18)。C. rodentiumに感染すると、感染初期と後期において、それぞれ病原体の制御とクリアランスに重要な自然免疫応答と適応免疫応答の両方が惹起される。ILC3はC. rodentiumの初期制御において重要な免疫細胞である(19-22)。感染後、マクロファージと樹状細胞(DC)は細菌の病原体関連分子パターン(PAMPs)によって活性化され、IL-23やIL-1βなどの炎症性サイトカインを分泌してILC3を活性化する(23-27)。活性化されると、ILC3はC. rodentium感染の制御に重要なサイトカインであるIL-22を速やかに産生する(5, 19, 28)。ILC3は感染初期におけるIL-22の主要な供給源であり(21, 29)、このサイトカインは抗菌ペプチドとムチンの産生をアップレギュレートし、腸管バリア抵抗性を促進する(19, 28)。
C. rodentiumのT3SSエフェクターは自然免疫応答を調節する(18)。C. rodentiumがILC3と直接相互作用するかどうかは不明である。しかし、最近の研究で、T3SSエフェクターEspOがIL-22シグナル伝達を調節することが示された(7)。この研究では、EspOを欠損したC. rodentiumに感染すると、大腸摘出片からのIL-22分泌が減少し、それに伴って抗菌ペプチドも減少することが報告されているが、IL-22を産生するILC3やT細胞の頻度に変化は認められなかった(7)。C. rodentiumのエフェクターがなぜIL-22をアップレギュレートするのかは不明である。他の病原体によるIL-22の調節は、コロニー形成を促進することが知られているが(30)、C. rodentiumの場合、IL-22はC. rodentium感染において保護的であることがよく説明されているので(19)、これは考えにくい。C. rodentiumは腸管上皮細胞(IEC)の代謝を調節することも知られている(18)。T3SSのエフェクターであるMapとEspFはミトコンドリアの破壊を引き起こし、IECの代謝を好気的解糖へと移行させ、C. rodentiumのコロニー形成をサポートする腸粘膜の酸素供給を増加させる(31-33)。ILC3の機能を制御する低酸素の役割を考えると(34)、C. rodentium T3SSエフェクターによる腸管の酸素化亢進がILC3を調節するかどうかが問題となる。最後に、C. rodentiumに感染すると、ILC3の代謝が変化し、増殖とサイトカイン産生が促進される(35)。これらの「訓練されたILC3」は「自然記憶」の特性を示し、マウスではナイーブなILC3よりも再感染を制御するのに優れている(35)。まとめると、ネズミインフルエンザ菌感染は、病原体とILCの相互作用について多くを学ぶための貴重なモデルである。
サルモネラ
サルモネラ腸炎菌は、消化器感染症を引き起こすいくつかの血清群を含んでいる(36, 37)。発展途上国では、腸チフス型のS. TyphiとS. Paratyphiが腸熱を引き起こす。S. Enterica serovar Typhimurium(S.Typhimurium)などの非チフス性血清株は、食品を媒介とする胃腸炎を引き起こし、通常は自己限定性であるが、播種感染を引き起こすことがある(36)。S. Typhimuriumは最も広く研究されている血清群で、ここで概説する知見もこの血清群に関するものである。他の多くのグラム陰性消化管病原体と同様に、S. TyphimuriumはT3SSをコードしており、サルモネラ菌では2つのT3SS系が別々に存在し、病原性因子の数々を分泌する(37)。
インターフェロン-γ(IFNγ)は、サルモネラ感染に対する防御において重要なサイトカインである(38-41)。サルモネラGI感染時のIFNγの主な自然発生源は、RORγtレベルが低下しているNKp46+ T-bet+ ILCである(41)。感染時のこれらのILCによるIFNγ産生はIL-12によって駆動されるが、IL-23は有意な影響を及ぼさない(41)。ILCは主に組織常在細胞であるが、Kasteleらはサルモネラ感染により腸間膜リンパ節の遊走性RORγt+ T-bet+ILC集団が増加し、IFNγ産生に寄与することを示した(42)。IFNγ産生細胞の同定をさらに精緻化した結果、ILC1による有意なIFNγ産生は示されたが、ILC3による産生は示されなかった(8)。IFNγはサルモネラ感染時のムチン産生を制御し、ムチンMUC2の欠損はマウスモデルにおける感染感受性を増加させる(39, 43)。これと同様に、ILCの枯渇やILCによるIFNγ産生の遺伝的欠損は、粘液産生を障害する(41)。さらに、ILCによるIFNγ産生を阻害すると炎症が抑制されることから、IFNγ産生ILCも腸の炎症に寄与している(41)。これらの研究から、サルモネラ感染によって誘導されるILCによるIFNγ産生は、防御的であると同時に病理学的でもあり得ることが示唆される。
IL-22はサルモネラ感染時に発現が上昇する(44)。IL-22とリンパ毒素αの産生を介したILC3は、in vitroでIECのフコシル化を媒介する(45)。In vivoでは、ILC3がサルモネラ感染時のフコシル化を媒介し、腸管フコシル化欠損マウスは感染しやすくなる(45)。その後の研究で、IL-22はサルモネラ感染を防御しないことが報告されている。実際、IL-22の増加は、微生物叢と競合する能力を向上させることにより、サルモネラ菌の感染を促進する(30, 46)。これは、IL-22によって誘導される抗菌ペプチドに対する耐性に起因している(30、47、48)。これらの観察と同様に、最近の研究では、サルモネラが感染時にILC3においてIL-22を誘導し、感染を促進することがわかった(8)。フラジェリンは抗原提示細胞を活性化してIL-23を産生させ、これがILC3を活性化した。さらに、サルモネラはILC3に直接侵入し、フラジェリン非依存的にカパーゼ-1を介したILC3のパイロプトーシスを引き起こす。ILC3の枯渇は、サルモネラ感染マウスの死亡率の低下と疾患の重症度の軽減につながる(8)。このように、サルモネラに誘導されたILC3のパイロプトーシスは、細菌を利する初期誘導後の自然IL-22産生を制限することで、サルモネラに対する宿主防御機構の可能性がある(8)。しかし、ILC3のパイロプトーシスを誘導する正確なシグナルは、依然として不明である。細胞死を制御することによるILC3の細菌制御のこの例は、他の消化管病原体にも関連することが証明されるかもしれない細菌防御機構である。
ディフィシル菌
C.difficile大腸炎は、広域抗生物質の使用により微生物叢が乱れた患者に起こる最も一般的な院内消化管感染症である(49)。C. difficile株は3つの異なる毒素、すなわち毒素A(TcdA)、毒素B(TcdB)、C. difficileトランスフェラーゼ(CDT)をコードしている(50)。これらの毒素の複合作用により、消化管上皮における宿主の細胞骨格が破壊され、最終的には上皮の完全性が失われる。毒素が介在する炎症は、軽度の下痢から偽膜性大腸炎までの症状を引き起こす(50)。
C. difficile感染症(CDI)におけるILCの役割については、いくつかの研究で報告されている(51-53)。Nfil3-/-マウスは、転写制御因子である核内因子インターロイキン3制御因子(NFIL3)の欠失により、ILCの成熟における発育障害のためにILCの数が減少しており、CDIに非常に罹患しやすい(54)。さらに、適応免疫細胞とILCの両方を欠損したRag2-/-γc-/-マウスは、適応免疫細胞のみを欠損したRAG欠損マウスや野生型マウスに比べてCDI後の死亡率が高い(51)。CDI後、Rag1-/-マウスではIFNγが増加し、ILC1またはILC1由来のIFNγの選択的欠損により、疾患の重症度と死亡率が増加する(51)。同じ研究では、CDI後のIL-22やIL-17のようなILC3関連サイトカインの増加も報告している。しかし、ILC3やILC3関連サイトカインIL-22の選択的欠損は、少なくとも適応免疫応答がない場合には、CDIの回復にわずかな効果しか示さなかった(51)。これとは対照的に、長谷川らはIL-22欠損マウスではCDI後の死亡率が増加することを報告している。IL-22の欠損は、C. difficileの感染負荷と腸管障害を変化させなかったが、IL-22は補体系を制御することによって、腸管障害後に移行した病原体のクリアランスに重要であった(55)。これらの研究を総合すると、ILC3およびIL-22は、CDIに対する初期の防御においてILC1がより重要であるのに対して、病原体の転移してくるのを防ぐことによって、感染の後期においてより重要であると考えられる。CDIにおけるILC3および/またはIL-22の防御的役割は、他の研究によってさらに確認されている(34, 53, 56, 57)。
ILC2は、蠕虫感染に対する免疫と消化管におけるアレルギー反応において重要な役割を担っている(5)。しかし、これらの細胞は最近、C. difficileを含む細菌感染においても重要であることが示されている(52)。ILC2sの活性化因子であるIL-33は、感染マウスの糞便組織においてCDI時に発現が上昇することが見いだされた。IL-33はILC2sを活性化することによってCDIを予防した(52)。IL-33によって活性化されたILC2sは杯細胞によるムチン産生を増加させ、上皮のバリア機能を改善するとともに、CDI時に保護作用を示す結腸内の好酸球数を増加させた(52, 58, 59)。
様々なILCサブセットの役割はCDIとの関連で研究されているが、C. difficileやその毒素がILCと直接相互作用するかどうかはまだ十分に定義されていない。最近、我々はTcdBがin vitroでILC3を直接活性化し、IL-22や他のエフェクター分子を誘導することを報告した(9)。TcdBを介したILC3の活性化には毒素の酵素活性が必要であり、small GTPase CDC42の不活性化が一部介在していた(9)。遺伝子発現解析から、毒素を介したILC3の活性化はIL-1βを介した活性化とは異なることが明らかになった(9)。C.ディフィシル感染時のIL-22の防御効果を考えると、毒素を介したILC3の活性化は意外に思われる。IL-22は微生物叢を形成し、病原体が資源を奪い合う他の種よりもC. difficileを好むようにするのかもしれない。この観察と毒素によって活性化されたILC3の機能のin vivoでの検証は、まだ決定されていない。
ヘリコバクター属
ヘリコバクター・ピロリ(Helicobacter pylori)は、世界人口の半数に感染している非常に蔓延したグラム陰性病原体である(60)。胃炎を引き起こし、胃腺癌の最も強い危険因子である(61)。ピロリ菌の主要な病原因子は、細胞毒素関連遺伝子A産物(CagA)を含む4型分泌系(T4SS)エフェクターである(61)。ILC2は胃における優勢なILC集団であり、ピロリ菌感染時にその数が増加する(62, 63)。IL-33はCagAをコードする菌株を持つ患者やピロリ菌感染マウスの胃粘膜で増加している。In vitroでCagAは胃上皮細胞によるIL-33産生を誘導し、ILC2の活性化とIL-5産生を引き起こす(10, 11)。同様に、ピロリ菌感染患者の胃粘膜ではIL7 mRNAレベルの上昇が認められる(64)。胃では、ILC2の蓄積と活性化はそれぞれIL-7とIL-33に依存している(63)。ILC2はB細胞と協調してピロリ菌特異的IgAを産生し、マウスモデルで胃の細菌をコートすることができる(63)。
H.アポデムスやH.チフロニウスのような胃以外のヘリコバクター種は、ピロリ菌とは異なる影響をILCに与える(12)。T細胞およびB細胞を欠損したマウスでは、これら2種のヘリコバクターが消化管にコロニー形成されると、IL-22および/またはIL-17産生ILC3とIFNγ産生ILC1の頻度が増加してILCが活性化され、消化管炎症が引き起こされる。しかし、感染するとILC3の数が減少し、特にT-betを発現するILC3が減少する(12)。これらのヘリコバクター属細菌がどのようにしてILC3数の減少を引き起こすかは、まだ不明である。ILC3の減少は適応免疫細胞を欠損したマウスでのみ観察され、野生型マウスでは観察されなかったことから、ヘリコバクターがコロニー形成している間、適応免疫がILC3を維持できることが示唆される。
カンピロバクター
主にC. jejuniとC. coliであるカンピロバクター種は、食品媒介性胃腸炎の一種の原因菌である(65)。これらのグラム陰性菌感染症はほとんどが自己免疫性であるが、長期にわたる免疫関連の腸機能障害がカンピロバクター感染症に関連している(66, 67)。IL-10シグナル伝達の欠如により腸炎を起こしやすいマウスモデルを用いて、カンピロバクター感染時のILCの役割を調べた研究がいくつかある(13, 68, 69)。ILC3の主要な活性化因子であるIL-23は、カンピロバクター感染時の炎症の主要な促進因子である(69)。Jingらは、IL-23がカンピロバクター感染時のILC1およびILC3によるIFNγ、IL-17、IL-22の産生を制御することを見出した(69)。これまでの研究と一致して、IFN-γとIL-17は炎症を促進したが、IL-22はカンピロバクター感染時の炎症には必要ないことがわかった(69)。このことは、IL-10シグナル伝達が無傷であったカンピロバクター感染モデルマウスにおいてIL-22が防御的であったという別の研究(70)とは対照的である。
カンピロバクター感染では、マウスのILCとT細胞サブセットの両方からIFNγ、IL-17、IL-22の産生が誘導される(68)。同様の観察結果は、ex vivoヒト腸管感染モデルを用いて報告された(71)。IFNγとIL-17の両方が、カンピロバクター感染時に腸の炎症を促進することがわかった(68)。最近の2つの研究では、ILC由来のIFNγが感染時の腸管病態に寄与することが判明した(13, 69)。ILC1がIFNγの主要な供給源である一方、ILC3も転写因子T-betを発現することにより、IFN-γ産生ILC1に転換することができる(5, 41)。興味深いことに、カンピロバクター感染はILC3のILC1への転換を誘導し、これらの元ILC3は腸の炎症を促進するIFNγを産生する(13)。IL-12とIL-23はin vitroでILC3-ILC1の可塑性を促進することが示されており(72)、両サイトカインはカンピロバクター感染時に上昇する(13, 68)。カンピロバクター感染時のIL-12とIL-23レベルの調節異常が、ILC3からILC1への転換を促進すると推測される。しかし、カンピロバクターがILC3からILC1への転換を制御するメカニズムはまだ解明されていない。カンピロバクター属は宿主細胞を調節する多くの毒素を産生するが、最もよく研究されているのはC. jejuni由来の細胞膨張毒素(CDT)で、ILC機能を調節する可能性がある。これらの研究を総合すると、ILCはカンピロバクター感染時に腸の炎症を誘導し、病態を促進する主要な役割を担っていることがわかる。
炭疽菌
炭疽菌は炭疽の原因菌であり、肺、消化管、皮膚に感染するまれな感染症であるが致死的である(73)。グラム陽性炭疽菌の主要な病原因子は致死毒素(LT)と浮腫毒素(ET)である(73)。LTとETはともに自然免疫細胞と適応免疫細胞の免疫機能を抑制することができる(74-76)。炭疽毒素の免疫抑制作用と同様に、LTはマウスモデルにおいてin vitroでもin vivoでもILC3の活性化を抑制することができる(14)。亜鉛メタロプロテアーゼであるLTは、マイトジェン活性化プロテインキナーゼを切断し、細胞シグナル伝達を撹乱する(77)。LTは、MAPKシグナル伝達を不活性化することにより、IL-23で活性化されたILC3によるIL-22産生を減少させた(14)。対照的に、アデニルシクラーゼとしてのETは、ILC3の細胞内cAMPレベルを上昇させ、in vitroでの活性化につながる(15)。LT、ET、ILC3が生体内でどのように相互作用するかは、まだ明らかにされていない。炭疽菌感染マウスの大腸で、IL-22誘導抗菌ペプチド、REG3βとREG3γをコードするmRNAの抑制を発見した研究があるように(75)、LTによる抑制が、ETによるILC3の活性化を克服する可能性がある。ETの効果は用量依存的であり、毒素はT細胞の増殖を抑制したり、Th17の分化を促進したりする(76, 78)。したがって、ETがin vivoでILC3に対して抑制作用を発揮する可能性もある。本総説の焦点ではなく、まだ研究されていないが、これらの毒素は呼吸器疾患時に肺のILCを調節する可能性が高い。全体として、炭疽菌とその2大毒素はILC3の機能を調節する。
ILCと適応免疫系のクロストーク
ILCは主に粘膜表面に存在する組織常在細胞であるが、末梢血、骨髄、一次および二次リンパ器官にも存在する(79-81)。最近、移動性ILCが感染との関連で報告されている(42)。適応免疫応答が開始されるリンパ系臓器に存在することから、ILCが適応免疫の形成に関与していることが示唆される。実際、いくつかの研究で、適応免疫の制御におけるILCの役割が強調されている(総説(81, 82))。ILCは、T細胞およびB細胞を介した応答に直接的または間接的に影響を与えることができる(82, 83)。病原体に対する最初の反応因子の一つとして、ILCはサイトカインミリーに影響を及ぼし、その結果、適応免疫応答にも影響を及ぼす(82, 83)。ILC2やILC3は、MHCIIを発現して抗原提示細胞(APC)として働くことで、T細胞と直接相互作用することもできる(84-86)。ILCはまた、OX40L、ICOS/ICOSL、PD-L1(後者2つはILC2についてのみ報告されている)のような共刺激分子や補助分子を発現し、T細胞との直接的な相互作用を促進することで、適応免疫応答を調節することができる(87-91)。逆に、適応免疫系はILCの機能を調節することもできる。例えば、T細胞由来のIFNγはILC2の機能を直接制限し(92, 93)、制御性T細胞はILC2とILC3の応答を制御することができる(94-96)。T細胞はまた、MHCIIや上記の他の補助分子を介したILC2との直接的な相互作用を介して、ILC2応答を増強することができる(86, 97)。このように、ILCと適応免疫細胞との間のクロストークは、ILCの機能だけでなく、適応免疫を形成している。
健康な消化管では、ILC3はT細胞およびB細胞の応答を制御することにより、微生物叢に対する免疫応答を制御している。APCとして働くILC3はT細胞と相互作用し、微生物特異的T細胞のクローン性欠失をもたらす(85)。同様に、ILC3はAPCとしてTヘルパー濾胞細胞と相互作用し、微生物叢に対する免疫グロブリンA(IgA)応答を制御することができる(98)。ILC3はまた、腸におけるリンパ毒素シグナル伝達を介して間接的にIgAの産生をサポートすることができる(99)。ILC3におけるリンパ毒素αシグナル伝達を遮断すると、IgAの産生が阻害され、腸内細菌叢の組成が変化する(99)。腸内細菌感染時のILCクロストークに関する研究は非常に限られている。上述したように、ILC3はC. rodentiumのような腸内病原体に対する防御に重要である(21)。いくつかの研究では、C. rodentium感染におけるILCと適応免疫応答の時空間的相互作用を解析しており、ILCは感染初期に重要であり、適応応答は感染を除去するために後から作用する(100-102)。ILC3の代表的なサイトカインであるIL-22は、リンパ毒素シグナルの下流で作用することにより、げっ歯類菌感染時の大腸リンパ系構造の組織化と維持を制御している(103)。大腸リンパ系構造はT細胞やB細胞を含んでおり、したがって適応免疫応答の開始部位である。最近の研究では、サルモネラ感染によって腸管RORγt+ T-bet+ILCの腸間膜リンパ節への遊走が誘導され、これが防御的IFNγ応答に寄与することが示された(42)。これらの移動性ILCが全体的な適応免疫応答に寄与するかどうかは、まだ不明である。胃以外のヘリコバクター種によるコロニー形成中、適応免疫系はILC3数を維持する(12)。ILCの生物学的理解が進むにつれ、健康な定常状態におけるILCと適応免疫系の相互作用が明らかになってきた。しかし、腸管感染症におけるILCと適応免疫系の相互作用の特異的な性質を明らかにし、より良い治療法の開発を促進するためには、さらなる研究が必要である。
腸内細菌感染症の治療におけるILCの標的化
細菌性消化器疾患の標準治療は抗生物質である。しかし、抗生物質耐性菌が増加の一途をたどっている現在、この治療が奏功しない患者もいる。宿主の免疫反応を標的とする、あるいは抗生物質との併用療法は、腸内細菌感染症に対する効果的な治療法となる可能性を秘めている。ILCはまれな免疫細胞であるが、組織の恒常性、炎症、消化管感染症に対する免疫の重要な調節因子である(5)。近年、ILCの生物学に対する理解が深まり、ILCを治療標的とする新しい、あるいはT細胞を標的とした治療法の開発が進んでいる(104)。既存のILCを標的とした治療戦略には、サイトカインの投与、ILCの養子移入、ILC関連サイトカインに対する抗体、ILCの枯渇、ILCの可塑性、遊走、機能の調節、微生物叢の操作などがある(104)。これらは、T細胞生物学に基づいて開発された経路を利用している。T細胞ではなくILCを正確に標的とする治療法の開発は、この分野の課題である。さらに、消化管内の酸素レベルを操作することは、病原体に対抗する有効な手段となりうる。このように、ILCを標的とした治療法に関するいくつかの前臨床研究や臨床研究によって明らかなように、ILCを標的とした臨床治療が検討されるようになってきている(104, 105)。実際、ILCを標的とした生物学的治療法はすでにいくつか承認されており、その他にも消化管の慢性炎症性疾患であるクローン病に対して複数の治療法が開発中である(104, 106)。
議論されているように、腸内細菌病原体はしばしばILCの機能を変調させ、病理学的あるいは防御的な結果をもたらす。ILCによる病原体に誘導されたサイトカイン産生は、病原体に有利に働くこともあれば、宿主の防御に寄与することもある。さらに、ILCの可塑性と遊走は腸内細菌病原体によっても調節される。したがって、ILCの生物学を標的とする治療薬は、消化管感染症の治療において魅力的な新規選択肢となる。既存のILCを標的とする生物学的治療薬は、腸内細菌感染症の治療に適応できる可能性がある。さまざまな腸内細菌感染症におけるILCの役割が研究によって明らかにされ始めているが、既存のILC標的化戦略を腸内細菌感染症の治療に応用する前に、感染症、特にヒトにおけるILCの正確な役割の定義に関するさらなる研究が必要である。このような研究により、感染症におけるILCの生物学が包括的に理解され、腸内細菌感染症に対するILCを標的とした既存の治療戦略の適応や新たな治療戦略の開発につながるであろう。
結論
比較的最近発見されたにもかかわらず、ILCは病原体による侵入を防ぐバリア抵抗性の重要な担い手として浮上してきた。ILCは病原体が最初に遭遇する免疫細胞の一つである。腸内細菌感染におけるILCは、病原体や感染の状況に応じて、防御的役割と病原的役割の両方を果たす。腸内細菌病原体は、宿主の免疫応答を回避する戦略を進化させ、消化管での感染を成立させている。ILC3における特定のシグナル伝達経路を操作する特定の病原性分子やエフェクター分子を同定できたのは、ほんのわずかな相互作用に過ぎない。今後の研究では、これらの異なる病原体がILCの応答を調節する共通かつ新規の方法を検討する必要がある。さらに、これらの知見の多くは動物感染モデルから得られたものである。これらの基礎研究を患者の転帰改善につなげるためには、ヒト感染症での検証が必要である。感染症におけるILCの生物学をより深く理解することは、腸内細菌感染症に対するILCを標的とした治療法につながる可能性が高い。
著者貢献
PSは、コンセプト作りに貢献し、第1稿を執筆した。LZは論文構想に貢献し、論文のレビューと編集を行い、図を作成した。すべての著者が論文に貢献し、提出されたバージョンを承認した。
資金提供
Zenewicz研究室の研究は、米国国立衛生研究所総合医学研究所(P20GM134973)およびStephensonがんセンターに授与された米国国立がん研究所がんセンター支援助成金P30CA225520の一部支援を受けている。
利益相反
著者らは、本研究が利益相反の可能性があると解釈されうる商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
参考文献
Eberl G, Colonna M, Di Santo JP, McKenzie AN. 自然リンパ球。自然リンパ球:免疫学における新たなパラダイム。科学 (2015) 348:aaa6566.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarSpits H, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, et al. Innate lymphoid cells-a proposal for uniform nomenclature. Nat Rev Immunol (2013) 13:145-9. doi: 10.1038/nri3365
PubMedアブストラクト|全文|Google ScholarVivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, et al. Innate lymphoid cells: 10 years on. Cell (2018) 174:1054-66. doi: 10.1016/j.cell.2018.07.017.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarSpits H, Bernink JH, Lanier L. NK細胞と1型自然リンパ球:宿主防御のパートナー。Nat Immunol (2016) 17:758-64. doi: 10.1038/ni.3482.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar免疫、炎症、組織恒常性の制御因子としての自然リンパ球。Nat Immunol (2016) 17:765-74.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar腸の健康と疾患におけるIL-22の役割。J Exp Med (2020) 217:e20192195. doi: 10.1084/jem.20192195.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarBerger、Crepin、Roumeliotis、Wright、Serafini、Pevsner、Fischer、M、et al. Citrobacter rodentium type III secretion system effector EspO affects mucosal damage repair and antimicrobial response. PloS Pathog (2018) 14:e1007406. doi: 10.1371/journal.ppat.1007406.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarXiong L, Wang S, Dean JW, Oliff KN, Jobin C, Curtiss,3rd R, et al. 第3群自然リンパ球パイロプトーシスはサルモネラ感染に対する宿主防御機構を表す。この論文では、サルモネラ感染症に対する宿主の防御機構を明らかにした。
PubMed要旨|全文|Google ScholarPope RL, Chitrakar A, Sah P, Shadid T, Ballard JD, Zenewicz LA. クロストリジオイデス・ディフィシル毒素bは3群自然リンパ球を活性化する。(1)クロストリジウム・ディフィシル毒素bは3群自然リンパ球を活性化する。
PubMedアブストラクト|クロスリファレンス全文|Google ScholarLv YP, Teng YS, Mao FY, Peng LS, Zhang JY, Cheng P, et al. Helicobacter pylori-induced IL-33 modulates mast cell responses, benefits bacterial growth, and contributes to gastritis. 細胞死 Dis (2018) 9:457. doi: 10.1038/s41419-018-0493-1
PubMedアブストラクト|クロスリファレンス全文|Google ScholarKuo CJ, Chen CY, Lo HR, Feng CL, Wu HY, Huang MZ, et al. Helicobacter pylori induces IL-33 production and recruits ST-2 to lipid rafts to exacerbate inflammation. Cells (2019) 8:1290. doi: 10.3390/cells8101290
PubMedアブストラクト|RefRefフルテキスト|Google ScholarBostick(ボスティック)JW、Wang(ワン)Y、Shen(シェン)Z、Ge(ゲー)Y、Brown(ブラウン)J、Chen(チェン)ZE、他 胃以外のヘリコバクター種によるグループ3自然リンパ球の二律背反的制御。Proc Natl Acad Sci USA (2019) 116:24760-9. doi: 10.1073/pnas.1908128116.
PubMed Abstract|クロスリファレンス全文|Google Scholarカンピロバクター感染は、ILC3からILC1への転換を介してIFNγ依存性の腸管病理を促進する。Mucosal Immunol (2021) 14:703-16. doi: 10.1038/s41385-020-00353-8.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarSeshadri S, Allan DSJ, Carlyle JR, Zenewicz LA. 炭疽菌致死毒素は、IL-23を介したMAPKシグナル伝達の障害を通じてILC3の機能を負に調節する。PloS Pathog (2017) 13:e1006690. doi: 10.1371/journal.ppat.1006690.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarSah P, Derouen JT, Alexander JL, Zenewicz LA. グループ3の自然リンパ球(ILC3)は、細胞内cAMPレベルの上昇に応答してIL-22をアップレギュレートする。Cytokine(2022)153:155862.doi:10.1016/j.cyto.2022.155862.Cytokine(2022)153:155862.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarBorenshtein D, McBee ME, Schauer DB. マウスにおけるcitrobacter rodentium感染モデルの有用性。この論文では、胃腸病と胃炎の関連性を明らかにすることを目的とし、胃腸病と胃炎の関連性を検討した。
PubMed Abstract|RefRef Full Text|Google ScholarCollins(コリンズ)JW, Keeney(キーニー)KM, Crepin(クレピン)VF, Rathinam(ラティナム)VA, Fitzgerald(フィッツジェラルド)KA, Finlay(フィンレイ)BB, et al.(シトロバクター ロデンティウム:感染、炎症、微生物叢)。Nat Rev Microbiol (2014) 12:612-23. doi: 10.1038/nrmicro3315
PubMed Abstract|クロスリファレンス全文|Google ScholarMullineaux-Sanders C, Sanchez-Garrido J, Hopkins EGD, Shenoy AR, Barry R, Frankel G. Citrobacter rodentium - host-microbiota interactions: immunity, bioenergetics and metabolism. Nat Rev Microbiol (2019) 17:701-15. doi: 10.1038/s41579-019-0252-z
PubMedアブストラクト|クロスリファレンス全文|Google Scholar第3群自然リンパ球は、付着・排出病原体に対する宿主防御を媒介する。この論文では、病原体に対する宿主の防御機構を、3群自然リンパ球が仲介していることを明らかにした。
パブコメ要旨|全文|Google Scholar腸管NKp46+細胞におけるインターロイキン22産生を促進する微生物叢(Microbial Flora drives interleukin 22 production in intestinal NKp46+ cells that provide innate mucosal immune defense)。免疫 (2008) 29:958-70. doi: 10.1016/j.immuni.2008.11.001
パブコメ要旨|全文|Google ScholarCD4(+)リンパ組織誘導細胞は腸管における自然免疫を促進する。免疫 (2011) 34:122-34. doi: 10.1016/j.immuni.2010.12.009
PubMedアブストラクト|RefRefフルテキスト|Google Scholarヒトのナチュラルキラー細胞サブセットは、粘膜免疫にIL-22の生得的供給源を提供している。Nature (2009) 457:722-5.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarCX(3)CR1(+)マクロファージは、citrobacter rodentium感染時に自然リンパ球によるIL-22産生をサポートする。Mucosal Immunol (2013) 6:177-88.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarCX(3)CR1(+) mononuclear phagocytes support colitis-associated innate lymphoid cell production of IL-22. J Exp Med (2014) 211:1571-83. doi: 10.1084/jem.20140678.
PubMed Abstract|クロスリファレンス全文|Google ScholarCCR2(+)単球から生じる腸管マクロファージは、自然リンパ球を活性化することで病原体感染を制御する。Nat Commun (2015) 6:8010. doi: 10.1038/ncomms9010
PubMedアブストラクト|クロスリファレンス全文|Google ScholarNotch2依存性古典的樹状細胞は、付着・離脱細菌病原体に対する腸管免疫を制御する。Nat免疫学(2013)14:937-48. doi: 10.1038/ni.2679
パブコメ抄録|クロスリファレンス全文|Google Scholarマクロファージβ2-インテグリンはILC3によるIL-22を制御し、致死的なcitrobacter rodentium誘発大腸炎から保護する。Cell Rep (2019) 26:1614-1626 e5. doi: 10.1016/j.celrep.2019.01.054
PubMed Abstract|クロスリファレンス全文|Google ScholarInterleukin-22 mediates early host defense against attaching and effacing bacterial pathogens. Nat Med (2008) 14:282-9. doi: 10.1038/nm1720
PubMedアブストラクト|RefRefフルテキスト|Google ScholarIL-22産生自然リンパ球の相補性と冗長性。Nat Immunol (2016) 17:179-86. doi: 10.1038/ni.3332.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarサイトカインIL-22は、関連常在菌を抑制することで病原体のコロニー形成を促進する。Immunity (2014) 40:262-73. doi: 10.1016/j.immuni.2014.01.003.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarCitrobacter rodentium感染はin vivoでミトコンドリア機能障害と腸管上皮バリア破壊の両方を引き起こす:ミトコンドリア関連タンパク質(Map)の役割。細胞微生物学 (2006) 8:1669-86. doi: 10.1111/j.1462-5822.2006.00741.x
パブコメ抄録|クロスリファレンス全文|Google ScholarNougayrede JP, Donnenberg MS. 腸管病原性大腸菌EspFはミトコンドリアを標的とし、ミトコンドリア死滅経路の開始に必要である。細胞微生物学 (2004) 6:1097-111.
パブコメ抄録|クロスリファレンス全文|Google ScholarCitrobacter rodentiumは、in vivoで腸管上皮細胞のATPフラックスとコレステロール恒常性を破壊する。Cell Metab (2017) 26:738-752 e6. doi: 10.1016/j.cmet.2017.09.003
PubMed Abstract|クロスリファレンス全文|Google ScholarFachi JL, Pral LP, Dos Santos JAC, Codo AC, de Oliveira S, Felipe JS, et al. Hypoxia enhances ILC3 responses through HIF-1alpha-dependent mechanism. Mucosal Immunol (2021) 14:828-41. doi: 10.1038/s41385-020-00371-6
PubMedアブストラクト|RefRefフルテキスト|Google Scholar訓練されたILC3応答は腸管防御を促進する。科学(2022)375:859-63.
PubMed Abstract|クロスリファレンス全文|Google ScholarGalan JE. サルモネラ・チフス菌と炎症:病原体中心の問題。Nat Rev Microbiol (2021) 19:716-25.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarLaRock DL、Chaudhary A、Miller SI. サルモネラ菌と宿主との相互作用。Nat Rev Microbiol (2015) 13:191-205.
PubMed Abstract|クロスリファレンス全文|Google ScholarBao S, Beagley KW, France MP, Shen J, Husband AJ. サルモネラ菌感染に対する腸管免疫においてインターフェロン-γは重要な役割を果たす。免疫学(2000)99:464-72.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarSonghet、Barthel M、Stecher B、Muller AJ、Kremer M、Hansson GC、et al. 間質IFN-γRシグナルはサルモネラ菌感染時の杯細胞機能を調節する。この論文では、サルモネラ菌感染時の間質IFN-γRシグナルが杯細胞機能を調節することを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholarサルモネラ(Salmonella typhimurium)感染におけるThy1+ NK細胞の防御的IFN-γ産生への寄与。この論文では、サルモネラ菌感染症におけるThy1+NK細胞の防御的IFN-γ産生への寄与を明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google ScholarT-bet勾配はCCR6-RORgammat+自然リンパ球の運命と機能を制御する。Nature (2013) 494:261-5.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarKastele V, Mayer J, Lee ES, Papazian N, Cole JJ, Cerovic V, et al. リンパに遊走する腸管由来ILCは、サルモネラ菌感染に応答してIFNγ産生を増加させる。Mucosal Immunol (2021) 14:717-27.
PubMedアブストラクト|全文|Google ScholarムチンMuc2は、サルモネラ腸炎における病原体負荷と上皮バリア機能障害を制限する。(2013年) 81:3672-83. doi: 10.1128/IAI.00854-13.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar腸管におけるサルモネラ菌血清型チフス菌に対するインターロイキン23による粘膜応答の制御。感染免疫 (2009) 77:387-98. doi: 10.1128/IAI.00933-08.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar自然リンパ球は腸管上皮細胞の糖鎖形成を制御する。サイエンス(2014)345:1254009.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarGrizotte-Lake M, Zhong G, Duncan K, Kirkwood J, Iyer N, Smolenski I, et al. 腸内常在菌は腸管上皮細胞のレチノイン酸合成を抑制し、インターロイキン22活性を制御し、微生物によるディスバイオシスを予防する。Immunity (2018) 49:1103-1115 e6. doi: 10.1016/j.immuni.2018.11.018
PubMedアブストラクト|RefRefフルテキスト|Google Scholarリポカリン-2耐性は、炎症腸内でのサルモネラ腸炎菌の増殖と生存に有利である。細胞宿主微生物(2009)5:476-86. doi: 10.1016/j.chom.2009.03.011.
PubMedアブストラクト|RefRefフルテキスト|Google Scholarサルモネラ菌が誘導する粘膜レクチンRegIIIbetaは、競合する腸内細菌叢を死滅させる。この論文では、サルモネラ菌が腸内細菌叢を死滅させるレクチンRegIIIbetaが、腸内細菌叢を死滅させることを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google ScholarSchnizlein MK, Young VB. クロストリジオイデスディフィシル感染サイクルの環境を捉える。Nat Rev Gastroenterol Hepatol (2022) 19:508-20. doi: 10.1038/s41575-022-00610-0
PubMed Abstract|クロスリファレンス全文|Google ScholarAbt MC、McKenney PT、Pamer EG. クロストリジウム・ディフィシル大腸炎:病因と宿主防御。Nat Rev Microbiol (2016) 14:609-20. doi: 10.1038/nrmicro.2016.108.
PubMed Abstract|クロスリファレンス全文|Google Scholar2つのILCサブセットが介在する自然免疫防御は、急性クロストリジウム・ディフィシル感染に対する防御に重要である。Cell Host Microbe (2015) 18:27-37. doi: 10.1016/j.chom.2015.06.011.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarIL-33 drives group 2 innate lymphoid cell-mediated protection during clostridium difficile. Nat Commun (2019) 10:2712. doi: 10.1038/s41467-019-10733-9
PubMedアブストラクト|クロスリファレンス全文|Google ScholarFachi JL, Secca C, Rodrigues PB, Mato FCP, Di Luccia B, Felipe JS, et al. 酢酸塩はFFAR2を介してc. difficileに対する好中球とILC3の応答を調整する。J Exp Med (2020) 217:e20190489. doi: 10.1084/jem.20191520.
クロスリーフフルテキスト|Google ScholarNfil3は自然リンパ球の発達と腸内病原体に対する宿主の防御に重要である。J Exp Med (2014) 211:1723-31. doi: 10.1084/jem.20140212.
パブコメ抄録|クロスリファレンス全文|Google Scholarインターロイキン22は補体系を制御し、病原体誘発腸管障害後の病原体に対する抵抗性を促進する。Immunity (2014) 41:620-32. doi: 10.1016/j.immuni.2014.09.010.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarペニシェAG、スピンラーJK、ブーンマP、サヴィッジTC、ダンSM. 加齢は、好中球およびIL-22を介する免疫を抑制することにより、マウスにおけるクロストリジウム(Clostridium)ディフィシル(difficile)感染に対する防御的宿主防御を損なう。Anaerobe (2018) 54:83-91. doi: 10.1016/j.anaerobe.2018.07.011.
PubMed Abstract|RefRef Full Text|Google ScholarCribas ES, Denny JE, Maslanka JR, Abt MC. インターロイキン-10(IL-10)シグナル伝達の消失は、急性clostridioides difficile感染に対するIL-22依存的な宿主防御を促進する。Infect Immun (2021) 89:e00730-20. doi: 10.1128/IAI.00730-20.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarCowardinCA、Buonomo EL、Saleh MM、Wilson MG、Burgess SL、Kuehne SA、et al.バイナリートキシンCDTは、保護的な大腸好酸球増加を抑制することにより、クロストリジウム・ディフィシレの病原性を増強する。Nat Microbiol (2016) 1:16108. doi: 10.1038/nmicrobiol.2016.108.
PubMed Abstract|クロスリファレンス全文|Google Scholar微生物が制御するIL-25は好酸球数を増加させ、クロストリジウム・ディフィシル感染時に防御を提供する。セルレップ(2016)16:432-43. doi: 10.1016/j.celrep.2016.06.007.
PubMed Abstract|クロスリファレンス全文|Google ScholarTshibangu-Kabamba E, Yamaoka. Helicobacter pylori infection and antibiotic resistance - from biology to clinical implications. Nat Rev Gastroenterol Hepatol (2021) 18:613-29. doi: 10.1038/s41575-021-00449-x
PubMedアブストラクト|クロスリファレンス全文|Google Scholarヘリコバクター・ピロリ:胃がんとその先。Nat Rev Cancer(2010)10:403-14。
PubMedアブストラクト|クロスリファレンス全文|Google Scholarヘリコバクター・ピロリ感染による胃疾患の2型免疫の偏りに2群自然リンパ球が関与している。Mediators Inflamm (2017) 2017:4927964.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar胃の細菌誘導性2群自然リンパ球はIgAの誘導を介して免疫防御を行う。免疫(2020)52:635-649 e4. doi: 10.1016/j.immuni.2020.03.002
PubMedアブストラクト|クロスリファレンス全文|Google Scholarヘリコバクター・ピロリ感染胃粘膜におけるサイトカインmRNAの発現。胃粘膜におけるサイトカインの発現。
PubMedアブストラクト|クロスリファレンス全文|Google ScholarカアコウシュNO、カスタノ-ロドリゲスN、ミッチェルHM、マンSM。カンピロバクター感染の世界疫学。Clin Microbiol Rev(2015)28:687-720。
PubMed Abstract|クロスリファレンス全文|Google ScholarRiddle MS, Gutierrez RL, Verdu EF, Porter CK. カンピロバクターに関連する慢性胃腸障害。カンピロバクターによる慢性胃腸障害。
PubMedアブストラクト|クロスリファレンス全文|Google ScholarO'Brien SJ. カンピロバクター感染の結果。Curr Opin Gastroenterol(2017)33:14-20。
PubMed Abstract|RefRef Full Text|Google ScholarマリクA、シャルマD、セントチャールズJ、ダイバスLA、マンスフィールドLS。カンピロバクター・ジェジュニによる大腸炎と自己免疫は、対照的な免疫応答によって引き起こされる。Mucosal Immunol (2014) 7:802-17.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarJing X, Korchagina AA, Shein SA, Muraoka WT, Koroleva E, Tumanov AV. IL-23は、自然リンパ球によるIL-17およびIFNγ応答を促進することにより、カンピロバクター・ジェジュニによる腸管病態に寄与する。この論文では、IL-23がカンピロバクター・ジェジュニンの腸管病態に関与していることを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholarマウスキャンピロバクター・ジェジュニ感染におけるIL-23/IL-22/IL-18軸。Gut Pathog (2016) 8:21. doi: 10.1186/s13099-016-0106-4
PubMedアブストラクト|クロスリファレンス全文|Google Scholarカンピロバクター・ジェジュニ感染に対するヒト宿主の自然免疫および適応性T細胞免疫の結果を明らかにした。この論文では、カンピロバクター・ジェジュニ感染に対するヒト宿主の自然免疫と適応T細胞免疫の結果を明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google ScholarBernink、Krabbendam、Germar、De Jong、Gronke、K、Kofoed-Nielsen、Mら:インターロイキン12および23は、腸管固有層におけるCD127(+)グループ1およびグループ3の自然リンパ球の可塑性を制御する。Immunity (2015) 43:146-60. doi: 10.1016/j.immuni.2015.06.019.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarMoayeri M, Leppla SH, Vrentas C, Pomerantsev AP, Liu S. Anthrax pathogenesis. Annu Rev Microbiol (2015) 69:185-208. doi: 10.1146/annurev-micro-091014-104523.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar炭疽菌浮腫因子の基質特異性:新たな作用機序の証拠。毒素(バーゼル)(2012)4:505-35. doi: 10.3390/toxins4070505
パブコメ抄録|全文|Google Scholar大腸免疫抑制、バリア機能障害、および消化管炭疽菌感染によるディスバイオシス。PloS One (2014) 9:e100532. doi: 10.1371/journal.pone.0100532.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarPaccani SR, Baldari CT. 炭疽毒素によるT細胞標的化:同じコインの2つの顔。Doi: 10.3390/toxins3060660.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar炭疽菌毒素の裏と表。Doi: 10.3390/toxins8030069.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarPaccani SR, Benagiano M, Savino MT, Finetti F, Tonello F, D'Elios MM, et al. 炭疽菌のアデニル酸シクラーゼ毒素はT(H)17細胞の強力な発達促進因子である。この論文では、炭疽菌のアデニル酸シクラーゼ毒素がT(H)17細胞の発達を強力に促進することを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google ScholarGasteiger G、Fan X、Dikiy S、Lee SY、Rudensky AY. Tissue residency of innate lymphoid cells in lymphoid and nonlymphoid organs. 科学 (2015) 350:981-5. doi: 10.1126/science.aac9593.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarウォーカーJA、クラークPA、クリスプA、バーロウJL、Szeto A、フェレイラACF、他。ポリクロミックレポーターマウスは、骨髄における未認識の自然リンパ球前駆細胞の不均一性ととらえどころのないILC3前駆細胞を明らかにした。Immunity (2019) 51:104-118 e7. doi: 10.1016/j.immuni.2019.05.002
PubMedアブストラクト|RefRefフルテキスト|Google ScholarInnate lymphoid cell and adaptive immune cell cross-talk: a talk meant to forget. J Leukoc Biol (2020) 108:397-417. doi: 10.1002/JLB.4MIR0420-500RRR
PubMedアブストラクト|クロスリファレンス全文|Google ScholarSonnenberg GF, Hepworth MR. 自然リンパ球と適応免疫の機能的相互作用。Nat Rev Immunol (2019) 19:599-613.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarウィザーズDR. 適応免疫の自然リンパ球制御。免疫学(2016)149:123-30.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarHepworth MR, Monticelli LA, Fung TC, Ziegler CG, Grunberg S, Sinha R, et al. Innate lymphoid cells regulate CD4+ T-cell responses to intestinal commensal bacteria. Nature (2013) 498:113-7.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarHepworth MR, Fung TC, Masur SH, Kelsen JR, McConnell FM, Dubrot J, et al. 免疫寛容。3群自然リンパ球は、常在細菌特異的CD4(+)T細胞の腸管選択を媒介する。Science (2015) 348:1031-5. doi: 10.1126/science.aaa4812.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarMHCIIを介した2群自然リンパ球とCD4(+)T細胞との対話は、2型免疫を増強し、寄生蠕虫の排出を促進する。Immunity (2014) 41:283-95. doi: 10.1016/j.immuni.2014.06.016
PubMedアブストラクト|RefRefフルテキスト|Google ScholarCD4(+)T細胞のエフェクターおよびメモリー機能におけるOX40およびCD30シグナル:エフェクター機能ではなくCD4(+)T細胞のメモリー維持におけるリンパ組織誘導細胞の明確な役割。Immunol Rev (2011) 244:134-48. doi: 10.1111/j.1600-065X.2011.01057.x
PubMedアブストラクト|クロスリファレンス全文|Google ScholarILC3由来のOX40Lは、免疫不全マウスにおける腸管トレグの恒常性に必須である。細胞分子免疫学(2020)17:163-77. doi: 10.1038/s41423-019-0200-x
PubMedアブストラクト|クロスリファレンス全文|Google Scholar第2群自然リンパ球とCD4+ T細胞は協力してマウスにおける2型免疫応答を媒介する。Allergy (2014) 69:1300-7. doi: 10.1111/all.12446.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarICOS:ICOS-ligand interaction is required for type 2 innate lymphoid cell function, homeostasis, and induction of airway hyperreactivity. Immunity (2015) 42:538-51. doi: 10.1016/j.immuni.2015.02.007.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarILC2s regulate adaptive Th2 cell functions via PD-L1 checkpoint control. J Exp Med (2017) 214:2507-21. doi: 10.1084/jem.20170051.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarDuerr CU, McCarthy CD, Mindt BC, Rubio M, Meli AP, Pothlichet J, et al. I型インターフェロンは、2群自然リンパ球の制御を介して2型免疫病理を抑制する。Nat Immunol (2016) 17:65-75. doi: 10.1038/ni.3308.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarDuster M, Becker M, Gnirck AC, Wunderlich M, Panzer U, Turner JE. T細胞由来のIFN-γは、マウスエリテマトーデスにおける保護的な2群自然リンパ球をダウンレギュレートする。Eur J Immunol (2018) 48:1364-75. doi: 10.1002/eji.201747303.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar自然リンパ球と適応リンパ球は、腸内細菌叢と脂質代謝を順次形成する。Nature (2018) 554:255-9. doi: 10.1038/nature25437.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarLAG3(+)制御性T細胞は、3群自然リンパ球駆動性大腸炎においてインターロイキン23産生CX3CR1(+)腸内常在マクロファージを抑制する。Immunity (2018) 49:342-352 e5. doi: 10.1016/j.immuni.2018.07.007
PubMedアブストラクト|RefRefフルテキスト|Google ScholarRigas D, Lewis G, Aron JL, Wang B, Banie H, Sankaranarayan I, et al. 制御性T細胞による2型自然リンパ球抑制は気道過敏性を減弱させ、誘導性T細胞コスティミュレーター-誘導性T細胞コスティミュレーターリガンド相互作用を必要とする。J Allergy Clin Immunol (2017) 139:1468-1477 e2. doi: 10.1016/j.jaci.2016.08.034
PubMed Abstract|RefRef Full Text|Google Scholar2型自然リンパ球はCD4+ Th2細胞応答を促進する。J Immunol (2014) 192:2442-8. doi: 10.4049/jimmunol.1300974.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarMelo-Gonzalez F, Kammoun H, Evren E, Dutton EE, Papadopoulou M, Bradford BM, et al. 抗原提示ILC3は大腸粘膜細菌に対するT細胞依存性IgA応答を制御する。J Exp Med (2019) 216:728-42. doi: 10.1084/jem.20180871.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarKruglov AA, Grivennikov SI, Kuprash DV, Winsauer C, Prepens S, Seleznik GM, et al. 腸内恒常性維持における自然リンパ球が産生する可溶性LTα3の非冗長機能。科学 (2013) 342:1243-6. doi: 10.1126/science.1243364.
パブコメ抄録|クロスリファレンス全文|Google ScholarTh22細胞は、腸内細菌に対する宿主防御に重要なIL-22の供給源である。免疫 (2012) 37:1061-75. doi: 10.1016/j.immuni.2012.08.024
PubMedアブストラクト|クロスリファレンス全文|Google ScholarIL-22 fate reporter reveals origin and control of IL-22 production in homeostasis and infection. J Immunol (2014) 193:4602-13. doi: 10.4049/jimmunol.1401244.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarSilberger DJ, Zindl CL, Weaver CT. Citrobacter rodentium: a model enteropathogen for understanding the interplay of innate and adaptive components of type 3 immunity. Mucosal Immunol (2017) 10:1108-17. doi: 10.1038/mi.2017.47
PubMedアブストラクト|RefRefフルテキスト|Google ScholarIL-22は、citrobacter rodentium感染時の大腸リンパ球構造の維持とリンパ毒素経路を橋渡ししている。Nat免疫学(2011)12:941-8. doi: 10.1038/ni.2089
PubMedアブストラクト|クロスリファレンス全文|Google ScholarCobb LM, Verneris MR. 自然リンパ球の治療的操作。JCI Insight (2021) 6:e146006. doi: 10.1172/jci.insight.146006.
PubMedアブストラクト|RefRefフルテキスト|Google Scholarヒト自然リンパ球の生物学と治療の可能性。FEBS J (2022) 289:3967-81.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarIBDの新規治療標的としての珍しい容疑者-鼻腔リンパ球。Nat Rev Gastroenterol Hepatol (2015) 12:271-83. doi: 10.1038/nrgastro.2015.52.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
キーワード 消化管、細菌、IL-22、ILC、自然リンパ球、免疫応答の調節
引用 Sah P and Zenewicz LA (2023) Modulation of innate lymphoid cells by enteric bacterial pathogens. Front. Immunol. doi: 10.3389/fimmu.2023.1219072.
受理された: 2023年05月08日;受理:2023年06月22日;
発行:2023年7月6日
編集者
Laurel L. Lenz, コロラド大学アンシュッツ・メディカル・キャンパス, アメリカ合衆国
査読者
Liang Zhou, フロリダ大学, 米国
アマンダ・M・ジェイミソン、ブラウン大学、米国
Copyright © 2023 Sah and Zenewicz. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*通信欄 Lauren A. Zenewicz, lauren-zenewicz@ouhsc.edu
免責事項:本論文で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または承認されるものではありません。
こんな人たちも見ています
アカカミアリの営巣が土壌微生物群集の構造に及ぼす影響
宋景傑、唐振振、趙雪青、尹燕雄、李仙勇、陳福寿、陳愛東、劉英
ポスト抗生物質時代における家禽の細菌病予防:抗生物質使用の代替としての自然免疫調節のケース
ジェームズ・R・G・アダムス、ジャイ・メハット、ロベルト・ラ・ラジョーネ、シャリアール・ベフブーディ
肥満に関連した腸管病原性微生物による腸内コロニー形成は、乳癌の肺転移および肝転移を促進する前転移ニッチを修飾する
Sheetal Parida、Sumit Siddharth、Himavanth Gatla、Shaoguang Wu、Guannan Wang、Kathleen Gabrielson、Cynthia L Sears、Brian H Ladle、Dipali Sharma
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
この記事が気に入ったらサポートをしてみませんか?
