樹状細胞:疾患進行における陰と陽
本文へスキップ
トップバーナビゲーション
免疫学の最前線
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
56
総閲覧数
5
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは1
レビュー記事
Front. 免疫学, 2024年01月04日
免疫におけるサイトカインと可溶性メディエーター
第14巻-2023年|https://doi.org/10.3389/fimmu.2023.1321051
樹状細胞:疾患進行における陰と陽
https://www.frontiersin.org/articles/10.3389/fimmu.2023.1321051/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FIMMU_XXXXXXXX_auto-dlvrit


Carlos Jiménez-Cortegana1* Francisca Palomares1 Gonzalo Alba1 Consuelo Santa-María2 Luis de la Cruz-Merino3 Victor Sánchez-Margalet1*† Soledad López-Enríquez1† 1.
1Department of Medical Biochemistry, Molecular Biology and Immunology, School of Medicine, University of Seville, Seville, Spain
2薬学部生化学・分子生物学教室、セビリア大学、セビリア、スペイン
3セビリア大学医学部臨床腫瘍科、ビルヘン・マカレナ大学病院、セビリア、スペイン
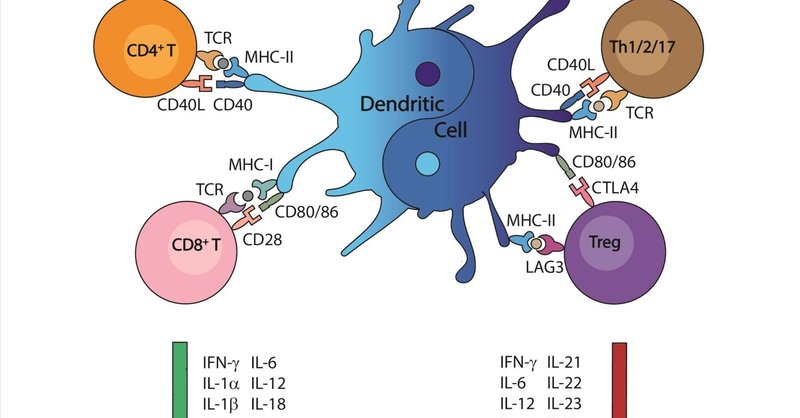
樹状細胞(DC)は、自然免疫と適応免疫をつなぐ抗原提示細胞である。樹状細胞は歴史的に、ナイーブT細胞を活性化し、癌などの多くの疾患において好ましい免疫応答を引き起こすために、抗原を捕捉し、処理し、提示する最も効果的で強力な細胞集団と考えられてきた。しかし、ここ数十年の間に、DCは有益な応答を促進するだけでなく、炎症性腸疾患(IBD)を含むいくつかの病態の開始や進行をも促進することが観察されるようになった。このような考え方に沿って、様々なDCサブセットの濃度と役割を強化したり損なったりするための様々な治療アプローチが試験されてきた。DCやDCベースのワクチンを促進するための阻害経路の遮断は、癌において成功裏に評価され、一方、DCの機能を阻害するためのターゲティングは、IBDにおいて有利であることが証明されている。本総説では、(a)DCの一般的な役割、(b)DCサブセットと免疫原性における役割、(c)癌におけるDCの役割と免疫原性DCを促進する治療的アプローチ、(d)IBDにおけるDCの役割とDC誘導性炎症を抑制する治療的アプローチを分析した。従って、我々はDCの "陰陽 "の役割を強調し、疾患進行におけるこの種の細胞の理解を深めることを目的とした。
1 はじめに
自然免疫応答と適応免疫応答の橋渡し役である樹状細胞(DC)は、T細胞免疫と寛容の両方を制御することから、最も強力な抗原提示細胞(APC)と考えられている(1)。DCは、CD34+造血前駆体から分化して他のDC前駆体になる異種の細胞集団である。DCは、単球由来DC(moDC)または炎症性DC(infDC)、形質細胞由来DC(pDC)、従来型DC(cDC)1およびcDC2(骨髄性DCまたは古典的DCとしても知られる)など、リンパ系組織と非リンパ系組織の両方に存在するサブセットを構成する(2)。DCは主に、未知の抗原や自己抗原を捕捉、処理し、適応免疫細胞に提示することで免疫応答を誘導する。外部抗原はウイルス感染(3)や癌(4)などの疾患に由来し、自己抗原はアレルギー、脳疾患、炎症性腸疾患(IBD)(6-8)などの自己免疫疾患(5)に関与する。しかし、ここ数十年の間に、DCはその環境に応じて興味深い正反対の挙動を示すことが報告されている。すなわち、DCは寛容原性DCと呼ばれ(9)、Treg細胞の活性化(10)、エフェクターT細胞の抑制、Th1/Th2免疫応答のネガティブモジュレーションといった特異的なメカニズムを介して末梢寛容を誘導する上で重要な役割を果たしている。このため、DCは免疫療法として阻害薬やDCをベースとしたワクチンを用いることで標的とすることに成功している(11, 12)。一方、DCの活性化はIBD(13)を含む他の疾患の発症に寄与する役割を果たす可能性がある(図1参照)。注目すべきは、DCは同じ疾患内でも有益な機能と有害な機能の両方を示すことである(14)。
図1
www.frontiersin.org
図1 病気の進行における樹状細胞の二重の役割。樹状細胞は、免疫応答を開始する最も効果的な抗原提示細胞であり、T細胞によって駆動される細胞傷害機構の活性化につながる。このイベントは腫瘍抗原を認識し、がん細胞を死滅させるために極めて重要である。しかし、腸の炎症が作り出す環境では、樹状細胞は逆の行動をとり、炎症性腸疾患を最終的に誘発する炎症性シグナルのカスケードを促進する。
樹状細胞が "陰と陽 "の二重の役割を持つ理由はまだ完全には解明されておらず、治療アプローチに重要な意味を持つ可能性がある。この点に関して、転写因子β-カテニンがヒトMoDCに対して用量依存的に異なる特性を誘導することが知られており、その阻害はIL-12p70を増加させIL-10を減少させることで炎症性状態をもたらす一方、その活性化は核内β-カテニンを増強し、低レベルのIL-12p70、より高いIL-10、DC上の抑制性細胞マーカーの発現に関連する(15)。C型レクチン受容体(CLR)もまた、DCにおいて異なる挙動を引き起こす可能性がある。実際、さまざまなナノワクチンが、DCのCLRに作用し、アレルギー患者の制御反応を誘導するように設計されている(16)。具体的には、DC特異的ICAM-3-grabbing nonintegrin(DC-SIGN、CD209としても知られる)は、ナノワクチンと結合するCLRであり、DCの表現型を変化させ、Tregの増殖を改善する(17)。
また、DC-SIGNはセリン・スレオニンプロテインキナーゼRAF1を促進し、T細胞の活性化と増殖に関与する可能性がある。RAFキナーゼを阻害すると、ヒトでもマウスでもDCの活性化が損なわれ、T細胞を介した免疫応答が損なわれるからである(18)。次に、がんとIBDという2つの異なる微小環境におけるDCの二重の挙動について、その調節異常と炎症促進機能にそれぞれ焦点をあてて概説することを目的とした。
2 DCサブセットと免疫原性における役割
2.1 DCの免疫原性および寛容原性の役割
免疫原性とは、タンパク質性物質(例えば、外来抗原)が免疫応答を促進する能力のことである。現在のところ、DCは貪食、受容体を介したエンドサイトーシス、あるいはマイクロピノサイトーシスによって抗原をサンプリングし、主要組織適合複合体クラスII(MHC-II)分子上のCD4+ T細胞やMHC-I上のCD8+ T細胞に抗原を提示するために、免疫原性機構を活性化することが知られている(19)。しかし、DCの免疫原性能力の発見は、がん治療(20)や他の病態(21)に適していることが示されている。ここ数年、これらの免疫原性DCは、抗レトロウイルス治療を受けているHIV患者(22)や卵巣がん患者(23)の個別化治療に用いられている。
成熟したDCは、刺激に応じて免疫応答を調整するために異なる分子機構を用いるからである(24)。この意味で、成熟したDCが免疫原性を持つためには、CD31、CD40、CD80、CD83、CD86(これらに限定されない)を含む一連のレセプターが必要である(25)。
さらに、様々な免疫疾患において、DCは寛容化能を持つ(1)。この意味で、DCはエフェクターと制御機構、特に自己免疫に関連する自己反応性を制御することにより、中枢と末梢の寛容に関与している(26)。しかし、DCのもう一つの寛容促進作用は、T細胞を制御性表現型(Treg)に分化させる能力である(27)。これらの機能は、PD-L1やCTLA-4などの表面マーカーの発現や、MHC分子、CD40、CD80、CD86のダウンレギュレーションによって特徴づけられる、未成熟または半成熟のDCが担っている(28, 29)。また、DCによる抗炎症性サイトカイン(IL-10やTGF-βなど)の産生が、この細胞集団の寛容効果を誘導することも判明している(30)。
2.2 DCサブタイプ
リンパ節、脾臓、胸腺、腸、血液、皮膚など、異なる組織やリンパ系臓器に存在する部位によって、異なるDCサブセットが見つかっている(31)。この点で、DCの可塑性がその分類を難しくしているが、発生学に基づく単純化された分類では、この細胞集団はcDC、moDCまたはinfDC、pDC、ランゲルハンス細胞(LC)に分けられ(19)、これらは免疫原性または寛容原性作用を持つ可能性がある。
定常状態では、cDCは非リンパ組織と脾臓辺縁帯の両方に存在し、炎症時にもリンパ節のTリンパ球ゾーン(TLZ)に移動する能力が高い(32)。cDC1はリンパ節傍皮質内に存在し、DEC205(CD205としても知られる)やT細胞免疫グロブリンおよびムチンドメイン含有タンパク質3(TIM3)などのレセプターを介して細胞関連抗原(死細胞も)を取り込み、優先的にはMHC-I上の交差提示によってCD8+T細胞に提示される。cDC1はまた、CD103とTLR(toll-like receptor)3の高発現によって特徴づけられ(34)、インターロイキン(IL)-12を産生することによってTヘルパー(Th)1細胞の細胞内防御に寄与し(35)、インフルエンザウイルス感染に対するTh17応答を促進する(36)。cDC2は皮膚で抗原を取り込み、C-X-Cモチーフケモカインレセプター4(CXCR4)またはCC-ケモカインレセプター7(CCR7)依存性などの異なる経路でTLZに移動する。加えて、cDC2は特定の条件下で腫瘍関連抗原(TAA)を取り込み、交差提示する(33)。また、インターフェロン制御因子4(IRF4)を発現しているため、cDC2はMHC-II上での抗原プロセッシングと提示に特に効率的であり、その結果、cDC1と比較してCD4+ T細胞増殖を誘導し(33, 37)、Th2およびTh17の極性化をサポートする(38)。興味深いことに、気道や肺胞の微小環境に存在するコロニー刺激因子-1(CSF-1)は、アレルゲン刺激に応答して、IRF4依存的にcDC2(cDC1ではない)上のCCR7の発現を上昇させ、Th2応答を促進する(39)。一方、IRF4の欠失はTh17応答を促進、抑制することが分かっている(40)。
cDCにおけるIRF4と同様に、moDCは抗腫瘍CD8+ T細胞を活性化し(41)、ウイルス免疫における呼吸性CD8+ T細胞の記憶を抑制するという二重の役割を担っている(42)。さらに、moDCやinfDC、cDC2は炎症時にCD11bを発現するため、これらの細胞集団を表現型的に区別することは困難である(19)。ヒトのpDCはCD123とCD303の共発現に基づくが、マウスのpDCはB220+とCD11c+である。pDCはTLR-7と-9を介してRNAとDNAウイルスを認識して細胞を活性化し、I型インターフェロン(IFN-I)を大量に放出する特異的な機能を持つ(43)。さらに、pDCは、クローン病(CD)と潰瘍性大腸炎(UC)の患者における分布、表現型、機能の違いを示し、急性大腸炎の発症やIBDの発症に重要な役割を果たすことが証明されているだけでなく(13)、IFN-Iを誘導し、ナチュラルキラー(NK)リンパ球をリクルートすることで、cDC1とともにウイルス感染に関与している(44)。さらに、LCは表皮に存在するが、マクロファージと共通の発生様式を持つ。LCは、抗原が表皮に多く存在する場合、特異的な適応免疫応答に必要であり(46)、皮膚免疫恒常性を維持するために、皮膚常在制御性T細胞(Treg)の増殖と活性化を選択的に促進する(46, 47)。
3 DCとがん
がんは、世界的に最も一般的な死因の一つである(48)。がんによる死亡率は年々下がり続けているが、米国では昨年1年間に200万人近くのがん患者が新たに発生し、60万人以上が死亡すると予想されている(49)。上記で説明したように、DCは免疫応答を開始する専門的なAPCとして働く。がんにおいて、DCの免疫原性能力は「がん免疫サイクル」と呼ばれ、多段階かつ代謝的なメカニズムで、DCがTAAを捕捉し、処理し、ナイーブT細胞に提示し、その結果、T細胞は活性化され、腫瘍微小環境(TME)内に浸潤し、類似抗原を特異的に認識することでがん細胞を死滅させ、新たなTAAを放出し、プロセスをやり直すことを説明する(50)。しかし、腫瘍増殖因子(TGF)-β(51)、IL-10(52)、細胞傷害性Tリンパ球抗原(CTLA)-4(53)、プログラム細胞死タンパク質(PD)-1発現(51, 53)などの阻害因子が抗腫瘍DC活性に影響を及ぼし、がんの進行につながる。
3.1 がんにおけるDCの「陰陽」的役割
現存するすべての種類のDCの中で、pDCとmoDCはがん免疫において相反する役割を担っているように思われる。リンパ球活性化遺伝子(LAG)-3、PD-1、CTLA-4などの抑制性マーカーの発現(55-57)、免疫抑制性サイトカイン(IL-10、TGF-β、プロスタグランジンE2など)の放出(58)、およびTregの増殖と蓄積(59)により、pDCは様々なタイプの腫瘍に浸潤し、予後不良と関連することが証明されている(54)。しかし、pDCは腫瘍細胞に対する溶解能を持つ可能性が示唆されている(60, 61)。MoDCは、表現型的に抗腫瘍性cDCと類似しており(62)、有益な免疫応答を媒介することが示されている(63, 64)が、Th17応答の維持にも関与しており、腫瘍促進状態を誘導する可能性がある(65)。また、単球性骨髄由来抑制細胞(MDSC)(66)と関連しており、多くの腫瘍学的環境において、腫瘍の進行や予後不良と相関している(67-69)。
対照的に、cDCはがんにおいてT細胞への抗原提示を優先的に促進する能力を示している(70)。具体的には、cDC1は、マウスではインテグリンaE(CD103としても知られる)、ヒトではBDCA3(CD141)の発現によって特徴づけられるが(31)、TAAを排出リンパ節に輸送し、MHC-I上の抗原を交差提示して細胞傷害性T細胞を活性化する能力に優れている(71)。癌におけるcDC1の重要な役割は、ヒトとマウスモデルの両方における多くの研究によって広く支持されている。例えば、cDC1の存在は、抗PD-1を用いたメラノーマ患者の良好な転帰と相関している(72)。CD103+のcDC1を欠くマウスでは、CD40L過剰発現キメラ抗原受容体(CAR)T細胞の抗腫瘍反応が損なわれている(73)。また、Batf3 DCは、モノクローナル抗体や養子T細胞療法による効果的な抗腫瘍反応に必要であることが示されている(74)。逆に、cDC2はCD8 T細胞に抗原を交差提示する能力が低下しており、CD4 T細胞をプライミングして抗腫瘍免疫を誘導する方が効率的である(37)。移動性のCD301b+ cDC2は、効果的なCD4 T細胞のプライミングに不可欠であることが証明されている(75)。しかし、このように確立された概念にもかかわらず、最近、cDC1のMHC-IIとCD40を欠失させると、線維肉腫マウスにおける早期のCD4 T細胞のプライミングが阻害され、腫瘍拒絶反応が損なわれることが知られている。
4 癌における免疫原性DCを促進する治療的アプローチ
4.1 がん免疫療法
免疫療法は、様々な種類の癌の予後を改善することが証明されている(77, 78)。特に、腫瘍へのDCの浸潤は予後や生存と正の相関があり(79, 80)、そのためDCの濃度と機能性の両方を高める様々な治療法の設計が可能になった。
抑制性の経路やシグナルは、TME内のDC濃度を低く維持し、腫瘍の進行につながるため、標的とされてきた。これらのメカニズムは、TMEに見られる免疫抑制状態のために阻害される可能性があり、MDSCは抗腫瘍免疫を低下させる能力を持っている(81)。しかし、PD-1/PD-L1免疫チェックポイントは、T細胞の活性化、増殖、細胞傷害性機能をも障害し(82)、これは抗PD-1療法を用いることで、特に他の治療法と併用することで、正常に回復している(83, 84)。さらに、DCはこの細胞集団によるIFN-γとIL-12の産生により、抗PD-1効果を高めるのに必要であることが観察されている(85)。もう一つの阻害シグナルである血管内皮増殖因子(VEGF)は、強力な血管新生作用を持ち、DCの成熟と増殖を阻害する(86, 87)。従って、標的抗VEGF療法によるVEGFの阻害は、血管新生を防ぐだけでなく、効果的な抗腫瘍反応を行うDCの能力を向上させる(88)。IL-6は、アポトーシス、血管新生、浸潤、転移、腫瘍細胞代謝などに関与する様々な経路をアップレギュレートすることにより、癌の進行を促進するもう一つのサイトカインである。事実、IL-6は細胞傷害性化学療法によって生じる抗がん免疫応答を阻害し(89)、IL-6/JAK/STAT3シグナルを介して抗腫瘍免疫応答を抑制して乳がんの転移を促進することが報告されている(90)。この考え方に沿って、IL-6/JAK/STAT3シグナルは肝細胞癌の有望な治療標的であることが示されている(91)。逆に、IL-10レベルがIL-4やIL-35と同様に癌で変化することが示されているが(92)、IL-10が癌において二重の機能を持つという証拠がある(93)。このラインでは、IL-10の抑制が慢性リンパ性白血病におけるT細胞の抗腫瘍免疫とチェックポイント遮断に対する反応を増強する(94)。
4.2 DCベースのがんワクチン
抗腫瘍免疫を向上させる他の選択肢は、DCワクチンである。DCワクチンは臨床的に評価されており、単独でも他の治療と組み合わせても毒性が限られているため、安全な治療法と考えられている(95-98)。DCは最も効果的なAPCであり、免疫学的T細胞応答を促進すると考えられている(33)。これらの特徴を総合すると、DCはがんワクチンの開発に最も適した細胞集団といえる。具体的には、cDC1ワクチンはMoDCワクチンよりも優れた抗腫瘍効果を示しており(99, 100)、また別の研究では、cDCだけでなくpDCワクチンもMoDCワクチンよりも強力な代替ワクチンと考えられると報告している(101)。もう一つの有望な免疫療法のアプローチは、DCレセプターリガンド、アジュバント、あるいはDCに正確に結合して抗腫瘍T細胞応答によりよい効果を発揮できる他のタイプの分子でDCを標的にする、いわゆるin vivoワクチン接種である(102)。In vivoワクチンは、TLR(103)やアデノシン受容体(104)などのDC受容体を標的としており、有望な結果が得られている(105)。さらに、ブロッコリーのようなアブラナ科の植物に含まれる天然化合物であるスルフォラファンでパルスしたDCは、健康な状態でも、膵臓がん由来の抗原がある場合でも、制御分子、JAK/STAT3、およびマイクロRNAシグナルの調節を介してT細胞の活性化を誘導することが証明されており、がんの共同治療にスルフォラファンを使用する可能性が提案されている(106)。
5 DCと炎症性腸疾患
IBDは、発症率(北米とヨーロッパだけを考慮すると、過去10年間で約350万人)と有病率(現在0.3%を超える)が高い疾患である(107)。IBDの病因は、遺伝的、環境的、微生物的因子、地理的位置、不適切な食事などによる免疫反応の相互作用が関与していることが知られているが、依然として不明である(108, 109)。IBDは、微生物叢に対する免疫反応の増悪と継続による上皮バリア機能の変化を特徴とし、慢性再発の改善や、管腔内微生物の適切な封じ込めと栄養吸収能力の両方の阻害を含む(110)。具体的には、UCは直腸の粘膜炎症から始まる結腸の局面を侵す。その主な症状は、血性下痢、腹痛、便意、テネスムスである(111)。一方、CDは消化管全体を侵す(ただし、回腸遠位部が最も頻繁に侵される)。CDは再燃と寛解を繰り返し、瘻孔、膿瘍、肉芽腫を引き起こす経壁性多形性炎症を引き起こす(112)。
5.1 IBDにおける炎症関連因子
従来、腸の炎症はTヘルパー細胞(Th)1、Th2、Th17、Tregによってのみ促進されると考えられてきたが、現在では、マクロファージ、DC、腫瘍壊死因子(TNF)、インフラマソームの活性化、オートファジーなど、他の免疫細胞、サイトカイン、プロセスによっても炎症が誘導されることがわかっている(113-117)。特に、オートファジーの欠損は抗原のサンプリングを減少させ、DCの成熟を増加させ、炎症性DCを促進する(118)。Atg16l1オートファジー遺伝子の欠損は、in vivoでDSS誘発大腸炎の細菌移動を促進し、オートファジーと貪食を制御し、腸の炎症を悪化させる(119)。炎症を起こしたUC大腸の免疫微小環境は、濾胞性Th細胞やIL17A+ Tregだけでなく、メモリー細胞(CD4+ T、IL17A+ CD161+ T、B細胞)、HLA-DR+ CD56+顆粒球、M1マクロファージ、活性化マスト細胞、好中球、そして静止DCと活性化DCの両方によって構成されている(120, 121)。CD患者では、末梢血単核球はTreg、DC、単球分画でIL-1Bを高発現しており(121)、一方、これらの患者の炎症粘膜は、HLA-DR+CD38+T細胞、TNF+IFN-γ+ナイーブB細胞、pDCでIL-1Bが特徴的である(121)。
5.1.1 IBDにおける炎症関連因子としてのDC
cDCサブセットは定常状態のヒトとマウスの両方の腸粘膜で観察されているが(122)、免疫応答を開始するT細胞との相互作用は相反するようである(123)。この考え方に沿って、TGF-βは狭窄を有するCD患者においてコラーゲン産生を増加させ、線維化を制御するという好ましくない機能を果たすことが示されているだけでなく(124)、IBDにおける炎症を抑制するために必要であることも示唆されている(125)。TNF-αの役割はIBDの免疫学的反応に不可欠である(126)。実際、TNF-αは大腸DCによるIL-22BPの発現を制御し、実験的大腸炎モデルではIL-22による大腸上皮機能の回復を抑制した(127)。注目すべきは、TNF-αでin vitro刺激したDCは、大腸菌で刺激したDCと比較して、DCの活性化と成熟を改善できなかったことである。このことは、UCおよびCD患者におけるDCと腸内細菌叢との相互作用の変化を示唆しているのかもしれない(116)。
図2
www.frontiersin.org
図2 マウスとヒトの炎症性腸疾患における樹状細胞の種類と最も一般的な炎症性表面マーカー。
腸のSIRPα-CD103+ cDC1はヒト腸の小さな細胞集団を構成し、交差提示CD141+CLEC9A+CADM1+ cDC1と分子的に類似している。一方、SIRPα+CD103+ cDC2はマウスとヒトの両方で小腸の主要な集団であり、SIRPα+CD103- cDC2は結腸で優勢である。CD103発現DCはCD患者でも見つかっている(128)。PD-L1/2を高発現するCD103+ DCサブセットは、TGF-βシグナルのネガティブレギュレーターであるSmad7タンパク質の欠損によって誘導される可能性がある(129)。また、CD103+ DCは結腸原性の役割を持ち、Tregを産生する能力が低下している(130)が、IFN-γ、IL-13、IL-6、IL-23、IL-12p35、IL-12p40、TNFなど、多種多様なサイトカインの誘導を通じてTh1/Th2/Th17応答を生成する(131-133)。DCにおけるCD83の発現はIBD患者でも認められている(134)。さらに、DCにおけるReceptor-interacting serine/threonine kinase 2 (RIPK2)シグナルの高発現は、IBDの新たな治療標的である(135, 136)。一方、CXCL10やCCL3などの他の分子の発現亢進は、CDやUCにおける活性化DCと正の相関があり(128, 137)、IBDの診断バイオマーカーとして有効であると考えられる。これらの分子は、in vitroでタバコの煙抽出物(CSE)に暴露された後のUC患者において、CD患者と比較して検出されたことから、CSEがDCの表現型を変化させ、DCの機能を変化させ、その結果、UCにおいてTh1極性化とFoxp3+CD4+T細胞レベルの増加をもたらすことが示された(138)。注目すべきは、変異(例えばNOD2fs遺伝子の変異)もDCの機能不全表現型を促進し、CD感受性を増加させることである(139)。
CD14+のcDCはIBD患者の炎症粘膜で見つかっているが、腸間膜リンパ節(MLN)では限られており、DCの表現型との関連はあまり研究されていない(122)。対照的に、マウスIBDの初期には、CD11bとB220を発現するmDCとpDCの両方が結腸(各サブセットの約50%)とMLN(主にmDC)で高レベルに認められるが(140)、MLNにおけるpDCの高レベルは他の症例でも報告されている(141)。逆に、CD14-HLA-DRint pDCは、CD11c+を発現するかしないか(122)、特にCDにおいてMLNで最も豊富なサブセットであることが示されている(141)。CD103+DC(13)やCD123-HLA-DR+ DCでもCD11cの高発現が観察され、CD123-HLA-DR+ DCはUC患者よりもIL-23を産生する(142)ことから、IBDの病態におけるCD11cの重要性が示されている。この意味で、クロモグラニン-A由来のペプチドであるクロモフンギン(CHR)は、DCのCD11cを制御することにより、腸の炎症に対する保護作用を示す(143)。CD14-CD64dimCD11b+CD36+CD11c+やCD14-CD64-CD163-DCなど、トランスクリプトーム解析や高次元表現型マッピングを用いることで、IBDではより多くのCD14-DCサブセットが見つかっている(141)。
さらに、CD103+およびCD11c- DCは、異なるレベルのTLR発現と関連している(144)。UC由来のDCは、TLRの活性化を介して炎症性サイトカインとケモカインを分泌する。TLRは、多型好中球の浸潤と他の自然免疫細胞の活性化、さらにナイーブT細胞のTh1細胞への分化とIL-12を放出するDCの活性化を誘導する(140)。これに関連して、制御性あるいは寛容性DCは結腸に浸潤したTregのレベルを増加させ、ガレクチン-3:TLR-4:キヌレニン依存的にTh1およびTh17細胞主導性の結腸炎症を抑制したことから、Tregの免疫抑制機能にTLRとガレクチン3の両方が重要であることが示された(145)。同様に、ガレクチンファミリーのもう一つのタンパク質であるガレクチン1は、CDやUCなどのマウスIBDにおいて、DCの免疫原性活性を制限することが証明されている(146)。
6 IBDにおけるDCを阻害する治療的アプローチ
DCは大腸粘膜で増加する傾向があり、腸内細菌叢に対する応答を制御する重要な機能を持つ可能性があることから、中心的な存在として注目されている(13)。IBDの予後を改善するための細胞ベースの治療法は多種多様であるが(147)、ここでは寛容原性DCを産生するDCを調節または減少させる治療法に焦点を当てる(表1)。
表1
www.frontiersin.org
表1 炎症性腸疾患におけるさまざまな治療アプローチによるDCへの影響。
6.1 抗体
IBDに対する最初の成功した治療法は、インフリキシマブやアダリムマブなどのTNF-αを標的とするものであった(148)。IL-12/IL-23 p40に対する抗体(risankizumab)やIL-23 p19に対する抗体(ustekinumab)がIBDの影響を軽減するために試験されている(133)。その他の抗体は、白血球上のインテグリンヘテロダイマーのα4鎖を標的とするもの(例、ナタリズマブ)、α4β7インテグリンを標的とするもので、炎症性単球やDCの腸への動員を阻害することで炎症を抑える可能性がある(例、vedolizumab)(148)、あるいはサリドマイド(149)やG-CSF(150)などの免疫調節剤を標的とするものである。
6.2 グルココルチコイドとチオプリンに基づく療法
グルココルチコイドの使用などの代替療法は、UCにおけるMHC-II分子の発現を低下させることにより、サイトカインの分泌を抑制し、T細胞とDCの活性化を抑制することができる(151)。また、チオプリンに基づく治療などは、オートファジー欠損DCの遊走障害を回復させ、DC-T細胞相互作用と細胞骨格の制御を改善することが証明されている(154)。さらに、間葉系幹細胞(MSC)投与は、DSS誘発UCマウスにおいて、炎症性サイトカイン(IL-1β、IL-6、IL-12など)の血清レベルを低下させ、結腸浸潤DCの表現型と機能を改善した(155)。CDでは、MSCはmDC上のCD80とCD86の発現、IL-12とTNF-αの産生を減少させただけでなく、IL-10の産生も改善した(165)。
6.3 抗生物質とプロバイオティクス
抗生物質は、大腸菌、バクテロイデス属、マイコバクテリウム・アビウムなどの腸管内腔細菌の濃度を低下させるが、これらはDCとともにIBDの慢性炎症に関連している(166)。特に、ベタラクタム系抗生物質は、MAPKおよびNF-kBシグナル伝達経路を介して、アレルギー患者におけるDCの成熟を変化させることが証明されている(167)。IBDもまた、DCの遊走と成熟によって促進されるため、ベタラクタム系抗生物質でDCを標的にすることで、IBDの臨床転帰が改善する可能性がある(115, 116, 168)。プロバイオティクスもまた、IBDにおける腸内細菌叢の調節に有効である(169)。この意味で、Ghavamiら(2020)はLactobacillus salivarius、Bacillus coagulans、Bacillus subtilis、Bifidobacterium bifidum(Bb)の役割を研究し、UC患者ではほとんどのプロバイオティクスによってCD80とCD86の発現が亢進し、CD患者ではBbによってのみ亢進したと結論づけた。また、UC患者のDCは、Bbを除くすべてのプロバイオティクスによってIL-10とTGF-βの産生を増加させ、TLRの発現を減少させた。CD患者のDCは、インテグリンß8の発現を増加させ、TLR-4、TLR-9、IL-12p40の発現を減少させた(14)。Saccharomyces boulardiiは、IL-8レベルを改善し、CD1c+CD11c+CD123- mDCによって誘導されるTh1分極化を抑制し、TNF-αおよびIL-6レベル、ならびにmDC上のCD40、CD80、CCR7の発現を低下させることにより、IBD患者の上皮の回復を促進した(156, 157)。ラクトバチルス・カゼイ・シロタ株は、T細胞にホーミング分子を刷り込む腸管DCの能力を改善し、IL-22産生を促進することによって、UC患者におけるDCの刺激的役割を回復させた(170, 171)(158)。さらに、Lactobacillus plantarumは、UC患者において変化した腸管DCの機能を回復させた(159)。
6.4 アフェレーシス
選択的顆粒球/単球アフェレーシス(SGMA)は、IBD患者からDCを除去するために試験されている(172)。急性UCでは、リンパ球、pDC、およびmDCのレベルが有意に低いことが判明しているため、アダコラム・アフェレーシス(AA)は寛容性の高い状態をもたらす可能性がある(160)。さらに、AAはIL-10を増加させ、UC患者のmDCとpDCの両方で循環TNF-αとCD16の発現を減少させた(173)。リンパ球タフェレーシスは、これらの患者において臨床的に安全であり、CD83+ DC、IL-6、IL-8のダウンレギュレーションに寄与することが示された(161)。
6.5 ビタミンD
ビタミンDもまた、DCの調節に関与しているようである。実際、ビタミンDの代謝産物は、IBDのような自己免疫疾患に対するDC治療法を開発するためのプロトコールに頻繁に用いられている(174)。ビタミン1,25(OH)2 Dは、少なくとも部分的には、DC活性を低下させ、抗菌ペプチド分泌を誘導し、抗/炎症性サイトカイン比を増加させることにより、IBDの転帰を改善している(152)。ビタミンD3はCD患者の低疾患活動性と正の相関があり、moDCの単球前駆体に対してin vivoで有益な効果を示した(153)。
6.6 糖
これと同様に、ビタミンDの欠乏は、mo-DCをリポ多糖(LPS)で刺激するin vitro実験のデータから、CDの炎症過程に関与していることが示唆されている(162)。逆に、LPSで活性化されたDCをルテオリン誘導体であるGLMで培養すると、炎症性サイトカイン産生やUC由来DCのMHC-II複合体に対する抗原提示能がダウンレギュレートされた(175)。フラクトオリゴ糖のような天然由来の他の分子は、CD患者においてIL-10+、TLR2+、TLR4+ DCの数を有意に増加させ、IL-6+ DCを減少させたが、臨床的な有益性は依然として矛盾している(163, 164)。
6.7 スルフォラファン
もう一つの分子であるスルフォラファンは抗がん作用を持ち(106)、マウスにおけるAMPKシグナル伝達経路の活性化作用により、腸の炎症性疾患の予防や治療に応用されている(176)。
7 結語
DCは、抗原と病原体の両方を取り込んで免疫応答を開始し、二次リンパ系臓器に移動して、そこで最終的にナイーブT細胞に分子を提示し、活性化されるため、自然免疫と適応免疫を結びつけており、生体の免疫恒常性の確立と維持において重要な役割を担っている。この本質的な免疫過程は、腫瘍細胞を殺すためにT細胞の細胞傷害性機構を強化しようとする癌のような多くの疾患の治癒や緩和のための治療介入ツールとして用いられている。逆に、ある条件下では、DCはIBDを含む他の病態における慢性炎症の誘導と維持に重要な役割を果たすことが示されており、DCのいわゆる「陰陽」の役割をもたらしている。
DCだけでなく、好中球、単球、マクロファージなどの他の免疫細胞も腸の炎症性状態を促進することは明らかである。この意味で、単球やマクロファージは、骨髄系の分化段階によって同じマーカーを発現するため、DCサブセットと区別するのが難しい。それでもなお、活性化DCは、CD80、CD86、CD103、CD83、IRF4、TLRなど(これらに限定されない)様々な特性マーカーを発現し、IL-6、IL-8、IL-12、IL-23、TNF-αなどのサイトカインを産生し、免疫系に混乱をもたらし、IBDの進行を促進する、腸の炎症部位に集積していることが判明している。
IBDにおけるDCの役割に関する既存の証拠に基づき、この細胞集団はIBDの良好なバイオマーカーとなりうると強く信じている。実際、in vivoおよびin vitroの実験のほとんどが、DCが貴重な治療標的となりうることを示している。なぜなら、DCの枯渇といくつかのサイトカイン(IL-10やTGF-βなど)の産生は、良好な結果をもたらしているからである。そのためには、腸内の炎症性状態を亢進させる可能性があるため、免疫細胞間のバランスにおいてDCが促進するメカニズムを十分に理解する必要もあるだろう。さらに、いくつかのDCマーカー(CD1c、CD11c、CD123など)の疾患における重要性をより明確にするために、さらなる研究が必要である。さらに、moDCやinfDC、LCの役割はあまり研究されていないが、IBDの病態に重要な役割を果たしている可能性があるため、これらのDCサブセットについても、IBDと癌の両方における臨床的有効性を高める革新的な戦略に到達するために、より多くの研究が必要であろう。
著者の貢献
CJ-C: 執筆-原案、執筆-校閲・編集。FP:執筆-レビューおよび編集。GA: 執筆-校閲・編集。CS-M: ライティング-校閲・編集。LC-M: 執筆-校閲・編集。VS-M: 概念化、監督、執筆-校閲・編集。SL-E:構想、監修、執筆-校閲・編集。
資金提供
著者は、本論文の研究、執筆、および/または出版に関して、いかなる金銭的支援も受けていないことを表明する。
利益相反
著者らは、本研究が、利益相反の可能性があると解釈されるような商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
参考文献
ネスS、リンS、ゴードンJR. 制御性樹状細胞、T細胞寛容、免疫疾患の樹状細胞治療。論文タイトル:Front Immunol (2021) 12:633436.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
パテンテTA、ピーニョMP、オリベイラAA、エヴァンジェリスタGCM、ベルガミ-サントスPC、バーブートJAM。ヒト樹状細胞:その不均一性とがん免疫療法における臨床応用の可能性。論文タイトル:Front Immunol (2018) 9:3176.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Martin-Gayo E, Yu XG. HIV-1感染の自然免疫制御における樹状細胞の役割。論文概要|Cross Immunol (2019) 10:1306.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Nin DS, Deng LW. 癌精巣抗原の生物学と癌におけるその治療的意義。細胞 (2023) 12(6):926.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lopez de Padilla CM, Reed AM. 小児の自己免疫疾患における樹状細胞の関与。小児の自己免疫疾患における樹状細胞の関与。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Brasal-プリエトM、フェルナンデス-プラデスL、Dakhaoui H、ソブリーノF、ロペス-エンリケスS、パロマレスF.食物アレルギーのin vitro診断ツールと治療法のアップデート、栄養素。栄養成分(2023)15(17):3744。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Walker PR, Calzascia T, Tribolet N, Dietrich PY. 脳におけるT細胞免疫応答と大脳悪性腫瘍との関連性。脳におけるT細胞免疫応答と大脳悪性腫瘍との関連。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
自然リンパ球と炎症性腸疾患。この論文では、自然リンパ球と炎症性腸疾患との関連について解説している。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Chrisikos TT, Zhou Y, Slone N, Babcock R, Watowich SS, Li HS. 恒常性、炎症、がんにおける樹状細胞の発生と機能の分子制御。Mol Immunol (2019) 110:24-39. doi: 10.1016/j.molimm.2018.01.014.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Jorgensen N, Persson G, Hviid TVF. 妊娠とがんにおける制御性T細胞の寛容機能。論文タイトル:Front Immunol(2019)10:911.doi:10.3389/fimmu.2019.00911。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Santos PM, Butterfield LH. 樹状細胞ベースのがんワクチン。J Immunol (2018) 200(2):443-9. doi: 10.4049/jimmunol.1701024.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Harari A, Graciotti M, Bassani-Sternberg M, Kandalaft LE. プライミングとブースティングのアプローチにおける抗腫瘍樹状細胞ワクチン接種。Nat Rev Drug Discov (2020) 19(9):635-52. doi: 10.1038/s41573-020-0074-8.
PubMed Abstract|全文|Google Scholar
炎症性腸疾患の治療における樹状細胞介入の新たな役割。BioMed Res Int (2022) 2022:7025634.
PubMed Abstract|全文|Google Scholar
炎症性腸疾患患者におけるプロバイオティクス細菌による免疫調節と寛容原性樹状細胞の生成。この論文では、炎症性腸疾患患者におけるプロバイオティクス細菌による免疫調節と寛容原性樹状細胞の生成について検討した。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Azeem W, Bakke RM, Appel S, Oyan AM, Kalland KH. 単球由来樹状細胞の二重の炎症促進・抗炎症機能。論文タイトル:Front Immunol (2020) 11:438.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Nunez、Rodriguez、MJ、Lebron-Martin、Martin-Astorga、MDC、Palomares、Ramos-Soriano、J、et al. 糖鎖ペプチド免疫療法によって誘導されるメチル化の変化とマウスにおける寛容との関連。この論文では、糖鎖ペプチド免疫療法により誘導されるメチル化の変化と寛容との関連について検討した。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
フコデンドロペプチドはDC-SIGN受容体を介して食物アレルギー患者の免疫系細胞に変化を引き起こす。この論文では、フコデンドロペプチドがDC-SIGNレセプターを介して食物アレルギー患者における免疫系細胞の変化を誘導することを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
RAFキナーゼは安定化し、樹状細胞の分化と機能に必要である。細胞死差異(2020)27(4):1300-15. doi: 10.1038/s41418-019-0416-4
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Eisenbarth SC. T細胞プログラミングにおける樹状細胞サブセット:場所が機能を決定する。Nat Rev Immunol (2019) 19(2):89-103. doi: 10.1038/s41577-018-0088-1
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wculek SK, Cueto FJ, Mujal AM, Melero I, Krummel MF, Sancho D. がん免疫学および免疫療法における樹状細胞。Nat Rev Immunol (2020) 20(1):7-24. doi: 10.1038/s41577-019-0210-z
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
間葉系幹細胞治療は、全身性エリテマトーデス患者においてFLT3LおよびCD1c(+)樹状細胞を誘導する。Nat Commun (2019) 10(1):2498.
PubMed Abstract|クロスリファレンス全文|Google Scholar
de Almeida Baptista MV, da Silva LT, Samer S, Oshiro TM, Shytaj IL, Giron LB, et al. HIV-1感染者における抗レトロウイルス療法抑制下での個別化樹状細胞療法の免疫原性:第II相臨床試験の中間解析。AIDS Res Ther (2022) 19(1):2. doi: 10.1186/s12981-021-00426-z
PubMed Abstract|クロスリファレンス全文|Google Scholar
Mastelic-Gavillet B, Balint K, Boudousquie C, Gannon PO, Kandalaft LE. 個別化樹状細胞ワクチン-最近のブレークスルーと有望な臨床結果。論文タイトル:Front Immunol(2019)10:766.doi:10.3389/fimmu.2019.00766。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ビタミンCは、NF-κBによるエピゲノム再プログラム化を促進し、樹状細胞の免疫原性を高める。Nucleic Acids Res (2022) 50(19):10981-94. doi: 10.1093/nar/gkac941
PubMed Abstract|クロスリファレンス全文|Google Scholar
Tackett N, Bradley JH, Moore EK, Baker SH, Minter SL, DiGiacinto B, et al. 模擬微小重力への長期曝露は樹状細胞の免疫原性を低下させる。Sci Rep (2019) 9(1):13825. doi: 10.1038/s41598-019-50311-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Morante-Palacios O, Fondelli F, Ballestar E, Martinez-Caceres EM. 自己免疫と炎症性疾患における寛容原性樹状細胞。トレンド免疫学(2021)42(1):59-75。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Bertolini TB, Biswas M, Terhorst C, Daniell H, Herzog RW, Pineros AR. 免疫療法と寛容における経口誘導制御性T細胞の役割。細胞免疫学(2021)359:104251. doi: 10.1016/j.cellimm.2020.104251
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Ritprajak P, Kaewraemruaen C, Hirankarn N. 寛容原性樹状細胞の現在のパラダイムと全身性エリテマトーデスに対する臨床的意義。Cells (2019) 8(10):1291. doi: 10.3390/cells8101291.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Palomares F, Gomez F, Bogas G, Campo P, Perkins JR, Diaz-Perales A, et al. pru p 3舌下免疫療法により全身反応を伴う桃アレルギー患者に誘発された免疫学的変化。Mol Nutr Food Res (2018) 62(3). doi: 10.1002/mnfr.201700669.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Guindi C, Cloutier A, Gaudreau S, Zerif E, McDonald PP, Tatsiy O, et al. 寛容原性骨髄由来樹状細胞による表現型とIL-10およびIL-12産生の制御におけるp38 MAPK/C/EBPbeta経路の役割。細胞 (2018) 7(12):256. doi: 10.3390/cells7120256
PubMed Abstract|クロスリファレンス全文|Google Scholar
樹状細胞のサブセットと位置。Int Rev Cell Mol Biol (2019) 348:1-68. doi: 10.1016/bs.ircmb.2019.07.004.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Amon L, Lehmann CHK, Heger L, Heidkamp GF, Dudziak D. The ontogenetic path of human dendritic cells. Dudziak、Mol Immunol (2020) 120:122-9. doi: 10.1016/j.molimm.2020.02.010.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
樹状細胞による抗原提示とCD4+ Tヘルパー細胞応答の指導。細胞分子免疫学(2020)17(6):587-99. doi: 10.1038/s41423-020-0465-0
PubMed Abstract|クロスリファレンス全文|Google Scholar
腫瘍内CD103(+)樹状細胞のTLR3活性化は、抗腫瘍免疫をもたらす腫瘍浸潤を修飾する。論文タイトル:Front Immunol(2019)10:503.doi:10.3389/fimmu.2019.00503。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Bottcher JP, Reis e Sousa C. The role of type 1 conventional dendritic cells in cancer immunity. Trends Cancer (2018) 4(11):784-92. doi: 10.1016/j.trecan.2018.09.001.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ADPリボシル化アジュバントは、粘膜Th17細胞の発達とインフルエンザウイルス感染に対する防御を促進するcDC1細胞の可塑性を明らかにした。Mucosal Immunol (2022) 15(4):745-61.
PubMed Abstract|全文|Google Scholar
Binnewies M, Mujal AM, Pollack JL, Combes AJ, Hardison EA, Barry KC, et al. Unleashing type-2 dendritic cells to drive protective antitumor CD4(+) T cell immunity. Cell (2019) 177(3):556-571 e16. doi: 10.1016/j.cell.2019.02.005.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
成熟段階の異なるCD11b(+)肺樹状細胞はTh17またはTh2分化を誘導する。Nat Commun (2021) 12(1):5029. doi: 10.1038/s41467-021-25307-x
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Moon HG, Kim SJ, Jeong JJ, Han SS, Jarjour NN, Lee H, et al. 気道上皮細胞由来コロニー刺激因子-1はアレルゲン感作を促進する。Immunity (2018) 49(2):275-287 e5. doi: 10.1016/j.immuni.2018.06.009.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
PRR非依存的シグナルおよび依存的シグナルによる樹状細胞におけるIRF4の阻害は、Th2応答を阻害し、Th17応答を促進する。論文番号: Elife (2020) 9:e49416.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Backer RA, Probst HC, Clausen BE. 古典的DC2サブセットと単球由来DC: DC2サブセットと単球由来DC:発生と機能的関係の解明。Eur J Immunol (2023) 53(3):e2149548. doi: 10.1002/eji.202149548.
PubMed Abstract|全文|Google Scholar
Shane HL, Reagin KL, Klonowski KD. 呼吸器環境は抗ウイルスメモリーCD8 T細胞の発達を迂回させる。J Immunol (2018) 200(11):3752-61. doi: 10.4049/jimmunol.1701268.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
CXCR4 の関与による pDC における TLR7 を介した I 型 IFN シグナル伝達の制御-ループス治療の新たな標的。Sci Adv (2019) 5(7):eaav9019. doi: 10.1126/sciadv.aav9019.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
形質細胞様樹状細胞はSARS-CoV-2感染後にI型インターフェロンを産生し、気道上皮細胞におけるウイルス複製を抑制する。
PubMed Abstract|クロスリファレンス全文|Google Scholar
炎症性自己免疫疾患におけるナチュラルキラー細胞。Clin Transl Immunol (2021) 10(2):e1250. doi: 10.1002/cti2.1250.
CrossRef 全文|Google Scholar
表皮の恒常性と乾癬の病態におけるランゲルハンス細胞の役割。J Cell Mol Med (2020) 24(20):11646-55. doi: 10.1111/jcmm.15834.
PubMed Abstract|クロスリファレンス全文|Google Scholar
骨形成タンパク質シグナルは樹状細胞機能の調節を介して皮膚の炎症を制御する。J Allergy Clin Immunol (2021) 147(5):1810-1822 e9. doi: 10.1016/j.jaci.2020.09.038
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pan(潘)H, Zhao(趙)Z, Deng(鄧)Y, Zheng(鄭)Z, Huang(黄)Y, Huang(黄)S, et al.1990年から2019年までの世界、地域、国の早期発症大腸がんの負担と傾向:Global Burden of Disease Study 2019の結果。BMC Public Health (2022) 22(1):1896. doi: 10.1186/s12889-022-14274-7
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
がん統計、2021年。CA Cancer J Clin(2021年)71(1):7-33.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Somarribas Patterson LF, Vardhana SA. がん免疫サイクルの代謝制御。トレンド免疫学(2021)42(11):975-93.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Yi M, Zhang J, Li A, Niu M, Yan Y, Jiao Y, et al. TGF-βとPD-L1を同時に標的とする二特異性抗体YM101の構築、発現、抗腫瘍活性の増強。J Hematol Oncol (2021) 14(1):27. doi: 10.1186/s13045-021-01045-x
PubMed Abstract|クロスリファレンス全文|Google Scholar
Batchu RB, Gruzdyn OV, Kolli BK, Dachepalli R, Umar PS, Rai SK, et al. 卵巣がんの腫瘍微小環境におけるIL-10シグナル。本論文は、IL-10が卵巣癌の微小環境においてどのようなシグナル伝達を担っているかを明らかにしたものである。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
癌治療におけるCTLA-4阻害薬とPD-1阻害薬の併用。J Exp Clin Cancer Res (2019) 38(1):255. doi: 10.1186/s13046-019-1259-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Plesca I, Benesova I, Beer C, Sommer U, Muller L, Wehner R, et al. 膵管腺癌における腫瘍浸潤型樹状細胞と形質細胞様樹状細胞の臨床的意義。膵管腺癌における腫瘍浸潤型樹状細胞と形質細胞様樹状細胞の臨床的意義。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Aggarwal V、Workman CJ、Vignali DAA。第3のチェックポイント阻害剤としてのLAG-3。Nat Immunol (2023) 24(9):1415-22. doi: 10.1038/s41590-023-01569-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ネオアジュバント化学(ラジオ)療法後の直腸癌におけるCTLA-4、CD86および腫瘍浸潤リンパ球の発現パターンと予後値。CTLA-4、CD86、および腫瘍浸潤リンパ球の発現パターン。
PubMed Abstract|クロスリファレンス全文|Google Scholar
李宏(Li H)、劉瑞(Liu SM)、金亮(Jin R)、孟呉(Meng W)、呉YL(Wu YL)、李浩(Li H)。非小細胞肺がんにおけるPD-1/PD-L1遮断療法に対する反応性と、骨髄系細胞とオルタナティブスプライシングに関連する共発現モジュールを組み合わせたリスクスコアは関連する。非小細胞肺癌におけるPD-1/PD-L1遮断効果に関連する骨髄系細胞に関連する共発現モジュールとalternative splicationを組み合わせたリスクスコア。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
固形がんにおける形質細胞様樹状細胞の免疫学: A brief review. Doi: 10.3390/cancers11040470.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ding S, Qiao N, Zhu Q, Tong Y, Wang S, Chen X, et al. Single-cell atlas reveals a distinct immune profile fostered by T cell-B cell crosstalk in triple negative breast cancer. Cancer Commun(Lond)(2023)43(6):661-84。
PubMed Abstract|クロスリファレンス全文|Google Scholar
免疫とがんにおける形質細胞様樹状細胞。J Neuroimmunol (2018) 322:63-73. doi: 10.1016/j.jneuroim.2018.06.012.
PubMed Abstract|RefRef Full Text|Google Scholar
Poropatich K, Dominguez D, Chan WC, Andrade J, Zha Y, Wray B, et al. 腫瘍微小環境におけるOX40+形質細胞様樹状細胞は抗腫瘍免疫を促進する。J Clin Invest (2020) 130(7):3528-42. doi: 10.1172/JCI131992.
PubMed Abstract|クロスリファレンス全文|Google Scholar
ヒトin vivo分化単球由来樹状細胞。Semin Cell Dev Biol (2019) 86:44-9. doi: 10.1016/j.semcdb.2018.02.018.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Lu C, Liu Y, Ali NM, Zhang B, Cui X. 腫瘍微小環境における自然免疫細胞の役割と抗腫瘍療法における研究の進展。Doi:10.3389/fimmu.2022.1039260。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wylie B, Macri C, Mintern JD, Waithman J. Dendritic cells and cancer: from biology to therapeutic intervention. Doi: 10.3390/cancers11040521.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Shahid A, Bharadwaj M. 癌におけるTh17細胞関連サイトカインと癌幹細胞の関連性: 新たな治療標的。Immunol Lett (2019) 213:9-20. doi: 10.1016/j.imlet.2019.07.001.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Bergenfelz C, Leandersson K. The generation and identity of human myeloid-derived suppressor cells. 論文タイトル:「ヒト骨髄由来サプレッサー細胞の発生と正体」(Front Oncol誌、2020年)10:109。
PubMed Abstract|クロスリファレンス全文|Google Scholar
Palazon-Carrion(パラゾン-カリオン)N、Jimenez-Cortegana(ヒメネス-コルテガナ)C、Sanchez-Leon(サンチェス-レオン)ML、Henao-Carrasco(ヘナオ-カラスコ)F、Nogales-Fernandez(ノガレス-フェルナンデス)E、Chiesa(キエーザ)M、他。末梢血の循環免疫バイオマーカーは、進行乳がんの臨床転帰と相関する。Sci Rep (2021) 11(1):17639. doi: 10.1038/s41598-021-93838-w
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
骨髄由来抑制細胞は、CCL11によってERKおよびAKTシグナルを活性化し、腫瘍細胞の上皮間葉転換を誘導することで、肺がん転移を促進する。この論文では、CCL11がERKおよびAKTシグナルを活性化し、腫瘍細胞の上皮間葉転換を誘導することにより、肺がんの転移を促進することを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Himenez-Cortegana、Palazon-Carrion N、Martin Garcia-Sancho A、Nogales-Fernandez E、Carnicero-Gonzalez F、Rios-Herranz E、他:難治性/再発性びまん性大細胞型B細胞リンパ腫における免疫学的バイオマーカーとしての循環骨髄由来抑制細胞と制御性T細胞:R2-GDP-GOTEL試験のトランスレーショナルリザルト。J Immunother Cancer (2021) 9(6):e002323. doi: 10.1136/jitc-2020-002323.
PubMed Abstract|RefRef Full Text|Google Scholar
樹状細胞ワクチン: 従来のアプローチから新世代へのシフト。細胞 (2023) 12(17):2147.
パブコメ要旨|全文|Google Scholar
Noubade R, Majri-Morrison S, Tarbell KV. Beyond cDC1:がん免疫におけるDCクロストークの新たな役割。論文タイトル:Front Immunol (2019) 10:1014.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wculek SK、Amores-Iniesta J、Conde-Garrosa R、Khouili SC、Melero I、Sancho D.死滅腫瘍抗原を有する天然マウス従来の1型樹状細胞による効果的ながん免疫療法。J Immunother Cancer (2019) 7(1):100. doi: 10.1186/s40425-019-0565-5
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Kuhn NF, Lopez AV, Li X, Cai W, Daniyan AF, Brentjens RJ. CD40L過剰発現CAR T細胞の抗腫瘍機能改善には、CD103(+)cDC1と内因性CD8(+)T細胞が必要である。Nat Commun (2020) 11(1):6171. doi: 10.1038/s41467-020-19833-3
PubMed Abstract|クロスリファレンス全文|Google Scholar
BATF3依存性樹状細胞は、細菌感染組織においてエフェクターT細胞応答と制御性T細胞応答の両方を促進する。PloS Pathog (2019) 15(6):e1007866. doi: 10.1371/journal.ppat.1007866.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
効果的なCD4 T細胞のプライミングには、リンパ節進入時にCD301b(+)移動性cDC2細胞によるレパートリースキャンが必要である。この論文では、CD4 T細胞のプライミングにCD301b(+)移動性cDC2細胞のレパートリースキャンが必要であることを示した。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
cDC1はCD4(+)T細胞にプライムされ、抗腫瘍免疫を誘導するためにCD4(+)T細胞にライセンスされる。Nature (2020) 584(7822):624-9. doi: 10.1038/s41586-020-2611-3.
PubMedアブストラクト|全文|Google Scholar
Basu A, Ramamoorthi G, Jia Y, Faughn J, Wiener D, Awshah S, et al. 乳癌における免疫療法: 現状と今後の方向性。doi: 10.1016/bs.acr.2019.03.006.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Johdi NA, Sukor NF. 大腸がん免疫療法:選択肢と戦略。Doi:10.3389/fimmu.2020.01624。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
腫瘍浸潤樹状細胞とナチュラルキラー細胞の細胞および遺伝子シグネチャーは神経芽腫の予後を予測する。Nat Commun (2020) 11(1):5992. doi: 10.1038/s41467-020-19781-y
PubMed Abstract|クロスリファレンス全文|Google Scholar
Szpor J, Streb J, Glajcar A, Fraczek P, Winiarska A, Tyrak KE, et al. 樹状細胞は乳がんの予後と生存に関連する。Diagnostics(バーゼル)(2021)11(4):702。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Sanchez-Leon ML, Jimenez-Cortegana C, Cabrera G, Vermeulen EM, de la Cruz-Merino L, Sanchez-Margalet V. 腫瘍微小環境における樹状細胞ベースのワクチンの効果: 骨髄由来サプレッサー細胞への影響。論文タイトル:Front Immunol(2022)13:1050484.doi:10.3389/fimmu.2022.1050484.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
PD-1/PD-L1経路:がんにおける現在の研究。Am J Cancer Res (2020) 10(3):727-42.
PubMed Abstract|Google Scholar
Hossain DMS, Javaid S, Cai M, Zhang C, Sawant A, Hinton M, et al. Dinaciclibは免疫原性細胞死を誘導し、抗PD1による腫瘍抑制を増強する。J Clin Invest (2018) 128(2):644-54. doi: 10.1172/JCI94586.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
レンバチニブ+抗PD-1抗体併用療法は、腫瘍関連マクロファージの減少とインターフェロン経路の活性化を介してCD8+ T細胞を活性化する。PloS One (2019) 14(2):e0212513. doi: 10.1371/journal.pone.0212513.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Garris CS, Arlauckas SP, Kohler RH, Trefny MP, Garren S, Piot C, et al. 抗PD-1がん免疫療法の成功には、サイトカインIFN-γとIL-12が関与するT細胞と樹状細胞のクロストークが必要である。Immunity (2018) 49(6):1148-1161 e7. doi: 10.1016/j.immuni.2018.09.024.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Giovanelli P, Sandoval TA, Cubillos-Ruiz JR. 腫瘍における樹状細胞の代謝と機能。Trends Immunol (2019) 40(8):699-718. doi: 10.1016/j.it.2019.06.004.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
腫瘍微小環境におけるVEGFシグナルによる樹状細胞抑制における低酸素の役割:機序と応用。Am J Cancer Res (2021) 11(8):3777-93.
PubMed Abstract|Google Scholar
肝細胞癌に対する抗VEGF/TKI療法と免疫療法の併用:現状と今後の展望。Hepatobil Surg Nutr (2021) 10(2):241-5. doi: 10.21037/hbsn-20-707.
CrossRef 全文|Google Scholar
Bent EH, Millan-Barea LR, Zhuang I, Goulet DR, Frose J, Hemann MT. 微小環境IL-6は、細胞毒性化学療法によって生じる抗がん免疫応答を阻害する。Nat Commun (2021) 12(1):6218. doi: 10.1038/s41467-021-26407-4
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Manore SG, Doheny DL, Wong GL, Lo HW. 乳癌転移におけるIL-6/JAK/STAT3シグナル:生物学と治療。論文概要] 乳癌転移におけるIL-6/JAK/STAT3シグナル伝達:生物学と治療.
パブコメ抄録|クロスリファレンス全文|Google Scholar
IL-6/STAT3 は肝細胞癌の有望な治療標的である。この論文では、IL-6/STAT3が肝細胞癌の有望な治療標的であることを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
IL-10、TGF-β、IL-4、IL-35の腫瘍促進作用: がん免疫療法におけるその意義。SAGE Open Med (2022) 10:205031211069012.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
インターロイキン10シグナルを標的としたがん免疫療法は、有望かつ複雑な課題である。Hum Vaccin Immunother (2020) 16(10):2328-32. doi: 10.1080/21645515.2020.1717185.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
インターロイキン10の抑制は、慢性リンパ性白血病におけるT細胞の抗腫瘍免疫およびチェックポイント阻害に対する反応を増強する。白血病(2021)35(11):3188-200.
PubMed Abstract|全文|Google Scholar
Th17誘導自己樹状細胞ワクチン接種は、卵巣がん患者において抗原特異的細胞性免疫および体液性免疫を促進する。Nat Commun (2020) 11(1):5173. doi: 10.1038/s41467-020-18962-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Liau LM, Ashkan K, Tran DD, Campian JL, Trusheim JE, Cobbs CS, et al. 新たに診断された膠芽腫における自己樹状細胞ワクチンの大規模第3相臨床試験からの生存に関する最初の結果。J Transl Med (2018) 16(1):142. doi: 10.1186/s12967-018-1507-6
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Esmaily M, Masjedi A, Hallaj S, Nabi Afjadi M, Malakotikhah F, Ghani S, et al. CTLA-4の遮断は樹状細胞ワクチンの抗腫瘍反応誘導能を高める。J Control Release (2020) 326:63-74. doi: 10.1016/j.jconrel.2020.06.017.
PubMed Abstract|クロスリファレンス全文|Google Scholar
樹状細胞ワクチン接種後の逐次抗PD1療法は、HER2乳腺がんモデルにおける生存を改善し、応答を媒介するCD4 T細胞の重要な役割を特定する。論文タイトル:Front Immunol (2019) 10:1939.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
体外で作製したCD103(+)樹状細胞を用いた原発性がんおよび転移性がんに対するワクチンの有効性。J Immunother Cancer (2020) 8(1):e000474. doi: 10.1136/jitc-2019-000474.
PubMed Abstract|全文|Google Scholar
Johnson P, Rosendahl N, Radford KJ. がん治療薬としての従来型1型樹状細胞(cDC1):課題と機会。専門家の意見 Biol Ther (2022) 22(4):465-72。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Bol KF, Schreibelt G, Rabold K, Wculek SK, Schwarze JK, Dzionek A, et al. 天然循環樹状細胞に基づくがん免疫療法の臨床応用。J Immunother Cancer (2019) 7(1):109. doi: 10.1186/s40425-019-0580-6
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Baldin AV, Savvateeva LV, Bazhin AV, Zamyatnin AA Jr. Dendritic cells in anticancer vaccination: rationale for ex vivo loading or in vivo targeting. DEMS: DEMS, DEMA, DEMA, DEMA, DEMA, DEMA, DEMA, DEMA, DEMA, DEMA, DEMA, DEMA, DEMA, DEMA, DEMA, DEMA.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chiang CL, Kandalaft LE. In vivoがんワクチン接種: どの樹状細胞をどのように標的とするか?Cancer Treat Rev (2018) 71:88-101. doi: 10.1016/j.ctrv.2018.10.012.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
アデノシン受容体拮抗薬とCD73阻害剤を用いた樹状細胞ベースの治療用がんワクチンの有効性の向上。Tumour Biol (2017) 39(3):1010428317695021.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
アジュバントTLR4結合60S酸性リボソームタンパク質P2と免疫チェックポイント阻害剤を用いたDCベースワクチンの改良。Cancer Immunol Immunother (2021) 70(4):1075-88. doi: 10.1007/s00262-020-02759-6.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wang Y, Petrikova E, Gross W, Sticht C, Gretz N, Herr I, et al. スルフォラファンは、制御分子、JAK/STAT3およびマイクロRNAシグナルの調節を通じて樹状細胞刺激能を促進する。論文タイトル:Front Immunol (2020) 11:589818.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
炎症性腸疾患における精密医療。Diagnostics (Basel) (2023) 13(17):2797.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
クローン病の炎症と再発の病態生理。Doi: 10.1186/s13062-020-00280-5.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Seyedian SS、Nokhostin F、Malamir MD。炎症性腸疾患の診断、予防、治療法に関する総説。J Med Life (2019) 12(2):113-22. doi: 10.25122/jml-2018-0075.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ardizzone A, Mannino D, Capra AP, Repici A, Filippone A, Esposito E, et al. Ulva pertusa on Colitis in Mice: Modulation of the Pain and Immune System. (2023)21(5):298.doi:10.3390/md21050298.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Feuerstein JD, Moss AC, Farraye FA. 潰瘍性大腸炎。Mayo Clin Proc (2019) 94(7):1357-73. doi: 10.1016/j.mayocp.2019.01.018.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Kelsen JR, Russo P, Sullivan KE. 早期発症炎症性腸疾患。Immunol Allergy Clin North Am (2019) 39(1):63-79. doi: 10.1016/j.iac.2018.08.008.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sun Q, Lu Z, Ma L, Xue D, Liu C, Ye C, et al. インテグリンβ6の欠損は、マクロファージの分極を変化させることにより、実験的大腸炎および大腸炎関連がんからマウスを保護する。論文タイトル:Front Oncol (2023) 13:1190229.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
マクロファージは腸の炎症と病態の改善に関与しており、IBDの治療標的となりうる。Nat Rev Gastroenterol Hepatol (2019) 16(9):531-43. doi: 10.1038/s41575-019-0172-4.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Smrekar N, Drobne D, Smid LM, Ferkolj I, Stabuc B, Ihan A, et al. 炎症性大腸粘膜における樹状細胞プロファイルは、炎症性腸疾患における腫瘍壊死因子α阻害薬に対する反応を予測する。Radiol Oncol (2018) 52(4):443-52. doi: 10.2478/raon-2018-0045.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Radwan P, Radwan-Kwiatek K, Tabarkiewicz J, Radej S, Rolinski J. 活動性クローン病および潰瘍性大腸炎患者由来の単球由来樹状細胞の表現型および機能的成熟の亢進。J Physiol Pharmacol (2010) 61(6):695-703.
PubMed Abstract|Google Scholar
Huang B, Chen Z, Geng L, Wang J, Liang H, Cao Y, et al. Mucosal profiling of pediatric-onset colitis and IBD reveals common pathogenics and therapeutic pathways. Cell (2019) 179(5):1160-1176 e24. doi: 10.1016/j.cell.2019.10.027.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
陳SL、李CM、李W、劉QS、胡SY、趙MY、他:潜在的治療標的であるオートファジーが腸の炎症を制御する仕組み。論文タイトル:「オートファジーは腸の炎症を制御するか?
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
樹状細胞におけるAtg16l1。樹状細胞におけるAtg16l1は、マウス大腸炎における抗菌防御およびオートファジーに必要である。IUBMB Life (2020) 72(12):2686-95. doi: 10.1002/iub.2406
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
潰瘍性大腸炎におけるリンパ球浸潤と主要発現遺伝子。Med (Baltimore) (2020) 99(35):e21997. doi: 10.1097/MD.00000000021997.
CrossRef 全文|Google Scholar
大腸と血液の単一細胞解析から、潰瘍性大腸炎とクローン病の免疫細胞シグネチャーが明らかになった。消化器病学(2020)159(2):591-608 e10. doi: 10.1053/j.gastro.2020.04.074
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
潰瘍性大腸炎およびクローン病患者の腸管粘膜および腸間膜リンパ節における単核食細胞の単細胞タンパク質およびRNA発現解析。細胞(2020)9(4):813.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Richter、Landsverk OJB、Atlasy N、Bujko A、Yaqub S、Horneland R、et al. Transcriptional profiling reveals monocyte-related macrophages phenotypically resembically DC in human intestine. Mucosal Immunol (2018) 11(5):1512-23. doi: 10.1038/s41385-018-0060-1.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Li C, Grider JR, Murthy KS, Bohl J, Rivet E, Wieghard N, et al. 上皮下筋線維芽細胞における小胞体ストレスは、クローン病における線維化を制御するTGF-β1活性を増加させる。Inflamm Bowel Dis (2020) 26(6):809-19. doi: 10.1093/ibd/izaa015
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Ghorbaninejad M, Abdollahpour-Alitappeh M, Shahrokh S, Fayazzadeh S, Asadzadeh-Aghdaei H, Meyfour A. TGF-β受容体I阻害剤は、炎症を起こした腸上皮細胞におけるEMTの誘導を制限する可能性がある。この論文では、TGF-β受容体I阻害剤が、炎症性腸管上皮細胞におけるEMTの誘導を抑制する可能性を示した。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Vulliemoz M, Brand S, Juillerat P, Mottet C, Ben-Horin S, Michetti P. 炎症性腸疾患におけるTNFα遮断薬:実践的推奨とユーザーズガイド:最新版。消化(2020)101 Suppl 1:16-26.
PubMedアブストラクト|全文|Google Scholar
TNFはIL-22の生物学的利用能を制限することにより、大腸炎における腸管組織の修復を妨げる。Mucosal Immunol (2022) 15(4):698-716.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
バイオインフォマティクス解析によるクローン病の免疫細胞浸潤と有効な診断バイオマーカーの同定。バイオインフォマティクス解析によるクローン病の免疫細胞浸潤と有効な診断バイオマーカーの同定。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Garo LP, Ajay AK, Fujiwara M, Beynon V, Kuhn C, Gabriely G, et al. Smad7は腸の炎症と自己免疫における免疫調節性PDL2/1-PD1シグナルを制御している。Cell Rep (2019) 28(13):3353-3366 e5. doi: 10.1016/j.celrep.2019.07.065
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ブドウ球菌属における還流ポンプ遺伝子norAの発現と多様性。(2022年)23(23):15306.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Dvornikova KA, Platonova ON, Bystrova EY. 炎症性腸疾患:ヒスタミン、免疫、疾患のクロストーク。Int J Mol Sci (2023) 24(12):9937.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Paeoniflorinは樹状細胞を介したT(H)17/T(reg)バランスの調節により潰瘍性大腸炎を改善する。炎症薬理学(2020)28(6):1705-16. doi: 10.1007/s10787-020-00722-6
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Neurath MF. 炎症性腸疾患および大腸がんにおけるIL-23。Cytokine Growth Factor Rev (2019) 45:1-8. doi: 10.1016/j.cytogfr.2018.12.002.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
潰瘍性大腸炎とクローン病患者におけるCD83(+)樹状細胞の存在と数の違い。SciRep(2020)10(1):10055.doi:10.1038/s41598-020-67149-5.SciRep(2020)10(1):10055.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
炎症性腸疾患の新たな治療標的としてのRIPK2。本庶 秀之, 渡辺 哲也, 鎌田 浩一, 皆賀 浩一, 工藤 正俊: 炎症性腸疾患の新たな治療標的としてのRIPK2.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
炎症性腸疾患治療のための新規RIPK2阻害剤の発見。生化学薬理学(2023)214:115647.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
潰瘍性大腸炎に関連する遺伝子シグネチャーの同定と大腸がんにおける免疫浸潤との関連。本論文は、潰瘍性大腸炎に関連する遺伝子シグネチャーと大腸がんにおける免疫浸潤との関連を明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
潰瘍性大腸炎とクローン病における喫煙の相反する影響は、樹状細胞に対する影響の差によって説明できるかもしれない。Inflamm Bowel Dis (2014) 20(5):800-10. doi: 10.1097/MIB.000000000018
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Kramer M, Netea MG, de Jong DJ, Kullberg BJ, Adema GJ. NOD2 3020insC変異を有するクローン病患者における樹状細胞機能の障害。J Leukoc Biol (2006) 79(4):860-6.
PubMed Abstract|RefRef Full Text|Google Scholar
樹状細胞の機能と腸疾患との関連。細胞 (2021) 10(3):583.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
腸間膜リンパ節における単核食細胞のトランスクリプトーム解析と高次元表現型マッピングから、潰瘍性大腸炎とクローン病の違いが明らかになった。クローン病性大腸炎(2020)14(3):393-405. doi: 10.1093/ecco-jcc/jjz156
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
炎症性腸疾患の病因と治療におけるIL-23の役割。Int J Mol Sci (2023) 24(12):10172.
パブコメ抄録|全文|Google Scholar
カプールK、エイッサN、ツシクディD、バーンスタインCN、ギアJE。クロモファンギン直腸内投与が大腸炎症状態におけるさまざまな免疫区画の樹状細胞関連マーカーに及ぼす影響。(2021年) 27(47):8138-55. doi: 10.3748/wjg.v27.i47.8138.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Toll様受容体と炎症性腸疾患。Doi: 10.3389/fimmu.2018.00072.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Volarevic V, Zdravkovic N, Harrell CR, Arsenijevic N, Fellabaum C, Djonov V, et al. Galectin-3 regulates indoleamine-2,3-dioxygenase-dependent cross-talk between colon-infiltrating dendritic cells and T regulatory cells and may represent a valuable biomarker for monitoring the progression of ulcerative colitis. Cells (2019) 8(7):709.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
炎症反応におけるガレクチン-1駆動回路の組織特異的制御(Cutine AM, Bach CA, Veigas F, Merlo JP, Laporte L, Manselle Cocco MN, et al. グリコバイオロジー(2021)31(8):891-907.
パブコメ抄録|全文|Google Scholar
炎症性腸疾患における細胞治療。薬理学研究(2021)163:105247.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Luzentales-Simpson M、Pang YCF、Zhang A、Sousa JA、Sly LM。Vedolizumab:炎症性腸疾患における病的炎症を抑制する作用機序の可能性。論文タイトル:「ヴェドリズマブ:炎症性腸疾患における病的炎症抑制作用の可能性」。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Deng L, Ding W, Granstein RD. サリドマイドはランゲルハンス細胞による腫瘍壊死因子α産生および抗原提示を阻害する。J Invest Dermatol (2003) 121(5):1060-5. doi: 10.1046/j.1523-1747.2003.12565.x.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
クローン病に対する顆粒球コロニー刺激因子治療の成功は、循環インターロイキン10産生T細胞の出現と形質細胞様樹状細胞の増加と関連している。臨床免疫学 (2009) 155(3):447-56. doi: 10.1111/j.1365-2249.2008.03799.x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
グルココルチコイド受容体は潰瘍性大腸炎における樹状細胞機能を調節する。楊X.庚J.孟H. Histol Histopathol (2020) 35(12):1379-89. doi: 10.14670/HH-18-241.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Nielsen OH, Rejnmark L, Moss AC. 炎症性腸疾患の自然史におけるビタミンDの役割。J Crohns Colitis (2018) 12(6):742-52. doi: 10.1093/ecco-jcc/jjy025.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Bartels LE, Bendix M, Hvas CL, Jorgensen SP, Agnholt J, Agger R, et al. 経口ビタミンD3補充は、クローン病患者における単球由来樹状細胞の成熟およびサイトカイン産生を低下させる。炎症薬理学(2014)22(2):95-103.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Prins MMC, Giugliano FP, van Roest M, van de Graaf SFJ, Koelink PJ, Wildenberg ME. チオプリンは腸の治癒におけるオートファジー障害の影響を補正する-ARHGAP18/RhoAの潜在的役割。この論文では、チオプリンが腸管治癒に及ぼすオートファジーの影響を補正すること、すなわちARHGAP18/RhoAの役割を明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
間葉系幹細胞の腹腔内投与は樹状細胞を抑制することでデキストラン硫酸ナトリウム誘発急性大腸炎を改善する。BioMed Pharmacother (2018) 100:426-32. doi: 10.1016/j.biopha.2018.02.060
PubMed Abstract|クロスリファレンス全文|Google Scholar
Thomas S, Metzke D, Schmitz J, Dorffel Y, Baumgart DC. クローン病および潰瘍性大腸炎患者の骨髄性樹状細胞を介したサッカロマイセス・ブーラルディイの抗炎症作用。この論文では、クローン病および潰瘍性大腸炎患者の骨髄系樹状細胞を介したサッカロマイセス・ブーラルディイの抗炎症作用について報告する。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Saccharomyces boulardiiは、腸内細菌叢とその代謝プロファイルを再構築することで、マウス実験的大腸炎を予防する。この論文では、Saccharomyces boulardii(サッカロマイセス・ブラルディ)が腸内細菌叢と代謝プロフィールを再構築することで実験的大腸炎を予防することを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ヒト腸管樹状細胞は潰瘍性大腸炎において、IL-4産生の増加とIL-22およびIFNγの消失を特徴とする異常な腸管特異的t細胞応答を駆動する。Inflamm Bowel Dis (2014) 20(12):2299-307。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Al-Hassi HO, Mann ER, Sanchez B, English NR, Peake ST, Landy J, et al. 潰瘍性大腸炎におけるヒト腸樹状細胞の特性の変化は、ラクトバチルス・プランタルムの細胞外暗号化ペプチドSTpによって回復する。Mol Nutr Food Res (2014) 58(5):1132-43. doi: 10.1002/mnfr.201300596.
PubMed Abstract | CrossRef Full Text | Google Scholar
ワイッツG、ペテルマンS、リーベS、エムリッヒJ、ラムローW. 潰瘍性大腸炎患者における顆粒球および単球吸着アフェレーシスによる樹状細胞の減少。この論文では、潰瘍性大腸炎患者における顆粒球および単球吸着アフェレーシスによる樹状細胞の減少について検討した。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
潰瘍性大腸炎におけるリンパ球タフェレーシスによる抗原提示樹状細胞の減少と機能低下。大腸炎におけるリンパ球タフェレーシスによる抗原提示樹状細胞の枯渇と機能低下.
PubMedアブストラクト|全文|Google Scholar
Bartels LE, Jorgensen SP, Bendix M, Hvas CL, Agnholt J, Agger R, et al. 25-ヒドロキシビタミンD3はクローン病における樹状細胞の表現型と機能を調節する。炎症薬理学(2013)21(2):177-86.
パブコメ抄録|クロスリファレンス全文|Google Scholar
クローン病患者におけるフラクトオリゴ糖の臨床的、微生物学的、免疫学的効果。また、そのような患者を対象とした臨床試験も行っている。
PubMed Abstract|クロスリファレンス全文|Google Scholar
活動性クローン病におけるフラクトオリゴ糖の無作為化二重盲検プラセボ対照試験。腸 (2011) 60(7):923-9. doi: 10.1136/gut.2010.232025
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
樹状細胞の発生と機能の転写制御。Int Rev Cell Mol Biol (2019) 349:55-151. doi: 10.1016/bs.ircmb.2019.10.001.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Fetter K, Weigel M, Ott B, Fritzenwanker M, Stricker S, de Laffolie J, et al. 小児クローン病におけるマイクロバイオームランドスケープと治療的意義。腸内細菌(2023)15(2):2247019.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ベータラクタム系抗生物質は、MAPK/NF-kBシステムを介してヒト樹状細胞の成熟に影響を与える。薬剤に対するアレルギー反応における役割。Toxicol Appl Pharmacol (2015) 288(3):289-99. doi: 10.1016/j.taap.2015.08.001.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Stagg AJ, Hart AL, Knight SC, Kamm MA. 樹状細胞:腸炎におけるその役割と腸内細菌との関係。腸 (2003) 52(10):1522-9. doi: 10.1136/gut.52.10.1522.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Alagon Fernandez Del Campo P, De Orta Pando A, Straface JI, Lopez Vega JR, Toledo Plata D, Niezen Lugo SF, et al. The use of probiotic therapy to modulate the gut microbiota and dendritic cell responses in inflammatory bowel diseases. Med Sci (Basel) (2019) 7(2):33. doi: 10.3390/medsci7020033
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Mann ER, You J, Horneffer-van der Sluis V, Bernardo D, Omar Al-Hassi H, Landy J, et al. 潰瘍性大腸炎における調節不全の循環樹状細胞機能は、プロバイオティクス菌株であるラクトバチルス・カゼイ・シロタによって部分的に回復する。本論文は、潰瘍性大腸炎における循環樹状細胞機能の調節異常を、プロバイオティクス乳酸菌カゼイ シロタ株によって部分的に回復させることを明らかにした。
パブコメ抄録|クロスリファレンス全文|Google Scholar
秦大、馬毅、王毅、侯旭、于立。腸粘膜バリアと疾患に対する乳酸菌の寄与:ラクトバチルス・カゼイの展望と課題。ライフ(バーゼル)(2022)12(11):1910.
パブコメ抄録|全文|Google Scholar
炎症性腸疾患患者に対する非薬理学的選択肢としての選択的顆粒球および単球アフェレーシス。この論文では、炎症性腸疾患患者に対する非薬物療法としての選択的顆粒球および単球アフェレーシスについて解説する。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
潰瘍性大腸炎患者において、腫瘍壊死因子α分泌CD16+抗原提示細胞は顆粒球タフェレシスにより効果的に除去される。この論文は、潰瘍性大腸炎患者において、顆粒球タフェレーシスによりCD16+抗原提示細胞が効果的に除去されることを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Saul L, Mair I, Ivens A, Brown P, Samuel K, Campbell JDM, et al. 1,25-ジヒドロキシビタミンD(3)は、CD31の発現をアップレギュレートすることにより、CD11c(+)樹状細胞のCD4(+)T細胞プライミング能力を抑制する。フロントイムノル(2019)10:600. doi: 10.3389/fimmu.2019.00600
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Kim WS, Song HY, Han JM, Byun EB. 新規ルテオリン誘導体GLMは樹状細胞における炎症反応を抑制する: 潰瘍性大腸炎に対する治療の可能性。Biochem Biophys Res Commun (2019) 518(1):87-93. doi: 10.1016/j.bbrc.2019.08.012.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
天然免疫系増強剤としてのスルフォラファンの可能性: 総説。分子(2021)26(3):752.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
キーワード:樹状細胞、炎症、免疫、がん、炎症性腸疾患
引用 Jiménez-Cortegana、Palomares F、Alba G、Santa-María C、de la Cruz-Merino L、Sánchez-Margalet V、López-Enríquez S(2024) 樹状細胞:疾患進行における陰と陽。Front. Immunol. 14:1321051.
受理された: 2023年10月16日;受理された: 2023年12月12日;
発行:2024年01月04日
編集者
Helena Stabile, ローマ・サピエンツァ大学, イタリア
査読者
Zheng Yuan, 中国医学科学院, 中国
Fabrizio Martelli, 国立衛生研究所(ISS), イタリア
Copyright © 2024 Jiménez-Cortegana, Palomares, Alba, Santa-María, de la Cruz-Merino, Sánchez-Margalet and López-Enríquez. 本記事は、クリエイティブ・コモンズ 表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Carlos Jiménez-Cortegana, cjcortegana@gmail.com; Victor Sánchez-Margalet, margalet@us.es.
これらの著者はシニアオーサーシップを共有している。
免責事項:本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
こんな人も見ています
腎症における炎症バイオマーカーとしてのMCP-1の役割
劉延龍、徐克、翔裕華、馬博燕、李海龍、李元、石岳、李秀樹、白燕
単純虫垂炎と比較した複雑虫垂炎児の虫垂におけるTh17反応の亢進は、微生物による腸内環境の異常と関連している。
サラ・メイ・M・L・ザ、ルネ・R・C・E・シュルールス、アガタ・ドレウニアク、ロエル・バックス、ティム・G・J・デ・マイ、アンドリース・E・ブディング、リンダ・ポルト、ヒュイブ・A・センス、ヒューゴ・A・ハイエ、L・W・アーネスト・ファン・ヘールン、ラモン・R・ゴーター、マドレーヌ・J・バンダーズ
サルコイドーシスのバイオマーカーと分子エンドタイプ:オミックス研究と非オミックス研究からの教訓
ホン・ロン・チー、ナン・マイル・S・シー、チャンドラ・モハン、シッティング・ヤン、クリシャン・G・ジャイン、クン・ソフィア・ザン、ビビアン・ガータン、ランジェン・チャオ
高スループットCRISPR技術:固形臓器移植の新たな展望
李暁漢、張晨、葉偉聡、余智章、張熙、李遠、牛玉青、蘭帥、王宋、羅子龍、趙九鹿、郝洋林、宗俊傑、夏成勲、夏家紅、呉潔
ナノボディ: ウイルス疾患治療への有望なアプローチ
ビトリア・メネゲッティ・ミナテル、カルロス・ロベルト・プルデンシオ、ベネディト・バラヴィエラ、ルイ・セアブラ・フェレイラ・ジュニア
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2024 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
ご利用条件
この記事が気に入ったらサポートをしてみませんか?
