リノール酸高含有食は腸内カンナビノイド系を調節し、マウスの大腸炎感受性を高める
腸内微生物
第15巻 2023年 - 第1号
オープンアクセス
857
閲覧数
0
現在までのCrossRef引用数
171
アルトメトリック
聞く
研究論文
リノール酸高含有食は腸内カンナビノイド系を調節し、マウスの大腸炎感受性を高める
https://www.tandfonline.com/doi/full/10.1080/19490976.2023.2229945

プーナムジョット・デオル
,
ポール・ルーガー
,
ジェフリー・D・ローガン
,
アリ・シャウキ
,
ジャン・リー
,
ジョナサン・D・ミッチェル
すべて表示
論文 2229945|2023年02月08日受理、2023年06月21日受理、オンライン公開:2023年07月03日
引用文献のダウンロード
https://doi.org/10.1080/19490976.2023.2229945
クロスマーク
この記事において
要旨
炎症性腸疾患(IBD)は多因子疾患であり、米国では発症率が増加していることから、食事を含む環境因子が関与していることが示唆されている。食事から摂取しなければならないリノール酸(LA、C18:2オメガ6)の過剰摂取が、ヒトのIBD発症を促進する可能性が示唆されている。LAとIBDの因果関係を証明するために、我々は、IBD感受性IL10ノックアウトマウスを含むいくつかのモデルにおいて、LAが約55%を占める大豆油(SO)をベースとした高脂肪食(HFD)が大腸炎感受性を上昇させることを示した。この効果は、遺伝子組み換え大豆油やオリーブ油由来の低LA HFDでは観察されなかった。従来のSO HFDは、免疫機能障害、腸管上皮バリア透過性の亢進、IBD感受性遺伝子Hepatocyte Nuclear Factor 4α (HNF4α)のアイソフォームのバランスの崩壊など、古典的なIBD症状を引き起こす。SO HFDは、LAを炭素源とする内因性付着性侵入性大腸菌(AIEC)の増加を含む腸内細菌異常症を引き起こす。メタボローム解析から、マウスの腸内では細菌が存在しない場合でも、大豆油の存在によってLA、オキシリピン、プロスタグランジンのレベルが上昇することが示された。IBDを予防するエンドカンナビノイド系の多くの化合物は、in vivoでもin vitroでもSOによって減少する。これらの結果は、高LA食が、オメガ-6およびオメガ-3多価不飽和脂肪酸の生理活性代謝物およびHNF4αアイソフォームのバランスの変化に関与する微生物および宿主主導の経路を介して、大腸炎感受性を増加させることを示している。
キーワード
IBD
PUFAs
大豆油
オリーブ油
オキシリピン
付着性大腸菌
HNF4α
腸内マイクロバイオーム
メタボロミクス
上皮バリア機能
前の記事次の記事
はじめに
炎症性腸疾患(IBD)は多因子性疾患であり、その発症は宿主の遺伝、免疫機能障害、腸内細菌叢、および食事を含む様々な環境因子の影響を受ける。 引用3 大豆油は必須脂肪酸であるリノール酸(LA、C18:2 ω6)を約55%含んでいるが、この多価不飽和脂肪酸(PUFA)はヒトの食事に1~2%kcalしか必要とされない。Citation3,Citation5高LA食は潰瘍性大腸炎およびクローン病Citation6,Citation7発症と正の相関があり、これまでの研究でIBD発症における食事、特に高脂肪・低繊維の欧米食の役割が明らかにされているが、Citation8,Citation9大豆油がIBDを促進するか予防するかについては、相反する報告がある。 Citation10-13さらに、LAおよびその下流代謝物であるアラキドン酸(AA、C20:4 ω6)は、オキシリピンやエンドカンナビノイドなどの生理活性脂質の前駆体であり、IBDとの関連が指摘されているCitation14,Citation15。Citation16-18しかし、IBDの原因因子としての食事性LAは確立されておらず、オキシリピン系とエンドカンナビノイド系の複合的な調節不全が大腸炎に及ぼす影響も十分に定義されていない。
ヒトとマウスのHNF4A遺伝子は高度に保存されており、2つのプロモーター(P1とP2)を持ち、P1アイソフォーム(HNF4α1-6)とP2アイソフォーム(HNF4α7-12)の発現を駆動する。 引用22 HNF4αの全身ノックアウトは胚致死であるが、引用23 P1またはP2由来のHNF4αのみを発現するエクソンスワップマウスは、腸を含む様々な組織におけるHNF4αアイソフォームの役割を研究するのに用いることができる。両方のHNF4αプロモーターは、陰窩の異なる部分ではあるが、小腸と結腸で活性である: P1-HNF4αは大腸陰窩の上部の分化した部分で発現し、P2-HNF4αは陰窩の下半分の増殖コンパートメントで発現する25。α1HMZ(P1-HNF4αのみ発現)およびα7HMZ(P2-HNF4αのみ発現)エクソンスワップマウスは、いずれもストレスのない条件下では健康であるが、低脂肪・高繊維食では、α1HMZオスはα7HMZオスよりもデキストラン硫酸ナトリウム(DSS)誘発性大腸炎を発症しにくいことが以前に示されている25。
腸内細菌叢は腸のホメオスタシスの制御に重要な役割を果たしており、腸内細菌叢の組成の乱れ(dysbiosis)は腸の炎症やIBDを含む様々な腸の病態を引き起こす可能性がある。 引用26-28 注目すべきことに、IBD患者では付着性・浸潤性大腸菌(AIEC)の発生率の増加が報告されており、引用29,引用30 一方、欧米食は遺伝的に感受性の高いマウスにおいて腸内AIECのコロニー形成を増加させる。引用31 我々は最近、ヒトAIECと90%のDNA配列相同性を有する新規マウスAIEC(mAIEC)を単離し、それがマウスの大腸炎を引き起こし、腸の炎症を悪化させることを示した。
我々は以前の研究で、現在のアメリカ人の食事と同様の大豆油を多く含む食事が、腸の大腸陰窩の長さを短くすることを示した。 引用34 本研究では、DSS誘発マウス、IL10ノックアウトマウス、HNF4αエクソンスワップマウスという3つの異なる大腸炎モデルを用いて、大豆油ベースのHFDがIBDの発症に及ぼす影響を調べた。3つのモデルすべてにおいて、LAを多く含むSO食を与えた成体雄で大腸炎感受性の増加が観察された。対照的に、LAを低く抑えた遺伝子組み換え大豆油(プレニッシュ)またはオリーブ油(もともとLAを低く抑えている)からなるHFDでは、それぞれ野生型(WT)マウスまたはIL10ノックアウトマウスの大腸炎感受性は上昇しなかった。我々は、高LA SO食がHNF4αタンパク質レベルだけでなく、腸内細菌叢や宿主および細菌両方のメタボロームにも及ぼす影響など、潜在的な基礎メカニズムを検討した。その結果、SO食それ自体はWTマウスにおいて大腸炎を引き起こさないが、SO食は腸管上皮バリア機能を低下させ、大腸炎感受性の亢進に寄与する可能性があることが示された。また、SO食を与えたマウスの腸内では、mAIECの拡大など、腸内細菌の異常も引き起こした。引用25,引用35,引用36 最後に、宿主の腸内細胞とin vitroで増殖させたSO-mAIECの両方のメタボローム解析から、LAとオキシリピンのレベルの上昇、エンドカンナビノイド系の代謝物とオメガ3エイコサペンタエン酸(EPA)のレベルの低下が、大腸炎感受性に関与していることが示唆された。これらの結果を総合すると、現在のアメリカ人の食生活に類似した大豆油(したがってLA)の多い食事は、IBD発症の素因となる環境因子であり、腸管バリア機能障害、HNF4αアイソフォームの不均衡、腸内細菌異常症、さらにオメガ6とオメガ3の生理活性代謝物の比率の乱れが、単独または複合的に、この影響に寄与している可能性がある。
研究結果
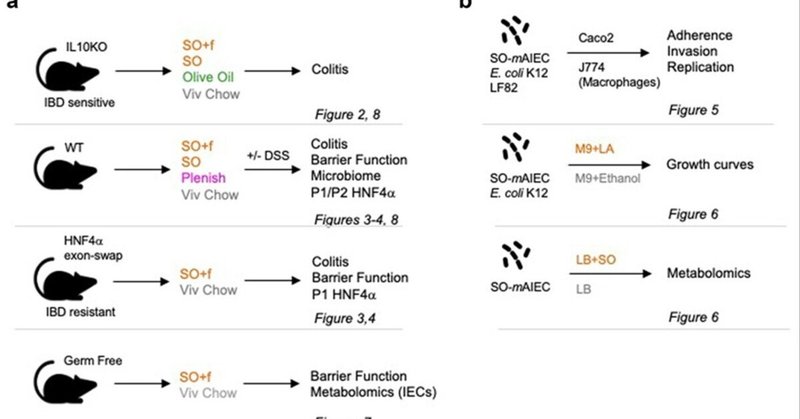
LAを多く含む食事がIBDに罹患しやすいという仮説を検証し、関連する可能性のある因子を特定するために、合計5種類の食事を用いた4つのin vivoモデルと培養細菌を用いた3つのin vitro実験を行った(図1)。
図1. 実験デザイン
注釈 (a) 4つの異なるモデル(C57BL6成体雄)と、高脂肪食(SO+f、大豆油+食物繊維;SO、大豆油;Plenish、低LA大豆油+オリーブ油)、DSS、および/またはリノール酸(LA)の経口投与による指示された処置を用いたin vivo実験。(b) 示した細菌株と哺乳動物細胞(CaCO2、J774)の処理または増殖条件を用いたin vitro実験。各モデルで使用したアッセイと結果を示す図を示す。
フルサイズ表示
LA高含有食はIL-10欠損マウスの大腸炎発症を促進する
IBD感受性遺伝子IL-10とLAの間に相互作用があるかどうかを調べるために、IL-10欠損マウス(IL-10-/-、IL-10 KOとも呼ばれ、軽度の大腸炎を発症する)のB6系統に、低脂肪ビバリウム(Vivarium)チョウ(脂肪13 kcal%、LA4.5 kcal%)または大豆油ベースの高脂肪食(HFD)(脂肪35 kcal%、LA18.6 kcal%)を10週間与えた。SO HFDの脂肪量は、現在のアメリカ食の脂肪量(~40 kcal%)に匹敵するが、一般的なげっ歯類の高脂肪食(~55~60 kcal%)よりは少ない。Citation37,Citation38 高繊維食はIBDに対する予防効果があると考えられているので、Citation39 この大豆油食(SO+f)には、Viv chowの23%の繊維に類似した19%の繊維も含まれていた(補足表S1)。
SO+f食を与えたIL-10-/-マウスは、大腸炎の疾患指標、すなわち7週目からの体重減少と3週目以降の血便の出現が加速された。一方、Viv chowを与えた動物では、わずか9週後に便に血液が認められ、10週後でも体重の有意な減少は見られなかった(図2a,b)。食餌処理開始時の体重は両群とも同程度であったにもかかわらず、SO+f食マウスは犠牲となった時点でViv chow群よりも有意に低い体重を示した(図2a)。SO+f食が高脂肪・高カロリー食であることを考えると、これは注目に値する。両群の結腸の長さは同程度であり、肉眼的な結腸組織学的にも明らかな差は認められなかったが、SO+f群のマウスはViv chow対照群と比較して陰窩の長さが有意に短かった(9.8%減少)(図2cおよび補足図S1A)。WTマウスと比較すると、IL-10-/-マウスではいずれの飼料でも陰窩の長さが伸びており(図2cおよび図3f)、これは以前の研究と一致しているCitation40,Citation41 IL-10-/-マウスではSO+f飼料による小腸全体の長さ(または脾臓重量)への影響は観察されなかった。SO+f食は、WTマウスの他の大豆油食で観察されたのと同様に、これらのマウスにおいて体重に対する肝臓の割合を減少させた(補足図S1B)(未発表データ)。
図2. LA高含有食はIL10-/-マウスの大腸炎感受性を増加させる。IL10-/-マウスにSO+fまたはViv食を10週間与えた。
注 (s)1週間の平均体重と収穫時;収穫時の体重は1週間の体重グラフの最後のデータポイントの数日後である。(b)血球検査。(c)結腸長および陰窩長。スケールバーは400ミクロン。結腸切片を補足図1に示す。 * vs Viv。T検定、P < 0.05 N = 5-12/群。
フルサイズ表示
図3. LA高含有食はWTおよびα1HMZマウスにおいて大腸炎感受性を上昇させ、バリア機能を低下させる。
注釈 (a) Viv chowまたはSO+f食を15週間摂取したWTマウスに、飲料水に2.5%のDSSを6日間投与した:DSS投与マウスの体重減少率、収穫時体重;収穫時体重は週間体重グラフの最後のデータポイントの数日後である。 * vs Viv P < .05, T-test N = 3-4 per group (b) マウスHnf4a遺伝子の模式図。2つのプロモーター(P1とP2)(上)と、α1HMZマウスでP1-HNF4αのみの発現を駆動するエクソンスワップ(1Dから1A)を示す。(c)体重減少率、収穫時体重、* vs α1HMZ Viv P < .05、T-test N = 3-4/群。(d)代表的な大腸組織像。大矢印は免疫浸潤、小矢印は陰窩構造の消失、線はSO+fにおける筋膜の肥厚。スケールバーは400ミクロン。(e)結腸の長さと陰窩の長さ(マウス1匹につき少なくとも10個の陰窩を測定)追加切片を補足図S2および3に示す。一元配置分散分析、Tukey's post-hoc。各群N = 5-12。
拡大表示
LAを多く含む食餌は、WTマウスではDSS誘発大腸炎に対する感受性を増加させ、HNF4αエクソンスワップマウスではDSS誘発大腸炎に対する抵抗性を克服する
過剰量のLAが野生型(WT)動物の大腸炎感受性に影響するかどうかを調べるため、雄性C57BL6/NマウスにSO+f食またはViv chowを15週間与え、その後DSSで処理した。大豆油を多く含むが食物繊維の少ない餌を用いた我々の以前の研究と一致して、引用33,引用34 SO+f食を15週間与えた後、マウスの体重はViv chow対照より有意に増加した(補足図S2A)。15週間飼育後、飲料水に2.5%の黄砂を添加したところ、黄砂投与3日目からSO+f群ではViv chow対照群に比べて体重の減少が観察された(図3a)。収穫時の体重の割合も、SO+f飼料マウスでは有意に低かった(88% vs Viv chowでは98%)(図3a)。
IBD感受性のIL-10-/-モデルと同様に、大豆油がIBD抵抗性の遺伝モデルにおいて大腸炎感受性に影響を与えるかどうかを調べるために、HNF4αのP1アイソフォーム(α1HMZ)のみを発現するHNF4αエクソンスワップマウスを用いて、IBD感受性遺伝子座HNF4αに対するSO+f食の影響を調べた(図3b)。我々は以前、α1HMZ雄性マウスがViv chowでDSS誘発性大腸炎に対して抵抗性を示す一方、HNF4αのP2アイソフォームのみを発現するマウスはDSS処理に対して非常に感受性が高いことを示したCitation25。興味深いことに、SO+f飼料を与えたα1HMZ雄性マウスは、WTマウスの10週齢に対して19週齢までViv chow群と比較して有意な体重増加を示さなかった(補足図S3A vs. 補足図S2A)。2.5%のDSSで6日間処理したところ、α1HMZ SO+f食マウスはViv chowコントロール(1.7%)よりも有意に体重が減少した(10.3%)が(図3c)、SO+f食マウスのDSS処理後の体重減少はWTマウスよりもα1HMZマウスの方がやや少なかった(10.3 vs WTの13%)(補足図S3B)。これらの結果は、我々が以前にViv chowで指摘したα1HMZマウスの感受性の低い表現型と一致している25。
Viv chowまたはSO+f食を与えたDSS処理WTマウスの遠位結腸の組織学的解析から、後者では陰窩構造が広範囲に失われ、粘膜下炎症が増加し、筋膜が肥厚していることが示された(図3d左および補足図S2E)。WTマウスと同様に、α1HMZマウスにDSSを投与すると、Viv chowコントロールと比較して、SO+f食群では陰窩構造の喪失がより大きく、免疫細胞の浸潤がより多かった(図3d右および補足図S3E)。
別のSO HFDで以前に見たように、引用33 SO+f食はWTマウスの結腸長と陰窩長の両方を減少させた。DSS処理により、結腸長はViv chow群とSO+f群の両方でさらに短くなり、後者ではより大きな影響(29%対19%の減少)があった(図3e、左)。陰窩の長さも結腸の長さと同様のパターンを示し、DSS処理により陰窩は両群で短縮したが、SO+fマウスだけが有意差(10.5%減少)を示した(図3e、左)。投与15週後、α1HMZ SO+f投与マウスの結腸長はViv chowコントロールと比較して有意差はなく(8.8 vs 10 cm、P = 0.06)、2つの食餌間で陰窩の長さに差はなかった(図3e、右)。DSS処理後、WTマウスと同様に、SO+f α1HMZマウスの結腸長は有意に減少し(8.8cmから5.1cmへ)、DSS処理Viv chow群(7.4cm)よりも有意に短かった。DSS処理により、SO+f α1HMZマウスの陰窩長も、無処理のSO+f群と比較して有意に減少した(12.5%減少)。しかし、α1HMZマウスでは、WTマウス(図3e、左)と同様に、DSS処理なしのViv chow食とSO+f食の間で、陰窩の長さに有意差は認められなかった(図3e、右)。
免疫機能障害はIBDの重要な症状であるため、WTおよびα1HMZの両マウスについて、無処置(naive)およびDSS処置したViv chowおよびSO+f食マウスの腸管上皮内白血球(IEL)および固有層白血球(LPL)における免疫細胞集団の特徴を調べた。Viv chow食マウスと比較して、DSS処理後のWT SO+fマウスでは腸管LPLにおける好酸球集団の有意な増加が観察されたが(図4a)、未処理マウスや処理・未処理マウスのIELでは観察されなかった(補足図S2C)。対照的に、LPL、IEL、末梢血単核細胞(PBMC)のいずれの免疫細胞集団においても、単球または好中球について、SO+fマウスとViv chow給餌マウスの間に有意差は観察されなかった(図4aおよび2d)。これらの結果を総合すると、Viv飼料を与えた対照マウスよりも、SO+f飼料を与えたマウスの方が、DSS投与による免疫調節異常が大きいことがわかる。免疫細胞分析でも、WTマウスで観察されたプロファイルとは異なるが、SO+f食を与えたα1HMZマウスでは、DSS処理後に免疫細胞が増加することが明らかになった(図4b)。SO+f食では、α1HMZマウスではWTマウスのように固有層内の好酸球の割合は変化しなかったが(図4a)、SO+f食ではLPL集団中の好中球とIEL集団中の単球が有意に増加した(図4b)。WTマウスと同様に、α1HMZマウスでも2つの異なる食餌のPBMCに有意差は観察されず、免疫異常は腸に限局していることが示された(補足図S3C)。これらの結果を総合すると、SO+f食はWTマウスにおいて、免疫細胞の調節異常、結腸および陰窩の長さの減少を含む黄砂誘発性大腸炎に対する感受性を増加させ、これらはすべて大腸炎症の増加と相関している。同じ食事でも遺伝子型によって異なる免疫応答が誘導されるという観察結果は、免疫細胞のリクルートと活性の基礎となるメカニズムが複雑であることを示唆しており、さらなる研究が必要である。
図4. LA高含有食はWTおよびα1HMZマウスにおいて免疫機能障害を増加させ、バリア機能を低下させる。
注 DSS処置したWTマウス(a)またはα1HMZマウス(b)における免疫細胞分析(Eos、好酸球;Mono、単球;Neutro、好中球)(無処置マウスのデータは補足図S2DおよびS3D参照);* vs WTまたはα1HMZ Viv P < .05、各細胞タイプについてVivとSO+fの間でT検定を実施、各群N = 3-4。(c) WTおよびα1HMZマウスにVivまたはSO+fを12週間、あるいはSO+fを8週間摂取させ、その後Vivを4週間摂取させた場合の上皮バリア透過性(WT逆群から外れ値1個を除去)。 * 対Viv、対Vivおよび逆転。P < 0.05、一元配置分散分析、Sidakのpost hoc比較。各群N = 6-22。(d)Viv食またはSO+f食を12週間与えたWTマウス、あるいはSO+f食を8週間与えた後Viv食を4週間与えた(逆転)WTマウスの遠位結腸からの全細胞抽出物(WCE、30μg)のHNF4α免疫ブロット。各レーンには異なるマウスのWCEを含む。P1コントロール-P1-HNF4αを発現するHCT116細胞からの核抽出物;P2コントロール-α7HMZマウスからの核抽出物(WTマウスのブロット全体およびα1HMZマウスのP1ブロットについては補足図S4を参照)。(e)P1およびP2-HNF4α免疫ブロットシグナル(図4dに示す)を、同じブロットのアクチン染色によって決定した総タンパク質に対して正規化した定量化。 P < .05、一元配置分散分析、Tukeyのポストホック比較。各群N = 3-4。
フルサイズ表示
LA高含有食は腸管バリア機能障害を増加させる:大腸HNF4αアイソフォームの役割
IL-10-/-マウス(大腸炎感受性)、DSS in WTマウス(化学的に大腸炎を誘発)、α1HMZマウス(大腸炎になりにくい)という3つの異なるモデルマウスにおいて、SO+f食が大腸炎感受性を増加させることを明らかにした後、FITC-Dextranアッセイを用いて腸管上皮バリア機能を調べることにより、その基礎となるメカニズムを調べた。その結果、12週後、SO+f食は、WTマウスとα1HMZマウスの両方で、上皮透過性(血清中のFITC-デキストランの増加によって決定される)を有意に増加させた(図4c)。このバリア欠損が食餌を変えることで回復するかどうかを調べるため、別のグループのマウスにSO+f食を8週間与え、その後Viv chowを4週間与えた。その結果、WTマウスのバリア透過性は、食餌の変更によって低下する傾向が見られたが、有意な差は認められなかった。一方、α1HMZマウスでは、SO+f食をViv chowに置き換えると、バリア機能が有意に改善した(図4c)。
遠位結腸全細胞抽出液のイムノブロット(IB)解析では、SO+f食を与えたWTマウスの結腸でP2-HNF4αアイソフォームの増加が認められた(図4d,eおよび補足図S4A)。食餌を4週間Viv chowに戻してもP2-HNF4αレベルは有意に減少しなかったことから、SO+f食はHNF4αアイソフォームの腸内発現に持続的な不均衡を引き起こす可能性が示唆された(図4d,e、補足図S4A)。P2-HNF4αアイソフォームのみを発現するマウスでは腸管上皮バリア機能が低下することを以前に報告した(引用25)。対照的に、WT(およびα1HMZ)マウスの遠位結腸におけるP1-HNF4αタンパク質のレベルは、SO+f食によって有意に変化しなかった(図4d,e、補足図S4B,C,D)。これらの結果を総合すると、大豆油に含まれるようなLAを多く含む食餌は、腸におけるP2-HNF4αアイソフォームの発現を増加させ、それによって上皮バリア機能を低下させることによって、部分的に大腸炎への感受性を高める可能性が示唆される。
LA高含有食は腸管mAIECを増加させる
SO食が大腸炎への感受性を高めるもう一つの可能性のあるメカニズムは、腸内細菌叢の変化である。腸内細菌叢を調べると、大豆油(食物繊維無添加、SOと呼ばれる、補足表S1参照)を多く含む食餌は腸上皮細胞に関連する細菌の異常繁殖を引き起こし、特定の大腸菌の系統型の相対的存在量が顕著に増加することが明らかになった(図5a、上部のオレンジ色の部分)。この大腸菌系統型のrRNA ITS領域の一部は、付着性浸潤性大腸菌(AIEC)と100%の配列同一性を有していたため、最近、別のIBD感受性遺伝学的マウスモデル(Citation32)で特徴づけを行い、分離株の表現型の特徴づけを行った(図5b)。Caco2-ブラシボーダー上皮細胞(Caco-2BBE)において、この大腸菌分離株(SO-mAIECと命名)は、非病原性大腸菌K-12と比較して、付着性および浸潤性の増加を示した。引用42 SO-mAIECはまた、マウスマクロファージ(J774A.1)において、大腸菌K-12およびAIEC LF82よりも高い複製を示した。これらの結果から、SO飼料を与えたマウスの腸内で存在量が増加した大腸菌の系統型および分離株は、実際にAIECであり、したがってSO-mAIECと命名され、完全な菌株名はUCR-SoS5であることが確認された。
図5. LAを多く含む餌は、WTマウスの腸内でSO-mAIECの存在量を増加させる。
注 (a)繊維質無添加のViv chowまたはSO食を与えたマウスの小腸および大腸(N = 4-5)の腸上皮細胞(IEC)の細菌種プロット。(b) Viv飼料またはSO+f飼料を与えたマウスのIECにおけるSO-mAIEC相対存在量のlog10と、示したマウスのメタデータとの相関。Spearmanの相関係数(r)(体重および脂肪組織)およびPearsonの相関係数(結腸長)(r)適合度または線形回帰のR2値および相関のP値(P)をグラフに示した。(c)ヒトAIEC LF82および非病原性大腸菌K12と比較した、SOによって濃縮された大腸菌分離株(SO-mAIEC)の表現型の特徴。Caco-2BBe細胞への菌の付着、CaCo-2BBe細胞への細胞内浸潤、およびJ774A.1マウスマクロファージでの複製について、以下のように評価した。 P < 0.05、一元配置分散分析、Tukeyのポストホック比較。4回の実験でN = 12。
フルサイズ表示
興味深いことに、SO-maiecの腸内存在量は、体重および脂肪組織重量と有意な正の相関を示し(図5c)、SO食の肥満誘発特性に関与している可能性が示唆されたCitation33,Citation34。逆に、結腸長はSO-maiecの存在量と緩やかな負の相関を示し(図5c)、この細菌がSO+f食を与えたマウスにおける結腸長の減少にも関与している可能性が浮上した(図3e)。
SO-MaiecはLAを蓄積、利用、代謝する。
SO食とSO-maiecとの関連をさらに調べるため、我々は、大豆油なし(LB)または大豆油あり(LB+SO)の培地でin vitro増殖させたSO-maiecの標的定量的メタボローム解析を行った(図6a)。大豆油はPUFAを多く含むため(~55%のLAと7%のα-リノレン酸、ALA、C18:3 ω3)、オキシリピン、エンドカンナビノイド、N-アシルエタノールアミン(NAE)などのPUFAの生理活性代謝物を測定するプラットフォームを用いた。主成分分析(PCA)の結果、大豆油の非存在下または存在下で生育させたSO-mAIECで 得られたプロファイルには、6サンプル中5サンプルで顕著な違いが見られた(図6a)。この差は主に、オメガ6系LAとオメガ3系ALAおよびそれらのエポキシ誘導体のレベルが1つのクラスター成分に合体したもの(クラスター10)と、ALAから誘導されるオメガ3系EPAとその代謝物(クラスター12)に起因するものであった(補足図S5Aおよび補足表S3)。大豆油存在下で生育させたSO-mAIECでは、対照培地に比べてLAおよびALAのレベルが有意に増加し(図6b)、LAの3つのオキシリピン代謝物(9-KODE、9,10-EpOMEおよび12,13-EpOME)のレベルも増加した(図6c)。これらのLA由来化合物はいずれも、細菌を欠失させた増殖培地(補足図 S5C)ではレベルに有意差を示さなかったことから、これらの結果は、SO-mAIEC分離株が大豆油からLAを蓄積・代謝できることを示唆している。
図 6. 試験管内で培養したSO-mAIECにおいて、大豆油はオキシリピンを増加させ、エンドカンナビノイド系代謝物を減少させる。
注釈 (a)培地にSOを添加または無添加で培養したSO-mAIECにおけるオキシリピンとエンドカンナビノイド/NAE代謝物の実験ワークフローと主成分分析(PCA)。培地中にSOを含むか含まないかでin vitro培養したSO-mAIECで測定した脂肪酸(b)、オキシリピン代謝産物(c)、エンドカンナビノイド系代謝産物(d)および(e)プロスタグランジンの絶対量。*P<0.05、T検定。各群N = 6。(f)LA、エタノール、またはグルコースを炭素源とした最小必須培地(M9)で増殖させたSO-mAIECと大腸菌K-12の増殖曲線。*P<0.05、T-検定。N=3反復/培養。補足図S6参照。
フルサイズ表示
LAから直接誘導されるNAE(リノールエタノールアミド、LEA)、ALA(α-リノレンエタノールアミド、aLEA)、DHA(ドコサヘキサエンエタノールアミド、DHEA)のレベルは、大豆油の非存在下または存在下で培養したSO-mAIECで有意差はなかった(補足表S4)。しかし、エンドカンナビノイドであるアナンダミド(アラキドノイルエタノールアミド、AEA)および近縁のNAEであるジホモ-γ-リノレンエタノールアミド(DGLEA)、エイコサペンタエノイルエタノールアミド(EPEA)、オレイルエタノールアミド(OEA)、 ステアロイルエタノールアミド(SEA)、パルミトイルエタノールアミド(PEA)、パルミトレオイルエタノールアミド(POEA)、およびN-オレイルグリシン(NOGLY)は、大豆油存在下で増殖したSO-mAIECではすべて有意に減少した(図6d)。対照的に、プロスタグランジンPGF3aはSO-mAIECで増加している(図6e)。
SO-mAIECがLAをエネルギー源として利用できるかどうかを調べるため、エタノール(ビヒクル)またはLAを唯一の炭素源として添加した最小培地(M9)でSO-mAIECを増殖させた。SO-mAIECはLA存在下で著しく増殖したが、非病原性大腸菌K12は全く増殖しなかった(図6f)。最初のK12培養の生存性は、4時間後にLA(およびエタノール)培養だけでなく、平行培養にもグルコースを添加して確認した(図6fおよび補足図S5D)。これらの結果は、LAが大腸菌K12の増殖を阻害している可能性を示唆しており、LAがプロバイオティクス乳酸菌種を含む多くの微生物に対して静菌的であることを示す発表結果とも一致しているCitation43。実際、マウスにLAを3日間毎日投与した結果、Lactobacillus murinusの存在量の減少を含む糞便微生物叢組成のβ多様性に変化が見られた(補足図S5E)。興味深いことに、病原性ヒトAIECであるLF82もLA存在下では増殖しなかった(補足図S5D)。これは、LF82がSO-mAIECとは異なり、LAが豊富な環境から分離されたわけではないため、SO-mAIECのようにLAを炭素源として利用する能力を持っていない可能性があることから説明できる。
無菌マウスの腸管上皮バリア機能はLA高含有食によって影響を受ける
これまでの結果から、大豆油を多く含む食餌は、少なくともin vitroにおいて、LAオキシリピンのレベルを上昇させ、NAEsとエンドカンナビノイドAEAのレベルを低下させる病原体SO-mAIECの増殖を助長する環境を提供することにより、大腸炎への感受性を誘導する可能性が示唆された。SOによる大腸炎感受性に宿主も関与しているかどうかを調べるため、無菌(GF)マウスを用いた。GFマウスには腸内細菌が存在しないため、高大豆油食に反応して観察されるいかなる影響も宿主に帰することができる。GFマウスは細菌がいないため粘液層が減少していることが知られておりCitation43、そのため黄砂処理中の上皮傷害に対して極めて敏感であるCitation44。そこで、IBD感受性の指標としてFITC-デキストランアッセイを用いて、SO+f食(ただし黄砂処理なし)を与えたGFマウスと通常飼育(Conv)マウスの腸管上皮バリア機能を調べたCitation45。
図4cに示すように、SO+f飼料を12週間摂取させたConvマウスでは、Viv chowコントロールに対してバリア透過性が有意に上昇した。Viv飼料を与えたGFマウスとSO+f飼料を与えたConvマウスのバリア透過性の差は有意ではなかったが(図7a)、GF SO+fマウスの血清中のFITCレベルはConv SO+fマウスよりも有意に高かった(P < 0.005)(補足図S6D)。これらの結果から、Convマウスでは腸内細菌の存在がSO+f食によって誘導されるバリア機能の低下に重要であるが、SO+f食の成分や宿主由来の代謝産物の中には、GFマウスのバリア機能障害を悪化させるものもあることが示唆される。
図7. LA高含有食はバリア機能を低下させ、従来型マウスおよび無菌マウスの腸内のメタボロームを変化させる。
注 (a)12週間Viv chowまたはSO+f食を与えたGFマウスの血中FITC-Dextranで測定した上皮バリア透過性。T検定。各群N = 3-5。ConvとGFのFITCの比較は補足図S6Dを参照。(b)8週間Viv chowまたはSO+f食を与えたConvマウスおよびGFマウスから単離したIECにおけるオキシリピンとエンドカンナビノイド/NAE代謝物のPCA。各群N = 6。(c) B.のメタボロミクスデータの模式図とベン分析。脂肪酸の絶対量(d)、LAからAA(オメガ6)およびALAからEPA(オメガ3)への代謝産物-基質比を示すグラフ(e)、Viv飼料またはSO+f飼料を8週間与えたConvマウスおよびGFマウスのIECで測定したエンドカンナビノイド/NAEsの絶対量(f)。a vs Conv Viv, b vs Conv SO+f, c vs GF Viv P < .05, P = .07 for AA Conv Viv vs GF Viv, One-way ANOVA (Holm-Sidak posthoc)。各群N = 6。補足図S7およびS8参照。
フルサイズ表示
LA高含有食の腸内メタボロームへの影響
腸内メタボロームがSO食の影響を受けるかどうか、また腸内細菌叢が関与しているかどうかを調べるため、Viv chowまたはSO+f食を与えたConvマウスとGFマウスから単離したIECに図6のメタボローム解析を適用した。食餌摂取期間が8週間と短かったのは、それ以降の時点で見られる肥満という交絡因子を排除して、バリア機能障害を引き起こす可能性のある化合物を同定するためである。飼育8週目の時点で、SO+f食を与えたConvマウスは体重と血清FITCの増加を示し始めたところであった。対照的に、GF Viv chowマウスとSO+fマウスの間に体重の差は見られなかった(補足図S6A vs. 補足図S6B)。これは、GFマウスがHFD誘発肥満に抵抗性であることを示す以前の報告と一致する。引用46,引用47 代謝物のPCA分析によると、マウスのマイクロバイオームの状態(ConvまたはGF)に関係なく、2つの食餌群(SO+fおよびViv chow)は互いに分離しており、宿主依存性の影響の概念を補強している(図7b)。この分離に最も寄与した変数は、EPAとドコサヘキサエン酸(DHA)、およびそれらのリポキシゲナーゼ誘導体と可溶性エポキシドヒドロラーゼ誘導体(クラスター1)であった(補足図S6Cおよび補足表S3)。
in vivoでの腸内メタボロームに対する食餌と微生物叢の寄与をより明確にするため、4つの条件から採取したIECで有意に代謝異常がみられた代謝物の比較解析を行った: ConvマウスとGFマウスにはViv chowまたはSO+fを与えた。食餌によって変化した代謝物を解析した結果、Viv chowを与えたConvマウスとSO+fを与えたGFマウスでは、合計27種類の化合物が有意に代謝異常であった(図7c、補足図S7)。合計21の化合物がConvとGFの両方の比較で(そして同じ方向で)調節異常であったことから、それらの蓄積/代謝には細菌ではなく、食餌および/または宿主細胞が関与していることが示唆された。
マイクロバイオームによってレベルが有意に変化する代謝物の解析(Viv chowとSO+f食の両方でConvとGFの比較)では、Viv chowの比較で33、SO+fの比較で18の代謝物が異なることが同定された(図7cおよび補足図S8)。このうち11種類はViv chowとSO+fの両食に共通しており、これらの代謝物については、食餌よりもむしろ腸内細菌叢の有無が決定要因であることが示唆された。注目すべきは、LA、ALA、エイコサペンタエン酸(EPA)の3つの化合物だけが、食餌(Viv chowとSO+fで21の共通代謝物)およびマイクロバイオーム(GFとConvマウスで11の共通代謝物)の両方によって制御されないことである(図7c)。
GFマウスとConvマウスの両方で、LAとALAはSO+fによって増加したが、EPAは減少した(図7d)。興味深いことに、3つの化合物すべてが、Convマウスに比べてGF Viv chowマウスで増加したことから、腸内細菌がこれらの化合物を隔離している可能性が示唆された。LAの炎症性代謝物であるアラキドン酸(AA)は、ConvマウスとGFマウスでLAとALAに類似したプロフィールを示したが、いずれも有意差はなかった(図7d)。オメガ-6(AA:LA)の産物:基質比は、ConvマウスおよびGFマウスともにVivおよびSO食餌で同様であった。しかし、オメガ3(EPA:ALA)の産物:基質比は、ConvマウスおよびGFマウスの両方でSO HFDによってほぼ10倍減少した(補足図S7C)。その結果、オメガ-6:オメガ-3の生成物:基質比はConvマウスおよびGFマウスともにSO食によって大きく増加し(図7e)、SO食によってEPAへのALA代謝が著しく障害されたことが示唆された。
他のNAEも同様に、食餌と腸内細菌叢の両方によって制御されなかった。例えば、EPEA(EPAから誘導)、DHEA(DHAを介してEPAから誘導)、およびPOEA(パルミトレイン酸、C16:1から誘導)はすべて、GFマウスとConvマウスの両方で、またConvマウスとGFマウスの両方で、SO+f食によって減少した(図7f、補足図S7、S8)。これは、LB+SO細菌培養において多くのNAEで観察された顕著な減少と類似している(図6d)。
食餌誘導性大腸炎感受性および腸内細菌異常症におけるLAの役割
大腸炎に対する感受性の亢進が、本当に従来の大豆油の高いLA含量に起因するのかどうかを調べるために、まず、2.5%のDSSで処理したWTマウス(プレニッシュ:油中の7.42%LA、HFD中の2.6kcal%LA vs SO HFD中の19kcal%LA、補足表S1)において、LA含量の低い遺伝子組み換え大豆油を用いた等カロリーHFDの影響を調べた。その結果、プレニッシュを与えたマウスはSOを与えたマウスに比べて体重減少が少なく、免疫浸潤や陰窩細胞の損傷を含む結腸の形態学的変化が少なかった(図8(a,b))。これらの結果は、オリーブ油を含むHFDを与えたIL-10欠損マウスの疾患活動性指数(補足表S2)がSO HFDに比べて低下したことと一致している。特筆すべきことに、オリーブ油高含有食は、LAが4.5kcal%であるのに対し、Viv chowでは3.3kcal%(補足表S1)と、Plenishの脂肪酸組成と類似しており、低脂肪Viv chowの疾患活動性指数と本質的に同じである(図8c)。
図8. 腸内細菌叢に対するLAの影響。
注 Viv chow、SOまたはPL飼料を12週間摂取したWTマウスに2.5%DSSを6日間投与し、その後3日間回復させた:DSS投与マウスの体重減少率(a)および大腸組織像(b)。大矢印は免疫浸潤、小矢印は陰窩構造の消失、スケールバーは400ミクロン。追加切片を補足図9に示す。 (c) 指示した食餌を6週間与えた後の疾患活動性指数(DAI)。DAIスコアの詳細は補足表2を参照。 * vs Viv、a vs 未処理のWT Viv、b vs 未処理のWT SO+f。T検定、P < .05 N = 5-12/群。
フルサイズ表示
SO+f食の食物繊維であるイヌリンがIBDに与える影響については曖昧な結果を示した研究もあるため、引用48-51 IL-10-/-マウスにも食物繊維を欠いた等カロリーSO食(脂肪35kcal)を6週間与え、その後疾患活動性指数を評価した(補足表S2)。その結果、食物繊維の有無にかかわらず、2つのSO食の疾患活動指数はほぼ同じであり、いずれもViv chowを与えたマウスの疾患活動指数より有意に大きかった(図8c)。
考察
LA(C18:2オメガ6)が50%以上を占める大豆油は、現在、米国で最も多く消費されている食用油であり、世界で2番目に多く生産されている食用油であるCitation2,Citation52。LAのような不飽和脂肪酸だけでなく飽和脂肪酸も多く含む食事がIBDの病態生理に関与していることが知られるようになってきているがCitation1,Citation6,Citation7、根本的なメカニズムについては比較的知られていない。ここで我々は、必須脂肪酸LAが1日の最低必要量をはるかに超える大豆油をベースとしたHFDが、マイクロバイオーム、オメガ6とオメガ3の生物活性代謝産物のバランス、IBD感受性遺伝子HNF4αに影響を与える複雑なメカニズムを介して、マウスの大腸炎感受性を増加させることを示した。
いくつかの異なるin vivo大腸炎モデルとin vitro細胞ベースアッセイを用いて、大豆油をベースとしたHFDの摂取が以下のことを初めて証明した: (i)付着性浸潤性大腸菌(AEIC)を増加させる。(ii)宿主および細菌細胞の両方において、炎症性LA由来のオキシリピンを増加させ、宿主においてはアラキドン酸(AA)やプロスタグランジンなどの他のLA代謝産物を増加させる; (v)結腸内のP2-HNF4αのレベルを増加させ、(vi)腸上皮バリア透過性を増加させ、(vii)体重減少、結腸および陰窩の長さの変化、結腸形態の崩壊など、結腸炎に典型的なその他の表現型の変化を引き起こす。重要なことは、LAの少ない等カロリーHFD-オリーブ油と遺伝子組換え大豆油(プレニッシュ)-は大腸炎感受性を増加させなかったことで、大豆油中の高いLA含量が決定要因である可能性が示唆された。最後に、大豆油食の効果は食物繊維の有無にかかわらず同様であったことから(図8)、食物繊維の添加によってもたらされる可能性のある有益な効果は、SO食の高いLA含量によって明らかに影を潜めたことが示唆される。
これらの所見に基づき、我々は、腸内細菌と宿主細胞の両方が関与するLA/SO誘発性大腸炎感受性の二部構成メカニズムを提唱する(図9a)。一方では、SOの高いLA含量が、通常は腸内にごく少量しか存在しない内因性AIECに、乳酸菌のような有益な細菌を含む他の細菌よりも増殖優位性を与える。SO-mAIECは、LAを炭素源として利用するだけでなく、LAを代謝して生体反応性オキシリピンを生成し、SOの存在下で、アナンダミドや他のNAEの産生を減少させることができる。一方、GFマウスを用いた実験では、SO食が宿主細胞に直接影響を及ぼし、LA由来のオキシリピンや、炎症性のアラキドン酸(AA、LA由来)やAA由来のプロスタグランジンが上昇することが示された。興味深いことに、大豆油に含まれる他の必須脂肪酸であるALA(C18:3オメガ3)のレベルも、大豆油存在下のマウス腸管およびin vitro SO-mAIEC培養で上昇した。しかし、SO-mAIECと宿主IECの両方で代謝されると思われるLAとは異なり、ALA由来のオキシリピン、EPAおよびそのNAE代謝物は、1つを除いてすべて減少した(図9b、補足図S7)。正味の結果は、抗炎症性のオメガ3系ALA由来の代謝産物のバランスが、炎症性のオメガ6系LA由来の代謝産物へとシフトしたことである。このシフトは、病原体であるSO-mAIECの増加とともに、IBD患者によく見られる状態である炎症性状態(図9c)へとバランスをさらに傾ける可能性がある。引用53 SO HFDを与えたWTマウスで認められた腸管免疫調節異常もまた、オメガ-6/オメガ-3比の上昇による炎症性状態と関連している可能性がある。 引用54,引用55 最後に、大腸細胞におけるHNF4αアイソフォームのバランスが変化し、バリア機能の低下と大腸炎に対する感受性に関連するP2-HNF4αのレベルが持続する(図9a,c)。
図9. 大豆油ベースのHFDが大腸炎感受性を増加させるモデルの提案。
注釈 (a) 大豆油高含有食が腸管上皮に及ぼす影響。宿主細胞(左)と微生物細胞(右)に特異的な影響を示し、最終的にバリア機能の破綻とIBDを引き起こす。(b)リノール酸(LA)とα-リノレン酸(ALA)の簡略化された代謝経路。(c)大豆油の多い食事によって引き起こされるALAとLA由来の抗炎症代謝産物と炎症代謝産物のバランスの乱れ。詳細は考察を参照。
フルサイズ表示
大腸炎感受性の食事誘発性付着性大腸菌(AIEC)
引用32 食餌が、生きた動物に添加された外因性AIECの存在量やコロニー形成効率に影響を与えることを示す報告もある。引用56-58 しかし、我々の知る限り、特定の食餌がin vivo系において内因性AIECの選択をもたらすことを示した研究は本研究が初めてである。また、その食餌の主要成分(LA)が、他の腸内微生物よりもこの病原体に対して栄養学的・生存学的に有利に働くことも示した。その結果、ヒトのIBDで観察される有益菌(乳酸桿菌など)と有害菌(AIEC)のバランスの崩壊と同様のディスバイオーシスがマウスで観察された。
大腸炎感受性におけるオキシリピンとプロスタグランジンの増加
Citation17,Citation62我々のin vitroの結果は、SO-mAIECが腸内に定着すると、LA由来のオキシリピンを高レベルに維持できることを示唆している。SO-mAIECが大豆油中のLAからこれらの化合物を内因的に産生できるかどうかは、まだ不明である。同様に、SO HFDを与えたConvマウスとGFマウスのメタボローム解析から、細菌がいない場合でも、宿主のIECも高レベルのLA由来オキシリピンを持つことが示された。実際、GFマウスのIECはConvマウスのIECよりもLAレベルが高く、腸内細菌叢(AIECなど)がLAを取り込み代謝できることをin vivoで証明している。SO-fedマウスの腸内におけるオキシリピンレベルの増加は、肝臓におけるLA(およびALA)オキシリピンレベルが、慢性炎症とも関連する肥満と相関することを示した我々の以前の知見を想起させる。 引用34,引用63 試験管内での細菌培養におけるオキシリピン代謝産物におけるすべての変化が、生体内で同定されたものと同じであったわけではないが(補足図S5,S7,S8)、いくつかのオキシリピンが増加し、他のオキシリピンが減少するという複雑なパターンが、UC患者の結腸生検で報告されている(引用17)。
大腸炎感受性におけるエンドカンナビノイド系代謝物とEPAの減少
エンドカンナビノイドであるAEAや、LA、ALA、その他の脂肪酸に由来する多数のNAEは、細菌およびマウスのメタボローム解析の両方で低下していた。特に興味深かったのは、単独培地と比較して、対照培地で培養したSO-mAIECでは、SO存在下で著しく減少したこれらの化合物(AEA、DGLEA、EPEA、NO-GLY、OEA、PEA、POEA、SEA)のレベルが有意に高かったという事実である。このことは、これらの細菌がエンドカンナビノイドやNAEを産生できることを示唆するだけでなく、培地中にSOが存在すると、その産生が阻害されるか、あるいはこれらの生理活性化合物の分解や分泌が増加することを示唆している。細菌がエンドカンナビノイドを産生できるという発見は、比較的新しいものである。引用16,引用64 大豆油がエンドカンナビノイドレベルに影響を与えるという研究はいくつか発表されているだけで、細菌や腸内では何も発表されていない。
また、SO食(Convおよび/またはGF)を与えたマウスでは、NAE(aLEA、DGLEA、DHEA、EPEA、NA-Gly、PEA、POEA)のレベルも低下しており、宿主IECも大豆油の存在下でエンドカンナビノイド系成分の産生が低下/分解が亢進していることが示唆された。例えば、LAに由来し、腸管上皮の「ゲートオープナー」と考えられているAEAは、SO食によってGFマウスで発現が上昇する。対照的に、バリア機能の保護因子であるPEAは、SO-mAIECおよびSO存在下のGFマウスで発現が低下する。 引用16 これらの結果は、エンドカンナビノイドレベルの低下がヒトにおける大腸炎の増加と関連していることと一致しており、エンドカンナビノイド(および大麻)がIBDに対する潜在的な治療活性を探索されつつあるという点で、治療上も関連性がある。
健康への有益な効果という点で、最もよく研究されているオメガ3系PUFAのひとつであるEPAは、大豆油の存在下でin vivoのメタボロームにおいて有意に減少した。これは、親脂肪酸であるALAが大豆油食で約30倍濃縮されているにもかかわらず(Supplemental Table S1)、宿主におけるALAからEPAへの代謝経路の一部が大豆油食によって損なわれていること、および/またはEPAがSO存在下で選択的に分解されていることを示唆している。観察された不均衡を説明する一つの可能性として、SO食に含まれる過剰な量のLAが、その代謝に関与する共有酵素群の利用においてALAを凌駕していることが考えられる。 引用66 このことは、AA:LAの産物/基質比がViv飼料とSO+f飼料を与えたマウスの間で同程度である一方で、EPA:ALAの比がSO HFDを与えたマウスではViv飼料を与えたマウスに比べて12倍減少しており、オメガ3経路よりもオメガ6経路が顕著に強化されていることからも裏付けられる(図7e)。Convマウスと比較してGFマウスで観察された高レベルのEPAは、1つまたは複数の腸内細菌の存在がマウスIECにおけるEPAレベルの低下につながる可能性も示唆している。抗炎症作用があると考えられている多くのEPA代謝産物、例えばDiHETE、HEPE、PGF3aCitation15,Citation67も、GFマウスとConvマウスの両方でSO+f食によって減少したことから、宿主効果が示唆された。対照的に、PGF3aレベルはSO-mAIEC培養で増加した。このプロスタグランジンがマウスの腸内細菌細胞でも増加しているのかどうか、もし増加しているのであれば、それが宿主IECで観察された減少と関係しているのかどうかについては、まだ明らかにされていない。
大豆油による大腸炎感受性におけるHNF4αアイソフォームの役割
我々は以前、P2-HNF4αの腸内発現が増加するとバリア機能が低下し、DSS誘発大腸炎が増加することを示したCitation25。ここでは、大豆油食が上皮透過性とともにP2-HNF4αタンパク質を増加させることを示し(図4)、腸内のHNF4αアイソフォームの不均衡がSO誘発大腸炎感受性に関与している可能性を示唆している(図9)。P2-HNF4αの発現増加の原因についてはまだ明らかにされていないが、HNF4αの発現はマイクロバイオームによって調節されることが示されていることから、高食餌性LAによる細菌性ディスバイオシスが関与している可能性がある(Citation68,Citation69)。もう一つの可能性は、LA自体がHNF4αアイソフォームのバランスを変化させることである。我々は以前、LAをHNF4αの内因性リガンドとして同定し、LAがHNF4αの転写活性とタンパク質の安定性を低下させることを示した。Citation19 しかし、P1-HNF4αとP2-HNF4αの両方が同一のリガンド結合ドメインを持つため、HNF4αアイソフォームバランスに対するLAの潜在的な影響は複雑なものである可能性が高い。最後に、HNF4αが免疫シグナル分子の直接的な制御を介して腸管上皮リンパ球コンパートメントを形成していることは、最近、他の研究者によって指摘されているCitation70。
結論
GFマウスにおけるわれわれの結果は、オメガ6系オキシリピンの増加とオメガ3系およびエンドカンナビノイド系代謝産物の減少が、バリア機能を低下させることを示唆している。従来のマウスでも同様のメカニズムが働いているようであるが、SOのLA含量の高さによってSO-mAEIC病態が選択され、さらに大腸炎の方向にバランスが傾くという特徴が加わっている。宿主と細菌の両方で同じ種類の化合物が変化するという事実は、これらの生理活性脂質が微生物と宿主の腸管バリア機能をどのように変化させるかを正確に決定することの重要性を強調している。
最後に、今回の結果から、大豆油に含まれる天然のLA含量の高さが、腸内細菌叢と宿主細胞の両方が関与する複数のメカニズムによって、米国におけるIBDの増加に寄与している可能性が示唆され、炎症性分子を増加させ、抗炎症性分子を減少させることによって、IBDに典型的な免疫活性環境を作り出している。このメカニズムの詳細については、今後の研究で明らかにする必要がある。
研究方法
動物と飼料
動物の飼育と処置は、カリフォルニア大学リバーサイド校のInstitutional Animal Care and Use Committeeのガイドラインに従い、NIHガイドラインの承認を得た。雄性若齢成体マウスは、12:12時間の明暗サイクルで、従来の非特異的病原体フリーのビバリウムまたはgnotobiotic施設のいずれかにて飼育した。従来飼育されていた野生型(WT)C57BL/6N(Charles River)、エクソンスワップHNF4α(α1HMZ)Citation24およびIL-10-/-マウスCitation71(Jackson Labs、Stock#:002251)を用いた。IL-10-/-マウスはB6系統であり、より軽症の自然発症大腸炎を発症することが知られている(JAX Labs、カタログ# 002251)。無菌マウス(C57BL/6N, Taconic)は、以前に記載されたように、gnotobiotic条件下で飼育された。離乳後、マウスは引き続き低脂肪のビバリウムチャウを与えるか、4種類の等カロリー高脂肪食(大豆油ベースの高脂肪食に食物繊維を添加(SO+f)または無添加(SO)、低LA大豆油食(Plenish)、オリーブ油食)のいずれかを24週間まで与えた。食物繊維源として(セルロースとともに)イヌリンを使用することにしたのは、大豆油の影響を複合化させる可能性のある食物成分を導入したくなかったからである。Viv飼料の繊維組成は、セルロース、ヘミセルロース、リグニンの混合物で、明確な定義はありません。SO+f飼料では、イヌリンを(セルロースとともに)食物繊維源として使用し、食物繊維の欠乏またはあまり特徴的でない食物繊維源の添加による大豆油の潜在的影響の複合化を回避した。4種類の高脂肪食はすべて35 kcalの脂肪を含み、Research Diets Inc.によって調製された。食餌の詳細な組成については補足表S1を参照のこと。すべてのマウスは餌と水を自由に摂取できた。試験終了時、マウスはNIHガイドラインに従い、炭酸ガス吸入により安楽死させた。
デキストラン硫酸ナトリウム(DSS)投与
8-15週間同じ飼料を摂取したWTまたはα1HMZマウスを、2.5%デキストラン硫酸ナトリウム塩(DSS)(試薬グレード、MW 3.6-5kDa、MP Biomedicals、#160110、カリフォルニア州サンタアナ)で6日間自由摂取させた後、直ちに犠牲にするか、水道水で3日間回復させた。マウスはDSS投与前、投与中、投与後も同じ餌を与え続け、体重、便の硬さ、毛並み、活動レベルの変化を毎日モニターした。便中の血液の有無は、Hemoccult Dispensapak Plus(カタログ番号61130、Beckman Coulter)を用いて1日おきにチェックした。
疾患活動性指数
引用73,引用74 (1)体重減少、(2)結腸長対体重比、(3)血液凝固検査値、および(4)結腸の肉眼的形態変化に基づいて、複合疾患活動性指数(DAI)スコアを算出した。採点基準の詳細はSupplementary Table S2を参照のこと。
リノール酸投与
ビバリウムチャウを食べているWTマウスに、使い捨ての動物用給餌針(カタログ番号01-208-87、Thermo Fisher Scientific)と注射器(カタログ番号14-823-434、BD Slip tip、Thermo Fisher Scientific)を用いて、製薬グレードのリノール酸(カタログ番号39269-10 G、Millipore Sigma)または水を3日間経口投与した。LAの1日投与量は0.26mg/kg体重/日であり、これは1日あたりLAから2.33kcalのエネルギーに相当し、マウスの1日のカロリー摂取量(1日4g/マウスの平均消費量に基づくと13.44kcalであり、3.36kcalは1gのViv chowから供給される)の17.38%を占める。Viv飼料はすでにLAから1.22kcalのエネルギーを供給している。したがって、0.26 mg/kg LAを投与されたViv chow給餌マウスのLA由来の総kcalは、17.38 + 1.22で18.6に等しく、これはSO+fおよびSO飼料中のLA kcal%と等しく、以前の研究で用いられたものと同様である。これらのサンプルは細菌rRNA内部転写スペーサー(ITS)ライブラリー構築に使用した。
組織採取
組織は、イムノブロットおよびメタボローム解析のために-80℃で保存する前に採取し、液体窒素中でスナップ凍結するか、またはその後の組織学的解析のために4℃で30%スクロース+PBS溶液中に保存する前に10%中性緩衝ホルマリン中で24時間固定した。肝臓および脂肪組織(腸間膜、腎周囲、生殖腺、脇腹皮下)を摘出し、重量を測定した。
組織包埋、切片化、染色
大腸全体を切除し、その長さを測定した。直腸に隣接する1.0~1.5cmの断片を切り出し、上記のように10%中性緩衝ホルマリンで固定し、最適冷却温度(OCT)化合物に包埋し、Microm Cryostatで5μmの厚さで切片化し、-20℃で保存した。すべてのスライドを95%エタノールで7分間、水道水で7分間、ddH20で2分間再水和し、ヘマトキシリン(Ricca Chemical)で40秒間染色した。その後、スライドを水道水で30秒間、流水水道水で90秒間、95%エタノールで15秒間浸漬し、エオシン(Sigma-Aldrich)で3秒間カウンター染色した後、95%エタノールと100%エタノールにそれぞれ2回と3回、毎回20秒間浸漬した。スライドはCitrisolve(Fisher Scientific)中に少なくとも40秒間放置した。スライドを固定し、Permount(Fisher Chemicals)で保存した。組織学的画像はEvos Microscope(Life Technologies)で撮影した。クリプト長および粘膜下厚はSPOT Imaging software(Sterling, MI)を用いて測定した。
イムノブロット分析
全細胞抽出物を液体窒素で保存した組織から調製し、以前に記載されたように、Bradford Assayでタンパク質濃度を決定した後、免疫化学発光で分析した。メンブレンを5%脱脂乳で30分間ブロックし、一次抗体(マウスモノクローナル抗HNF4α P1およびP2;カタログNo. それぞれPP-K9218-00およびPP-H6939-00、R&D Systems社製)を1%牛乳中で4℃で一晩インキュベートした。TBST(トリス緩衝生理食塩水、0.1% Tween 20)で数回洗浄した後、ブロットを西洋ワサビペルオキシダーゼ(HRP)標識ヤギ抗マウス(GαM-HRP)二次抗体(Jackson ImmunoResearch Laboratories)で室温で40分間インキュベートし、TBSTで5分間の洗浄を3回、TBS(トリス緩衝生理食塩水)で5分間の洗浄を2回行った。SuperSignal™ West Pico PLUS Chemiluminescent Substrate(Thermo Fisher Scientific)を用いてブロットを現像し、Chemi-Docイメージングシステム(Bio-Rad)で画像化した。ブロットのクマシー染色により、タンパク質の負荷が等しいことが確認された。ブロットをTBSTで2回洗浄した後、ストリッピングバッファー(0.5M NaOH溶液)で室温、5分間振とうしながらインキュベートし、TBSTで2回、TBSで1回洗浄した(各3分間)。ブロットを5%牛乳でブロックし、上述の免疫ブロット法に従った。
インビボ透過性アッセイ
マウスを木材チップ敷料(Newco Specialty、カタログ番号91100)上で一晩絶食させた。15時間後、マウスの体重を測定し、水で希釈したFITC-デキストラン(FD-4 Sigma)を600μg/gm体重の用量で経口投与した。投与は黄色灯下で行い、動物間を2分間ずらして行った。投与4時間後にマウスを犠牲にし、心臓穿刺で血液を採取した(BD 3-ml Luer-Lok Syringes, catalog no. 14-823-435, FisherおよびBD 26 G ⅝インチ皮下注射針、カタログ番号. 14-826-6A、Fisher)、1.5mlエッペンドルフチューブに移した。検体は氷上で45分間静置した後、9.3rcfで15分間遠心し、血清を新しいチューブに回収した。サンプルは、黒色96ウェルプレート(コーニング、カタログ番号3991)に3連で、水で1:5に希釈した。血清 FITC-デキストラン濃度は、Veritas Microplate Luminometer(Turner Biosystems, Sunnyvale, CA)、GloMax ソフトウェア(Promega, Madison, WI)を用いて、励起/発光波長 490/520 nm で測定した。
腸管免疫細胞プロファイル
IELおよびLPLの分離
上皮内白血球(IEL)および固有層白血球(LPL)は、マウスの小腸から既述の方法で単離した。腸を3~4インチに切断し、各セグメントをギブコRPMI1640培地で湿らせたペーパータオル上で転がし、残存する脂肪組織を除去した。セグメントを湾曲した鉗子で反転させ、30mlの抽出培地(RPMIに5%(w/v)ジチオスレイトール(DTT)を93μl、0.5M EDTAを60μl、長さ40cmの小腸あたりウシ胎児血清を500μl加えたもの)に入れ、500rpmで37℃、15分間撹拌した。IELを豊富に含む上清から組織片を分離するために、スチール製ストレーナーを使用し、氷上に置いた。組織片に残った粘液は、乾いたペーパータオル上でブロッティングして取り除いた。これらの断片を1.5mlのエッペンドルフチューブに入れ、600μlの消化培地(25mlのRPMIと12.5mgのディスパーゼ、37.5mgのコラゲナーゼII、300μlのFBS)を加えた。ディスパーゼ(ギブコ、カタログ番号17105041)とコラゲナーゼ(ギブコ、カタログ番号17101015)は使用直前に加えた。組織をチューブ内ではさみで細かくし、25mlの消化液を入れたカップに入れ、500rpmで15分間撹拌した。組織の大きな塊は、血清ピペットで上下にピペッティングして砕き、37℃での撹拌をさらに15分間続けた。消化された組織とIELを含む上清を100μmのセルストレイナーで50mlのチューブに移し、10%FBSを含むRPMI 20mlですすいだ。濾過した溶液を500×g、4℃で10分間遠心し、上清を注意深くデカントし、ペレットを10%FBSを含むRPMI 1mlに再懸濁した。再懸濁した細胞を40μmのセルストレーナーで濾過し、50mlのチューブに移し、10%FBSを含むRPMI 20mlですすいだ。濾過液を500×g、10分間、4℃で遠心し、上清を注意深くデカントし、ペレットを2%FBSを含むRPMI 1mlに再懸濁した。この懸濁液を以下に述べるフローサイトメトリーに使用した。
PBMC単離
マウスを安楽死させ、1mLの血液を採取し、直ちに1mLの4%クエン酸ナトリウムと混合した。次に、1mLの洗浄培地(5%熱不活性化子牛胎児血清(FCS)入りRPMI)を加えて混合し、続いて1mLのHistopaque-1077(カタログ番号:10771、Sigma-Aldrich)をゆっくりと下層に加えた。この混合液を400gで30分間、室温で遠心した。PBMCを間相から注意深く吸引し、培養液で洗浄した。
フローサイトメトリー
単離したPBMC、IELおよびLPLを蛍光活性化細胞選別バッファー(FACS)バッファーで洗浄し、Fcブロック(25μg/mL αCD16/32および10μg/ml ラットIgG)とインキュベートし、フロー抗体で30分間染色した: F4/80(Cl:A3-1、Bio Rad MCA497FB)、SiglecF(E50-2440、BD Biosciences 562,757)、CD4(RM4-5、BD Biosciences 550,954)、Ly6C(HK 1. 4、Biolegend 128,018)、CD11b(M1/70、Biolegend 101,226)、CD11c(N418、Biolegend 117,310)、Ly6G(1A8、Biolegend 127,628)、MHCII(M5/114. 15.2、Biolegend 107,622)、CD19(1D3、BD Biosciences 562,956)、CD115(AFS98、Biolegend 135,517)、CD8(53-6.7、Biolegend 100,742)。全ての細胞はBD LSRII(BD Biosciences)で取得し、FlowJo(FlowJoTM v10)を用いて解析した。細胞集団は以下のように同定された:マクロファージ(CD11b+ F4/80+)、好酸球(CD11b+ SiglecF+)、単球(CD11b+ Ly6C+)、好中球(CD11b+ Ly6G+)、CD4+ T細胞(CD4+ CD8-)、CD8+ T細胞(CD8+ CD4-)、B細胞(CD4- CD19+)。
メタボロームおよびマイクロバイオーム解析のための腸管上皮細胞(IEC)の単離
腸管上皮細胞(IEC)は、マイクロバイオームおよびメタボローム解析のために、以前に記載されたとおりに単離した。Citation32 細菌DNAは、DNeasy PowerSoil Kit(Qiagen, Valencia, CA)を用い、Mini-Beadbeater-16(BioSpec, Bartlesville, OK)を用いた30秒間のビーズビート工程でIECから単離した。メタボローム解析のため、細胞を液体窒素で瞬間凍結し、処理まで-80℃で保存した。
細菌rRNA内部転写スペーサー(ITS)ライブラリーの構築と配列決定
イルミナ細菌rRNA ITS遺伝子ライブラリーは以下のように構築した: PCRは、MJ Research PTC-200サーマルサイクラー(Bio-Rad Inc、 Hercules、CA)において、50 mM Tris(pH8.3)、500 μg/mlのウシ血清アルブミン(BSA)、2. 5 mM MgCl2、250 μMの各デオキシヌクレオチド三リン酸(dNTP)、400 nMのフォワードPCRプライマー、200 nMの各リバースPCRプライマー、2.5 μlのDNA鋳型、0.625ユニットのJumpStart Taq DNAポリメラーゼ(Sigma-Aldrich, St.) PCRプライマーは、スモールサブユニット(ITS-1507F、GGTGAAGTCGTAACAAGGTA)およびラージサブユニット(ITS-23SR、GGGTTBCCCCATTCRG)rRNA遺伝子と超可変ITS領域の一部をターゲットとした; プライマー結合部位は、一般的に使用されているスモールサブユニットrRNA遺伝子プライマー1492 RCitation79とラージサブユニットrRNA遺伝子プライマー129Fのリバースと相補体であった。 Citation80 PCRプライマーは凍結し、1回解凍したのみである。熱サイクリングパラメーターは94℃で5分間、94℃で20秒間、56℃で20秒間、72℃で40秒間を35サイクル、その後72℃で10分間であった。PCR産物はQiagen QIAquick PCR Purification Kit (Qiagen)を用い、製造元の指示に従って精製した。DNA配列決定(シングルエンド150塩基)は、Illumina MiSeq(Illumina, Inc.)
細菌rRNA ITS配列の処理と解析
UPARSEパイプラインを使用して、デフォルトパラメーターまたは推奨ガイドライン(引用文献81)を用いて、脱多重化、長さトリミング、クオリティフィルタリング、およびアンプリコン配列バリアント(ASV)ピッキングを行った(https://www.drive5.com/usearch/manual10/uparse_pipeline.html)。簡単に説明すると、推奨される1.0の予想エラー閾値を使用してデマルチプレックスした後、配列は145 bpの均一な長さにトリミングされ、その後デリプライシングされた。脱複製された配列は、UNOISE3.Citation82を使用して、ゼロ半径操作分類単位(ZOTU)を生成するために、エラー修正(ノイズ除去)とキメラフィルタリングにかけられた。非細菌DNAを持つASVは、ヌクレオチドデータベースに対してシード配列のローカルBLAST検索Citation83を行うことで同定した。最高得点のBLASTヒットのいずれかが、げっ歯目、真菌類、Viridiplantae王国、またはPhiX内の分類学的IDを含んでいた場合、ASVは削除された。細菌ASVの分類学的割り当ては、未分類の指定を除いた最も高いBLASTヒットの最も低い共通の分類学的レベルを見つけることによって行った。データは、各ASVのリード数をそのサンプルの総リード数で割ることにより、各サンプル内で正規化した。バクテリアrRNA ITS配列は、National Center for Biotechnology Information (NCBI)のSequence Read Archive (SRA)にSRA BioProject Accession PRJNA622821として寄託されている。
バクテリアrRNA ITS配列解析
QIIMECitation84を用いて、様々な分類レベルでの系統型の存在量表を作成した。相関分析とプロット、および細菌種プロットは、Prism (GraphPad, La Jolla, CA)を用いて行った。
ベータ多様性プロット
QIIMECitation84を用いてヘリンガーベータ多様性距離行列(LA経口投与実験用)を算出し、主座標分析を用いて描写し、Adonis PERMANOVA検定を用いて統計的に評価した。
mAIECの単離
本研究で使用したmAIEC株(UCR-SoS5、結果ではSO mAIECと称する)は、製造業者(Sigma-Aldrich、ミズーリ州セントルイス)の記載に従って、選択培地である大腸菌ChromoSelect Agar Bを用いて、食物繊維入り高大豆油食(SO+f)を与えたマウスから採取した皮下脂肪から単離した。この菌株は、選択培地からコロニーを選択し、LB寒天培地上で2回連続してストリーク・プレーティングを行い、単一コロニーを得ることで精製した。この菌株のrRNA ITS領域をPCR増幅し、サンガー法を用いてアンプリコンの塩基配列を決定することにより、イルミナ配列解析で同定された大腸菌系統型と同一のrRNA ITS塩基配列を有することを確認した。
mAIECの表現型試験
Caco-2ブラシボーダー上皮(Caco2-BBe)細胞へのmAIECの接着能と浸潤能を、以前に記載された方法を用いて調べた。Citation32 mAIECの細胞内複製は、J774A.1細胞(ATCC TIB-67)、実験前日までRPMI+10%FBS、ペニシリン(100 U/ml)、ストレプトマイシン(100 μg/ml)で維持したマウスマクロファージを用いて行った。J774A.1細胞におけるmAIECの細胞内複製は、1ウェルあたり2mlの培地を用いた24ウェルプレートを用いたゲンタマイシン生存アッセイにより決定した。J774A.1単層を20個/マクロファージのMOIで感染させ、37℃、5%CO2で2時間インキュベートした。感染したマクロファージをPBSで2回洗浄し、RPMI+10%FBSおよび150mg/mlゲンタマイシン中で1時間インキュベートし、細胞外細菌を死滅させた。J774A.1細胞をPBSで1回洗浄した後、1mlの1% Triton-X 100で30分間インキュベートして溶解した。溶解した細胞溶液(1 ml)を集め、14,000×gで10秒間遠心し、上清をデカントし、細胞を120μlのPBSに再懸濁した。溶解した細胞液を連続希釈し、LB寒天培地にスプレッドプレートし、37℃で一晩培養し、細菌を定量した。このプロセスを別のプレートで繰り返したが、上記の150mg/mlゲンタマイシンを1時間インキュベートした後、細胞をPBSで1回洗浄し、RPMI+10%FBSと20mg/mlゲンタマイシンを加え、37℃でさらに23時間インキュベートした。mAIECおよびコントロール細菌の細胞内複製は、感染後24時間で回収された細菌数を感染後1時間の細菌数で割った平均パーセンテージで表し、細菌数を正規化するために2つのJ774A.1細胞数を用いた。対照菌は、LF82ヒトAIEC(故Arlette Darfeuille-Michaud博士の好意により提供)とK12(非侵襲性大腸菌、ATCC 25,404)であった。
メタボローム解析のためのmAIECの培養
mAIECは、10%大豆油を加えたLBブロス中で、37℃で20時間、350rpmで振盪しながら好気的に増殖させた。14,000×gで30秒間遠心分離して菌体を回収し、上清を除去した。この操作をさらに2回繰り返し、大豆油を可能な限り除去した。細菌ペレットは液体窒素で瞬間冷凍し、分析するまで-80℃で保存した。コントロールは、大豆油無添加のLBブロスで培養したmAIECと、大豆油添加および無添加のLBブロスで培養し、37℃で20時間、350rpmで振盪したものである。
単独炭素源実験
mAIECまたは大腸菌K-12をLB培地で20時間、37℃、300rpmで好気的に増殖させた後、ビタミン(ATCC、カタログ番号MD-VS)および微量ミネラル(ATCC、カタログ番号MD-TMS)を添加した最小必須培地(標準M9培地、ただしグルコースを含まない)で希釈(1:50)した。この培地に、エタノール(Cayman Chemicals、カタログ番号9015050)に溶かした2 mMリノール酸、または同量のエタノールを添加した。大腸菌K-12には、M9培地に0.4%のグルコースを添加した第3の処理を行った。OD600の測定は、Synergy HTX Microplate readerを用いて、接種後0、30、90、150、180、240分に行った。LAとエタノール処理後のK-12菌の生存率を示すため、240分後にグルコースを0.4%の濃度で添加し、さらに360分と1440分の2回OD測定を行った。各条件につき3つの複製培養を行った。少なくとも2つの独立した実験のうち、代表的な1つの実験の結果を示す。
メタボローム解析
細胞ペレット:非エステル化オキシリピン、エンドカンナビノイド、N-アシルエタノールアミン、多価不飽和脂肪酸抽出物
抽出前に細胞ペレット(IECとバクテリア)を秤量した。オキシリピン、エンドカンナビノイド、N-アシルエタノールアミン(NAEs)および多価不飽和脂肪酸(PUFAs)は、約80mgの細胞ペレットからアセトニトリル/イソプロパノール/水混合溶媒[3:3:2 v/v]を用いた液体抽出プロトコールにより単離し、内部標準法を用いてUPLC-MS/MSにより定量した。簡単に説明すると、約80mgの細胞ペレットを、20μLのBHT/EDTA(1:1 MeOH:水)、メタノール中の1250nMの重水素化オキシリピンおよびエンドカンナビノイドサロゲート20μL、および1:1メタノール:アセトニトリル中の5μMの1-シクロヘキシルウレイド、3-ドデカン酸(CUDA)および1-フェニルウレイド、3-ヘキサン酸(PUHA)20μLと混合した。内部標準物質CUDAとPUHAは、分析物の定量に使用する同位体標識内部標準物質の推定を可能にするため、抽出後、分析前にサンプルに添加した(内部標準物質の全リストは補足表S4を参照)。その後、0.5 mL のアセトニトリル/イソプロパノール/水(3:3:2)を加え、3 mm のステンレススチールビーズを加えた後、Geno/Grinder 2010 を用いてサンプルをホモジナイズした。ホモジネートを15,000rcfで10分間遠心し、0.1 µm PVDFスピンフィルターでろ過し、後述の質量分析用に回収した。
細菌培養培地:非エステル化オキシリピン、エンドカンナビノイド、N-アシルエタノールアミン、多価不飽和脂肪酸の抽出
非エステル化オキシリピン、エンドカンナビノイド、NAE、および多価不飽和脂肪酸は、60mgのHydrophilic-Lipophilic-Balancedカラム(Oasis, Waters Corporation, Milford, MA)を用いた固相抽出を用いて単離した。簡単に説明すると、カラムを1カラム容量の酢酸エチルと2カラム容量のメタノールで洗浄し、さらに2カラム容量の5%メタノール、0.1%酢酸水溶液でコンディショニングした。次に、カラムに5μLのBHT/EDTA(1:1 MeOH:水)と5μLの250nM重水素化オキシリピンとエンドカンナビノイドサロゲート(メタノール中)を添加した。サンプル(200 µL)を800 µLの5%メタノール、0.1%酢酸水溶液と混合し、カラムに移し、重力下で抽出した。カラムは1カラム容量の30%メタノールと0.1%酢酸水溶液で洗浄した。分析対象物を0.5mLのメタノールで溶出し、次いで1.5mLの酢酸エチルで溶出した。溶出液を真空乾燥し、1-シクロヘキシルウレイド-3-ドデカン酸(CUDA)および1-フェニルウレイド-3-ヘキサン酸(PUHA)を1:1メタノール:アセトニトリル中5 µMで50 µLに再構成し、0.1 µm PVDFスピンフィルターでろ過し、後述の質量分析用に回収した。
質量分析
抽出物中の残基は、2.1 mm × 150 mm、1.7 μm BEH C18 カラム(Waters, Milford, MA)で分離し、API 6500 QTRAP(Sciex; Redwood City, CA)のマルチ反応モニタリングによるエレクトロスプレーイオン化で検出し、既報のように、真正標準物質の7~9点検量線に対して定量した。例外はLA、ALA、EPEA、POEAで、それぞれの標準物質は酸化されやすいため、相対量を報告している。これらの化合物の相対存在量は、GC/MSプラットフォームでの独立した定量測定値と一致することを以前に決定している。
統計分析
データは、GraphPad Prism 6を用いて、平均値±平均値の標準誤差(SEM)で示した。一元配置分散分析(One-way ANOVA)または反復測定(RM)分散分析(repeated measures (RM) ANOVA)の後、ポストホック検定(多重比較の場合はTukey's、一対比較の場合はSidak、図の凡例で指定)またはStudent's T-testを適宜使用し、図の凡例で示した。データはShapiro-Wilk正規性検定を用いて正規性を検定した(詳細は補足表S3を参照)。統計的有意性はαレベル0.05とし、P値が0.05以下を有意とみなした。体重、脂肪組織重量、肝臓(体重比)、結腸の長さ、腸上皮細胞における mAIEC の相対的存在量の間で線形回帰分析を行った。有意性の判定には以下のカットオフ値を用いた: PearsonまたはSpearmanの係数r>0.5、P≦0.05。メタボロミクスデータについては、まず頑健なHuber M検定を用いて外れ値を除去し、多変量正規インピュテーションを用いて欠損データをインプットした。さらに、SAS VARCLUSプロシージャの実装であるJMP変数クラスタリングアルゴリズムを使用して、各細胞タイプごとに変数をクラスタ化し、データ削減のためにクラスタ成分に変換した。キュレーションしたメタボロミクスデータを補足表S4に示す。クラスター成分は、代謝変化の概要を提供するために、実験サンプルのPCA分析に使用した。
補足資料
補足資料
ダウンロード Zip (2140 KB)
謝辞
DuPont社からプレニッシュオイルをいただいた。図9のモデルはBioRender.comで作成した。
情報開示
著者による潜在的な利益相反は報告されていない。
データの利用可能性に関する声明
細菌のrRNA ITS配列は、National Center for Biotechnology Information (NCBI)のSequence Read Archive (SRA)にSRA BioProject Accession PRJNA622821 (https://www.ncbi.nlm.nih.gov/bioproject/PRJNA622821/)として寄託されている。本研究の結果を裏付けるメタボロミクスデータは、論文および補足資料の中で入手可能である。
補足資料
本論文の補足データは、https://doi.org/10.1080/19490976.2023.2229945 からオンラインでアクセスできる。
追加情報
資金提供
NIH R01 DK053892、DK127082(FMS);クローン性大腸炎財団キャリア開発賞454808(PD);UCR Metabolomics Core Seed Grant(FMS、PD);FY17-18 P&F Grant from the NIH/UC Davis WCMC DK097154(JB、PD)。NIH R35 GM124724, R01 AI157106 (AH); Crohn's and Colitis Foundation Senior Research Award, NIH R01 DK091281, American Gastroenterological Association IBD Research Award (DFM). NIH R01 AI153195(MGN)。USDA Intramural project 2032-51530-022-00Dおよび2032-51530-025-00D(JWN)より追加支援を受けた。USDAは機会均等を提供する雇用主である。USDA National Institute of Food and Agriculture Hatch project CA-R-NEU-5680 (FMS)。
参考文献
Knight-Sepulveda K、Kais S、Santaolalla R、Abreu MT。食事と炎症性腸疾患。Gastroenterol Hepatol. 2015;11:511-28. [PubMed], [Google Scholar].
Blasbalg TL、Hibbeln JR、Ramsden CE、Majchrzak SF、Rawlings RR。20世紀の米国におけるオメガ3脂肪酸とオメガ6脂肪酸の消費の変化。2011;93(5):950から962までDoi:10.3945/AJCN.110.006643。[Crossref], [PubMed], [Web of Science ®], [Google Scholar].
モロデッキーNA、スンIS、ラビDM、ガリWA、フェリスM、チェルノフG、ベンチモールEI、パナッチョーネR、ゴーシュS、バークマHW、ら。 時間の経過とともに増加する炎症性腸疾患の発生率と有病率、システマティックレビューに基づく。Gastroenterology. 2012;142(1):46-54.e42。クイズe30. doi:10.1053/j.gastro.2011.10.001. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
バーLH、ダンGD、ブレナンMF。全身非経口栄養中の必須脂肪酸欠乏症。Ann Surg。1981;193(3):304-311。[Crossref], [PubMed], [Web of Science ®], [Google Scholar].
ダ・コスタGG、ダ・コンセイサン・ネポムセーノG、ダ・シルバ・ペレイラA、シモンエスBFT、ダ・コスタGG、ダ・コンセイサン・ネポムセーノG、ダ・シルバ・ペレイラA. 世界の食事パターンと社会経済データとの関連:生態学的探索研究。グローバルヘルス。2022;18(1):31. doi:10.1186/s12992-022-00820-w. [クロスリファレンス], [PubMed], [Web of Science ®], [Google Scholar].
Tjonneland A, Olsen A, Overvad K, Bergmann MM, Boeing H, Nagel G, Linseisen J, Hallmans G, Palmqvist R, Sjodin H, et al. IBD in EPIC study investigators: linoleic acid, a dietary n-6 polyunsaturated fatty acid, and the aetiology of ulcerative colitis: a nested case-control study within a European prospective cohort study. Gut. 2009;58:1606-1611. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Alzoghaibi MA, Walsh SW, Willey A, Iii FA, Graham MF. リノール酸は、オレイン酸ではなく、クローン病患者から単離したヒト腸平滑筋細胞によるインターロイキン-8の産生をアップレギュレートする。臨床栄養2003;22:529-535。[Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Hintze KJ, Benninghoff AD, Cho CE, Ward RE. 前臨床研究のための西洋食のモデル化。Adv Nutr. 2018;9(3):263-271. doi:10.1093/advances/nmy002. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
マリオン-ルテリエR、Savoye G、ゴーシュS.IBD:私たちが信頼する食品で。J Crohns Colitis. 2016;10(11):1351–1361. doi:10.1093/ecco-jcc/jjw106. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
潰瘍性大腸炎のリスクと食事性脂肪酸の摂取量:症例対照研究。Int J Colorectal Dis. 2015;30(9):1255–1260. doi:10.1007/s00384-015-2232-8. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Barros KV, Xavier RAN, Abreu GG, Martinez CAR, Ribeiro ML, Gambero A, Carvalho PO, Nascimento CMO, Silveira VLF. 大豆と魚油の混合物は、デキストラン硫酸ナトリウム(DSS)大腸炎ラットのIL-10を増加させ、DNA損傷から保護し、大腸炎症を減少させる。脂質健康障害。2010;9(1):68. doi:10.1186/1476-511X-9-68. [Crossref], [PubMed], [Google Scholar].
Wiese DM, Horst SN, Brown CT, Allaman MM, Hodges ME, Slaughter JC, Druce JP, Beaulieu DB, Schwartz DA, Wilson KT, et al. Serum fatty acids are correlated with inflammatory cytokines in ulcerative colitis. PLoS One. 2016;11(5):e0156387. doi:10.1371/journal.pone.0156387. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Moldal T, Løkka G, Wiik-Nielsen J, Austbø L, Torstensen BE, Rosenlund G, Dale OB, Kaldhusdal M, Koppang EO. 食餌魚油の植物油への置換は、アトランティックサーモン(Salmo salar)の腸の中ヒダの短縮と関連している。BMC Vet Res. 2014;10(1):60. doi:10.1186/1746-6148-10-60. [Crossref], [PubMed], [Google Scholar].
Alvheim AR, Torstensen BE, Lin YH, Lillefosse HH, Lock EJ, Madsen L, Hibbeln JR, Malde MK. 食餌リノール酸は、アトランティックサーモン(Salmo salar L.)およびマウスにおいて内因性2-アラキドノイルグリセロールおよびアナンダミドを上昇させ、マウスにおいて体重増加と炎症を誘導する。この論文では、サケとマウスにおける2-アラキドノイルグリセロールとアナンダミドの動態を明らかにした。[Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Gabbs M, Leng S, Devassy JG, Monirujaman M, Aukema HM. Advances in our understanding of oxylipins derived from dietary PUFAs. 2015;6(5):513-540。doi:10.3945/an.114.007732。[Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Cani PD, Plovier H, Van Hul M, Geurts L, Delzenne NM, Druart C, Everard A. Endocannabinoids - at the crossroads between the gut microbiota and host metabolism [internet]. Nat Rev Endocrinol. 2016;12(3):133–143. doi:10.1038/nrendo.2015.211. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Diab J, Al-Mahdi R, Gouveia-Figueira S, Hansen T, Jensen E, Goll R, Moritz T, Florholmen J, Forsdahl G 治療歴のない潰瘍性大腸炎患者と深い寛解期にある潰瘍性大腸炎患者における大腸粘膜オキシリピンとエンドカンナビノイドの定量的解析とサイトカイン遺伝子発現との潜在的関連性[internet]。Inflammatory Bowel Diseases 2019; 25:490-497. https://doi.org/10.1093/ibd/izy349. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Zhang W, Li H, Dong H, Liao J, Hammock BD, Yang G-Y. 可溶性エポキシドヒドロラーゼの欠損は、マウスにおけるデキストラン硫酸ナトリウム誘発大腸炎および発癌を抑制する。この論文では、エポキシド加水分解酵素の欠損がデキストラン硫酸ナトリウム誘発大腸炎と発がんを抑制することを明らかにした。[Crossref], [PubMed], [Google Scholar].
核内受容体に結合する内因性リガンドの同定。PLoS One. 2009;4(5):e5609. doi:10.1371/journal.pone.0005609. [Crossref]、[PubMed]、[Web of Science ®]、[Google Scholar].
遺伝学コンソーシアムUI、Barrett JC、Lee JC、Lees CW、Prescott NJ、Anderson CA、Phillips A、Wesley E、Parnell K、Zhang H、et al. 潰瘍性大腸炎のゲノムワイド関連研究により、HNF4A領域を含む3つの新しい感受性遺伝子座が同定された。Nat Genet. 2009;41:1330-1334. [クロスリファレンス], [PubMed], [Web of Science ®], [Google Scholar].
スラーデックFM、Zhong WM、Lai E、JE D Jr. 肝臓に濃縮された転写因子HNF-4はステロイドホルモン受容体スーパーファミリーの新規メンバーである。Genes Dev. 1990;4(12b):2353–2365. doi:10.1101/gad.4.12b.2353. [このような遺伝子発現を解析するために、遺伝子発現を解析する手法として、遺伝子発現を解析する手法と、遺伝子発現を解析する手法とがある。
Ko HL, Zhuo Z, Ren EC. HNF4αコンビナトリアルアイソフォームヘテロダイマーは、対応するホモダイマーとは異なる明確な遺伝子標的を活性化する。Cell Rep. 2019;26(10):2549-57.e3. doi:10.1016/j.celrep.2019.02.033. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Chen WS, Manova K, Weinstein DC, Duncan SA, Plump AS, Prezioso VR, Bachvarova RF, JE D Jr. 内臓内胚葉で発現するHNF-4遺伝子の破壊は、胚外胚葉の細胞死とマウス胚の胃形成障害を引き起こす。Genes Dev. 1994;8(20):2466–2477. doi:10.1101/gad.8.20.2466. [クロスリファレンス], [PubMed], [Web of Science ®], [Google Scholar].
Briancon N, Weiss MC. HNF4αのAF-1活性化ドメインのin vivoでの役割はエクソンスワッピングによって明らかになった。2006;25(6):1253-1262。doi:10.1038/sj.emoj.7601021. [このような研究は、日本ではほとんど行われていない。
核内受容体HNFの相反する役割. 大腸炎および大腸炎関連結腸癌における核内受容体HNF4αアイソフォームの相反する役割。Elife [Internet]. 2016;5 doi:10.7554/eLife.10903. [クロスリファレンス], [PubMed], [Web of Science ®], [Google Scholar].
腸の炎症におけるディスバイオシス:原因または結果。Int J Med Microbiol. 2016;306(5):302–309. doi:10.1016/j.ijmm.2016.02.010. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
常在細菌叢が宿主の病態生理に及ぼす影響:免疫と炎症に焦点をあてて[internet]. Semin Immunopathol. 2015;37(1):1–3. doi:10.1007/s00281-014-0472-2. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Tamboli CP, Neut C, Desreumaux P, Colombel JF. 炎症性腸疾患におけるディスバイオシス。Gut. 2004;53(1):1–4. doi:10.1136/gut.53.1.1. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
ダルフィーユ=ミショー(Darfeuille-Michaud)A、ヌート(Neut)C、バルニッヒ(Barnich)N、レダーマン(Lederman)E、ディ・マルティーノ(Di Martino)P、デスルモー(Desreumaux)P、ガンビエ(Gambiez)L、ジョリー(Joly)B、コルトー(Cortot)A、コロンベル(Colombel)JF。クローン病患者の回腸粘膜における付着性大腸菌の存在。Gastroenterology. 1998;115:1405-1413. doi: 10.1016/S0016-50859870019-8. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Palmela C, Chevarin C, Xu Z, Torres J, Sevrin G, Hirten R, Barnich N, Ng SC, Colombel J-F Adherent-invasive Escherichia coli in inflammatory bowel disease [internet]. Gut 2018; 67:574-587. doi: 10.1136/gutjnl-2017-314903 [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Martinez-Medina M, Denizot J, Dreux N, Robin F, Billard E, Bonnet R, Darfeuille-Michaud A, Barnich N. Western diet induces dysbiosis with increased E coli in CEABAC10 mice, alters host barrier function favouring AIEC colonisation. Gut. 2014;63(1):116–124. doi:10.1136/gutjnl-2012-304119. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Shawki A, Ramirez R, Spalinger MR, Ruegger PM, Sayoc-Becerra A, Santos AN, Chatterjee P, Canale V, Mitchell JD, Macbeth JC, et al. 自己免疫感受性遺伝子PTPN2は、新規マウス付着性侵入性大腸菌の増殖を抑制する。Gut Microbes. 2020;11:1547-1566. doi: 10.1080/19490976.2020.1775538. [Taylor & Francis Online], [Web of Science ®], [Google Scholar].
大豆油は肥満促進作用がある。大豆油はマウスのココナッツオイルやフルクトースよりも肥満および糖尿病誘発性が高い:肝臓の潜在的な役割。PLoS One. 2015;10:e0132672. doi: 10.1371/journal.pone.0132672. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Deol P, Fahrmann J, Yang J, Evans JR, Rizo A, Grapov D, Salemi M, Wanichthanarak K, Fiehn O, Phinney B, et al. Omega-6 and omega-3 oxylipins are implicate in soybean oil-induced obesity in mice. Sci Rep. 2017;7:12488. doi: 10.1038/s41598-017-12624-9. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
核内受容体HNF4αのSrcチロシンキナーゼリン酸化は、ヒト結腸癌におけるHNF4αのアイソフォーム特異的欠損と相関する。この論文では、ヒト大腸がんにおける核内受容体HNF4αのアイソフォーム特異的欠損とSrcチロシンキナーゼのリン酸化が相関していることを明らかにした。[クロスリファレンス], [PubMed], [Web of Science ®], [Google Scholar].
Vuong LM, Chellappa K, Dhahbi JM, Deans JR, Fang B, Bolotin E, Titova NV, Hoverter NP, Spindler SR, Waterman ML, et al. ヒト大腸がん細胞における腫瘍増殖とt細胞因子4/AP-1相互作用に対する肝細胞核因子4αアイソフォームの影響の違い。Mol Cell Biol. 2015;35:3471-3490. doi: 10.1128/MCB.00030-15. [Taylor & Francis Online], [Web of Science ®], [Google Scholar].
Shan Z, Rehm CD, Rogers G, Ruan M, Wang DD, Hu FB, Mozaffarian D, Zhang FF, Bhupathiraju SN. 米国成人の炭水化物、タンパク質、脂肪の摂取量と食事の質の傾向、1999-2016年。JAMA. 2019;322:1178-1187. doi: 10.1001/jama.2019.13771. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Speakman JR. ヒトの肥満モデルとしてげっ歯類の肥満を研究するための高脂肪食の使用。Int J Obes. 2019;43:1491-1492. doi: 10.1038/s41366-019-0363-7. [Crossref], [Web of Science ®], [Google Scholar].
Yusuf K, Saha S, Umar S. Health benefits of dietary fiber for the management of inflammatory bowel disease. Biomedicines Int. 2022;10 doi:10.3390/biomedicines10061242. [Crossref], [Google Scholar].
Lee JW, Bajwa PJ, Carson MJ, Jeske DR, Cong Y, Elson CO, Lytle C, Straus DS. フェノフィブラートはインターロイキン-17とインターフェロン-γの発現を抑制し、インターロイキン-10欠損マウスにおける大腸炎を改善する。Gastroenterology. 2007;133:108-123. doi: 10.1053/j.gastro.2007.03.113. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Berg DJ, Davidson N, Kühn R, Müller W, Menon S, Holland G, Thompson-Snipes L, Leach MW, Rennick D. インターロイキン10欠損マウスにおける腸炎および大腸がんは、異常なサイトカイン産生およびCD4(+)TH1様反応と関連している。J Clin Invest. 1996;98:1010-1020. doi: 10.1172/JCI118861. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Darfeuille-Michaud A, Boudeau J, Bulois P, Neut C, Glasser A-L, Barnich N, Bringer M-A, Swidsinski A, Beaugerie L, Colombel J-F. クローン病における回腸粘膜に付着性浸潤性大腸菌の高い有病率。Gastroenterology. 2004;127:412-421. doi: 10.1053/j.gastro.2004.04.061. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Nieman C. 微量脂肪酸が微生物の増殖に及ぼす影響. 1954;18:147-163.doi:10.1128/br.18.2.147-163.1954。[Crossref], [PubMed], [Google Scholar].
Hernández-Chirlaque C、Aranda CJ、Ocón B、Capitán-Cañadas F、Ortega-González M、Carrero JJ、Suárez MD、Zarzuelo A、Sánchez de Medina F、Martínez-Augustin O. DSS大腸炎における無菌および抗生物質処理マウスの上皮傷害感受性。J Crohns Colitis. 2016;10:1324-1335. doi: 10.1093/ecco-jcc/jjw096. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
炎症性腸疾患における上皮バリアと粘膜免疫との関係。Cell Mol Gastroenterol Hepatol. 2017;4(1):33–46. doi:10.1016/j.jcmgh.2017.03.007. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Bäckhed F, Manchester JK, Semenkovich CF, Gordon JI. 無菌マウスにおける食事誘発性肥満に対する抵抗性の基礎となるメカニズム。この論文では、肥満の原因である食餌誘導性肥満に対する無菌マウスの抵抗性の基礎となるメカニズムを明らかにした。[クロスフ], [PubMed], [Web of Science ®], [Google Scholar].
ターンボーPJ、バックヘドF、フルトンL、ゴードンJI。肥満とマウス遠位腸内細菌叢の著明かつ可逆的な変化との関連性。Cell Host & Microbe. 2008;3:213-223. doi: 10.1016/j.chom.2008.02.015. [Crossref]、[PubMed]、[Web of Science ®]、[Google Scholar].
Miles JP, Zou J, Kumar M-V, Pellizzon M, Ulman E, Ricci M, Gewirtz AT, Chassaing B. 低脂肪および高脂肪食への発酵性食物繊維の添加は黄砂誘発急性大腸炎の重症度を悪化させる。Inflamm Bowel Dis. 2017;23:1133-1143. doi: 10.1097/MIB.000000001155. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Microbiota fermentation-NLRP3 axis shapes the impact of dietary fibres on intestinal inflammation. Gut. 2019;68:1801-1812. doi: 10.1136/gutjnl-2018-316250. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Videla S, Vilaseca J, Antolín M, García-Lafuente A, Guarner F, Crespo E, Casalots J, Salas A, Malagelada JR. 食餌性イヌリンはラットにおけるデキストラン硫酸ナトリウムによる遠位大腸炎を改善する。Am J Gastroenterol. 2001;96:1486-1493. doi: 10.1111/j.1572-0241.2001.03802.x. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Schultz M, Munro K, Tannock GW, Melchner I, Gottl C, Schwietz H, Scholmerich J, Rath HC. イヌリンを含むプロバイオティクス製剤(SIM)の摂取が、HLA-B27トランスジェニックラットの大腸炎の重症度と腸内細菌叢組成に及ぼす影響。Clin Diagn Lab Immunol. 2004;11:581-587. doi: 10.1128/CDLI.11.3.581-587.2004. [Crossref], [PubMed], [Google Scholar].
Food and Agriculture Organization. World food and agriculture - statistical yearbook 2022. ローマ: FAO; 2022. 10.4060/cc2211en. [Crossref], [Google Scholar].
Lee SH, Kwon JE, Cho M-L. 炎症性腸疾患の免疫学的病態。Intest Res. 2018;16:26-42. doi: 10.5217/ir.2018.16.1.26. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Calder PC. 多価不飽和脂肪酸と炎症。Biochem Soc Trans. 2005;33:423-427。[クロスレフ]、[PubMed]、[Webオブサイエンス®]、[Googleスカラー]。
Chapkin RS, Davidson LA, Ly L, Weeks BR, Lupton JR, McMurray DN. (n-3)脂肪酸の免疫調節効果:炎症と結腸がんとの推定される関連性。J Nutr. 2007;137:200S-204S。[Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Agus A, Denizot J, Thévenot J, Martinez-Medina M, Massier S, Sauvanet P, Bernalier-Donadille A, Denis S, Hofman P, Bonnet R, et al. Western diet induces a shift in microbiota composition enhancing susceptibility to adherent-invasive E. coli infection and intestinal inflammation. Sci Rep. 2016;6:19032. doi: 10.1038/srep19032. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
食餌性乳化剤は、付着性浸潤性大腸菌の遺伝子発現に直接影響を与え、慢性腸炎を促進する。この論文では、大腸菌の遺伝子発現に直接的な影響を与える乳化剤について、その作用機序を明らかにした。[Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Gimier E, Chervy M, Agus A, Sivignon A, Billard E, Privat M, Viala S, Minet-Quinard R, Buisson A, Vazeille E, et al. Methyl-donorの補充はクローン病モデルマウスにおける付着性-侵入性大腸菌による腸内コロニー形成を予防する。この論文では、クローン病モデルマウスにおいて、メチルドナー補給が付着性侵入性大腸菌による腸管コロニー形成を抑制することを明らかにした。[クロスリファレンス], [PubMed], [Web of Science ®], [Google Scholar].
Kaur N, Chen C-C, Luther J, Kao JY. 炎症性腸疾患における腸内細菌異常症。Gut Microbes. 2011;2:211-216. doi: 10.4161/gmic.2.4.17863. [Taylor & Francis Online], [Web of Science ®], [Google Scholar].
Gkouskou KK, Deligianni C, Tsatsanis C, Eliopoulos AG. 炎症性腸疾患モデルマウスにおける腸内細菌叢。Front Cell Infect Microbiol. 2014;4:28. doi: 10.3389/fcimb.2014.00028. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Alam MT, Amos GCA, Murphy ARJ, Murch S, Wellington EMH, Arasaradnam RP. 炎症性腸疾患患者における分類学的レベルの異なる微生物の不均衡。Gut Pathog. doi: 10.1186/s13099-019-0341-6. [クロスリファレンス], [PubMed], [Web of Science ®], [Google Scholar].
マートンLT、デA GR、デCA、バルバリョSM。オメガ脂肪酸と炎症性腸疾患:概要。Int J Mol Sci Int. 2019;20(19):4851. doi:10.3390/ijms20194851. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
肥満と炎症:関連メカニズムと合併症。Arch Med Sci. 2017;13:851-863. doi: 10.5114/aoms.2016.58928. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
de Vos WM, Tilg H, Van Hul M, Cani PD, de Vos WM. 腸内細菌叢と健康:メカニズム的洞察。Gut. 2022;71(5):1020–1032. doi:10.1136/gutjnl-2021-326789. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Naftali T. Is cannabis of potential value as a therapeutic for inflammatory bowel disease? dig. Dis Sci. 2019;64(10):2696-2698. doi:10.1007/s10620-019-05763-8. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
シュミッツG、エッカーJ.n-3とn-6脂肪酸の相反する効果。プログ脂質Res. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
(14R,15S)-14,15-ジヒドロキシ-5Z,8Z,10E,12E-イコサテトラエン酸によるヒトナチュラルキラー細胞活性の阻害. Proc Natl Acad Sci USA. 1984;81(22):6914–6918. doi:10.1073/pnas.81.22.6914. [クロスフ], [PubMed], [Web of Science ®], [Google Scholar].
腸内細菌叢が腸内環境を制御していることを明らかにした。微生物叢は、転写因子Hepatocyte nuclear factor 4 alphaを抑制することによって腸上皮遺伝子発現を制御する。Genome Res Int. 2017;27(7):1195-1206. doi:10.1101/gr.220111.116. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Lickwar CR, Davison JM, Kelly C, Mercado GP, Wen J, Davis BR, Tillman MC, Semova I, Andres SF, Vale G, et al. 小腸上皮による異なる微生物シグナルと栄養シグナルの転写統合。Cell Mol Gastroenterol Hepatol. 2022;14(2):465–493. doi:10.1016/j.jcmgh.2022.04.013. [クロスリファレンス], [PubMed], [Web of Science ®], [Google Scholar].
Lei X, Ketelut-Carneiro N, Shmuel-Galia L, Xu W, Wilson R, Vierbuchen T, Chen Y, Reboldi A, Kang J, Edelblum KL, et al. 上皮HNF4Aは免疫シグナル分子の直接制御を介して上皮内リンパ球コンパートメントを形成する。J Exp Med. 2022;219:e20212563. doi: 10.1084/jem.20212563. [クロスリファレンス], [PubMed], [Web of Science ®], [Google Scholar].
Kühn R, Löhler J, Rennick D, Rajewsky K, Müller W. インターロイキン10欠損マウスは慢性腸炎を発症する。Cell. 1993;75:263-274. doi: 10.1016/0092-86749380068-P. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
Alavi S, Mitchell JD, Cho JY, Liu R, Macbeth JC, Hsiao A. Interpersonal gut microbiome variation drives susceptibility and resistance to Cholera Infection. Cell. 2020;181:1533-46.e13. doi: 10.1016/j.cell.2020.05.036. [Crossref]、[PubMed]、[Web of Science ®]、[Google Scholar].
タバコの煙に曝露したマウスにおける黄砂誘発大腸炎の重症度低下は、免疫調節と微生物シフトに関連している。SciRep.2020;10:3829.doi:10.1038/s41598-020-60175-3. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
モンバルボンM、ピシャヴァンM、ラングロワA、エルドゥアルE、マッジョットF、ニュートC、マレヴェイT、ダランシーS、デュブコイL、トロッタインF、ら。マウスの大腸炎症は、iNKT細胞のリクルートを通じてタバコの煙によって改善される。PLoS One. 2013;8:e62208. doi: 10.1371/journal.pone.0062208. [クロスリファレンス], [PubMed], [Web of Science ®], [Google Scholar].
オレイン酸またはリノール酸の経口投与は創傷治癒の炎症期を促進する。J Invest Dermatol. 2012;132(1):208–215. doi:10.1038/jid.2011.265. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
前田泰志、Hwang-Verslues WW、Wei G、Fukazawa T、Durbin ML、Owen LB、Liu X、Sladek FM. 腫瘍抑制因子p53は、ヒト肝細胞核因子4α(HNF4α)遺伝子の発現をダウンレギュレートする。生化学雑誌2006;400:303-313. [このような遺伝子発現を解析することは、遺伝子発現を解析する上で非常に重要である。
Couter CJ, Surana NK. マウス小腸リンパ球の単離とフローサイトメトリーによる特性解析。J Vis Exp Int. 2016;111. doi: 10.3791/54114. [Crossref], [Google Scholar].
Ruegger PM, Clark RT, Weger JR, Braun J, Borneman J. rRNA内部転写スペーサーのハイスループット配列解析による細菌の分解能の向上。J Microbiol Methods. 2014;105:82-87. doi: 10.1016/j.mimet.2014.07.001. [クロスフ], [PubMed], [Web of Science ®], [Google Scholar].
Frank JA, Reich CI, Sharma S, Weisbaum JS, Wilson BA, Olsen GJ. 細菌16S rRNA遺伝子の増幅に一般的に使用される2種類のプライマーの批判的評価。Appl Environ Microbiol. 2008;74:2461-2470. doi: 10.1128/AEM.02272-07. [Crossref]、[PubMed]、[Web of Science ®]、[Google Scholar].
ハントDE、Klepac-Ceraj V、Acinas SG、Gautier C、Bertilsson S、Polz MF. 細菌多様性の系統学的研究に使用する23S rRNA PCRプライマーの評価。Appl Environ Microbiol. 2006;72:2221-2225. doi: 10.1128/AEM.72.3.2221-2225.2006. [Crossref]、[PubMed]、[Web of Science ®]、[Google Scholar].
Edgar RC. UPARSE: 微生物アンプリコンリードからの高精度OTU配列。Nat Methods. 2013;10:996-998. doi: 10.1038/nmeth.2604. [Crossref]、[PubMed]、[Web of Science ®]、[Google Scholar].
Edgar RC. UNOISE2: Improved error-correction for Illumina 16S and ITS amplicon sequencing[Internet]. 10.1101/081257. [Crossref], [Google Scholar].
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ. 基本的なローカルアライメント検索ツール。この検索ツールは、遺伝子発現を調べるのに便利である。[Crossref]、[PubMed]、[Web of Science ®]、[Google Scholar].
Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Pena AG, Goodrich JK, Gordon JI, et al. QIIMEによる高スループットコミュニティシーケンスデータの解析。Nat Methods. 2010;7:335-336. doi: 10.1038/nmeth.f.303. [このような研究は、科学技術振興機構(JST)が行っている。
Pedersen TL, Gray IJ, Newman JW. 血漿および血清オキシリピン、エンドカンナビノイド、胆汁酸、ステロイド、脂肪酸、非ステロイド性抗炎症薬の96ウェルプレートフォーマットでの定量。Anal Chim Acta. 2021;1143:189-200. doi: 10.1016/j.aca.2020.11.019. [Crossref], [PubMed], [Web of Science ®], [Google Scholar].
PDFダウンロード
関連研究
こんな記事も読まれています
おすすめ記事
引用元
情報提供者
著者
研究開発関係者
編集者
図書館員
学会
オープンアクセス
概要
オープンジャーナル
オープンセレクト
Dove Medical Press
F1000Research
機会
別刷りとe-prints
広告ソリューション
早期出版
企業アクセスソリューション
ヘルプと情報
ヘルプ&コンタクト
ニュースルーム
すべてのジャーナル
書籍
最新情報
ご登録いただくと、個別のリサーチやリソースをEメールでお届けします。
登録する
テイラー・アンド・フランシス・グループのFacebookページ
テイラー・アンド・フランシス・グループTwitterページ
テイラー・アンド・フランシス・グループLinkedinページ
テイラー・アンド・フランシス・グループYoutubeページ
テイラー・アンド・フランシス・グループ微博ページ
著作権 © 2023 Informa UK LimitedプライバシーポリシーCookie利用規約アクセシビリティ
イングランド&ウェールズ登録第3099067号
5 ハウィック・プレイス|ロンドン|SW1P 1WG
Acceptクッキーポリシー
当社は、お客様のウェブサイト体験を向上させるためにクッキーを使用しています。クッキーの使用方法と、クッキーの設定を管理する方法については、クッキーポリシーをご覧ください。このメッセージを閉じることで、クッキーの使用に同意したことになります。
この記事が気に入ったらサポートをしてみませんか?
