炎症性腸疾患における環状RNA
本文へスキップ
トップバーナビゲーション
免疫学の最前線
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
44
総閲覧数
記事のインパクトを見る
記事のaltmetricスコアは2
レビュー記事
Front. 免疫学、2023年12月22日
粘膜免疫
第14巻-2023年|https://doi.org/10.3389/fimmu.2023.1307985
炎症性腸疾患における環状RNA
https://www.frontiersin.org/articles/10.3389/fimmu.2023.1307985/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FIMMU_XXXXXXXX_auto-dlvrit


Jie Lun1† Jing Guo1† Mengchao Yu2† Hongwei Zhang3* Jing Fang1*
1Department of Oncology, The Affiliated Hospital of Qingdao University, Qingdao Cancer Institute, Qingdao, China (青島大学附属病院腫瘍科 青島癌研究所 中国青島市
2中国青島市立病院中央研究所
3中国済南市青島大学附属山東省母子医院
炎症性腸疾患(IBD)は、腸管に障害をもたらすいくつかの慢性炎症性疾患を包括する用語である。IBDの病態解明はかなり進んでいるが、正確な発症機序は完全には解明されていない。サーキュラーRNA(circRNA)は、真核生物に存在する一本鎖の共有結合で閉じた内因性分子で、様々な生物学的機能を持つ。サーキュラーRNAは、癌、心血管疾患、神経疾患など多くの疾患において調節作用を持つことが示されている。CircRNAはIBDにおいても重要な役割を果たすことが判明しており、IBDとの関連では十分な研究が行われていないが、IBDの診断や予後のバイオマーカーとして、またIBDの治療標的となり得るCircRNAがいくつか同定されている。本稿では、IBDにおけるcircRNAの機能と役割の解明に関する最近の進歩を概観し、その臨床応用の可能性について述べる。
1 はじめに
炎症性腸疾患(IBD)は、消化管全体を侵す慢性炎症性疾患である。IBDには大きく分けてクローン病(CD)と潰瘍性大腸炎(UC)の2種類がある。IBDの罹患率は年々増加しており、世界中で懸念されている(1, 2)。IBDは当初、欧米先進国の人々に多く発症すると考えられていた。ここ数十年、IBDの罹患率は、特に最近の先進国や発展途上国で増加の一途をたどっている(3, 4)。IBDの増加は、工業化や環境・生活様式の大きな変化と並行して進行してきた(1)。現在、IBDの治療には抗生物質、抗炎症剤、手術が用いられている。これらの治療法の有効性は様々であり、通常は満足のいくものではない(5, 6)。現在、IBDを治癒させることは不可能であり、QOLに深刻な影響を及ぼしている。したがって、この疾患に対するアンメット・メディカル・ニーズが存在する。IBDの病態はよくわかっていない。多くのエビデンスは、IBDはおそらく遺伝的因子、環境因子、腸内細菌叢の複合作用によって引き起こされ、腸管上皮バリアの破壊につながることを示している(7)。しかし、その程度や根本的なメカニズムはよくわかっていない。IBDの現在の治療法は、主に症状の治療に重点を置いており、粘膜上皮の修復にはあまり注意が払われていない(8)。従来の治療アプローチでは、期待通りの結果が得られないこともある。腸管バリア機能を改善する新たな治療法を模索する努力がなされている(9)。IBDの病態を認識することは、患者の症状を和らげるためのより効率的な治療法の開発に必ず役立つであろう。
環状RNA(circRNA)は、共有結合で閉じたループ構造を持つが、5′キャップや3′ポリ(A)テールを持たないノンコーディングRNAである(10)。circRNAはその環状構造のおかげで、エキソヌクレアーゼが過剰な条件下でない限り、エキソヌクレアーゼによる分解から守られている(11)。CircRNAは一般的に細胞質に存在する(12, 13)。CircRNAは豊富に発現し、生物種間で高度に保存されており(14)、細胞種特異的、組織特異的なパターンを示すことが多い(15)。真核生物では何千ものcircRNAが同定されており(16, 17)、これらのcircRNAのいくつかは生理学的、病理学的プロセスにおいて重要な役割を果たしていることが判明している(18-20)。circRNAは、慢性炎症性疾患、代謝異常、神経疾患、心血管疾患、癌などの様々な疾患に関与している(21-24)。固有の環状特性により、circRNAは細胞内でも血液や唾液などの細胞外血漿中でも極めて安定である(25-27)。circRNAはエクソソームによって細胞体から細胞外環境に輸送され(28)、体液中に発現している(29)。これらの知見は、疾患に関連するcircRNAが有望な診断バイオマーカーであることを示唆している。実際、いくつかのcircRNAが潜在的な診断バイオマーカーとして同定されている(30)。circRNAは非常に安定であり、特異的に発現することから、複数の疾患治療のための有望かつ効果的な標的でもある(14, 31)。circRNAの機能に基づいて、アンチセンスオリゴ、RNA干渉、低分子化合物、CRISPR/Cas9などのアプローチが提案されている(14, 32)。
IBDでは、circRNAの特性はよく分かっておらず、その機能もよく分かっていない。IBDにおけるcircRNAの研究はあまり行われていないが、これらの分子がIBDにおいて重要な役割を果たしていることが示されている(33)。IBD患者と健常人の間で、いくつかのcircRNAの発現に差があることが判明している(34)。これらのcircRNAの中には、IBDの発症を制御する作用を示すものもある(33, 35)。circRNAがIBDの診断、予後、治療に応用できる可能性を示す証拠が増えつつある(33, 36)。IBDに対するcircRNAの機能については、今後さらに研究が進むことは間違いない。ここでは、IBDにおけるcircRNAの役割に関する現在の知見を概説し、臨床での利用の可能性について議論したい。
2 IBDとcircRNAの概要
2.1 IBDの病態に関する基礎知識
IBDの病態はよくわかっていない。多くの研究により、IBDは遺伝的欠陥、環境異常、腸内ホメオスタシスを乱し、腸管における免疫介在性炎症を誘発するディスバイオシスなど、いくつかの要因によって引き起こされる多因子疾患であることが示されている(7, 37-39)。
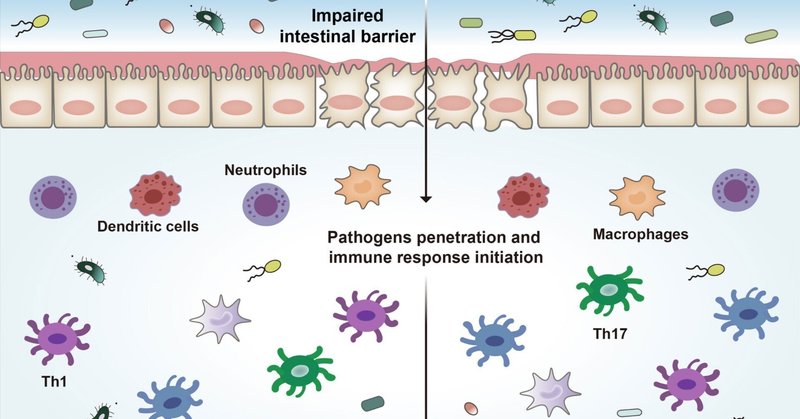
IBDの発症機序の一つとして、腸管バリア機能の喪失が提唱されており、これによって免疫細胞が腸管内容物に暴露され、免疫ホメオスタシスが破壊される。腸管バリアは腸管上皮細胞(IEC)と免疫細胞から構成されている。IECには、腸細胞(吸着細胞)、杯細胞、神経内分泌細胞、パネス細胞、ミクロフォールド細胞(M細胞)、房細胞などがある(40)。最も豊富な細胞は腸細胞と杯細胞である。杯細胞は上皮を覆う粘液を分泌し、これは粘膜の防御と修復に不可欠である(41)。腸上皮バリアは、IECに関連した厚い粘膜層を構成している。杯細胞から分泌される主要なムチンであるムチン2を欠損させると、マウスモデルで自然大腸炎を引き起こすことが証明された(42)。IEC同士は、上皮細胞同士をつなぎとめるタイトジャンクション(TJ)によって結合し、正常な腸管バリアの完全性を維持している(9, 43)。腸管TJタンパク質は透過性シールの形成に役立っており、このシールは副細胞輸送経路において重要な役割を果たしている(44, 45)。これらの重要な構成要素が組み合わさって、病原体に対する物理的バリアが形成される。腸管上皮バリアは腸管内腔と粘膜の免疫系を隔てており、このバリアの障害がIBDの中心的なメカニズムであると考えられている。ひとたび上皮バリアが破壊されると、免疫細胞は内腔から微生物やその他の抗原にさらされることになり(図1)、その結果、炎症が進行し、腸管バリアの完全性が損なわれることになる(46-49)。
図1
www.frontiersin.org
図1 IBDの病態。腸管上皮バリアの破壊は細菌やその他の抗原の侵入を引き起こし、一連の炎症反応を誘発し、最終的に腸炎を引き起こす。Th1は1型Tヘルパー細胞、Th2は2型Tヘルパー細胞、Th17は17型Tヘルパー細胞。
腸管上皮には、好中球、樹状細胞(DC)、マクロファージ、リンパ球など多くの免疫細胞が存在する(50, 51)。これらの免疫細胞は、IECの物理的・機能的バリアを補完し、IBDにおける免疫応答に寄与している(39, 52)。腸管バリアの破壊に応答して、微生物産物やその他の抗原がバリアを通過し、DCやその他の抗原提示細胞(APC)と出会い、炎症性および抗炎症性のシグナル伝達経路を開始し、局所および循環リンパ球の異なるサブセットを活性化する(53, 54)。これらのAPCはサイトカインを分泌し、T細胞に抗原を提示することで、自然免疫と適応免疫を結びつけている(55-57)。病原体に応答すると、1型Tヘルパー(Th1)細胞が活性化され、細胞媒介免疫と遅延型過敏反応を媒介する(58, 59)。Th1細胞はIL-12によって誘導され、IFN-γ、TNF-α、IL-2を分泌し、マクロファージや好中球を動員する(60)。Th1反応の異常は腸の炎症と関連していると考えられている。Th2細胞はIL-4によって誘導され、IL-4、IL-5、IL-13を分泌し、Th1細胞の発達を抑制し、マクロファージを活性化することによって自然免疫応答を増強する(58)。Th17細胞はIL-17A、IL-17F、IL-21、IL-22を産生し、これらは腸の炎症を促進するのに重要である(61, 62)。制御性T細胞(Treg)もIBDの病態に関与している(63)。これらの細胞は、IL-10やTGF-βを含む抗炎症因子を産生することにより、免疫寛容を調節するという負の役割を担っている(64)。
微生物叢の恒常性の維持と腸管バリアの保護には、免疫細胞と腸管上皮細胞との協力関係がある。腸管固有層に存在する形質細胞は、免疫グロブリンA(IgA)を分泌する。分泌されたIgAは、単純拡散を介して腸管上皮上の高分子免疫グロブリン受容体(pIgR)に到達し、腸管内腔に移行する。
腸管バリアのホメオスタシスは、腸管のホメオスタシスを維持する必須成分である常在細菌叢によって強化される(68, 69)。常在微生物は、消化や代謝、上皮バリアや宿主免疫系の恒常性の調節、病原体のコロニー形成の抑制など、宿主の多くの生理的プロセスに影響を及ぼす(70-73)。腸内では、ほとんどの微生物が宿主と相互扶助的な関係を保ちながら生活しており、共生微生物の中には特定の条件下で病気を引き起こすものもある(39)。腸内細菌叢の組成は、宿主の腸炎に対する感受性を決定する重要な因子であると考えられている(39)。腸内細菌叢組成の変化、すなわちディスバイオーシスは、IBDの重要な特徴である(74)。腸内細菌叢の組成が変化すると、腸管透過性の亢進や腸の炎症と相まって、有益な微生物代謝産物と有害な微生物代謝産物のバランスが崩れる(73)。常在微生物のディスバイオシスと腸管バリアの崩壊は、IBD発症の根底にある主要なメカニズムであると考えられている(39)。
微生物叢と腸管免疫系には双方向の関係がある。腸内細菌叢には免疫調節作用がある(75)。腸内細菌叢の異常による自然免疫は、IBD発症の中心的なプロセスである(38)。腸管免疫応答は腸内細菌叢と免疫細胞からなる結果である(52)。プロバイオティクスの介入は、炎症反応と抗炎症反応のバランスを保ち、IBD患者の炎症因子と抗炎症因子の産生に影響を与える。微生物-免疫軸を調節することは、IBDの新たな治療法につながる可能性がある。例えば、ビフィドバクテリウム・インファンティスの投与は、UC患者におけるC反応性タンパク質、TNF-α、IL-6などの炎症性サイトカインの産生を減少させた(76)。circRNAが微生物叢に直接影響を与えるかどうかはまだ不明である。免疫細胞や腸上皮細胞に対するcircRNAの影響を考慮すると、circRNAは、おそらく免疫系や上皮細胞を介して、間接的に微生物叢に影響を与えている可能性がある。そしてその逆もまた然りで、微生物叢は腸管上皮細胞や免疫細胞におけるcircRNAの発現にも影響を与えている可能性がある。
2.2 circRNAの生合成と機能
circRNAは、前駆体mRNA(pre-mRNA)からバックスプライシングを介して産生される(27, 77)。circRNAの大部分はタンパク質をコードする遺伝子によってコードされている。circRNAは1つまたは複数のエクソンから構成されている(78)(図2)。いくつかのcircRNAでは、エクソンが環状化され、エクソンとエクソンの間にイントロンが保持されており、これらのcircRNAはエクソン-イントロン型circRNAあるいはEIciRNAと呼ばれている(79)。circRNAにはもう一つ、circular intronic RNA (ciRNA)と呼ばれるものがある。CiRNAはデブランチングを免れたイントロンラリアットから産生される(80)。エクソンのみのcircRNAは主に細胞質に存在するが(12, 78)、ciRNAは核内に局在することを好む(80, 81)。同種の直鎖RNAと比較して、多くのcircRNAは発現レベルが低い。しかし、いくつかの遺伝子では、circRNAの発現は高レベルである(82)。いくつかのcircRNAは、血小板由来の細胞外小胞に豊富に発現している(83)。
図2
www.frontiersin.org
図2 circRNAの生合成と機能。circRNAは主に、エクソンを先行するエクソンに接続するバックスプライシングイベントの産物であり、その結果、共有結合で閉じられたエクソン型circRNAとなる(I)。内部のイントロンが保持されると、エクソンとイントロンの配列を含むエクソン-イントロン型circRNA(EIcircRNA)が産生されることがある。分岐していないイントロンのラリアットは、環状イントロンRNA(ciRNA)を形成する。EIcircRNAはRNA pol IIと会合し、U1 snRNP (II)との相互作用を介して親遺伝子の転写を促進する。ciRNAは核内に蓄積し、親遺伝子のpol II活性を促進することにより、cisで遺伝子の転写を制御する(III)。細胞質では、circRNAはmiRNAスポンジとして働き(IV)、RNA結合タンパク質(RBP)を含むタンパク質と相互作用し(V)、タンパク質に翻訳される(VI)。また、circRNAは疾患のバイオマーカーとしても利用される可能性がある(VII)。
多くの研究により、豊富なcircRNAの中にはマイクロRNA(miRNA)のスポンジとして働くものがあることが示されている(84)。多くのcircRNAは一つ以上のmiRNA結合部位を持ち、いくつかのcircRNAは複数のmiRNAが結合する部位を持つ(21)。miRNAのスポンジとして、circRNAはmiRNAの機能を隔離し、抑制する(85)。例えば、circular RNA ciRS-7はmiR-7に対して70以上の結合部位を持ち、miR-7をスポンジしてmiR-7の活性を抑制し、その結果miR-7標的遺伝子の発現を増加させる(84)。さらに、circRNAの吸着はmiRNAの発現を変化させるかもしれない。例えば、ciRS-7をノックアウトしたマウスでは成熟miR-7のレベルが減少したことから、ciRS-7はmiR-7を分解から守る機能を持つことが示唆された(86)。ciRS-7によるmiR-7の阻害あるいは保護は細胞の状況に依存する。多くのcircRNAの発現レベルは非常に低く、多くのcircRNAはmiRNAと結合する部位をほとんど持っていない(78, 87)ので、これらのcircRNAはmiRNAのスポンジとしては機能しないかもしれない。
circRNAはタンパク質と結合することができ、RNA結合タンパク質(RBP)を含む多くのcircRNA関連タンパク質が同定されている(21, 27)。circRNAとRBPとの結合は、circRNAの生合成、核外輸送、分解、機能を制御する可能性がある(88, 89)。相互作用を通して、circRNAは関連タンパク質の挙動に影響を与えたり、運命に影響を与えたりする可能性がある(89-91)。タンパク質のスポンジとしての機能(11, 92)に加え、circRNAはタンパク質の足場(93, 94)やタンパク質のリクルーター(95)として機能し、それによってタンパク質の細胞内局在、タンパク質間相互作用、安定性、タンパク質-DNA相互作用を制御することができる。例えば、肝細胞癌(HCC)細胞では、circRPN2はエノラーゼ1(ENO1)と結合し、ENO1の分解を促進し、それによって細胞の解糖を制御している(96)。CircAmotl1は、Stat3の発現と核内移行を促進し、マウスの切除創傷モデルにおける治癒過程を促進した(97)。
ほとんどのcircRNAは細胞質に存在するが、EIciRNAとciRNAは核内に保持され、そこでU1核小リボ核タンパク質と相互作用し、親遺伝子の転写を促進する(79)。また、RNAポリメラーゼII (Pol II)を介した転写を積極的に調節することによっても転写を促進することができる(80) (図2)。circRNAの大部分はノンコーディングRNAであると考えられている。しかしながら、最近の研究では、circRNAの中には特定の条件下でキャップ非依存的にタンパク質に翻訳されるものがあることが示されている(98, 99)。
3 IBDにおけるcircRNAの役割
circRNAは多くの生物学的過程や疾患に関与している。circRNA定量的形質座位(circQTLs)のSNPsのサブセットが、複雑な疾患、特に統合失調症、IBD、II型糖尿病のゲノムワイド関連研究のシグナルと高度に関連していることが示された(100)。遺伝子発現の調節因子として、circRNAは遺伝的変異や表現型の変化に影響を与える。いくつかのcircRNAはIBDの発症に関与していることが分かっている(表1)。多くのcircRNAがヒトで見つかっているが、IBDにおける役割はあまり調べられていない。IBDにおけるcircRNAプロファイルを解析し、その機能を調べることで、IBDの根底にあるメカニズムが明らかになると考えられる。
表1
www.frontiersin.org
表1 IBDに関与するCircRNA
3.1 サークRNAと腸上皮バリア
腸管上皮バリアは生体防御の第一線である。腸上皮は、接合タンパク質を介して強固に結合した単層の上皮細胞から構成され、腸管バリアの完全性を維持している。腸上皮バリアは腸管内腔の病原体から宿主を守っており、その破壊がIBDの病態の中核をなしていると考えられている。腸管幹細胞(ISC)は、IECに分化することができる腸管上皮の分裂細胞であり、上皮内膜の更新を担っている(118, 119)。ロイシンリッチリピート含有Gタンパク質共役型受容体5(Lgr5)陽性ISCは、ISCのサブグループを構成する。Lgr5+ ISCは、自己複製と分化を経て、傷ついた腸上皮を修復し、腸の恒常性を維持する。Lgr5+ISCの自己複製と分化が乱れると、腸の炎症につながる可能性がある(120, 121)。環状RNA circPan3は、ヒトとマウスのLgr5+ ISCsで過剰発現していた(122)。ISCにおいて、circPan3はIL-13受容体サブユニット(IL-13Rα1)mRNAと結合し、IL-13Rα1の発現を促進し、ISCの自己複製を増加させた。ヒトLgr5+ ISCにおけるcircPan3の枯渇は、ISCの更新を阻害し、上皮再生の阻害につながった(122)。同様に、circPan3はマウスISCのIL-13Rα1 mRNAと結合して安定化し、IL-13Rα1の発現を可能にした。これらの結果は、circPan3がISCの自己再生に重要であることを示している。最近の報告では、環状RNA circBtnl1がAtf4 mRNAの安定性を阻害することにより、ISCの自己複製を抑制することが示された(123)。CircBtnl1はAtf4 mRNAの崩壊を仲介してSox9の転写を抑制し、ISCの自己複製を負に調節した。
オートファジーの間、リソソーム中の細胞質病原体は標的とされ、分解される(124)。ATG16L1はオートファジーと腸上皮の恒常性維持に重要な役割を果たしている(125)。RNA結合タンパク質HuRは転写後制御因子である(126, 127)。腸上皮では、HuRと環状RNAのcircPABPN1がATG16L1の発現を制御している(128)。高レベルのcircPABPN1は、IECにおいてHuRとAtg16l1 mRNAとの結合を阻害し、HuRによって誘導されるATG16L1の翻訳を抑制し、ATG16L1の産生率を低下させた。ATG16L1の発現を制御することにより、HuR-circPABPN1相互作用はオートファジーを制御している。この結果は、HuR/circPABPN1/ATG16L1軸がIBDの発症に関与していることを示唆している(128)。最近の研究では、circHECTD1の過剰発現が、miR-182-5pの作用を介してHuR依存的なオートファジーを促進することにより、UCを緩和することが明らかにされた(101)。CircHECTD1の発現はUC患者の大腸粘膜で低下していた。circHECTD1の過剰発現は、デキストラン硫酸ナトリウム塩(DSS)投与マウスにおいて、オートファジーを促進することにより、結腸の傷害数を減少させ、炎症を抑制した。
Circ_0001187のレベルは、UC患者の大腸粘膜で増加していた(102)。circ_0001187は、MYD88を標的とするmiR-1236-3pのスポンジとして働いていた。circ_0001187の欠失は、ヒト正常大腸粘膜細胞において、TNF-α誘発アポトーシス、炎症、酸化ストレスを抑制し、これはmiR-1236-3p阻害剤によって阻害された。その結果、circ_0001187はmiR-1236-3pを介してUCの発症を促進することが示された。circ_0001187の発現は、UC患者の血清エクソソームにおいて上昇することがわかった。これらの知見は、circ_0001187がUCのバイオマーカーおよび/または治療標的となる可能性を示唆している。
ゲノムワイドなプロファイル解析により、circHIPK3を含む約300のcircRNAが、セカール結紮穿刺後のマウス腸管粘膜で発現に差があることが示された(103)。IBD患者の腸管上皮細胞では、circHIPK3の発現レベルが低下していた。circHIPK3の過剰発現は創傷後の腸上皮の修復を促進し、一方、circHIPK3の枯渇は上皮の回復を抑制した。マウスでは、circHIPK3をサイレンシングするとIECの増殖が阻害され、circHIPK3の過剰発現は腸上皮の再生を促進した。メカニズム的には、circHIPK3はmiR-29bをスポンジ化し、IECにおけるRac1、Cdc42、サイクリンB1の発現を増加させた。これらの知見は、circHIPK3がmiR-29bのレベルを低下させることによって腸管上皮の修復に寄与していることを示している。
注目すべきことに、TNF-αはCDの文脈でcircRNA_103765の発現を促進し、これは抗TNF-α mAbで処理することにより逆転した(104)。In vitroでTNF-αを処理すると、circRNA_103765の発現が誘導され、この発現に細胞のアポトーシスが依存していた。circRNA_103765の枯渇は、TNF-αによるヒトIECsのアポトーシス誘導を妨げた。さらに、circRNA_103765はmiR-30ファミリーメンバーをスポンジ化し、Delta-like ligand 4(DLL4)の発現を増強した。これらの知見は、circRNA_103765がmiR-30ファミリーメンバーをスポンジしてDLL4の発現を媒介することにより、IBDを制御していることを示している。circRNA_103765の阻害は、IBDの治療戦略となりうるかもしれない。
CD患者の大腸組織におけるcircGMCL1の発現レベルは低下しており、この効果はCDに関連した炎症指標の上昇と関連していた(105)。CircGMCL1はオートファジーを誘導し、NLRP3インフラマソームが誘導するパイロプトーシスと炎症性サイトカインを抑制した。あるメカニズム研究では、circGMCL1の発現はmiR-124-3pレベルと関連しており、その結果、オートファジー関連遺伝子であるmiR-124-3p標的アネキシン7の発現を促進することが示された。さらに、実験的大腸炎モデルにおいて、oe-circGMCL1を導入したポリ乳酸-グリコール酸ミクロスフェアをマウスに投与すると、大腸炎の重症度が有意に低下したことから、circGMCL1がCD治療の標的となる可能性が示された。
CircRNAは敗血症ラットの腸粘膜を保護した。Liuら(129)は、敗血症ラットの腸管上皮透過性、酸化的損傷、および形態学的変化におけるcirc_0001105の役割を調査し、circ_0001105が腸の炎症、酸化的損傷、およびYAP1の発現を低下させることによってラットの腸管バリア機能を保護し、それによって敗血症ラットの生存期間を延長させることを明らかにした。circDMNT3Bの発現低下は、敗血症ラットのmiR-20b-5pをスポンジ化するため、腸粘膜透過性の低下に寄与した(130)。したがって、circDNMT3Bのサイレンシングは腸粘膜の透過性を増加させ、酸化的損傷を引き起こし、腸組織中のIL-6とIL-10のレベルを増加させた。circDNMT3Bを欠損させると、リポ多糖(LPS)で処理したヒト腸管上皮Caco2細胞のアポトーシス率が上昇した。これらの結果は、circDMNT3Bがラット腸管上皮バリアを保護していることを示している。
circRNA CCND1の発現レベルは、UC患者およびLPSで処理したCaco2細胞で低下していた。循環RNA CCND1は、Caco-2細胞のLPS誘導アポトーシスと炎症反応を抑制し、miR-142-5p/NCOA3軸を介してUCの保護的役割を果たした(106)。ロング・ノンコーディングRNAであるCDKN2B-AS1は、直鎖状と環状の両方で発現している(110)。CDKN2B-AS1は結腸上皮細胞に発現しており、その発現レベルはUC患者で低下している。線状および円形のCDKN2B-AS1の発現を阻害すると、バリア機能が増加した。
circAtp9bの発現上昇はUC患者の血漿サンプルで観察された(112)。LPS処理はヒト大腸上皮細胞におけるcircAtp9bの発現を上昇させ、PTENの発現を増加させ、最終的に大腸上皮細胞のアポトーシスを促進した。Circ_0001021の発現はUC患者で減少しており、これはUCの重症度と関連していた(113)。circ_0001021はmiR-224-5pをスポンジ化することにより、上皮のバリア機能を制御していた。実験的大腸炎では、circSMAD4が大腸組織で発現上昇し、circSMAD4の増加は炎症因子の増加と正の相関を示した(115)。circSMAD4の過剰発現は、TJタンパク質の機能を破壊し、miR-135a-5pをスポンジすることによって上皮細胞のアポトーシス率を増加させた。Si-circSMAD4投与は実験的大腸炎を改善した。
3.2 CircRNAと免疫恒常性
circRNAは、自己免疫疾患、癌、感染症などの免疫関連疾患の発症に関与している(131-133)。多くの研究により、circRNAは免疫応答、特に骨髄系やリンパ系の細胞において重要な役割を果たしていることが示されている(100, 134)。
circRNAはマクロファージの活性化に一役買っている(135)。CircCdr1asは、炎症性マクロファージで発現低下し、抗炎症性マクロファージで発現上昇することが見いだされ、CircCdr1asの過剰発現は、抗炎症マーカーの発現を誘導し、ナイーブマクロファージと炎症性マクロファージにおけるCD206+細胞の割合を増加させた(136)。
circRNAはDCの制御にも関与している。自己免疫性肝炎患者の末梢血から採取した単球由来DCにおいて、差次的に発現するcircRNAが同定され(31)、circRNAがDCの機能に影響を与え、自己免疫疾患の病態に関与している可能性が示された。環状RNA circSnx5は、DC主導性の免疫と寛容を調節する(137)。メラトニンは、大腸炎モデルマウスの骨髄由来樹状細胞(BMDC)の活性化を阻害し、それは細胞の貪食能の阻害と炎症性サイトカインの分泌の減少によって反映された(138)。RNA配列解析の結果、メラトニンは、circRNA-0520やcircRNA-2243などのノンコーディングRNAに影響を与えることで、DSS誘発大腸炎マウスにおけるBMDCsの免疫寛容表現型を持つ細胞への変化を促進することが示された。
腸では、3群自然リンパ球(ILC3)が免疫、炎症、組織の恒常性の制御に重要な役割を果たしている(139, 140)。Liuら(116)は、腸の炎症条件下でILC3においてcircKcnt2が活性化されることを見出した。CircKcnt2は、ヌクレオソームリモデリング脱アセチル化酵素(NuRD)複合体をBatfのプロモーター上にリクルートし、適応免疫の重要なレギュレーターであるBatfの発現を抑制した。その結果、IL-17の発現が抑制され、それによってILC3の不活性化が促進され、自然免疫性大腸炎の抑制が促進された。最近の研究で、自然リンパ球のホメオスタシス制御におけるcircRNAの重要な役割が明らかになった。具体的には、circZbtb20はILC3細胞で高発現しており、circZbtb20を欠失させるとILC3細胞の数が減少し、細菌感染に対する感受性が上昇した(117)。CircZbtb20はAlkbh5とNr4a1 mRNAの相互作用を増強し、Nr4a1 mRNAのm6A修飾を損ない、mRNAの安定性を促進した。Nr4a1はNotch2シグナルを活性化し、ILC3細胞の恒常性を維持する。circRNA-miRNA-mRNAの軸を通して、circRNA_004662は、単球/マクロファージにおけるT細胞の活性化と増殖、炎症促進抑制、抗炎症促進反応に関与するmTORシグナル伝達に協力した(108)。
circRNAは、自然免疫に関係する二本鎖RNA(dsRNA)依存性プロテインキナーゼ(PKR)と結合し、阻害する(141)。ウイルス感染後、circRNAは分解されてPKRを遊離し、これが活性化されて免疫応答に寄与する。Poly(I:C)刺激やウイルス感染は、RNase Lを介したグローバルなcircRNAの分解を刺激し、これは初期の自然免疫応答におけるPKRの活性化に必要である。全身性エリテマトーデス患者の末梢血単核球(PBMC)では、リン酸化PKRの発現量が増加し、circRNAの発現量は減少していた。
自然免疫は、N6-メチルアデノシン(m6A)で修飾されたcircRNAによって阻害される(142)。m6A修飾のない外来circRNAは、K63結合ユビキチン鎖や自然免疫受容体RIG-Iと相互作用して、RIG-Iの重合と活性化を促進し、下流の抗ウイルスシグナル伝達を開始し、インターフェロン調節因子3(IRF3)の活性化を誘導し、それによって自己免疫経路の遺伝子の発現を促進する。
CircRNAは、炎症性サイトカインと抗炎症性サイトカインの産生を制御する(143)。Circ_0007456はICAM-1の発現を調節することにより、ナチュラルキラー(NK)細胞に対するHCCの感受性に影響を与えた(144)。HCC細胞から分泌されたCircUHRF1は、NK細胞によるIFN-γとTNF-αの分泌を阻害した(145)。非小細胞肺がん(NSCLC)細胞由来のエクソソームcircUSP7は、CD8+T細胞からのIFN-γ、TNF-α、グランザイム-B、パーフォリン分泌を阻害した(146)。Circ_0005519は、喘息患者のCD4+ T細胞においてIL-13とIL-6の発現を誘導することにより、CD4+ T細胞で発現が上昇した(147)。膀胱がん細胞由来のCircTRPS1は、CD8+ T細胞の消耗を調節した(148)。
CircRNA_103516は、CDとUCの両方で、寛解期に比べて再燃期に顕著に増加し、circRNA_103516の増加は疾患活動性と正の相関を示した(108)。circRNA_103516は、UCおよびCD患者において、炎症性サイトカインと正の相関を示し、抗炎症性サイトカインとは負の相関を示したことから、circRNA_103516はIBDにおいて炎症性機能を持つことが示唆された。狭窄および貫通性CD患者におけるcircRNA_103516の高い普遍性は、このcircRNAがCDの狭窄および貫通挙動に寄与していることを示している。Songら(149)は、circRIG-IがDEAD-Box Helicase 3 X-Linkedと相互作用してMAVS/TRAF5/TBK1軸を刺激し、IRF3を介したI型IFN転写を活性化し、大腸の炎症性障害を悪化させることを示した。Qiaoら(109)は、circRNA-102685がCD患者の大腸組織で高発現し、miRNA-146の作用を潜在的に制御し、NF-κBの活性化を通して腸の炎症を緩和し(150)、TregやDCなどの免疫細胞の機能に影響を与えることを示した(151)。さらに、circRNA-102685は、IBDで同定されたケモカインシグナル伝達経路とアポトーシスに関与していることが判明した(152, 153)。
免疫細胞の分化制御にもcircRNAが関与していることを示唆する証拠が増えている。circHIPK3はアレルギー性鼻炎におけるTh2分化に関与していた(154)。実験的自己免疫性脳脊髄炎モデルにおいて、circINPP4BがmiR-30aを標的とすることでTh17の分化を促進することが示された(155)。circRNA000324とcircRNA000324は、1型糖尿病患者におけるCD4+T細胞の分化制御に関与している可能性がある(156)。
3.3 IBDのバイオマーカーとしてのCircRNA
IBDの診断とモニタリングにゴールドスタンダードはない。臨床症状と病理組織学的検査を伴う内視鏡検査が、IBD診断のための2つの従来の方法である(157)。内視鏡検査と生検分析を組み合わせる方法は、IBDの診断に最も有効な方法である。効果的ではあるが、この方法は費用と侵襲性が高く、臨床医の専門知識が必要である(158)。IBD診断のための非侵襲的なバイオマーカーの開発が求められている。circRNAはIBDと関連しており、いくつかの研究ではcircRNAが非侵襲的で安価なバイオマーカーになる可能性が示唆されている。
IBDのバイオマーカーを同定することは、IBDの診断と予後に重要であり、IBDのバイオマーカーは病気の経過を予測し、治療効果をモニターするのに役立つ可能性がある。CircRNAは血球や血漿(26, 27, 29)、細胞外小胞(28, 83)、唾液(25)、尿(23)中に存在する。それらは組織や体液中で安定である(159)。これらの特徴は、circRNAが有望なバイオマーカーであることを示しており、実際、いくつかのcircRNAはIBDの潜在的なバイオマーカーとして同定されている(表1)。Yinら(114)は、CD患者のPBMCにおいて、4つのcircular RNA (004662, 102610, 103124, 092520)の発現が、健常対照のこれらのcircular RNAのレベルと比較して有意に増加していることを示した。これら4つのcircRNAのROC下面積(AUC)は、それぞれ0.85、0.78、0.74、0.66であり、CDの診断バイオマーカーとなりうるものであった。さらに、circRNA_004662は、UC患者における発現量と比較して、CD患者においてより高発現しており、CD患者とUC患者の鑑別に使用できる可能性が示唆された。
circRNA_103516は、UCおよびCD患者のPBMCで発現が上昇し、疾患活動性および炎症性サイトカインTNF-αおよびIFNγレベルと正の相関を示し、抗炎症性サイトカインIL-10レベルと負の相関を示した(108)。CDとUCの診断に用いられたcircRNA_103516のAUC値は、それぞれ0.790と0.687であった。従って、PBMC中のcircRNA_103516はIBD診断のバイオマーカーとして働く可能性がある。Wangら(111)は最近、UC患者においてcirc_0007919のレベルが低下すると、エンハンサーオブポリコンボホモログ1(EPC1)と血管作動性腸ポリペプチド受容体1(VIPR1)の発現が増加することを示したが、これはこのcircRNAがhsa-let-7aとmiR-138をスポンジし、SIRT1の阻害とNF-κBの活性化を通じて腸の炎症を引き起こすためである。circ_0007919の発現レベルは、UCの病態および進行に関連しており、診断および治療への応用の可能性を示している。circRNA_102610は、CD患者のPBMCにおいて著しく過剰発現しているcircRNAであり(114)、miR-130a-3pを吸収することによって、IECsの増殖と上皮間葉転換を促進する(107)。CircRNA_102610は、CDの臨床サンプルにおいて高レベルで検出されたことから、IBDの新規バイオマーカーとしても機能する可能性が示唆された。
唾液中で差次的に発現するcircRNAもバイオマーカーの可能性がある。口腔扁平上皮癌(OSCC)の唾液では、hsa_circ_0001874とhsa_circ_0001971が発現上昇しており、OSCCの診断のためのバイオマーカーとしての唾液中のcircRNAの可能性を示している(160)。尿中エクソソーム由来のhsa_circ_0036649の発現レベルは、腎線維症の程度と関連することが示され、このcircRNAが慢性腎線維症のバイオマーカーとして機能する可能性が示された(161)。IBD患者の唾液や尿サンプル中のcircRNAレベルに変化があるかどうかはまだ不明である。原稿に引用されている研究は、IBD患者と健常対照者を比較したものであり、その結果は、circRNAの発現レベルがIBDと相関していることを示している。感染性大腸炎やアレルギー性大腸炎など、IBDとは無関係なタイプの腸炎もいくつかある。これらのcircRNAの発現レベルが感染性大腸炎やアレルギー性大腸炎とも相関しているかどうかはまだ不明である。IBDの診断に特異性の高いcircRNAを同定するためには、臨床研究だけでなく大規模な調査が必要である。
4 結論
ここ数十年、IBD は世界的な健康問題となっている(1)。多くの努力がなされてきたが、IBDの正確な病態はよくわかっていない。IBDの病態にcircRNAが関与していることが新たな証拠によって示されており、circRNAの一部は臨床応用の可能性がある。circRNAはmiRNAのスポンジとして機能し、腸管バリア機能と免疫応答を制御する遺伝子の発現を制御することができる。circRNA_103516とcircRNA_004662は、CD患者のPBMCで高発現していることが研究で示されており、診断のためのバイオマーカーとして役立つ可能性がある(108, 114)。IBDにおけるcircRNAの研究はまだ初期段階にあり、IBDにおけるcircRNAの知識は限られている。この分野では、より焦点を絞った研究が必要である。IBDに対するcircRNAの影響の根底にある分子メカニズムを明らかにする必要がある。有望な治療アプローチを探索する必要がある。circRNAの発現を抑制または促進することは、IBDの治療に有益である可能性がある。circRNAの組織特異的/細胞型特異的な拮抗薬や模倣薬、またcircRNAの送達方法の開発が最も効率的なアプローチとなりうる。現在のところ、多くの研究はまだ実験室でのものであり、臨床応用には至っていない。有望な治療法の安全性と有効性を評価するためには、動物実験を行い、厳密な臨床試験を行う必要がある。
circRNAにはまだ未解決の問題や未解決の疑問がある。circRNAの塩基配列は直鎖状mRNAと重複しているため、circRNAの同定と特性解析は難題である。circRNAの量と分類に関する正確な記述はまだ不足している。現在のところ、circRNAの同定、特性解析、評価の方法は、全て特定の接合部位に依存している(162)。circRNAの調節とcircRNA機能への影響に関する知識は限られている。circRNAがどのように細胞内へ輸送され、細胞外へ排泄されるのかもよく分かっていない。間違いなく、これらの問題に取り組むことは、IBDの診断、予後、治療法の開発に大いに役立つであろう。
まとめると、circRNAはIBD研究の有望な分野となりつつあり、IBDにおけるcircRNAの役割とその基礎となるメカニズムの解明は、IBDの効率的な治療法の開発に役立つことは間違いない。
著者貢献
JL:執筆-原案、執筆-校閲・編集。JG:執筆-原案、執筆-校閲・編集。MY:執筆-原案、執筆-校閲・編集。HZ:構想、執筆-原案、執筆-校閲・編集。JF:構想、資金獲得、監修、執筆(原案)、執筆(校閲・編集)。
資金提供
著者は、本論文の研究、執筆、および/または発表のために財政的支援を受けたことを表明する。本研究は、中国自然科学基金会(82073061、32000434)、山東省自然科学基金会(ZR2020MH206、ZR2020QH193)、中国科学技術部(2020YFA0803300)の支援を受けている。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
参考文献
Ng SC, Shi HY, Hamidi N, Underwood FE, Tang W, Benchimol EI, et al. 21世紀における炎症性腸疾患の世界的発生率と有病率:集団ベースの研究の系統的レビュー。Lancet (2017) 390:2769-78. doi: 10.1016/S0140-6736(17)32448-0
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ananthakrishnan AN, Kaplan GG, Ng SC. 炎症性腸疾患の世界的疫学の変化:21世紀への医療提供の持続。Clin Gastroenterol Hepatol (2020) 18:1252-60. doi: 10.1016/j.cgh.2020.01.028.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Kaplan GG, Windsor JW. 炎症性腸疾患の世界的進化における4つの疫学的段階。Nat Rev Gastroenterol Hepatol (2021) 18:56-66. doi: 10.1038/s41575-020-00360-x
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Agrawal M, Jess T. Implications of the changing epidemiology of inflammatory bowel disease in a changing world. doi: 10.1002/ueg2.12317
CrossRef 全文|Google Scholar
Chudy-Onwugaje KO, Christian KE, Farraye FA, Cross RK. IBD治療のための新規および新興治療法の最新レビュー。炎症性腸疾患(2019)25:820-30.
クロスリーフフルテキスト|Google Scholar
炎症性腸疾患患者の治療における生物学的製剤および/または低分子の併用療法の役割。世界消化器病学会(2022)28:6743-51. doi: 10.3748/wjg.v28.i47.6743
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
IBDにおける環境トリガー:進歩とエビデンスのレビュー。Nat Rev Gastroenterol Hepatol (2018) 15:39-49. doi: 10.1038/nrgastro.2017.136.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
炎症性腸疾患に対する新たな治療法。Ther Adv Chronic Dis (2020) 11:2040622319899297.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
IBDの疾患修飾療法:新たな治療薬からの洞察。トレンド・モル・メッド(2023)29:241-53.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Liu CX, Chen LL. 環状RNA: その特性、細胞での役割、応用。細胞 (2022) 185:2016-34. doi: 10.1016/j.cell.2022.04.021
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
エクソンの環状化にはカノニカルスプライスシグナルが必要である。Cell Rep (2015) 10:103-11. doi: 10.1016/j.celrep.2014.12.002.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
円形RNAは豊富に存在し、保存されており、ALUリピートと関連している。RNA (New York NY) (2013) 19:141-57. doi: 10.1261/rna.035667.112.
クロスレフ・フルテキスト|Google Scholar
円形RNAは、調節能を持つ動物RNAの大きなクラスである。Nature (2013) 495:333-8. doi: 10.1038/nature11928.
パブコメ抄録|クロスリファレンス全文|Google Scholar
He AT, Liu J, Li F, Yang BB. 治療アプローチとしての環状RNAの標的化:現在の戦略と課題。シグナルトランスダクション・ターゲット・サー(Signal Transduct Target Ther) (2021) 6(1):185.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
環状RNA:解析、発現、潜在的機能。Dev(ケンブリッジ・イングランド)(2016)143:1838-47. doi: 10.1242/dev.128074.
クロスレフ・フルテキスト|Google Scholar
Salzman J, Chen RE, Olsen MN, Wang PL, Brown PO. 環状RNA発現の細胞型特異的特徴。この論文では、RNA発現の細胞型特異的な特徴を明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
イントロン配列の解析から、動物における環状RNA生合成の特徴が明らかになった。Cell Rep (2015) 10:170-7. doi: 10.1016/j.celrep.2014.12.01.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Huang Y, Zhang C, Xiong J, Ren H. Emerging important roles of circRNAs in human cancer and other diseases. このような背景のもとで、ヒトのがんやその他の疾患におけるcircRNAの重要な役割が明らかにされつつある。
PubMedアブストラクト|Ref全文|Google Scholar
Misir S, Wu N, Yang BB. 環状RNAの特異的発現と機能。細胞死差異(2022)29:481-91.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
生理学および非免疫疾患における環状RNA。このような研究成果をもとに、RNAの生物学的性質と、RNAの生物学的性質を明らかにし、RNAの生物学的性質とRNAの生物学的性質の関連性を明らかにする。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Kristensen LS, Hansen TB, Venø MT, Kjems J. Circular RNAs in cancer: opportunities and challenges in the field. Oncogene (2018) 37:555-65. doi: 10.1038/onc.2017.361.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Aufiero S, Reckman YJ, Pinto YM, Creemers EE. Circular RNAs open a new chapter in cardiovascular biology. Nat Rev Cardiol (2019) 16:503-14. doi: 10.1038/s41569-019-0185-2.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Vo JN, Cieslik M, Zhang Y, Shukla S, Xiao L, Zhang Y, et al. The landscape of circular RNA in cancer. Cell (2019) 176:869-881.e813. doi: 10.1016/j.cell.2018.12.021.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Fan W, Pang H, Xie Z, Huang G, Zhou Z. Circular RNAs in diabetes mellitus and its complications. 糖尿病と合併症における環状RNA。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ヒト唾液中のマイクロRNA、piwi-interacting RNA、およびcircular RNAのランドスケープ。臨床化学(2015)61:221-30. doi: 10.1373/clinchem.2014.230433
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
胃がん患者の血漿中サーキュラーRNAプロファイリングと液滴デジタルRT-PCRによる検出。J Mol Med (Berl) (2018) 96:85-96. doi: 10.1007/s00109-017-1600-y.
PubMed Abstract|CrossRef Full Text|Google Scholar
Li X, Yang L, Chen LL. 環状RNAの生合成、機能、および課題。論文番号:Mol Cell (2018) 71:428-42.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
円形RNAはエクソソームに濃縮され安定である:がん診断のための有望なバイオマーカー。細胞研究(2015)25:981-4. doi: 10.1038/cr.2015.82.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Memczak S, Papavasileiou P, Peters O, Rajewsky N. Identification and Characterization of circular RNAs as a new class of putative biomarkers in human blood. 論文名:PloS One (2015) 10:e0141214.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
CircRNA:ヒト疾患における役割とバイオマーカーとしての可能性。細胞死(2021)12:468.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Yang Q, Li F, He AT, Yang BB. 環状RNA: 発現、局在、治療の可能性。この論文では、RNAの発現、局在、および治療の可能性を明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
円形RNA hsa_circRNA_002178のサイレンシングは、マイクロRNA-328-3pを介したCOL1A1の阻害を介して乳がんの進行を抑制する。J Cell Mol Med (2020) 24:2189-201. doi: 10.1111/jcmm.14875.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
炎症性腸疾患に関与するロングノンコーディングRNAおよびサーキュラーRNAはどれか?細胞死(2020)11:456.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
クローン病患者の大腸生検におけるマイクロアレイ解析による環状RNAの発現プロファイル。日本臨床検査薬学会誌(2021) 35:e23788.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
李QQ、張HH、戴SX。超早期発症炎症性腸疾患の病態と治療における新たな知見と進歩。また、そのような病態を有する患者に対する治療法についても検討した。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
炎症性腸疾患とそれに関連する大腸がんの有望なバイオマーカーとしてのCircRNA。Am J Transl Res (2021) 13:1580-93.
PubMed Abstract|Google Scholar
Xavier RJ, Podolsky DK. 炎症性腸疾患の病態解明。Nature (2007) 448:427-34.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kaser A, Zeissig S, Blumberg RS. 炎症性腸疾患。Annu Rev Immunol (2010) 28:573-621. doi: 10.1146/annurev-immunol-030409-101225
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
炎症性腸疾患における宿主-微生物叢相互作用。Nat Rev Immunol (2020) 20:411-26. doi: 10.1038/s41577-019-0268-7.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
腸の陰窩(クリプト):Clevers H, Batlle E. SnapShot. 細胞(2013)152:1198-1198.e2. doi: 10.1016/j.cell.2013.02.030
パブコメ抄録|クロスリファレンス全文|Google Scholar
腸における粘液層の構成と機能的役割。細胞分子生命科学(2011)68:3635-41.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Muc2欠損マウスは自然に大腸炎を発症し、Muc2が大腸保護に重要であることを示している。胃腸病学(2006)131:117-29. doi: 10.1053/j.gastro.2006.04.020
PubMed Abstract|クロスリファレンス全文|Google Scholar
Odenwald MA, Turner JR. 腸管上皮バリア:治療標的?Nat Rev Gastroenterol Hepatol (2017) 14:9-21. doi: 10.1038/nrgastro.2016.169.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Chelakkot C, Ghim J, Ryu SH. 腸管バリアの完全性を制御するメカニズムとその病理学的意義。Exp Mol Med (2018) 50:1-9. doi: 10.1038/s12276-018-0126-x
PubMed Abstract|RefRef Full Text|Google Scholar
Lee B, Moon KM, Kim CY. 腸上皮におけるタイトジャンクション:疾患との関連およびファイトケミカルによる制御。J Immunol Res (2018) 2018:2645465.
PubMedアブストラクト|Ref 全文|Google Scholar
Turner JR. 健康および疾患における腸粘膜バリア機能。Nat Rev Immunol (2009) 9:799-809.
PubMed Abstract|全文|Google Scholar
Marchiando AM, Graham WV, Turner JR. 恒常性と疾患における上皮バリア。Annu Rev Pathol (2010) 5:119-44. doi: 10.1146/annurev.pathol.4.110807.092135.
パブコメ抄録|全文|Google Scholar
鈴木敏明. タイトジャンクションによる腸管上皮透過性の制御. Cell Mol Life Sci (2013) 70:631-59. doi: 10.1007/s00018-012-1070-x
パブコメ抄録|クロスリファレンス全文|Google Scholar
Brown E, Taylor CT. 腸炎症における低酸素感受性経路。J Physiol (2018) 596:2985-9. doi: 10.1113/jp274350.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Allaire JM, Crowley SM, Law HT, Chang SY, Ko HJ, Vallance BA. 腸上皮:粘膜免疫の中心的コーディネーター。Trends Immunol (2018) 39:677-96. doi: 10.1016/j.it.2018.04.002.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Saez A, Herrero-Fernandez B, Gomez-Bris R, Sánchez-Martinez H, Gonzalez-Granado JM. 炎症性腸疾患の病態生理:自然免疫系。本論文は、炎症性腸疾患の病態生理と自然免疫系についてまとめたものである。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
炎症性腸疾患:腸内環境の変化とその影響。炎症性腸疾患:微生物叢、免疫系、腸上皮の三方向関係。Crit Rev Microbiol (2021) 47(2):254-73。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ラモスGP、パパダキスKA. 疾患のメカニズム:炎症性腸疾患。Mayo Clin Proc (2019) 94(1):155-65. doi: 10.1016/j.mayocp.2018.09.013.
PubMed Abstract|RefRef Full Text|Google Scholar
炎症性腸疾患における常在細菌、免疫応答、腸管バリアの相互作用。また、腸管バリアは、炎症性腸疾患における常在細菌、免疫応答、腸管バリアとの相互作用に重要な役割を果たしている。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Holleran G, Lopetuso L, Petito V, Graziani C, Ianiro G, McNamara D, et al. The innate and adaptive immune system as targets for biologic therapies in inflammatory bowel disease. Int J Mol Sci (2017) 18:2020. doi: 10.3390/ijms18102020
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
抗原提示細胞とT細胞間のクロストークは、腸の恒常性、細菌感染、腫瘍形成に影響を与える。論文名:Front Immunol(2019)10:360.doi:10.3389/fimmu.2019.00360。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Schuijs MJ, Hammad H, Lambrecht BN. 2型免疫における抗原提示細胞のプロと「アマチュア」。Trends Immunol (2019) 40:22-34. doi: 10.1016/j.it.2018.11.001.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ラファエルI、ナラワデS、イーガーTN、フォルストフーバーTG。自己免疫疾患および炎症性疾患におけるT細胞サブセットとそのシグネチャーサイトカイン。Cytokine (2015) 74:5-17. doi: 10.1016/j.cyto.2014.09.011.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zielinski CE. Tヘルパー細胞サブセット:分野の多様化。Eur J Immunol (2023):e2250218.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
CD4(+)T細胞サブセットの機能的および表現型の可塑性。BioMed Res Int (2015) 2015:521957.
PubMed Abstract|クロスリファレンス全文|Google Scholar
IL-6は、IL-21経路とIL-23経路の連続的な関与を促進することにより、T(H)-17細胞の分化をプログラムする。Nat免疫学(2007)8:967-74.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Gaffen SL, Jain R, Garg AV, Cua DJ. IL-23-IL-17免疫軸:メカニズムから治療試験まで。Nat Rev Immunol (2014) 14:585-600.
PubMedアブストラクト|クロスリード全文|Google Scholar
腸管制御性T細胞は、腸管に特化した細胞である。腸管制御性T細胞は、腸管免疫のホメオスタシスと疾患における特殊な組織限定免疫細胞である。この論文では、腸管免疫の恒常性と疾患における特殊な組織制限性免疫細胞としての腸管制御性T細胞の役割を明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Mayne CG, Williams CB. 炎症性腸疾患の発症における誘導制御性T細胞と自然制御性T細胞。Doi: 10.1097/MIB.0b013e318281f5a3.
クロス・リーフ・フルテキスト|Google Scholar
IgAトランスサイトーシスのインテグリンαEβ7依存的メカニズムには、形質細胞と腸管上皮の直接接触が必要である。粘膜免疫 (2021) 14:1347-57. doi: 10.1038/s41385-021-00439-x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
上皮細胞由来の代謝物が、腸管常在形質細胞による免疫グロブリンA分泌を制御する。(2023年) 24:531-44. doi: 10.1038/s41590-022-01413-w
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Pracht K, Wittner J, Kagerer F, Jäck HM, Schuh W. 腸: IgA形質細胞にとって非常に動的な微小環境。論文タイトル:「腸:IgA形質細胞の高度に動的な微小環境」(Front Immunol, 2023)14:1114348.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
炎症性腸疾患におけるマイクロバイオーム:現状と今後の展望。消化器病学(2014)146:1489-99。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lynch SV, Pedersen O. The human intestinal microbiome in health and disease. N Engl J Med (2016) 375:2369-79. doi: 10.1056/NEJMra1600266.
PubMed Abstract|RefRef Full Text|Google Scholar
Round JL, Mazmanian SK. 腸内細菌叢は健康時と疾患時の腸管免疫応答を形成する。この論文では、腸内細菌叢が健康時と疾患時の腸管免疫応答を形成することを明らかにした。
PubMedアブストラクト|Ref 全文|Google Scholar
ヒト腸内細菌叢の多様性、安定性、回復力。Nature (2012) 489:220-30.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
腸内細菌叢:病原体のコロニー形成、免疫応答、炎症性疾患における役割。Immunol Rev (2017) 279:70-89. doi: 10.1111/imr.12567.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
炎症性腸疾患のキーアクターとしての腸内細菌叢由来代謝産物。Nat Rev Gastroenterol Hepatol (2020) 17:223-37. doi: 10.1038/s41575-019-0258-z
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
本田和彦、Littman DR. 感染症および炎症におけるマイクロバイオーム。Annu Rev Immunol (2012) 30:759-95. doi: 10.1146/annurev-immunol-020711-074937.
パブコメ抄録|全文|Google Scholar
ヒトの免疫系の変異は、遺伝的でない影響によって大きく左右される。Cell (2015) 160:37-47. doi: 10.1016/j.cell.2014.12.020.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ビフィズス菌35624は腸を超えて宿主の炎症プロセスを調節する。腸内細菌(2013)4:325-39.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kjems J. The biogenesis, biology and characterization of circular RNAs. Nat Rev Genet (2019) 20:675-91.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
郭JU、アガルワルV、郭H、バーテルDP。哺乳類環状RNAの同定と特性解析の拡大。Genome Biol (2014) 15:409. doi: 10.1186/s13059-014-0409-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
エクソン-イントロン環状RNAは核内での転写を制御する。Nat Struct Mol Biol (2015) 22:256-64.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
また、このようなRNAは、細胞内に存在し、細胞外から細胞内へ取り込まれ、細胞外から細胞内へ取り込まれ、細胞外から細胞内へ取り込まれ、細胞外から細胞内へ取り込まれ、細胞外から細胞内へ取り込まれ、細胞外から細胞内へ取り込まれ、細胞外から細胞内へ取り込まれる。この論文では、RNAが細胞内でどのように機能しているのかを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
RNaseH1による環状イントロンRNAの分解と転写機能の関連性。中国生命科学(2021)64:1795-809.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Salzman J, Gawad C, Wang PL, Lacayo N, Brown PO. ヒト遺伝子の転写産物である円形RNAは、多様な細胞型において数百のヒト遺伝子の転写産物のうち優勢なアイソフォームである。このような遺伝子発現は、遺伝子発現を制御する上で重要な役割を果たしている。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
血小板由来細胞外小胞におけるcircRNAの選択的放出。J Extracell Vesicles (2018) 7:1424473.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
天然RNAサークルは、効率的なマイクロRNAスポンジとして機能する。Nature (2013) 495:384-8. doi: 10.1038/nature11993.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
蕭MS、艾Y、Wilusz JE. 環状RNAの生合成と機能が注目される。トレンド・セル・バイオル(2020)30:226-40. doi: 10.1016/j.tcb.2019.12.004.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Piwecka M, Glažar P, Hernandez-Miranda LR, Memczak S, Wolf SA, Rybak-Wolf A, et al. 哺乳類の環状RNA遺伝子座の欠損はmiRNAの調節不全を引き起こし、脳機能に影響を及ぼす。Science (2017) 357:eaam8526. doi: 10.1126/science.aam8526
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
円形RNAは長寿命であり、成長因子に応答して最小限の初期変化しか示さない。Nucleic Acids Res (2016) 44:1370-83. doi: 10.1093/nar/gkv1367
PubMedアブストラクト|Ref 全文|Google Scholar
circRNAとRNA結合タンパク質の相互作用: RNA結合タンパク質とcircRNAの相互作用:circRNAの維持と機能の重要な部分。この論文では、RNA結合タンパク質とcircRNAの相互作用について、RNA結合タンパク質とcircRNAの相互作用のメカニズム、RNA結合タンパク質とcircRNAの相互作用のメカニズム、RNA結合タンパク質とcircRNAの相互作用のメカニズムについて解説している。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Huang A, Zheng H, Wu Z, Chen M, Huang Y. 環状RNA-タンパク質相互作用:機能、メカニズム、同定。この論文では、RNAとタンパク質の相互作用について、その機能、メカニズム、同定方法などを解説している。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Foxo3活性を増強する環状RNAによる腫瘍アポトーシスの誘導。Cell Death Differ (2017) 24:357-70. doi: 10.1038/cdd.2016.133.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Luo J, Liu H, Luan S, Li Z. 環状RNAの結合パートナーとしてのタンパク質の挙動への誘導。Cell Mol Life Sci (2019) 76:4233-43. doi: 10.1007/s00018-019-03216-z.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
CIRRNAの生合成はプレmRNAスプライシングと競合する。論文番号:Mol Cell (2014) 56:55-66.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
環状RNAは、AKTのリン酸化と核局在を活性化し、アポトーシスを抑制し、心臓の修復を促進する。Theranostics (2017) 7:3842-55. doi: 10.7150/thno.19764.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Du W, Zhang C, Yang W, Yong T, Awan F, Yang BB. circRNA-タンパク質相互作用の同定と特徴づけ。Theranostics (2017) 7:4183-91. doi: 10.7150/thno.21299.
PubMed Abstract | CrossRef Full Text | Google Scholar
新規FLI1エキソン性環状RNAは、TET1とDNMT1を協調的に制御することにより、乳がんの転移を促進する。Genome Biology (2018) 19(1):218. doi: 10.1186/s13059-018-1594-y
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
LiJ、Hu ZQ、Yu SY、Mao L、Zhou ZJ、Wang PC、et al. CircRPN2は、肝細胞がんにおける好気的解糖と転移を阻害する。Cancer Res (2022) 82:1055-69. doi: 10.1158/0008-5472.CAN-21-1259
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
環状RNAはSTAT3と相互作用し、Dnmt3aとmiR-17の機能を調節することにより、STAT3の核内転位と創傷修復を増加させる。Mol Ther (2017) 25:2062-74. doi: 10.1016/j.ymthe.2017.05.022.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Pamudurti NR, Bartok O, Jens M, Ashwal-Fluss R, Stottmeister C, Ruhe L, et al. circRNAの翻訳。論文番号:Mol Cell (2017) 66:9-21.e27. 論文番号:10.1016/j.molcel.2017.02.021
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
翻訳における長鎖ノンコーディングRNAと環状RNAの役割。Cold Spring Harb Perspect Biol (2019) 11:a032680.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ヒト背外側前頭前皮質における円形RNA発現と関連する量的形質座位の検出。Genome Biol (2019) 20:99. doi: 10.1186/s13059-019-1701-8.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Xu Y, Tian Y, Li F, Wang Y, Yang J, Gong H, et al. 環状RNA HECTD1は、miR-182-5p/huR軸を介して腸細胞のオートファジーを促進することで、潰瘍性大腸炎を緩和する。炎症性腸疾患(2022)28:273-88.
CrossRef フルテキスト|Google Scholar
Ouyang W, Wu M, Wu A, Xiao H. Circular RNA_0001187は、骨髄分化因子88のアップレギュレーションを介して潰瘍性大腸炎の発症制御に関与する。バイオエンジニアリング(2022)13:12863-75. doi: 10.1080/21655979.2022.2077572
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
循環型RNA circHIPK3は、マイクロRNA 29bの機能を低下させることにより、腸管上皮の恒常性を促進する。胃腸病学(2021)161:1303-1317.e3. doi: 10.1053/j.gastro.2021.05.060
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
CircRNA_103765は、クローン病においてmiR-30ファミリーのスポンジを介して炎症促進因子として働く。論文番号:Sci Rep (2021) 11:565.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
PLGA-ミクロスフェアに担持されたcircGMCL1は、オートファジーを促進することでNLRP3インフラマソーム誘導性パイロプトーシスを緩和し、クローン病大腸炎を予防する。細胞死(2022)13:782.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Xiang P, Ge T, Zhou J, Zhang Y. 潰瘍性大腸炎におけるmiR-142-5p/NCOA3軸を介したcircRNA CCND1の保護的役割。BMC Gastroenterol (2023) 23:18. doi: 10.1186/s12876-023-02641-6
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
クローン病におけるHsa_circRNA_102610のアップレギュレーションは、hsa-miR-130a-3pのスポンジ化を介して、トランスフォーミング増殖因子β1による上皮間葉転換を促進する。世界消化器病学会(2020)26:3034-55. doi: 10.3748/wjg.v26.i22.3034
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
循環環状RNA_103516の増加は、成人患者における炎症性腸疾患の新規バイオマーカーである。World J Gastroenterol (2019) 25:6273-88. doi: 10.3748/wjg.v25.i41.6273.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Qiao YQ、Cai CW、Shen J、Zheng Q、Ran ZH。クローン病患者の大腸組織における環状RNA発現変化。Mol Med Rep (2019) 19:4500-6. doi: 10.3892/mmr.2019.10070.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Rankin CR、Lokhandwala ZA、Huang R、Pekow J、Pothoulakis C、Padua D.線形および環状CDKN2B-AS1発現は炎症性腸疾患と関連し、腸管バリア形成に関与する。生命科学(2019)231:116571. doi: 10.1016/j.lfs.2019.116571.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wang T, Chen N, Ren W, Liu F, Gao F, Ye L, et al. circRNAとmRNAの発現プロファイルの統合解析により、潰瘍性大腸炎の病態におけるhsa_circ_0007919の関与が明らかになった。J Gastroenterol (2019) 54:804-18. doi: 10.1007/s00535-019-01585-7.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
潰瘍性大腸炎におけるcircAtp9bの過剰発現はリポ多糖によって誘導され、PTENをアップレギュレートして大腸上皮細胞のアポトーシスを促進する。この論文では、潰瘍性大腸炎におけるPTENの発現をリポ多糖によって誘導され、大腸上皮細胞のアポトーシスを促進することを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Hsa_circ_0001021は潰瘍性大腸炎においてmiR-224-5pのスポンジ化を介して腸管上皮バリア機能を制御する。Epigenomics (2021) 13:1385-401. doi: 10.2217/epi-2021-0230
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
クローン病患者末梢血単核球における環状RNA発現プロファイル。Med (Baltimore) (2019) 98:e16072. doi: 10.1097/MD.00000000016072.
クロスリーフフルテキスト|Google Scholar
circSMAD4 は、miR-135a-5p のスポンジ化を介してヤヌスキナーゼ 2 を標的とすることで、実験的大腸炎を促進し、腸管バリア機能を障害する。大腸バリア機能を障害し、実験的大腸炎を促進する。
パブコメ抄録|クロスリファレンス全文|Google Scholar
誘導性環状RNA circKcnt2は、ILC3の活性化を阻害し、大腸炎の治癒を促進する。Nat Commun (2020) 11:4076. doi: 10.1038/s41467-020-17944-5
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
環状RNA circZbtb20は、Alkbh5依存的なNr4a1 mRNAのm6A脱メチル化を介して、ILC3の恒常性と機能を維持する。細胞分子免疫学(2021)18:1412-24.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
幹細胞コンパートメントのプロトタイプである腸陰窩。細胞 (2013) 154:274-84.
パブコメ抄録|クロスリファレンス|Google Scholar
Baulies A, Angelis N, Li VSW. 腸管幹細胞の特徴。開発(2020)147:dev182675.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
腸管幹細胞と炎症。Curr Opin Pharmacol (2015) 25:62-6. doi: 10.1016/j.coph.2015.11.008.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wang Z, Qu YJ, Cui M. Modulation of stem cell fate in intestinal homeostasis, injury and repair. この論文では、幹細胞の運命が腸の恒常性、傷害、修復においてどのように調節されているかを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhu P, Zhu X, Wu J, He L, Lu T, Wang Y, et al. ILC2sから分泌されるIL-13は、circular RNA circPan3を介して腸管幹細胞の自己複製を促進する。Nat Immunol (2019) 20:183-94. doi: 10.1038/s41590-018-0297-6.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Noncoding RNA circBtnl1は、Atf4 mRNAの安定性の破壊を介して腸管幹細胞の自己複製を抑制する。EMBO J (2023) 42:e112039. doi: 10.15252/embj.2022112039.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
オートファジーの新たな制御と機能。Nat Cell Biol (2013) 15:713-20.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Foerster EG, Mukherjee T, Cabral-Fernandes L, Rocha JDB, Girardin SE, Philpott DJ. オートファジーが腸管上皮バリアを制御する仕組み。オートファジー(2022)18:86-103.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Giammanco A, Blanc V, Montenegro G, Klos C, Xie Y, Kennedy S, et al. 腸管上皮HuRは、増殖とアポトーシスの異なる経路を調節し、小腸および大腸腫瘍の発生を抑制する。Cancer Res (2014) 74:5322-35. doi: 10.1158/0008-5472.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Xiao L, Wang JY. 消化管上皮の恒常性と疾患におけるRNA結合タンパク質とマイクロRNA。Curr Opin Pharmacol (2014) 19:46-53. doi: 10.1016/j.coph.2014.07.006.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
HuRとcircPABPN1の相互作用は、ATG16L1の翻訳を変化させることにより、腸上皮におけるオートファジーを調節する。論文タイトル:Mol Cell Biol (2020) 40:e00492.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
環状RNA circ_0001105は、炎症と酸化的損傷およびYAP1の発現を抑制することにより、敗血症ラットの腸管バリアを保護する。遺伝子 (2020) 755:144897.
パブコメ抄録|クロスリファレンス全文|Google Scholar
LiuJ、Liu Y、Zhang L、Chen Y、Du H、Wen Z、他。circDMNT3Bのダウンレギュレーションは、miR-20b-5pのスポンジを介して敗血症ラットの腸粘膜透過性機能障害を助長する。この論文では、腸管粘膜のmiR-20b-5pを介した、敗血症ラットの腸管粘膜透過性機能障害に関与するcircDMNT3Bのダウンレギュレーションを明らかにした。
PubMed Abstract|クロスリファレンス全文|Google Scholar
免疫関連疾患における環状RNAの役割。免疫疾患における環状RNAの役割。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Yan L, Chen YG. 免疫応答とウイルス感染における環状RNA。トレンド生化学(2020)45:1022-34. doi: 10.1016/j.tibs.2020.08.006
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
過去、現在、未来:環状RNAと免疫の関係。本論文では、RNAと免疫との関係を明らかにすることを目的とした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Zurawska A, Mycko MP, Selmaj KW. 多発性硬化症における調節機構の新しい層としての環状RNA。J Neuroimmunol (2019) 334:576971. doi: 10.1016/j.jneuroim.2019.576971.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Xu M, Xie F, Tang X, Wang T, Wang S. Insights into the role of circular RNA in macrophage activation and fibrosis disease. この論文では、マクロファージの活性化と線維化疾患における環状RNAの役割について明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マクロファージ表現型の調節における環状RNA cdr1asの役割。生命科学(2022)309:121003. doi: 10.1016/j.lfs.2022.121003
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
円環状RNA circSnx5は、miR-544/SOCS1軸とPU.1活性制御を介して樹状細胞の免疫原性を制御する。論文タイトル:Mol Ther (2020) 28:2503-18.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
デキストラン硫酸ナトリウム誘発大腸炎マウスの骨髄由来樹状細胞に対するメラトニンの効果を調べるためのRNA-Seqアプローチ。Doi: 10.1016/j.tox.2022.153354.
パブコメ抄録|クロスリファレンス全文|Google Scholar
ウィザーズDR、ヘップワースMR. グループ3自然リンパ球:腸管免疫系のコミュニケーションハブ。論文タイトル:Front Immunol (2017) 8:1298.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Zhou W, Sonnenberg GF. 腸管における第3群自然リンパ球の活性化と抑制。トレンド免疫学(2020)41:721-33. doi: 10.1016/j.it.2020.06.009
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
円形RNAの構造と分解は、自然免疫におけるPKRの活性化を制御する。Cell (2019) 177:865-80. doi: 10.1016/j.cell.2019.03.046.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Chen YG, Chen R, Ahmad S, Verma R, Kasturi SP, Amaya L, et al. N6-メチルアデノシン修飾は環状RNA免疫を制御する。Mol Cell (2019) 76:96-109.e9. doi: 10.1016/j.molcel.2019.07.016
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
アシュラフィザデM、ザラビA、モスタファビE、アレフAR、セティG、ワンL、ら:ノンコーディングRNAに基づく炎症の制御。本論文は、RNAに基づく炎症制御機構を明らかにしたものである。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hsa_circ_0007456は、miR-6852-3p/ICAM-1軸を介して、肝細胞癌に対するナチュラルキラー細胞を介した細胞毒性を制御する。細胞死 (2021) 12:94. doi: 10.1038/s41419-020-03334-8
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
がん細胞由来のエクソソームcircUHRF1はナチュラルキラー細胞の疲弊を誘導し、肝細胞がんにおける抗PD1療法への抵抗性を引き起こす可能性がある。Doi: 10.1186/s12943-020-01222-5
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
癌細胞由来エクソソームcircusp7は、NSCLCにおけるmiR-934/HP2軸を制御することで、CD8 T細胞の機能障害と抗PD1耐性を誘導する。論文要旨集:Mol Cancer(2021)20:144.doi:10.1186/s12943-021-01448-x。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Huang Z, Cao Y, Zhou M, Qi X, Fu B, Mou Y, et al. Hsa_circ_0005519は、CD4 T細胞のhsa-let-7a-5pを制御してIL-13/IL-6を増加させ、喘息に影響を及ぼす。Clin Exp Allergy (2019) 49:1116-27. doi: 10.1111/cea.13445.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
エクソソーム由来のcirctrps1は、膀胱がんの微小環境において悪性表現型とCD8+ T細胞の疲弊を促進する。論文概要] 膀胱癌の微小環境におけるエクソソーム由来circtrps1の悪性表現型とCD8+T細胞の疲弊を促進する。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Song J, Zhao W, Zhang X, Tian W, Zhao X, Ma L, et al. 変異型RIG-Iは、circRIG-Iシグナルの活性化を通じて、がんに関連する炎症を増強する。論文タイトル:Nat Commun (2022) 13:7096.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
マイクロRNA-146bは、核内因子κBを活性化し、上皮バリア機能を改善することで、マウス大腸炎の腸管障害を改善する。遺伝子医学(2013)15:249-60.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Xu XM, Zhang HJ. 炎症性腸疾患の新たな分子的知見としてのMiRNA:自己免疫と炎症における重要な制御因子。世界消化器病学会(2016)22:2206-18. doi: 10.3748/wjg.v22.i7.2206.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Mudter J, Neurath MF. T細胞のアポトーシスと炎症性腸疾患の制御:治療的意義。Gut (2007) 56:293-303. doi: 10.1136/gut.2005.090464.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Nunes T, Bernardazzi C, de Souza HS. 細胞死と炎症性腸疾患:腸上皮におけるアポトーシス、ネクローシス、オートファジー。BioMed Res Int (2014) 2014:218493.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
CircHIPK3、LncGAS5、およびmiR-495間の制御ネットワークは、アレルギー性鼻炎におけるTh2分化を促進する。細胞死 (2020) 11:216. doi: 10.1038/s41419-020-2394-3
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
環状RNA circINPP4BはmiR-30aのスポンジとして働き、実験的自己免疫性脳脊髄炎の進行過程でTh17細胞の分化を制御する。細胞分子免疫学 (2021) 18:2177-87. doi: 10.1038/s41423-021-00748-y
PubMedアブストラクト|クロスリファレンス|Google Scholar
1型糖尿病関連circRNAはCD4+ T細胞の機能を制御する。バイオメディカルレズInt(2022)2022:4625183.
パブコメ抄録|クロスリファレンス全文|Google Scholar
メルメドGY、シーゲルCA、スピーゲルBM、アレンJI、シーマR、コロンベルJF、他。炎症性腸疾患の質指標:プロセスとアウトカムの指標の開発。doi: 10.1097/mib.0b013e31828278a2.
クロスリファレンス全文|Google Scholar
Canavese G, Villanacci V, Sapino A, Rocca R, Daperno M, Suriani R, et al. 炎症性腸疾患の診断は、臨床現場ではしばしば支持されない。Dig Liver Dis (2015) 47:20-3. doi: 10.1016/j.dld.2014.09.007.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
円形RNA:生合成、機能、および可能性のあるがんバイオマーカーとしての役割。Int J Genomics (2017) 2017:6218353.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
口腔扁平上皮がんの診断のための新規バイオマーカーとしての唾液循環RNA hsa_Circ_0001874およびhsa_Circ_0001971。Cell Physiol Biochem(2018)47:2511-21。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Cao Y, Shi Y, Yang Y, Wu Z, Peng N, Xiao J, et al. 慢性腎線維症のバイオマーカーとしての尿中エクソソーム由来circRNA。Ann Med (2022) 54:1966-76. doi: 10.1080/07853890.2022.2098374.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Jeck WR, Sharpless NE. 環状RNAの検出と特性評価。Nat Biotechnol (2014) 32:453-61. doi: 10.1038/nbt.2890.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
キーワード:環状RNA、炎症性腸疾患、炎症、腸管上皮バリア、病因
引用 Lun J, Guo J, Yu M, Zhang H and Fang J (2023) 炎症性腸疾患における環状RNA。Front. Immunol. 14:1307985.
受理された: 2023年10月05日;受理された: 2023年12月07日;
発行:2023年12月22日
編集者
オスカー・メディナ・コントレラス、メキシコ小児病院、メキシコ
査読者
Zili Lei, 広東薬科大学, 中国
Yang-Ding Lin, テキサス大学サンアントニオヘルスサイエンスセンター(米国
Vu L. Ngo, ジョージア州立大学, 米国
Copyright © 2023 Lun, Guo, Yu, Zhang and Fang. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*通信: Jing Fang, jfang@qdu.edu.cn; Hongwei Zhang, zhanghw1999@163.com
これらの著者は本研究に等しく貢献している。
免責事項:本論文で表明されたすべての主張は、あくまでも著者のものであり、必ずしもその関連組織、あるいは出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではありません。
こんな人も見ています
血清脂質と炎症性腸疾患との関連:系統的レビューおよびメタ解析
ホンシン・チェン、ウェイヤン・リー、ジンイー・フー、フェン・シュー、イズー・ルー、レイ・ズー、ホン・シェン
腸内細菌叢、代謝産物、重症筋無力症の遺伝的因果関係の証拠:双方向メンデルランダム化研究
Dandan Sheng、Song Wang、Peihong Li、Jiaxin Li、Zheng Xiao、Hui Lv、Weiping Liu、Bo Xiao、Luo Zhou
子宮頸管環境における微生物叢動態、代謝および免疫相互作用と自然早産におけるその役割
Stanley Onyango、Jia Dai Mi、Angela Koech、Patricia Okiro、Marleen Temmerman、Peter von Dadelszen、Rachel M. Tribe、Geoffrey Omuse
骨肉腫に対するCAR-T細胞療法の現状と今後の課題
李 静喆、張 和、香 冠寧
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
