産業残渣河川で飼育されたクロバエ幼虫の腸内細菌相組成:腸管に沿った群集動態の解明
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
395
総閲覧数
29
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは1
オリジナル研究論文
Front. 微生物学、2023年12月01日
微生物共生
第14巻-2023年|https://doi.org/10.3389/fmicb.2023.1276187
この論文は次の研究テーマの一部です。
ブラックソルジャーフライ(Hermetia illucens L.)幼虫の腸内マイクロバイオーム:共生、機能、応用
全4記事を表示
産業残渣河川で飼育されたクロバエ幼虫の腸内細菌相組成:腸管に沿った群集動態の解明
https://www.frontiersin.org/articles/10.3389/fmicb.2023.1276187/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FCIMB_XXXXXXXX_auto-dlvrit
Dries Vandeweyer1† Daniele Bruno2† Marco Bonelli3 Freek IJdema1,4 Bart Lievens4 Sam Crauwels4 Morena Casartelli3,5 Gianluca Tettamanti2,5 Jeroen De Smet1* 1.
1ベルギー、ゲール、ルーヴェン工科大学、微生物・分子システム学科、昆虫生産・加工研究グループ
2インスブリア大学バイオテクノロジー・生命科学部、ヴァレーゼ、イタリア
3イタリア、ミラノ、ミラノ大学バイオサイエンス学部
4ベルギー、ルーヴェン工科大学、微生物・分子システム学科、プロセス微生物生態学・バイオインスピレーショナルマネージメント研究室
5イタリア、ポルティチ、ナポリ・フェデリコ2世大学、バイオインスパイアード農業環境技術研究大学間センター
いくつかの昆虫種は、価値の低い有機基質(すなわち残流)を価値の高いバイオマスに変換する効率的なバイオコンバーターとして注目されている。ブラックソルジャーフライ(BSF)(Hermetia illucens)の幼虫は、低価値の産業残渣を含む幅広い基質で生育できることから、バイオコンバージョンに特に興味深い。これは、BSFのような多食性昆虫の腸内細菌叢の可塑性に一因がある。腸内細菌叢の組成は飼育基質によって変化するが、これは特定の基質の消化を促進する微生物の採用をサポートするメカニズムによるものであろう。同時に、特定の微生物属は未知のメカニズムによって異なる基質上で持続する。本研究では、BSF幼虫の腸内に存在する細菌群集の組成が、2種類の産業残渣物(スウィル(ケータリングとスーパーマーケットの残飯の混合物)と可溶分を含む蒸留乾燥穀物)にどのように反応するかを調査することで、この微生物の可塑性に関する知見を得ることを目的とした。基質、飼育開始時および収穫時の幼虫全体、飼育残渣、幼虫の腸内領域の細菌相組成を16S rRNA遺伝子配列決定により調査した。その結果、基質と昆虫の発育の両方が幼虫全体の細菌組成に影響を与えていることが観察された。腸内領域を拡大すると、前・中腸と後中腸・後腸の間で、群集組成の多様性が高い方から低い方へと明らかにシフトしており、中腸領域で選択圧が発生していることが示された。さらに、細菌相の存在量は後腸で常に高かったが、その多様性は比較的低かった。さらに、後腸の細菌群集は異なる基質において比較的保存されており、BSFコア微生物群のメンバーを保有していることがわかった。我々は、後腸が昆虫関連微生物のリザーバーとして機能している可能性を推測している。このことは、腸管のこの未解明な領域について、さらなる研究を行うことを示唆している。全体として、これらの知見は腸管に沿った細菌叢の構造と動態の理解に貢献し、(産業)残留河川での幼虫のパフォーマンスを向上させるためのマイクロバイオーム工学の取り組みに役立つと考えられる。
はじめに
近年、低価値の有機基質を食品、飼料、生体分子に効率的に変換するバイオコンバーターとしての昆虫の可能性が注目されている(De Smet et al.) 循環経済の概念の中で、昆虫を媒介とするバイオコンバージョンが特に注目されており、特に産業から排出される、あるいは人間の消費によって生成される低価値の残留ストリームの再利用と価値化について注目されている(Jiang et al.) このようなバイオコンバージョンにとって最も興味深い昆虫種のひとつが、クロソタバエ(BSF, Hermetia illucens)である(Tomberlin and van Huis, 2020)。
BSFの幼虫は多種多様な基質で生育可能であり、その中にはビール醸造用の使用済み穀物やケータリングの廃棄物など、経済的に価値の低い有機残渣の流れも含まれる(Zheng他、2012;Ceccotti他、2022)が、その性能は基質に大きく依存する(Broeckx他、2021)。例えば、幼生の発育時間や最大幼生体重などの飼育パラメータは、使用する飼育基質に強く影響される(Cappellozzaら、2019)。さらに、食餌は幼虫の腸内細菌叢の数と動態に影響し(Bruno et al., 2019b; Wynants et al., 2019; Klammsteiner et al., 2020)、微生物叢の変化が成長成績の変化と相関するかどうか、またどのように相関するかという疑問が生じる(Klammsteiner et al., 2021)。この観点から、昆虫自身とその腸内微生物群集によって行われる昆虫の生物変換能力に寄与する代謝メカニズムに関する研究が開始されている(Jiang et al.) 最近、無菌のBSF幼虫やgnotobioticのBSF幼虫を用いることで、腸内細菌叢がこれらの幼虫のタンパク質分解をどのように助けるかがすでに明らかになっている(Yuら、2023)。代謝プロセスにおける昆虫と微生物の相互作用に関する深い知識は、このような産業残渣の流れにおける幼虫のパフォーマンスを向上させ、ひいてはBSF幼虫飼育の持続可能性を高めるためのマイクロバイオーム工学ツールの開発にとって極めて重要である。
上述の研究を含むほとんどの研究は、幼虫全体または腸全体のレベルで、飼育基質に基づいて腸内細菌叢がどのように変化するかをマッピングしている(Wynantsら、2019;Klammsteinerら、2020;Tegtmeierら、2021a,b;Zhinengら、2021;Gorrensら、2022)。しかし、Bonelliら(2019)は、BSF幼虫の腸は、形態と機能が異なる領域で組織化されていることを明らかにした。簡単に説明すると、消化管は短い前腸、3つの主要領域(前腸、中腸、後腸)からなる中腸、後腸に分けられる。3つの中腸領域に焦点を当てた分析により、酵素活性、内腔pH、上皮形態に違いがあることが明らかになった(Bonelli et al.) したがって、腸は微小環境の集合体であり、それぞれが特定の微生物叢を保有していると考えるべきである。実際、BSF幼虫では、3つの中腸領域が、中腸内腔の化学的特性と各領域の生理学的機能に関連する、あるいは影響を受ける、異なる微生物群集を保有していることが判明している(Bruno et al.) これらの異なる領域内の微生物叢を特徴付けることは、腸全体レベルで見るのと比較して、特定の領域における特定の微生物の存在と、その特定の腸領域で活動する消化プロセスにおいて宿主をサポートする機能との相関関係を単純化する機会を提供する。このアプローチは、このような相関関係を検証するために必要なin vitroおよびin vivoの作業とともに、消化プロセスにおける微生物群集と昆虫自体の寄与を定義し、特定のポリマー(例えば、セルロース、ヘミセルロース、リグニン)の分解機能を持つ特定の細菌および菌株を同定することを可能にする。さらに、食餌がどのように微生物相を形成するのか、微生物群集組成の変動が幼虫の成長性能の違いに関与している可能性があるのかを理解することにも貢献する(Tettamanti et al.)
本研究の目的は、(1)BSF幼虫を2種類の産業残渣(ケータリングやスーパーマーケットの食品残渣と可溶分を含む蒸留乾燥穀物の混合物)で飼育している間に、BSF幼虫全体に存在する微生物群集に関する追加データセットを作成すること、および(2)同じ残渣で飼育した収穫時のBSF幼虫の腸内領域に存在する微生物群集に関する追加データセットを作成することであった。以前の研究(Wynants et al., 2019; IJdema et al., 2022)で採用されたものと同じシーケンスパイプラインを用いて、幼虫の成長パフォーマンスと選択した残留流の微生物および栄養組成を考慮しながら、幼虫全体の微生物叢と腸領域の微生物叢を説明した。さらに、後腸の微生物組成の分析も行った。この領域の群集はこれまで分析されていなかったからである。この研究により、BSF幼虫の微生物相に関する既存の情報が増え、このようなデータは、特定の微生物の存在と腸内の代謝機能を関連付けるための第一歩となる。
材料と方法
昆虫飼育基質、飼育プロトコル、幼虫成長モニタリング
幼虫の発育と腸内細菌叢に及ぼす2つの異なる産業残渣の影響を比較するため、BSF幼虫をケータリングと スーパーマーケットの食品残渣混合物(以下、「スウィル」と呼ぶ)と、バイオ燃料生産から生じる穀物ベースの残渣 流である可溶分を含む乾燥ジスチラーズ・グレイン(DDGS、ブランド名 Proticorn)で飼育した。スウィルとDDGSはそれぞれ、より正確にはRenewi社(ベルギー、Kampenhout)とAlco Bio Fuel社(ベルギー、Ghent)から直接入手した。糞尿は主に植物性であると思われるが、Renewi 社が様々なケータリング会社やスーパーマーケットから調達したため、その正確な組成は不明である。市販の鶏用飼料(CF, Chicken start mash, AVEVE, Leuven, Belgium)を対照基質として用いた。スウィルは使用するまで冷凍保存(-20℃)した。飼育前に室温で解凍し、余分な自由水を除去した後、CF と DDGS を乾物:水=1:1の割合で混合し、幼虫に直接与えた。
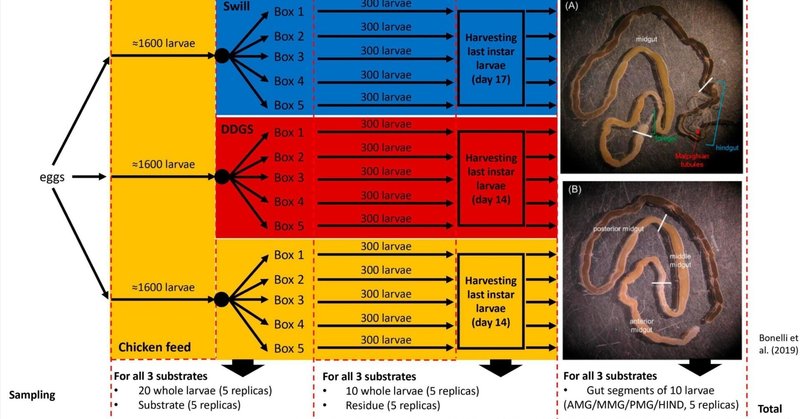
2015年にインスブリア大学(イタリア、ヴァレーゼ)で設立されたBSFコロニー(Brunoら、2019a)から得た卵を、27.0±0.5℃、相対湿度70±5%、暗所で孵化させた。各飼育基質について、新生幼虫をCF上で4日間哺育した。4 日目に、幼虫を各飼料ごとに 5 つの別々の飼育箱(16cm×16cm×9cm)(各 300 頭)に分け(図 1)、100g の基質(上記のように調製した CF、スウィルまたは DDGS)を充填し、27.0±0.5℃、相対湿度 70±5%の暗所にて最終幼虫齢に達するまで飼育した。給餌基質には3日ごとに新鮮な飼料を加えた。
図1
www.frontiersin.org
図 1. 図 1. 2 種類の工業用残渣を用いたクロソイフライ飼育の実験セットアップ。概要には、飼育4日目、収穫時、および幼虫を解剖して3つの主腸切片(A)と中腸切片(B)を得た後のサンプリング詳細を含む。
3つの基質上での幼虫の成長を経時的にモニターするため、4日目から2日ごとに少なくとも20匹の幼虫を無作為に採取した。サンプリング後、幼虫を水道水で洗って体から食べかすを取り除き、水分を拭き取った後、体重を測定した。体重は25%が蛹になるまで記録した。各基質における幼虫の成長の分析は3連で行った。
実験セットアップとサンプリング
実験セットアップの完全な概要を図1に示す。飼育中、細菌相をモニターするために2つのサンプリング時点を選んだ。4日目に、20匹の幼虫からなるサンプルを5個ずつ、3つの別々の哺育箱すべてから採取した。さらに、3つの異なる飼育基質(幼虫に投与する前)から、それぞれ5gのサンプルを採取した。2 回目のサンプリング時点(「収穫時の幼虫」と表記)は、CF と DDGS で飼育した幼虫については 14 日目、スウィルで飼育した幼虫については 17 日目であった(幼虫サイクルの最終日に相当し、幼虫は最大体重に達し、まだ活発に摂食しており、前蛹期の前である)。この時点で、完全に成長した幼虫10頭からなるサンプル1個と、飼育残渣(糞や脱殻を含む飼育期間終了時の残留基質)5gからなるサンプル1個を、飼育基質ごとに各箱から採取した。サンプリング後、幼虫を水中70%エタノールで洗浄し、その後オートクレーブ蒸留水で2回洗浄し、クチクラに付着した余分な餌を除去した。この2回目のサンプリング時点で、各基質につき各飼育箱から10頭の幼虫を1プールずつ追加で採集した。これらの幼虫を洗浄、消毒し(上記参照)、解剖して4つの異なる腸領域を得た(下記「腸領域の解剖と分離」参照)。このようにして、各飼育基質について20個の腸領域のサンプルを得た。合計120のサンプルを収集し、細菌相組成を分析した(図1)。サンプルは分析まで凍結保存(-20℃)した。
基質化学組成の決定
飼育用基質の化学組成分析は La-Chi laboratory(パドヴァ大学農学部、食品・天然資源・動物・環境学科、 Agripolis、Legnaro、イタリア)で実施した。CF および DDGS 試料はそのまま分析し、糞尿試料は凍結乾燥機(Alpha 2-4 LD plus, Martin Christ GmbH, Osterode am Harz, Germany)を用いて 12~15 mbar、-80℃で一晩凍結乾燥した。全サンプルをAOAC Internationalのプロトコル(Horwitz, 2000; Latimer, 2016)に従い、粗タンパク質、粗脂質、粗繊維、無窒素抽出物、灰分について分析した。
腸領域の解剖と分離
4つの腸領域を得るために、まず収穫時の幼虫を氷上で麻酔し、次にサンプルの二次汚染を避けるために滅菌ピンセットとハサミを用いて、水平流フード内で実体顕微鏡下で腸を分離するために解剖した。腸を滅菌リン酸緩衝生理食塩水(mM単位:137 NaCl、2.7 KCl、4.3 Na2HPO4、1.4 KH2PO4、pH 7.4)で満たした滅菌シャーレに入れ、前腸、中腸、後腸(それぞれAMG、MMG、PMG)、後腸(HG)の4つの対象領域に分けた(Bonelli et al.) 外部からの汚染の可能性を低減するため、各幼虫の腸の解剖には新しいシャーレを使用し、各分解の間にピンセットとハサミを水中70%エタノールで消毒した。10個の腸領域を滅菌プラスチックチューブに集め(各食餌につき腸領域あたり5反復)、使用するまで-80℃で保存した。
DNA抽出および総細菌量qPCRアッセイ
DNA 抽出の前に、すべてのサンプル(合計 120 個)を 4℃の冷蔵庫で 1 時間解凍した。サンプルは、滅菌したスパチュラで混ぜる(新鮮な基質(5 g×15サンプル)および飼育残渣(5 g×15サンプル))か、滅菌したストマッカーバッグ(完全に成長した幼虫、各10幼虫×15サンプル)または滅菌した遠心チューブ(新生児(各20幼虫×15サンプル)および腸領域(各10腸領域×60サンプル))で破砕してホモジナイズした。サンプルはE.Z.N.A.® Soil DNA kit(Omega Bio-Tek, VWR, Leuven, Belgium)を用い、製造元のプロトコールに従ってゲノムDNA抽出を行った。DNAの量と質は、mySPEC分光光度計(mySPEC Touch, 732-2534, VWR)を用いて評価した。
サンプルの総細菌量を定量化するために、DNA抽出物を、Borremansら(2019)の記載に従って、16S rRNA遺伝子のV4領域を標的とする定量的リアルタイムPCR(qPCR)に供した。各DNA抽出物は2回測定した。簡単に説明すると、qPCR反応(10μl)には、1μlのDNA抽出液(DNA濃度は8~413ng/μl、平均67ng/μl)、5μlのPowerUp™ SYBR® Green qPCRマスターミックス(Life Technologies社、Thermo Fisher Scientific社、ベルギー、アッセ)、および0.2μMの各プライマー(515Fおよび806R)が含まれていた(補足表1)。qPCRは、QuantStudio 3システム(Applied Biosciences社、Thermo Fisher Scientific社)を用いて実行した。反応プロトコールは、50℃で2分、95℃で10分を1サイクルとして、95℃で15秒、60℃で60秒を40サイクル繰り返した。各サイクルの終了時に蛍光を測定し、60℃から95℃まで徐々に温度を上昇させながら融解曲線解析を行った(0.1℃/秒)。各アッセイには、鋳型なしコントロール(NTC、DNA抽出液の代わりに滅菌ミリQ水)と、鶏の飼料で飼育した全幼虫のサンプル(WLD18CF1)から生成した16S rRNA遺伝子断片(515Fおよび806R)の精製(E.Z.N.A.® Cycle Pure kit、VWR)および定量(mySPEC Touch、VWRおよびDNAコピー数計算機、Thermo Fisher Scientific)PCR産物の連続標準希釈液が含まれた(補足表1)。各サンプルの遺伝子コピー数は、DataConnect™ Cloud Software(Thermo Fisher Scientific)の Design and Analysis 2 アプリケーションを使用して計算し、遺伝子コピー数/g サンプル(両レプリケートの平均値)で表した。検出限界は100または1,000コピー/μlのDNA抽出液に対応する。特定の細菌種は 16S rRNA 遺伝子を複数コピーしており、絶対量の過大評価につながる可能性があるため、qPCR 結果の正規化が適用されることがあります。しかし、この方法にはまだ疑問があるため(Starke et al.
16S rRNA遺伝子配列決定による細菌相組成の決定
細菌相組成の概要を得るために、各サンプルを、Bossaertら(2021)が記載したように、デュアルインデキシング戦略(Kozichら、2013)を用いたIllumina MiSeqシーケンスにかけた。準備として、すべてのDNA抽出物のV4 16S rRNA遺伝子領域を、バーコード化されたバージョンのプライマー515Fと806R(補足表1)を用いたPCRで増幅した(Caporaso et al.) 次に、得られたアンプリコンをAgencourt AMPure XP磁気ビーズ(Beckman Coulter, Indianapolis, IN, USA; メーカープロトコール)を用いて精製し、等モル濃度でライブラリーにプールした。PCRのネガティブコントロール、および昆虫から分離した7種の細菌からなるモックコミュニティ(Gloder et al. エタノール沈殿とゲル抽出(QIAquick Gel Extraction Kit, Qiagen, Hilden, Germany)による最終精製後、ライブラリーは2 nMに希釈され、アントワープ大学でMiSeq v2 500サイクル試薬キット(Illumina, San Diego, CA, USA)を用いてIllumina MiSeqシーケンサーを用いてシーケンスされた。
得られたデマルチプレックスFASTQシーケンスファイルでは、バーコードおよびプライマー配列が除去された。コンセンサス配列を形成するため、USEARCH(v11.0.667)(Edgar, 2013)を用いて、オーバーラップ領域で最大10ミスマッチを許容した状態でペアエンドリードをマージした。次に、配列を250塩基目で切断し、250 bpより短いリード、または総期待誤差閾値が0.1以上のリードは、USSEARCHを使用して破棄した。その後、Mothur (v1.39.3)のコマンド "classify.seqs "と "remove.lineage "または "get.lineage "をSILVAデータベース(v1.38)と組み合わせて使用し、潜在的な葉緑体、ミトコンドリア、その他の非ターゲット配列を同定、除去した。次に、USSEARCHに実装されているUNOISE3アルゴリズム(Edgar and Flyvbjerg, 2015)により、配列をゼロ半径操作分類単位(zOTU)(Edgar, 2016)に分類した。最小グローバル相対存在量が8リードのzOTUのみが保持され、キメラ配列は除去された。すべてのデータセットをR(v3.5.2)で「decontam」(v1.2.0)を用いて解析し、昆虫サンプル対陰性対照サンプルにおけるzOTUの有病率に基づいて汚染物質の存在を補正した(R Development Core Team, 2013; Davis et al.) 最後に、配列数を13,000リードに希釈し、0.1%未満の相対存在量は除外した。各zOTUの分類学的起源は、SILVA Living Tree Project v1.23(LTP v1.23)に基づき、USEARCHに実装されているSINTAXアルゴリズムで決定した(補足表3)。ブートストラップの信頼値が0.80を超えた場合、分類学的同定は信頼できるとみなされた。さらに、除染後に残ったzOTUの分類学的同定は、GenBankのタイプ物質とのBLAST検索で検証した(補足表3)。模擬コミュニティを解析した結果、予想された分類群はすべて検出され、品質フィルタリングと除染ステップを通過した汚染物質は1つもなかった。処理されたシーケンスデータから、RのPhyloseq(v1.26.0)パッケージ(McMurdie and Holmes, 2013)を用いてChao1多様性指数とShannon-Wiener多様性指数を算出した。
統計解析とデータの可視化
BSF幼虫腸管領域の総細菌量と多様性指数を表示するために、JMP Pro 17(SAS Institute, v17.0.0)を用いてボックスプロット図を作成した。ノンパラメトリックのKruskal-Wallis検定を用いて、飼育基質ごとのサンプル間の総細菌量と多様性の平均値の差を求めた。Rのphyloseqパッケージのplot_heatmap関数を用いて、最も豊富なzOTUのヒートマップを作成した。該当する場合は、Dunnのpost-hoc検定を用いて一対比較を行った。いずれの場合も有意水準は0.05とした(JMP Pro 16)。サンプル間の細菌相組成の違いを可視化するために、Rのphyloseqパッケージ内のplot_ordination関数を使用して、Bray-Curtis距離に基づく非計量多次元尺度法(NMDS)順序プロットを作成した。ヘリンジャー変換した相対存在量データのブレイカーチス非類似度は、Rのveganパッケージ(Oksanen et al、 2022)(補足表5)。また、RのMicrobiomeMarkerパッケージのrun_lefse、rune_deseq2、run_edgerコマンド(デフォルト設定)を用いて、食餌ごとの幼生腸内の特徴的なzOTUを検索するために、判別分析効果量(LEfSe)、DESEq2、EdgeR BioMarker分析を行った。最後に、3つの基質で飼育した昆虫間の最終幼虫体重と幼虫期間の長さの差異を検出するために、ノンパラメトリックのKruskal-WallisとDunnのポストホック検定、および一元配置分散分析(ANOVA)とTukeyの検定をそれぞれR環境で行った。
結果と考察
飼育基質の栄養組成
微生物叢の変化が飼料の特定の特徴とどのように相関しているかを評価するために、飼料の栄養組成を決定した。この分析により、本研究で飼育基質となった鶏の飼料および2種類の工業的残渣の間で強いばらつきがあることが明らかになった(表1)。給餌時」のタンパク質含量が最も高い飼料は DDGS であり、次いで CF および糞尿であった(表 1)。DDGS の脂質総含有量(給与時)は 4.5%であり、スウィルと CF(それぞれ 2.5%と 2.6%)のほぼ 2 倍であった。粗繊維含量は 3 種類の飼料とも、文献で試験された他の基質(Broeckx ら、2021)と比べて低 かった。DDGS の粗繊維含有率は 1.8%であり、スウィル(0.9%)および CF(1.0%)と比較するとやや高い。最後に、3 種類の飼料の無窒素抽出物(化学物質のうちデンプンと糖類を含む)には以下の順序が観察された: CF > DDGS > swill(それぞれ 26.6、18.0、7.4%)であった。
表 1
www.frontiersin.org
表 1. 鶏用飼料、DDGS および糞尿の化学組成および含水率。数値(飼料 100 g あたりの g)は「給与時」および「乾物」基準で表した。前者は幼虫に給餌した飼料に水分含量を考慮して計算した値であり、後者は水分を含まない場合の値である。
このような飼料間の栄養組成の違いは、幼虫の成長成績に影響を与える可能性がある(Scalaら、2020;Broeckxら、2021;Laganaroら、2021)。例えば、タンパク質含量が高い飼料は幼虫の体重を重くし、発育期間が短くなることが多い(Nguyenら、2013;Beniers and Graham、2019;Egginkら、2023)。同時に、タンパク質と炭水化物の比率も幼虫の良好な成長に不可欠であることが判明しており、最適な範囲は1:2から1:3であることが示されている(Egginkら、2023)。
飼育基質の細菌群集組成
栄養組成の違いとは別に、飼料(Scalaら、2020;Broeckxら、2021;Laganaroら、2021)には可変的な微生物群集が含まれることもある。栄養の変動とともに、これは幼虫の腸内細菌叢の組成にも影響を与える可能性がある。特に、飼育基質中に存在する特定の高分子を分解する機能を持つ分類群が幼虫の腸内群集に定着し(Auger et al.
経時的な基質中の細菌負荷
飼育基質の微生物の違いを最初に知るために、総細菌量を測定した。初期細菌負荷は DDGS の方が CF およびスウィルよりもはるかに低く、それぞれ平均 3.3 × 105 対 3.2 × 108 および 3.5 × 108 16S DNA コピー/g 基質であった。DDGS は発酵工程の副産物であり、乾燥工程を経ていることから、このような微生物量の減少は予想されたことである。とはいえ、DDGS には粗タンパク質、脂肪、繊維、およびビタミンなどその他の栄養素が少量含まれている(Iram ら、2020)。従って、一度水分を補給すれば、微生物は飼料中で十分に増殖するはずである。実際、実験終了時までに DDGS 残渣の総細菌数は 2.1 × 109 16S DNA コピー/g 残渣と大幅に増加したが、これは CF およびスウィル残渣の平均 DNA コピー数/g(それぞれ 1.0 × 1010 および 3.1 × 108)と同程度であった。興味深いことに、総細菌量は実験期間中比較的一定であった。これは水分含量(ひいては水分活性)の差に起因すると考えられ、この差はサンプリングおよび実験に使用する前 にすでに高い値を示していた。一方、DDGS と CF は乾燥した調合飼料であったため、実験開始時に追加の水分が必要となり、微生物の増殖にとっ てより好都合な条件が発生した可能性が高い。
基質中の微生物群集組成と BSF 幼虫飼育中のその動態
次に、16S rRNA遺伝子配列決定法を用いて、群集レベルの多様性を調べた。その結果、DDGS 飼料および CF 飼料の微生物相はスウィルと比較してより多様であることが明らかになった(図 2)。このことは、DDGS および CF の平均シャノン多様性指数(それぞれ 3.96および 3.88)に比べ、豚糞粉の平均シャノン多様性指数が低いこと(3.18)で示された(補 表 4)。この多様性は 3 種類の基質すべて の残渣で低下し、CF、DDGS、スウィルでそれぞれ 2.89、2.47、2.14 となった。Jiang ら(2019)も同様の減少を観察し、これは摂食中に基質が腸内を通過することによって微生物群に選択圧がかかるためであると推測している。
図2
www.frontiersin.org
図2. 本研究で用いた3つの異なる基質について、基質、飼育中4日目(D4)のクロソルガエバエ幼虫、収穫時の幼虫、飼育後の残渣の細菌群集組成の相対存在量をそれぞれ示した。データは 5 標本(n = 5)の平均値で示したが、鶏飼料基質(n = 1)、DDGS 基質(n = 4)および DDGS 上での収穫時の幼虫(n = 3)は除いた。表示された zOTU は、少なくとも 1 つのサンプルで全体の相対存在量が 5%を超えていた。その他の zOTU はすべて「その他の zOTU(5%未満)」として表示した。zOTUの同定はSILVA Living Tree Projectから得た。
4 つの zOTU が、CF と DDGS の両方で最も豊富であった(zOTU あたり全リードの 5-12%)。それらは、Levilactobacillus sp. (zOTU 5)、2 種類の Corynebacterium sp. (zOTU 6 および 10)、および Massilia sp. (zOTU 13)であった。他方、下水中の群集は、Leuconostoc属の乳酸菌(zOTU 22、38、42、56、58)が全リードの52.6%を占め、Latilactobacillus属の乳酸菌(zOTU 25、全リードの11.2%)に支配されていた。この証拠に基づき、微生物学的見地からは、DDGS と CF はスウィルよりも類似性が高いと結論づけることができる。このことは、DDGS と CF がともに穀物ベースの基質であり、むしろ組成がより変動しやすい食品残渣の混合物であるという事実から説明できるかもしれない。残渣では、幼生に関係する zOTU が時間の経過とともに優勢になり、この群集のシフトが起こった。これは、残渣の微生物群集の形成におけるBSF幼虫の影響に関する先行研究と一致している(Jiang et al.)
次に、このような基質間の栄養および微生物の違いが、これらの飼料でのBSF幼虫の生育成績、ひいては微生物群集にどのような影響を与えるかを調べた。
異なる飼育基質が幼虫の成長に与える影響
使用した飼育基質によって、幼虫の成長成績に重要な違いが見られた(図3)。詳細には、バイオ燃料製造の副産物である穀物ベースの DDGSで飼育した幼虫は、対照として用いた鶏用飼料基質と比較して、幼虫期の長さ(それぞれ14.3±0.3日と13.7±0. 3 日)(ANOVA p 値:p < 0.001, Tukey p 値:DDGS 対 CF, p = 0.392)、および幼虫が到達した最大体重(それぞれ 290 ± 11 mg および 303 ± 11 mg)(Kruskal-Wallis p 値:p < 0.001, Dunn p 値:DDGS 対 CF, p = 1.000)。幼虫をケータリングやスーパーマーケットから回収された食品残渣からなる残留有機物であるスウィルで飼育した場合、幼虫の成育は遅かった(幼虫期間完了まで 17.3 ± 0.3 日)(ANOVA p-value: p < 0. 001, Tukey p-value: p < 0. 001, Tukey p-value: swill vs. CF, p < 0.01)、コントロールに比べて小さいままであった(幼虫が到達した最大体重は187±8mgのみ)(Kruskal-Wallis p-value: p < 0.001, Dunn p-value: swill vs. CF, p < 0.001)。幼生の発育に関するこれらのデータと既存の文献を比較すると、幼生はスウィル飼料で期待どおりの結果を示した。例えば、Lievens ら(2022)は、BSF 幼虫を、工業的に採取されたものではなく、新鮮な原材料から構成された人工スウィルで飼育した場合、最大体重 199.6 ± 16 mg を観察した。産業廃棄物の流れを調べた別の研究では、最終質量は 176.4 ± 15 mg であったと報告している(Broeckx 他、2021)。
図3
www.frontiersin.org
図3. CF(黄色のグラフ)、DDGS(赤色のグラフ)、および汚泥(青色のグラフ)で飼育したクロソタバエ幼虫の発育時間。灰色の点線は幼虫が最大体重に達した日(幼虫期の終わりとみなす)を示す。エラーバーは標準誤差を示す。異なる文字は、異なる基質で飼育した幼虫が幼虫期の終わりに到達した最大体重の統計的有意差を示す。
豚糞飼料で観察された幼虫の成長成績への悪影響は、他の飼料と比較して、この飼料に含まれるエネルギー含有大栄養素(タンパク質、脂肪、炭水化物)の量が少ないことで説明できるかもしれない(表1)。基質の水分含量が高いこと、特に自由水分が過剰であることは、BSF幼虫の成長にとって有害である(Padmanabhaら、2020;Yaktiら、2023)。このことを念頭に置いてもなお、飼育基質として糞尿を使用することは興味深いかもしれない。
飼育基質と幼虫の発育段階が幼虫全体の細菌相組成に及ぼす影響
幼虫の成長性能への影響に加えて、飼育基質は幼虫の腸内細菌群集の組成に影響を与える可能性がある(Jeon et al.) 特定の腸内微生物は、飼料に含まれるタンパク質、セルロース、脂質、ペクチンなどの高分子の消化を可能にする酵素をコードする遺伝子の存在により、宿主の消化プロセスのサポートに関与する(Engel and Moran, 2013; Callegari et al.) したがって、飼育基質の化学的含量は幼虫の腸内微生物集団の組成に影響を与える可能性があり(Bruno et al., 2019b; Klammsteiner et al. そこでまず、選択した基質で飼育中の幼虫全体の微生物相を調べた。
D4および収穫時の基質、飼育残渣、全幼虫のサンプルについてNMDSおよびPERMANOVA分析を行った結果(図4)、幼虫の細菌組成に対する食餌の影響は有意であり(R2 = 0.08; p < 0.001)、異なるサンプルタイプ間でも変動が見られた(R2 = 0.15; p < 0.001)。予想通り、D4の幼虫サンプルは、同じ飼料(CF)で飼育された幼虫に由来し、発育日も同じであったため、密接に関連していた。逆に、D4以降に3つの異なる飼料で飼育された幼虫に由来する収穫時のサンプル間の距離は増加した。意外なことに、DDGSに移行した幼虫のD4時の群集は、他の2種類の飼料に移行した幼虫のD4時の群集と比較して異なっていた(図2)。同定された zOTU の大部分は 3 試料すべてに存在し、これは NMDS(Figure 4)の距離が近いことを説明するものであるが、これらの zOTU の存在量は 3 試料間で有意に異なっていた(Figure 2)。例えば、DDGS に移行した幼虫の Providencia sp. (zOTU 7):Weissella sp. (zOTU 2) の存在比は約 5:1 であったが、他の 2 種類の飼料では 1:6 ~ 1:70 であった(図 2)。各飼料は独立した飼育サイクルで分析されたことから、未知の環境パラメーターが生物学的複製内でさえも群集動態を変化させ、細菌群集のどのメンバーが優勢になるかを決定する可能性があることが示された。Gorrensら(2022)の研究でも、産業環境における連続した6回の飼育サイクルを調べたところ、同じような存在量の変動が観察された。収穫時には、3つの基質すべてでシフトが観察され、その結果、鶏の飼料で育てた幼虫でもシフトが観察された(図4)。これらの幼虫は飼育サイクルの間、ずっと同じ基質上で飼育されるため、このことは注目に値する。このことは、後述するように、食餌以外に、発育段階などの要因も細菌群集の構成に明確な影響を与えることを示している。
図4
www.frontiersin.org
図4. ヘリンジャー変換した細菌群集の相対存在量データ(ストレス=0. 1757)、飼育4日目(D4)のクロソイフライ幼虫、収穫時の幼虫、飼育後の残渣のそれぞれについて、本研究で使用した3つの異なる飼育基質(n = 5)、ただしニワトリ飼料基質(n = 1)、DDGS基質(n = 4)、DDGS上の収穫時の幼虫(n = 3)は除いた。2つのデータ点間の距離が大きいほど、細菌群集の類似性が高い。異なる色は異なる飼育基質(黄色はチキンフィード、赤はDDGS、青はスウィル)を表し、異なる記号は異なるサンプルタイプ(三角は基質サンプル、球はD4時の幼虫サンプル、丸は収穫時の幼虫サンプル、四角は残渣サンプル)を表す。
食餌に依存した特定の変化を拡大すると、モルガネラの一種であるzOTU 14が収穫時の幼虫の微生物叢のかなりの部分(4.1%)を占め、特にDDGS食で顕著であったことは興味深い。Morganella morganii は Klebsiella oxytoca とともに、腸内で尿素を加水分解することにより、テフ リトコミバエ Bactrocera dorsalis の幼虫の窒素リサイクルを助けることが文献で報告されている(Ren ら、2022)。この草食性昆虫にとって、窒素はしばしば制限的な栄養素であり、さらに昆虫の窒素利用率が低いために、大量の窒素性廃棄物を排泄する。この排泄物は主に尿酸の形をしているが、双翅目の種は排泄前にこの尿酸をアラントインに分解する(Barragán-Fonseca et al.) そのため自然界では、昆虫は共生生物を使ってこの窒素廃棄物を再利用する戦略を進化させてきた(Douglas, 2015)。簡単に説明すると、尿酸またはアラントインは中核となる共生生物によって尿素とNH4+ に代謝され、さらに昆虫が再吸収できる必須アミノ酸も生成される(Green and Popa, 2012)。DDGS飼料はもちろん窒素制限飼料には該当しないが、タンパク質の摂取が不均衡になると、カイコBombyx moriなど他の昆虫でも窒素性排泄物の分泌が増加することが示されている(Horie and Watanabe, 1983; Woods et al.) したがって、この食餌でこのモルガネラ属菌がより多く生息しているのは、増殖に適した窒素基質がより多く利用可能であることと関連している可能性があるという仮説を立てた。実際、既存のデータセットでも、タンパク質が豊富な餌、例えば魚食でこの属がより多く存在することが示されている(Bruno et al.) さらに、BSF幼生から分離されたモルガネラは、ウレアーゼ活性を有することがすでに示されている(Callegari et al.) 将来的には、これらの共生細菌の機能的特徴を明らかにすることで、窒素廃棄物の代謝における役割を実証できることが期待される。
興味深いことに、基質の微生物相と幼虫との直接的な相互作用はあまり見られなかった。CF上では、基質中に存在するいくつかのzOTU[例えば、Enterococcus属(zOTU 1)、Massilia属(zOTU 13)、Bifidobacterium属(zOTU 15)]がD4から収穫までの間に幼虫においてより優勢になったが(図2)、異なる基質中に存在する他の高存在細菌は、それらの基質上で幼虫を飼育した後、必ずしも高存在で発見されたわけではない。例えば、スウィル細菌組成の主要なLeuconostoc属2種(zOTU 38と42)は、この基質で飼育した幼虫にはほとんど見られなかった。その結果、飼育基質、微生物相、幼虫の相互作用は、基質への接種後の特定の食中毒病原体の運命について観察されたように、特定の微生物種に依存する可能性がある(De Smetら、2021;Gorrensら、2021)。
摂食基質に加え、幼虫の微生物群集を形成するもうひとつのパラメーターは昆虫の発育である。実際、特定の細菌群集組成が、BSFの異なる発生段階(幼虫、前蛹、蛹、成虫、卵)(Zhengら、2013;Heusslerら、2022)、あるいは異なる幼虫齢期(Gorrensら、2022;Ijdemaら、2022)を特徴づけることが示されている。図2、4で報告したように、また多様性指標(補足表4)および全幼虫サンプルのみに着目した追加的なNMDS(補足図1)によって確認されたように、4日目(D4)の幼虫と収穫時の幼虫の一般的な微生物組成は大きな違いを示した。しかし、これらの差異について、食餌と昆虫の発育という両パラメーターの重要性を紐解くことはほぼ不可能であることは明らかである。これは、CFで飼育された幼虫だけが実験期間中ずっと同じ餌を食べ続けるという実験セットアップ(図1)のせいでもある。D4の幼虫は主にWeissella属(zOTU 2)とProvidencia属(zOTU 7)の細菌を保有していたが、収穫期の幼虫はEnterococcus属(zOTU 1)、Massilia属(zOTU 13)、Levilactobacillus属(zOTU 4)といった他の属が優勢で、全く異なる多様な細菌組成を含んでいた。この観察は、幼生発生過程における細菌群集の「成熟」という仮説に合致する。細菌群集組成の同様の成熟は、BSF幼虫に関する別の研究(Gorrensら、2022年)で観察されただけでなく、他の家畜(Everaertら、2017年)やヒト(Bellerら、2021年)でも起こることが知られている。
幼虫D4から収穫時の幼虫まで、餌の種類とは無関係に起こる微生物叢の変化については、経時的な飼育環境の変化も考えられる。実際、幼虫が生息する基質の微生物組成は、幼虫の存在に強く影響される。基質pHの変化[アルカリ性pHへの典型的な進化(Meneguzら、2018)]、排泄物の存在、幼虫の消化器官を通過することで、基質由来の特定の細菌の増殖が促進されたり回避されたりする可能性がある(Bonelliら、2019;Brunoら、2019b)。実際、本研究で調査したすべての飼料において、図4および補足図2に示すように、基質から残渣への細菌組成のシフトが観察された(R2 = 0.15、p < 0.001)。また、図2および多様性指標(補足表4)から、すべての飼育飼料の残渣は、最初の基質と比較して、異なる多様性の低い細菌組成を保持していることが明らかである。
BSF幼虫の腸内全域における細菌群集動態
これまでのところ、腸内微生物群集は幼虫全体のレベルで評価されており、昆虫の大きさのために腸の解剖がまだ複雑すぎる昆虫の発生初期段階についても調べる可能性がある。しかし、微生物叢の多様性は昆虫の腸の複雑さに正比例する可能性がある。特に、摂取した餌の種類は別として、上皮の形態、内腔の異なるpHの存在、および/または消化酵素の変化は、昆虫の腸全体に沿った微生物叢の組成に影響を与える可能性がある(Dillon and Dillon, 2004)。BSFの場合、幼虫の腸内のpHの強い変動(Brunoら、2019b)、および消化酵素(主にリゾチーム)の存在と活性の違い(Bonelliら、2019、2020)は、この器官の全長に沿った微生物群集を強く形成する可能性がある。Brunoら(2019b)は、この仮説を探求した最初の研究者である。彼らは、中腸領域に沿って多様性が減少する一方で、細菌負荷は中腸の前方から後方に向かって増加することを発見した。彼らはまた、タンパク質含量の高い基質が中腸のディスバイオシスを誘発する可能性があると結論づけた。これらの知見をさらに詳しくするために、この研究では、この仮説を検証するためにさらに基質を調べ、初めて後腸の微生物群集の分析も行った。実際、我々の知る限り、BSF幼虫の腸内微生物組成は、器官全体(Klammsteiner et al. 後腸を別のサンプルとして導入することで、新たな興味深い知見が得られる。
本研究で使用した3つの基質で飼育したBSF幼虫由来の腸領域における細菌相組成を比較したところ、腸領域に沿った細菌相のシフト(R2 = 0.25; p < 0.0001)、および異なる飼料間での細菌相のシフト(R2 = 0.26; p < 0.001)が起こった。図5、6に示すように、AMGとMMGの組成は、基質あたりでは依然として非常に類似していた。しかし、PMGをAMGおよびMMGと比較すると、NMDSプロット上の距離の増加によって示されるように、細菌組成のシフトが観察された(図6)。PMGでは、典型的には少数の細菌が優勢になった。まず、Enterococcus sp. (zOTU 1)がすべての PMG サンプルに豊富に存在することが確認された(CF、DDGS、およびスウィルの PMG ではそれぞれ 64、21、および 15%)一方、この種は AMG および MMG サンプルでは 10%未満の量しか検出されなかった。PMG サンプル中のその他の優勢な zOTU は、対照として CF では放線菌属(zOTU 8, 29%)、DDGS ではコリネバクテリウム属(zOTU 6, 24% および zOTU 10, 15%)の 2 種、そして混 合飼料ではレンティラクトバチルス属(zOTU 12, 21%)、リモシラクトバチルス属(zOTU 16, 11%)およびオルバレス属(zOTU 11, 31%)であった。ニワトリの飼料と汚泥の基質では、細菌組成の主なシフトはMMGとPMGの間で起こった(図 6)。このシフトはBrunoら(2019b)でも観察され、彼らはMMG中の低pH(≦3)と抗菌ペプチド、リゾチーム、消化酵素の存在が、生きている腸内細菌の大部分に強く影響しているという仮説を立てた。今後の研究では、このような微生物の不活性化が、果たしてMMGにおけるこれらの活動と関連づけられるのかどうかを探る必要がある。注目すべきは、DDGSを給与した幼虫の腸内における観察結果がこれらの観察結果と完全には一致しなかったことで、シフトはむしろPMGとHGの間でのみ発生した(図6)。これは 2 種類のコリネバクテリウム属細菌(zOTU 6 および zOTU 10)と 1 種類のコンパニ ラクトバチルス属細菌(zOTU 9)が PMG に持続的に存在することと関連しているようである。
図5
www.frontiersin.org
図 5. 本研究で用いた3つの異なる飼育基質それぞれについて、クロソルガエバエ腸内領域の細菌群集組成の相対存在量。データは5反復の平均値で示した。表示されたzOTUは、少なくとも1つのサンプルで全体の相対存在量が5%を超えていた。その他の zOTU はすべて "その他の zOTU(5%未満)"として表示した。zOTUの同定はSILVA Living Tree Projectから得た。
図6
www.frontiersin.org
図6. 本研究で使用した3つの異なる基質(n = 5)それぞれについて、クロミバエ腸管領域の細菌群集(ストレス = 0.1677)のヘリンジャー変換相対存在量データから得られたブレイ・カーティス非類似度に基づく非計量多次元尺度法(NMDS)プロット。2つのデータ点間の距離が大きいほど、細菌群集の類似性が高い。異なる色は異なる飼育基質(黄色はチキンフィード、赤はDDGS、青はスウィル)を表し、異なる記号は異なるサンプルタイプ(プラスは前中腸、開いた菱形は中腸、塗りつぶした菱形は後中腸、アスタリスクは後腸)を表す。
全体として、MMG選択は乳酸菌Enterococcus sp.、Lentilactobacillus sp.およびLimosilactobacillus sp.、放線菌綱のActinomycetales sp.および2つのCorynebacterium sp.、そしてOrbales sp.に最も影響を及ぼさなかったようである。実際、Enterococcus属や(以前は)Lactobacillus属を含むいくつかの乳酸菌は、非常に低いpHレベルでも生存することが観察されており(Menconi et al., 2014; Mubarak and Soraya, 2018)、また放線菌綱の中にも、いくつかの好酸性種が同定できる(Guo et al.) Orbales目は、ガンマプロテオバクテリアの中では比較的若い細菌目である。この目の最初の種はマルハナバチやチョウで同定されたが(Kwong and Moran, 2013)、最近では、Orbales属はダークリングビートルや野生で捕獲されたショウジョウバエ属のような他の昆虫種とも関連していた(Martinson et al.) 多くのOrbales属について低pHでの生存はまだ明確に記載されていないが、この目のメンバーはハチの腸内で多糖類の発酵を担っている。例えば、Gilliamella sp.はハチの腸内でペクチンの主要な分解者である (Zheng et al., 2019)。この発酵は酸産生も引き起こすことから、これらの微生物はより低いpH環境に耐える耐性を持っていると考えるのが妥当である。
上記の観察を強化するため、3つのBioMarker解析(LEfSe、DESeq2、EdgeR)を用いて、幼虫の腸内で領域ごとに特徴的なzOTUを探した。3つの方法すべてでzOTUが同定された場合のみ、その領域で特徴的と判断した。最後に、食餌に関係なく(図7)、また食餌ごとに(補足表6, 7)、各地域で特徴的なzOTUを調べるために解析を行った。興味深いことに、プロテウス属(zOTU 21)を除けば、MMGの特徴的なzOTUはすべて高い耐酸性で知られる属に属しており、これはこの低pH微小環境での淘汰を生き延びる能力と一致している。このことは、より中性から塩基性のpH環境(pH6-8)を示す他の3つの地域と比較して、MMGがより多くの特徴的なzOTUを含む理由も説明できる。
図7
www.frontiersin.org
図7. 異なる腸領域のバイオマーカー分析。判別分析効果量(LEfSe)、DESEq2、EdgeR BioMarker分析を行い、幼虫の腸管領域ごとに、給餌飼料に関係なく、特徴的なzOTUを探索した。3つの分析すべてで有意であったzOTUのみを示す。LEfSe解析のEF-LDAスコアは、特定のzOTUの分類学(属レベル)とともに示されている。
4つの腸領域における微生物群集の相対組成(図5)の他に、細菌DNAの総存在量(図8A)と多様性指標を決定した(図8B、C)。Brunoら(2019b)は中腸の前部から後部にかけて細菌量が増加すると報告しているが、この傾向は本研究ではスウィル食でのみ観察された(図8A)。種の多様性の減少についても同様である(図8B、C)。しかし、理由は不明であるが、これらの傾向は CF および DDGS 飼料でははるかに顕著ではなかった(図 8)。それにもかかわらず、すべての基質から得られた HG サンプルにおいて、細菌の変動性(図 5、8B、C)は低いが、総細菌負荷量(図 8A)は高いことが検出された。さらに、NMDS(図6)およびヒートマップ(図9)分析によると、すべてのHGサンプルの細菌相組成は非常に類似していることが観察された。また、各腸管領域における飼料間のBioMarker解析でも、各食品で腸管に沿って移動する際に観察される特徴的なzOTUが少なくなることから、多様性の減少が指摘されている(補足表6)。異なるHGサンプルで観察された優勢属は、Buttiauxella属(zOTU 3)、Enterococcus属(zOTU 1および28)、Providencia属(zOTU 7)およびMorganella属(zOTU 14)で、このうち後者3種はBSFの「コア」微生物叢の重要なメンバーとして名前が挙げられている(IJdema et al.) Providencia属もまた、BioMarker解析によって、HG領域の特徴的なzOTUであることが同定された(図7)。これらのコア属の中から、例えばButtiauxella属は、野菜や特に穀物に含まれ、ミネラルの吸収を阻害する難消化性成分であるフィチン酸の加水分解を助けることが報告されている(Shi et al.) 窒素リサイクルにおけるモルガネラの潜在的役割については、すでに議論されている。例えば、zOTU 14 は(GenBank との BLAST 検索により)Morganella morganii と同定され、DDGS を給与した収穫時の幼虫の HG に最も多く含まれていた(総カウントの 13.1%)。窒素性廃棄物はHGの開始時にマルピーギ管から排泄されるため、これは驚くべきことではない。
図 8
www.frontiersin.org
図8. 本研究で使用した3つの異なる飼育基質それぞれについて、クロコショウジョウバエ幼虫の腸内領域における16S rRNA遺伝子コピー/gサンプルの絶対量(A)、観察されたリッチネス(B)、およびシャノン多様性(C)。データは5反復の箱ひげ図で示してある。基質ごとの腸領域間の有意差は箱ひげ図の下に異なる文字で示した。
図9
www.frontiersin.org
図9. 本研究で調査した全サンプルの、鶏飼料基質(n = 1)、DDGS 基質(n = 4)、および DDGS 上の収穫時幼虫(n = 3)を除く、正規化(Z スコア)平均(n = 5)のヒートマップ表示。ヒートマップの色は青(負の Z スコア)から赤(正の Z スコア)まで。各行は全体の相対存在量が 5%を超える ZOTU を表し、各列は各試料を表す。サンプルの色は使用した飼育基質の違いを示す(黄色は鶏用飼料、赤色は DDGS、青色は糞尿)。サンプルはデンドログラムに従ってクラスタ化され、細菌群集組成の類似性を示している。
HGにおける明らかに保存された群集は、他の昆虫にも見られる特徴である(Breznak, 2003; Andert et al.) ゴキブリのPeriplaneta americanaでは、後腸微生物叢は非常に安定したコア微生物叢を示し、個体間の組成のばらつきが少ないだけでなく、食餌シフトにも対応している(Tinker and Ottesen, 2016)。これらの観察結果は、後腸が「コア」微生物叢を保持するリザーバーとしての役割を果たしていることを示しているように思われる。後腸は基質中に存在する栄養素に応じて増殖し、BSF幼虫が残存する難消化性の多量栄養素(繊維など)を消化したり、代謝の排泄産物(尿酸など)から栄養素を回収したりするのを助ける。この増殖の証拠は、細菌DNAの総存在量を見れば明らかで、HG領域のすべての食餌で最も高かった(図8)。
最後の余談として、CFで飼育したBSF幼虫から得たHGサンプルでは、クロストリジウム属細菌(zOTU 17, 20%)の相対量が多いことも観察された。この目には、病原性を持つ可能性のあるクロストリジウム属を含む、いくつかの胞子形成種が含まれていることから、このことは、細菌性胞子が中腸領域とそのすべての微生物学的障壁を通過して生き残り、最終的に後腸にコロニー形成する能力を示しているのかもしれない。この観察結果は、BSF幼虫を食用や飼料として利用する際の食品安全性に影響を及ぼす可能性がある(Vandeweyerら、2021年)。
結論
本研究により、関連する農産業残渣を餌とするBSF幼虫全体およびその腸管領域における細菌群集の組成と動態に関する追加データが得られた。本研究で得られた知見は、これらの細菌群集をマッピングした先行研究を支持するものであり、腸管に沿った腸内細菌叢の空間的動態をよりよく理解するのに役立つ。まず、異なる飼料での幼虫の成長を分析したところ、DDGSと鶏の飼料では同程度の成長(幼虫の最大体重はそれぞれ303 ± 11 mgと290 ± 11 mg)であったが、汚泥では減少した(幼虫の最大体重は187 ± 8 mg)。異なる基質の栄養学的分析から、この観察結果の背景には、 飼料中のタンパク質と炭水化物の含有量の低さがあると考えられ、すでに述べたように、BSFの生育にはこれらの栄養素が重要であることが確認された。幼虫全体の微生物群集に注目すると、2つの観察ができる。まず、いくつかの先行研究で述べられているように、幼虫に異なる餌を与えた場合、微生物群集の変化が観察される。しかし、1つの飼料を与えた場合でも、微生物群集の多様化とシフトを伴う微生物群集の明確な成熟が、4日目から最終齢の終わり(飼料によって14日目または17日目)までの幼虫の発育中に起こる。全体として、これらの異なるパラメーターの影響を解明することはまだ不可能である。細菌相の動態を包括的に理解するためには、各パラメーター(例えば、餌の栄養・水分含量、pH、幼虫の発育)の影響を探るための対照実験を含む、より多くの研究が必要である。そのような実験の1つとして、幼生を頻繁に交換する餌で飼育することで、餌の変化(例えば、経時的なpHの上昇や水分の減少)を避け、幼生の老化が腸内細菌叢にどのような影響を与えるかをより明確に研究することができる。
このことは、さまざまな腸内領域の細菌相を調べたときにさらに明らかになった。これまでの研究では腸全体あるいは特定の中腸地区のみが調査されてきたため、これまでまったく無視されてきた後腸領域の分析が初めて行われた。全体として、細菌群集の存在量と多様性に関するほとんどの結果は、Brunoら(2019b)によって得られた結果と一致し、微生物群集を形成するBSF中腸における選択的プロセスを示している。PMGでは、DDGSではなく、鶏の飼料と残渣を給与した場合に、細菌群集はより豊富であったが、多様性は低かった。後 腸では、いずれの飼料でも多様性の低い豊富な群集が認められた。この多様性の低い群集は 3 種 類の飼料で保存されており、主に Buttiauxella、Enterococcus、Providencia、Morganella が含まれていた。したがって我々は、後腸が昆虫関連微生物の貯蔵庫としての役割を担っている可能性を仮定し、腸管のこの未解明の領域に関するさらなる研究を正当化する。実際、後腸は主に体液調節と排泄に関連しているが、特定の微生物が保存的に存在することから、例えば基質の難分解性フラクションの処理など、さらなる機能を示唆している可能性がある。例えば、ヘミセルロースやセルロースなどの多糖類を分解できる細菌は、昆虫の後腸に生息している可能性がある(Cook et al., 2007)。
全体として、これらの知見はBSFの腸管に沿った細菌相の構造と動態の理解に貢献し、産業副産物で幼虫のパフォーマンスを向上させるマイクロバイオーム工学の取り組みに役立つ。
データの利用可能性
本研究で発表されたデータセットはオンラインリポジトリにある。リポジトリ名とアクセッション番号は以下の通り: https://www.ncbi.nlm.nih.gov/, PRJNA706185.
倫理声明
昆虫については倫理的承認が不要であるため、現地の法律および研究機関の要件に従い、動物を用いた研究には倫理的承認は必要なかった。
著者の貢献
DV、DB、JDが研究を計画し、原稿を執筆した。DV、DB、JD、MBは実験とデータ解析を行った。FI、SC、BLはシーケンス結果の処理と解釈に協力した。MCとGTは、原稿の修正、アイデア、フィードバック、原稿作成を通して貢献した。すべての著者が論文に貢献し、提出されたバージョンを承認した。
資金提供
著者らは、本論文の研究、執筆、および/または出版のために金銭的支援を受けたことを表明する。本研究は、Flanders Research Foundation [FWO; SBO project ENTOBIOTA (S008519N) and postdoctoral fellowship 12V5222N]、欧州連合のHorizon 2020 Research and Innovation program [H2020 project SUSINCHAIN (861976)]、Fondazione Cariplo (grant number 2020-0900)、欧州連合Next-GenerationEU [Piano Nazionale di Ripresa e Resilienza (PNRR)-missione 4 componente 2, investimento 1. 4- D.D. 1032 17/06/2022, CN00000022].
謝辞
Leen Van Campenhout博士のこのプロジェクトの立ち上げと発展への貢献、Ruben Smets博士とSofie Bossaert博士の統計と図のデザインへの協力に感謝する。
利益相反
著者らは、潜在的な利益相反と解釈されうる商業的または金銭的関係がない中で研究が行われたことを宣言する。
著者らは、投稿時にFrontiers誌の編集委員であったことを申告した。このことは、査読プロセスおよび最終的な決定には影響しなかった。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本論文で評価される可能性のあるいかなる製品、またはそのメーカーが主張する可能性のある主張も、出版社によって保証または支持されるものではない。
補足資料
本論文の補足資料は、https://www.frontiersin.org/articles/10.3389/fmicb.2023.1276187/full#supplementary-material に掲載されている。
補足図1|飼育中4日目(D4)のクロソイフライ幼虫と収穫時の幼虫の細菌群集(ストレス=0.1129287)のヘリンジャー変換相対存在量データから導き出したブレイ・カーティス非類似度に基づく非計量多次元尺度法(NMDS)プロット(DDGS上の収穫時の幼虫(n=3)を除き、本研究で使用した3つの異なる飼育基質(n=5)それぞれについて)。2つのデータ点間の距離が大きいほど、細菌群集の類似性が高い。異なる色は異なる飼育基質(黄色はチキンフィード、赤はDDGS、青はスウィル)を表し、異なる記号は異なるサンプルタイプ(球はD4時の幼虫サンプル、丸は収穫時の幼虫サンプル)を表す。
補足図2|飼育後の基質と残渣の細菌群集(ストレス=0.08969413)のHellinger変換相対存在量データから導き出したBray-Curtis非類似度に基づく非計量多次元尺度法(NMDS)プロット。2つのデータ点間の距離が大きいほど、細菌群集の類似性が高い。異なる色は異なる飼育基質(黄色はチキンフィード、赤はDDGS、青は汚泥)を表し、異なる記号は異なるサンプルタイプ(三角は基質サンプル、四角は残渣サンプル)を表す。
参考文献
Andert, J., Marten, A., Brandl, R., and Brune, A. (2010). 腐食性コガネムシ幼虫(Pachnoda spp.)の後腸内細菌群集の種間および種内比較。FEMS Microbiol. Ecol. 74, 439-449.
パブコメ抄録|全文|Google Scholar
Auger,L.、Deschamps,M. H.、Vandenberg,G.、Derome,N. (2023). Microbiota is structured by gut regions, life stage, and diet in the Black Soldier Fly (Hermetia illucens). Front. Microbiol. 14:1221728. doi: 10.3389/FMICB.2023.1221728.
抄録|全文|Google Scholar
Barragán-Fonseca, K. B., Gort, G., Dicke, M., and van Loon, J. J. A. (2020). タンパク質および炭水化物濃度を変化させた人工飼料に対するクロソイバエ(Hermetia illucens)の栄養可塑性。(1)クロソイバエ(Hermetia illucens)の栄養可塑性。
パブコメ要旨|全文|Google Scholar
Beller, L., Deboutte, W., Falony, G., Vieira-Silva, S., Tito, R. Y., Valles-Colomer, M., et al. 腸内細菌叢の成熟における継時的段階。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Beniers, J. J. A., and Graham, R. I. (2019). タンパク質および炭水化物の飼料濃度が黒兵児蝿(Hermetia illucens)幼虫の成長と組成に及ぼす影響(Effect of protein and carbohydrate feed concentrations on the growth and composition of black soldier fly (Hermetia illucens) larvae)。J. Insects Food Feed 5, 193-199. doi: 10.3920/JIFF2018.0001.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bonelli, M., Bruno, D., Brilli, M., Gianfranceschi, N., Tian, L., Tettamanti, G., et al. クロミミバエの幼虫は、中腸の形態的・機能的応答を通じて、異なる餌基質に適応する。Int. J. Mol. (2020)クロソイの幼虫は中腸の形態的・機能的応答を通して異なる食基質に適応する。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bonelli, M., Bruno, D., Caccia, S., Sgambetterra, G., Cappellozza, S., Jucker, C., et al. Hermetia illucens幼生中腸の構造的および機能的特徴づけ。Front. doi: 10.3389/fphys.2019.00204.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Borremans, A., Crauwels, S., Vandeweyer, D., Smets, R., Verreth, C., Van Der Borght, M., et al. イエローミールワーム(Tenebrio molitor)ペーストの発酵における6種類の市販食肉用スターター培養物の比較。Microorganisms 7:540. doi: 10.3390/microorganisms7110540.
抄録|全文|Google Scholar
Bossaert, S., Winne, V., Van Opstaele, F., Buyse, J., Verreth, C., Herrera-Malaver, B., et al. 完成ビールの樽熟成によるサワービール製造における微生物群集組成とビールケミストリーの時間的動態の記述。Int. J. Food Microbiol. 339:109030. doi: 10.1016/j.ijfoodmicro.2020.109030.
パブコメ要旨|全文|Google Scholar
Breznak, J. A. (2003). シロアリとその他の食虫類の腸内細菌叢。Annu. Rev. Microbiol. 36, 323-343. doi: 10.1146/ANNUREV.MI.36.100182.001543
抄録|全文|Google Scholar
Broeckx, L., Frooninckx, L., Slegers, L., Berrens, S., Noyens, I., Goossens, S., et al. 有機サイドストリームで飼育したクロバエ幼虫の成長。Sustainability 13:12953.
CrossRef 全文|Google Scholar
Bruno, D., Bonelli, M., Cadamuro, A. G., Reguzzoni, M., Grimaldi, A., Casartelli, M., et al. Hermetia illucens(Diptera: Stratiomyidae)成虫の消化器系.形態学的特徴と機能的特性。細胞組織研究 378, 221-238.
パブコメ抄録|クロスリファレンス|Google Scholar
Bruno, D., Bonelli, M., De Filippis, F., Di Lelio, I., Tettamanti, G., Casartelli, M., et al. hermetia illucens幼生の腸内細菌叢は食餌の影響を受け、異なる中腸領域で多様な組成を示す。Appl. Environ. Microbiol. (1)哺乳類における腸内細菌叢の変化(2)腸内細菌叢の変化(3)腸内細菌叢の変化(4)
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Callegari, M., Jucker, C., Fusi, M., Leonardi, M. G., Daffonchio, D., Borin, S., et al. Hermetia illucensに関連する培養可能な腸内細菌群集の加水分解プロファイル。Front. Microbiol. 11:1965. doi: 10.3389/FMICB.2020.01965
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Caporaso, J. G., Lauber, C. L., Walters, W. A., Berg-Lyons, D., Lozupone, C. A., Turnbaugh, P. J., et al. サンプルあたり数百万配列の深さにおける16S rRNA多様性のグローバルパターン。Proc. Natl. Acad. 米国科学アカデミー紀要 108, 4516-4522.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Cappellozza, S., Leonardi, M. G., Savoldelli, S., Carminati, D., Rizzolo, A., Cortellino, G., et al. 循環経済によって昆虫からタンパク質を生産する最初の試み。動物 9:278.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ceccotti, C., Bruno, D., Tettamanti, G., Branduardi, P., Bertacchi, S., Labra, M., et al. 食品廃棄物および産業廃棄物からの新たな価値 - クロバエ(Hermetia illucens)の幼虫を用いた、醸造所副産物と対になった油脂性微生物バイオマスからのオメガ3脂肪酸の生物濃縮。Waste Manag. 143, 95-104.
パブコメ要旨|全文|Google Scholar
Cook, D. M., Henriksen, E. D. C., Upchurch, R., and Doran Peterson, J. B. (2007). Tipula abdominalis (Diptera: Tipulidae)のデトリタス食幼虫から高分子分解バクテリアを分離し、後腸内細菌群集の特徴を明らかにした。Appl. Environ. Microbiol. (1)幼虫のデトリタス食性、(2)幼虫のデトリタス食性、(3)幼虫のデトリタス食性
抄録|全文|Google Scholar
Davis, N. M., Proctor, D. M., Holmes, S. P., Relman, D. A., and Callahan, B. J. (2018). マーカー遺伝子およびメタゲノミクスデータにおける汚染配列の簡単な統計的同定と除去。微生物ゲノム 6:226.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
De Smet, J., Vandeweyer, D., Van Moll, L., Lachi, D., and Van Campenhout, L. (2021). クロバエ幼虫(Hermetia illucens)の飼育中に接種されたサルモネラの動態。DOI: 10.1016/J.FOODRES.2021.110692.
パブコメ要旨|全文|Google Scholar
De Smet, J., Wynants, E., Cos, P., and Van Campenhout, L. (2018). Black soldier fly larvae (Hermetia illucens)の飼育中の微生物群集動態と利用可能性への影響。Appl. Environ. Microbiol. 84, e02722-17. doi: 10.1128/AEM.02722-17.
パブコメ抄録|全文|Google Scholar
Dillon, R. J., and Dillon, V. M. (2004). 昆虫の腸内細菌: 非病原性相互作用。Annu. Rev. Entomol. 49, 71-92. doi: 10.1146/annurev.ento.49.061802.123416.
パブコメ抄録|全文|Google Scholar
Douglas, A. E. (2015). 多生物昆虫: 常在微生物の多様性と機能。Annu. Rev. Entomol. 60, 17-34. doi: 10.1146/ANNUREV-ENTO-010814-020822
パブコメ抄録|全文|Google Scholar
Edgar, R. C. (2013). UPARSE: 微生物アンプリコンリードからの高精度OTU配列。Nat. Doi: 10.1038/nmeth.2604.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Edgar, R. C. (2016). UNOISE2: Improved error-correction for Illumina 16S and ITS amplicon sequencing. bioRxiv [Preprint] doi: 10.1101/081257.
CrossRef 全文|Google Scholar
Edgar, R. C., and Flyvbjerg, H. (2015). 次世代シーケンサーリードのエラーフィルタリング、ペアアセンブリ、エラー修正。バイオインフォマティクス 31, 3476-3482.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Eggink, K. M., Donoso, I. G., and Dalsgaard, J. (2023). 黒兵バエ(Hermetia illucens)幼虫の最適な食餌タンパク質/炭水化物比。J. Insects Food Feed 9, 789-798.
パブコメ要旨|全文|Google Scholar
Engel, P., and Moran, N. A. (2013). 昆虫の腸内細菌叢-構造と機能の多様性。FEMS Microbiol. 論文概要: 昆虫の腸内細菌叢-その構造と機能の多様性-.
昆虫の生態学的研究。
Everaert, N., Van Cruchten, S., Weström, B., Bailey, M., Van Ginneken, C., Thymann, T., et al. 腸のホメオスタシスに影響を及ぼす生物学的および食餌学的要因を含む、ブタの初期腸成熟とコロニー形成に関する総説。Anim. Feed Sci. Technol. 233, 89-103. doi: 10.1016/J.ANIFEEDSCI.2017.06.011
クロスレフフルテキスト|Google Scholar
Gloder, G., Bourne, M. E., Verreth, C., Wilberts, L., Bossaert, S., Crauwels, S., et al. による寄生が、宿主イモムシの内部マイクロバイオームを変化させるが、外部マイクロバイオームは変化させない。Anim. doi: 10.1186/S42523-021-00135-Y.
パブコメ抄録|全文|Google Scholar
Gorrens, E., De Smet, J., Vandeweyer, D., Bossaert, S., Crauwels, S., Lievens, B., et al. 連続した工業的飼育サイクルにおけるクロバエ幼虫(Hermetia illucens)の細菌群集。(2022)連続した工業的飼育サイクルにおけるクロバエ幼虫(Hermetia illucens)の細菌群集。
PubMed Abstract|RefRef Full Text|Google Scholar
Gorrens, E., Van Looveren, N., Van Moll, L., Vandeweyer, D., Lachi, D., De Smet, J., et al. クロバエ幼虫(Hermetia illucens)の基質中の黄色ブドウ球菌と飼育中のその動態。Microbiol. Spectr. 9:e0218321. doi: 10.1128/spectrum.02183-21
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Green, T. R., and Popa, R. (2012). 黒兵バエ幼虫によって処理された堆肥浸出液中のアンモニア含有量の増加。Appl. Biochem. Biotechnol. 166, 1381-1387.
パブコメ要旨|全文|Google Scholar
Guo,X.,Liu,N.,Li,X.,Ding,Y.,Shang,F.,Gao,Y.,他(2015)。Red soil harbor diverse culturable actinomycetes that are promising sources of new secondary metabolites. Appl. Environ. Microbiol. 81:3086.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Heussler, C. D., Klammsteiner, T., Stonig, K. T., Insam, H., Schlick-Steiner, B. C., and Steiner, F. M. (2022). クロソタバエ(Hermetia illucens L., Diptera: Stratiomyidae)の卵表面の微生物叢の解読と発生過程におけるその起源。
CrossRef 全文|Google Scholar
堀江義人・渡辺和男(1983).蚕(Bombyx mori)の成長、血球成分および尿酸排泄に及ぼす各種飼料タンパク質および制限アミノ酸の補給の影響。昆虫生理学 29, 187-199.
クロスレフ・フルテキスト|Google Scholar
Horwitz, W. (ed.) (2000). AOAC International の公式分析法。Revision 1, 17th Edn. Gaithersburg MD: AOAC International.
Google Scholar
IJdema, F., de Smet, J., Crauwels, S., Lievens, B., and van Campenhout, L. (2022). 16S rRNA遺伝子アンプリコンシークエンシングに基づくクロミバエ(Hermetia illucens)幼虫の微生物叢のメタ解析。FEMS Microbiol. Ecol. (株)日本農芸化学会誌, 98:fiac094.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Iram, A., Cekmecelioglu, D., and Demirci, A. (2020). DDGS の発酵原料としての可能性。Appl. Microbiol. Biotechnol. 104, 6115-6128. doi: 10.1007/S00253-020-10682-0/TABLES/4
CrossRef 全文|Google Scholar
Jeon, H., Park, S., Choi, J., Jeong, G., Lee, S.-B., Choi, Y., et al. Hermetia illucensの生ごみ減少幼生における腸内細菌群集。Curr. Microbiol. 62, 1390-1399.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Jiang, C. L., Jin, W. Z., Tao, X. H., Zhang, Q., Zhu, J., Feng, S. Y., et al. クロバエ幼虫(Hermetia illucens)は、腸内マイクロバイオームによる生ごみ生分解の代謝機能を強化する。Microb. Biotechnol. 12, 528-543.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Klammsteiner, T., Walter, A., Bogataj, T., Heussler, C. D., Stres, B., Steiner, F. M., et al. 低バイオ負荷飼料で飼育したクロソイバエ(Hermetia illucens)幼虫のコア腸内細菌叢。Front. Microbiol. 11:993. doi: 10.3389/FMICB.2020.00993
パブコメ要旨|全文|Google Scholar
Klammsteiner, T., Walter, A., Bogataj, T., Heussler, C. D., Stres, B., Steiner, F. M., et al. ブラックソルジャーフライ(Hermetia illucens)幼虫の発育と腸内マイクロバイオーム機能に及ぼす加工食品(缶詰および油廃棄物)の影響。Front. Microbiol. 12:619112.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kozich, J. J., Westcott, S. L., Baxter, N. T., Highlander, S. K., and Schloss, P. D. (2013). MiSeq Illuminaシーケンスプラットフォームにおけるアンプリコン配列データ解析のためのデュアルインデックスシーケンス戦略とキュレーションパイプラインの開発。Appl. Environ. Microbiol. 79, 5112-5120.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kwong, W. K., and Moran, N. A. (2013). ミツバチとマルハナバチの腸内共生細菌の培養と特性評価: ミツバチとマルハナバチの腸内共生細菌の培養と特性解析:βプロテオバクテリア科ナイセリア属のSnodgrassella alvi gen. Int. J. Syst. Evol. Microbiol. 63, 2008-2018. doi: 10.1099/IJS.0.044875-0
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Laganaro, M., Bahrndorff, S., and Eriksen, N. T. (2021). 低品質基質および高品質基質で生育したクロソイフライ幼虫の成長と代謝性能。Waste Manag. 121, 198-205. doi: 10.1016/J.WASMAN.2020.12.009.
PubMed Abstract|RefRef Full Text|Google Scholar
Latimer, G. W. (ed.) (2016). AOAC internationalの公式分析法、第20版。Rockville, MD: AOAC International.
Google Scholar
Lievens, S., Poma, G., Frooninckx, L., Van der Donck, T., Seo, J. W., De Smet, J., et al. Polyvinyl Chloride (Micro)Plastics and Black soldier fly larvae (Hermetia illucens L.) Mutual Influence between Polyvinyl Chloride (Micro)Plastics and Black soldier fly larvae (Hermetia illucens L.). Sustainability 14:12109. doi: 10.3390/SU141912109/S1
パブコメ要旨|全文|Google Scholar
Martinson, V. G., Carpinteyro-Ponce, J., Moran, N. A., and Markow, T. A. (2017). Cactophilic Drosophila種の個体群における特徴的で宿主に制限された腸内細菌叢。Appl. Environ. Microbiol. 83, e01551-17. doi: 10.1128/AEM.01551-17.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
微生物学的研究(微生物学、微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学、環境微生物学)。PLoS One 8:e61217. doi: 10.1371/JOURNAL.PONE.0061217.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Menconi, A., Kallapura, G., Latorre, J. D., Morgan, M. J., Pumford, N. R., Hargis, B. M., et al. 市販のプロバイオティクス培養物における乳酸菌の同定と特徴づけ。Biosci. Microb. doi: 10.12938/BMFH.33.25.
パブコメ抄録|全文|Google Scholar
Meneguz, M., Gasco, L., and Tomberlin, J. K. (2018). クロ兵バエ(Hermetia illucens, L; Diptera: Stratiomyidae)の幼虫発生におけるpHと摂食システムの影響。PLoS One 13:e0202591.
パブコメ抄録|全文|Google Scholar
Mubarak, Z., and Soraya, C. (2018). The acid tolerance response and pH adaptation of Enterococcus faecalis in extract of lime Citrus aurantiifolia from Aceh Indonesia. doi: 10.12688/F1000RESEARCH.13990.2.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Nguyen, T. T. X., Tomberlin, J. K., and Vanlaerhoven, S. (2013). Hermetia illucens (Diptera: Stratiomyidae) の幼虫発生に及ぼす資源の影響。J. Med. J. Med. Entomol. 50, 898-906.
抄録|全文|Google Scholar
Oksanen, J., Blanchet, F. G., Friendly, M., Kindt, R., Legendre, P., McGlinn, D., et al: コミュニティ生態学パッケージ。R package version 2.5-7. オンラインで入手可能:https://www.researchgate.net/publication/346579465_vegan_community_ecology_package_version_25-7_November_2020
Google Scholar
Padmanabha, M., Kobelski, A., Hempel, A. J., and Streif, S. (2020). Hermetia illucens幼生の包括的な動的成長発達モデル。PLoS One 15:e0239084.
パブコメ抄録|クロスリファレンス全文|Google Scholar
R Development Core Team (2013). R: A language and environment for statistical computing. ウィーン: R Foundation for Statistical Computing.
Google Scholar
Ren, X., Cao, S., Akami, M., Mansour, A., Yang, Y., Jiang, N., et al. 腸内共生細菌はテッポウムシBactrocera dorsalisの窒素リサイクルに関与する。BMC Biol.20:201.
抄録|全文|Google Scholar
Scala, A., Cammack, J. A., Salvia, R., Scieuzo, C., Franco, A., Bufo, S. A., et al. Hermetia illucens (L.) (Diptera: Stratiomyidae) larvae produced at an industrial scale. (1)哺乳類を対象とした哺乳動物実験。
パブコメ要旨|全文|Google Scholar
(2008)。新規フィターゼ遺伝子appA. イネ科コイ腸から分離されたButtiauxella sp.GC21由来の新規フィターゼ遺伝子appA。水産養殖 275, 70-75.
CrossRef 全文|Google Scholar
Shumo, M., Khamis, F. M., Ombura, F. L., Tanga, C. M., Fiaboe, K. K. M., Subramanian, S., et al. ケニアにおける2つの都市有機廃棄物の流れで飼育された黒兵バエ幼虫(Hermetia illucens)の腸内細菌種の分子学的調査。Front. Microbiol. 12:687103.
この論文で述べられているように、ケニアでは都市廃液を利用した有機性汚泥の生産が盛んである。
(2021)。16S rRNA遺伝子コピー数の正常性。16S rRNA遺伝子のコピー数を正規化しても、メタ分類学的調査においてより信頼性の高い結論は得られない。Microb. Ecol. 81, 535-539. doi: 10.1007/S00248-020-01586-7
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tegtmeier,D.、Hurka,S.、Klüber,P.、Brinkrolf,K.、Heise,P.、Vilcinskas,A. (2021a). 工業的に養殖されているクロソイの幼虫の潜在的飼料としての綿実プレスケーキは、彼らの細菌および真菌腸内細菌叢の適応を誘発する。Front. Microbiol. 12:634503.
PubMedアブストラクト|クロスリファレンス|Google Scholar
Tegtmeier, D., Hurka, S., Mihajlovic, S., Bodenschatz, M., Schlimbach, S., and Vilcinskas, A. (2021b). ブラックソルジャーフライ腸内細菌叢の培養非依存的・培養依存的特性解析により、産業応用の可能性を秘めた培養可能な細菌が多数存在することが明らかになった。微生物学9:1642.
パブコメ抄録|全文|Google Scholar
Tettamanti, G., Van Campenhout, L., and Casartelli, M. (2022). ブラックソルジャーフライの消化器系に関する知識の飢餓的必要性。J. Insects Food Feed 8, 217-222.
パブコメ抄録|全文|Google Scholar
Tinker, K. A., and Ottesen, E. A. (2016). アメリカゴキブリ(Periplaneta americana)のコア腸内細菌叢は安定しており、食餌シフトに強い。Appl. Environ. Microbiol. 82, 6603-6610.
パブコメ抄録|全文|Google Scholar
Tomberlin, J. K., and van Huis, A. (2020). 害虫から飼料としての昆虫産業の「王冠の宝石」まで: An historical perspective. J. Insects Food Feed 6, 1-4. doi: 10.3920/JIFF2020.0003.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Vandeweyer, D., De Smet, J., Van Looveren, N., and Van Campenhout, L. (2021). 食品および飼料としての昆虫に含まれる生物学的汚染物質。J. Insects Food Feed 7, 807-822.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Varelas, V. (2019). 食品および飼料用の食用昆虫大量生産のための潜在的な新しい供給源としての食品廃棄物: A review. doi: 10.3390/FERMENTATION5030081.
CrossRef 全文|Google Scholar
Warnes, M. G. R., Bolker, B., Bonebakker, L., Gentleman, R., and Huber, W. (2016). パッケージ 'gplots'. データをプロットするための様々なRプログラミングツール。
Google Scholar
Woods, M. J., Hoffman, L. C., and Pieterse, E. (2019). ブラックソルジャーフライ(Hermetia illucens)新生幼虫用の人工飼料。J. Insects Food Feed 5, 99-105. doi: 10.3920/JIFF2018.0028.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wynants, E., Frooninckx, L., Crauwels, S., Verreth, C., De Smet, J., Sandrock, C., et al. 実験室および大規模な4つの異なる場所で有機廃棄物の流れで飼育された黒兵児蝿の幼虫(Hermetia illucens)の微生物相を評価する。Microb. Ecol. 77, 913-930.
パブコメ要旨|全文|Google Scholar
Yakti, W., Müller, M., Klost, M., Mewis, I., Dannehl, D., and Ulrichs, C. (2023). Hermetia illucens (L.) (Diptera: Stratiomyidae) larvae growth as a driver of substrates. 昆虫14:266. doi: 10.3390/INSECTS14030266.
パブコメ要旨|全文|Google Scholar
Yu,Y.,Zhang,J.,Zhu,F.,Fan,M.,Zheng,J.,Cai,M.,他(2023)。クロバエ幼虫(Hermetia illucens L.)とその腸内微生物によるタンパク質分解の促進。Front. Microbiol. 13:1095025.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
(2021年). 黒兵児蝿(Hermetia Hermetia)。黒兵児蝿(Hermetia illucens)の幼虫は鶏糞中の微生物群集を著しく変化させる。Curr. Microbiol. 78, 303-315. doi: 10.1007/S00284-020-02276-W
パブコメ抄録|クロスリファレンス全文|Google Scholar
Zheng, H., Perreau, J., Elijah Powell, J., Han, B., Zhang, Z., Kwong, W. K., et al. 植物多糖類消化のためのミツバチ腸内細菌叢の分業。Proc. Natl. Acad. Sci. U.S.A. 116, 25909-25916. doi: 10.1073/PNAS.1916224116/-/DCSUPPLEMENTAL
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Zheng, L., Crippen, T. L., Singh, B., Tarone, A. M., Dowd, S., Yu, Z., et al. 16S rDNAパイロシークエンシングによるクロバエ(Diptera: Stratiomyidae)の連続したライフステージからの細菌多様性の調査。J. Med. J. Med. Entomol. 50, 647-658.
抄録|全文|Google Scholar
鄭、L., Hou, Y., Li, W., Yang, S., Li, Q., and Yu, Z. (2012). を用いた稲わらとレストラン廃棄物からのバイオディーゼル生産。doi: 10.1016/J.ENERGY.2012.09.006.
CrossRef 全文|Google Scholar
Zhineng, Y., Ying, M., Bingjie, T., Rouxian, Z., and Qiang, Z. (2021). クロバエ幼虫(Hermetia illucens)の腸内細菌叢と機能的特徴。Ann. Microbiol. 71:13. doi: 10.1186/S13213-021-01626-8
クロスリファレンス全文|Google Scholar
キーワード Hermetia illucens、腸領域、後腸、細菌群集、微生物叢、Illumina MiSeq
引用 Vandeweyer D, Bruno D, Bonelli M, IJdema F, Lievens B, Crauwels S, Casartelli M, Tettamanti G and De Smet J (2023) 産業残留河川で飼育されたクロバエ幼虫の腸管領域における細菌相組成:腸管に沿った群集動態を明らかにする。Front. Microbiol. doi: 10.3389/fmicb.2023.1276187.
受理された: 受理:2023年8月11日: 2023年10月30日;
発行:2023年12月01日
編集者
カシフ・ウル・レーマン、イスラミア・バハワルプール大学、パキスタン
査読者
ヘザー・ローズ・ジョーダン(ミシシッピ州立大学、米国
Henry Joseph Oduor Ogola(ジャラモギ・オギンガ・オディンガ科学技術大学、ケニア
Copyright © 2023 Vandeweyer, Bruno, Bonelli, IJdema, Lievens, Crauwels, Casartelli, Tettamanti and De Smet. これは、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文である。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Jeroen De Smet, jeroen.desmet@kuleuven.be
これらの著者は、本研究に等しく貢献し、筆頭著者である。
免責事項:本論文で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではありません。
こんな人たちも見ています
宿主系統と食性が竹食性昆虫の腸内細菌群集を形成する
クアンガン・ファン、ジー・ワン、ジュンハオ・ホァン、シュウク・チャン、アルフリード・P・フォーグラー、クァンカン・リュウ、ヨンチュン・リ、マオウェイ・ヤン、ユー・リー、シュグオ・チュウ
家畜に寄生するハードマダニにおけるBorrelia theileriおよび近縁種Borrelia属の分子学的証拠
メラン・カーン,マシャール・M・アルムタイリ,アブドゥルアジズ・アロウフィ,田中哲也,張俊中,陳倩珍,アビド・アリ
臨床関連病原体に対する抗クオラムセンシング剤の発見に関する計量書誌学的分析:現状、開発、および将来の方向性
Bo Peng、Yanqun Li、Jiajia Yin、Wenping Ding、Wang Fazuo、Zhihui Xiao、Hao Yin
症例報告: 常染色体劣性遺伝性Leber遺伝性視神経症を引き起こすDNAJC30の変異は東欧人に多い
Toby Charles Major、Eszter Sara Arany、Katherine Schon、Magdolna Simo、Veronika Karcagi、Jelle van den Ameele、Patrick Yu Wai Man、Patrick F. Chinnery、Catarina Olimpio、Rita Horvath
一過性脳虚血発作は脈絡叢血液CSFバリアの持続的損傷を引き起こす
ヤン・チェン、リン・リン、モハマド・イクバル・H・ブイヤン、カイ・ヘ、ロシャニ・ジャ、シャンシャン・ソン、ビクトリア・M・フィースラー、グルナズ・ベガム、ヤン・イン、ダンダン・スン
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
クッキーの使用について当社ウェブサイトでは、運営に必要なクッキーを使用するほか、パフォーマンスの追跡やサービスの改善、パーソナライズ化のためにクッキーを使用しています。必要でないクッキーを管理または拒否するには、「クッキーの設定」をクリックしてください。クッキーの使用方法の詳細については、当社のクッキーポリシーをご覧ください。
クッキーの設定
クッキーを受け入れる
この記事が気に入ったらサポートをしてみませんか?
