ベルベリンは腸内細菌叢を介したリゾホスファチジルコリンの調節を介して高脂肪食関連大腸がんを抑制する
Int J Biol Sci 2023; 19(7):2097-2113. doi:10.7150/ijbs.81824 This issue Cite
研究論文
ベルベリンは腸内細菌叢を介したリゾホスファチジルコリンの調節を介して高脂肪食関連大腸がんを抑制する
https://www.ijbs.com/v19p2097.htm

Haitao Chen1,2#、Chenxiao Ye3#、Changhong Wu3#、Jiali Zhang3、Lu Xu4、Xuanying Wang4、Chao Xu1,2、Jin Zhang5、Yong Guo6 、Qinghua Yao1,2,7
中国科学院大学癌病院(浙江癌病院)中西医学統合科、中国科学院基礎医学・癌研究所(IBMC)、杭州、浙江省310022、中国。
中西医統合腫瘍研究所、浙江省中医薬重点実験室、杭州市、浙江省、310022、中国。
浙江中医薬大学、杭州、浙江省、310053、China.
Dr. Neher's Biophysics Laboratory for Innovative Drug Discovery, State Key Laboratory of Quality Research in Chinese Medicine, Macau, 999078, China.
空軍医科大学附属第二病院中医学部、西安710038、中国。
浙江中医薬大学第一附属病院腫瘍科、杭州、浙江省、310003、中国。
浙江省頭頸部がんトランスレーショナルリサーチ重点実験室、杭州、浙江省、310022、China.
これらの著者は、本研究に等しく貢献した。
✉ 対応する著者: Qinghua Yao, yaoqh@zjcc.org.cn; Yong Guo, guoyong1047@zcmu.edu.cn
引用します:
Chen H, Ye C, Wu C, Zhang J, Xu L, Wang X, Xu C, Zhang J, Guo Y, Yao Q. Berberine inhibits high fat diet-associated colorectal cancer through modulation of the gut microbiota-mediated lysophosphatidylcholine. Int J Biol Sci 2023; 19(7):2097-2113. doi:10.7150/ijbs.81824. https://www.ijbs.com/v19p2097.htm
コピー 他のスタイル
EndNote MEDLINE BibTex ReferenceManager RIS Download File インポートインストラクション
要旨
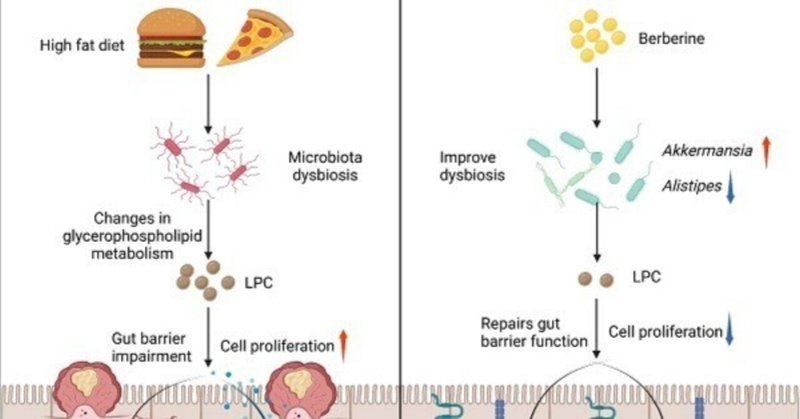
食事性脂肪の摂取は、大腸がん(CRC)のリスク上昇と正の相関がある。現在、高脂肪食(HFD)によって引き起こされるCRCの複雑な病態のため、臨床治療は不十分なままである。腸内細菌叢のアンバランスは、高脂肪食に伴う大腸腫瘍の発生と関連していると考えられています。そこで、我々は、ベルベリン(BBR)の抗腫瘍活性について、16S rDNA配列決定および液体クロマトグラフィー/質量分析を事前に実施することにより、調節不全の腸内細菌叢および関連代謝物の調節を検討した。予想通り、BBR投与は、HFDを与えたAOM/DSS誘発CRCモデルマウスにおいて、大腸ポリープの数を有意に減少させ、腸バリア障害を改善し、大腸炎症および関連するがん化経路を阻害した。さらに、BBRは、HFDを摂取したCRCモデルマウスにおいて、腸内細菌叢の異常を緩和し、アッケマンシアやパラバクテロイデスなどの有益な腸内細菌の存在量を増加させた。さらに、メタボローム解析により、HFDに関連したCRCの進行中にグリセロリン脂質代謝が著しく変化することが示されたが、BBR投与により、グリセロリン脂質代謝物、特にCRC細胞の増殖を促進し細胞接合障害を改善することが確認されたリゾホスファチジルコリン(LPC)のこれらの変化が元に戻った。注目すべきは、BBRは腸内細菌叢が枯渇したHFD飼育CRCモデルマウスに対して明確な抗腫瘍効果を示さなかったが、BBR処理した腸内細菌叢を腸内細菌叢枯渇CRCマウスに移植すると、BBRの大腸腫瘍形成およびLPC量に対する抑制作用が再現された。本研究により、BBRは腸内細菌が制御するLPCレベルの調節を通じて、直接的にHFD関連CRCを抑制することが示され、それによって、西洋食関連CRCの臨床的予防および治療のための有望な微生物相調節治療戦略が提供される。
キーワード Berberine、欧米型食生活、大腸がん、マイクロバイオーム、グリセロリン脂質代謝、Wntパスウェイ
はじめに
大腸がん(CRC)は、一般的な消化器がんとして、悪性腫瘍の中でも比較的高い罹患率と死亡率を持ち、人間の健康を著しく危険にさらす[1]. 食事は、CRCの発生と発症を制御する上で、よく知られた重要な役割を担っています[2, 3]。臨床試験では、高脂肪食(HFD)摂取とCRCリスクとの間に有意な正の相関があることが示されており[4, 5]、HFDが腸内細菌叢と脂質代謝を調節することで大腸腫瘍の発生を促進することが研究で確認されています[6]。ライフスタイルや社会経済的地位の向上に伴い、食事性脂肪の過剰摂取は一般的な食事パターンとなっている。したがって、HFDに関連する大腸腫瘍の発生を予防および治療するために、詳細な研究が必要である。
ベルベリン(BBR)は、Coptis coptidisから抽出された天然のイソキノリンアルカロイドであり、中国では感染性腸疾患の臨床治療に広く使用されている[7]。近年、いくつかの研究により、BBRが微生物叢の構造を調節することで、2型糖尿病、黄砂誘発性大腸炎、関節リウマチなどの症状を緩和することが示されています[8-10]。また、BBRは、HFD誘発肥満マウスにおける脂質代謝障害を調節することが実証されている[11]。我々の以前の研究では、BBRは、チャウ食を与えたAOM/DSS誘発CRCマウスにおいて、腸内細菌叢を調節することにより炎症反応を抑制することが示された[12]。さらに、Wangらは、BBRがHFDで飼育したApc min/+マウスのCRCの発症を緩和し、HFDによって引き起こされる腸内細菌叢の摂理を改善することを報告している[13]。しかし、HFDに関連した大腸腫瘍の発生に対するBBRの効果は十分に研究されておらず、腸内細菌叢とその代謝物がBBRの潜在的な効果を変化させるかどうかはほとんど不明なままである。
ここで、我々は、BBRが腸内細菌叢および関連代謝物の調節を通じて、HFD関連大腸がんを直接阻害するという仮説を立てた。この仮説を検証するために、AOM/DSS処理したBalb/cマウスを用いて、HFD関連大腸腫瘍発生に対するBBRの抑制効果を確認しました。また、16S rRNA配列決定および液体クロマトグラフィー/質量分析(LC-MS)を行い、HFD投与CRCモデルマウスの腸内細菌叢および代謝物に対するBBRの調節効果を明らかにした。続いて、試験管内で大腸がん細胞の増殖を制御するBBRの効果を明らかにしました。さらに、HFDに関連する大腸腫瘍の発生に対するBBR治療における腸内細菌叢の重要な役割を検証するために、腸内細菌叢枯渇モデルマウスおよび糞便微生物叢移植(FMT)実験を実施しました。
材料と方法
従来のAOM/DSS誘発CRCマウスモデル
8週齢の雄BALB/cマウスを、Shanghai B&K Co. (Ltd.(中国、上海)から購入した。すべてのマウスは、浙江中医薬大学の実験動物センターで、制御された環境(20±2℃、湿度50±5%、12時間の明暗サイクルで、普通食(ND)またはHFD)で飼育された。7日間食事に適応させた後、マウスをND群、HFD群、HFD+BBR群の3群(1群10匹)にランダムに分けた。すべてのマウスにAOM(10mg/kg、Sigma-Aldrich、米国)を1回腹腔内注射し、その後、DSS(2%、MP Bio、米国)を飲料水に7日間、通常の飲料水に14日間投与するサイクルを3回繰り返した。一方、HFD+BBR群マウスには、BBR(100mg/kg、Shanghai Yuanye Bio-Technology Co.Ltd.、中国)を1日1回、10週間経口摂取させた。ND群およびHFD群マウスには、飲料水をガベージした(図1A)。
BBRのHFD関連大腸腫瘍発生抑制に関与する腸内細菌叢を決定する。雄のBALB/cマウスを7日間HFDに適応させ、その後ランダムに3つのグループ(1グループ10匹)に分けた: HFD群、HFD+抗生物質(HFD+ABX)群、HFD+ABX+BBR群である。すべてのマウスに、これまでの方法に従ってAOMとDSSを投与した。HFD+ABX群およびHFD+ABX+BBR群のマウスには、既報の通り、実験前2週間、実験期間中は2週間おきに、腸内細菌叢を枯渇させる抗生物質カクテル(0.2 g/L アンピシリン、ネオマイシンおよびメトロニダゾール、ならびに 0.1 g/L バンコマイシン)入り飲水を与えた[6]。HFD+ABX+BBR群マウスにBBR(100mg/kg)を1日1回経口投与し、10週間投与した。HFD群およびHFD+ABX群のマウスは、飲料水をガベージした(図8A)。
糞便微生物叢移植(FMT)実験
HFD関連大腸腫瘍発生幇助効果に対するBBR制御腸内細菌叢の直接的な寄与を決定するために、FMT前に8週齢の雄BALB/cマウスを2週間連続で抗生物質カクテルで処理し、次にNDを与えた2群(1群8匹)に分け、HFD飼育AOM/DSSモデルマウスまたはHFD+BBR飼育AOM/DSSモデルマウスからの糞便試料でガバメントをした。簡単に言うと、200mgの便サンプルを1mLのPBSでホモジナイズした。その後、レシピエントマウスに0.2mLの懸濁液を週2回、胃内ガベージで投与した。すべてのマウスは、大腸新生物を誘発するためにAOMおよびDSSも受けた。マウスは18週目に犠牲となった(図8A)。
ウェスタンブロット分析
ウェスタンブロット分析は、以前に記載されたように実施した[14]。簡単に言えば、結腸または細胞タンパク質をSDS-PAGEに供し、PVDF膜に転写し、異なる一次抗体で同時検出するためにスライスした。β-アクチン(1:1000、カタログ番号66009-1-Ig、Proteintech、米国)、オクルディン(1:1000、カタログ番号ab216327、Abcam、英国)、ZO-1(1:1000、カタログ番号ab216880、Abcam、英国)、PCNA(1:500、カタログ番号AF0239、Affinity、米国)、IL-1β(1:1000、カタログ番号12242S、CST、米国)、IL-6(1:1000、カタログ番号. DF6087、Affinity Biosciences、中国)、stat-3(1:1000、カタログ番号12640S、CST、米国)、p-stat-3(S727)(1:1000、カタログ番号 ET1607-39、Huabio、中国)、非ホスポ(活性)βカテニン(1:1000、カタログ番号8814S、CST、米国)およびTNF-α(1:1000、カタログ番号41504、シグナルウェイ抗菌、米国)。一次抗体と4℃で一晩インキュベートした後、シグナルを検出し、タンパク質バンド強度をImage Labのデンシトメトリーで解析し、別途ImageJソフトウェアで定量化した。
酵素結合免疫吸着法(ELISA)分析
血清または腸管組織中のIL-1β、IL-6、TNF-αおよびIFN-γを含むサイトカイン、ならびに糞便中のLPCは、FANKEL(中国、上海)提供のELISAキットにより、製造者の説明書に従って測定した。
ヘマトキシリン・エオシン(HE)染色
大腸のパラフィン包埋標本を4μmの切片に切断した。脱脂後、切片をヘマトキシリン・エオジンで3~5分間染色し、PANNORAMIC (3DHISTECH, Hungary) と CaseViewer2.4 (3DHISTECH, Hungary) で写真撮影・解析を行った。既報[14]の通り、組織学的スコアは、炎症と異形成の全体的な程度を示す複合スケールで構成されていた。
免疫組織化学染色
免疫組織化学は、既報の通り実施した[14]。使用した抗体は以下の通りである: PCNA抗体(カタログ番号GB11010-1、Wuhan Servicebio Technology、中国)、β-カテニン(abcam番号ab32572、Wuhan Servicebio Technology、中国)。その後、パラフィン切片をデジタルスキャンし、PANNORAMIC (3DHISTECH, Hungary) および Halo (Indica labs, USA) で解析した。
免疫蛍光法(Immunofluorescence
免疫蛍光のために、細胞を4%パラホルムアルデヒド(Biosharp、中国)中で20分間、室温で固定した。さらにPBSで2回洗浄した後、ブロッキング液(Dawenbio, China)で1時間室温でブロッキングした。試料を一次抗体(Occludin (1:200), ZO-1 (1:200) and E-cadherin (1:200, catalog no. ab40772, Abcam, USA))と4℃で一晩インキュベートし、その後二次抗体(1:200、カタログ番号 ab150077, Abcam, USA)と室温で1時間培養した。核は1μg/mLのDAPI(Solarbio, China)で染色した。サンプルは共焦点レーザー走査型顕微鏡(Leica TCS SP8)でスキャンした。細胞サンプルからの5つのランダムフィールドを、さらなる分析のために収集した。
腸内細菌叢の解析
E.Z.N.A.®Stool DNA Kit (Omega, USA)を用いて、メーカーの説明書に従って、糞便サンプルから細菌ゲノムDNAを抽出した。続いて、16S rDNA遺伝子の解析を既述のように行った[14]。簡単に説明すると、16S rRNAのV3 - V4領域を、それぞれフォワードプライマー341 (5'-CCTACGGNGGCWGCAG-3') とリバースプライマー805R (5'-GACTACHVGGTATCTAATCC-3') でPCRにより増幅した。PCR増幅後、Agencourt AMPure XP purification kit (Beckman Coulter Inc., Brea, CA, USA) で精製し、Qubit (Invitrogen, USA) 装置で定量を行った。その後、アンプリコンをAgilent 2100 Bioanalyzer(Agilent、米国)およびIllumina sequencing(Kapa Biosciences、Woburn、MA、米国)で検証し、最終結果をNovaSeq PE250プラットフォームでさらに分析した。
ハイスループットトランスクリプトームシーケンス(RNA-Seq)検出
HFD飼育マウスおよびHFD+BBR処理マウスの大腸粘膜の全RNAを、配列決定および解析のためにLC-Bio Technology(中国、杭州)に送付した。簡単に説明すると、RNAは、製造者の手順に従ってTrizol試薬(Invitrogen、米国)を用いて抽出された。単離したRNAをDNaseで精製した後、バイオアナライザー2010とRNA 1000 Nano LabChip Kit (Agilent, USA)を用いて収集したRNAの品質と純度を確認した。その後、RNA-Seqサンプル調製キット(Illumina, San Diego, USA)のプロトコルに従い、切断したRNAをcDNAに逆転写し、paired terminal sequencingをillumina Nova seq6000(LC Sciences, USA)で、前述のように実施した[14]。
メタボロームプロファイリング
メタボローム解析のために腸管組織サンプルを採取した。120μLの予冷した50%メタノールで代謝物を抽出し、1分間ボルテックス混合した後、室温で10分間インキュベートした。4,000gで20分間遠心分離した後、上清を新しい96ウェルプレートに移した。サンプルは、LC-MS分析前に-80℃で保存した。まず、すべてのクロマトグラフィー分離は、超高性能液体クロマトグラフィー(UPLC)システム(SCIEX、英国)を用いて行われました。逆相分離には、ACQUITY UPLC T3カラム(100 mm * 2.1 mm, 1.8 µm, Waters, UK)を使用しました。カラムから溶出した代謝物の検出には、高分解能のTripleTOF 5600plusタンデム質量分析計(SCIEX、UK)を使用しました。Q-TOFは、ポジティブイオンモードとネガティブイオンモードの両方で動作しました。LC-MSの生データファイルはmzXML形式に変換され、Rソフトウェアに実装されたXCMS、CAMERA、およびmetaXツールボックスで処理されました。
細胞培養
リゾホスファチジルコリン(LPC)は、Avanti Polar Lipids(Merch, Darmastadt, Germany)より購入した。正常腸管上皮細胞株IEC-6細胞およびCRC細胞株(HCT-116、HCT-8およびSW480細胞)を24ウェルプレートに20,000細胞/ウェルで播いた。細胞を24時間血清飢餓状態にし、0.1%脂肪酸を含まないウシ血清アルブミンまたはLPC(10μmol/Lおよび20μmol/L)を添加したRPMI1640培地で最大3日間培養した。細胞計数のために、細胞をトリプシン処理し、実験終了時に細胞数を記録した。細胞は70%エタノールで一晩固定し、ヨウ化プロピジウムで染色し、フローサイトメトリーで分析した。ウェスタンブロッティング解析のために、12ウェルプレートの1ウェルあたり50,000個の細胞を播種し、指示通りに処理した。最後に、ウェスタンブロッティング解析のために、細胞を洗浄し、掻き取り、回収した。
RAW 264.7マウスマクロファージは、中国科学院細胞銀行から入手し、10%(v/v)熱不活性化FBSを含むダルベッコ変法イーグル培地(DMEM)中、5%CO2/95%空気下で37℃にて培養した。LPCを添加(10μmol/Lおよび20μmol/L)または無添加で24ウェルプレートの1ウェルあたり合計5×105個の細胞を播種し、最大3日間培養した。その後、細胞を回収し、ウェスタンブロッティング解析を行った。
細胞共培養系を確立するために、トランスウェルチャンバー(0.4μm、6.5mm)を使用しました。下部チャンバーにはHCT-116、HCT-8またはSW480細胞を入れ、上部チャンバーにはRAW 264.7マウスマクロファージを懸濁した。5%CO2、37℃のインキュベーターで3日間培養した後、下部チャンバーの細胞を回収し、免疫蛍光を行った。
統計解析
SPSS 23.0 ソフトウェア(IBM, Chicago, IL, USA)を使用してデータを解析し、さらなる解析の前にデータの正規性と分散の均質性をテストした。一般に、2つ以上のグループの比較には、分散分析(ANOVA)を使用した。2群間の差は、t-test分析で行った。データが歪んでいたり、分散が均一でない場合は、ノンパラメトリック検定を使用して、グループ間の有意差を分析した。2群間のカテゴリー変数の比較は、カイ二乗検定またはフィッシャーエクステクトを用いて行った。グラフ作成は、GraphPad Prism 8.0 software (La Jolla, CA, USA)で行った。すべてのデータは、平均値±SDで示した。P値が0.05未満は、統計的に有意であるとみなした。
結果
BBRは、マウスにおけるHFD関連大腸腫瘍の発生を阻害する。
HFD関連大腸腫瘍発生に対するBBRの効果を調べるために、AOM/DSS処理Balb/cマウスにHFDを与え、BBRを投与する場合としない場合を検討した(図1A)。生存率は、HFDのみを投与された対照マウスよりも、BBR投与されたHFD投与マウスで有意に高かった(p < 0.05、図1B)。BBRを投与したHFD飼育マウスでは、BBRを投与しないマウスよりも結腸長が長く(p<0.05)、結腸直腸腫瘍数が少なかった(p<0.001)(図1C〜E)。顕微鏡による組織学的検査に基づき、HFDを与えたマウスの組織学的スコアは、NDまたはHFD+BBRを与えたマウスよりも有意に高かった(いずれもp<0.01、図1F)。HFDを摂取したマウスの大腸上皮細胞の増殖は、NDを摂取したマウス(p<0.01)およびHFD+BBRを摂取したマウス(p<0.001)よりも大きく、増殖細胞のマーカーである増殖細胞核抗原(PCNA)の組織化学的スコアが著しく高かったことから明らかである(図1G)。
BBRは、HFDを与えたAOM/DSS処置マウスにおいて、炎症性サイトカインを抑制し、腸のバリア機能を修復する。
炎症反応に対するBBRの効果を調べるために、血清および大腸の炎症性サイトカインレベルを測定した。血清中のインターロイキン-6(IL-6)のレベルは、HFDを与えたマウスがNDを与えたマウスよりも顕著に高かった(p < 0.001)。しかし、血清IL-1β(p<0.01)、IL-6(p<0.05)およびINF-γ(p<0.01)濃度は、HFD飼育マウスにおけるBBR処理後に有意に減少した(図2A)。さらに、大腸組織におけるIL-1β、IL-6、および腫瘍壊死因子-α(TNF-α)は、ND飼育マウスよりもHFD飼育マウスでより上昇し(すべてp<0.05)、BBRは、ウェスタンブロッティングによると、HFD飼育マウスの大腸IL-6およびTNF-αの発現を明らかに抑制した(すべてp<0.05,図2B)。これまでの研究で、IL-6/STAT3シグナル経路の活性化が大腸炎および大腸炎関連癌の発症に関与していることが報告されている[15, 16]。そこで、大腸上皮におけるSTAT3およびphospho-STAT3(p-STAT3)の発現を検討した。HFD飼育マウスではND飼育マウスと比較して明らかなp-STAT3の上昇が観察され、BBRは大腸組織におけるp-STAT3の発現を効果的に抑制した(p < 0.01、図2C)。
さらに、HFDは腸のバリア機能を損なうことが研究で示されている[6, 17]。BBRがAOM/DSS処置マウスのHFDによって誘導された腸バリア機能障害を修復する可能性があるかどうかを確認するために、BBR処置の有無にかかわらず、HFD飼育マウスの結腸タイトジャンクションタンパク質の発現を観察した。大腸組織におけるZonula occludens-1 (ZO-1) (p < 0.001) およびOccludin (p < 0.01) のレベルは、ND飼育マウスよりもHFD飼育マウスで著しく低かった(図2)。HFD飼育マウスのBBR処理後、ウェスタンブロッティングに基づき、ZO-1(p<0.05)およびオクルディン(p<0.001)の発現が顕著に増加した(図2D)。これらの結果は、BBRがIL-6/p-STAT3シグナル経路などの炎症経路を抑制することで腸のバリア機能を修復し、それによってHFDに関連する大腸腫瘍の発生を抑制する可能性を示した。
図1
BBRは、マウスのHFD関連大腸腫瘍発生を抑制する。(A) HFDを摂取させたAOM/DSSマウスを用いたBBR実験のデザイン。(B)3群の生存率。(C) 犠牲時の大腸の代表的な画像。(D)結腸の長さ。(E)結腸ポリープの数。 F)腸管切片のHE染色と組織学的スコア:バー=50μm、(10μm×5)。(G)大腸切片の免疫組織化学(IHC)染色、PCNAの発現を示す:bar=50μm、(10μm×5)。(*p < 0.05, **p < 0.001, ***p < 0.001).
(新しいウィンドウで表示)
BBRはAOM/DSS処理マウスのHFDによって誘発される腸内細菌叢の異常増殖を制御する
BBRによるHFD関連CRC発症抑制における腸内細菌叢の変化の潜在的役割を探るため、ND飼育、HFD飼育、HFD+BBR飼育のAOM/DSS処理マウスの糞便サンプルについて16S rRNA配列決定を実施しました。PCA分析(β多様性)により、3群間で腸内細菌叢のクラスタリングに有意差があることが示された(p = 0.001、図3A)。HFD飼育マウスでは、ND飼育マウスよりも低い細菌リッチネス(p<0.001)および細菌多様性(p<0.05)が観察された(図3B)。興味深いことに、BBR処理は、HFDを与えたAOM/DSSマウスにおいて、細菌の豊富さ(p<0.05)および多様性(p<0.001)をさらに著しく減少させた(図3B)。具体的には、HFDを与えたマウスにおいて、BBR処理後に門脈レベルのVerrucomicrobiaの存在量が明らかに濃縮された(図3C)。総カバレッジが85%(ND飼育マウスとHFD飼育マウスの間)または93%(HFD飼育マウスとHFD+BBR飼育マウスの間)を超える上位30属の存在量は、ヒートマップで可視化した(図3D)。Escherichia-ShigellaおよびClostridium_sensu_stricto_1を含む潜在的な病原性細菌属の存在量が有意に濃縮され、Prevotellaceae_UCG-001およびLachnospiraceae_NK4A136_groupなどの有益細菌の存在は、HFD餌のマウスがND餌マウスより低い(両方p < 0. 興味深いことに、保護細菌属であるAkkermansia(p < 0.01)およびParabacteroidesが濃縮され、AlistipesおよびClostridium_sensu_stricto_1を含む潜在的病原細菌は、HFDで飼育したマウスのBBR投与後に著しく減少した(その他p < 0.05, Figure 3F, Table S1)。これらの結果から、腸内細菌叢は、HFDに関連するCRCの発生に対するBBRの効果を媒介する上で重要な役割を果たす可能性があることが示唆された。
図2
BBRは、HFDを摂取したCRCモデルマウスにおいて、炎症性サイトカインを抑制し、腸のバリア機能を修復する。(A)血清中の炎症性サイトカイン(IL-1β、IL-6、TNF-α、IFN-γ)のレベル。(B)大腸組織における炎症性サイトカイン(IL-1β、IL-6、TNF-α)レベル。(C)大腸組織におけるSTAT3およびp-STAT3の発現量。(D)結腸組織における腸管バリア関連タンパク質ZO-1およびオクルディンの発現。(*p < 0.05, **p < 0.001, ***p < 0.001).
(新しいウィンドウで表示)
図3
BBRは、AOM/DSS処理マウスにおいて、HFDによって誘導される腸内細菌叢のディスバイオシスを制御する。(A)3群間の腸内細菌叢の主成分序列分析。(B)3群間の腸内細菌叢の豊かさ指数(Chao1およびObserved_outs)および多様性指数(ShannonおよびSimpson)。(C)サンプル間の門派レベルでの細菌分類学的プロファイリング。(D) NDマウスとHFDマウス、またはHFDマウスとHFD+BBRマウスの間で、上位30個の濃縮細菌OTUの相対存在量ヒートマップを示す。(E)NDマウスとHFDマウスの便サンプルにおけるEscherichia-Shigella、Clostridium_sensu_stricto_1、Prevotellaceae_UCG-001、Lachnospiraceae_NK4A136_groupの相対的存在量である。(F)HFDマウスおよびHFD+BBRマウスの便サンプルにおけるAkkermansia、Parabacteroides、Alistipes、Clostridium_sensu_stricto_1の相対的存在量。(*p < 0.05, **p < 0.001).
(新しいウィンドウで表示)
BBRはHFDで飼育したAOM/DSS処理マウスの腸内細菌叢関連代謝物を変化させる
代謝物における微生物叢の制御的役割を考慮し、HFD関連CRCモデルマウスのBBR投与による代謝変化を明らかにするために、AOM/DSSを投与したND飼料、HFD飼料、HFD+BBR飼料マウスの糞便サンプルについてLC-MSを用いて代謝プロファイリングを実施しました。教師なしPCA解析の結果、糞便代謝プロファイルはND飼育マウスとHFD飼育マウス(図4A1)、HFD飼育マウスとHFD+BBR飼育マウス(図4A2)の間で有意に異なることがわかった。また、2群間で異なる糞便代謝物が同定され(図4B1-2)、異なるメタボロームシグナル伝達経路に濃縮されていることが判明した。これらの経路の中で、グリセロリン脂質代謝は、NDマウスと比較してHFDを与えたマウスで最も変化した経路であった(図4C1)。興味深いことに、グリセロリン脂質代謝は、BBR処理後のHFDを与えたマウスにおいても、変化したパスウェイのトップであった(図4C1)。トップ経路のさらなる分析を通じて、リゾホスファチジルコリン(LPC)、アセトアルデヒドおよびリゾホスファチジン酸(LPA)は、BBR投与後のHFDを摂取したマウスで有意に減少することが判明した(図4D、表S2)。
微生物叢と代謝物の潜在的な関連性を明らかにするため、部分的なスピアマンの相関分析により、差次的に存在する細菌と代謝物の関係を分析した。Akkermansiaは、BBR処理後に細菌属の中で最も高い存在度を示し、LPCおよびアセトアルデヒドと最も負の相関を示した。一方、2つの病原性細菌、Clostridium_sensu_stricto_1とAlistipesはHFD飼育マウスで豊富に存在し、LPCおよびアセトアルデヒドと正の関連を示した(図4E)。LPCは、腫瘍の発生にしばしば関連するエピジェネティックな効果を発揮することが報告されている[18, 19]。そこで、HFDを与えたマウスの腸内のLPC含量がNDを与えたマウスのそれよりも有意に高いこと、およびBBR処理によりHFDを与えたマウスのLPC含量が明らかに抑制されることを確認した(いずれもp<0.01、図4F)。
図4
BBRは、HFDで飼育したAOM/DSS処理マウスの腸内細菌叢関連代謝物を変化させる。(A1-2)NDマウスとHFDマウス、またはHFDマウスとHFD+BBRマウスにおける腸内メタボローム解析のPCAプロットである。(B1-2)NDマウスとHFDマウス、またはHFDマウスとHFD+BBRマウスの差分代謝物のボルカノプロット。(C1-2)NDマウスとHFDマウス、またはHFDマウスとHFD+BBRマウスの差分濃縮代謝物のパスウェイ解析。(D)グリセロリン脂質代謝経路の3群間における代謝物の差分ヒートマップ。(E)BBR改変微生物と代謝物の関連性を示す相関分析。(F)3群におけるマウス便LPC濃度。(**p < 0.01).
(新しいウィンドウで表示)
BBR関連差分代謝物LPCは、細胞増殖と細胞接合障害に寄与する
CRC発症におけるLPCの機能的役割の可能性を探るため、3つのCRC細胞株(HCT-116、HCT-8、SW480)および正常腸管上皮細胞株(IEC-6)をLPCで直接処理した。LPCは明らかにCRC細胞と正常腸管上皮細胞の増殖を促進した(図5A)。細胞周期実験から、LPC処理は、陰性対照と比較して、IEC-6、HCT116、およびHCT-8細胞のG1からS期への細胞周期進行を加速することが示唆された(図5B)。また、HCT-116およびHCT-8細胞において、LPC投与後にβ-cateninおよびPCNAの発現が有意に増加した(図5C、図S1)。
さらに、LPCが炎症経路や腸管上皮バリア機能に調節的な役割を持つかどうかを確認するため、LPCをRaw264.7細胞に投与した。LPC処理によりIL-6およびp-STAT3タンパク質が明らかに上昇したことから(図5D)、LPCがIL-6/p-STAT3経路において触媒的役割を担っていることが示された。その後、Raw264.7細胞をHCT-8細胞またはHCT-116細胞と共培養した。免疫蛍光法により、LPC処理により、HCT-8またはHCT-116細胞のオクルディンおよびE-カドヘリンのタンパク質が著しく減少することが示された(図5E)。これらの結果から、BBRのHFD関連CRCの進行抑制作用は、少なくとも部分的には、腸内のLPC含量を抑制することによるグリセロリン脂質代謝の制御を介して生じることが示された。
BBRはHFD食マウスの発がん経路および炎症性シグナル遺伝子を抑制する
BBRがHFD関連大腸腫瘍の発生を抑制する分子メカニズムを包括的に理解するために、HFD飼育マウスの大腸上皮の遺伝子発現プロファイルを、BBR投与有無にかかわらずRNA配列解析を行った。がんおよび炎症反応の経路に関与する発現差のある遺伝子は、|logFC|>3、調整p<0.01で同定された。がん関連遺伝子のデータは、BBRで処理したHFD給餌マウスと比較して、HFD給餌マウスで18のアップレギュレートおよび2のダウンレギュレート遺伝子を明らかにした(図6A、表S3)。エンリッチメント解析により、Wnt/β-カテニンシグナル伝達は、BBRが腸の腫瘍形成を阻害する主な経路であることが示された(図6B)。さらに、炎症反応遺伝子に関するデータでは、BBR処理したHFD飼育マウスと比較して、HFD飼育マウスでは14個のアップレギュレート遺伝子および4個のダウンレギュレート遺伝子が示された(図6C、表S4)。一方、NF-κBシグナルおよびIL-17シグナルを含む複数の経路が、BBRの抗HFD関連大腸腫瘍形成に関与することが見出された(図6D)。さらに、β-カテニンおよびIL-17の有意に低いタンパク質発現は、免疫組織化学およびELISA分析によれば、それぞれ、BBRで処置したHFD飼育マウスでHFD飼育マウスよりも観察された(図6E-G)。これらの結果から、BBRはWntおよびIL-17シグナル経路を抑制することにより、HFD関連大腸がんを阻害することが示唆された。
抗生物質は、マウスのHFD関連大腸腫瘍発生に対するBBRの抑制効果を減衰させる
BBRのHFD関連大腸腫瘍発生抑制に腸内細菌叢が関与しているかどうかを調べるため、抗生物質を用いて腸内細菌叢を枯渇させ、HFD飼育マウスの腸内腫瘍の進行に対するBBRの調節作用を観察した(図7A)。先行研究[6, 20]と同様に、抗生物質はHFD飼育マウスの大腸ポリープ数を効果的に減少させ、大腸長の短縮を緩和させた。しかし、HFD+ABXマウスとHFD+ABX+BBRマウスの間で、結腸長および結腸ポリープ数に差は認められなかった(図7B-D)。HE染色では、抗生物質がHFD飼育マウスの腸管粘膜の組織学的スコアを著しく低下させたが(p<0.01)、BBRは抗生物質投与後に組織学的スコアをさらに低下させなかった(図7E、F)。一方、大腸組織では、HFD+ABXマウスおよびHFD+ABX+BBRマウスでは、HFD群マウスに比べてPCNAのタンパク質発現が有意に低下し、オクルディンのタンパク質発現が顕著に高かった(p<0.01)が、BBR投与あり/なしの抗生物質処理HFD飼育マウスでは差は見られなかった(図7G、H)。さらに、BBRのLPC発現調節に対する抗生物質の影響を明らかにするために、抗生物質介入下のHFD飼育マウスにおいて、BBR投与の有無にかかわらず腸内のLPCの含有量を測定したところ、有意差は観察されなかった(図7I)。これらの結果は、HFD関連大腸腫瘍発生に対するBBRの抑制効果を腸内細菌叢が媒介することを示した。
図5
BBR関連微量代謝物LPCは、細胞増殖および細胞接合障害に寄与している。(A)CRC細胞株HCT116、HCT-8、SW480、および正常腸管上皮細胞株IEC-6のLPC処理有無による細胞増殖曲線。(B)LPC処理の有無にかかわらず、HCT116細胞およびHCT8細胞をフローサイトメトリーで解析した。(C)LPC処理の有無にかかわらず、HCT 8細胞およびHCT 116細胞におけるβ-cateninおよびPCNAの発現。(D)LPC処理の有無にかかわらず、Raw 264.7細胞におけるIL-6およびp-STAT3の発現を確認した。(E)LPC処理の有無にかかわらず、Raw264.7細胞と共培養したHCT-8細胞およびHCT-116細胞におけるオクルディンおよびE-カドヘリンの発現。(*p < 0.05, **p < 0.001, ***p < 0.001).
(新しいウィンドウで表示)
図6
BBRは、HFD飼育マウスにおける発がん性経路および炎症性シグナル伝達遺伝子を抑制する。(A)HFD群とHFD+BBR群の比較で、がん経路に関与する大腸上皮の差次的発現遺伝子。(B)濃縮解析による、HFD+BBR群と比較したHFD群におけるがんシグナル伝達経路の変化。(C)HFD+BBR群と比較したHFD群における炎症反応経路に関与する大腸上皮の差次的発現遺伝子。(D)濃縮解析による、HFD+BBR群と比較したHFD群における炎症反応シグナル伝達経路の変化。(E)Wntシグナル経路とTh 17シグナル経路の発現量の異なる遺伝子をネットワークで示した。(F)結腸組織におけるβ-カテニンの発現:bar=200μm、(40μm×5)。(G)血清および結腸組織中のIL-17のグループ間レベル。(*p < 0.05, ***p < 0.001).
(新しいウィンドウで表示)
図7
抗生物質処理は、マウスのHFD関連大腸腫瘍発生に対するBBRの抑制効果を減衰させる。(A) HFDを与えたAOM/DSSマウスでの抗生物質実験のデザイン。(B) 犠牲時の大腸の代表的な画像。(C)大腸ポリープの数。(D) 大腸の長さ。(E)腸管切片のHE染色:bar=50μm、(10μm×5)。(F)3群間の組織学的スコア。(G)結腸組織におけるPCNAの発現。(H)結腸組織におけるオクルディンの発現。(I) 3群間のマウス便LPC濃度。(**p < 0.001, ***p < 0.001)
(別ウィンドウで表示)
FMTはHFDを摂取したマウスの大腸腫瘍発生に対するBBRの抑制効果を再現する
HFD関連大腸腫瘍発生に対するBBR制御腸内細菌叢の寄与をさらに検証するために、BBR投与ありまたはなしのHFD飼育マウスの糞便サンプルを、抗生物質処理により細菌叢が枯渇したAOM/DSS誘発CRCマウスに移植した(図8A)。BBRのバイオアベイラビリティが生体内で非常に低いことを考えると[21, 22]、高濃度のBBRが便中に残存していた可能性がある。FMT前に便中に残存するBBRの含有量を測定するため、LC-MSを用いて、BBR標準試料との比較に基づいて、糞便懸濁液中に残存するBBRの含有量が約170 ug/mlであることを確認し、これはHFD飼育マウスに直接投与したBBR(100mg/kg/d)の濃度より有意に低かった(図8B)。したがって、FMT実験では、BBR処理の直接的な抗腫瘍効果は除外された。FMT(HFD)マウスは、FMT(HFD+BBR)マウスに関して結腸長に差を示さなかったが(図8C)、HFD+BBR群マウスからの便は、FMT(HFD)マウスよりもFMT(HFD+BBR)マウスの結腸ポリプ数の著しい減少(p<0.01)および腸管粘膜組織スコアの低下(p<0.さらに、HFD+BBRマウスの便は、HFD飼育マウスと比較して、大腸組織におけるPCNA発現を有意に抑制し、オクルディンを増加させた(図8G)。機械的に、BBRが制御する腸内細菌叢/代謝物がHFD関連大腸増殖をどのように阻害するかを理解するために、さらに、HFD関連大腸腫瘍形成に対するBBRの効果に深く関連する発がんおよび炎症経路を検討した。WntおよびIL-6/STAT3シグナル経路に関与するβ-カテニンおよびp-STAT3の発現は、FMT(HFD+BBR)マウスではFMT(HFD)マウスより低かった(図8H、I)。これらのデータは、BBRが制御する腸内細菌叢/代謝物が、HFDに関連する大腸腫瘍の発生を直接抑制し、腸管バリアの損傷を修復していることを示した。
FMT後に腸内細菌叢が正常にコロニー形成されたかどうかを検証するために、16S rRNAシーケンシングを用いて、FMT処理後の腸内細菌叢の構造と組成を決定した。腸内細菌叢の組成は、FMT(HFD)マウスとFMT(HFD+BBR)マウスの間で有意に異なっていた(図8J)。さらに、属レベルの存在量を評価したところ、FMT(HFD+BBR)マウスでは有益菌Akkermansiaに富み(p < 0.01, 図8K)、FMT(HFD)マウスでは潜在的病原体Alistipesに富んでいました(p < 0.001, 図8L)。さらに、腸内細菌叢の代謝物に対する調節作用を明らかにするために、レシピエントマウスのLPC量を検出したところ、HFD+BBRマウスの便はHFD飼育マウスの便に比べてLPC量が有意に低いことがわかりました(p < 0.001、図8N). これらの知見は、微生物叢の結果と合わせて、HFD関連大腸腫瘍形成に対するBBRの効果における、変化した腸内微生物叢とその関連代謝物LPCの両方の役割を明らかにするものであった。
考察
臨床研究により、西洋食がヒトにおけるCRCのリスク上昇と関連することが確認されている。疫学的データでは、HFDはしばしば肥満につながり、男性の結腸がんリスクを30~70%増加させることが示されています[23]。一方、HFDは腸内細菌叢と関連代謝物の調節を通じて腸内炎症を増加させることにより、大腸腫瘍の発生を促進することを示す証拠が増えています[6、24]。したがって、HFDに関連するCRCの予防と治療のために、有効な薬剤が緊急に必要とされています。腸内細菌叢の調節因子であるBBRは、有益な細菌の存在量を増加させる一方で、病原性細菌の存在量を抑制することが報告されています[14, 25]。BBRは現在、腸内感染症の治療に広く用いられており、臨床の場では大腸腺腫の再発リスクを低下させる安全性と有効性が確認されている[26]。BBRは、HFDに関連した大腸腫瘍の発生に対して実質的な治療能力を有することが観察されているが、その治療メカニズムはまだ完全に解明されていない。特に、BBRが腸内細菌叢および関連代謝産物を変化させるかどうかは不明であった。
本研究では、BBRがHFD飼育マウスモデルにおいて、腸内細菌叢とその代謝物を変化させることにより、大腸腫瘍の発生を効果的に抑制することを明らかにした。BBRは、HFD食CRCモデルマウスにおいて、腸の炎症およびがん化経路を有意に抑制し、上皮バリア障害を緩和し、グリセロリン脂質代謝に関与する細菌を濃縮することがわかった。 しかし、腸内細菌叢が枯渇したマウスへのBBR投与では、HFD関連大腸腫瘍発生に対する有意な効果は認められなかった。特に、BBR処理したHFD飼育マウスの糞便を、微生物叢が枯渇したCRCモデルマウスに移植すると、大腸腫瘍の発生とLPC濃度が抑制されました。本研究は、グリセロリン脂質代謝の制御とHFDに関連した大腸腫瘍の発生におけるBBRと腸内細菌叢の関連を明らかにした最初の研究である。
BBR投与は、HFD飼育マウスの腸内細菌叢の構造を、主にOTU数、微生物叢の多様性、および分類群の豊かさを変化させることにより、有意に変化させた。特に、BBRは、門レベルでVerrucomicrobiaの存在量を明らかに濃縮した。Escherichia-ShigellaおよびClostridium_sensu_stricto_1の相対量は、HFD飼育マウスで増加したが、BBR処理HFD飼育マウスではAlistipesとともに減少し、AkkermansiaおよびParabacteroidesなどの有益な腸内微生物は有意に増加した。
Akkermansia属は、この研究ではBBR処理後に最も高い存在度(55%以上)を示し、いくつかの研究で炎症反応を抑制し、SCFAを上昇させ、免疫機能を制御することが証明されている[27-29]。重要なことは、アッケシソウがCRCの発生および発症を抑制することを示す証拠が増えていることです[30、31]。最近の研究では、白頭翁煎じ薬が、アッケシソウを増やし、IL-6/STAT3経路を抑制することにより、急性大腸炎を起こしたマウスの炎症症状を有意に緩和することが報告されました[32]。同様に、我々の研究では、BBRがHFDを与えたAOM/DSSマウスにおいて、効果的にAkkermansiaの存在量を増加させ、L-6/STAT3経路を抑制することが示され、BBRの腫瘍進行の予防の基礎となるメカニズムの可能性を示している。
図8
FMTは、HFDを摂取したマウスにおける大腸腫瘍の発生に対するBBRの抑制効果を再現した。(A) AOM/DSSマウスを用いたFMT実験のデザイン。(B)2群のマウスにおける便中のBBR濃度。(C)結腸の長さ。(D)大腸ポリープの数。(E) 犠牲時の結腸の代表画像。(F)腸管切片のHE染色と組織学的スコア:bar=50μm、(10μm×5)。(G)結腸組織におけるPCNAおよびオクルディンの発現。(H)大腸切片のIHC染色、β-カテニンの発現を示す:bar=200μm、(40μm×5)。(I)大腸組織におけるp-STAT3の発現を示す。(J)2群間の腸内細菌叢の主成分オーダリング解析。(K)FMT(HFD)マウスおよびFMT(HFD+BBR)マウスの便サンプルにおけるAkkermansiaの相対存在量である。(L)FMT(HFD)マウスおよびFMT(HFD+BBR)マウスの便サンプルにおけるAlistipesの相対存在量。(N)2群におけるマウスの便中LPC濃度。(*p < 0.05, **p < 0.001, ***p < 0.001).
(新しいウィンドウで表示)
また、CRC患者ではAlistipes、Escherichia-Shigella、Clostridium_sensu_stricto_1の存在量が大幅に増加し、CRCモデルマウスではこれらの細菌のコロニー形成が腫瘍進行を促進することが判明しています[33-35]。CRCメタゲノムに関するマルチコホート解析により、AlistipesがCRCの臨床診断のための細菌マーカーとして使用される可能性があることが確認されました[36]。Alistipes の一種である Alistipes finegoldii が IL-6/STAT3 経路の活性化を通じて右側 CRC を促進することが研究により確認されています[37]。さらに、Sirt3欠損CRCモデルマウスにおいて、Escherichia/Shigellaの高存在がWnt経路の活性化と密接に関連していることを発見した実験研究がある[38]。Clostridium_sensu_stricto_1とREG3G、CCL8、IDO1などの炎症関連遺伝子との強い関連性を考えると、この細菌は大腸炎の発症を促進するようです[39]。本研究では、BBR投与により、HFDを摂取したCRCモデルマウスにおいて、上記の病原性細菌、およびIL-1β、IL-6、INF-γなどの腸管炎症因子の存在量が効果的に減少し、IL-6/STAT3およびWntシグナル伝達経路が抑制された。さらに、有望な抗生物質候補であるParabacteroidesは、HFDを与えたAOM処理マウスにおいて、大腸腫瘍の発生と腸管上皮バリアの維持に保護的な役割を持つことが実証されている[40]。
さらに、BBR処理後に最も濃縮されたAkkermansia属は、LPCと負の相関があった。アケルマンシアがグリセロリン脂質代謝を直接制御することを示す決定的な証拠はないが、関連する研究では、アテローム性動脈硬化症併発のApoE-/-マウスにおいて、アケルマンシアの相対存在量の減少がLPCの含有量の増加に関連することが報告されている[41]。同様に、他の研究では、薬剤が腸内のLPCの濃度を調節しながら、Akkermansiaの存在量を調節することが明らかにされている[42, 43]。これらの結果を総合すると、アッカーマンシアはグリセロリン脂質代謝、特にLPC濃度の調節に大きな影響を及ぼしている可能性があることがわかります。さらに、大腸腫瘍の発生を促進するHFDの影響に関する研究では、パラバクテロイデスの枯渇がLPCとLPAの両方に負の相関があることが示されている[44]。したがって、我々の知見は、HFD関連腫瘍発生に対するBBRは、腸内細菌叢に対するBBRの制御効果に依存する形で、グリセロリン脂質代謝の制御における変化と密接に関連していることを示した。
最近の研究では、グリセロリン脂質代謝が、肥満、高脂血症、2型糖尿病、大腸炎、大腸発癌などの様々な疾患の発症に関与していることが確認されている[45-49]。複数の研究により、グリセロリン脂質代謝がCRCの発生と発症に関与していることが証明され、いくつかの薬剤がこの代謝経路を制御することで抗CRC治療の役割を担っています[50, 51]。さらに重要なことは、グリセロリン脂質代謝の重要な代謝物であるLPCが、in vitroおよびin vivoで炎症反応を高めることが実証されており、さらに、腸内のその含有量は腸内細菌叢によって調節されている[52]。本研究では、腸内細菌叢が正常なHFD飼育マウスにおいて、LPCの濃度が顕著に上昇し、BBRがこの変化を効果的に逆転させることを発見しました。さらに、LPCはin vitroでCRC細胞の増殖、炎症性サイトカインの亢進、および上皮細胞接合部の障害を効果的に促進した。興味深いことに、腸内細菌を除去したHFD飼育マウスでは、BBRはLPC濃度を低下させず、抗腫瘍効果の喪失が観察された。これらの結果を総合すると、BBRはHFDによる腸内細菌叢と関連する代謝異常を制御することで、がん原性LPCの濃度を低下させ、細胞増殖を抑制し、腸のバリアを改善し、HFD関連大腸腫瘍の発生を抑制することが示された。
最後に、NDを与えた腸内細菌減少マウスにおいて、BBRで制御された腸内細菌が大腸粘膜に及ぼす直接的な影響について検討した。HFDマウスの便を与えたマウスと比較して、NDを与えたHFD+BBRマウスの便を与えたマウスは、腸内のLPC濃度が低く、大腸ポリープが有意に少なく、細胞増殖も少なかったことから、CRC発症抑制に寄与するBBR制御腸内細菌叢の直接的な役割が示唆されました。その結果、BBR制御腸内細菌叢は、主に細胞増殖の制御に関与するIL-6/STAT3およびWntシグナル伝達経路を抑制することが分かりました。同時に、BBR制御腸内細菌叢は、上皮細胞の結合を効果的に改善し、腸の完全性を保護することも明らかにした。これまでの研究で、腸内細菌叢が発がん性遺伝子や炎症性因子を制御することが示されている[53, 54]。さらに、BBR処理した大腸炎マウスの便を無菌マウスに移植すると、腸の炎症が抑制され、腸の粘膜バリアが改善することが分かっており[25, 55]、本研究での観察結果を支持する。さらに、腸内細菌叢の分析により、HFD-FMTマウスとHFD+BBR-FMTマウスの間で腸内細菌叢の組成に有意差があることが示され、腸内細菌叢の調節がBBRの腸管バリア機能の改善および腫瘍進行の抑制に重要な因子となる可能性が示されました。以上より、BBRの経口摂取は、過剰な食事性脂肪による腸内細菌叢/代謝物の不均衡を調整し、細胞増殖を抑制し、腸管バリア機能障害を緩和し、最終的にCRC発症の進行を抑制することが示唆された。
結論
本研究により、BBR投与が腸内細菌叢を制御し、LPC産生を抑制し、HFDに関連する大腸腫瘍の発生を阻害することが示された。腸内細菌叢が減少したCRCモデルマウスでは、BBR投与の有無でLPC濃度に差はなく、抗生物質投与したCRCモデルマウスのHFD関連腫瘍の進行をBBR投与でさらに抑制することはなかった。HFD飼育マウスおよびHFD飼育+BBR処理マウスの糞便微生物叢を腸内細菌叢枯渇CRCモデルマウスに移植すると、大腸腫瘍形成およびLPC濃度に対するBBRの抑制効果が再現されたことから、BBRが制御する腸内細菌叢とHFD関連大腸腫瘍形成の直接的関連が示された。これらの知見は、BBRが腸内細菌叢を介したLPC形成の調節を通じて、HFD関連CRCを直接阻害することを初めて実証したものである。我々のデータは、CRCの臨床治療、特に西洋食を好む患者に対する腸内細菌叢の調節因子としてのBBRの将来の応用を支持する洞察を提供した。
補足資料
補足図および表
謝辞
本研究は、中国国家自然科学基金(No.82204823、No.82074201)、中国博士研究基金(No.2021M703485)、浙江省自然科学基金(No.LQ22H290002、LY21H290001)、浙江省伝統中医薬研究計画(No.2022ZQ016)、浙江省医療健康基盤計画(No.2021KY569、2022RC109)から支援を受けた。
著者貢献
Haitao Chen、Chenxiao Ye、Changhong Wu、Yong Guo、Qinghua Yaoが研究を設計・考案し、Haitao Chen、Chenxiao Ye、Changhong Wu、Jiali Zhang、Lu Xu、Xuanying Wang、Chao Xu、Jin Zhangが実験とデータ分析を行い、Haitao ChenとChenxiao Yeが論文を執筆、Yong GuoとQinghua Yaoは論文を修正しました。すべての著者が最終原稿を読み、承認した。
データおよび資料の入手方法
16s rRNA解析の全データは、SRAデータベースにアップロードされています。完全なデータセットは、https://www.ncbi.nlm.nih.gov/bioproject/PRJNA894724 と https://www.ncbi.nlm.nih.gov/bioproject/PRJNA894766 でアクセスできます。RNA-Sequencingデータセットの生データはGEO (GSE216908)にアップロードされています。非標的メタボロームデータはすべてEMBL-EBI MetaboLightsデータベースにMTBLS6683という識別子で寄託されている。完全なデータセットは www.ebi.ac.uk/metabolights/MTBLS6683 からアクセス可能です。本研究で使用および分析されたその他のデータセットは、合理的な要求があれば対応する著者から入手可能です。
倫理に関する声明
すべての動物プロトコルは、浙江中医薬大学実験動物倫理委員会(第20210531-21号)によって承認された。実験は、Institutional Animal Careガイドラインを遵守して実施された。
競合する利益
著者らは、競合する利害関係が存在しないことを宣言している。
参考文献
シーゲルR L、ミラーK D、フックスH E.他、がん統計、2022年。CA Cancer J Clin. 2022;72(1):7-33
大腸癌の世界的負担:新たな傾向、危険因子、予防戦略. Nat Rev Gastroenterol Hepatol. 2019;16(12):713-732
Baena R, Salinas P. Diet and colorectal cancer. Maturitas. 2015;80(3):258-264
Vernia F, Longo S, Stefanelli G. et al. Dietary Factors Modulating Colorectal Carcinogenesis. Nutrients. 2021 13(1)
Sofi F, Dinu M, Pagliai G. et al. Fecal microbiome as determinant of the effect of diet on colorectal cancer risk: comparison of meat-based versus pesco-vegetarian diets (the MeaTIc study). Trials. 2019;20(1):688
Yang J, Wei H, Zhou Y. et al. High-Fat Diet Promotes Colorectal Tumorigenesis Through Modulating Gut Microbiota and Metabolites. Gastroenterology. 2022;162(1):135-149
Zhang W, Xu J H, Yu T. et al. ベルベリンとメトホルミンがdb/dbマウスの腸内炎症と腸内細菌叢組成に与える影響. Biomed Pharmacother. 2019;118:109131
Zhang Y, Gu Y, Ren H. et al. ベルベリンとプロバイオティクスの2型糖尿病に対する腸内細菌関連効果(the PREMOTE study). Nat Commun. 2020;11(1):5015
Zhu L, Gu P, Shen H. Protective effects of berberine hydrochloride on DSS-induced ulcerative colitis in rats. Int Immunopharmacol. 2019;68:242-251
Huang D N, Wu F F, Zhang A H. et al. 関節リウマチの治療におけるベルベリンの有効性: マルチターゲットから治療可能性へ。ファーマコル・レス.2021;169:105667
Xu X, Zhu X P, Bai J Y. et al. Berberine alleviates nonalcoholic fatty liver induced by a high-fat diet in mice by activating SIRT3. FASEB J. 2019;33(6):7289-7300
Chen H, Zhang F, Zhang J. et al. A Holistic View of Berberine Inhibiting Intestinal Carcinogenesis in Conventional Mice Based on Microbiome-Metabolomics Analysis. Front Immunol. 2020;11:588079
Wang H, Guan L, Li J. et al. The Effects of Berberine on the Gut Microbiota in Apc (min/+) Mice Fed with a High Fat Diet. Molecules. 2018 23(9)
Chen H, Ye C, Cai B. et al. ベルベリンは腸内細菌叢の調節を通じて腸管炎症性遺伝子および発がん因子を抑制し、腸管発がんを抑制する. BMC Cancer. 2022;22(1):566
Xuan-Qing C, Xiang-Yu L V, Shi-Jia L. Baitouweng decoction is alleviate dextran sulfate sodium-induced ulcerative colitis by regulating intestinal microbiota and the IL-6/STAT3 signaling pathway. J Ethnopharmacol. 2021;265:113357
Grivennikov S, Karin E, Terzic J. et al. IL-6 and Stat3 are required for survival of intestinal epithelial cells and development of colitis-associated cancer. Cancer Cell. 2009;15(2):103-113
高脂肪食は十二指腸のバリア機能を低下させ、不安神経症やうつ病様行動に必要な腸-脳軸に沿ったグリア依存的な変化を誘発するet al. J Neuroinflammation. 2021;18(1):115
リゾホスファチジルコリンによる胆管細胞老化は発癌に関与する可能性がある。J Hepatobiliary Pancreat Sci. 2015;22(9):675-682
Gao F, Chen J, Zhang T. et al. LPCAT1はJAK2/STAT3シグナルを介し子宮頸癌の癌遺伝子として機能する。Exp Cell Res. 2022;421(1):113360
Hwang S, Jo M, Hong J E. et al. Enterotoxigenic Bacteroides fragilis (ETBF) -Colonized AOM/DSS BALB/c MiceにおけるZerumboneの大腸腫瘍形成に対する保護効果. Int J Mol Sci. 2020 21(3)
Younis F A, Saleh S R, El-Rahman S. et al. ベルベリン内包アルブミンナノ粒子の調製、物理化学的特性評価、生物活性評価。Sci Rep. 2022;12(1):17431
ベルベリンを内包した新規キトサンナノ粒子の生体内抗アポトーシス活性は、変形性関節症を効果的に改善する。Int Immunopharmacol. 2015;28(1):34-43
Bardou M, Barkun A N, Martel M. Obesity and colorectal cancer. Gut. 2013;62(6):933-947
Zeng H, Umar S, Rust B. et al. 大腸における二次胆汁酸および短鎖脂肪酸: 大腸マイクロバイオーム、細胞増殖、炎症、および癌に焦点をあてて。Int J Mol Sci. 2019 20(5)
Cui H, Cai Y, Wang L. et al. Berberine Regulates Treg/Th17 Balance to Treat Ulcerative Colitis Through Modulating the Gut Microbiota in the Colon. Front Pharmacol. 2018;9:571
Chen Y X, Gao Q Y, Zou T H. et al. Berberine versus placebo for the prevention of recurrence of colorectal adenoma: a multicentre, double-blinded, randomised controlled study. The lancet. Gastroenterology & hepatology. 2020;5(3):267-275
Gu Z, Pei W, Shen Y. et al. Akkermansia muciniphila and its outer protein Amuc_1100 regulates tryptophan metabolism in colitis. Food Funct. 2021;12(20):10184-10195
Yang W, Ren D, Zhao Y. et al. Fuzhuan Brick Tea Polysaccharide Improved Ulcerative Colitis in Association with Gut Microbiota-Derived Tryptophan Metabolism. J Agric Food Chem. 2021;69(30):8448-8459
Zhang T, Li Q, Cheng L. et al. Akkermansia muciniphila is a promising probiotic. Microb Biotechnol. 2019;12(6):1109-1125
Gu Z Y, Pei W L, Zhang Y. et al. Akkermansia muciniphila in inflammatory bowel disease and colorectal cancer. Chin Med J (Engl). 2021;134(23):2841-2843
Wang L, Tang L, Feng Y. et al. Akkermansia muciniphilaまたは低温殺菌菌の精製膜タンパク質は、マウスにおけるCD8(+)T細胞の調節により大腸炎関連腫瘍の発生を鈍らせる。Gut. 2020;69(11):1988-1997
Xuan-Qing C, Xiang-Yu L V, Shi-Jia L. Baitouweng decoction alleviate dextran sulfate sodium-induced ulcerative colitis by regulating intestinal microbiota and the IL-6/STAT3 signaling pathway. J Ethnopharmacol. 2021;265:113357
Sheng Q, Du H, Cheng X. et al. 異なるステージと異なる部位の大腸がん患者における糞便腸内細菌叢の特徴. オンコル・レット. 2019;18(5):4834-4844
Wang T, Cai G, Qiu Y. et al. 大腸がん患者と健常者ボランティアの腸内細菌叢の構造的棲み分け. ISME J. 2012;6(2):320-329
Zeng X, Jia H, Zhang X. et al. ケフィアの摂取は、腸内細菌叢の調節によりアゾキシメタン/デキストラン硫酸ナトリウム誘発大腸癌を改善する. Food Funct. 2021;12(22):11641-11655
Dai Z, Coker O O, Nakatsu G. et al. Multi-cohort analysis of colorectal cancer metagenome identified altered bacteria across populations and universal bacterial markers. Microbiome. 2018;6(1):70
Parker B J, Wearsch P A, Veloo A. et al. The Genus Alistipes: 炎症、がん、メンタルヘルスに新たな示唆を与える腸内細菌(Gut Bacteria with Emerging Implications to Inflammation, Cancer, and Mental Health). Front Immunol. 2020;11:906
大腸の炎症と腫瘍形成における腸内細菌叢とサーチュイン-3のクロストーク。Exp Mol Med. 2018;50(4):1-11
Wen X, Wang H G, Zhang M N. et al. Fecal microbiota transplantation ameliorates experimental colitis via gut microbiota and T-cell modulation. World J Gastroenterol. 2021;27(21):2834-2849
Koh G Y, Kane A V, Wu X. et al. Parabacteroides distasonisはアゾキシメタン処理したA/Jマウスにおいて腫瘍形成を抑制し、炎症マーカーを調節して腸管バリアの完全性を促進する。Carcinogenesis. 2020;41(7):909-917
Hu K, Liao X X, Wu X Y. et al. ApoE(-/-)マウスの脂質代謝物および腸内細菌叢が微生物叢-腸-脳軸からアテローム性動脈硬化症の共倒れに及ぼす影響. Front Mol Biosci. 2022;9:786492
Zhang N, Liu J, Chen Z. et al. Integrated Analysis of the Alterations in Gut Microbiota and Metabolites of Mice Induced After Long-Term Intervention with Different Antibiotics. Front Microbiol. 2022;13:832915
Ryan P M, Patterson E, Carafa I. et al. Metformin and Dipeptidyl Peptidase-4 Inhibitor Differentially Modulate the Intestinal Microbiota and Plasma Metabolome of Metabolically Dysfunctional Mice. Can J Diabetes. 2020;44(2):146-155
Yang J, Wei H, Zhou Y. et al. High-Fat Diet Promotes Colorectal Tumorigenesis Through Modulating Gut Microbiota and Metabolites. Gastroenterology. 2022;162(1):135-149
Zhu Y, Wei Y L, Karras I. et al.グリセロリン脂質代謝シグナル経路を介したブラックチョークベリー(Aronia melanocarpa L.)ポリフェノールによる腸内細菌叢および脂質プロファイルの変調(Modulation of the gut microbiota and lipidomic profiles by black chokeberry (Aronia melanocarpa L.) polyphenols via the glycerophospholipid metabolism signal pathway. フロント・ニュートラ 2022;9:913729
Du L, Wang Q, Ji S. et al. Shanmei Capsuleによるメタボロームおよび微生物リモデリングは高脂肪食誘発マウスの高脂血症を改善する. Front Cell Infect Microbiol. 2022;12:729940
López-Hernández Y, Lara-Ramírez E E, Salgado-Bustamante M. et al. Glycerophospholipid Metabolism Alterations in Patients with Type 2 Diabetes Mellitus and Tuberculosis Comorbidity. アーチ・メッド・レス. 2019;50(2):71-78
Yuan Z, Yang L, Zhang X. et al. Huang-lian-Jie-du decoction and its effective fraction in alleviating acute ulcerative colitis in mice.のメカニズム: アラキドン酸代謝およびグリセロリン脂質代謝を調節する。J Ethnopharmacol. 2020;259:112872
Shan S, Wu C, Shi J. et al. Inhibitory Effects of Peroxidase from Foxtail Millet Bran on Colitis-Associated Colorectal Carcinogenesis by the Blockage of Glycerophospholipid Metabolism. J Agric Food Chem. 2020;68(31):8295-8307
Lv J, Jia Y, Li J. et al. Gegen Qinlian decoction enhances the effect of PD-1 blockade in colorectal cancer with microsatellite stability by remodelling the gut microbiota and the tumour microenvironment. Cell Death Dis. 2019;10(6):415
Hong X, Wang G, Liu X. et al. Lipidomic biomarkers: 尿中ビスフェノールA曝露と大腸がんとの関連性の潜在的なメディエーター。J Hazard Mater. 2022;427:127863
Tang X, Wang W, Hong G. et al. Gut microbiota-mediated lysophosphatidylcholine generation promotes colitis in intestinal epithelium-specific Fut2 deficiency. J Biomed Sci. 2021;28(1):20
Kadosh E, Snir-Alkalay I, Venkatachalam A. et al. The gut microbiome switches mutant p53 from tumour-suppressive to oncogenic. Nature. 2020;586(7827):133-138
Zhou C B, Zhou Y L, Fang J Y. Gut Microbiota in Cancer Immune Response and Immunotherapy. Trends Cancer. 2021;7(7):647-660
Li Q, Cui Y, Xu B. et al. Jiawei Gegen Qinlian decoctionの主な有効成分は、腸内細菌叢依存的に異なる食事環境下で潰瘍性大腸炎を予防する。薬学研究.2021;170:105694
著者連絡先
対応する著者 Qinghua Yao, yaoqh@zjcc.org.cn; Yong Guo, guoyong1047@zcmu.edu.cn
2022-12-14受領
2023-3-23に受理された
2023年4月9日発行
引用のスタイル
APAコピー
Chen, H., Ye, C., Wu, C., Zhang, J., Xu, L., Wang, X., Xu, C., Zhang, J., Guo, Y., Yao, Q. (2023). ベルベリンは腸内細菌叢を介したリゾホスファチジルコリンの調節を介して高脂肪食関連大腸癌を抑制する。International Journal of Biological Sciences, 19(7), 2097-2113。https://doi.org/10.7150/ijbs.81824。
ACSコピー
ベルベリンは、腸内細菌が介在するリゾホスファチジルコリンの調節を通じて、高脂肪食に関連した大腸がんを抑制する。Int. J. Biol. Sci. 2023, 19 (7), 2097-2113. DOI: 10.7150/ijbs.81824.
NLMコピー
Chen H, Ye C, Wu C, Zhang J, Xu L, Wang X, Xu C, Zhang J, Guo Y, Yao Q. Berberine is inhibits high fat diet-associated colorectal cancer through modulation of the gut microbiota-mediated lysophosphatidylcholine. Int J Biol Sci 2023; 19(7):2097-2113. doi:10.7150/ijbs.81824. https://www.ijbs.com/v19p2097.htm
CSEコピー
Chen H, Ye C, Wu C, Zhang J, Xu L, Wang X, Xu C, Zhang J, Guo Y, Yao Q. 2023年。ベルベリンは腸内細菌叢を介したリゾホスファチジルコリンの調節を介して高脂肪食関連大腸癌を抑制する。Int J Biol Sci. 19(7):2097-2113.
これは、クリエイティブ・コモンズ表示ライセンス(https://creativecommons.org/licenses/by/4.0/)の条件の下で配布されるオープンアクセス記事です。完全な条件については http://ivyspring.com/terms を参照してください。
©2023 Ivyspring International Publisher. 利用規約
この記事が気に入ったらサポートをしてみませんか?
