ウイルス感染時のNK細胞サブセットと機能不全:治療薬の新たな道?
本文へスキップ
トップバーナビゲーション
免疫学の最前線
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
396
総閲覧数
14
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは3
レビュー記事
Front. 免疫学、2023年10月19日
ウイルス免疫学
第14巻-2023年|https://doi.org/10.3389/fimmu.2023.1267774
ウイルス感染時のNK細胞サブセットと機能不全:治療薬の新たな道?
https://www.frontiersin.org/articles/10.3389/fimmu.2023.1267774/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FIMMU_XXXXXXXX_auto-dlvrit








Jenna K. Dick1,2,3 Ross Cromarty2 Geoffrey T. Hart1,2,3 Joshua Rhein1
1Division of Infectious Diseases and International Medicine, Department of Medicine, University of Minnesota, Minneapolis, MN, United States
2米国ミネソタ州ミネアポリス、ミネソタ大学メーソンがんセンター
3米国ミネソタ州ミネアポリス、ミネソタ大学免疫学センター
ウイルスのチャレンジにおいて、ナチュラルキラー(NK)細胞は感染に対する初期の免疫応答者として重要な役割を果たす。この応答中、NK細胞集団には、特にその頻度、位置、サブタイプの有病率という点で、大きな変化が生じる。この総説では、いくつかの病原性ウイルス感染に伴うNK細胞レパートリーの変化について、特にこれらの環境におけるNK細胞の調節異常の一因となる変化に焦点を当てながら、まとめている。この調節異常は、NK細胞の過応答性あるいは低応答性を引き起こすことによって、宿主の病態を悪化させる。反応亢進型のNK細胞は宿主の細胞死を引き起こし、炎症亢進環境の形成に寄与する。低応答性のNK細胞集団は疲弊に向かってシフトし、しばしばウイルスの病原性を制限できず、おそらくウイルスの持続を可能にする。NK細胞の調節障害に対処することを目的としたいくつかの新しい治療法は、過去30年間に癌の治療において生まれ、ウイルス性疾患の治療においても有望であることが証明された。しかし、このような治療法をウイルス感染症に応用することは、まだ十分に検討されていない。本総説では、TGF-β阻害剤、免疫チェックポイント阻害剤、養子NK細胞療法、CAR NK細胞、NK細胞エンゲイジャーの投与など、いくつかの治療法について簡単に紹介する。
1 はじめに
ナチュラルキラー(NK)細胞は、その細胞傷害活性と、生理的ストレスを受けたがん細胞やウイルス感染細胞に対する初期応答者として働く自然免疫細胞としての役割で注目されるリンパ球の一種である(1)。NK細胞は、適応免疫応答が発現する前にウイルスに応答する能力を持つことから、ウイルス感染において特に重要である(2)。ある種のウイルス感染に対する防御におけるNK細胞の役割については、選択的NK細胞欠損症患者において証明されている。このような患者の特徴的な臨床症状は、重症で再発性のウイルス感染である(3, 4)。例えば、19人のNK細胞欠損患者グループのうち、42%が早死にし、53%がサイトメガロウイルス、エプスタイン・バーウイルス、水痘帯状疱疹ウイルス、単純ヘルペスウイルスなどの重症ヘルペスウイルス感染症を経験していた(5)。NK細胞欠損症患者において、これらの感染症に関連した重篤な合併症の発生率が劇的に増加していることは、ウイルス感染症との闘いとその抑制におけるNK細胞の重要な役割を強く物語っている。
1.1 NK細胞サブセット
他の免疫細胞と同様、NK細胞はCD34+造血幹細胞に由来し、その発生はほとんど個別の段階で起こる。NK細胞系譜へのコミットメントは、CD3の消失と自然細胞傷害性レセプターNKp44とNKp46の獲得に依存している(6)。NK細胞は二次リンパ組織、骨髄、肺、肝臓、脾臓、子宮組織にも存在することが知られている。
NK細胞は、表面マーカーCD56とCD16(FcgrIIIa)の相対的発現に基づいて異なる集団に分けられており、CD56brightとCD56dimの2つが最大のサブセットである(7)。CD56bright NK細胞は血液中の全NK細胞のおよそ2-10%を占め、主に二次リンパ系臓器に存在し、NK細胞の50%を占めるのに対し、CD56dim NK細胞は血液中のNK細胞の90%を占める(8)。CD56bright NK細胞はCD56dim NK細胞に分化し、CD16を発現する(9, 10)。機能的には、CD56bright NK細胞はCD56dim NK細胞よりも細胞傷害性がはるかに低く、IFN-γやTNF-αのような抗ウイルス性炎症性サイトカインの産生に関与していると考えられている(7, 8)。対照的に、CD56dim NK細胞は、パーフォリンとグランザイムBを10倍多く含み、CD16を発現しているため、抗体依存性細胞傷害性(ADCC)に関与することができ、細胞傷害性がはるかに高い(11)。CD16は、他のレセプターを介さずに単独でNK細胞を活性化することが知られている唯一のレセプターである(12)。注目すべきは、CD56dim NK細胞はIFN-γのような炎症性サイトカインを産生する能力もあり、通常、刺激後2~4時間で産生するのに対し、CD56bright NK細胞は刺激後16時間以上経ってから主にサイトカインを産生することである(13)。NK細胞にはもう一つ、適応性(あるいは記憶様)NK細胞と呼ばれるサブセットがあり、抗原を介したクローン形成や長期間の記憶など、適応免疫系の特質を備えていることが知られており、後に詳しく検討する予定である(14)。最後に、末梢組織に存在し、異なる表現型マーカーを持つNK細胞集団の異なるサブセットも存在する(15)。
1.2 NK細胞レセプターとシグナル伝達
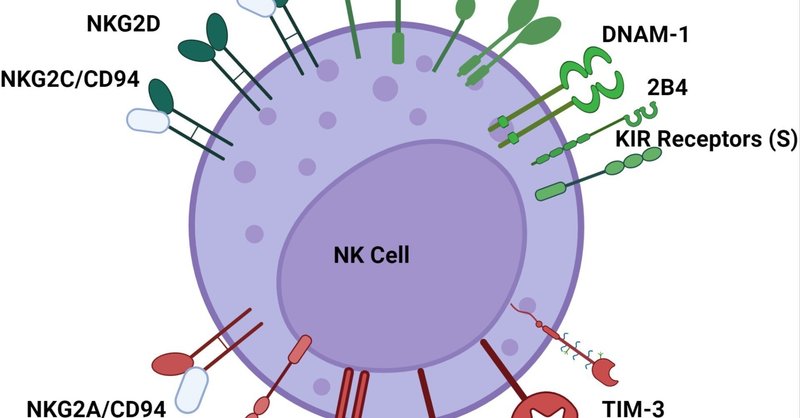
NK細胞は、制御不全細胞や感染細胞を認識するメカニズムにおいてユニークである。細胞傷害性Tリンパ球のように主要組織適合性(MHC)分子によって提示されたウイルスペプチドのみを認識するのではなく、NK細胞の活性化は、非抗原特異的な方法でウイルス感染細胞と非感染細胞を区別するために、異なる活性化受容体と抑制受容体のバランスに依存している。多くのNK細胞レセプターは、MHCクラスI分子やMHCクラスI鎖関連(MIC)分子などの表面発現を感知する(16)。NK細胞の活性化は、活性化シグナルが抑制シグナルを上回った場合にのみ起こる(図1)(17)。重要なことは、NK細胞は抗原に感作されることなく、ウイルス感染細胞や腫瘍標的を認識できるということである。ウイルスの中には、MHC-Iをダウンレギュレートしてウイルス抗原の提示を妨害し、細胞傷害性Tリンパ球から逃れるものがある。このMHC-Iのダウンレギュレーションは、NK細胞によるウイルス感染細胞の認識と殺傷を促進する。MHC-Iを欠く細胞を認識するというこの概念は、「ミッシング・セルフ」仮説として知られている(18)。
図1
www.frontiersin.org
図1 NK細胞の活性化受容体と抑制受容体。NK細胞の活性化は、主にHLAと結合するレセプターを用いた活性化シグナルと抑制シグナルのバランスに依存し、非抗原特異的なメカニズムでウイルス感染細胞と非感染細胞を区別する。活性化受容体には、NKG2C、NKG2D、NKG2E、NKp30、NKp44、NKp46、NKp80、DNAM-1、および細胞質尾部の短いKIR受容体が含まれる。抑制性受容体には、NKG2A、PD-1、LAG-3、TIGIT、TIM-3、および長い細胞質尾部を持つKIR受容体が含まれるが、KIR2DL4は活性化型である。KIRレセプターファミリーには活性化レセプターと抑制レセプターの両方があり、またどちらにも作用するレセプターもある。同様に、2B4も活性化シグナルと抑制シグナルのいずれかを提供することができる。
活性化レセプターには、NKp30、NKp44、NKp46、NKp80などの天然細胞傷害性レセプター(NCR)に加え、NKG2C、NKG2D、NKG2EなどのNKG2ファミリーのレセプターがある(7, 19)。NKp44が活性化NK細胞によって発現されるのに対して、NKp30、NKp46、NKp80は静止NK細胞によって発現される(20)。NK細胞の成熟過程における自然細胞傷害性レセプターの獲得は、腫瘍細胞に対する細胞傷害活性の発現と相関しており、NK細胞の活性化におけるレセプターファミリーの重要性を示している(21)。NKG2CとNKG2Eは、HLA-Eに結合するCD94とヘテロ二量体を形成し、この相互作用が抗ウイルス反応におけるNK細胞の拡大を支えている(17)。もう一つの活性化レセプターはDNAM-1で、これはネクチンおよびネクチン様分子と結合する(22)。
抑制性レセプターには、長い細胞質尾部を持つキラー細胞免疫グロブリン様(KIR)レセプターファミリーのメンバーが含まれる(23)。注目すべきは、多くのKIRレセプターは抑制性であるが、一部は活性化性で短い尾を持ち、活性化と抑制の両方を持つものもあることである(24)。同様に、2B4もNK細胞レセプターの一つであり、調節する共受容体やシグナル伝達分子の存在によって、活性化と抑制の両方を示すことが観察されている(25)。NKG2A/CD94ヘテロダイマーは、HLA-Eをリガンドとして結合するもう一つの重要な抑制性レセプターとしても機能している(26)。血液中では、NK細胞の約50%がNKG2A/CD94レセプターを発現している(27)。NK細胞の分化に関しては、NK細胞の成熟過程でNKG2Aが段階的に減少し、同時にキラー免疫グロブリン様受容体(KIR)が増加することが指摘されている(28)。TIGIT、LAG-3、TIM-3、PD-1レセプターは、古典的には細胞傷害性Tリンパ球上の抑制性レセプターとして定義されているが、状況に応じて抑制的または活性化的にNK細胞応答を調節する役割を果たすことがある(29, 30)。
1.3 NK細胞レセプターとリガンドの遺伝的変異
NK細胞シグナル伝達の複雑さに加えて、多くのNK細胞レセプターとリガンド、特にKIRレセプターファミリーとHLA遺伝子の中に、広範な遺伝的多様性が存在する(31-33)。詳しく述べると、KIRレセプターファミリーは、異なるKIR遺伝子の存在、KIR遺伝子のコピー数という点で大きく異なり、これらの遺伝子内にかなりの多型性が存在するため、個体間でKIRレパートリーが著しく異なることが判明している(34, 35)。二つの主要なハプロタイプが同定され、グループAおよびグループBと呼ばれている(36)。A群ハプロタイプはその構成が比較的一貫しており、活性化KIRレセプターKIR2DS4と抑制性KIRレセプターKIR2DL1、KIR2DL3、KIR3DL1、KIR3DL2、KIR2DL4からなる(31)。これに対し、Bハプロタイプはあまり固定されておらず、1つ以上の活性化KIR受容体と抑制性KIR受容体KIR2DL5A、KIR2DL5B、KIR2DL2をコードする遺伝子を含んでいる。ハプロタイプの中で、A群は構成遺伝子の対立遺伝子多型の点で異なり、B群は遺伝子の含有量とコピー数の点でより異なるが、対立遺伝子の変異も考慮される(36)。多くのNK細胞レセプターのリガンドとなるHLA遺伝子ファミリーには、35,000以上の異なるMHC対立遺伝子が存在し、ヒトゲノムの中で最も多型性の高い領域となっている(37)。KIRレセプターとHLAリガンドの様々な組み合わせが、機能的活性化に差異を示し(32, 38-40)、さらにヒト免疫不全ウイルス(HIV)(41, 42)、C型肝炎ウイルス(HCV)(43)、SARS-CoV-2(44)、エボラウイルス(45)における感染転帰と関連しているという観察から、NK細胞シグナル伝達におけるこの多様性の意味は非常に明らかである。
同様の効果は、NKG2D/NKG2DLシグナル伝達軸内の遺伝的変異の影響からも観察できる。NKG2DはKIRレセプターファミリーに比べて進化的に保存されているが、異なるハプロタイプが存在し、慢性骨髄性白血病の無治療寛解の予後因子であるだけでなく、異なる癌リスクの素因に関与している(46)。ヒトでは、NKG2DのリガンドはMICとULBPであり、ウイルス感染細胞によって発現が上昇し、これらのリガンドはともに広範な多型性を示す(48)。これらのリガンドの特定の対立遺伝子は、デングショック症候群(49、50)、大腸がん(51)、口腔扁平上皮がん(52、53)、乳がん(54)、子宮頸がん(55)などの疾患と関連している。KIRレセプターファミリーとNKG2D/NKG2DL軸の例を合わせると、個人のNK細胞レパートリーの遺伝的内容が、疾患におけるNK細胞機能の制御に重要な役割を果たしていることがよくわかる。
1.4 その他のNK細胞マーカー
その他の注目すべきNK細胞マーカーには、CD57、CD69、CD107aがある。CD57を発現しているNK細胞は、終末分化、老化、高い細胞傷害性を持っている(56)。CD69はNK細胞が急性活性化の際に発現するマーカーである(57, 58)。さらに、CD69は組織常在NK細胞のマーカーとしても示されている(59)。CD107aは、NK細胞の活性化に伴って放出されるグランザイムやパーフォリンなどの分子を含む細胞傷害性顆粒の内膜に発現している。顆粒が放出されると、その膜は細胞外膜と融合し、顆粒を放出した細胞はCD107a陽性となる。したがって、マーカーとしてのCD107aはNK細胞の顆粒放出(脱顆粒)を示している(60)。
NK細胞は主に、アポトーシスを活性化するセリンプロテアーゼであるグランザイムBと標的細胞の膜に孔を形成するタンパク質であるパーフォリンをそれぞれ含む顆粒を放出することによって感染細胞を殺す(61, 62)。この過程でパーフォリンは、グランザイムが標的細胞の膜を越えて浸潤することを可能にし、そこでプロカスパーゼを含む内部成分を切断し、アポトーシスを開始させる(63)。ADCCは、NK細胞が標的細胞を殺すもう一つの重要なメカニズムである。ADCCでは、標的細胞は抗体と結合し、抗体のFc領域がCD16と結合し、最終的に上述のように標的細胞を殺す細胞傷害性エフェクター分子の放出を引き起こす(64)。
ウイルス感染に対するNK細胞の反応中、NK細胞の活性化レセプターと抑制レセプターのレパートリーは変化し、しばしばNK細胞の機能性に影響を及ぼす。この総説の目的は、これらの変化、特にHIV、HCV、A型インフルエンザウイルス(IVA)、サイトメガロウイルス(CMV)、SARS-CoV-2に関連したNK細胞の調節異常と消耗に関する変化を要約することである。これらのウイルスが選ばれたのは、その臨床的関連性と、発症過程におけるNK細胞の表現型やレパートリーの変化を指摘する文献が数多く存在するためである。これらのウイルスはそれぞれ異なるウイルスファミリーを代表するものであり、さらに、急性ウイルス感染と慢性ウイルス感染がNK細胞集団に与える影響の類似点と相違点についての視点を提供するものである。さらに、効果的なNK細胞応答を維持または増強するのに役立つ可能性のある治療薬についても検討する。
2 ウイルス感染時のNK細胞
2.1 ヒト免疫不全ウイルス(HIV)
HIVはレトロウイルス科に属し、2本の一本鎖RNA分子からなるゲノムを持つ(65)。HIVは主にCD4+ T細胞を標的とし、最終的にその枯渇を招くため、感染者は免疫不全が進行し、日和見感染症や稀な癌に罹患しやすくなる(66)。現代の抗レトロウイルス療法(ART)により、ウイルスの複製は、ARTを受けている患者が無毒化する程度まで制御することができる(66)。しかし、ARTはリンパ組織に潜伏する感染細胞の貯蔵庫を作るため、治癒には至らない(67)。HIV感染の性質を考慮すると、血液とリンパ組織の両方におけるHIV感染におけるNK細胞の役割を明らかにすることが重要視されている。
HIV感染、およびCD4 T細胞の枯渇によって生じる一般的な免疫調節異常の中で、NK細胞はその受容体発現と機能活性に関して大きな変化を受ける。CD4T細胞数の減少というHIVの進行は、細胞傷害性CD56dim NK細胞の量の減少と関連している(68, 69)。残りのCD56dim NK細胞集団は、より成熟した表現型に特徴的なCD57とKIRレセプターの発現を持っている。しかし、これらの細胞は、脱顆粒能やパーフォリンの発現が低いことから明らかなように、機能的な可能性が低下している(70, 71)。CD56ブライトNK細胞集団については、組織輸送に関連するケモカイン受容体であるCCR7を発現しているが、これは減少していることが指摘されている。このCCR7発現の減少は、HIVウイルス量と相関しており(72)、NK細胞輸送の問題がHIV複製を抑制できない一因になっているという考えを裏付けている。さらに、CD56ブライトNK細胞は、HIV感染中、TGF-βの発現が高いことも分かっており、これはTGF-βが免疫エフェクター機能を阻害することから注目される(73, 74)。HIV感染が進行すると、CD56neg NK細胞の量も増加することが観察されている(図2)(71, 75, 76)。健常人では、CD56neg NK細胞サブセットは末梢血中のNK細胞のおよそ5.7%を占めるが、HIV-1感染後には平均10.6%増加することがメタ解析で示されている(77)。CD56陰性NK細胞は、比較的多くの阻害性レセプターを発現しているため、細胞傷害機能が著しく低下している(78)。さらに、この細胞集団は、抗炎症および恒常性維持機能に関連するサイトカインであるTGF-βをより多く産生することが知られている。TGF-βはまた、自己CD8 T細胞の機能性とIFN-γを産生する可能性を阻害する可能性がある(79)。CD56陰性NK細胞集団は、C型肝炎ウイルス(HCV)、エプスタイン・バーウイルス(EBV)、慢性サイトメガロウイルス(CMV)など、他の慢性ウイルス感染症でも増加することが知られている。この観察は、慢性ウイルス感染症に共通する特徴である可能性を示唆している(80)。
図2
www.frontiersin.org
図2 慢性ウイルス感染時に増加するCD56neg NK細胞サブセット。このNK細胞サブセットは、HIV、慢性HCV、EBV、慢性CMVの感染時に増加することが観察されている。このサブセットは、受容体レパートリーの変化、特にNKp30やNKp46のような活性化受容体の発現低下に加え、抑制性KIR受容体KIR2DL2の発現増加により、細胞溶解能が大幅に低下している(52)。興味深いことに、抑制性KIRレセプターKIR2DL1とKIR3DL1の発現は、CD56+とCD56陰性NK細胞の間で同等である。HIVでは、このサブセットはTGF-βの発現が高く、他のNK細胞の疲弊に寄与することが分かっている。
HIV感染中は、NK細胞におけるNKp80やNKp46のような活性化型自然細胞傷害性受容体(NCR)の発現が抑制される(81)。抑制性レセプターに関しては、HIVウイルス血症は抑制性KIRレセプターの発現の有意な増加と関連し、一方、NKG2Aは低下することが示されており、これらを合わせると、活性化レセプターと抑制性レセプターの両方の発現の変化は、細胞溶解機能の低下と関連している(82)。さらに、CD69、CD18、CD11bの発現も低下しており、機能障害がさらに示唆されている(83)。NK細胞によるIFN-γ産生の低下も観察されており、C型肝炎ウイルス(HCV)との同時感染は、IFN-γと脱顆粒能をさらに低下させ、機能的能力を相乗的に損なうことが分かっている(84, 85)。
細胞傷害性Tリンパ球による標的化を避けるために、HIVはMHC-I分子であるHLA-AとHLA-Bを選択的にダウンレギュレートするが、NK細胞による溶解を避けようとする個体では、HLA-EとHLA-Cをほとんど保持する(86)。これはHIVのNefタンパク質に依存したメカニズムで起こり、前述の表面MHC-I分子は急速に内在化され分解される(87)。同様に、HLA-CはHIV-1のウイルス性タンパク質U(Vpu)によって、すべてではないが、一部の個体で発現が低下することが示されている(88, 89)。HIVは、そのVprタンパク質に依存するメカニズムによって、感染細胞のNKG2Dに対するリガンドの発現を誘導することが示されている(90)。その後のNK細胞の活性化は、そのリガンドに持続的にさらされることでNKG2Dレセプターが脱感作され、その結果、レセプターのダウンレギュレーションが起こり、NK細胞の細胞傷害活性が低下するため、CD4 T細胞の枯渇とNK細胞の機能不全に寄与すると推測されている(91, 92)。しかし、NKG2Dシグナル伝達だけではNK細胞の脱顆粒を引き起こすには不十分で、NK-T-B-抗原(NTB-A)との共活性化が必要であり、この抗原はVpuの作用によってダウンレギュレートされ、NK細胞応答からの逃避を可能にするからである(93)。またHLA-Eは、NKG2Aとの相互作用を阻害するHIV抗原を表示することができ、このメカニズムによってNK細胞のシグナル伝達が阻害される。これはHLA-Cとは対照的で、HLA-CはHIV感染中もブロックされないため、KIRレセプターを介したシグナル伝達が保存されている。このことから、HIV+細胞は、抑制性KIRレセプターを持たないNKG2A発現NK細胞に対して特異的に感受性が高いことが示唆され(94)、この可能性を利用した治療法はさらに検討されるべきであろう。同様に、HLA-AとHLA-CとNK細胞抑制性レセプターとの相互作用を阻害することで、HIV感染細胞に対する細胞傷害性が増強された(95)。
HIV感染初期には、NK細胞の数と分布は比較的変化していない。この段階ではKIR+ NK細胞はまれであり、NK細胞のレパートリーが相対的にナイーブであるため、感染を制御する能力が制限される(96)。HIV感染が進行すると、リンパ組織においてCXCR5+ NK細胞の増加が観察されるようになる(97)。このNK細胞集団は、NKG2DやNKp44などの活性化レセプターを高度に発現しているが、非感染者のCXCR5+ NK細胞に比べて脱顆粒が減少しており、機能障害を示している。最も注目すべきは、これらの細胞の頻度がリンパ組織内のHIV-1負荷と負の相関を示すことで、HIV-1リザーバーの制御における潜在的重要性が示されている。
リンパ組織内には、NKG2A阻害性レセプター、NKG2D、NKp46、NKp30活性化レセプターを大量に発現するCD56ブライトNK細胞のサブセットも存在する(98)。このサブセットはまた、低量のCD57とCD16しか発現しないため、分化状態や細胞傷害性に関して比較的未熟である。ヒト化MISTRG-6-15マウスでは、HIV-1感染後、リンパ組織のNK細胞は、非リンパ組織のNK細胞と比較すると、相対的に成熟度が低く、同様に機能不全であった。しかし、この観察結果は、このマウスモデルでは、NK細胞のリンパ系組織への浸潤を阻害する輸送レセプターの不一致が一因である可能性がある。腸粘膜内では、上皮内腔と固有層に存在するNK細胞の2つの異なるサブセットが、慢性HIV感染時には有意に減少しており、上皮内サブセットが安定している自然発症のHIVコントローラーとは対照的である(100)。
KIRレセプターの発現に関しては、活性化KIR2DS4の発現が減少する一方で、他の抑制性KIRの発現は増加するKIR3DL2を除いて一定であることが示されている(101)。興味深いことに、KIR2DS4のダウンレギュレーションに失敗すると、慢性HIVにおいてNK細胞の過剰な活性化が促進されるためか、ウイルス複製が増加することが報告されている(102, 103)。同様に、抑制性KIR受容体KIR2DL3の保有は、特にHLA-C2の保因者である場合、慢性的な免疫活性化の増加と関連している(104)。この同じ研究では、活性化KIR3DS1の保因者も慢性HIV感染時に免疫活性化が亢進することも指摘している。さらなる研究では、受容体の同族リガンドが存在するKIR3DS1+ NK細胞は、in vitroでHIV感染を制御する能力が向上し、in vivoではウイルスのセットポイントが低下することが示されている(105, 106)。全体として、これらの研究は、ある種の受容体-リガンド遺伝子の存在がHIVにおける異なる機能性と関連していることから、個人のKIRおよびHLAレパートリーの重要性を再度強調している。
また、HIV感染がメモリーNK細胞の増加と持続に関連することを示唆する証拠も増えている(107)。例えば、SIVまたはSHIVに感染したマカクは、脾臓と肝臓に存在する抗原特異的NK細胞のサブセットを発達させ、GAGやENVのようなウイルス抗原でパルスした樹状細胞を特異的に溶解することが分かっている(108)。これはNKG2Cに依存したメカニズムで起こり、健康なサルから単離されたNK細胞が非特異的に少ない細胞を溶解するのとは著しく対照的である。ヒトでは、まれなHIVペプチド特異的NK細胞の存在が観察されており、ウイルス量の低下、CD4数の増加、HIV特異的T細胞応答の強化とも関連している(109, 110)。このような細胞が発生するメカニズムを解明し、その機能をより詳細に調べるためには、さらなる研究が必要である。NKG2C+メモリーNK細胞の増加もHIV感染初期に報告されており、NKG2C+ CD57+NK細胞の頻度が高い患者は、抗レトロウイルス療法(ART)開始1ヵ月後の免疫活性化とHIV RNAが低いことが判明している(111)。この研究の患者はサイトメガロウイルス(CMV)血清陽性であったため、このデータからは、このメモリーNK細胞集団がHIV感染そのものによってどの程度誘導されたかは不明である。いずれにせよ、HIVにおけるNKG2C+ CD57+メモリーNK細胞の機能的役割のさらなる解明が必要である。
ARTは、HIV感染によってCD56dim、CD56negative、CD56bright NK細胞サブセットで観察される表現型の変化を正常化しない(112)。CD56dimおよびCD56brightの陽性率、ならびにCD107a、グランザイムB、NKG2DおよびNKp46の発現の欠損は、ART療法後も残存しており、NK細胞の機能障害が長期化していることを示唆している(113)。機能障害にもかかわらず、ARTによるウイルス抑制後もNK細胞の活性化は持続する(114)。しかし、サイトカインによって誘導されるIFN-γと活性化レセプターNKp44の発現も減少し、CD56bright細胞数はART中に観察されるT制御細胞数の減少と逆相関しており、自己反応性を示唆している(115)。対照的に、抑制性レセプターの相対的発現はART後に回復し、健常ドナーと同程度になるようである(82)。ARTにもかかわらず、HIVにおけるNK細胞の調節異常は、感染症の免疫病態の明らかな構成要素であり、後述する治療薬の多くが治療戦略の標的としている道である。
2.2 C型肝炎ウイルス(HCV)
C型肝炎ウイルス(HCV)はフラビウイルス科に属し、一本鎖RNAゲノムを持つ(116)。HCVは主に肝細胞に感染するが、マクロファージ、B細胞、T細胞などの肝外組織でも複製することがある(117)。HCV感染は多くの場合無症状であるが、慢性感染はしばしば肝線維化、重症の場合は肝硬変の発症を伴う(118)。
NK細胞反応に関しては、急性HCV感染時の血液中では、CD56bright NK細胞の相対的な有病率は増加し、CD56dim NK細胞の有病率はわずかに減少する(119)。さらに、両サブセットは、強いサイトカイン産生と細胞傷害活性を示しながら、活性化レセプターNKG2Dの発現をアップレギュレートすることが判明している。急性感染後、約25%の人は自然にウイルスを排除するが、大多数の人ではウイルスが持続し、慢性感染に至る(120)。HCVの自然治癒は、CD57とKIRレセプター(KIR2D、KIR3DL1、KIR3DL2)の発現が増加し、NKG2Aの発現が減少した、高度に分化したNK細胞の表現型と関連している(図3)(121)。さらに、NKp30の発現のような特定のNK細胞の表現型は、自然消退と関連している(122)。KIR2DL3やHLA-C1のホモ接合体もまた、自然消退と強く関連している(43)。抑制性レセプターNKG2Aおよび抑制性KIR2DL3の発現は、HCV慢性感染時に増加する一方で、NKp30およびNKp46の発現は健常対照と比較して減少することが判明している(123, 124)。さらに、HLA-B44、HLA-C12、KIR3DS1の保有は、HCVの自然消退の失敗と関連している(125)。全体として、自己クリアランスと成熟した機能的に活性なNK細胞の存在、および特異的KIRレセプターの有無との相関は、HCVの慢性化決定におけるNK細胞の関与を示唆している。
図3
www.frontiersin.org
図3 慢性HCV感染と比較して、自己クリアリングHCV感染はより高度に分化したNK細胞レパートリーと関連している。急性HCV感染後、2つの転帰が考えられる。およそ4分の1の症例ではHCV感染は自然治癒するが、およそ4分の3の症例では慢性化する。自然治癒した症例では、NKp30、CD57、KIRの発現が増加し、NKG2Aの発現が減少するなど、より分化したNK細胞の表現型が見られる。慢性HCV症例では、NKp46、NKp30、CD16のNK細胞発現が減少し、NKG2Aの発現が増加する。NKG2A阻害性シグナル伝達は、HCV感染におけるNK細胞疲弊の重要な原因であることが同定されている。
慢性HCV感染はまた、末梢血中のNK細胞総数、特にCD56dimサブセットの著しい減少とも関連しており(126, 127)、これは慢性HIV感染時に起こることと同様である。さらに、血液中のCD56bright NK細胞の相対的な割合は、サブセットの拡大とCD56dim NK細胞の減少の両方により、慢性感染中に増加するようである(128, 129)。例えば、CD56dim NK細胞サブセットは、慢性HCV感染時には血液中の全リンパ球の4.9%まで縮小し、健常対照者では9.0%であることが観察されている(123)。ある生体外研究において、細胞外HCVコアタンパク質はCD56ブライトNK細胞の頻度と相関していることが判明した。このことは、このタンパク質がNK細胞の分化を抑制し、よりナイーブなCD56ブライトNK細胞の有病率の増加を説明する一助となる可能性を示唆している(130)。このような直接的なウイルス制御は、組織ホーミングのような慢性HCV感染時の血中NK細胞サブセット有病率の変化の根拠となる他の説明とともに、さらなる研究が有益であろう。
肝臓のNK細胞は主にCD56brightサブセットであり、肝臓の線維化は、NKG2DやNKp46などの活性化レセプターの発現低下と関連している(131)。慢性HCV感染時には、IL-26が過剰発現することが判明している(132)。IL-26は最近、炎症性メディエーターとして同定されたサイトカインであり、傷害を受けた細胞から細胞外DNAと結合し、骨髄系細胞やリンパ系細胞の活性化を誘導する(133)。HCV感染時にIL-26が過剰発現すると、CD56bright NK細胞上のTNF関連アポトーシス誘導リガンド(TRAIL)の発現が上昇し、HCV感染肝細胞を殺す能力が高まる(132)。さらに、慢性HCV感染時には、肝内NKp44+ NK細胞の増加が観察されている(134)。これらの肝内NKp44+ NK細胞はTNF-αの強力な産生細胞であり、その頻度はHCV-RNAおよび線維化ステージの両方と正の相関があり、肝障害に関与している可能性を示している。また、肝硬変になると、循環NK細胞に対する肝常在NK細胞の相対的有病率が増加することが観察されており、HCV関連肝線維症へのNK細胞の関与がさらに示唆されている(135)。病態をより深く理解するためには、肝臓のNK細胞反応が肝線維化を媒介するのか、あるいはIL-10やその他の機序によって肝線維化を抑制しようとしているのか、さらなる研究が必要である。
機能的に言えば、HCV感染患者のNK細胞は、脱顆粒能とサイトカイン産生能が低下している(136)。感染が進行すると、NKG2D、NKp30、NKp46の発現が減少し、CD56neg NK細胞サブセットとNKG2Aの発現の増加が観察される(137)。残存するCD56dim NK細胞もCD16を発現するが、その程度は低く、ADCC能を制限している(128)。さらに、ヒト化マウスの肝細胞はQa-1(HLA-Eに対するマウス機能的ホモログ)をアップレギュレートしており、これは阻害性NKG2Aレセプターシグナル伝達を通じてNK細胞の疲弊に大きく寄与している(138)。さらに、抗NKG2A抗体は、マウスにおいてNK細胞のIFN-γ産生を回復させ、ウイルス複製を減少させることが示されており、NK細胞の疲弊におけるこの経路の相対的重要性を示している。このような免疫チェックポイント阻害剤については、後でさらに検討する。
直接作用型抗ウイルス(DAA)療法は、慢性HCV感染に伴うNK細胞レパートリーの変化の多くを正常化することが示されている。例えば、CD56dim NK細胞の有病率は増加し、CD56bright NK細胞サブセットの有病率は減少し、両者とも健常対照と同程度のレベルにまで回復する(139, 140)。DAAはまた、IL-12、IL-18、NKp30、NKp46、TRAILの発現の低下と同様に、末梢におけるNK細胞の活性化の低下とも関連している(139, 141)。このことは、DAA、ひいてはそれが引き起こすウイルス力価の低下が、NK細胞の活性化を低下させるという考えをさらに裏付けるものであり、また、治療によってNK細胞の活性化が低下することにより、肝障害の媒介にNK細胞が関与することを示唆している。
2.3 サイトメガロウイルス(CMV)
サイトメガロウイルス(CMV)はヘルペスウイルス科の一員で、大きな直鎖二本鎖ゲノムを持つ(142)。このウイルスは、上皮細胞、線維芽細胞、単球、マクロファージを含む様々な細胞に感染し、後に再活性化しやすい潜伏性貯蔵庫を形成する(143)。CMV感染におけるNK細胞の最も注目すべき特徴は、適応NK細胞としても知られるNKG2C+ CD57+メモリーNK細胞の拡大である(144-147)。これらの細胞は、NKG2Cを発現する表現型的に成熟したCD56dim NK細胞であり、急性感染後も持続する(148)。さらに、このNKG2C NK細胞集団は、抑制性KIR2DLレセプターを優先的に発現しており、これが機能性の向上に寄与していると報告されている(149)。CMV血清陽性もまた、NKp30の発現低下とNKp46の発現上昇と関連している(図4)(150)。
図4
www.frontiersin.org
図4 急性CMV感染とその後の再活性化は、NKG2C+メモリー様NK細胞の増加と関連している。これらの細胞は、表現型的に成熟しており、長期間持続し、機能的な潜在能力を示すことから、適応性NK細胞またはメモリー様NK細胞と呼ばれている。この集団はNKG2Cの発現によって表現型が規定され、CD57、NKp46、抑制性KIR2DLレセプターの高発現と関連している。
NKG2C+のCD56dim NK細胞の同様の拡大は、ウイルス性肝炎(B型肝炎とC型肝炎の両方)とCMVの同時感染時に観察されており、CMVに関連したNKG2Cの拡大は、他のウイルス感染の設定でも顕著であることを示唆している(151)。このNKG2C+メモリーNK細胞集団は、ADCCの能力が高く、TNF-αとIFN-γを産生する強力な能力を持つことが判明している(152)。前述したように、これらのNKG2C+ CD57+NK細胞は、CMV感染において、適応免疫系に匹敵する選択的増殖、持続性、および機能的能力を有することから、適応NK細胞と呼ばれている(153)。CMV感染による二次的なNKG2C+ CD57+NK細胞の出現と持続は、エピジェネティックな変化によって引き起こされると考えられている(154, 155)。
移植後にCMVの再活性化を経験した造血幹細胞移植(HSCT)レシピエントは、適応NK細胞の割合が同様に増加している(156)。これらの適応性NK細胞は、造血幹細胞移植後のレシピエントでは、少なくとも1年間は体内に存在する(157)。対照的に、CMV血清陰性のレシピエントは、比較的成熟度の低いNK細胞の集団を保持しており、おそらくこれらのレシピエントの防御効果は低いと考えられる。このことは、NK細胞が造血幹細胞移植後に最初に回復するリンパ球の一つであることを考えると、特に重要である(158)。CMV再活性化に関連したNK細胞のこのような増殖は、すべてのNK細胞サブセットの数の有意な増加とも関連しており、それはさらなるウイルス再活性化がなくても持続する(157)。さらに、CMV血清陽性のドナーから移植されたNKG2C+ NK細胞は、CMV再活性化時に機能が亢進する(159)。このことは、NKG2C+メモリーNK細胞も移植可能であり、治療法としての合理性があるという考えを支持するもので、さらなる研究が望まれる。
2.4 インフルエンザウイルスA(IVA)
インフルエンザA型ウイルスはオルソミクソウイルス科のウイルスで、8本の直鎖RNA鎖からなるセグメント化ゲノムを持つ(160)。さらに、ウイルスの侵入と排出をそれぞれ仲介する表面糖タンパク質である、発現するヘマグルチニン(HA)とノイラミニダーゼ(NA)に基づいて分類される(161)。インフルエンザウイルスは主に上気道および下気道の上皮細胞に感染し、重症例では急性呼吸窮迫症候群を引き起こすことがある(162)。
インフルエンザウイルスA(IVA)感染は、肺組織へのNK細胞の浸潤を誘導し、組織ホーミングのマーカーであるCXCR3、CXCR6、CCR5を発現するNK細胞数が有意に増加する(163, 164)。マウスでは、IL-15の遮断がこの浸潤を遅らせることから明らかなように、この浸潤はIL-15によっても部分的に制御されている(165)。重症感染症は、末梢血中のNK細胞の総数の減少、特にCD56ブライトNK細胞の減少に関連しており、CD69を発現するNK細胞の割合の増加によって明らかなように、NK細胞の活性化が顕著である(166, 167)。
全体として、NKp46を発現するNK細胞数は減少しているが、血液中のコアセプター2B4を発現する細胞数は増加しており、これらの細胞もまた、より高度な活性化を示している(168)。残りのNKp46発現NK細胞のうち、NKp46+ NKp44+NK細胞の割合が拡大する一方、NKp46+ NKp44-の割合は減少し、NK細胞の活性化に寄与している(169)。NKp46+のNKG2A+ NK細胞サブセットもIVA感染によって誘導されることがわかっている。このNK細胞のサブセットは、以前に暴露されたインフルエンザ抗原に再び遭遇すると、細胞傷害性の低下とIFN-γ産生の増加を示すという記憶表現型を示した(170)。インフルエンザはまた、NK細胞に直接感染してアポトーシスを誘発することができ、感染によってNK細胞の細胞傷害機能が阻害されることが示されている(171-173)。
肺では、組織常在NK細胞はNK細胞集団の10~25%であり、肺のNK細胞のほとんどは循環NK細胞であることを意味する(15)。肺組織常在NK細胞の大部分はCD16で、いくつかの研究では同様にCD56dimとCD56brightのサブセットに分けられている(15)。機能的には、CD56bright肺組織常在NK細胞サブセットは、ex vivoで他のNK細胞と比較して、IVA感染に反応して脱顆粒とIFN-γ産生が増加し、より高い機能性を示すと報告されている(174)。このサブセットの機能亢進の理論的根拠はよくわかっておらず、それがin vivoで反映されるかどうかも不明である。
IVAのHAとNAを発現する複製欠損型A型インフルエンザ偽型と共培養すると、NK細胞の異なる活性化が観察された(175)。特に、2009 H1N1と比較して、H5N1や1918 H1N1では、NKp46のダウンレギュレーションとともに、CD69、CD107a、IFN-γのより強固なアップレギュレーションが観察された(Fig. 5)(175)。より広く言えば、インフルエンザは、特にCD56ブライトNK細胞において、脱顆粒とサイトカイン産生の両方を誘導し、その活性化は宿主免疫に寄与するが、組織障害にも寄与する可能性がある(176)。例えば、高用量のA型インフルエンザウイルスに感染させたNK細胞欠損マウスでは、死亡率や疾病罹患率が低下しており、NK細胞応答がいかに有害であるかを示している(177)。逆に、病原性の弱いH9N2型鳥インフルエンザウイルスまたは高病原性H5N1型鳥インフルエンザウイルスに感染したニワトリのNK細胞応答を調べた研究では、病原性の低い鳥インフルエンザウイルスの方が、より強力に活性化されたNK細胞応答を誘導することがわかった(178)。このことは、インフルエンザにおける顕著なNK細胞反応は、必ずしもウイルスの病原性と関連しているわけではなく、防御的である可能性さえあることを示している。さらに、CD94の発現はインフルエンザの症状の重症度と負の相関があり、CD94を含むレセプターを介したシグナル伝達がIVA感染の制御に一役買っていることを示唆している(179)。全体として、インフルエンザウイルス間におけるNK細胞の反応の違いを明らかにし、どのような相関関係が有害な反応を予測するのかを明らかにするためには、さらなる研究が必要である。
図5
www.frontiersin.org
図5 異なるIVA PPとNK細胞を共培養すると、NK細胞の活性化が異なる。PBMCから単離したNK細胞を異なるIVAウイルスの偽型粒子(PP)と共培養したin vitro実験では、CD69、CD107a、IFN-γ発現の点でPP間に差のある活性化が認められた(139)。図に示した所見は、500 HAU/mL IVA共培養量に対応するものである。病原性の高い1918 H1N1およびH5N1 IVAウイルスをモデル化したPPは、病原性の低い2009 H1N1PPよりも大きな活性化を誘導した。このことは、IVA感染において、インフルエンザウイルス間の初期NK細胞活性化の差が、ウイルス間の病原性の差に関与している可能性を示唆している。IVAがNK細胞に感染して死滅させるために複製が欠損していない全ウイルスを用いて、この効果をin vivoで特徴づけるためには、さらなる研究が必要である。
NK細胞によって組織化されるIFN-γ応答は、感染において特に重要である。注目すべきことに、NK細胞の活性化とIFN-γ分泌の障害は、インフルエンザに対する細胞傷害性Tリンパ球活性の低下と関連している(180)。このことはマウスでも確認されており、NK細胞活性化後のIFN-γ産生の初期増加は、インフルエンザ感染時のCD8およびNK細胞における下流の細胞傷害性機能をもたらす(181)。NK細胞によって組織化されたこの強力なIFN-γ応答は、A型インフルエンザ感染時の胸腺萎縮にも関与しており、劇症化する可能性があることを示している(182)。
NK細胞の表現型やサブセットはほとんど変化しないが、患者はIFN-γの産生が増加し、刺激後の活性化が亢進することが示されている(183, 184)。しかし、インフルエンザワクチン接種は、CD56dim NK細胞の一部をメモリーNK細胞に誘導し、細胞内NKp46を発現させることから、ワクチン接種後にIFN-γ NK細胞応答が増強されるメカニズムの可能性がある(185)。これらのワクチン誘導メモリーNK細胞は、ワクチン接種後6ヵ月間持続するIFN-γ応答の亢進を示す。また、多価インフルエンザワクチンを接種したマウスのNK細胞は、ワクチンを接種していないマウスと比較して、グランザイムBとパーフォリンの発現量が多く、異種亜型インフルエンザ株でチャレンジされた後、より成熟した表現型になることが判明している(186)。このことは、インフルエンザワクチン接種によってNK細胞がプライミングされ、ワクチン由来の体液性免疫が苦手とする異型インフルエンザ株に対しても、より高い防御を提供できるようになるという考えを再び支持するものである。他のワクチンによって誘導されるNK細胞集団の変化については、まだ十分に研究されておらず、免疫の相関としてワクチンによって誘導されるこれらのNK細胞の表現型の変化を調べることは、もっと注目されるべきことである。
2.5 SARS-CoV-2
SARS-CoV-2はコロナウイルス科に属し、大きな一本鎖RNAゲノムを持つ(187)。このウイルスは主に気道のACE2+細胞、特にII型肺胞肺細胞に感染し、重症例では急性呼吸窮迫症候群を引き起こすことがある(188)。重症のCOVID-19疾患は、血液中のCD56+ CD16+ NK細胞の著しい減少と関連している(189-191)。この循環NK細胞の減少は、急性SARS-CoV-2感染と相関しており、疾患の重症度と関連している(192, 193)。入院患者では、NK細胞数はウイルス量の減少スピードと直接相関している。例えば、血液中のNK細胞数が正常な患者は、NK細胞数が少ない患者と比較して、ウイルス量の減少が早かったことから、循環NK細胞が成人患者におけるCOVID-19の重症度と転帰の予後臨床マーカーとなる可能性が示唆された(194)。COVID-19後に患者が回復すると、循環NK細胞数は正常に戻る。長期のCOVID-19に罹患した患者では、症状が続いているにもかかわらず、NK細胞数は回復している(195)。COVID-19感染から4~6週間後に起こる重篤な感染後合併症である小児多系統炎症症候群(MIS-C)では、CD56dim NK細胞数も減少している(196)。
COVID-19の間、NK細胞は強力に活性化され、それはCD69と増殖マーカーであるKI-67の発現の増加によって証明される(192)。CD94とキラー細胞レクチン様レセプターG1をそれぞれコードする遺伝子KLRD1とKLRG1の発現もまた、多くの患者で減少し、NK細胞の活性化に寄与していることが指摘されている(197)。
SARS-CoV-2感染もまた、NKG2Cの発現の増加と関連しており、先に述べたメモリーNK細胞と同様の集団を形成している(192, 198)。興味深いことに、適応性NK細胞を持つ患者では、検出可能な循環CMV DNAはみられなかったことから、重症COVID-19患者における適応性NK細胞の拡大は、COVID-19による二次的なCMV再活性化とは無関係である可能性が示唆された。SARS-CoV-2そのものが適応NK細胞の増殖を促進するのか、あるいは炎症性サイトカインの産生によって促進されるのかは、まだ明らかにされていない。長COVID-19に罹患した患者では、CD57+ NKG2C+メモリーNK細胞のレベルが増加している。これらは、長COVID-19を発症しやすいことを予測する上で重要な変数のひとつである。しかしながら、メモリー様NK細胞の個体数が増加したにもかかわらず、そのエフェクター機能は低下したままであった(195)。
パーフォリンやグランザイムAのような細胞傷害性エフェクター分子の発現も、ほとんどのCOVID-19症例で有意に増加している(189, 199, 200)。これらの細胞傷害性エフェクターが発現上昇する一方で、COVID-19患者のNK細胞は脱顆粒能と細胞傷害性が低下していることが示されている(201)。さらに重症例では、NK細胞が産生するTNF-αとIFN-γの量が減少している(202-204)。抑制性KIRおよびNKG2Aレセプターは、COVID-19の間にアップレギュレートされることが分かっており、NK細胞の疲弊に寄与している可能性が高い(205, 206)。NKG2Aもまた、急性の重症COVID-19患者では高度にアップレギュレートされるが、軽症および中等症の患者では、感染症が消失した後にNKG2Aの回復が見られる(198)。NK細胞の著しい消耗は、プログラム細胞死タンパク質1(PD-1)、リンパ球活性化遺伝子3(LAG-3)、TIGITの発現頻度の増加、NKG2Dの発現頻度の減少によってさらに裏付けられている。しかし、NK細胞におけるPD-1の発現レベルは疾患の重症度とは相関していない(203, 204)。一方、TIGITとDNAM-1の発現低下はウイルスクリアランスの遅さと関連している(207)。全体として、組織ホーミングの問題とは対照的に、COVID-19におけるNK細胞の機能低下の原因が疲労にどの程度あるのかを確認するためには、さらなる研究が必要である。
感染はCD56dim CD16neg NK細胞集団の拡大にも関連しており、このNK細胞集団は標準的なCD56dim CD16+ NK細胞サブタイプに比べて細胞傷害能が低下している(図6)。また、CD56dim CD16neg NK細胞はSARS-CoV-2の初期に拡大し、軽症例や中等症例では減少するが、重症のCOVID-19症例ではこのサブセットが拡大し続けることが示されている(208)。この研究はまた、CD16の消失がこれらの細胞でAdam17を介した切断によって媒介されている可能性を示唆している(208)。MIS-Cでは、CD16+NK細胞の有病率が減少していることが研究で示されており、MIS-CではNK細胞のADCC機能が低下していることが示唆されている(200)。しかし、MIS-CにおけるNK細胞の機能を、単なる免疫表現型分類を超えて直接的に調べるためには、さらなる研究が必要である。
図6
www.frontiersin.org
図6 SARS-CoV-2の重症化は、血液中のCD56+ CD16+ NK細胞数の有意な減少と関連している。CD56+ CD16+ NK細胞の減少は、ADAM17によって触媒されるCD16の脱落によるものである。この結果、細胞傷害性の低いCD56+ CD16-NK細胞が蓄積し、重症の場合はADCCに関与する能力が損なわれる。CD16は標的細胞に付着した抗体と結合することでADCCを仲介し、最終的に脱顆粒をもたらす。
致死的なCOVID-19症例では、患者はパーフォリン、グランザイムA、KI-67の発現が低下しており、NK細胞の細胞傷害活性の欠損が罹患率や死亡率の上昇に関係していることが示唆された(209)。これを裏付ける観察として、重症のCOVID-19ではNK細胞を介したADCCが障害されているようである(210)。COVID-19感染では、TGF-βシグナル伝達がNK細胞のエフェクター機能の著しい低下と関連しており、患者血清がTGF-β依存的にNK細胞の細胞傷害性を阻害することが判明している(194)。同様に、IFN-γ産生の障害もTGF-β依存的に起こるようである(211)。このことは、TGF-βシグナル伝達がCOVID-19におけるNK細胞の調節障害と消耗に大きく寄与していることを示唆している。
3 NK細胞治療薬
NK細胞の表現型とレパートリーには広範な変化があり、ウイルス感染ではしばしばNK細胞の疲弊とNK応答の調節不全につながることから、NK細胞の機能を促進することを目的としたいくつかの治療アプローチが研究されている。NK細胞関連の治療法の大半は、がん生物学の領域に由来するものであり、ウイルス性疾患の文脈で研究されるようになったのはごく最近のことである。
3.1 TGF-β阻害剤
治療用TGF-β阻害剤の開発は、がん、心血管系疾患、線維症の発症に異常なTGF-βシグナル伝達が関与していることに大きく起因している。治療薬として、TGF-β阻害剤は、小さなエフェクター薬から、TGF-β経路構成成分の多様なホストを標的とするブロック抗体まで、多種多様な構造を持つ(212, 213)。HIV感染におけるTGF-βシグナル伝達は、転写抑制因子Blimp-1をアップレギュレートすることによって潜伏期を促進することが証明されている(214, 215)。TGF-βタイプI受容体阻害剤であるGalunisertibは、SIV感染アカゲザルに投与され、SIV潜伏リザーバーの再活性化を増加させ、その後のSIVに対する免疫反応を増強することが示された(216)。SARS-CoV-2感染時のTGF-βシグナル伝達もまた、その後のウイルス病原体形成に寄与する機能的活性を制限するNK細胞の調節異常と関連しており(194, 217)、TGF-β阻害剤が急性ウイルス感染症にも適用される根拠があることを示している。
大まかに言えば、TGF-βシグナル伝達は、IL-15によるmTOR経路の活性化を制限することによって、部分的にNK細胞の細胞傷害機能を損なうことが示されている(218)。さらに、TGF-β受容体サブユニットTGF-βRIIの欠失は、IL-15に対するNK細胞の細胞傷害機能を促進し、2つの異なるマウス腫瘍モデルにおいて転移を制限するNK細胞の能力を高めることが示されている(218)。NK細胞の細胞傷害機能とIFN-γのような炎症性サイトカインの分泌を阻害することによって、TGF-βが過剰なNK細胞の活性化を抑制する上で重要な役割を果たしていることは注目に値する。TGF-β阻害剤の試験においては、NK細胞過敏症のリスクと、それに続く炎症性環境およびこれが誘発する組織損傷を考慮すべきである。しかしながら、TGF-βシグナル伝達がNK細胞の調節障害に明らかに寄与していること、そしてこのシグナル伝達を抑制することでNK細胞の細胞傷害性が実際に有益に促進されるという証拠を考慮すると、TGF-β阻害剤をウイルス感染症の治療薬として使用する可能性について、さらなる検討が必要である。
3.2 免疫チェックポイント阻害剤
NK細胞の調節異常の重要な構成要素は、阻害経路によって引き起こされる疲弊である。これらの阻害経路は免疫チェックポイントと呼ばれており、免疫チェックポイント阻害剤は、免疫機能を維持するために、これらの経路を阻害するために開発された(219)。
NKG2AはほとんどのNK細胞に発現する重要な抑制性レセプターであり、NK細胞の免疫チェックポイントと考えられている。モノクローナル抗体モナリズマブのようなNKG2A阻害剤は、NK細胞やCD8細胞の活性を増強することにより、扁平上皮癌の治療において抗腫瘍免疫を促進することが判明している(220)。モナリズマブはまた、マウスの大腸がん(221)やHLA-E+白血病およびリンパ腫(222)に対しても同様の効果を示した。NKG2A遮断モノクローナル抗体はウイルス性肝炎の治療にも有望であり、患者の培養NK細胞は細胞傷害性の亢進を示した(223)。同様に、NKG2A遮断モノクローナル抗体は、HCV感染時にNK細胞によるIFN-γの産生を回復させることが示されており、CD8 T細胞の消耗の減少に関連している(138)。この治療法は、NKとCD8 T細胞の消耗がNKG2Aの発現の増加によって部分的に引き起こされることから、COVID-19の治療にも応用できる根拠がある(205, 224, 225)。
阻害性KIRレセプターを標的とする抗体もまた、NK細胞関連の免疫チェックポイント療法として登場した。阻害性KIR(KIR2DL-1、KIR2DL-2、KIRT2Dl-3)を標的とするIPH2101と名付けられたそのようなKIR阻害剤は、最近第1相試験が実施され、安全性と忍容性が認められ、ex vivoアッセイでは多発性骨髄腫に対するNK細胞細胞傷害性の増大が示された(226)。しかし、IPH2101 の第 2 相試験は臨床的有効性の欠如のため中止され(227)、同様に、別の抗 KIR 抗体である lirulumab(KIR2DL-1、KIR2DL-2、KIRT2Dl-3 を標的とする)の試験も客観的奏効基準を満たせなかったため中止された(228)。IPH2101 はまた、多発性骨髄腫に対する試験で抗腫瘍薬レナリドミドと併用され、初期のデータから相乗効果が期待できることが示唆されているが、さらなる試験が必要である(229, 230)。この研究で強調されたように、免疫チェックポイント阻害剤の重要な利点は、他の治療薬と容易に併用できることである。IPH2101は急性骨髄性白血病でも試験され、早期からTNF-αとCD69のアップレギュレーションが検出された(231)。KIR3DL2を標的とするIPH4102という別の抗KIR抗体も再発難治性皮膚T細胞リンパ腫で試験され、試験参加者の36.4%に有望な臨床効果をもたらす可能性が示された(232)。KIR阻害剤のウイルス感染症での試験はほとんど行われていないが、特にHIV感染症では、HIVウイルス血症が阻害性KIRレセプターの発現増加と関連しているため、研究が必要である(82)。
PD-1シグナル伝達は、T細胞疲弊の特徴として、また癌における免疫逃避の一因として関与しており、もう一つの重要な免疫チェックポイントと考えられている(233, 234)。PD-1シグナル伝達は、多発性骨髄腫(235)、腎細胞癌(236)、カポジ肉腫(237)のNK細胞にとって重要であることが示されており、NK細胞の疲弊に寄与している(29)。PD-1チェックポイント阻害剤は、ペムブロリズマブ、ニボルマブ、セミピリマブなど数種類がFDAに承認されており、これらは多様な癌で臨床試験されている(238)。PD-1の有意な発現は、慢性HIV(239)、HCB(240)、HCV(241)、インフルエンザ(242)、SARS-CoV-2(243)で示されており、同様の網羅的効果がある。
マウスのインフルエンザチャレンジモデルでは、PD-1阻害剤がCD8 T細胞の機能を高め、ウイルスクリアランスを早めることが示された(244)。SIVに感染したアカゲザルでは、PD-1の遮断は良好な忍容性を示し、血液と腸における機能的なSIV特異的CD8 T細胞の拡大とメモリーB細胞の拡大をもたらし、これらすべてがウイルス量の低下と生存期間の延長に関連していた(245)。同様に、CD4+ヒト化マウスでは、PD-1遮断はHIVウイルス量の低下とT細胞数の増加と関連していた(246)。HBVにおいても、PD-1遮断はCD8+T細胞の拡大とIFN-γとIL-2の分泌を再び促進することが示されている(247)。重要なことは、急性熱性マラリア時のNK細胞におけるPD-1のアップレギュレーションは、ADCCの亢進と関連しているが、そうでなければ、脱顆粒は減少していることである(248)。この所見は、NK細胞に対するPD-1遮断の影響は、CD8 T細胞の機能よりも、機能的活性に対する影響という点で、より微妙なものである可能性を示唆している。全体として、PD-1遮断がこれらのウイルス感染症におけるNK細胞集団に与える影響を明らかにするためには、さらなる研究が必要である。しかし、CD8 T細胞の反応だけをみても、PD-1遮断が有望な治療法であることは明らかであり、感染症においてさらなる検討が必要である(249)。
3.3 養子NK細胞療法
もう一つの治療法は、外因性NK細胞の投与である。その目的は、ウイルスが介在するNK細胞の機能障害や消耗時に、NK細胞の機能活性を補うために、機能的に無傷な細胞を供給することである。同種NK細胞の投与は、白血病の治療に安全かつ効果的に用いられている(250)。外因性NK細胞の投与はまた、非小細胞肺癌(251)、プラチナ抵抗性卵巣癌(252)、メラノーマ(253)、腎細胞癌(253)の治療においても臨床効果を示している。感染症における養子NK細胞療法の研究はほとんど行われていない。SARS-CoV-2やHIV-1では、細胞傷害性と持続性が増強されるため、適応性NK細胞の注入も考慮される(198)。
最近、人工多能性幹細胞(iPSC)由来の遺伝子操作NK細胞株が出現した。これらの細胞における遺伝子編集には、非可溶性CD16aレセプター、膜結合型IL-15/IL-15R融合タンパク質、補酵素CD38のノックアウトなどがあり、投与後のNK細胞の持続性と機能を促進する(254)。HIVに関しては、ヒト胚性幹細胞由来の同種NK細胞が、ヒト化マウスにおける急性感染時のHIV複製を減少させ、潜伏期の逆転と組み合わせることでHIVリザーバーを減少させることが示されている(255, 256)。さらに、ハプロアイデンティカルNK細胞をHIV感染ART抑制患者にIL-2またはN-803(IL-15スーパーアゴニスト)の支持療法と組み合わせて注入する安全性第1相試験が終了している(NCT03346499、NCT03899480)。
SARS-CoV-2に対する治療薬として、初代NK細胞やiPSC由来のNK細胞、あるいは "市販の "NK細胞を用いた臨床試験が行われており、養子NK細胞移植が急性ウイルス感染症に対する有効な治療法である可能性が示唆されている。この例として、FT516と呼ばれるIPSC由来のNK細胞株を低酸素状態のCOVID-19患者に投与し、その安全性と最大耐容量を評価した第1相試験がある。この試験(NCT04363346)の結果は間もなく発表される予定である。これらを総合すると、外因性NK細胞を利用することの安全性が実証されたことに加え、ウイルス感染症、特にHIVの治療に有効である可能性を示唆する予備的知見が得られたことから、さらなる調査が必要である。
3.4 サイトカイン刺激とサイトカイン誘導性メモリー様NK細胞
生体内で、また外因性NK細胞の養子移入の前に、NK細胞の抗ウイルス機能を増強するアプローチが注目されている。腫瘍学では、IL-12、IL-15、IL-18など、NK細胞の拡張と成熟を促進する能力を持つ多くのサイトカインが、NK細胞の機能不全の治療に用いられてきた(257-259)。SARS-CoV-2に関連して、COVID-19に関連した急性呼吸窮迫症候群(ARDS)における低用量IL-2の有効性を検討する第2相臨床試験が終了した(NCT04357444)。IL-15で処理し、不活化全インフルエンザウイルスで刺激したNK細胞は、IL-15で処理しなかった場合と比較して、より旺盛なNK細胞応答を示すことが示された(260)。HIVでは、IL-15で刺激されたNK細胞は、一様に改善されたエフェクター機能を示し、潜伏期間逆転薬で処理されたHIV感染細胞を殺す能力を示した(261)。
IL-12、IL-15、IL-18もまた、転写、エピジェネティック、代謝のメカニズムを通じてNK細胞に変化を誘導し、最終的に細胞傷害性を高めてメモリー様行動をもたらすことから、特に注目されている(262)。サイトカイン誘導記憶様(CIML)NK細胞は、細胞分裂を何度も繰り返した後でも、IFN-γ応答の増加に加えて、想起応答の増強も示している(263, 264)。また、NKG2C、NKG2A、CD69、CD94の発現が増加しているが、CD57やKIRレセプターの発現は増加していない(263)。CIML NK細胞はエフェクター機能が高く、比較的容易に作製できるため、特に骨髄性悪性腫瘍、多発性骨髄腫、頭頸部扁平上皮癌を対象として、これらの細胞の養子移入に関する広範な研究が行われている(262)。例えば、リンパ球減少化学療法を受けている骨髄性悪性腫瘍患者に500万から1000万細胞/kgを注入すると、CMVの再活性化とは無関係にNK細胞が10倍から50倍に増加し、数ヵ月間持続した(265)。養子移入されたCIML NK細胞に関する他の第1相試験でも、臨床効果が報告されている。急性骨髄性白血病を対象としたある研究では、9例中5例に臨床効果が認められ、うち4例は完全寛解であった(259)。別の研究では、8例中4例に完全寛解が認められ(266)、N-803を3週間投与した別の研究では、28日目までに87%の完全寛解が得られた(267)。CIML NK細胞の養子移入は、ウイルス感染症の治療法としてはまだ十分に研究されておらず、特にHIVを対象とした前臨床研究が優先されるべきである。
3.5 IL-15スーパーアゴニスト療法
NK細胞のエフェクター機能に対するIL-15刺激の前述の利点により、in vivoでIL-15シグナル伝達を増強する新規アプローチが研究されてきた。そのような治療法の一つがIL-15スーパーアゴニストALT-803である。SIV陽性のアカゲザルでは、N72D変異IL-15分子をα受容体に結合させたIL-15スーパーアゴニストであるALT-803(現在はN-803)と、IL-15活性を増加させるように設計されたヒトIgG1フラグメントから構成され、末梢血中のNK細胞集団を増加させ、ウイルス量を減少させることが示された(268)。SHIVに感染したアカゲザルでは、N-803がウイルス特異的CD8+T細胞とNK細胞のB細胞濾胞への移動を媒介することが示されたが、潜伏期の逆転は観察されなかった(269)。N-803の最近の第1相臨床試験では、この分子はARTが抑制されたHIV感染者においても安全で忍容性があることが示された。さらに、N-803はCD8+ T細胞およびNK細胞の活性化、HIV RNA発現の誘導と関連しており、同時にリンパ組織におけるHIV DNAの経時的な減少を示した(270)。前述の前臨床試験および第1相試験の有望な結果を受け、HIVリザーバーに対するこれらの分子の効果を検証するための今後の臨床試験が必要である。
3.6 NK細胞エンゲイジャー
上述したように、ウイルス感染、特にHIVは、感染細胞が発現する活性化受容体と抑制受容体を操作することにより、NK細胞によるウイルス感染細胞の自然認識を阻害し、免疫反応を回避することができる(82, 86, 87, 90-95)。広範中和抗体(bnAbs)はウイルス制御に関与することが確認されており(271)、治療や予防戦略として用いられている(272, 273)。
さらに、HIV感染リスクの統計学的に有意な減少を示したRV144 HIVワクチン試験(274)では、リスク減少の相関因子の一つとして、HIV ENVタンパク質のV1V2ループを標的とするIgG抗体の増加が認められた(275, 276)。その後の解析で、これらのIgG抗体はFcを介したNK細胞のADCC機能を誘発することが示された(277、278)。これらのデータは、非中和抗体が効果的なFc-エフェクター機能を媒介することにより、HIV防御に一役買っていることを示唆している(279-281)。さらに、HIVに対するNK細胞を介したADCCは、NK細胞の機能障害にもかかわらず、HIV制御の重要なメカニズムとして注目されている(282-284)(75, 113)。しかし、HIV特異的bnAbsの主な懸念は、HIVが急速に変異し、bnAbを介した中和から逃れる可能性があることである(285-288)。さらに、一般にIgG1アイソタイプのbnAbの大部分は、中和能力は高いが、Fcエフェクター機能はIgG3アイソタイプに比べて劣る(289-291)。
NK細胞を介した殺傷のための有望な戦略として、低分子の設計がある。この分野では、NK細胞上の活性化レセプターに結合するNK細胞エンゲイジャー(NKCE)、Bi-およびTri-特異的キラー・エンゲイジャー(BiKEsおよびTriKEs™)、ならびに多特異的抗体ベースの構築物(ANKETおよびStitchMabs)の開発により、大きな進歩を遂げている(292-297)。簡単に説明すると、TriKEs™はCD16受容体に直接結合する抗CD16関与分子で構成され、フレキシブルリンカーを介してIL-15分子に結合し、さらにリンカーを介して抗原関与分子に結合し、目的の抗原を標的とする(298)。同様に、BiKEは、類似の抗CD16関与分子が、類似の抗原関与分子とリンカーを介して結合したものである(298)。ANKETコンストラクトは、NK細胞レセプター、一般的にはNKp46を標的とするFabと、目的の抗原を標的とする別のFabから構成される(292)。前述したように、ANKET分子は、1つまたは2つの異なる抗原に2価の結合を示すように作製することもできる(292)。さらに、T細胞ベースのナノ・エンゲイジャーも、二重特異性T細胞エンゲイジャー(BiTE)(299)、二重親和性リターゲッティング抗体(DART)(300、301)という形で開発されているが、これは本総説の範囲外であり、ここではこれ以上論じない。
HIV感染に対するこれらの治療法を考えてみると、上記のNK細胞エンゲージャーの多くは、NK細胞エンゲージメント分子としてNKp46かCD16のいずれかを使用している。しかし、HIV感染中のNK細胞は、活性化受容体と抑制受容体の発現が調節され、調節不全に陥っている。重要なことは、HIV感染時のNK細胞の機能障害にもかかわらず、NK細胞は依然としてCD16の発現を保持しており、ADCCを媒介できることである(82)。したがって、NKの機能不全、CD16の保持、HIVと闘うためのFcを介したエフェクター機能の重要性を考えると、これらを利用した戦略は有望である。最近、CD16相互作用を介してNK細胞に直接結合する低分子が開発された(302)。これは、以前にがんを標的とするために設計されたBiKEおよびTriKE™構築体を利用することによって達成された(303-308)。
これらの分子は、Fcを介するエフェクター機能で生じる潜在的な問題を軽減しながら、複数のウイルス感染に対する様々な抗原の標的化を可能にする。さらにIL-15分子は、NK細胞の持続、拡大、活性化を誘導する(257)。現在、VRC01 bnAbのHIV結合領域を用いたBiKE構築体が作製されている。このVRC01 BiKE構築物は、HIV感染細胞株HIV-IIIBとACH-2には結合するが、非感染細胞株H9やCEMには結合しないことが示された。さらに、このVRC01 BiKEは、CD107a発現による脱顆粒、IFN-γおよびTNF-αサイトカイン産生によって評価される効果的なNK活性化と、それに続くこれらのHIV感染細胞に対する殺傷を媒介した(309)。現在、VRC01結合領域と他の既知のHIV bnAb結合領域を利用したTriKE構築物の作製と試験が進行中である。
しかし、HIVはbnAbを介したウイルス制限から逃れることができるため、新規治療薬の開発においては、その幅の広さが重要な考慮点となる。重要なことは、すべてのHIV亜種は、細胞表面への最初のgp120結合にCD4レセプターを利用しなければならないということである(310)。したがって、新規治療薬のHIV結合領域としてCD4レセプターを用いれば、HIVのエスケープを克服できる可能性がある(285)。しかし、このレセプターは多くの細胞で使用される天然に存在するレセプターであるため、自己標的化を誘発しないよう、設計には慎重な配慮が必要である。この分野ではすでに広範な研究が行われており(311-313)、mD1.22と名付けられたCD4細胞外ドメイン1(CD4ECD1)分子は、強力なHIV中和作用を持ち、MHCクラス2への結合がほとんどないことが同定されている(314)。CD16結合能を持つBiKEコンストラクトにデザインすると、NK細胞の脱顆粒を誘導し、HIV標的細胞を死滅させた(315)。現在、CD4ECD1 TRiKEが開発・試験中である。さらに、これらのTriKEは、チェックポイント阻害剤治療(308)、あるいは他のサイトカインに基づく戦略や養子NK移植戦略と併用することができ、ウイルス感染と闘うための併用療法に、これらのNK細胞エンゲージャーの大きな可能性を強調している。
3.7 CAR NK細胞
キメラ抗原受容体(CAR)細胞は、長年がん分野で普及してきたもう一つの有望な治療法であり、現在ではウイルス性疾患の潜在的治療法として研究され始めている。CAR NK細胞はCAR T細胞よりも安価で、サイトカインストームを起こしにくいため、多くの研究者がCAR NK細胞の作製に着手している(316)。そのような例のひとつに、IL-15を分泌し、SARS-CoV-2スパイクタンパク質を標的とする細胞外ACE2ドメインを持つCARを発現するCAR-NK細胞療法があり、in vitroでSARS-CoV-2に対して有望視されている(317)。現在、重症のCOVID-19患者を治療するために、表面にACE2を発現するCAR NK細胞を試験する別の臨床試験も進行中である(NCT04324996)。
CAR NK細胞は現在、HIVを治療する臨床試験にも使用されている(318)。HIVの場合、CAR-NK細胞は主にHIVエンベロープ糖タンパク質gp160の単一エピトープを標的としてきた。最近、より広い範囲のgp160を標的とする万能型CAR-NK細胞が開発され、より高い活性化とHIV感染ヒトCD4+ T細胞を殺す能力が示された(319)。議論されている治療薬の概要を図7に視覚的に示す。
図7
www.frontiersin.org
図7 ウイルス感染時のNK細胞調節不全に対処しようとするいくつかの新しい治療薬の視覚的概要。(A)TGF-βシグナルはmTOR経路を阻害し、その結果NK細胞のエフェクター機能が損なわれることが示されている。TGF-β阻害剤の使用は、mTORシグナル伝達を促進し、ひいてはNK細胞の活性を促進する。(B)免疫チェックポイント阻害剤は、NK細胞の疲弊を引き起こしている抑制性シグナル伝達を減少させることができる。例えば、NKG2A阻害剤であるモナリザブ(Monalizumab)は、NK細胞の活性化とエフェクター機能へのシフトに寄与する阻害性NKG2Aをブロックすることができる。(C)養子NK細胞療法は、免疫反応を補うために外因性NK細胞を投与する。(D)N-803はIL-15受容体融合タンパク質と結合した変異型IL-15分子からなるIL-15スーパーアゴニストである。N-803の投与はNK細胞の増殖と成熟を促進する。(E)NK細胞エンゲージャーの一例は、抗原連結分子に連結されたIL-15分子に連結されたCD16エンゲージ分子からなるTRiKE™構築物である。TRiKE™がNK細胞のCD16分子に結合すると活性化が誘導され、一方IL-15は増殖と成熟をサポートする。抗原連結分子は、目的の抗原を標的とするように設計されている。(F)CARレセプターの細胞外抗原認識ドメインにより、CAR NK細胞は目的の抗原を産生する細胞を特異的に標的とすることができます。CAR NK細胞は、CAR T細胞よりも少ないリスクで、疲弊したNK細胞応答を補うために投与することができる。
4 ウイルス感染時のNK細胞治療の展望
上述したように、NK細胞の調節異常を改善するために、TGF-β阻害剤、養子細胞療法、サイトカイン療法、NK細胞エンゲイジャー、CAR NK細胞など、いくつかの治療法が登場してきた。これらの治療薬の多くは、主にがんを対象として試験されてきたが、ウイルス感染においてNK細胞の機能を維持・回復させる可能性のある治療薬として、さらなる注目に値する。さらに、これらの治療薬を他の治療薬と併用することで、相乗効果が期待でき、特に有益であることが証明されるかもしれない。
KIRファミリーのようなNK細胞レセプターやHLAのようなリガンドには広範な遺伝的差異が存在するため(31-33, 37)、レセプターやリガンド遺伝子の個人的レパートリーによって、これらの治療薬の有効性にも大きな違いがあると考えられる。IPH4102のようなKIRチェックポイント阻害剤は、その最も明確な例の一つである。個人のKIRレパートリーには大きなばらつきがあるため、治療に対する反応も患者間で非常にばらつきがあり、臨床的な反応を示すのは一部の患者だけである(232)。他のNK細胞レセプターやリガンドにも遺伝的なばらつきがあるため、ここで取り上げた他の治療薬にも同様の反応のばらつきが予想される。もう一つの考慮点は、これらの治療薬の多くが、NK細胞の細胞傷害作用や炎症性サイトカインの分泌を増強することによって、組織障害や炎症亢進状態を助長する危険性もあるということである。とはいえ、このリスクと可能な治療効果との間にはバランスがあることが証明されるかもしれない。
5 結語
NK細胞はウイルスのチャレンジに早期に対応する上で重要な役割を果たすが、その調節が異常になることもある。この調節異常は、活性化または抑制性レセプターの有病率の変化、サブセットの有病率における相対的成熟、機能的エフェクタータンパク質の発現、あるいは個人のレセプターやHLAの遺伝的産物のいずれに関係するものであれ、効果的な抗ウイルス応答を行う能力を制限する。例えば、慢性のHIVやHCV、そして急性のSARS-CoV-2においては、末梢血中のCD56+ CD16+ NK細胞の総有病率が先天的に減少し、それに伴ってNK細胞の消耗が著しく増加する。これとは対照的に、ウイルス感染に対するNK細胞の異常な活性化は、一部のインフルエンザウイルスに見られるように、過剰な組織損傷を媒介することによって、ウイルス性疾患の病因に直接寄与することもある。
病態と相関するNK細胞レパートリーの特徴を明らかにする重要な研究がなされてきた一方で、in vivoでのNK細胞集団の変化をもたらすシグナル伝達環境の解明については、あまり研究がなされてこなかった。議論したように、TGF-βのようなサイトカインがNK細胞の表現型や機能を変化させることは知られているが、疾患特異的なNK細胞レパートリーをもたらすシグナル伝達の全体像については、より広範な特徴づけが必要である。このことは、HLAやKIRレセプターファミリーのような重要なレセプターファミリーの両方に存在する広範な遺伝的変異を考慮すると、特に当てはまる。NK細胞レパートリーにおける遺伝的変異の大きさと、それに伴うNK細胞レセプターとそのリガンド間の親和性の違いは、NK細胞レパートリーと疾患との関係を解明することを極めて困難にしている。要するに、NK細胞反応の状態は、これらのレセプターとそのリガンドの相対的な発現によって決定されるのではなく、その遺伝的内容と、それが作り出すレセプターとリガンドの相対的な親和性によって決定されるのである。このような限界にもかかわらず、ウイルス感染に伴うNK細胞のレパートリーと活性の変化に対処しようとする治療薬を試験する前臨床および臨床の初期研究は、依然として有望である(図8)。
図8
www.frontiersin.org
図8 ウイルス感染におけるNK細胞治療薬の使用を支える論理のシェーマ。多くのウイルス感染は、レセプターの発現やサブセットの優勢という点で、NK細胞のレパートリーの変化と関連しており、その結果、NK細胞の機能性が変化する。NK細胞レパートリーにおける特定の変化は、病態と闘うために機能性を変化させる治療的調節の標的とすることができる。例えば、慢性HCVはNKG2Aの発現の著しい増加と関連しており、最終的にはNK細胞の疲弊と抗ウイルス反応の減弱に寄与する。NKG2A遮断薬の投与は、抗ウイルス免疫を促進するエフェクター機能の回復を助けるために、抑制性シグナル伝達を妨害する。
著者貢献
JB:構想、調査、プロジェクト管理、監督、執筆(原案)、執筆(校閲・編集)。JD:執筆-原案、執筆-校閲・編集。RC:執筆-原案、執筆-校閲・編集。GH: 執筆-校閲・編集。JR:構想、監修、執筆-原案、執筆-校閲・編集。
資金提供
著者は、本論文の研究、執筆、および/または発表のために金銭的支援を受けたことを表明する。本研究はNCATS UL1TR002494(JD)の支援を受けた。
謝辞
図作成に使用したBioRenderに感謝する。
利益相反
著者らは、本研究が利益相反の可能性があると解釈されるような商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
参考文献
Vivier E, Tomasello E, Baratin M, Walzer T, Ugolini S. ナチュラルキラー細胞の機能。Nat Immunol (2008) 9(5):503-10.
PubMed Abstract|全文|Google Scholar
Wu Y, Tian Z, Wei H. サイトカインによるナチュラルキラー細胞の発生および機能制御。論文タイトル:Front Immunol (2017) 8:930.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Biron CA, Byron KS, Sullivan JL. ナチュラルキラー細胞のない青年における重症ヘルペスウイルス感染症。N Engl J Med (1989) 320(26):1731-5. doi: 10.1056/NEJM198906293202605
PubMed Abstract|全文|Google Scholar
オレンジJS. ヒトナチュラルキラー細胞の欠損。Curr Opin Allergy Clin Immunol (2006) 6(6):399-409.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
オレンジJS. ナチュラルキラー細胞欠損症。J Allergy Clin Immunol (2013) 132(3):515-25. doi: 10.1016/j.jaci.2013.07.020.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Yu J, Freud AG, Caligiuri MA. ナチュラルキラー細胞の発生場所と細胞段階。トレンド免疫学(2013)34(12):573-82。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Cooper MA, Fehniger TA, Caligiuri MA. ヒトナチュラルキラー細胞サブセットの生物学。この論文では、ヒトのナチュラルキラー細胞サブセットの生物学的特徴について解説している。
PubMed Abstract|クロスリファレンス全文|Google Scholar
CD56bright ナチュラルキラー(NK)細胞:重要なNK細胞サブセット。免疫学 (2009) 126(4):458-65.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Carson WE, Fehniger TA, Caligiuri MA. CD56ブライトナチュラルキラー細胞サブセット:インターロイキン2およびc-kitリガンドに対する別個の機能的応答の特徴づけ。Eur J Immunol (1997) 27(2):354-60。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
CD56bright human NK cells differentiate into CD56dim cells: role of contact with peripheral fibroblasts. J Immunol (2007) 179(1):89-94.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
CD56ブライト細胞は、CD56dim NK細胞とはKIRレパートリーと細胞傷害性の特徴が異なる。このようなNK細胞は、CD56dim NK細胞と比較して、KIRレパートリーと細胞傷害性の特徴が異なる。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Capuano、Pighi、Battella S、De Federicis D、Galandrini R、Palmieri G. CD16を介するNK細胞の機能を利用して腫瘍標的mAbsの治療効果を高める。論文概要] 癌を標的とした抗腫瘍薬の治療効果を高めるためにCD16を介したNK細胞の機能を利用する。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ヒトナチュラルキラー細胞のサブセット機能の再検討により、活性化時に豊富なIFN-γを迅速に産生する細胞溶解性CD56(dim)CD16+ NK細胞が明らかになった。この論文では、NK細胞のサブセット機能を再検討し、活性化時にCD56(dim)CD16+NK細胞がIFN-γを大量に産生することを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ムハルAM、デルコンテRB、サンJC. ナチュラルキラー細胞:生得的特徴から適応的特徴へ。Annu Rev Immunol (2021) 39:417-47. doi: 10.1146/annurev-immunol-101819-074948.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
感染症およびがん発症時の肺におけるナチュラルキラー細胞の動員および組織常在化。論文概要|医学書院(2022)13:887503.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Topham NJ, Hewitt EW. ナチュラルキラー細胞の細胞傷害性:どのように引き金を引くのか?免疫学(2009)128(1):7-15.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ウイルス感染は、感染細胞およびバイスタンダー細胞のQa-1bを調節し、NK細胞による殺傷を適切に誘導する。J Exp Med (2021) 218(5):e20201782. doi: 10.1084/jem.20201782.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
H-2欠損リンパ腫変異体の選択的拒絶反応は、代替免疫防御戦略を示唆している。Nature (1986) 319(6055):675-8.
PubMed Abstract|全文|Google Scholar
Chester C, Fritsch K, Kohrt HE. ナチュラルキラー細胞の免疫調節:がん免疫療法のための活性化、抑制性、共刺激性受容体シグナル伝達の標的化。論文番号:Front Immunol (2015) 6:601.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
免疫系が感知する発がん性ストレス:ナチュラルキラー細胞受容体の役割。Nat Rev Immunol (2009) 9(8):568-80.
PubMed Abstract|全文|Google Scholar
IL-21はヒトCD34+細胞前駆体のNK細胞への急速な成熟と表面キラーIg様受容体の獲得を誘導する。Eur J Immunol (2003) 33(12):3439-47.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Cifaldi L, Doria M, Cotugno N, Zicari S, Cancrini C, Palma P, et al. DNAM-1活性化受容体とそのリガンド:ウイルスは感染の様々な段階においてNK細胞を介した免疫監視にどのような影響を及ぼすのか?Int J Mol Sci (2019) 20(15):3715.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ナチュラルキラー細胞とその受容体。D. M. M. (2002) 10(2-3):147-64. doi: 10.1016/S0966-3274(02)00062-X.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Blunt MD, Khakoo SI. 活性化キラー細胞免疫グロブリン様受容体: 検出、機能、および治療的使用。Int J Immunogenet (2020) 47(1):1-12. doi: 10.1111/iji.12461.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Waggoner SN, Kumar V. Evolving role of 2B4/CD244 in T and NK cell responses during virus infection. 論文タイトル:「ウイルス感染におけるT細胞およびNK細胞の反応における2B4/CD244の進化する役割」。
PubMedアブストラクト|クロスリファレンス|Google Scholar
免疫および免疫介在性疾患におけるNKG2Aの意義。免疫と免疫介在性疾患におけるNKG2Aの意義。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
NK細胞を用いた免疫チェックポイント阻害。Doi:10.3389/fimmu.2020.00167。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
NK細胞の終末分化:NKG2Aの相関的な段階的減少とKIRの獲得。NK細胞の終末分化:NKG2Aの段階的減少とKIRの獲得との相関.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ナチュラルキラー細胞における免疫チェックポイントPD-1:腫瘍免疫療法における発現、機能、標的化。がん(バーゼル)(2020)12(11):3285. doi: 10.3390/cancers12113285.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Anderson AC, Joller N, Kuchroo VK. Lag-3、Tim-3、およびTIGIT:免疫調節に特化した機能を持つ共抑制性受容体。免疫 (2016) 44(5):989-1004. doi: 10.1016/j.immuni.2016.05.001.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Pende D, Falco M, Vitale M, Cantoni C, Vitale C, Munari E, et al. Killer Ig-like receptors (KIRs): Their role in NK cell modulation and developments leading to their clinical exploitation. 論文タイトル:Front Immunol (2019) 10:1179.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
成人白血病患者に対するNK細胞ベースの免疫療法における多型KIRおよびHLAクラスI遺伝子の関連性。がん(バーゼル)(2021)13(15):3767. doi: 10.3390/cancers13153767
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ヒトキラー細胞免疫グロブリン様受容体(KIR)遺伝子ファミリー内の変異。この論文では、KIR遺伝子ファミリーの変異について解説している。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Norman、PJ、Stephens、HA、Verity、DH、Chandanayingyong、D、Vaughan、RW。3つの民族集団におけるナチュラルキラー細胞免疫グロブリン様受容体配列の分布。免疫遺伝学 (2001) 52(3-4):195-205.
免疫遺伝学(2001)52(3-4):195-20.
Shilling、Guethlein LA、Cheng NW、Gardiner CM、Rodriguez R、Tyan D、et al. Allelic polymorphism synergizes with variable gene content to individualize human KIR genotype. J Immunol (2002) 168(5):2307-15. doi: 10.4049/jimmunol.168.5.2307
PubMed Abstract|クロスリファレンス全文|Google Scholar
キラー細胞抑制受容体遺伝子におけるヒトの多様性。免疫 (1997) 7(6):753-63. doi: 10.1016/S1074-7613(00)80394-5
PubMed Abstract|クロスリファレンス全文|Google Scholar
IPD-IMGT/HLAデータベース。Nucleic Acids Res (2023) 51(D1):D1053-D60.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ナチュラルキラー細胞のレパートリー選択とエフェクター機能の調節におけるHLAおよびKIR多型の役割。この論文では、ナチュラルキラー細胞のレパートリー選択とエフェクター機能の調節におけるHLAとKIRの多型の役割について報告する。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
NK細胞抑制性レセプターの直接結合と機能転移により、HLA-Cアロタイプ認識の新しいパターンが明らかになった。J Immunol (1998) 161(2):571-7. doi: 10.4049/jimmunol.161.2.571.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
KIRのAA型は特定のKIR対立遺伝子を有し、NK細胞に有益な機能を与えることがハプロアイデンティカル造血幹細胞移植において示唆されている。(1):3595、(2):3595、(3):3595、(4):3595、(5):3595、(6):3595。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
NK細胞を介した免疫圧に対するHIV-1の適応。Nature誌(2011)476(7358):96-100.
パブコメ要旨|全文|Google Scholar
Hölzemer A, Thobakgale CF, Jimenez Cruz CA, Garcia-Beltran WF, Carlson JM, van Teijlingen NH, et al. HLA-C*03:04-restricted HIV-1 p24 Gag sequence variantの選択は、KIR2DL3+ナチュラルキラー細胞からのウイルス逃避と関連している:南アフリカにおける観察コホートからのデータ。PloS Med (2015) 12(11):e1001900. doi: 10.1371/journal.pmed.1001900.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
HLAおよびNK細胞抑制レセプター遺伝子のC型肝炎ウイルス感染の治癒における役割。科学 (2004) 305(5685):872-4. doi: 10.1126/science.1097670
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ナチュラルキラー細胞免疫グロブリン様レセプターがSARS-CoV-2感染に対する免疫応答の違いを引き起こす。この論文では、SARS-CoV-2感染における免疫応答の違いを、ナチュラルキラー細胞免疫グロブリン様レセプターが引き起こしていることを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
エボラウイルス感染におけるKIR2DS1およびKIR2DS3と致死的転帰との関連。免疫遺伝学 (2010) 62(11-12):767-71.
PubMedアブストラクト|クロスリファレンス|Google Scholar
末梢血リンパ球の自然細胞傷害活性およびがん免疫監視に関連するNKG2Dハプロタイプの同定。がん研究 (2006) 66(1):563-70. doi: 10.1158/0008-5472.CAN-05-2776.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
NKG2D遺伝子多型はダサチニブによる慢性骨髄性白血病の病勢コントロールと関連する。Int J Hematol (2017) 106(5):666-74. doi: 10.1007/s12185-017-2294-1
PubMed Abstract|クロスリファレンス全文|Google Scholar
Zingoni A、Molfetta R、Fionda C、Soriani A、Paolini R、Cippitelli M、他:NKG2Dとそのリガンド: 「一人は万人のために、万人は一人のために」。Doi: 10.3389/fimmu.2018.00476.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Khor CC, Chau TN, Pang J, Davila S, Long HT, Ong RT, et al. Genome-wide association study identifies susceptibility loci for dengue shock syndrome at MICB and PLCE1. デングショック症候群の遺伝子座はMICBとPLCE1であることが明らかになった。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
デングショック症候群のタイ人患者におけるMICBとPLCE1におけるGWASで同定されたSNPsの関連を再現研究で確認。BMC Med Genet (2014) 15:58. doi: 10.1186/1471-2350-15-58.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
KRAS変異大腸癌の転移を促進する遺伝子。論文タイトル:Front Genet (2020) 11:511.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
日本人におけるMICA-A5.1対立遺伝子と口腔扁平上皮がん感受性の上昇との関連。J Oral Pathol Med (2007) 36(6):351-6. doi: 10.1111/j.1600-0714.2007.00539.x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
口腔扁平上皮がん患者における可溶性MICAとMICA A5.1ホモ接合体遺伝子型との関係。臨床免疫学 (2009) 130(3):331-7. doi: 10.1016/j.clim.2008.09.004.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Lavado-Valenzuela R, Benavides M, Carabantes F, Alonso A, Caballero A. スペイン人乳がん女性におけるMHCクラスI鎖関連遺伝子A膜貫通多型。組織抗原 (2009) 74(1):46-9. doi: 10.1111/j.1399-0039.2009.01254.x.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Jumnainsong A, Romphruk AV, Jearanaikoon P, Klumkrathok K, Romphruk A, Luanrattanakorn S, et al. タイ北東部集団におけるMICAの細胞外ドメインの多型と子宮頸がんとの関連。組織抗原(2007)69(4):326-33.
PubMed Abstract|クロスリファレンス全文|Google Scholar
ヒトナチュラルキラー細胞およびTリンパ球におけるCD57。Cancer Immunol Immunother (2016) 65(4):441-52. doi: 10.1007/s00262-016-1803-z.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
CD69はナチュラルキラー細胞に対する刺激性受容体であり、その細胞傷害作用はCD94阻害性受容体によって阻害される。免疫学(1999) 97(1):159-65.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
CD69は活性化NK細胞を介した抵抗性標的の殺傷に必要である。血液 (2005) 106(11):3322-. doi: 10.1182/blood.V106.11.3322.3322.
PubMed Abstract|全文|Google Scholar
組織常在NK細胞:発生、成熟、および臨床的関連性。Di:10.3390/cancers12061553。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ナチュラルキラー細胞活性を同定するための機能的マーカーとしてのCD107a。J Immunol Methods (2004) 294(1-2):15-22.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Velotti F, Barchetta I, Cimini FA, Cavallo MG. 炎症性疾患におけるグランザイムB:アポトーシス、炎症、細胞外マトリックスのリモデリング、上皮間葉転換、線維化。論文タイトル:炎症性疾患におけるグランザイムB:アポトーシス、炎症、細胞外マトリックスのリモデリング、上皮間葉転換、線維症。
PubMedアブストラクト|全文|Google Scholar
パーフォリン:免疫反応における重要なプレーヤー。DOI: 10.5114/ceji.2014.42135.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ナチュラルキラー細胞治療における分子メカニズムの解明。Exp Mol Med (2015) 47(2):e141. doi: 10.1038/emm.2014.114.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lo Nigro C, Macagno M, Sangiolo D, Bertolaccini L, Aglietta M, Merlano MC. 固形がんにおけるNKを介した抗体依存性細胞傷害性:生物学的証拠と臨床的展望。Ann Transl Med (2019) 7(5):105. doi: 10.21037/atm.2019.01.42.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
HIV-1の構造生物学:メカニズムと治療に関する洞察。Nat Rev Microbiol (2012) 10(4):279-90.
パブコメ抄録|クロスリファレンス全文|Google Scholar
HIV感染症。Nat Rev Dis Primers (2015) 1:15035. doi: 10.1038/nrdp.2015.35.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Cohn LB, Chomont N, Deeks SG. HIV-1潜伏リザーバーの生物学と治療戦略への示唆。細胞宿主微生物(2020)27(4):519-30. doi: 10.1016/j.chom.2020.03.014.
パブコメ要旨|クロスリファレンス全文|Google Scholar
HIVに感染している青少年と感染していない高リスクの青少年におけるナチュラルキラー細胞の数と機能。この論文では、HIV感染者と非感染者におけるナチュラルキラー細胞の数と機能、HIV感染者と非感染者におけるナチュラルキラー細胞の数と機能、HIV感染者と非感染者におけるナチュラルキラー細胞の数と機能、AIDS Res Hum Retroviruses (2001) 17(6):543-52.
パブコメ抄録|クロス全文|Google Scholar
治療歴のあるHIV-1血清陽性者におけるCD56(dim)NK細胞サブセットの選択的枯渇とCD56(bright)NK細胞の維持。J Clin Immunol (2002) 22(3):176-83.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
HIV感染は、分化度の低いCD56dim CD16+ NK細胞の優先的減少と関連している。J Virol (2010) 84(2):1183-8. doi: 10.1128/JVI.01675-09
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
HIV-1感染と曝露が生後1年間のケニア人乳児のナチュラルキラー(NK)細胞の表現型に及ぼす影響。この論文では、HIV-1感染と曝露が生後1年間のケニア人乳児におけるナチュラルキラー(NK)細胞の表現型に及ぼす影響について検討した。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
CD56(bright)NK細胞におけるCCR7発現の消失は、CD56(dim)CD16(+)NK細胞様の表現型と関連し、HIVウイルス量と相関する。この論文では、NK細胞におけるCD56(bright)NK7発現がCD56(dim)CD16(+)NK細胞様表現型と関連し、HIVウイルス量と相関することを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
HIV-1感染におけるCD39+ CD56brightナチュラルキラー細胞の頻度の増加は、免疫の活性化および疾患の進行と相関する。J Acquir Immune Defic Syndr (2017) 74(4):467-72。
PubMed Abstract|クロスリファレンス全文|Google Scholar
IL-10(+)NK細胞およびTGF-β(+)NK細胞は、HIV感染において負の制御的役割を果たす。BMC Infect Dis (2018) 18(1):80. doi: 10.1186/s12879-018-2991-2
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Cao WJ, Zhang XC, Wan LY, Li QY, Mu XY, Guo AL, et al. CD56(neg)NK細胞の免疫機能異常はHIV-1疾患の進行と関連している。この論文では、HIV-1感染症におけるCD56(negative)NK細胞の免疫機能異常が、HIV-1感染症の進行に関連していることを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
CD56negCD16+NK細胞は、HIV-1感染時にエフェクター機能が低下した活性化成熟NK細胞である。レトロバイオロジー(2013)10:158.
パブコメ要旨|全文|Google Scholar
Cocker ATH, Liu F, Djaoud Z, Guethlein LA, Parham P. CD56陰性NK細胞: 末梢血における頻度、HIV-1感染時の拡大、機能的能力、およびKIR発現。Doi:10.3389/fimmu.2022.992723。
パブコメ抄録|クロスリファレンス全文|Google Scholar
CD56-/CD16+ナチュラルキラー(NK)細胞の特徴:HIVに感染したウイルス血症患者で増加する高度に機能不全に陥ったNKサブセット。この論文では、HIV感染者におけるCD56-/CD16+ナチュラルキラー(NK)細胞の特徴を明らかにした。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Ma M, Yin X, Zhao X, Guo C, Zhu X, Liu T, et al. HIV感染者のCD56(-) CD16(+) NK細胞は、自己CD8(+) T細胞によるIFN-γ産生を負に制御する。J Leukoc Biol (2019) 106(6):1313-23. doi: 10.1002/JLB.3A0819-171RR
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
慢性感染症におけるCD56-CD16+ NK細胞サブセット。生化学会誌(2023)51(3):1201-12.
パブコメ抄録|クロスリファレンス全文|Google Scholar
HIV-1感染慢性患者とHIVコントローラーにおけるNK細胞サブセットと受容体発現の変化。HIV-1 慢性感染者とHIV感染者におけるNK細胞サブセットと受容体発現の変化。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
HIV-1感染におけるナチュラルキラー細胞:抑制性受容体と活性化受容体に対するウイルス血症の二律背反的影響とその機能的相関。この論文では、HIV-1感染症におけるナチュラルキラー細胞の役割について、HIV-1感染症におけるナチュラルキラー細胞の役割について、HIV-1感染症におけるナチュラルキラー細胞の役割について解説している。
パブコメ抄録|クロスリファレンス全文|Google Scholar
マハパトラS、シアラーWT、ミナードCG、メイスE、ポールM、オレンジJS。HIV感染児のNK細胞は、表現型と機能が変化している。J Allergy Clin Immunol (2019) 144(1):294-303 e13. doi: 10.1016/j.jaci.2018.11.052.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Dillon SM、Lee EJ、Bramante JM、Barker E、Wilson CC。HIV-1未治療感染では細菌に対するナチュラルキラー細胞のインターフェロン-γ応答が低下し、ウイルスが抑制されてもその欠陥は持続する。J Acquir Immune Defic Syndr (2014) 65(3):259-67. doi: 10.1097/01.qai.0000435603.50598.2b
PubMed Abstract|クロスリファレンス全文|Google Scholar
Kaczmarek DJ, Kokordelis P, Kramer B, Glassner A, Wolter F, Goeser F, et al. HIV/HCV共感染におけるNK細胞プールの変化。PloS One (2017) 12(4):e0174465. doi: 10.1371/journal.pone.0174465.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
HIV-1によるクラスI主要組織適合複合体タンパク質の選択的ダウンレギュレーションは、HIV感染細胞をNK細胞から保護する。免疫 (1999) 10(6):661-71. doi: 10.1016/S1074-7613(00)80065-5
PubMed Abstract|クロスリファレンス全文|Google Scholar
Schwartz O, Maréchal V, Le Gall S, Lemonnier F, Heard JM. 主要組織適合複合体クラスI分子のエンドサイトーシスはHIV-1 Nefタンパク質によって誘導される。このことは、HIV-1がHIVに感染したことを示唆している。
パブコメ抄録|全文|Google Scholar
Apps R, Del Prete GQ, Chatterjee P, Lara A, Brumme ZL, Brockman MA, et al. HIV-1 Vpu mediates HLA-C downregulation. Cell Host Microbe (2016) 19(5):686-95. doi: 10.1016/j.chom.2016.04.005.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bachtel ND, Umviligihozo G, Pickering S, Mota TM, Liang H, Del Prete GQ, et al. HIV-1によるHLA-Cのダウンレギュレーションは宿主のHLA遺伝子型に適応する。PloS Pathog (2018) 14(9):e1007257. doi: 10.1371/journal.ppat.1007257.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
HIV-1 Vprは、ATRを介したDNA損傷応答の活性化を通じて、ナチュラルキラー細胞を介した感染細胞の溶解を引き起こす。この論文では、HIV-1 VprがATRを介したDNA損傷応答の活性化を介してナチュラルキラー細胞を介した感染細胞の溶解を引き起こすことを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Richard J, Sindhu S, Pham TN, Belzile JP, Cohen EA. HIV-1 Vprは活性化NKG2D受容体のリガンドの発現をアップレギュレートし、NK細胞を介した殺傷を促進する。血液 (2010) 115(7):1354-63.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
酒井和彦、Dimas J、Lenardo MJ. VifおよびVprアクセサリー蛋白質は独立してHIV-1誘導性T細胞の細胞障害および細胞周期停止を引き起こす。この論文では、VifとVprのアクセサリータンパク質が、HIV-1に誘導されるT細胞の細胞障害と細胞周期の停止を独立に引き起こすことを明らかにした。
パブコメ抄録|クロスリファレンス全文|Google Scholar
HIV-1感染細胞との相互作用に伴うナチュラルキラー細胞の脱顆粒は、VpuによるNTB-Aのダウンモジュレーションによって阻害される。細胞宿主微生物(2010)8(5):397-409.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
HLA-Eによって提示される保存されたHIV-1由来ペプチドは、感染T細胞をNKG2A/CD94を持つナチュラルキラー細胞による攻撃に非常に感受性を示す。PloS Pathog (2016) 12(2):e1005421. doi: 10.1371/journal.ppat.1005421.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ヒト免疫不全ウイルスに感染した原発性T細胞芽細胞の自己ナチュラルキラー細胞による殺傷は、主要組織適合複合体クラスI分子の発現を変化させるウイルスの能力に依存する。血液 (2004) 104(7):2087-94.
PubMed Abstract|全文|Google Scholar
Luteijn R, Sciaranghella G, van Lunzen J, Nolting A, Dugast AS, Ghebremichael MS, et al. リンパ節における早期のウイルス複製は、NK細胞を介した制御から逃れる手段をHIVに提供する。Eur J Immunol (2011) 41(9):2729-40.
PubMed Abstract|全文|Google Scholar
HIV-1感染者のリンパ節におけるCXCR5(+)NK細胞の集積の意義。この論文では、HIV-1感染者のリンパ節におけるCXCR5(+)NK細胞の集積の意義を明らかにした。
PubMed Abstract|クロスリファレンス全文|Google Scholar
HIV+ ControllersおよびART抑制者の血液およびリンパ球T細胞とNK細胞の深い表現型解析。この論文では、HIV感染者(HIV+)とART抑制者の血中およびリンパ球中のT細胞およびNK細胞の表現型を詳細に解析している。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Sungur CM, Wang Q, Ozanturk AN, Gao H, Schmitz AJ, Cella M, et al. ヒト化マウスにおけるHIV-1感染に対するヒトNK細胞の防御効果。ヒトNK細胞はヒト化マウスにおいてHIV-1感染を防御する。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
HIV感染における粘膜NK細胞の分布の変化。Mucosal Immunol (2012) 5(1):30-40.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
宿主のKIR/HLA-C遺伝子型は、HIVが介在するNK細胞レパートリーの変化を決定し、HLA-Cのダウンモデュレーションに影響するvpu配列変異と関連している。HLA-Cのダウンモデュレーションに影響するvpuの配列変異と関連している。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
HLA-C*04:01/KIR2DS4遺伝子の組み合わせと集団頻度の高いヒト白血球抗原対立遺伝子は、HIVの疾患進行速度を促進する。AIDS (2015) 29(5):507-17。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
KIR2DS4はHIV-1の病原性を促進する:免疫遺伝学的データとナチュラルキラー細胞機能の解析による新たな証拠。PloS One (2014) 9(6):e99353. doi: 10.1371/journal.pone.0099353.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Mhandire K, Zijenah LS, Tshabalala M, Yindom LM, Mlambo T, Mhandire DZ, et al. KIRおよびHLA-C遺伝子多型は、抗レトロウイルス療法未治療の成人ジンバブエ人における血漿IP-10濃度に影響を及ぼす。OMICS (2019) 23(2):111-8. doi: 10.1089/omi.2018.0147.
PubMed Abstract|RefRef Full Text|Google Scholar
ナチュラルキラー細胞を介したHIV-1複製阻害のKIR/HLAサブタイプによる違い。この論文では、HIV-1感染症におけるHIR/HLAサブタイプの違いによるナチュラルキラー細胞による増殖抑制の違いを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
KIR遺伝子のコピー数変異はHIV-1の制御に影響を及ぼす。この論文では、KIR遺伝子のコピー数の変動がHIV-1の制御に影響を及ぼすことを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
HIV-1感染におけるNK細胞: 基礎科学からワクチン戦略まで。Front Immunol (2018) 9:2290.
PubMedアブストラクト|Google Scholar
Reeves RK, Li H, Jost S, Blass E, Li H, Schafer JL, et al. アカゲザルにおける抗原特異的NK細胞記憶。Nat Immunol (2015) 16(9):927-32. doi: 10.1038/ni.3227.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Tiemessen CT, Shalekoff S, Meddows-Taylor S, Schramm DB, Papathanasopoulos MA, Gray GE, et al. Cutting Edge: HIV-1ペプチドに対する異常なNK細胞応答は、HIV-1の母子感染防御と関連している。この論文では、HIV-1ペプチドに対する異常なNK細胞応答が、母子感染防御と関連していることを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Tiemessen CT, Shalekoff S, Meddows-Taylor S, Schramm DB, Papathanasopoulos M, Gray G, et al. ヒト免疫不全ウイルス1型(HIV-1)ペプチドに応答するナチュラルキラー細胞は、HIV-1感染の制御と関連している。この論文では、HIV-1ペプチドに反応するナチュラルキラー細胞が、HIV-1感染の制御と関連していることを明らかにした。
パブコメ抄録|クロスリファレンス全文|Google Scholar
NKG2C(+)記憶様NK細胞は一次感染時のHIVウイルス血症の制御に寄与する: Optiprim-ANRS 147。Clin Transl Immunol (2017) 6(7):e150. doi: 10.1038/cti.2017.22.
クロス・リーフ・フルテキスト|Google Scholar
Jensen SS, Hartling HJ, Tingstedt JL, Larsen TK, Nielsen SD, Pedersen C, et al. HIV特異的ADCCは抗レトロウイルス療法後に改善し、NK細胞の表現型の正常化と相関する。J Acquir Immune Defic Syndr (2015) 68(2):103-11. doi: 10.1097/QAI.0000000000000429.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Nabatanzi R, Bayigga L, Cose S, Rowland-Jones S, Canderan G, Joloba M, et al. アフリカのコホートにおけるART治療を受けたHIV感染成人のナチュラルキラー(NK)細胞の異常な活性化と機能障害。Clin Immunol (2019) 201:55-60. doi: 10.1016/j.clim.2019.02.010.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lichtfuss GF, Cheng WJ, Farsakoglu Y, Paukovics G, Rajasuriar R, Velayudham P, et al. ウイルスが抑制されたHIV患者は、NK細胞の活性化と持続的な自然免疫の活性化を示す。免疫学(2012)189(3):1491-9.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
抑制的HAARTにもかかわらずCD4(+)T細胞の再構成が不良なHIV-1感染患者のNK細胞は、IFN-γ産生の低下と自己反応性CD56(bright)細胞の高頻度を示す。Immunol Lett (2017) 190:185-93. doi: 10.1016/j.imlet.2017.08.014.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
HCVの分子生物学、複製、免疫応答の概要。また、HCVの分子生物学的、複製学的、免疫学的応答についても解説している。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Revie D, Salahuddin SZ. C型肝炎ウイルスのin vivoおよびin vitroにおける複製に重要なヒトの細胞型:古い主張と現在の証拠。この論文では、C型肝炎ウイルスの増殖に重要なヒトの細胞型について解説している。
パブコメ要旨|全文|Google Scholar
Millman AJ, Nelson NP, Vellozzi C. Hepatitis C: Review of the epidemiology, clinical care, and continue challenges in the direct acting antiviral era. Curr Epidemiol Rep (2017) 4(2):174-85. doi: 10.1007/s40471-017-0108-x
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
C型肝炎ウイルスの急性感染におけるナチュラルキラー細胞の活性化。消化器病学(2010)138(4):1536-45.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
C型肝炎ウイルスのクリアランス、再感染、持続性、注射薬物使用者の研究からの考察:ワクチンに向けて。Lancet Infect Dis (2012) 12(5):408-14. doi: 10.1016/S1473-3099(12)70010-5
PubMed Abstract|クロスリファレンス全文|Google Scholar
de Groen RA, Groothuismink ZMA, van Oord G, Kootstra NA, Janssen HLA, Prins M, et al. 自己限定型HCV感染におけるNK細胞は、より広範囲に分化しているが記憶様ではないレパートリーを示す。J Viral Hepat (2017) 24(11):917-26. doi: 10.1111/jvh.12716.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Golden-Mason L, Cox AL, Randall JA, Cheng L, Rosen HR. ナチュラルキラー細胞の細胞傷害性とNKp30発現の増加は、高リスク者におけるC型肝炎ウイルス感染を防御し、in vitroでの複製を阻害する。肝臓病学(2010)52(5):1581-9.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Harrison RJ, Ettorre A, Little AM, Khakoo SI. NKG2AとC型慢性肝炎ウイルス感染症の治療との関連。臨床 Exp Immunol (2010) 161(2):306-14. doi: 10.1111/j.1365-2249.2010.04169.x.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Ji HF, Wang J, Yu L, Niu JQ, Ayana DA, Jiang YF. CD158b+NK細胞の高頻度は、C型肝炎ウイルスの持続感染と関連している。Ann Hepatol (2013) 12(4):539-47. doi: 10.1016/S1665-2681(19)31337-7
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Frias M, Rivero-Juárez A, Rodriguez-Cano D, Camacho Á, López-López P, Risalde M, et al. HLA-B、HLA-C、KIRは、C型肝炎の自然治癒に対するIFNL3の予測値を改善する。Sci Rep (2018) 8(1):659. doi: 10.1038/s41598-017-17531-7
PubMed Abstract|クロスリファレンス全文|Google Scholar
C型慢性肝炎におけるNK細胞頻度の低下は、ex vivoでの細胞溶解殺傷には影響しない。Hepatology (2006) 43(3):573-80.
PubMed Abstract|クロスリファレンス全文|Google Scholar
C型慢性肝炎ウイルス感染はNK細胞頻度を低下させ、サイトカイン分泌を抑制する: 抗ウイルス治療による逆転。バイオケムバイオフィジックスレズコミュニ(2010)393(2):331-7. doi: 10.1016/j.bbrc.2010.02.008
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
C型肝炎ウイルスの単発暴露後の感染消失および持続感染におけるナチュラルキラー細胞のサブセット分布の変化(Golden-Mason L, Madrigal-Estebas L, McGrath E, Conroy MJ, Ryan EJ, Hegarty JE, et al. Gut (2008) 57(8):1121-8. doi: 10.1136/gut.2007.130963.
PubMed Abstract|クロスリファレンス全文|Google Scholar
CD56ブライトNK細胞、CD3-CD16+CD56-NK細胞、および活性化CD4+T細胞またはB細胞の頻度の増加は、CD4+CD25High T細胞と並行して、HCV献血者における潜在的なウイルス血症を制御する。J Med Virol (2009) 81(1):49-59. doi: 10.1002/jmv.21340
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Golden-Mason L, Hahn YS, Strong M, Cheng L, Rosen HR. 細胞外HCVコアタンパク質は、NK細胞において未熟な制御性表現型を誘導する:急性感染の転帰への示唆。PloS One (2014) 9(7):e103219. doi: 10.1371/journal.pone.0103219.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
慢性HCV感染は肝臓よりも血液中のNK細胞の表現型に影響を与える。PloS One (2014) 9(8):e105950. doi: 10.1371/journal.pone.0105950.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
IL-26は慢性HCV感染患者において過剰発現しており、ヒトNK細胞によるTRAIL媒介細胞傷害性とインターフェロン産生を増強する。Gut (2015) 64(9):1466-75. doi: 10.1136/gutjnl-2013-306604.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
細胞外DNAによる炎症と微生物防御に関与するサイトカイン、IL-26。論文番号:Front Immunol (2019) 10:204.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Nel I, Lucar O, Petitdemange C, Beziat V, Lapalus M, Bedossa P, et al. 肝内TNFα産生NKp44+ NK細胞の蓄積は、慢性HCV感染における肝線維化およびウイルス量と相関する。Med (Baltimore) (2016) 95(19):e3678. doi: 10.1097/MD.000000003678.
CrossRef 全文|Google Scholar
Maretti-Mira AC, Salomon MP, Hsu AM, Dara L, Golden-Mason L. Etiology of end-stage liver cirrhosis impacts hepatic natural killer cell heterogenicity. この論文では、肝硬変の病態が肝ナチュラルキラー細胞の異型性に影響を及ぼすことを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Lunemann S, Malone DF, Hengst J, Port K, Grabowski J, Deterding K, et al. 急性および慢性ウイルス性肝炎におけるナチュラルキラー細胞の機能低下。J Infect Dis (2014) 209(9):1362-73. doi: 10.1093/infdis/jit561.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
急性HCV感染におけるNKp30+NKp46+、CD161+、およびNKG2D+ NK細胞の頻度の低下は、ウイルスクリアランスを予測する可能性がある。J Hepatol (2011) 55(2):278-88. doi: 10.1016/j.jhep.2010.11.030.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
NKG2AはHCV持続のためのNK細胞疲弊チェックポイントである。Nat Commun (2019) 10(1):1507. doi: 10.1038/s41467-019-09212-y
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
C型慢性肝炎ウイルス感染に対するインターフェロンフリー療法中の免疫学的解析により、ナチュラルキラー細胞コンパートメントの変調が明らかになった。J Infect Dis (2016) 213(2):216-23. doi: 10.1093/infdis/jiv391.
PubMed Abstract|クロスリファレンス全文|Google Scholar
C型慢性肝炎患者の早期治療における直接作用型抗ウイルス薬によるNK細胞の一過性の回復。J Clin Transl Hepatol (2022) 10(6):1117-24. doi: 10.14218/JCTH.2021.00427.
PubMed Abstract|クロスリファレンス全文|Google Scholar
C型肝炎ウイルス治癒患者における適応的ナチュラルキラー細胞の機能回復。Hepatology (2021) 73(1):79-90.
PubMed Abstract|クロスリファレンス全文|Google Scholar
感染細胞培養および臨床検体から得られたヒトサイトメガロウイルスゲノム全塩基配列。この論文では、ヒトサイトメガロウイルスに感染した細胞培養物および臨床検体から得られた完全なヒトサイトメガロウイルスゲノムの塩基配列を明らかにした。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Wang YQ, Zhao XY. ヒトサイトメガロウイルスの一次感染と再活性化:ビリオンが運ぶ分子からの洞察。論文タイトル:「ヒトサイトメガロウイルスの一次感染と再活性化:ビリオンが運ぶ分子からの知見」(Front Microbiol (2020) 11:1511.
パブコメ抄録|クロスリファレンス全文|Google Scholar
ヒトサイトメガロウイルス急性感染症におけるCD57+NKG2Chiナチュラルキラー細胞サブセットの拡大。米国国立科学アカデミー(2011)108(36):14725-32. doi: 10.1073/pnas.1110900108
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
同種移植後のサイトメガロウイルス再活性化は、強力な機能を有する教育済みNKG2C+ナチュラルキラー細胞の持続的増加を促進する。血液 (2012) 119(11):2665-74.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Rolle A, Brodin P. 環境の影響に対する免疫の適応:NK細胞とHCMVの場合。Trends Immunol (2016) 37(3):233-43. doi: 10.1016/j.it.2016.01.005.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ヒトのCMV感染に対するメモリーT細胞とNK細胞の協調的拡大。Eur J Immunol (2016) 46(5):1168-79. doi: 10.1002/eji.201546179.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Hendricks DW, Balfour HH Jr., Dunmire SK, Schmeling DO, Hogquist KA, Lanier LL. 最先端: NKG2C(hi)CD57+NK細胞は、エプスタイン・バーウイルスではなくサイトメガロウイルスの急性感染に特異的に反応する。J Immunol (2014) 192(10):4492-6. doi: 10.4049/jimmunol.1303211.
PubMed Abstract|クロスリファレンス全文|Google Scholar
サイトメガロウイルス(CMV)感染で増幅したNKG2C+ NK細胞は、キラー細胞Ig様受容体2DLを優先的に発現する:CMV感染樹状細胞の制御における機能的影響。J Immunol (2013) 191(5):2708-16. doi: 10.4049/jimmunol.1301138.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
カンポスC、ロペスN、ペラA、ゴルディージョJJ、ハスーネF、タラゾーナR、他:CMV血清状態および年齢による健常人ドナーの安静時およびIL-2活性化NK細胞上のNKp30、NKp46およびDNAM-1活性化レセプターの発現。Biogerontology (2015) 16(5):671-83. doi: 10.1007/s10522-015-9581-0
PubMed Abstract|クロスリファレンス全文|Google Scholar
慢性肝炎患者において、CMVは自己特異的KIRを発現するNKG2C+ NK細胞のクローン性増殖を促進する。Eur J Immunol (2012) 42(2):447-57. doi: 10.1002/eji.201141826
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ヒトサイトメガロウイルスに対するNKG2Cbright NK細胞の抗体媒介応答。J Immunol (2015) 194(6):2715-24. doi: 10.4049/jimmunol.1402281.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
適応ナチュラルキラー(NK)細胞とサイトメガロウイルス(CMV)の免疫学的現象を解読する。この論文では、NK細胞とサイトメガロウイルス(CMV)の免疫学的現象について解説している。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Cichocki F, Miller JS, Anderson SK, Bryceson YT. NK細胞の分化とエフェクター機能のエピジェネティック制御。Doi:10.3389/fimmu.2013.00055。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Cytomegalovirus infection drives adaptive epigenetic diversification of NK cells with altered signaling and effector function. Immunity (2015) 42(3):443-56. doi: 10.1016/j.immuni.2015.02.008.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
CMVは造血幹細胞移植レシピエントにおいて迅速なNK細胞の成熟を誘導する。Immunol Lett (2013) 155(1-2):11-3. doi: 10.1016/j.imlet.2013.09.020.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
CMV再活性化はNK細胞レパートリーの長期的拡大と分化を引き起こす。この論文では、CMVの再活性化がNK細胞のレパートリーの長期的な拡大を引き起こすことを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Storek J, Dawson MA, Storer B, Stevens-Ayers T, Maloney DG, Marr KA, et al. 血液幹細胞移植と比較した同種骨髄移植後の免疫再構成。血液 (2001) 97(11):3380-9. doi: 10.1182/blood.V97.11.3380.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ヒトサイトメガロウイルス(CMV)誘発記憶様NKG2C(+)NK細胞は移植可能であり、レシピエントCMV抗原に応答してin vivoで増殖する。この論文では、NKG2C(+)NK細胞は移植可能であり、レシピエントCMV抗原に応答してin vivoで増殖することを明らかにした。
PubMed Abstract|クロスリファレンス全文|Google Scholar
Steinhauer DA, Skehel JJ. インフルエンザウイルスの遺伝学。この論文では、インフルエンザウイルスの遺伝学的特性について解説している。
インフルエンザウイルスに関する文献。
インフルエンザウイルスの生物学。ワクチン(2008)26 Suppl 4(Suppl 4):D49-53.
パブコメ要旨|全文|Google Scholar
Kalil AC, Thomas PG. インフルエンザウイルス関連重症疾患:病態生理学と疫学。Crit Care (2019) 23(1):258. doi: 10.1186/s13054-019-2539-x
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
COVID-19およびインフルエンザにおけるNK細胞およびT細胞サブセットの肺ホーミング受容体発現および活性化プロファイルの比較。論文タイトル:Front Immunol (2022) 13:834862.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Carlin LE, Hemann EA, Zacharias ZR, Heusel JW, Legge KL. インフルエンザAウイルス感染時の肺へのナチュラルキラー細胞の動員は、CXCR3、CCR5、ウイルス曝露量に依存する。論文タイトル:Front Immunol (2018) 9:781.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Verbist KC, Rose DL, Cole CJ, Field MB, Klonowski KD. IL-15はインフルエンザウイルス感染に対する呼吸器自然免疫応答に関与する。この論文では、IL-15がインフルエンザウイルス感染に対する呼吸器自然免疫反応に関与していることを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
パンデミックH1N1 2009の重症感染は、一過性のNKおよびTの欠損と異常なCD8応答と関連している。PloSワン(2012) 7(2):e31535. doi: 10.1371/journal.pone.0031535.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Jost S, Quillay H, Reardon J, Peterson E, Simmons RP, Parry BA, et al. インフルエンザに伴うサイトカインレベルとNK細胞活性化の変化。インフルエンザに伴うサイトカインレベルの変化とNK細胞の活性化。
インフルエンザ罹患時のNK細胞活性化に関する文献。
インフルエンザに対する2B4+ナチュラルキラー(NK)細胞の増加とNKp46+NK細胞の減少。Immunology (2011) 132(4):516-26. doi: 10.1111/j.1365-2567.2010.03394.x.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
H1N1インフルエンザウイルス免疫化ではなく、インフルエンザウイルス感染が末梢血NK細胞サブセットレベルの変化と関連している。臨床ワクチン免疫学 (2013) 20(8):1291-7. doi: 10.1128/CVI.00194-13
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
新規インフルエンザウイルスヘマグルチニン特異的メモリーNK細胞の表現型および機能的特徴。J Virol (2021) 95(12):e00165-21. doi: 10.1128/JVI.00165-21.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
インフルエンザウイルスはヒトナチュラルキラー細胞に直接感染し、細胞アポトーシスを誘導する。J Virol (2009) 83(18):9215-22. doi: 10.1128/JVI.00805-09
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
鳥インフルエンザウイルスはヒトナチュラルキラー細胞に直接感染し、細胞活性を阻害する。Virol Sin (2017) 32(2):122-9. doi: 10.1007/s12250-016-3918-y
PubMed Abstract|クロスリファレンス全文|Google Scholar
インフルエンザウイルス感染時におけるナチュラルキラー細胞の機能障害。Immunol Cell Biol (2009) 87(8):579-89.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Cooper GE, Ostridge K, Khakoo SI, Wilkinson TMA, Staples KJ. インフルエンザAウイルスに対するヒトCD49a(+)肺ナチュラルキラー細胞の細胞傷害性。論文タイトル:Front Immunol (2018) 9:1671.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Du N, Zhou J, Lin X, Zhang Y, Yang X, Wang Y, et al. インフルエンザA疑似型H5N1ウイルスと1918年および2009年パンデミックH1N1ウイルスによるNK細胞の異なる活性化。J Virol (2010) 84(15):7822-31. doi: 10.1128/JVI.00069-10.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Scharenberg M, Vangeti S, Kekalainen E, Bergman P, Al-Ameri M, Johansson N, et al. Influenza A virus infection induces hyperresponsiveness in human lung tissue-resident and peripheral blood NK cells. 論文タイトル:Front Immunol (2019) 10:1116.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Zhou G, Juang SW, Kane KP. NK細胞はマウスにおけるインフルエンザウイルス感染の病態を悪化させる。Eur J Immunol (2013) 43(4):929-38. doi: 10.1002/eji.201242620.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Jansen CA, de Geus ED, van Haarlem DA, van de Haar PM, Löndt BZ, Graham SP, et al. 鳥インフルエンザウイルス感染ニワトリにおける肺NK細胞応答の差は病原性と相関する。Sci Rep (2013) 3:2478.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bongen E, Vallania F, Utz PJ, Khatri P. KLRD1発現ナチュラルキラー細胞はインフルエンザ感受性を予測する。Genome Med (2018) 10(1):45. doi: 10.1186/s13073-018-0554-1
PubMedアブストラクト|クロスリード全文|Google Scholar
急性インフルエンザウイルス感染時のウイルス特異的CTL活性には、損なわれていないNK細胞の活性化が必須である。Cell Mol Immunol (2018) 15(9):827-37. doi: 10.1038/cmi.2017.10.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
インフルエンザウイルス感染マウスにおけるNKT細胞活性化の下流でのIFN-γ産生は、NK細胞とウイルス抗原特異的CD8+T細胞の両方の細胞溶解活性を増強する。ウイルス学 (2010) 407(2):325-32. doi: 10.1016/j.virol.2010.08.030
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Duan X, Lu J, Zhou K, Wang J, Wu J, Fu Gao G, et al. NK細胞はA型インフルエンザウイルス感染による胸腺萎縮に関与する。J Gen Virol (2015) 96(11):3223-35. doi: 10.1099/jgv.0.000276.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wagstaffe HR, Pickering H, Houghton J, Mooney JP, Wolf AS, Prevatt N, et al. インフルエンザワクチン接種は、ヒト骨髄系細胞のサイトカイン分泌とNK細胞機能を促進する。J Immunol (2019) 203(6):1609-18. doi: 10.4049/jimmunol.1801648.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
インフルエンザウイルスに対するワクチン接種を受けた健常成人におけるガンマインターフェロン産生NK細胞の頻度の上昇。臨床ワクチン免疫学(2008)15(1):120-30.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Dou Y, Fu B, Sun R, Li W, Hu W, Tian Z, et al. インフルエンザワクチンはヒトNK細胞の細胞内免疫記憶を誘導する。PloS One (2015) 10(3):e0121258. doi: 10.1371/journal.pone.0121258.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
不活化多価A型インフルエンザウイルスワクチンは、マウスおよびフェレットにおいて広範な予防効果を示す。Sci Transl Med (2022) 14(653):eabo2167.
パブコメ抄録|クロスリファレンス全文|Google Scholar
SARS-CoV-2のゲノム、構造、進化、病因、治療法に関する洞察: 構造ゲノム学的アプローチ。バイオチム・バイオフィジス・アクタ(Biochim Biophys Acta)Mol Basis Dis(2020)1866(10):165878。
パブコメ要旨|全文|Google Scholar
Lamers MM, Haagmans BL. SARS-CoV-2の病原性。Nat Rev Microbiol (2022) 20(5):270-84. doi: 10.1038/s41579-022-00713-0
PubMedアブストラクト|クロスリファレンス|Google Scholar
COVID-19肺炎: COVID-19肺炎:CD8(+)T細胞およびNK細胞の数は減少しているが、細胞傷害能は代償的に増加している。臨床免疫学(2020)218:108516.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
COVID-19疾患の進行および予後の指標としてのNK細胞およびCD8(+)T細胞の消耗レベルの上昇。Doi:10.3389/fimmu.2020.580237。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
末梢と肺におけるCOVID-19に対する免疫応答の違いは、単一細胞RNA配列決定によって明らかになった。細胞生物学 (2020) 6:73. doi: 10.1038/s41421-020-00225-2
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
COVID-19の重症度に関連するナチュラルキラー細胞の免疫型。この論文では、COVID-19の重症度とナチュラルキラー細胞の免疫型との関連を明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
重症COVID-19患者における末梢免疫応答の単一細胞アトラス。Nat Med (2020) 26(7):1070-6. doi: 10.1038/s41591-020-0944-y
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Witkowski、Tizian C、Ferreira-Gomes M、Niemeyer D、Jones TC、Heinrich F、他。 COVID-19における時期尚早なTGFbeta応答は、NK細胞の抗ウイルス機能を制限する。Nature (2021) 600(7888):295-301.
PubMedアブストラクト|クロスリファレンス|Google Scholar
スペイン人長期COVID患者コホートにおける持続的な過剰細胞傷害性免疫反応:診断バイオマーカーの同定。論文タイトル:「長期COVID患者における持続的な過剰細胞傷害性免疫反応:診断バイオマーカーの同定」(Front Immunol、2022年)13:848886.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
小児の多系統炎症症候群の遺伝子発現ネットワークにおける消耗性細胞傷害性T細胞のダウンレギュレーション。Nat Commun (2021) 12(1):4854. doi: 10.1038/s41467-021-24981-1
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
COVID-19患者における動的な血中単細胞免疫応答。シグナルトランスダクション・ターゲット・サー(Signal Transduct Target Ther) (2021) 6(1):110.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
SARS-CoV-2「メモリー」NK細胞をCOVID-19回復期ドナーから同定し、養子細胞療法に用いる。免疫学 (2022) 165(2):234-49.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Malengier-Devlies、Filtjens J、Ahmadzadeh K、Boeckx B、Vandenhaute J、De Visscher A、他。重症COVID-19患者は、高活性化NK細胞とNK細胞-血小板凝集塊を示す。論文概要: COVID-19の重症患者ではNK細胞の活性が亢進しており、NK細胞と血小板の凝集がみられる。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
TIM3+TRBV11-2T細胞とパトロール単球およびCD16+NK細胞におけるIFNγシグネチャーがMIS-Cを特徴づける。J Exp Med (2022) 219(2):e20211381.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bozzano、Dentone、Perrone、Di Biagio、Fenoglio、Parodi、A、他。 COVID-19患者における発症時のNK細胞の広範な活性化、組織輸送、ターンオーバー、機能障害は、その後の疾患の重症度と関連する。PloS病原体(2021)17(4):e1009448. doi: 10.1371/journal.ppat.1009448.
PubMed Abstract|全文|Google Scholar
Mazzoni A, Salvati L, Maggi L, Capone M, Vanni A, Spinicci M, et al. 重症COVID-19における免疫細胞細胞傷害性の低下はIL-6依存性である。J Clin Invest (2020) 130(9):4694-703. doi: 10.1172/JCI138554.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
VarchettaS、Mele D、Oliviero B、Mantovani S、Ludovisi S、Cerino A、他。COVID-19患者におけるユニークな免疫学的プロフィール。細胞分子免疫学(2021)18(3):604-12. doi: 10.1038/s41423-020-00557-9
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Hutanu A, Manu D, Gabor MR, Vasiesiu AM, Andrejkovits AV, Dobreanu M. COVID-19患者におけるナチュラルキラー細胞亜集団の動的評価。この論文では、COVID-19患者におけるナチュラルキラー細胞のサブポピュレーションを動的に評価した。
パブコメ抄録|クロスリファレンス全文|Google Scholar
NKG2A受容体が介在するCOVID-19患者における自然免疫と、モナリズマブ、コルロキン、抗ウイルス剤を用いた治療の可能性。医学仮説(2020)140:109777. doi: 10.1016/j.mehy.2020.109777.
PubMed Abstract|クロスリファレンス全文|Google Scholar
入院中のCOVID-19患者におけるCD56(dim)CD16(neg)NK細胞サブセットの拡大と抑制性KIRの増加。ウイルス(2021)14(1):46.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
NK細胞受容体およびリガンド組成がSARS-CoV-2のクリアランスに影響する。J Clin Invest (2021) 131(21):e146408. doi: 10.1172/JCI146408.
PubMedアブストラクト|全文|Google Scholar
重症COVID-19患者ではNK細胞集団の異常が遷延する。J Allergy Clin Immunol (2021) 148(4):996-1006 e18. doi: 10.1016/j.jaci.2021.07.022.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マルチオミクスプロファイリングにより、COVID-19における自然免疫と造血の広範な調節異常が明らかになった。J Exp Med (2021) 218(8):e20210582. doi: 10.1101/2020.12.18.423363.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Vigón L, García-Pérez J, Rodríguez-Mora S, Torres M, Mateos E, Castillo de la Osa M, et al. ICUに入室したCOVID-19患者のスペイン人コホートにおける抗体依存性細胞細胞傷害性の障害。論文タイトル:「COVID-19患者における抗体依存性細胞傷害作用の障害」(Front Immunol, 2021)12:742631.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
重症COVID-19患者における年齢依存性のNK細胞機能不全。論文タイトル:「NK細胞の加齢に伴う機能障害と重症COVID-19患者」。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Huang CY, Chung CL, Hu TH, Chen JJ, Liu PF, Chen CL. がん治療におけるTGF-β阻害剤の最近の進歩。BioMed Pharmacother (2021) 134:111046. doi: 10.1016/j.biopha.2020.111046.
パブコメ抄録|クロスリファレンス全文|Google Scholar
Wang H, Chen M, Sang X, You X, Wang Y, Paterson IC, et al. TGF-βリガンドおよび受容体を標的とする低分子阻害剤の開発: 構造、機序、前臨床試験、臨床応用。Eur J Med Chem (2020) 191:112154. doi: 10.1016/j.ejmech.2020.112154.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chinnapaiyan S、Dutta RK、Nair M、Chand HS、Rahman I、Unwalla HJ。TGF-β1は、初代分化ヒト気管支上皮細胞におけるウイルス負荷を増加させ、HIV-1の潜伏を促進する。Sci Rep (2019) 9(1):12552. doi: 10.1038/s41598-019-49056-6
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kaczmarek Michaels K, Natarajan M, Euler Z, Alter G, Viglianti G, Henderson AJ. Blimp-1、メモリーCD4+ T細胞におけるHIV-1プロウイルスの転写を抑制する内在性因子。J Immunol (2015) 194(7):3267-74. doi: 10.4049/jimmunol.1402581.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
TGF-βシグナル伝達の遮断は、in vivoでHIV-1/SIVリザーバーと免疫応答を再活性化する。JCIインサイト(2022)7(21):e162290.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
重症COVID-19におけるNK細胞の機能障害: TGF-β誘導によるインテグリンβ2のダウンレギュレーションは、NK細胞の細胞傷害性を制限する。シグナル伝達ターゲットザー(2022)7(1):32. doi: 10.1038/s41392-022-00892-5
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Viel S, Marcais A, Guimaraes FS, Loftus R, Rabilloud J, Grau M, et al. TGF-βは、mTOR経路を抑制することにより、NK細胞の活性化と機能を阻害する。Sci Signal (2016) 9(415):ra19. doi: 10.1126/scisignal.aad1884
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
NK細胞に基づく免疫チェックポイント阻害。Doi:10.3389/fimmu.2020.00167。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Andre P, Denis C, Soulas C, Bourbon-Caillet C, Lopez J, Arnoux T, et al. 抗NKG2A mAbは、T細胞とNK細胞の両方を解き放つことで抗腫瘍免疫を促進するチェックポイント阻害剤である。Cell (2018) 175(7):1731-43 e13. doi: 10.1016/j.cell.2018.10.014.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Ducoin K, Oger R, Bilonda Mutala L, Deleine C, Jouand N, Desfrancois J, et al. ヒト大腸がんにおける抗腫瘍CD8 T細胞応答を高めるためのNKG2Aの標的化。大腸癌におけるNKG2Aを標的とした抗腫瘍CD8 T細胞応答の増強.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Ruggeri L, Urbani E, Andre P, Mancusi A, Tosti A, Topini F, et al. 抗NKG2A抗体投与による白血病細胞および正常造血細胞への影響。Haematologica (2016) 101(5):626-33. doi: 10.3324/haematol.2015.135301.
PubMed Abstract|クロスリファレンス全文|Google Scholar
ナチュラルキラー細胞阻害受容体NKG2Aを遮断することにより、ヒトナチュラルキラー細胞の活性が上昇し、マウスにおけるB型肝炎ウイルス感染が消失する。消化器病学(2013)144(2):392-40. doi: 10.1053/j.gastro.2012.10.039
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
COVID-19患者における抗ウイルスリンパ球の機能的消耗。細胞分子免疫学(2020)17(5):533-5. doi: 10.1038/s41423-020-0402-2
PubMed Abstract|クロスリファレンス全文|Google Scholar
COVID-19と闘うための潜在的アプローチ:ミニレビュー。Di:10.1007/s11033-020-05988-1。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
再発/難治性多発性骨髄腫患者を対象とした抗 KIR 抗体 IPH2101 の第 1 相試験。血液 (2012) 120(22):4324-33. doi: 10.1182/blood-2012-06-438028.
パブコメ抄録|クロスリファレンス全文|Google Scholar
モノクローナル抗体IPH2101によるKIR2Dのチェックポイント阻害は、骨髄腫患者におけるNK細胞の収縮と応答性低下を誘導する。Clin Cancer Res (2016) 22(21):5211-22. doi: 10.1158/1078-0432.CCR-16-1108.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Vey N, Goncalves A, Karlin L, Lebouvier-Sadot S, Broussais F, Marie D, et al. さまざまな血液がん(HEM)または固形がん(SOL)の患者(pts)を対象とした、完全ヒト抗 KIR モノクローナル抗体(mAb)である IPH2102(lirilumab, BMS-986015, LIRI)の第 1 相用量漸増試験。J Clin Oncol (2015) 33(15_suppl):3065.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
新規抗阻害性 KIR 抗体 IPH2101 とレナリドマイドの併用によるナチュラルキラー細胞対多発性骨髄腫効果の増強。血液 (2011) 118(24):6387-91.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Benson DM、Cohen AD、Jagannath S、Munshi NC、Spitzer G、Hofmeister CC、et al.再発/難治性多発性骨髄腫患者を対象とした抗 KIR 抗体 IPH2101 とレナリドマイドの第 I 相試験。Clin Cancer Res (2015) 21(18):4055-61. doi: 10.1158/1078-0432.CCR-15-0304.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Vey N, Bourhis J-H, Dombret H, Bordessoule D, Prébet T, Charbonnier A, et al. 高齢の急性骨髄性白血病(AML)患者を対象とした抗ナチュラルキラー阻害受容体(KIR)モノクローナル抗体(1-7F9、IPH2101)の第I相試験:単回投与と反復投与の臨床的および免疫学的効果。血液 (2009) 114(22):632-. doi: 10.1182/blood.V114.22.632.632.
クロスレフ・フルテキスト|Google Scholar
Bagot M, Porcu P, Marie-Cardine A, Battistella M, William BM, Vermeer M, et al. 再発または難治性の皮膚T細胞リンパ腫患者におけるファースト・イン・クラスの抗KIR3DL2モノクローナル抗体IPH4102:国際的、ファースト・イン・ヒト、非盲検、第1相試験。Lancet Oncol (2019) 20(8):1160-70. doi: 10.1016/S1470-2045(19)30320-1
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
腫瘍免疫療法におけるPD-1/PD-L1チェックポイント阻害薬。この論文では、腫瘍免疫療法におけるPD-1/PD-L1チェックポイント阻害薬について解説する。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
AlsaabHO、Sau S、Alzhrani R、Tatiparti K、Bhise K、Kashaw SK、他:がん免疫療法のためのPD-1およびPD-L1チェックポイントシグナル阻害:メカニズム、組み合わせ、および臨床転帰。論文タイトル:Front Pharmacol(2017)8:561.doi: 10.3389/fphar.2017.00561.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
PD-1/PD-L1軸はナチュラルキラー細胞対多発性骨髄腫効果を調節する:新規抗PD-1モノクローナル抗体CT-011の治療標的。血液 (2010) 116(13):2286-94.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
末梢血細胞上のPD-1発現は腎細胞がん患者の病期とともに増加し、外科的腫瘍切除後は急速に減少する。Cancer Immunol Res (2014) 2(4):320-31. doi: 10.1158/2326-6066.CIR-13-0133.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
PD-1は、カポジ肉腫患者における活性化NK細胞の機能的消耗を媒介する。Oncotarget (2016) 7(45):72961-77. doi: 10.18632/oncotarget.12150.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Ai L, Chen J, Yan H, He Q, Luo P, Xu Z, et al. がん治療におけるPD-1/PD-L1阻害剤の研究状況と展望。Drug Des Devel Ther (2020) 14:3625-49. doi: 10.2147/DDDT.S267433.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ナチュラルキラー細胞におけるPD-1の発現とPD-1発現の関連性。HIV-1慢性感染症におけるナチュラルキラー細胞およびCD8(+)T細胞上のPD-1発現。ウイルス免疫学(2012)25(4):329-32.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Bertoletti A, Gehring AJ. B型肝炎ウイルス感染時の免疫反応。J Gen Virol (2006) 87(6):1439-49. doi: 10.1099/vir.0.81920-0
パブコメ抄録|クロスリファレンス全文|Google Scholar
C型肝炎ウイルス免疫療法におけるプログラム死-1/プログラム死-L1シグナル伝達経路とその遮断。World J Hepatol (2015) 7(23):2449-58. doi: 10.4254/wjh.v7.i23.2449.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
PD-1経路は、メモリーCD8の発生と機能を制御する。Cell Rep (2020) 31(13):107827. doi: 10.1016/j.celrep.2020.107827.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Aghbash PS, Eslami N, Shamekh A, Entezari-Maleki T, Baghi HB. SARS-CoV-2感染: PD-1/PD-L1とCTLA-4軸の役割。生命科学 (2021) 270:119124. doi: 10.1016/j.lfs.2021.119124.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
McNally B, Ye F, Willette M, Flaño E. 気道における上皮PDL-1の局所遮断は、インフルエンザウイルス感染時のT細胞機能とウイルスクリアランスを増強する。J Virol (2013) 87(23):12916-24. doi: 10.1128/JVI.02423-13.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Velu V, Titanji K, Zhu B, Husain S, Pladevega A, Lai L, et al. PD-1遮断によるin vivoでのSIV特異的免疫の増強。Nature (2009) 458(7235):206-10.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
PD-1受容体のin vivo遮断は、HIV-1ウイルス量を抑制し、ヒト化マウスにおけるCD4+ T細胞レベルを改善する。J Immunol (2013) 190(1):211-9. doi: 10.4049/jimmunol.1201108.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
B型慢性肝炎におけるプログラム死-1経路の遮断により、抗ウイルス性肝内T細胞応答が回復する。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マラリア曝露者のNK細胞におけるPD-1発現は、自然細胞傷害性の低下と抗体依存性細胞傷害性の亢進と関連している。感染免疫 (2020) 88(3):e00711-19. doi: 10.1128/IAI.00711-19.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Rao M, Valentini D, Dodoo E, Zumla A, Maeurer M. 感染症に対する抗PD-1/PD-L1療法:がんのパラダイムから学ぶ。Int J Infect Dis (2017) 56:221-8. doi: 10.1016/j.ijid.2017.01.028.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Davis ZB, Felices M, Verneris MR, Miller JS. ナチュラルキラー細胞養子移入療法:がんに対する防御の第一線を利用する。Cancer J (2015) 21(6):486-91。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
進行非小細胞肺がん患者における同種ナチュラルキラー細胞の養子移入の第I相試験。Cancer Immunol Immunother (2010) 59(12):1781-9. doi: 10.1007/s00262-010-0904-3.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Geller MA, Cooley S, Judson PL, Ghebre R, Carson LF, Argenta PA, et al. 再発卵巣がんおよび乳がん患者に対する同種ナチュラルキラー細胞療法の第Ⅱ相試験。細胞療法(2011)13(1):98-107. doi: 10.3109/14653249.2010.515582.
PubMed Abstract|クロスリファレンス全文|Google Scholar
進行腎細胞癌または黒色腫患者における同種細胞株NK-92の注入:第I相試験。細胞療法 (2008) 10(6):625-32. doi: 10.1080/14653240802301872
PubMed Abstract|クロスリファレンス全文|Google Scholar
Woan、Kim、Bjordahl R、Davis ZB、Gaidarova S、Goulding J、et al. 適応性NK細胞の特徴を利用して、免疫療法を強化するiPSC由来NK細胞を作製。細胞幹細胞 (2021) 28(12):2062-75 e5. doi: 10.1016/j.stem.2021.08.013.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
倪 Z、Knorr DA、Bendzick L、Allred J、Kaufman DS. ヒト多能性幹細胞由来のナチュラルキラー細胞によるキメラ受容体CD4zetaの発現はin vitroでの活性を向上させるが、in vivoでのHIV感染抑制は増強しない。Stem Cells (2014) 32(4):1021-31.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
潜伏期の逆転とナチュラルキラー細胞は、in vivoでHIVリザーバーを減少させる。Nat Commun (2022) 13(1):121. doi: 10.1038/s41467-021-27647-0
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
IL-15 trans-presentationはin vivoでヒトNK細胞の発生と分化を促進する。J Exp Med (2009) 206(1):25-34.
パブコメ要旨|全文|Google Scholar
癌患者を対象とした遺伝子組換えヒトインターロイキン15のヒト初臨床試験における再分布、増殖亢進、ナチュラルキラー細胞およびCD8 T細胞の活性化、ならびにサイトカイン産生。J Clin Oncol (2015) 33(1):74-82. doi: 10.1200/JCO.2014.57.3329
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Romee、Rosario M、Berrien-Elliott MM、Wagner JA、Jewell BA、Schappe T、他。 サイトカインにより誘導された記憶様ナチュラルキラー細胞は、骨髄性白血病に対して増強された反応を示す。Sci Transl Med (2016) 8(357):357ra123. doi: 10.1126/scitranslmed.aaf2341.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wagstaffe HR, Nielsen CM, Riley EM, Goodier MR. IL-15はIL-12産生を促進することにより、インフルエンザに対する多機能性NK細胞応答を促進する。J Immunol (2018) 200(8):2738-47. doi: 10.4049/jimmunol.1701614.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Garrido C, Abad-Fernandez M, Tuyishime M, Pollara JJ, Ferrari G, Soriano-Sarabia N, et al. Interleukin-15刺激ナチュラルキラー細胞は、潜伏期の逆転後にHIV-1感染細胞をクリアする。J Virol (2018) 92(12):262. doi: 10.1128/JVI.00235-18
クロスリーフフルテキスト|Google Scholar
Cytokine-induced memory-like NK cells: from the basics to clinical applications. 論文タイトル:「記憶様NK細胞:基礎から臨床応用まで」(Front Immunol, 2022)13:884648.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
サイトカイン活性化はヒト記憶様NK細胞を誘導する。血液(2012)120(24):4751-60.
パブコメ抄録|クロスリファレンス全文|Google Scholar
ベリアン-エリオットMM、ワグナーJA、フェニガーTA。ヒトサイトカイン誘導記憶様ナチュラルキラー細胞。J Innate Immun (2015) 7(6):563-71.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Shapiro RM, Birch GC, Hu G, Vergara Cadavid J, Nikiforow S, Baginska J, et al. 移植後再発に対して注入したドナー記憶様NK細胞の拡大、持続、および有効性。J Clin Invest(2022)132(11):e154334。
PubMed Abstract|クロスリファレンス全文|Google Scholar
ドナー記憶様NK細胞は、移植後に再発したAMLの小児患者において持続し、寛解を誘導する。血液(2022)139(11):1670-83.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Berrien-Elliott、Foltz JA、Russler-Germain DA、Neal CC、Tran J、Gang M、他。造血細胞移植ドナー由来の記憶様NK細胞は、白血病患者への移植後も機能的に持続する。Sci Transl Med (2022) 14(633):eabm1375. doi: 10.1126/scitranslmed.abm1375.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ellis-Connell AL, Balgeman AJ, Zarbock KR, Barry G, Weiler A, Egan JO, et al. ALT-803は、抗レトロウイルス治療を行わない場合に、シミアン免疫不全ウイルスの複製を一過性に減少させる。J Virol (2018) 92(3):e01748-17. doi: 10.1128/JVI.01748-17.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
ヒトIL-15スーパーアゴニストN-803は、ウイルス特異的CD8+ T細胞およびNK細胞のB細胞濾胞への遊走を促進するが、ART抑制SHIV感染マカクにおける潜伏期間を逆転させない。このような背景のもとで、SHIVの潜伏期を逆転させることはできなかった。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
HIV感染者におけるIL-15スーパーアゴニストN-803の安全性とウイルス学的影響:第1相試験。Nat Med (2022) 28(2):392-400. doi: 10.1038/s41591-021-01651-9
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lynch RM, Boritz E, Coates EE, DeZure A, Madden P, Costner P, et al. HIV-1慢性感染時における広域中和抗体VRC01投与のウイルス学的効果。Sci Transl Med (2015) 7(319):319ra206. doi: 10.1126/scitranslmed.aad5752.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
HIV感染症の治療と予防のための広範中和抗体。この論文では、HIV感染症の治療と予防のための広範な中和抗体について解説している。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
広範中和抗体を誘導するHIV-1ワクチンの戦略。Nat Rev Immunol (2023) 23(3):142-58. doi: 10.1038/s41577-022-00753-w
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
タイにおけるHIV-1感染予防のためのALVACおよびAIDSVAXによるワクチン接種。タイにおけるHIV-1感染予防のためのALVACとAIDSVAXの接種。
パブコメ抄録|クロスリファレンス全文|Google Scholar
HIV-1ワクチン有効性試験の免疫相関分析。この論文では、HIV-1ワクチンの有効性試験における免疫相関の解析を行った。
パブコメ抄録|クロスリファレンス全文|Google Scholar
タイ第III相HIV1型ワクチン試験(RV144)レジメンは、gp120のV2ループ内の保存領域を標的とする抗体を誘導する。AIDS Res Hum Retroviruses (2012) 28(11):1444-57. doi: 10.1089/aid.2012.0103.
パブコメ抄録|クロスリファレンス全文|Google Scholar
ワクチン誘発Env V1-V2 IgG3は、HIV-1感染リスクの低下と相関し、ワクチン接種後すぐに低下する。Sci Transl Med (2014) 6(228):228ra39. doi: 10.1126/scitranslmed.3007730.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
HIV-1ワクチンの有効性試験で得られた抗体依存性細胞傷害性媒介抗体は、複数のエピトープを標的とし、VH1遺伝子ファミリーを優先的に使用する。J Virol (2012) 86(21):11521-32. doi: 10.1128/JVI.01023-12.
PubMedアブストラクト|Ref全文|Google Scholar
FCGR2C多型はRV144試験におけるHIV-1ワクチン防御と関連する。J Clin Invest (2014) 124(9):3879-90. doi: 10.1172/JCI75539.
PubMed Abstract|クロスリファレンス全文|Google Scholar
ADCCは、弱毒化SIVの持続感染中に経時的に発現し、SIV(mac)251チャレンジに対する完全防御と関連する。この論文では、ADCCがSIV(mac)251チャレンジに対する完全防御と関連することを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
組換え型gp120ワクチン誘導抗体は、Fc受容体を有するエフェクター細胞の存在下でHIV-1の臨床株を阻害し、HIV感染率と逆相関する。J Immunol (2007) 178(10):6596-603.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
子宮頸管抗体依存性細胞傷害を有する女性は性器HIV-1 RNA量が少ない。J Infect Dis (2004) 190(11):1970-8。
PubMed Abstract|クロスリファレンス全文|Google Scholar
HIV感染の緩徐な進行に関連する特異的抗体依存性細胞細胞障害応答。免疫学 (2013) 138(2):116-23.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
HIV-1に対する生体内広範中和抗体によるHIV-1感染細胞のクリアランス促進。科学(2016)352(6288):1001-4.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
HIV-1による抗体中和とエスケープ。Nature(2003)422(6929):307-12。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
広範中和抗体からのHIV-1のin vivoエスケープダイナミクスの予測。この論文では、HIV-1が中和抗体から生体内に脱出するダイナミクスを予測した。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Dingens AS, Arenz D, Weight H, Overbaugh J, Bloom JD. 広範中和抗体からのHIV-1エスケープの抗原アトラスは、機能的エピトープと構造的エピトープを区別する。Immunity (2019) 50(2):520-32.e3. doi: 10.1016/j.immuni.2018.12.017.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Isitman G, Stratov I, Kent SJ. HIV感染における抗体依存性細胞傷害性とNK細胞駆動性免疫逃避:HIVワクチン開発への示唆。HIV 感染における抗体依存性細胞傷害と NK 細胞を介した免疫逃避:HIV ワクチン開発の意義. Adv Virol (2012) 2012:637208.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Tudor D, Yu H, Maupetit J, Drillet AS, Bouceba T, Schwartz-Cornil I, et al. Isotype modulates epitope specificity, affinity and antiviral activities of anti-HIV-1 human broadly neutralizing 2F5 antibody. この論文では、抗HIV-1ヒト広中性化2F5抗体のエピトープ特異性、親和性、抗ウイルス活性を同型により調節することを明らかにした。
パブコメ抄録|クロスリファレンス全文|Google Scholar
IgG3は、HIV V2特異的広域中和抗体の中和効力とFcエフェクター機能を増強する。PloS Pathog (2019) 15(12):e1008064. doi: 10.1371/journal.ppat.1008064.
PubMed Abstract|クロスリファレンス全文|Google Scholar
de Taeye SW, Bentlage AEH, Mebius MM, Meesters JI, Lissenberg-Thunnissen S, Falck D, et al. ヒトIgGアロタイプのFcγR結合とADCC活性。論文タイトル:Front Immunol (2020) 11:740.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Demaria O, Gauthier L, Debroas G, Vivier E. がん免疫療法におけるナチュラルキラー細胞エンゲージャー: 次世代の免疫腫瘍学的治療法。Eur J Immunol (2021) 51(8):1934-42. doi: 10.1002/eji.202048953.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Pinto S, Pahl J, Schottelius A, Carter PJ, Koch J. Reimagining antibody-dependent cellular cytotoxicity in cancer: The potential of natural killer cell engagers. トレンド免疫学 (2022) 43(11):932-46.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Au KM, Park SI, Wang AZ. 標的化学免疫療法のための三特異的ナチュラルキラー細胞ナノエン ゲンガー。このような研究は、日本ではほとんど行われていない。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Mei Y, Xiang B, Yang J. Novel strategies for redirecting NK cells in cancer immunotherapy. J Nutr Oncol (2017) 2(2):66-72. doi: 10.34175/jno201702003.
CrossRef Full Text|Google Scholar
Ma J, Mo Y, Tang M, Shen J, Qi Y, Zhao W, et al. Bispecific Antibodies: from research to clinical application. 本論文は、「二重特異性抗体:研究から臨床応用へ」をテーマに、二重特異性抗体に関する研究成果をまとめたものである。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
次世代二重特異性抗体を用いた抗腫瘍治療薬の課題と戦略。細胞分子免疫学(2020)17(5):451-61. doi: 10.1038/s41423-020-0417-8.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Vallera DA, Felices M, McElmurry R, McCullar V, Zhou X, Schmohl JU, et al. IL15三特異的キラー・エンゲイジャー(TriKE)は、ナチュラルキラー細胞をCD33+ターゲットに特異的にすると同時に、持続性、in vivoでの拡大、機能強化を誘導する。Clin Cancer Res (2016) 22(14):3440-50. doi: 10.1158/1078-0432.CCR-15-2710.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Huehls AM, Coupet TA, Sentman CL. がん免疫療法のための二重特異性T細胞エンゲイジャー。Immunol Cell Biol (2015) 93(3):290-6. doi: 10.1038/icb.2014.93.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Sung JA, Pickeral J, Liu L, Stanfield-Oakley SA, Lam CY, Garrido C, et al. Dual-Affinity Re-Targeting proteins direct T cell-mediated cytolysis of latently HIV-infected cells. J Clin Invest (2015) 125(11):4077-90. doi: 10.1172/JCI82314.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
B細胞リンパ腫の最適なリダイレクトT細胞殺傷を達成するための二重親和性再標的分子の応用。血液(2011)117(17):4542-51.
PubMed Abstract|クロスリファレンス全文|Google Scholar
二特異性および三特異性NK細胞エンゲイジャー:標的NK細胞免疫療法の新しい道。Mol Diagn Ther (2021) 25(5):577-92.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
NK細胞を介したADCCの影響:CD16分子の構造と発現は、健常日本人におけるFcγRIIIa-V158F遺伝子型によって異なる。Hum Immunol (2016) 77(2):165-71. doi: 10.1016/j.humimm.2015.11.001.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
CD16aの生物学から抗体依存性細胞媒介性細胞傷害性の改善へ。論文タイトル:CD16aの生物学から抗体依存性細胞傷害性の改善へ.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
FcγRIIIa受容体ポリペプチド(FcγRIIIa受容体ポリペプチドとFcγRIIIa受容体ポリペプチドの複合体)、FcγRIIIa受容体ポリペプチドとFcγRIIIa受容体ポリペプチドの複合体。FcγRIIIa受容体多型は、HIVに対するNK細胞を介したADCC活性に影響を及ぼす。BMC Infect Dis (2019) 19(1):1053. doi: 10.1186/s12879-019-4674-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
フェリスM、レンヴィクTR、デイビスZB、ミラーJS、バジェラDA。NK細胞を介した腫瘍細胞の標的化を改善するためのbiKEおよびTriKEの生成。Doi: 10.1007/978-1-4939-3684-7_28.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
TriKEs and BiKEs join CARs on the cancer immunotherapy highway. Hum Vaccin Immunother (2016) 12(11):2790-6. doi: 10.1080/21645515.2016.1198455.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
ナチュラルキラー細胞は解き放たれた: NKを介した抗腫瘍免疫療法におけるチェックポイント受容体の遮断とBiKE/TriKEの利用。Semin Immunol (2017) 31:64-75. doi: 10.1016/j.smim.2017.07.011.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
新規HIVエンベロープ二特異的キラー・エンゲイジャーは、HIV感染細胞に対するナチュラルキラー細胞を介したADCC応答を増強する。血液 (2016) 128(22):2517-. doi: 10.1182/blood.V128.22.2517.2517
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Wilen CB, Tilton JC, Doms RW. HIV:細胞結合と侵入。HIV:細胞への結合と侵入。
パブコメ抄録|クロスリファレンス全文|Google Scholar
HIV-1の強力な阻害剤およびワクチン免疫原の構成要素としてのヒトCD4ドメインの設計。この論文では、ヒトCD4ドメインがHIV-1を強力に阻害し、ワクチン免疫原の構成要素となることを明らかにした。
パブコメ要旨|全文|Google Scholar
Sakihama T, Smolyar A, Reinherz EL. CD4のオリゴマー化はクラスII主要組織適合複合体タンパク質との安定な結合には必要であるが、ヒト免疫不全ウイルスgp120との相互作用には必要ない。この論文では、CD4がヒト免疫不全ウイルスgp120と相互作用するためには、クラスII主要組織適合複合体タンパク質と安定に結合することが必要であるが、ヒト免疫不全ウイルスgp120と相互作用するためには、CD4のオリゴマー化が必要ではないことを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Lamarre D, Capon DJ, Karp DR, Gregory T, Long EO, Sékaly RP. クラスII MHC分子とHIV gp 120エンベロープタンパク質は、CD4分子の機能的に異なる領域と相互作用する。EMBO J (1989) 8(11):3271-7. doi: 10.1002/j.1460-2075.1989.tb08487.x.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
単一のヒトCD4および抗体ドメインに基づく、極めて強力かつ広範な交差反応性を有する二重特異性多価HIV-1阻害剤。J Virol (2014) 88(2):1125-39. doi: 10.1128/JVI.02566-13.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Li W, Wu Y, Kong D, Yang H, Wang Y, Shao J, et al. ヒト抗CD16抗体ドメインと融合したワンドメインCD4は、HIV-1感染細胞を効果的に殺傷する。Sci Rep (2017) 7(1):9130. doi: 10.1038/s41598-017-07966-3.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
悪性腫瘍に対するCAR-NK細胞療法の前臨床および臨床研究。前臨床および臨床における悪性腫瘍に対するCAR-NK細胞療法の研究。
パブコメ要旨|クロスリファレンス全文|Google Scholar
COVID-19の治療におけるIL-15標的スパイクを分泌する市販のCARナチュラルキラー細胞。Nat Commun (2022) 13(1):2576.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Mazarzaei A, Vafaei M, Ghasemian A, Mirforughi SA, Rajabi Vardanjani H, Alwan NAS. HIVワクチン接種と根絶のためのメモリーおよびCAR-NK細胞ベースの新規アプローチ。J Cell Physiol (2019) 234(9):14812-7. doi: 10.1002/jcp.28280.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
HIV-1 gp160の様々なエピトープを標的とするユニバーサルCAR-NK細胞。ACS Chem Biol (2020) 15(8):2299-310. doi: 10.1021/acschembio.0c00537.
PubMedアブストラクト|クロスリファレンス|Google Scholar
キーワード NK細胞、NK細胞機能不全、HIV、C型肝炎、CMV、インフルエンザ、SARS-CoV-2、免疫療法
引用 Bjorgen JC, Dick JK, Cromarty R, Hart GT and Rhein J(2023)ウイルス感染時のNK細胞サブセットと機能障害:治療法の新しい道?Front. Immunol. 14:1267774.
受理された: 2023年7月27日;受理:2023年9月25日;
発行:2023年10月19日
編集者
ニールス・A・W・レンマーマン、ボン大学病院、ドイツ
査読者
シルヴァナ・ガウディエリ、西オーストラリア大学、オーストラリア
ラミン・ヤゴビ(イラン、シラーズ医科大学
Copyright © 2023 Bjorgen, Dick, Cromarty, Hart and Rhein. 本論文は、クリエイティブ・コモンズ 表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文である。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Jacob C. Bjorgen, bjorg091@umn.edu
本誌編集長: Jacob C. Bjorgen, Viral Pathogenesis and Evolution Section, Laboratory of Infectious Diseases, National Institute of Allergy and Infectious Diseases, National Institutes of Health, Bethesda, MD, United States.
免責事項:本論文で表明されたすべての主張は、著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または承認されるものではありません。
こんな人たちも見ています
マウスナチュラルキラー細胞の発生制御
ウィルフォード・ゴー、ニコラス・D・ハンティントン
COVID-19回復期患者における免疫系の包括的フローサイトメトリープロファイリング
Sergio Gil-Manso、Iria Miguens Blanco、Rocío López-Esteban、Diego Carbonell、Luis Andrés López-Fernández、Lori West、Rafael Correa-Rocha、Marjorie Pion
ヒト血液中の自然型骨髄性免疫細胞のモニタリングのための標準化され検証されたフローサイトメトリー法の開発
Kyra van der Pan、Sandra de Bruin-Versteeg、Daniela Damasceno、Alejandro Hernández-Delgado、Alita J. van der Sluijs-Gelling、Wouter B. L. van den Bossche、Inge F. de Laat、Paula Díez、Brigitta A. E. Naber、Annieck M. Diks、Magdalena A. Berkowska、Bas de Mooij、Rick J. Groenland、Fenna J. de Bie、Indu Khatri、Sara Kassem、Anniek L. de Jager、Alesha Louis、Julia Almeida、Jacqueline A. M. van Gaans-van den Brink、Alex-Mikael Barkoff、Qiushui He、Gerben Ferwerda、Pauline Versteegen、Guy A. M. Berbers、Alberto Orfao、Jacques J. M. van Dongen、Cristina Teodosio。
MDSCの存在は、肝硬変患者におけるCOVID-19ワクチン接種後の抗原特異的T細胞反応性の障害と関連する。
Andreas Törnell、Elin Blick、Samer Al-Dury、Hanna Grauers Wiktorin、Johan Waern、Johan Ringlander、Sigrun Einarsdottir、Magnus Lindh、Kristoffer Hellstrand、Martin Lagging、Anna Martner
結核菌EspRはIL-4を転写制御することによりTh1-Th2シフトを調節し、共感染時のマイコバクテリアの持続性とHIVの増殖を増加させる。
Sriram Yandrapally、Anushka Agarwal、Archismita Chatterjee、Satarupa Sarkar、Krishnaveni Mohareer、Sharmistha Banerjee
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
