敗血症における免疫調節における間葉系幹細胞とマクロファージの可塑性とクロストーク
本文へスキップ
トップバーナビゲーション
免疫学の最前線
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
474
総閲覧数
17
ダウンロード
記事のインパクトを見る
記事のaltmetricスコアは2
レビュー記事
Front. 免疫学、2024年1月30日
Sec.免疫寛容とその制御
第15巻 - 2024年|https://doi.org/10.3389/fimmu.2024.1338744
この論文は次の研究テーマの一部です
免疫応答と疾患における環境因子
全ての論文を見る
敗血症における免疫調節における間葉系幹細胞とマクロファージの可塑性とクロストーク
https://www.frontiersin.org/articles/10.3389/fimmu.2024.1338744/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FIMMU_XXXXXXXX_auto-dlvrit
Bin Liu1 Peifeng Cheng1 Dan Mu1 Huimin Du2* Bailin Niu1,3* 1.
1Department of Critical Care Medicine, Chongqing Key Laboratory of Emergency Medicine, School of Medicine, Chongqing University Central Hospital, Chongqing University, China 重慶大学医学部救急医学重点実験室、重慶、中国
重慶医科大学第一附属病院腫瘍科(中国、重慶市
米国マサチューセッツ州ボストン、ブリガム・アンド・ウィメンズ病院およびハーバード大学医学部外科。
敗血症は、感染に対する宿主免疫応答の調節障害を特徴とする多臓器疾患である。免疫反応の動態は敗血症の発症と進行に重要な役割を果たしている。マクロファージはその不均一性と可塑性で知られ、敗血症の免疫反応に積極的に関与する。これらの細胞は刻々と変化する免疫微小環境の影響を受け、両面的な免疫制御を示す。近年、敗血症における間葉系幹細胞(MSC)の免疫調節機能が注目されている。免疫微小環境はMSCsに大きな影響を与え、MSCsは諸刃の剣のような二重の免疫調節機能を示すようになる。この発見は、敗血症の進行を理解し、効果的な治療戦略を考案する上で非常に重要である。重要なことは、マクロファージと間葉系幹細胞には密接な相互関係があり、敗血症の際には、これら2つの細胞型が相互作用し、協力して炎症過程を制御しているという事実である。本総説では、敗血症時の免疫微小環境におけるマクロファージとMSCの可塑性と、両者間の複雑なクロストークについてまとめている。このことは、今後これらの細胞を臨床における免疫調節治療に用いる上で、重要な関心事である。
はじめに
敗血症は、感染に対する不均衡な免疫応答によって引き起こされる多臓器機能不全を特徴とし(1, 2)、死亡率の高さと医療負担の大きさから、公衆衛生上の重要な課題となっている(3)。敗血症の病態は、免疫恒常性と複雑に関連しており、初期段階では過剰な全身炎症反応が特徴的であり、その後、宿主免疫系と病原体との間のダイナミックな相互作用が続き、回復または免疫抑制の長期化という結果を決定する(4, 5)。この過程で、2種類の免疫細胞が重要な役割を果たす。
マクロファージは自然免疫系の重要な構成要素であり、末梢血や様々な臓器に存在し、貪食を通して病原体の除去に貢献している。特筆すべきは、マクロファージが驚くべき可塑性を示すことであり、それはいくつかの要因に影響される。マクロファージはその起源に基づいて、胚組織に由来する組織常在マクロファージ(RTM)と末梢血単球由来マクロファージ(mo-mac)に分類することができる。これらのサブセットはそれぞれ異なる分化過程を経て、特に異なる免疫微小環境において多様な表現型と機能を持つようになる。Parkらは、RTMが疾患状態において持続的な炎症反応と広範な損傷を媒介する一方、疾患に関連したシグナルがmo-macsの非定常状態の分化を促進し、それによって疾患の進行を悪化させることを示唆している(6)。この分岐がマクロファージサブセット間の不均一性を生み出している。さらに、極性化はマクロファージの可塑性にさらに寄与し、マクロファージは免疫微小環境中の異なるシグナル分子によってM1とM2の表現型に極性化される。これらの極性化マクロファージは、敗血症のすべての段階に関与し、ほぼ正反対の免疫機能を示す(7)。M1型マクロファージが産生するサイトカインの循環濃度が高いほど、敗血症の死亡率と正の相関があることが報告されている(8)。
間葉系幹細胞(MSCs)は、様々な細胞型に分化できる多能性幹細胞であり、炎症性微小環境とコミュニケーションをとり、免疫系を増強または抑制する能力を持っている(10)。マクロファージを標的とすることで、MSCの免疫調節作用を活用することは、敗血症の治療に有望である(11, 12)。ここでは、敗血症の文脈における、様々な経路を介したMSCによる免疫調節について概説する。さらに、MSC由来の細胞外小胞(MSC EVs)を敗血症治療に用いる際の進歩についても検討する。MSC EVsは、同様の生物学的活性、低い免疫原性、最小限の発がん性リスク、シグナル伝達分子を輸送することで他の細胞と効果的にコミュニケーションする能力(13, 14)を有している。
敗血症の発症は、免疫微小環境の動態や免疫系の制御と密接な関係がある(図1)。マクロファージは、その不均一性、可塑性、機能的多様性から、敗血症に対する免疫反応の開始と制御に極めて重要な役割を果たしている。病原体を除去し、組織損傷を誘発し、炎症を促進し、炎症を抑制するマクロファージの能力は、敗血症の転帰を改善または悪化させる。同様に、MSCは炎症性微小環境とダイナミックに関連しており、この環境におけるサイトカイン濃度の変化は、MSCの免疫調節機能を変化させ、その結果、免疫応答を制御する可能性がある。この総説では、敗血症のさまざまな免疫段階におけるマクロファージとMSCのそれぞれの免疫調節可塑性と、敗血症環境におけるそれらの相互作用について包括的にまとめている。
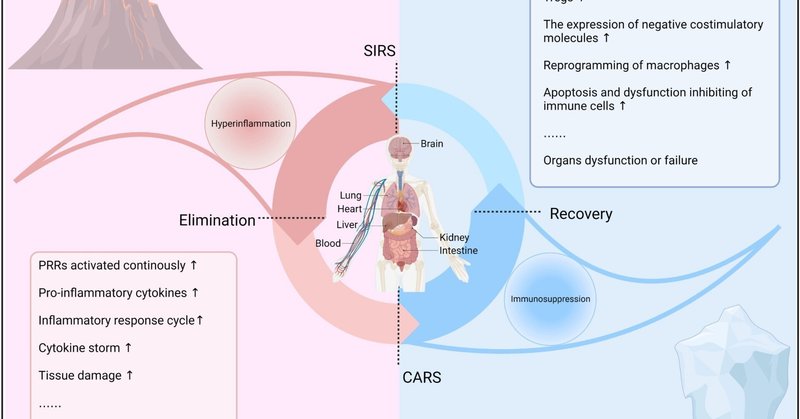
図1
www.frontiersin.org
図1 敗血症における免疫反応の動態。敗血症では、宿主細胞によるPRRの認識後、病原体を排除するために自然免疫反応と適応免疫反応が活性化され、全身性炎症反応症候群(SIRS)を引き起こす可能性がある。同時に、代償性抗炎症反応(CARS)が過剰な炎症を防ぎ、免疫バランスを維持して組織障害を軽減する。しかし、免疫調節異常は常に不均衡な状態をもたらし、その結果、炎症亢進や免疫抑制を引き起こし、敗血症の進行や予後を悪化させる。
マクロファージの基本的性質
発生源
マクロファージはほとんどすべての組織に存在し、哺乳類において宿主防御、創傷修復、免疫調節に重要な役割を果たしている。当初、これらの細胞は単球-貪食細胞系(MPS)の一部として分類され、骨髄前駆細胞に由来する単球のみに由来すると信じられていた(15)。しかし、その後の研究により、この見解は覆された。RTMの大部分は、卵黄嚢造血内皮細胞由来の多能性赤血球-骨髄系前駆細胞(EMP)に由来し、造血幹細胞(HSC)は大動脈-生殖腺-中咽頭(AGM)造血内皮細胞から発生することが判明した(16, 17)。系統追跡実験により、これらの所見はさらに確認されている(18-20)。胚由来のマクロファージが同定されたことで、MPSの理解は一変し、多様なマクロファージ系譜の存在が明らかになった。
免疫調節特性の可塑性
最近の研究では、マクロファージの先天性を研究する際に、異なる環境における分化過程と動態を考慮することの重要性が強調されている。RTMニッチの維持と拡大は、その場でのRTMの自己複製と単球の遊走と分化の2つが主な原因であると提唱されている(6)。異なる臓器や組織におけるRTMの割合は加齢とともに変化する傾向があり(21-26)、サブセットを区別し、末梢血由来マクロファージの機能的メカニズムを再考する必要があることを示している。Matthew D. Parkらは、単球の非定常分化という概念を導入し、定常状態ではM-CSFやGM-CSFなどの恒常性関連シグナルが単球のRTMへの連続的分化に寄与していることを示唆した。しかし、疾患状態では、インターロイキン(IL)-33、TSLP、損傷関連分子パターン(DAMPs)、病原体関連分子パターン(PAMPs)などの疾患関連シグナルが恒常性シグナルを上回り、単球が疾患関連マクロファージに分化する(6)。別の研究では、慢性肉芽腫性疾患(CGD)でも同様の傾向が見られ、MHCII+CD206+CD36+の成熟表現型を欠くNOX2産生単球によって疾患の進行が促進された。しかし、野生型(WT)mo-macsとCGD mo-macsをそれぞれCGDマウスとWTマウスに移植すると、免疫表現型と成熟挙動が逆転した(27)。この逆転は、炎症環境がmo-macsの表現型と機能をリモデリングしたためである。
さらに、遺伝子発現の可塑性により、マクロファージは様々な環境シグナルに応答して、異なる表現型に極性化され、異なる機能を発揮することができる(28)。2つの主な亜集団は、古典的に活性化された(M1)マクロファージと選択的に活性化された(M2)マクロファージである(29)(図2A)。重要なことは、マクロファージ極性化は複数の環境因子の影響を受けるダイナミックなプロセスであり、このプロセスが可逆的であることを示唆する証拠があることで、極性化したマクロファージでさえも新たな免疫条件下で別の表現型に移行する可能性があることが示唆されている(30, 31)。マクロファージの極性化は、マクロファージの表現型や機能の違いをすべて正確かつ完全に捉えているわけではなく、マクロファージの異種機能は、そのサブグループだけでなく、細胞が存在する臓器や組織の機能にも依存していることが、多くの研究によって明らかになっている(32)。したがって、異なる条件下で異なる表現型と生物学的機能を持つマクロファージサブタイプをより詳細に理解するには、さらなる研究が必要である。
図2
www.frontiersin.org
図2 マクロファージとMSCの極性化。(A)マクロファージの極性化;(B)MSCの極性化。TLR、Toll様受容体;MCSF、マクロファージコロニー刺激因子;GM-CSF、顆粒球マクロファージコロニー刺激因子;LPS、リポ多糖;PGE2、プロスタグランジン-2;TGF-β、トランスフォーミング増殖因子-β;TNF-α、腫瘍壊死因子-α;MSCs、間葉系幹細胞。
敗血症におけるマクロファージの免疫調節可塑性
敗血症時の炎症亢進への関与
敗血症の際、マクロファージは活性化され、細胞表面のパターン認識受容体(PRR)によるPAMPsの認識に応答して、炎症性表現型をとる。これらの細胞は、ケモカインCCL3およびCCL4によって炎症部位に動員される。さまざまなTLRアイソフォームは、病原微生物成分によって活性化される。例えば、リポ多糖(LPS)はLPS結合タンパク質(LBP)によって認識され、LPSはCD14とMD-2に結合してマクロファージに運ばれる。次にLPSはマクロファージ表面のTLR4に結合する。その後、TLR4はMyD88アダプタータンパクファミリーと相互作用し、マイトジェン活性化プロテインキナーゼ(MAPK)と核因子-κB(NF-kB)シグナル伝達経路の活性化を引き起こし、マクロファージのM1様表現型への移行を誘導する(33、34)。
病原体による活性化は、貪食、細胞傷害、抗原提示を促進する。マクロファージは酸素依存性および酸素非依存性の殺菌システムによって病原体を除去し、自然免疫防御応答を開始する。同時に、これらの細胞は他の免疫細胞をリクルートし、腫瘍壊死因子α(TNF-α)、IL-1、IL-6、IL-8、IL-12、遊走阻止因子(MIF)などの炎症性サイトカインの産生を共同で増加させる。これらのうち、IL-12はナチュラルキラー(NK)細胞を活性化し、IFN-γを産生するTh1エフェクター細胞へのT細胞の分化を促進する。IFN-γはSTATを介することにより、マクロファージの貪食・殺菌機能を高める(35)。IFN-γは、単球におけるHLA-DRの発現とTNF-αの分泌を増加させることにより、敗血症を改善することが研究で示されている(36)。炎症反応の初期段階で放出されるTNF-αとIL-1は、強力な炎症性メディエーターである。これらの因子は、前駆細胞からマクロファージへの分化を強化し、マクロファージの活性化を促進するだけでなく、他の免疫細胞を活性化して炎症性サイトカインを分泌させることにより、炎症カスケードを増幅させる。活性化されたマクロファージはMIFを放出し、微生物パターン認識受容体の発現をアップレギュレートすることで、全身の炎症反応を強める。これまでの研究で、MIFとCCL2が協力して炎症性単球をリクルートし、敗血症マウスの炎症性因子を高レベルにし、致死的ショックを引き起こすことが示されている(37)。PAMPsによって引き起こされる初期の自然免疫防御反応では、身体は外来病原体の侵入に速やかに反応する。しかし、DAMPsが持続的に放出されると、炎症性サイトカインカスケードを引き起こし、全身性反応症候群(SIRS)につながる急速で圧倒的な免疫反応を引き起こす。注目すべきは、PAMPとDAMPの活性化を区別する研究である。例えば、HMGB1は、PAMPによって活性化された場合は炎症性メディエーターとして、無菌組織傷害時に傷害細胞から受動的に放出された場合はDAMPとして作用する。MD-2-LPS-TLR4シグナル伝達経路を阻害することなく、四量体ペプチドであるHMGB1(P5779)とMD-2の結合を特異的に阻害すると、DAMPが介在する炎症性傷害が減弱することが示されている(38, 39)。次に、活性化されたM1マクロファージは、MHC IIとコスティミュレイトリー分子CD40、CD86、CD80をアップレギュレートし、同時にCXCL9、CXCL10、CXCL11を分泌してTh1細胞をリクルートし、適応免疫応答を開始する(40)。さらに、M1マクロファージは誘導性一酸化窒素合成酵素(iNOS)を高レベルで発現し、微生物にダメージを与えるNOと活性酸素種(ROS)を高レベルで産生する。これらのマクロファージは、外来病原体の侵入から身体を守るために、免疫反応を効果的に活性化し、強化する。マクロファージは敗血症の初期段階で圧倒的な免疫反応に貢献し、組織や臓器に必然的にダメージを与える。実際、これらの細胞は二重の役割を果たしている。
敗血症時の免疫抑制への関与
敗血症が進行すると、マクロファージは免疫抑制を媒介するようになり、これは炎症性サイトカインレベルの低下と抗炎症性サイトカイン産生の増加を特徴とする。この移行により、M1マクロファージはM2表現型として知られる明確な免疫状態へと変化する(31, 41)。M2マクロファージの活性化は、JAK-STAT6経路で作用するTh2サイトカインIL-4とIL-13、およびJAK-STAT3経路で作用するIL-10によって媒介される。この活性化により、KLF4(Krüppel-like factor)とSTAT6がNF-κBコアクチベーターから解離し、NF-κBの転写が阻害される(7, 42)。さらに、IL-13とIL-33の結合は、M2マクロファージにおける低酸素誘導性転写因子HIF-2αの蓄積を促進し、アルギナーゼ-1(Arg-1)、CCL17、CCL24などの関連遺伝子のアップレギュレーションを引き起こす(43)。M2マクロファージにおけるArg1とArg2の発現のアップレギュレーションは、アルギニンのオルニチンとポリアミンへの異化を可能にし、損傷部位の組織修復をサポートする(44, 45)。さらに、M2マクロファージはC型レクチンCD206とエンドサイトーシス受容体CD163の高発現を示し、貪食活性を高め、CCL17、CCL18、IL-10、トランスフォーミング増殖因子β(TGF-β)、IL-1Rの分泌を促進する。その結果、Th2細胞、Treg細胞、その他の免疫抑制細胞がリクルートされ、抗炎症性サイトカインを大量に放出する。さらに、M2マクロファージはTGF-β1と血小板由来増殖因子(PDGF)を放出し、血管新生、組織傷害の修復、線維芽細胞から筋線維芽細胞への分化を促進する(46)。
重要なことは、これらのマクロファージはM2遺伝子の顕著なアップレギュレーションを示すが、敗血症などの病的環境におけるこれらの単球/マクロファージの再プログラミングは、古典的なM2マクロファージの活性化とは異なることを示唆する新たな証拠が出てきたことである(47, 48)。例えば、P21はプログラミングにおいて重要な制御的役割を担っており、P21が欠損するとIFN-βが増加することが研究で示されている。その結果、炎症性傷害の回避に役立つ低応答性表現型に再プログラムされる単球の能力が損なわれる(48)。さらに、MyD88、IRAK-M、ST2など、TLRシグナル伝達のいくつかの負の制御因子が、マクロファージ寛容モデルにおいてアップレギュレートされ、その結果、M1遺伝子の発現が抑制されることが示されている(49)。エンドトキシン耐性として知られるこの現象は、エンドトキシンに対する反応が鈍く、IL-1RやIL-10のような抗炎症性サイトカインの放出が変化しないか増強され、炎症性サイトカインの放出が減少する、再プログラムされたマクロファージによって特徴づけられる。Davisらは、敗血症からの回復後の創傷治癒障害は、単球/マクロファージの炎症表現型の変化と関連していることを発見した。彼らは、ヒストンメチル化酵素MLL1がNF-κB遺伝子座に結合し、活性化ヒストンH3K4me3のメチル化が単球/マクロファージの表現型を変化させ、炎症性サイトカインが減少していても創傷修復の第一段階の開始を妨げることを発見した。さらに重要なことに、骨髄移植の研究から、このエピジェネティックな修飾は骨髄前駆細胞/幹細胞で始まり、末梢のマクロファージに伝達されることが明らかになり、敗血症の回復後もダメージが長く持続することが可能になった(50)。全体として、マクロファージの表現型と機能の再プログラミングは、免疫学的恒常性と免疫微小環境の影響を受けている。先に述べた単球の非定常分化と、再プログラムされたマクロファージで観察されるエンドトキシン耐性との間には、共通の関連性があるかもしれないが、この関連性を確立するにはさらなる研究が必要である。
単球/マクロファージ上のHLA-DRの発現低下は、敗血症患者における単球/マクロファージの機能低下や予後不良と関連している。ある前向き研究では、単球の30%未満にHLA-DRが持続的に発現していることが、敗血症における死亡率と独立して関連していた(51)。この発現低下は、IL-10やTGF-βシグナル伝達に関与するMHCクラスII分子やCD86コスティミュレイトリー分子の発現低下、さらには単球/マクロファージによる抗原提示の障害と関連している可能性がある。その結果、これらの細胞はTリンパ球と結合し、病原体タンパク質を提示し、適応免疫応答を活性化することができなくなる(49)。エフェクターT細胞の活性化は、マクロファージによる抗原提示に依存する敗血症時の適応免疫反応の重要な初期段階である。マクロファージは、その機能障害に加えて、PD-L1などのリンパ球陰性コスティミュレイトリー分子やその他のリガンドの発現を増加させ、それによって免疫応答を負に制御している。敗血症による免疫抑制の間、T細胞のアポトーシスが著しく増加することを示唆する証拠が増えている。さらに、残ったT細胞は機能的疲弊を起こす可能性があり、これは炎症性サイトカインや抗炎症性サイトカインの産生障害、PD-1やTIM-3のような陰性コスティミュレイトリー分子の発現増加、CD127(IL-7Rα鎖)の発現低下によって特徴づけられる(52, 53)。近年、敗血症におけるT細胞の標的療法が進歩している(54, 55)。敗血症患者のリンパ球を用いたin vitroの実験では、免疫チェックポイントPD-1やPD-L1の阻害剤による治療がリンパ球のアポトーシスを減少させることが証明されている(56, 57)。LAG3とPD-1の二重遮断は、リンパ球の免疫抑制を改善することが示されている(58, 59)。
したがって、マクロファージのM1様細胞からM2様細胞へのリプログラミング、抗原提示の減少、負のコスティミュレイトリー分子の発現増加は、敗血症の抗炎症メカニズムに関与しており、炎症亢進状態に対する代償反応として機能している。しかし、この病的な抗炎症反応は免疫麻痺を引き起こし、二次感染や死亡リスクの増加など、より深刻な結果をもたらす可能性がある(7)。
MSCの基本的性質
供給源
MSCは当初骨髄で発見されたが、その後、骨髄、脂肪、肺、心臓、筋肉など様々な組織で同定されている(60, 61)。これらの細胞は、自己複製能と、脂肪細胞、骨芽細胞、軟骨細胞などの中胚葉由来細胞に分化するユニークな能力を有しており、組織再生のための貴重な供給源となっている(62)。しかし、MSCsの特異的マーカーがなく、in vivoでの生物学的特性の理解も限られているため、難題となっている。現在、MSCの同定は、非特異的細胞マーカー(CD29、CD51、CD73、CD90、CD105は陽性、CD31、CD34、CD45は陰性)、線維芽細胞の形態、三系列分化能に依存している(63)。
多機能性
MSCの多能性分化能は、免疫原性の低さ、安全性、入手の容易さ、 倫理的な受容性と相まって、幹細胞を用いた再生治療の有望な候補と して位置づけられている(64-67)。MSCの様々な細胞種への分化能が確立されていることについては、広範 に検討されている(68-71)。重要なことは、異なる供給源から、異なる年齢で得られたMSCは、異種分化傾向や幹 性の程度を示すことである(72)。加えて、MSCは造血機能を欠き、CD34を発現しないが(73)、造血補助において独自の役割を果たす(74、75)。血管周囲MSCは、幹細胞因子(SCF)とCXCL12を産生することで、造血幹細胞の自己複製ニッチを維持している(76)。骨髄由来MSC(BMSC)は、NochおよびWntシグナル伝達経路を介して造血幹細胞の増殖と分化を促進する(77)。119人の患者を含むレトロスペクティブな多施設共同研究では、造血幹細胞とMSCを共移植した場合、生存率の改善と合併症の減少が示された(78)。さらに、MSCは組織傷害の修復において、傷害組織の種類に応じて、血管新生の促進、筋線維芽細胞への分化、炎症の抑制、組織の恒常性の維持などの機能的適応性を示す(76)。
免疫調節活性
MSC移植は、様々な疾患の治療において潜在的な有用性を示している(79-83)。しかし、MSCはサイズが大きいため(約15~30μm)、静脈内投与すると肺毛細血管に巻き込まれやすく、分布が制限される(84)。このことは、MSCが治療効果を発揮する別の補助 的メカニズムの存在を示唆しており、MSCの免疫調節 機能がこの文脈で役割を果たしていると考えられてい る(85, 86)。MSCはケモカインレセプターを有し、炎症組織への遊走を可能にし、そこで免疫反応を制御し、組織修復に好都合な環境を作り出し、内因性修復機構を活性化する(87)。MSCの免疫調節能力は構成的なものではなく、文脈依存的なものであり、炎症環境に影響されることは注目に値する。これらの細胞は可塑的な免疫調節機能を示し、特定の免疫微小環境に応じて抗炎症作用や炎症促進作用を発揮する(88)。
敗血症におけるMSCの免疫調節可塑性
MSC1とMSC2
最近の研究から、MSCは迅速な免疫調節効果を発揮し、その効果はMSCの枯渇後も持続することが明らかになっており、敗血症などの免疫関連疾患の治療に有利であることが明らかになっている(83, 89, 90)。敗血症の初期段階では、グラム陰性菌由来のLPSのような外因性PAMPsが宿主細胞膜上のTLR4によって認識され、細胞内感染またはストレスシグナルが細胞内宿主小胞内のTLR7およびTLR8を活性化する。その後、MAPKやNF-kBなどの制御因子の活性化により免疫細胞が活性化され、炎症性サイトカイン、ケモカイン、抗菌ペプチドの分泌が促進され、最終的に自然免疫応答が開始され、外来病原体を排除する。HSP70は、MSC上のTLR2を介してNF-κBシグナル伝達経路を活性化し、MSCの炎症性表現型を誘導することが確認されている(91)。TLR4はLPSを相乗的に認識して結合し、同様の効果をもたらすが(92)、TLR3の活性化は敗血症モデルにおける生存率の改善につながる(93)。MSCsはTLR4とTLR3を発現しており、それらの活性化によって炎症性表現型(MSC1)または抗炎症性表現型(MSC2)が誘導される(94)(図2B)。MSCの表現型はToll様受容体と密接に関連しているようであり、敗血症における免疫反応を制御するための潜在的な標的となっている。
免疫調節は炎症性サイトカインの影響を受ける
炎症性サイトカインは、MSCsの免疫調節活性の刺激に重要な役割を果たしている。ほとんどの哺乳類におけるiNOSまたはインドールアミン2,3-ジオキシゲナーゼ(IDO)のアップレギュレーションは、げっ歯類における免疫調節の際に、MSCの免疫抑制スイッチとして機能する(87)。MSCがiNOSの発現をアップレギュレートし、一酸化窒素(NO)を生成するには、IFN-γや複数の炎症性サイトカインによる活性化が必要である。MSCによるケモカインの分泌はT細胞を惹きつけ、T細胞はその後、高濃度のNOによって抑制され、増殖と免疫活性の低下につながる。抗炎症状態では、免疫微小環境は逆転する。iNOSの発現は抑制され、MSCによるケモカインの分泌は減少せず、T細胞の免疫活性を高める。全体として、この逆転は炎症性サイトカインの影響を受けており、MSCの免疫制御の方向性を調節することができる。
Tリンパ球への影響
Tリンパ球のアポトーシスは、敗血症による免疫抑制の重要な因子である(95-97)。リンパ球数は、初期の敗血症の重要な指標となり、特に高齢患者において死亡率と関連している(98、99)(100、101)。MSCは、T細胞を標的として免疫反応を制御する潜在的な標的として浮上してきた。ケモカインや接着タンパク質の分泌を通じて、MSCはT細胞などの免疫細胞をリクルートする(88)。高レベルの炎症性因子が存在すると、MSCは、NO、IDO、プロスタグランジンE2(PGE2)、TGF-βなどの様々な免疫抑制メディエーターの産生を通じて、T細胞の増殖と分化を直接阻害する(102)。しかし、この免疫抑制効果は、炎症性サイトカインのレベルが低下するにつれて減少する(図3)。MSCを活性化T細胞と共培養し、デキサメタゾンを添加してT細胞の活性化を抑制すると、炎症性サイトカインの産生が減少し、その結果T細胞の免疫抑制が減少することが示されている(76)。
図3
www.frontiersin.org
図3 敗血症におけるマクロファージとMSCの免疫調節可塑性。敗血症では、単球由来マクロファージと組織常在マクロファージはM1マクロファージに分極し、一方、MSCは病原体の認識に応答してMSC1に分極する。M1マクロファージは病原体と闘うために炎症性サイトカインを放出し、激しい炎症と組織傷害を引き起こす。炎症性サイトカインやTh1由来のIFN-γで刺激されたMSCは、iNOSの発現を上昇させ、T細胞の機能を阻害することで免疫反応を抑制する。さらに、MSCはTLR4の認識に応答してMSC1に極性化し、炎症を促進する。抗炎症条件下では、マクロファージはM2表現型に偏極する一方、MSCはiNOS発現をダウンレギュレートし、炎症を促進する。さらに、MSCはTLR3の認識に応答してMSC2へと分極し、炎症を抑制することができる。(TLR、Toll様受容体;TNF-α、腫瘍壊死因子α;iNOS、誘導性一酸化窒素合成酵素;DAMPs、損傷関連分子パターン;HLA-DR、ヒト白血球抗原DR;NO、一酸化窒素)。
敗血症におけるMSCとマクロファージ間のクロストーク
敗血症におけるMSCのマクロファージへの影響
前述のように、マクロファージの不均一性は、その起源、免疫表現型、組織特異性によって決定される。炎症性傷害では、末梢単球が傷害部位に移動し、恒常的または非恒常的な炎症環境に基づいて様々な表現型に分化する。また、RTMは可逆的に異なる免疫表現型に分極し、炎症環境において再プログラムすることができる。MSCは、パラクリン免疫調節メディエーター、直接的な細胞間接触、EVの分泌を通じて、マクロファージの免疫表現型と機能を調節し、敗血症時の免疫バランスを回復させることができる。
細胞間直接接触
これまでの研究から、マクロファージに対するMSCの免疫調節作用は、少なくとも次の3つの経路を通じて起こると考えられている:(1)細胞表面分子を介した直接細胞間接触、(2)TGF-β、IDO、PGE2、TSG-6などのMSCによって生成されるパラクリンシグナル、(3)マクロファージによる貪食に応答したリプログラミング。Liuらは、MSCとCX3CR1-/Ly6Chi単球の共培養モデルを確立し、MSCが炎症性Ly6Chi単球のNR4A1発現を上昇させ、細胞間の直接接触を通じてLy6Chi単球をパトロールLy6Clo単球に変化させ、それによって心筋梗塞の予後を改善することを見出した(103)。角膜炎症性リンパ管新生に関する別の研究では、MSCsの全身投与により腫瘍壊死因子α刺激遺伝子6(TSG-6)の発現が上昇した。TSG-6は、CD11b+Ly6C+単球/マクロファージ表面のCD44と相互作用し、NF-κBシグナルを遮断し、炎症性単球/マクロファージの動員を減少させた(104)。TSGは約35kDaのタンパク質糖タンパク質であり、その後、様々な疾患において重要な抗炎症性の役割を果たすことが発見された(105)。さらにLiらは、MSCと炎症性マクロファージが直接接触することで、MSCにおけるTSG-6とCD200の発現を増加させることも示した。この相互作用により、炎症性マクロファージは抗炎症性表現型へとリプログラミングされ、これはMSCに発現するCD200と炎症性マクロファージに発現するCD200Rの結合により促進された(106)。CD200もまた、その受容体であるCD200Rと結合することで抗炎症作用を示す糖タンパク質である(107)。
パラクリン免疫調節メディエーター
MSCは、免疫調節メディエーターの分泌を通じて、パラクリン効果を発揮する。その1つのメカニズムは、T細胞特異的ケモカイン受容体CXCR3と相互作用することにより、近傍のT細胞をリクルートするケモカインの分泌である。さらに、MSCは炎症環境においてiNOSの発現を上昇させ、高濃度のNOを生成する。この局所的なNOの増加は、T細胞の活性と増殖を相乗的に阻害する(図3)(88)。興味深いことに、Yeらの研究では、MSCにおけるSIRT1の過剰発現が、NF-κBのアセチル化を低下させることによってiNOSの発現を抑制する一方で、SIRT1欠損の炎症性M1マクロファージでは、LPS活性化に反応してiNOSの発現が増加することが示された。著者らは、この矛盾したパターンは、炎症制御に対するiNOS活性の作用の違いに起因している可能性を示唆している。MSCによるNOの放出は、T細胞増殖と同種T細胞応答を抑制することができるが、一方、炎症性マクロファージは、侵入してきた病原体を排除するためにNOを使用する(108)。
MSCから分泌される炎症のもう一つの重要なメディエーターはPGE2である(図4A)。LPSまたはTNF-αによる活性化後、MSCはシクロオキシゲナーゼ-2(COX2)の発現を上昇させ、PGE2の放出を触媒する。その結果、プロスタグランジンEP2およびEP4受容体の活性化を通じて、マクロファージが抗炎症表現型を採用するように再プログラムされる。その結果、マクロファージは大量のIL-10を産生し、IL-6とTNF-αのレベルは低下する(109)。注目すべきことに、MSCはM1様およびM2様マクロファージ表現型を誘導することができ、MSCからのPGE2放出は、マクロファージに抗炎症性表現型を誘導すると同時に、NOX2活性と活性酸素産生の増加を通じてマクロファージの殺傷活性を高めることができる(12)。
図4
www.frontiersin.org
図4 敗血症におけるマクロファージとMSCのクロストーク。(A)直接的な細胞接触、パラクリンシグナル伝達、排出細胞分裂、ミトコンドリアの移動、MSC-EVを介したメッセージ伝達を介したマクロファージに対するMSCの作用。これらの相互作用により、敗血症時のマクロファージの表現型と機能が再プログラムされる。(B)M1マクロファージとM2マクロファージは、アポトーシス促進、直接動員、IL-1β発現促進など、MSCに対して異なる作用を及ぼし、MSCの骨形成分化に影響を与える。さらに、M1マクロファージとM2マクロファージは、炎症性サイトカインと抗炎症性サイトカインを放出することにより、MSCの免疫調節機能を変化させ、敗血症における異なる免疫環境を作り出す。(PGE2、プロスタグランジン-2;TGF-β、トランスフォーミング増殖因子-β;MSCs、間葉系幹細胞;MSC-Abs、間葉系幹細胞由来アポトーシス小体;MSC-EVs、間葉系幹細胞由来細胞外小胞;MEVs、マクロファージ由来細胞外小胞;iNOS、誘導性一酸化窒素合成酵素)。
治療目的でマクロファージに抗炎症性のM2表現型を誘導するMSCの能力は、数多くの研究で確認されているが(110-112)、従来の「M1/M2の二分法」というパラダイムは、否定されつつある。M1およびM2表現型だけでは、MSCによる制御を含むマクロファージの異質性を特徴づけるには不十分であることを示唆する証拠が増えている。ある研究では、TGF-βがMSCから分泌され、敗血症の炎症亢進期にAkt/FoxO1シグナル伝達経路を通じて貪食作用を増強しながら、マクロファージのM2極性を誘導することが示された(113)。しかし、マクロファージにおける活性酸素産生の低下と炎症の抑制が同時に起こることを示唆する反対側の報告もあった。大腸結紮穿刺(CLP)モデルにおいて、BMSCは細胞質E3ユビキチンリガーゼ(Parkin)の発現を上昇させ、骨髄由来マクロファージ(BMDM)におけるマイトファジーを増加させ、それによってミトコンドリアの活性酸素産生を減少させ、NLRP3インフラマソームの活性化を抑制し、炎症メディエーターであるIL-1βとIL-18の放出をブロックし、炎症反応を抑制した(114, 115)。これらの知見を総合すると、MSCは異なるメカニズムを通じて、敗血症の様々な局面においてマクロファージの表現型を制御できることがわかる。MSCは、炎症亢進時には炎症反応を緩和するためにM2様表現型を、免疫抑制時には免疫機能を回復させるためにM1様表現型を採用するようにマクロファージを制御する。さらに、マクロファージの貪食活性と殺傷活性を高め、抗炎症作用と組織修復を促進することは、敗血症治療の有望な戦略である。今後の研究では、根底にある現象とメカニズムのさらなる解明、異なるマクロファージ表現型の特異的マーカーの同定、それらの誘導条件の決定に焦点を当てるべきである。これらの努力は、MSCが制御するマクロファージ表現型の新規な様式の包括的理解に貢献し、MSCを用いた敗血症の臨床治療のための新たな戦略を提供するであろう。
貪食と内在化
MSCがマクロファージに対して効果を発揮するもう一つの方法は、内在化と貪食である。マクロファージによるMSCの貪食は、骨肉腫の抑制モ デルで研究されており、注入されたMSCのかなりの割合が、 腫瘍に到達する前に脾臓マクロファージに貪食されることが 確認されている(116)。喘息モデルでは、MSCは肺マクロファージに取り込まれた後、M2分極化を促進し、喘息症状を改善することが示された(117)。同様に、敗血症のマウスモデルでは、静脈内注射後、肺のマクロファージがMSCを貪食し、マウスの生存率が上昇することが観察された(118)。しかし、MSCを貪食した後、マクロファージがどのように再プログラミングを受け、敗血症を改善するのかについては疑問が残る。Minらは、マクロファージがLRPマーカーを発現し、アポトーシスを起こしたMSCの細胞質成分を内在化するというメカニズムを提唱した。その後、これらのマクロファージは抗原提示に関連する遺伝子をダウンレギュレートし、その結果、T細胞の活性化が抑制され、炎症が抑制される(119)。同様に、Piraghajらは、アポトーシスMSCとの同時培養に反応して、マクロファージがM2表現型に偏極する傾向があり、TNF-αとNOの産生が減少し、IL-10の産生が増加し、貪食活性が高まることを示した(120)。マクロファージは、アポトーシス細胞を飲み込むエフェロサイトーシス能力を有しており、アポトーシスに起因する炎症成分の放出を防ぎ、炎症によるダメージを軽減する役割を果たしている。これらの知見は、マクロファージがアポトーシスを起こしたMSCを貪食すると、その免疫活性と機能が変化することを示唆している。このことは、アポトーシスMSCの注入後の長期的な抗炎症作用を説明し、マクロファージとMSCの相互作用を解明する可能性がある。さらに、アポトーシスMSCが細胞膜の変形を起こし、MSCアポトーシスボディ(AB)と呼ばれる小胞構造を形成すると、アポトーシスMSCと同様の表面シグナルが露出するため、マクロファージを引き寄せ、貪食を受ける。さらに、MSC ABは、貪食に反応してM2分極を誘導することもできる(121)(図4A)。したがって、これらの知見は、MSCがそれ自体で免疫調節能を持っているだけでなく、その誘導体がマクロファージと相互作用して免疫応答を調節できることを示している。これらの相互作用をより詳細に調べるためには、さらなる研究が必要である。
マクロファージに対するMSC-EVの作用
様々な疾患の治療におけるMSCのユニークな利点にもかかわらず、その臨床応用にはまだいくつかの課題がある。第一に、MSCは注入後、肺毛細血管に滞留する傾向があり、これが治療効果の妨げとなっている。第二に、MSCは同種移植の際に免疫原性を引き起こす可能性がある(122)。最後に、MSCが悪性腫瘍に移動し、潜在的に腫瘍形成を促進する危険性がある(123)。近年、MSC由来のEV(MSC-EV)は、敗血症治療の有望な選択肢として浮上してきた(124、125)。MSC-EVは、MSCと同様の生物学的活性を示し、その直径と産生様式に基づいて、アポトーソームAB(1000~5000nm)、マイクロバブルMV(100~1000nm)、エキソエンドソーム(40~150nm)の3つの形態に分類することができる。MSC-EVは免疫原性が低く、発がんリスクも低いため、移植治療に用いる細胞よりも安全であることから、敗血症の治療に用いることが注目されている(126)。MSC-EVは、様々な体液中に安定的に存在することができ、生理活性分子、タンパク質、脂質、核酸(mRNA、miRNA、DNA)などのシグナル分子を包み込んで輸送することで、細胞間コミュニケーションを促進する。数多くのin vivoおよびin vitroの研究により、MSC-EVはエンドサイトーシスや膜融合により、これらのシグナル分子をマクロファージに送達し、免疫相互作用を促進することが実証されている(127-129)。肺炎モデルにおいて、Monselらは、MSC-EVをILR3アゴニストのポリ(I:C)で前処理すると、COX2のmRNA発現が促進され、それが単球に移行することを見出した。その結果、単球はM2マクロファージに分化し、TNF-αの産生が減少し、IL-10の産生が増加した。同様に、別の研究では、低酸素性プレコンディショニング後に脂肪由来MSCから放出されたEVは、in vitroでCD206、CD51、CD36を発現するM2表現型にマクロファージを転換することが示された(129)。
マイクロRNA(miRNA)は、アポトーシス、腫瘍分布、血管新生に複数の影響を及ぼす、MSC-EVに存在する重要な制御物質として同定されている。MSC-EVには150以上のmiRNAが同定されており、マクロファージに対する免疫調節作用に焦点を当てた研究が増加している(124)(図4A)。例えば、Liらは、MSC-EVがマクロファージの免疫表現型を標的とし、制御できることを実証する画期的な研究を行った。血小板と単球との結合により、MSC-EVは末梢血単球を標的として結合することができ、炎症性微小環境に到達し、炎症性マクロファージを抗炎症性マクロファージに再プログラムすることができる。さらに、敗血症の治療に特化した研究もいくつかある。Songらの研究チームは、IL-1βで前処理したMSCがエクソソームを通じてmiR-146aをマクロファージに移行させ、その結果M2が極性化し、敗血症マウスの生存率が改善したことを報告している(132)。同様に、Yaoらは、IL-1βで前処理したMSC-EVにおいて有意に発現が上昇したmiR-21が、in vitroおよびin vivoでM2極性を促進することを発見した(111)。マクロファージの極性化とは別に、他の制御メカニズムも研究されている。例えば、Zhangらは、TNF-αで前処理したMSC-EVがmiR-299-3pをアップレギュレートし、マクロファージにおけるNLRP3経路を阻害することで、急性肝不全における炎症性傷害を軽減することを示した(133)。Liによる別の研究では、MSC-EVが抗アポトーシス性miR-21-5pを伝達し、肺虚血/再灌流(I/R)傷害を緩和することが発見された(134)。さらに、Suらは、BMSC由来のEVに含まれるmiR-17が、BRD4の発現を仲介することによって、LPS誘発マクロファージアポトーシスを阻害することを発見し、免疫細胞のアポトーシスを緩和することによって、敗血症における免疫抑制の新規治療法を提供する可能性を見出した(135)。これらの知見は、敗血症治療のためにマクロファージを標的とするMSC-EVの重要な免疫療法の可能性を強調するものである。しかし、MSC-EVがマクロファージを標的とした、より安全で効率的な新しい敗血症治療法となるには、さらなる研究と臨床応用が必要である。
MSCからマクロファージへのミトコンドリア移入の効果
ミトコンドリアの移入は、組織の恒常性と正常な発達を維持するだけでなく、損傷した組織の回復や免疫恒常性の回復を促進する(136, 137)。現在の研究では、MSCがミトコンドリアをマクロファージに移し、免疫機能や恒常性の回復を助ける様々な方法が注目されている(137、138)。例えば、Jacksonらは、ARDSマウスモデルにおいて、トンネルナノチューブ(TNT)を介したミトコンドリアの移動が、マクロファージの貪食能力を向上させることを示した(118)。Phinneyらは、ミトコンドリアを持つMSC-EVがマクロファージと融合すると、ATPレベルと酸素消費率が増加することを報告している(139)。しかし、ミトコンドリアの移入がマクロファージ免疫機能をどのように特異的に媒介するかについての理解は、まだ非常に限られている。マクロファージ極性化の観点から見ると、M1マクロファージは解糖の増加、炎症性亢進、mROS蓄積、ミトコンドリア機能障害を示す。対照的に、M2マクロファージは、酸化的リン酸化の亢進、解糖フラックスの低下、ミトコンドリア活性の亢進を示す(140)。MorrisonらのARDS肺傷害に関する研究では、細胞外小胞を介したミトコンドリアの移動が、マクロファージの酸化的リン酸化を促進し、M2マーカーCD206の発現を促進し、貪食能を改善することが示された(141)。最近、Hwangらは、多細菌性糞便スラリー敗血症ラットにおけるミトコンドリア移入の役割を調査し、L6筋細胞と臍帯間葉系幹細胞から分離したミトコンドリア移入が、生存率と細菌クリアランスの改善に役立つことを見出した(142)。したがって、敗血症におけるMSCsのミトコンドリア移植の役割、特にマクロファージに対する調節的役割とそのメカニズムがさらに解明されることで、敗血症の免疫調節治療に新たなアプローチが提供されることが期待される。
異なるマクロファージ表現型に対するMSCの効果
実際、敗血症の状況において、マクロファージを標的とするMSCの免疫調節効果やメカニズムを研究する上で、マクロファージの不均一性が課題となる。マクロファージの免疫表現型と機能的定義が不完全であることが、この困難の一因であり、単純化されすぎたM1/M2極性化パラダイムが蔓延している。この単純化しすぎは、免疫微小環境におけるマクロファージの真のダイナミックな免疫動態を無視し、MSCがマクロファージを標的とする免疫を制御するメカニズムの包括的な探求を妨げている。マクロファージの不均一性は、同じ組織内での多様な起源からも生じる。組織に常在するマクロファージは、定常状態では免疫の恒常性と組織の修復を維持し、末梢血単球由来のマクロファージによって補完されるが、その割合は臓器によって様々である。これらの集団を区別することが重要になるのは、感染症や疾患時であり、このような場合、迅速な免疫応答には末梢単球からのマクロファージのリクルートが必要となる。現在の疾患モデルでは、これらの集団を区別できないことが多く、それぞれの機能の理解に影響を与えている。最近の研究では、組織常在肺胞マクロファージ(TRAM)と単球由来マクロファージ(MoAM)の違いを、傷害後の肺線維症への影響を評価することで明らかにしようとした(143)。重症肺炎モデルにおいて、胎盤間葉系幹細胞(PMSCs)治療は、肺胞マクロファージ(AMΦ)の量と機能を維持しながら、骨髄由来マクロファージ(BMMΦ)のリクルートとM1分極化を防ぎ、TNF-αの発現をダウンレギュレートした。さらに調べたところ、PMSCsを投与するとBMMΦとAMΦの両方でM2極化が促進されることがわかった。しかし驚くべきことに、BMMΦにおける細菌貪食と活性酸素種(ROS)産生を抑制する一方で、AMΦにおける抗菌機能を増強した(144)。この画期的な研究により、組織に常在するAMΦとリクルートされたBMMΦの集団におけるMSCの免疫調節の違いが強調された。単球由来マクロファージの非定常分化の概念(6)が浮上するにつれ、今後の研究では、疾患に関連したmo-macsを正確に定義し、疾患間で共通する経路を探り、疾患参加における保守的な分子プログラムを解明し、mo-macsを標的とするMSCの特異的メカニズムを解明する必要がある。さらに、単球由来マクロファージの定常分化と非定常分化、マクロファージのM1/M2極性化の時間的・空間的関係を明らかにすることは、MSCの免疫調節経路や、異なるマクロファージ亜集団を標的とするメカニズムについての理解と調節をさらに深め、敗血症に対するMSC治療の方向性を導くことになるだろう。
敗血症におけるマクロファージがMSCに及ぼす影響
敗血症の発生と進行は免疫バランスの乱れと密接な関係があり、MSCは免疫調節能力を有している。これまでの研究で、マウスの死亡率を減少させるMSCの能力は、マクロファージの存在に依存しており、一方、T細胞、B細胞、NK細胞の枯渇は、MSCの有益な効果に影響を与えないことが示されている(109)。さらに、Cutlerら(145)が示したように、マクロファージが枯渇すると、MSCの抗炎症作用が阻害される。これらの知見は、MSCの免疫調節作用と宿主マクロファージとの間に重要な関係があることを示唆している。従って、敗血症におけるMSCとマクロファージ間の免疫相互作用を調べることは極めて重要である。
炎症性微小環境の変化によるマクロファージのMSCへの影響
敗血症の初期段階において、マクロファージはPAMPsやDAMPsの活性化によりM1表現型に極性化する。その結果、マクロファージはTNF-αやIL-1βなどの炎症性サイトカインを放出し、他の免疫細胞を動員して炎症亢進環境を確立する。このような環境では、高レベルの炎症性因子がMSCの免疫抑制スイッチを活性化し、過剰な炎症反応を緩和する(図4B)。いくつかの研究では、MSCの抗炎症作用の誘導におけるIFN-γの重要な役割も強調されている(87, 88, 146)。さらに、活性化T細胞によって産生されたIFN-γは、MSC上のPD-L1発現を直接アップレギュレートし、共培養系におけるT細胞増殖の抑制につながる(147)。このことは、MSCの抗炎症作用が、パラクリンシグナルだけでなく、直接的な細胞間接触によっても媒介されることを示唆している。
敗血症が免疫抑制段階に進むと、マクロファージはM2表現型に移行し、炎症性サイトカインのレベルは低下する。その代わりに、抗炎症性サイトカインの放出が増加し、MSCが炎症促進性表現型をとるように誘導する(図4B)。例えば、MSCにIL-10を投与すると、T細胞の増殖が促進されることが示されている(148)。さらに、TGF-βはMSCのオートクライン因子として働き、Smadシグナル伝達経路を通じてiNOS/IDO発現のダウンレギュレーションを仲介し、MSCの抗炎症機能を阻害する(149)。しかし、MSCの免疫調節機能に関する研究のほとんどは、敗血症における炎症の過剰活性化段階に焦点を当てたものである。したがって、免疫抑制期におけるMSCの炎症促進機序を解明するためには、さらなる研究が必要である。
異なるマクロファージ表現型がMSCに及ぼす影響
マクロファージとMSCは、周囲の環境に影響され、双方向的な免疫調節の役割を担っている。MSCがマクロファージに及ぼす免疫作用は広く研究されているが、マクロファージがMSCに及ぼす作用の根底にあるメカニズムは、まだ十分に解明されていない。急性心筋梗塞(AMI)の微小環境において、低酸素・血清欠乏(H/SD)はマクロファージのM1表現型への極性を誘導し、M1マクロファージは抗アポトーシスタンパク質BCL-2を標的とするmiR-222を含むエクソソームを分泌することにより、BMSCsのアポトーシスを誘導する(150)。しかし、電気紡糸ポリ(ㄊ-カプロラクトン)繊維(PCL繊維)フィルムのマウス皮下移植モデルでは、PCL繊維がM1型マクロファージをリクルートし、M1型マクロファージからM2型マクロファージへの転換を促進し、さらに間質細胞由来因子-1(SDF-1)の分泌と傷害部位へのMSCsのリクルートを高め、組織再生や統合に効果的な役割を果たすことがわかった(151)。現在のところ、敗血症時にマクロファージがMSCに及ぼす役割とそのメカニズムに関する証拠は限られている。しかし、これらの研究は、異なるマクロファージ表現型が、敗血症の異なる段階において、MSCに異なる影響を及ぼす可能性を示唆する洞察を与えている。従って、敗血症治療の指針とするためには、異なる条件下におけるマクロファージとMSC間の免疫相互作用を明らかにするためのさらなる研究が必要である。
ミトコンドリア移動によるマクロファージのMSCへの影響
細胞間のミトコンドリア移動は、標的細胞のストレス時における新しいコミュニケーション様式である。Speesらは、重要な研究において、健康なミトコンドリアを移植することで、損傷した組織の機能不全を補い、細胞の恒常性を回復できることを示した(136)。MSCはミトコンドリア移植のドナー細胞としてだけでなく、マクロファージからのレシピエント細胞としても機能することに注意することが肝要である。増殖または分化状態のMSCは、酸化的リン酸化(OXPhos)代謝の亢進を示し、ミトコンドリア活性を増加させる。逆に、増殖能が低下したMSCは解糖へとシフトし、ミトコンドリアの機能不全と細胞内の活性酸素(ROS)の蓄積をもたらし、MSCの免疫抑制機能を低下させる(152)。骨粗鬆症の条件下で、Caiらは、M1様マクロファージからMSCに酸化障害を受けたミトコンドリアを移植すると、コハク酸の循環蓄積が起こり、活性酸素レベルが上昇することを発見した(153)。これは低酸素誘導因子α(HIF-α)を活性化し、IL-1βの発現を促進し、MSCの骨形成分化に影響を与えた。別の研究では、1バッチのBMSCから移植前のBMSCにミトコンドリアを移植すると、OXPHOS、ATP産生、遊走、および骨形成分化が促進された。敗血症では、活性ミトコンドリアと損傷ミトコンドリアが共存し、MSCの免疫調節能力に影響を与える。マクロファージは、ミトコンドリアを移入することによって、MSCの免疫表現型や機能に影響を与える可能性があるが、この文脈におけるミトコンドリア移入のレシピエントとしてのMSCを確認し、探求するためには、さらなる研究が必要である。
結論と展望
敗血症の病態は免疫反応の動態と複雑に関連しており、炎症性反応と抗炎症性反応が共存しうる。重要な自然免疫細胞であるマクロファージは、敗血症に対する免疫反応に重要な役割を果たし、またその影響を受ける。MSCは幹細胞としての特性と免疫調節能力を有しており、敗血症における重要な役割を担っている。さらに、免疫調節は環境因子の影響を受ける。
MSCの免疫調節能力が宿主マクロファージの存在に依存していることは、研究によって確認されている。マウスでマクロファージが枯渇すると、MSCの抗炎症作用は低下する。炎症性サイトカインの活性化は、MSCにおけるiNOSの発現をアップレギュレートするのに重要であり、それによって抗炎症スイッチが引き起こされる。敗血症の様々な段階を通して、マクロファージは様々な表現型に極性化し、炎症環境の変化に寄与し、MSCの免疫調節作用に間接的に影響を与える。マクロファージの表現型が異なれば、MSCの機能的特性にも直接影響を与えることが示唆された研究は限られている。
ほとんどの研究は、主にMSCによって誘導されるマクロファージの抗炎症作用に焦点を当てており、本総説では関連する経路について概説した。第一に、MSCは直接接触することにより、炎症性マクロファージを抗炎症状態に再プログラムし、それによりNF-kBシグナルを阻害して炎症性マクロファージの動員を抑制する。第二に、MSCはパラクリンPGE2とオートクリンTGF-βを介してマクロファージに影響を与え、M2表現型に誘導することができる。特筆すべきことに、MSCはM1様マクロファージとM2様マクロファージを誘導することができ、その結果、抗炎症作用と貪食作用の増強が組み合わさり、敗血症治療の可能性がある。その結果、マクロファージは、アポトーシスを起こしたMSCやMSC由来のアポトーシス小体を積極的に貪食し、抗原提示をダウンレギュレートし、M2表現型に偏向することで、再プログラムすることができる。最後に、MSC-EVは、敗血症動物に対するEV治療の有効性をメタアナリシスを用いてまとめた最近の総説が示すように、細胞を用いない新しい治療法を提供し、ほとんどのMSC-EV治療が敗血症マウスの死亡率を減少させたと結論づけている(125)。
結論として、マクロファージとMSCは、敗血症の進行中に著しい可塑性を示す。免疫微小環境との相互作用や互いの相互作用が、敗血症で観察される免疫不均衡を解明する鍵を握っているのかもしれない。敗血症におけるマクロファージがMSCに与える影響や、MSCの免疫機構を明らかにするためには、さらなる研究が必要である。敗血症のさまざまな段階にある患者に対する的確な標的療法の開発と統一基準の確立が、敗血症治療に前向きな進歩をもたらすことが期待される。
著者貢献
XT: ソフトウェア、原案執筆。JW:リソース、可視化、執筆-原案、ソフトウェア。BL:方法論、リソース、執筆(原案)。PC: リソース、ソフトウェア、執筆 - 原案。DM: 資金獲得、リソース、執筆 - レビューと編集。HD: 資金獲得、資源、執筆-校閲・編集。BN: 構想立案、資金獲得、執筆-校閲・編集。
資金提供
著者は、本論文の研究、執筆、および/または発表のために金銭的支援を受けたことを表明する。本研究は、中央大学基礎研究基金[2022CDJYGRH-014]、重慶市医学科学研究プロジェクト(重慶市衛生委員会と科学技術局の共同プロジェクト)[2023ZDXM012]および[2021MSXM033]、重慶市衛生委員会医学研究プロジェクト[2023wsjk082]、重慶市科学技術局研究プロジェクト[CSTB2022BSXM-JCX0050]の支援を受けた。
利益相反
著者らは、本研究が潜在的な利益相反と解釈されるような商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体、出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
参考文献
Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, et al. 敗血症と敗血症性ショックの第3次国際コンセンサス定義(Sepsis-3)。Jama (2016) 315(8):801-10. doi: 10.1001/jama.2016.0287.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
敗血症と敗血症性ショック。Lancet (2018) 392(10141):75-87. doi: 10.1016/S0140-6736(18)30696-2.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
GBD 2017肝硬変コラボレーター。195の国と地域における肝硬変の原因別の世界的、地域的、国家的負担(1990-2017年):世界疾病負担調査2017のための系統的分析。Lancet Gastroenterol Hepatol (2020) 5(3):245-66. doi: 10.1016/s2468-1253(19)30349-8.
PubMed Abstract|RefRef Full Text|Google Scholar
Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy. Nat Rev Immunol (2013) 13(12):862-74.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Xiao W, Mindrinos MN, Seok J, Cuschieri J, Cuenca AG, Gao H, et al. Host Response to Injury Large-Scale Collaborative Research: 重篤な傷害を受けたヒトにおけるゲノムの嵐。J Exp Med (2011) 208(13):2581-90. doi: 10.1084/jem.20111354.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
健康と疾患におけるマクロファージ。細胞(2022)185(23):4259-79.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
陳X、劉Y、高Y、周S、蔡Y. マクロファージ極性化が敗血症に対する宿主免疫応答に果たす役割。この論文では、敗血症における宿主免疫応答におけるマクロファージ極性化の役割を明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bozza FA, Salluh JI, Japiassu AM, Soares M, Assis EF, Gomes RN, et al. 敗血症における重症度マーカーとしてのサイトカインプロファイル:マルチプレックス解析。Crit Care (2007) 11(2):R49.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Feng L, Song P, Zhou H, Li A, Ma Y, Zhang X, et al. Pentamethoxyflavanone regulates macrophage polarization and ameliorates sepsis in mice. Biochem Pharmacol (2014) 89(1):109-18. doi: 10.1016/j.bcp.2014.02.016.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
間葉系幹細胞:免疫応答を制御する諸刃の剣。細胞死差(2012)19(9):1505-13. doi: 10.1038/cdd.2012.26
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Xu Y, Liu X, Li Y, Dou H, Liang H, Hou Y. SPION-MSCは、MSC発現TRAF1依存性マクロファージ分極を制御することにより、敗血症の治療効果を高める。Stem Cell Res Ther (2021) 12(1):531.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Rabani R, Volchuk A, Jerkic M, Ormesher L, Garces-Ramirez L, Canton J, et al. 間葉系幹細胞は、敗血症時のマクロファージにおけるNOX2依存性の活性酸素種産生と細菌殺傷を増強する。Eur Respir J (2018) 51(4). doi: 10.1183/13993003.02021-2017
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
間葉系幹細胞とその細胞外小胞は、肝疾患に対する重要な免疫学的効能を有する。(2022)13:880523.doi:10.3389/fimmu.2022.880523.Front免疫学(2022)13:880523.
PubMedアブストラクト|全文|Google Scholar
間葉系幹細胞由来エクソソームの新たな治療アプローチ。バイオメディカルサイエンス(2021)28(1):39.
PubMed Abstract|クロスリファレンス全文|Google Scholar
van Furth R, Cohn ZA, Hirsch JG, Humphrey JH, Spector WG, Langevoort HL. 単核食細胞系:マクロファージ、単球、およびそれらの前駆細胞の新しい分類。(1972)46(6):845-52。
PubMed Abstract|Google Scholar
Gomez Perdiguero E, Klapproth K, Schulz C, Busch K, Azzoni E, Crozet L, et al. Tissue-resident macrophage originate from yolk-sac-derived erythro-myeloid progenitors. Nature (2015) 518(7540):547-51.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wynn TA, Chawla A, Pollard JW. 発生、恒常性、疾患におけるマクロファージ生物学。Nature (2013) 496(7446):445-55.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Mds1 creERT2-based lineage-tracing reveals increasing contributions of HSCs to fetal hematopoies and to adult tissue-resident macrophages in the marrow. 血液 (2021) 138(Supplement 1):2153-3. doi: 10.1182/blood-2021-154041
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
成体ランゲルハンス細胞は主に胎生期の肝単球に由来し、卵黄嚢由来のマクロファージの寄与はわずかである。J Exp Med (2012) 209(6):1167-81.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Lineage tracing clarifies the cellular origin of tissue-resident macrophage in the developing heart. J Cell Biol (2022) 221(6). doi: 10.1083/jcb.202108093.
クロスレフ・フルテキスト|Google Scholar
Huang Y, Xu Z, Xiong S, Sun F, Qin G, Hu G, et al. Repopulated microglia are solely derived from the proliferation of residual microglia after acute depletion. Nat Neurosci (2018) 21(4):530-40. doi: 10.1038/s41593-018-0090-8
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhan L, Krabbe G, Du F, Jones I, Reichert MC, Telpoukhovskaia M, et al. 自己複製ミクログリアによる近位再コロニー化は、成体マウス脳におけるミクログリアの恒常性を再確立する。PloS Biol (2019) 17(2):e3000134. doi: 10.1371/journal.pbio.3000134.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
サイトカインTGF-βは肺胞マクロファージの発生と恒常性を促進する。Immunity (2017) 47(5):903-912 e4. doi: 10.1016/j.immuni.2017.10.007.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
肺マクロファージ組成のシフトは、COVID-19の重症度と回復に関連する。Sci Trans Med (2022) 14(662). doi: 10.1126/scitranslmed.abn5168.
CrossRef 全文|Google Scholar
Zigmond E, Jung S. 腸管マクロファージ:よく教育された規則からの例外。トレンド免疫学(2013)34(4):162-8。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
大腸の常在マクロファージと炎症性マクロファージは、同じLy6Chi単球前駆体の文脈依存的な代替運命を示す。Mucosal Immunol (2013) 6(3):498-510.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
マウス慢性肉芽腫性疾患における単球由来マクロファージのターンオーバーの亢進と成熟不全。血液(2022)139(11):1707-21.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Cassetta L, Cassol E, Poli G. Macrophage polarization in health and disease. 科学的世界ジャーナル(2011)11:2391-402. doi: 10.1100/2011/213962
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Shapouri-Moghaddam A, Mohammadian S, Vazini H, Taghadosi M, Esmaeili SA, Mardani F, et al. Macrophage plasticity, polarization, and function in health and disease. J Cell Physiol (2018) 233(9):6425-40. doi: 10.1002/jcp.26429.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sica A, Mantovani A. Macrophage plasticity and polarization: in vivo veritas. J Clin Invest (2012) 122(3):787-95.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Sica A, Erreni M, Allavena P, Porta C. Macrophage polarization in pathology. Cell Mol Life Sci (2015) 72(21):4111-26. doi: 10.1007/s00018-015-1995-y
PubMed Abstract|クロスリファレンス全文|Google Scholar
de Sousa JR, Da Costa Vasconcelos PF, Quaresma JAS. 感染症におけるマクロファージの機能的側面、表現型の不均一性、組織免疫応答。Infect Drug Resist (2019) 12:2589-611. doi: 10.2147/idr.S208576.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Liu SF, Malik AB. 敗血症性ショックと炎症の病態機序としてのNF-κB活性化。Am J Physiol Lung Cell Mol Physiol (2006) 290(4):L622-45. doi: 10.1152/ajplung.00477.2005.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhou S, Wang G, Zhang W. 敗血症に伴う急性呼吸窮迫症候群に対するTLR4/MyD88シグナル伝達経路の効果、マクロファージの活性化と炎症反応の制御を介して。Exp Ther Med (2018) 15(4):3376-84. doi: 10.3892/etm.2018.5815.
PubMed Abstract|RefRef Full Text|Google Scholar
Luo WJ, Yu SL, Chang CC, Chien MH, Chang YL, Liao KM, et al. HLJ1 amplifies endotoxin-induced sepsis severity by promoting IL-12 heterodimerization in macrophages. 本論文は、HLJ1がマクロファージにおけるIL-12のヘテロ二量体化を促進することにより、エンドトキシンによる敗血症の重症化を増幅させることを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Döcke WD, Randow F, Syrbe U, Krausch D, Asadullah K, Reinke P, et al.医学: 敗血症患者における単球の不活性化:IFN-γ治療による回復」 Nature Medicine (1997) 3(6):678-81.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
実験的な多細菌性敗血症モデルにおいて、MIFは炎症性マクロファージを動員するが、MIF-2は動員しない。J Clin Invest (2021) 131(23). doi: 10.1172/JCI127171.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, et al. マウスにおけるエンドトキシン致死の後期メディエーターとしてのHMG-1。Science誌(1999年)285(5425):248-51.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Andersson U, Tracey KJ. HMGB1は無菌性炎症および感染症の治療標的である。Annu Rev Immunol (2011) 29:139-62.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
マクロファージの活性化と極性化:命名法と実験ガイドライン。Immunity (2014) 41(1):14-20. doi: 10.1016/j.immuni.2014.06.008.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
骨格筋損傷後にリクルートされた炎症性単球は、抗炎症性マクロファージに切り替わって筋新生をサポートする。この論文では、骨格筋傷害後に動員される炎症性単球が抗炎症性マクロファージに切り替わり、筋新生をサポートすることを明らかにした。
PubMed Abstract|クロスリファレンス全文|Google Scholar
Krüppel-like factor 4はマクロファージの極性を制御する。J Clin Invest (2011) 121(7):2736-49. doi: 10.1172/jci45444.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Kurowska-Stolarska、Stolarski B、Kewin P、Murphy G、Corrigan CJ、Ying S、他。IL-33は、気道炎症に寄与する交代的に活性化されたマクロファージの極性を増幅する。J Immunol (2009) 183(10):6469-77。
PubMedアブストラクト|全文|Google Scholar
Rath M, Muller I, Kropf P, Closs EI, Munder M. Metabolism via arginase or nitric oxide synthase: Two competing arginine pathways in macrophage. 論文タイトル:Front Immunol(2014)5:532.doi:10.3389/fimmu.2014.00532.論文タイトル:Front Immunol(2014)5:532.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Mills CD, Kincaid K, Alt JM, Heilman MJ, Hill AM. immunology: M-1/M-2マクロファージとTh1/Th2パラダイム。J Immunol. (2000) 164(12):6166-73. doi: 10.4049/jimmunol.164.12.6166.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Murray PJ, Wynn TA. マクロファージサブセットの防御機能と病原性機能。Nat Rev Immunol (2011) 11(11):723-37.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Pena OM, Pistolic J, Raj D, Fjell CD, Hancock RE. エンドトキシン耐性は、ヒト単核球における代替極性化(M2)の特徴的な状態を表す。J Immunol (2011) 186(12):7243-54. doi: 10.4049/jimmunol.1001952.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
p21は、p50-p50 NF-κBおよびIFN-βの制御を介してマクロファージの再プログラミングを媒介する。J Clin Invest (2016) 126(8):3089-103. doi: 10.1172/JCI83404.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Biswas SK, Lopez-Collazo E. Endotoxin tolerance: New mechanisms, molecules and clinical significance. トレンド免疫学(2009)30(10):475-87。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
敗血症は骨髄および末梢マクロファージに長期間のエピジェネティック修飾を引き起こし、炎症と創傷治癒を障害する。Arterioscler Thromb Vasc Biol (2019) 39(11):2353-66. doi: 10.1161/atvbaha.119.312754.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Wang TS, Deng JC. 免疫抑制の分子および細胞学的側面。J Mol Med (Berl) (2008) 86(5):495-506.
PubMedアブストラクト|クロスリファレンス|Google Scholar
敗血症および多臓器不全で死亡した患者における免疫抑制。JAMA (2011) 306(23):2594-605。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
T 細胞の疲弊に関する分子および細胞学的知見。Nat Rev Immunol (2015) 15(8):486-99.
PubMed Abstract|全文|Google Scholar
敗血症の免疫病理における共抑制受容体/チェックポイントタンパク質の新規な役割。J Leukoc Biol (2018). doi: 10.1002/jlb.2mir0917-377r
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
敗血症におけるPD-1とPD-L1の発現制御の役割。論文概要|医学書院(2023)14:1029438.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Patera AC, Drewry AM, Chang K, Beiter ER, Osborne D, Hotchkiss RS. 最前線の科学: 敗血症患者における免疫機能の欠損は、PD-1またはPD-L1の発現と関連しており、PD-1またはPD-L1を標的とする抗体によって回復させることができる。J Leukoc Biol (2016) 100(6):1239-54. doi: 10.1189/jlb.4HI0616-255R.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Chang K, Svabek C, Vazquez-Guillamet C, Sato B, Rasche D, Wilson S, et al. プログラム細胞死1:プログラム細胞死リガンド1経路を標的とすると、敗血症患者のT細胞疲弊が逆転する。Crit Care (2014) 18(1):R3. doi: 10.1186/cc13176.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
敗血症におけるLAG3とPD-1の異なる発現特性とT細胞疲弊に対する相乗効果: 免疫チェックポイント遮断の新たな戦略。論文タイトル:Front Immunol(2019)10:1888.doi:10.3389/fimmu.2019.01888.論文タイトル:Front Immunol(2019)10:1888.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
乳がん患者のT細胞におけるLAG3とPD-1の共発現特性から、新たな治療戦略が明らかになった。Int Immunopharmacol (2020) 78. doi: 10.1016/j.intimp.2019.106113.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Friedenstein AJ, Petrakova KV, Kurolesova AI, Frolova GP. 骨髄の異所性。骨形成組織および造血組織の前駆細胞の分析。移植 (1968) 6(2):230-47.
PubMed Abstract|Google Scholar
Cheung TS, Dazzi F. 免疫制御における間葉系と骨髄系の相互作用。Semin Immunol (2018) 35:59-68. doi: 10.1016/j.smim.2018.01.002.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bernardo ME, Fibbe WE. 間葉系間質細胞:炎症のセンサーとスイッチャー。細胞幹細胞(2013)13(4):392-402.
パブコメ抄録|クロスリファレンス全文|Google Scholar
間葉系幹細胞の免疫生物学。細胞死差(2014)21(2):216-25. doi: 10.1038/cdd.2013.158.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ding D-C, Shyu W-C, Lin S-Z. 間葉系幹細胞。細胞移植(2011)20(1):5-14.
パブコメ抄録|全文|Google Scholar
骨再生のためのMSC拡張およびMSCベースのマイクロティッシュの戦略。Biomaterials (2019) 196:67-79. doi: 10.1016/j.biomaterials.2017.11.023.
PubMed Abstract|クロスリファレンス全文|Google Scholar
ヒト間葉系幹細胞のin vivoプライミングは、肝細胞増殖因子改変間葉系幹細胞による心臓修復の治療可能性を促進する。この論文では、肝細胞増殖因子を添加した間葉系幹細胞をプライミングすることで、心臓の修復を促進することを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Hu X, Garcia M, Weng L, Jung X, Murakami JL, Kumar B, et al. 成人造血ニッチに共通する間葉系間質前駆細胞の同定。Nat Commun (2016) 7:13095.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
頭蓋顔面骨の発生、修復、再生における縫合間充織の幹細胞。Nat Commun (2016) 7:10526. doi: 10.1038/ncomms10526
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
間葉系幹細胞を用いた骨組織再生の応用の進展。バイオアクトマター (2021) 6(3):666-83.
PubMed Abstract|クロスリファレンス全文|Google Scholar
Zhang L, Ma XJ, Fei YY, Han HT, Xu J, Cheng L, et al. 肝臓再生における幹細胞治療: 間葉系幹細胞と人工多能性幹細胞を中心に。この論文では、肝臓再生における幹細胞治療について、間葉系幹細胞と人工多能性幹細胞を中心に解説している。
パブコメ抄録|クロスリファレンス全文|Google Scholar
再生医療のための間葉系幹細胞。Cells (2019) 8(8). doi: 10.3390/cells8080886.
CrossRef フルテキスト|Google Scholar
Andrzejewska A, Lukomska B, Janowski M. Concise review: mesenchymal stem cells: from roots to boost. Stem Cells (2019) 37(7):855-64.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Mayle A, Luo M, Jeong M, Goodell MA. マウス造血幹細胞のフローサイトメトリー解析。細胞測定パートA(2013)83A(1):27-37。
クロスレフ・フルテキスト|Google Scholar
Ng J, Guo F, Marneth AE, Ghanta S, Kwon MY, Keegan J, et al. マウス好中球減少性敗血症におけるCpG条件付き間葉系間質細胞による緊急顆粒球増生。血液学的研究(2020)4(19):4965-79.
パブコメ抄録|クロスリファレンス|Google Scholar
間葉系間質細胞は造血幹細胞を再プログラムすることにより好中球の訓練免疫を促進する。この論文では、間葉系間質細胞が造血幹細胞を再プログラムすることで好中球の訓練免疫を促進することを明らかにした。
PubMedアブストラクト|クロスリファレンス|Google Scholar
Wang Y, Fang J, Liu B, Shao C, Shi Y. 間葉系幹細胞と免疫応答の相互制御。細胞幹細胞 (2022) 29(11):1515-30. doi: 10.1016/j.stem.2022.10.001.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
正常および白血病の骨髄ニッチにおけるMSCコミュニケーションにおけるノッチおよびwntシグナルの役割。論文タイトル:「骨髄ニッチにおけるノッチシグナルとwntシグナルの役割」(Front Cell Dev Biol (2020) 8:599276).
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
重症再生不良性貧血に対する同種造血幹細胞移植後、間葉系幹細胞の共移植は急性gvhdとウイルス血症を改善できる: 119例の多施設レトロスペクティブ研究。Blood (2018) 132(Supplement 1):4653-3. doi: 10.1182/blood-2018-99-118758.
CrossRef 全文|Google Scholar
脂肪由来間葉系幹細胞を用いた血小板産生: その機序解明と臨床応用。J Thromb Haemost (2021) 19(2):342-50. doi: 10.1111/jth.15181.
PubMed Abstract|クロスリファレンス全文|Google Scholar
脂肪由来間葉系幹細胞と細胞外小胞は、乳がんの前臨床治療において抗腫瘍活性を付与する。薬理学研究(2020)157:104843. doi: 10.1016/j.phrs.2020.104843
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
骨代謝異常の治療戦略としての間葉系幹細胞と骨修復材料の併用: 臨床効果のエビデンスと作用機序の示唆。薬理研究(2021)172:105851.
パブコメ抄録|クロスリファレンス全文|Google Scholar
COVID-19患者におけるヒト臍帯由来間葉系幹細胞治療:第1相臨床試験。シグナル伝達ターゲット(Signal Transduct Target Ther) (2020) 5(1):172.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
重症敗血症治療のための臍帯由来間葉系幹(間質)細胞:第1相臨床試験。トランスランス(2018)199:52-61. doi: 10.1016/j.trsl.2018.04.006
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Krueger TEG, Thorek DLJ, Denmeade SR, Isaacs JT, Brennen WN. コンサイスレビュー:間葉系幹細胞を用いたドラッグデリバリー:良いもの、悪いもの、醜いもの、そして将来性。Stem Cells Transl Med (2018) 7(9):651-63.
PubMed Abstract|クロスリファレンス全文|Google Scholar
von Bahr L, Batsis I, Moll G, Hagg M, Szakos A, Sundberg B, et al. ヒトにおける間葉系間質細胞治療後の組織の解析から、長期間の生着は限定的であり、異所性組織の形成は認められない。Stem Cells (2012) 30(7):1575-8.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Feng G, Zhang J, Li Y, Nie Y, Zhu D, Wang R, et al. IGF-1 Cドメイン修飾ハイドロゲルは、AKIに対する細胞治療を強化する。J Am Soc Nephrol (2016) 27(8):2357-69. doi: 10.1681/ASN.2015050578.
PubMed Abstract|RefRef Full Text|Google Scholar
Wang Y, Chen X, Cao W, Shi Y. 免疫調節における間葉系幹細胞の可塑性:病理学的および治療的意義。Nat Immunol (2014) 15(11):1009-16. doi: 10.1038/ni.3002.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
間葉系幹細胞を介した免疫抑制は、ケモカインと一酸化窒素の協調作用によって起こる。細胞幹細胞 (2008) 2(2):141-50. doi: 10.1016/j.stem.2007.11.014
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Laroye、Gibot S、Reppel L、Bensoussan D. 簡潔な総説:間葉系間質/幹細胞: 敗血症と敗血症性ショックの新しい治療法?Stem Cells (2017) 35(12):2331-9.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Liu KD, Wilson JG, Zhuo H, Caballero L, McMillan ML, Fang X, et al. START(STem cells for ARDS Treatment)試験のデザインと実施、中等度-重症急性呼吸窮迫症候群の治療に対するヒト間葉系幹細胞/間質細胞の第1/2相試験。Ann Intensive Care (2014) 4:22. doi: 10.1186/s13613-014-0022-z
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Li X, Wang S, Zhu R, Li H, Han Q, Zhao RC. 肺腫瘍エクソソームはNFkappaB-TLRシグナル経路を介して間葉系幹細胞に炎症性表現型を誘導する。J Hematol Oncol (2016) 9:42. doi: 10.1186/s13045-016-0269-y
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
TLR4誘導性IFN-γ産生はTLR2感受性を上昇させ、マウスにおけるグラム陰性敗血症を促進する。J Exp Med (2008) 205(8):1747-54. doi: 10.1084/jem.20071990.
PubMed Abstract|全文|Google Scholar
Toll様受容体3リガンドであるpoly(I:C)は、MiR-143の阻害を介して、間葉系幹細胞の免疫抑制機能と敗血症治療効果を改善する。Stem Cells (2014) 32(2):521-33.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Waterman RS, Tomchuck SL, Henkle SL, Betancourt AM. 新しい間葉系幹細胞(MSC)パラダイム:炎症性MSC1または免疫抑制性MSC2表現型への極性化。この論文では、間葉系幹細胞(MSC)の新たなパラダイムとして、炎症性MSC1または免疫抑制性MSC2の表現型への極性化を示した。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
敗血症免疫学における現在のギャップ:トランスレーショナルリサーチの新たな機会。Lancet Infect Dis (2019) 19(12):e422-36. doi: 10.1016/S1473-3099(19)30567-5
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
HotchkissRS、Tinsley KW、Swanson PE、Schmieg RE Jr.、Hui JJ、Chang KC、他:敗血症誘発アポトーシスは、ヒトにおけるBリンパ球およびCD4+ Tリンパ球の進行性の深い枯渇を引き起こす。J Immunol (2001) 166(11):6952-63。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Martin MD, Badovinac VP, Griffith TS. CD4T細胞応答と敗血症誘発免疫麻痺状態。Doi:10.3389/fimmu.2020.01364。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Jiang J, Du H, Su Y, Li X, Zhang J, Chen M, et al. 成人敗血症予測のための非ウイルス感染関連リンパ球減少症、およびその持続はより高い死亡率を示す。医学(2019)98(29)。
クロス・リーフ・フルテキスト|Google Scholar
Liu B, Du H, Zhang J, Jiang J, Zhang X, He F, et al. リンパ球数、国際標準化比、プロカルシトニンに基づく新しい敗血症スクリーニングツールの開発(LIPスコア)。論文タイトル:「敗血症の診断と治療」(共立出版)。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
高齢者の重症敗血症における持続的炎症とT細胞疲弊。Crit Care (2014) 18(3):R130. doi: 10.1186/cc13941.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
高齢者の重症敗血症における免疫担当T細胞の減少とリンパ球減少の遷延。Crit Care Med (2013) 41(3):810-9. doi: 10.1097/CCM.0b013e318274645f.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Shi Y, Wang Y, Li Q, Liu K, Hou J, Shao C, et al. 炎症性疾患における間葉系幹細胞および間質細胞の免疫制御機構。Nat Rev Nephrol (2018) 14(8):493-507. doi: 10.1038/s41581-018-0023-5.
PubMedアブストラクト|Ref 全文|Google Scholar
Lu、Ma、G、Sheng、Z、Wang、Q、Chen、L、Qi、J、et al. MSCs Contribute to the Conversion of Ly6C(high) Monocytes into Ly6C(low) Subsets under AMI. Stem Cells Int (2020) 2020:2460158.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Song HB, Park SY, Ko JH, Park JW, Yoon CH, Kim DH, et al. 間葉系間質細胞は、TSG-6依存的にマクロファージを抑制することで、角膜の炎症性リンパ管新生を抑制する。Mol Ther (2018) 26(1):162-72. doi: 10.1016/j.ymthe.2017.09.026
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Jiang Y, Glasstetter LM, Lerman A, Lerman LO. TSG-6(Tumor necrosis factor-α-stimulated gene/protein-6):腎炎症に対する新たな治療薬。高血圧 (2023) 80(1):35-42. doi: 10.1161/hypertensionaha.122.19431
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Li Y, Zhang D, Xu L, Dong L, Zheng J, Lin Y, et al. 炎症性マクロファージとの細胞間接触は、2つの流産モデルにおける間葉系幹細胞の免疫治療効果を高める。Cell Mol Immunol (2019) 16(12):908-20. doi: 10.1038/s41423-019-0204-6.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Ritzel RM, Al Mamun A, Crapser J, Verma R, Patel AR, Knight BE, et al. CD200-CD200R1阻害シグナルは自然細菌感染を防ぎ、脳卒中後の神経炎症の解消と回復を促進する。J Neuroinflamm (2019) 16(1):40. doi: 10.1186/s12974-019-1426-3
クロス・リーフ・フルテキスト|Google Scholar
Ye F, Jiang J, Zong C, Yang X, Gao L, Meng Y, et al. Sirt1過剰発現間葉系幹細胞は、その炎症促進能を介して抗腫瘍効果を促進する。論文タイトル:Mol Ther (2020) 28(3):874-88.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
骨髄間質細胞は、プロスタグランジンE(2)依存的に宿主マクロファージをリプログラミングしてインターロイキン10産生を増加させることにより、敗血症を抑制する。この論文では、骨髄間質細胞が、プロスタグランジンE(2)に依存して宿主マクロファージを再プログラムし、インターロイキン-10の産生を増加させることにより、敗血症を抑制することを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Park HJ, Oh SH, Kim HN, Jung YJ, Lee PH. 間葉系幹細胞は、実験的およびヒトのパーキンソン病において、M2ミクログリアの分極化を介してα-シヌクレインのクリアランスを促進する。Acta Neuropathologica (2016) 132(5):685-701. doi: 10.1007/s00401-016-1605-6
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
IL-1βでプライミングされた間葉系幹細胞が分泌するエクソソームmiR-21は、マクロファージM2の極性化を誘導し、敗血症を改善する。生命科学 (2021) 264:118658. doi: 10.1016/j.lfs.2020.118658
PubMed Abstract|クロスリファレンス全文|Google Scholar
間葉系幹細胞は、転写因子EBを介したオートファジーの改善を通じてマクロファージをM2表現型に誘導し、糖尿病性腎症を緩和する。Stem Cells (2020) 38(5):639-52.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
MSC分泌TGF-βは、Akt/FoxO1経路を介してリポ多糖刺激マクロファージM2様分極を制御する。Stem Cell Res Ther (2019) 10(1):345. doi: 10.1186/s13287-019-1447-y
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
間葉系間質細胞を介した敗血症予防の新規メカニズム:マイトファジーの増加とミトコンドリア活性酸素の減少によるマクロファージにおけるインフラマソーム活性化の抑制。Oxid Med Cell Longev (2018) 2018:3537609. doi: 10.1155/2018/3537609.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Heid ME, Keyel PA, Kamga C, Shiva S, Watkins SC, Salter RD. ミトコンドリアの活性酸素種は、NLRP3依存的なリソソーム損傷とインフラマソームの活性化を誘導する。J Immunol (2013) 191(10):5230-8. doi: 10.4049/jimmunol.1301490.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hasgur、Desbourdes L、Relation T、Overholt KM、Stanek JR、Guess AJ、他。静脈内注入した間葉系間質細胞の脾臓マクロファージによる貪食は、腫瘍局在化を抑制する。Doi:10.1016/j.jcyt.2020.04.102。
PubMed Abstract|クロスリファレンス全文|Google Scholar
間葉系幹細胞は、喘息モデルマウスにおいて、貪食を通じて抑制性マクロファージを誘導する。Stem Cells (2016) 34(7):1836-45.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
間葉系幹細胞がARDSのin vitroおよびin vivoモデルにおいてマクロファージの貪食を増強する重要なメカニズムとして、トンネルナノチューブを介したミトコンドリアの移動がある。Stem Cells (2016) 34(8):2210-23.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
間葉系間質細胞は、単球およびマクロファージをプロセシングボディで再プログラムする。Stem Cells (2021) 39(1):115-28.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Ghahremani Piraghaj M, Soudi S, Ghanbarian H, Bolandi Z, Namaki S, Hashemi SM. アポトーシス間葉系幹細胞(MSCs)の排出がC57BL/6腹膜マクロファージ機能に及ぼす影響。生命科学(2018)212:203-12. doi: 10.1016/j.lfs.2018.09.052
PubMed Abstract|CrossRef Full Text|Google Scholar
間葉系幹細胞由来のアポトーシス小体:生物学的機能と治療の可能性。細胞 (2022) 11(23). doi: 10.3390/cells11233879
CrossRef 全文|Google Scholar
Oliveira RL, Chagastelles PC, Sesterheim P, Pranke P. In vivoにおける同種間葉系幹細胞に対する免疫原性反応と、同種膵島と共移植した前活性化間葉系幹細胞の役割。Stem Cells Int (2017) 2017:9824698.
PubMed Abstract|RefRef Full Text|Google Scholar
Mantovani A. MSC、マクロファージ、がん:危険なメナージュ・ア・トロワ。細胞幹細胞 (2012) 11(6):730-2. doi: 10.1016/j.stem.2012.11.016
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
間葉系幹細胞由来の細胞外小胞: 敗血症に対する新規無細胞療法。この論文では、間葉系幹細胞由来の細胞外小胞が、敗血症に対する新しい無細胞治療法であることを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
敗血症モデルにおける細胞外小胞の保護特性:前臨床研究のシステマティックレビューとメタアナリシス。J Transl Med (2023) 21(1):262. doi: 10.1186/s12967-023-04121-7
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Crivelli B, Chlapanidas T, Perteghella S, Lucarelli E, Pascucci L, Brini AT, et al. 間葉系幹細胞/間葉系細胞細胞外小胞: 活性原理から次世代ドラッグデリバリーシステムへ。J Control Release (2017) 262:104-17. doi: 10.1016/j.jconrel.2017.07.023.
PubMed Abstract | CrossRef Full Text | Google Scholar
Zheng G, Huang R, Qiu G, Ge M, Wang J, Shu Q, et al. 間葉系間質細胞由来細胞外小胞:再生および免疫調節作用と敗血症における応用の可能性。Cell Tissue Res (2018) 374(1):1-15. doi: 10.1007/s00441-018-2871-5
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
間葉系幹細胞由来細胞外小胞の免疫調節能: 免疫細胞を標的とする。免疫細胞由来細胞外小胞の免疫調節能:免疫細胞を標的とする。
パブコメ抄録|クロスリファレンス全文|Google Scholar
抗炎症作用のメディエーターとしての間葉系幹細胞由来細胞外小胞:マクロファージ極性化の裏付け。Stem Cells Transl Med (2017) 6(3):1018-28. doi: 10.1002/sctm.16-0363.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Monsel A, Zhu YG, Gennai S, Hao Q, Hu S, Rouby JJ, et al. マウス重症肺炎におけるヒト間葉系幹細胞由来マイクロベシクルの治療効果。Am J Respir Crit Care Med (2015) 192(3):324-36. doi: 10.1164/rccm.201410-1765OC
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
末梢単球を介した血小板膜工学的細胞外小胞による心臓修復のための標的免疫調節療法。バイオマテリアル(2022)284.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
エクソソームmiR-146aは、敗血症に対するインターロイキン-1βプライミング間葉系幹細胞の治療効果増強に寄与する。Stem Cells (2017) 35(5):1208-21.
PubMed Abstract|クロスリファレンス全文|Google Scholar
hUCMSCs由来のエクソソームをTNFαで前処理すると、マクロファージにおけるNLRP3の活性化が抑制され、急性肝不全が改善する。生命科学(2020)246:117401.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
間葉系間質細胞由来エクソソームは、抗アポトーシスmiR-21-5pを輸送することにより、マウス肺の虚血再灌流障害を緩和する。Eur J Pharmacol (2019) 852:68-76. doi: 10.1016/j.ejphar.2019.01.022.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
マイクロRNA-17を含む間葉系幹細胞由来細胞外小胞は、リポ多糖誘発敗血症におけるマクロファージアポトーシスを抑制する。この論文では、リポ多糖誘発敗血症におけるマクロファージアポトーシスを抑制するマイクロRNA-17を発現する間葉系幹細胞由来細胞外小胞について検討した。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Qiu P, Liu Y, Zhang J. 総説:敗血症におけるマクロファージオートファジーの役割とメカニズム。Inflammation (2019) 42(1):6-19. doi: 10.1007/s10753-018-0890-8.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Velarde F, Ezquerra S, Delbruyere X, Caicedo A, Hidalgo Y, Khoury M. Mesenchymal stem cell-mediated transfer of mitochondria: mechanism and functional impact. 細胞生命科学(2022)79(3):177.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Xing J、Wang R、Cui F、Song L、Ma Q、Xu H. 敗血症における間葉系幹細胞のマクロファージに対する制御の役割。また、そのような病態が、マクロファージにどのような影響を及ぼしているのかも明らかにした。
パブコメ抄録|クロスリファレンス全文|Google Scholar
間葉系幹細胞は細胞外小胞を用いてマイトファジーを外注し、マイクロRNAをシャトルする。Nat Commun (2015) 6(1). doi: 10.1038/ncomms9472
クロスリーフフルテキスト|Google Scholar
Mehta MM, Weinberg SE, Chandel NS. 免疫のミトコンドリア制御:ATPを超えて。Nat Rev Immunol (2017) 17(10):608-20. doi: 10.1038/nri.2017.66.
PubMed Abstract|クロスリファレンス全文|Google Scholar
間葉系間質細胞は、細胞外小胞のミトコンドリア移入により、臨床的に関連する肺損傷モデルにおけるマクロファージを調節する。Am J Respir Crit Care Med (2017) 196(10):1275-86. doi: 10.1164/rccm.201701-0170OC
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Hwang JW, Lee MJ, Chung TN, Lee HAR, Lee JH, Choi SY, et al. ラットの糞便スラリーモデルに対するミトコンドリア移植の免疫調節効果。Crit Care (2021) 25(1). doi: 10.1186/s13054-020-03436-x
パブコメ要旨|全文|Google Scholar
Misharin AV、Morales-Nebreda L、Reyfman PA、Cuda CM、Walter JM、McQuattie-Pimentel AC、他。 単球由来肺胞マクロファージは肺線維化を促進し、生涯にわたって肺に持続する。J Exp Med (2017) 214(8):2387-404. doi: 10.1084/jem.20162152.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
胎盤間葉系幹細胞は、クレブシエラが介在する急性呼吸窮迫症候群において、IL-1βを介してM1骨髄マクロファージよりもM2肺胞マクロファージを押し上げる。(2023)78(5):504-14。doi: 10.1136/thoraxjnl-2021-217928
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Cutler AJ, Limbani V, Girdlestone J, Navarrete CV. 臍帯由来間葉系間質細胞は単球の機能を調節してT細胞の増殖を抑制する。臍帯由来間葉系間質細胞は単球の機能を調節し、T細胞の増殖を抑制する。
PubMed Abstract|クロスリファレンス全文|Google Scholar
Gong P, Ding Y, Sun R, Jiang Z, Li W, Su X, et al. 間葉系幹細胞は、病原性マクロファージの動員を抑制することで、全身性硬化症を緩和する。細胞死発見(2022)8(1):466.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
B7-H1のアップレギュレーションを介したMSCによるT細胞増殖抑制のプライミングにおけるIFNγの重要な役割。細胞増殖抑制におけるIFNγの重要な役割. Cell Res (2008) 18(8):846-57.
PubMed Abstract|クロスリファレンス全文|Google Scholar
間葉系幹細胞が免疫抑制機能を発揮するには、十分かつ継続的な免疫応答が必要である。移植計画(2009)41(6):2607-11. doi: 10.1016/j.transproceed.2009.06.119
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
TGF-βは間葉系幹細胞の存在下で免疫応答を促進する。J Immunol (2014) 192(1):103-9. doi: 10.4049/jimmunol.1302164.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
M1マクロファージ由来エクソソームはmiR-222を伝達し、骨髄間葉系幹細胞のアポトーシスを誘導する。研究成果報告書(2021年)101(10):1318-26.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
線維性トポグラフィーを介したマクロファージ表現型転換が間葉系幹細胞のリクルートメントに及ぼす影響: in vivo研究。Biomaterials (2017) 149:77-87. doi: 10.1016/j.biomaterials.2017.10.007.
PubMed Abstract|クロスリファレンス全文|Google Scholar
筋骨格系前駆細胞/間質細胞由来ミトコンドリアは、細胞の分化と治療機能を調節する。論文タイトル:Front Immunol(2021)12:606781.DOI:10.3389/fimmu.2021.606781。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
骨粗鬆症における代謝リモデリングを通じて、ミトコンドリア移行が細胞運命を制御する。doi: 10.1002/advs.202204871.
CrossRef フルテキスト|Google Scholar
キーワード:間葉系幹細胞、マクロファージ、免疫調節、可塑性、クロストーク、敗血症
引用 Tao X, Wang J, Liu B, Cheng P, Mu D, Du H and Niu B (2024) 敗血症の免疫調節における間葉系幹細胞とマクロファージの可塑性とクロストーク。Front. Immunol. doi: 10.3389/fimmu.2024.1338744.
受理された: 15 November 2023; Accepted: 2024年1月10日;
発行:2024年1月30日
編集者
パク・ジュヨン(ソウル大学、韓国
査読者
Elba Mónica Vermeulen, CONICET Institute de Biología y Medicina Experimental, アルゼンチン
Xuehui He、ラドバウド大学メディカルセンター、オランダ
Copyright © 2024 Tao, Wang, Liu, Cheng, Mu, Du and Niu. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*Correspondence: Huimin Du, 1020677872@qq.com; Bailin Niu, nberlin@126.com.
これらの著者は本研究に等しく貢献し、筆頭著者である。
免責事項:本論文で表明されたすべての主張は、あくまでも著者らのものであり、必ずしもその関連組織、あるいは出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではありません。
こんな人も見ています
自己免疫疾患におけるB細胞受容体レパートリーの異常
結城勇人、板宮貴弘、長淵康夫、太田峰人、藤尾敬士
妊娠に伴う免疫学的変化のモニタリングのための標的血中転写パネルのデザイン
Tobias Brummaier、Darawan Rinchai、Mohammed Toufiq、Mohammed Y. Karim、Tanwir Habib、Jürg Utzinger、Daniel H. Paris、Rose McGready、Alexandra K. Marr、木野智茂、Annalisa Terranegra、Souhaila Al Khodor、Damien Chaussabel、Basirudeen Syed Ahamed Kabeer
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2024 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
ご利用条件
この記事が気に入ったらサポートをしてみませんか?
