
小胞体を介したファゴサイトーシスはマクロファージへの侵入のメカニズムである
小胞体を介したファゴサイトーシスはマクロファージへの侵入のメカニズムである
著者リンク オーバーレイパネルを開くEtienneGagnon1MichelDesjardins15
https://doi.org/10.1016/S0092-8674(02)00797-3
権利と内容を取得する
エルゼビア・ユーザーライセンスに基づくオープンアーカイブ






要旨
貪食は、人間が本来持っている感染症に対する抵抗力の重要な一面である。本研究では、マクロファージにおけるファゴソーム形成の膜源として、貪食カップの下にある小胞体(ER)とマクロファージ形質膜の融合があることを明らかにした。ERの連続した波は、ファゴリソソーム生合成の際に成熟したファゴソームと関連するようになる。このように、ERは予期せぬ多能性融合特性を有しているようである。ERを介したファゴサイトーシスは、ホスファチジルイノシトール3-キナーゼによって部分的に制御され、宿主における最終的な輸送にかかわらず、不活性粒子や細胞内病原体の内包に利用されている。病原体が迅速に死滅する好中球では、ERは貪食のための膜の主要な供給源としては使用されない。我々は、細胞内病原体は、宿主細胞での破壊を避けるために、小胞体を介した食作用に適応し利用するように進化してきたと提唱している。
前の記事へ次の記事へ
はじめに
貪食は、細胞が異物を取り込むプロセスであり、栄養補給に利用する単細胞生物から、自然免疫に重要な役割を果たす哺乳類に至る真核生物に見られる(Aderem and Underhill, 1999参照)。貪食は、粒子リガンドが細胞表面の様々な受容体に結合することで開始される。これは、アクチン細胞骨格の再配列につながる多様なシグナルを誘発し(MayとMachesky、2001)、Rho/Racファミリーの様々な低分子GTPaseによって制御されるステップであるCaronとHall 1998, Massolら1998.1.1. ホスファチジルイノシトール3-キナーゼはまた、細胞膜(PM)に集められ、そこで仮足伸長とファゴソーム形成に役割を果たす Coxら1999, Vieiraら2001. マクロファージの顕著な貪食能力は、その機能と生存率を損なうことなく、自分自身と同じ大きさの粒子を内包する能力によって示されている(CannonとSwanson、1992)。HeineとSchnaitmanによる初期の報告(1971年)以来、ファゴソームはPMの侵入によって形成されることが広く受け入れられている。細胞表面膜の喪失を克服するために、ファゴソーム上に存在するPM成分は速やかに細胞表面にリサイクルされると考えられ(Pittら、1992)、一方、エンドサイトーシスおよびポストゴルジ経路のオルガネラとの融合現象によって、成熟したファゴソームにさらなる膜が動員されるDesjardinsら、1994a, Jahrausら、1998。
ファゴリソソームの生合成に関わる分子機構を理解するために、我々はプロテオミクス的アプローチを用いてラテックスビーズ含有ファゴソームの組成の包括的な特性評価を行った。その結果、このオルガネラから250以上のタンパク質が同定され、ファゴリソソーム生合成のメカニズムに関する新しい知見が得られた(Garin et al. 驚くべきことに、ファゴソーム調製物には、カルネキシンやカルレティキュリンなどの小胞体(ER)のタンパク質がいくつか含まれており、ERが汚染物質であるか、食作用のプロセスで役割を果たしている可能性が示唆された(Garinら、2001年)。
本研究では、貪食の初期にERが直接PMに結合・融合することによってファゴソームが形成されることを示した。ERはまた、ファゴソーム成熟の様々な段階において、膜を供給するために連続的に添加される。ERを介した貪食は、マクロファージが不活性粒子や細胞内病原体(Salmonella Enterica serovar typhimuriumやLeishmania donovaniなど)を取り込むために広く用いられているプロセスであり、これらはすべてER特性を示すファゴソーム内に見いだされる。ERを介した食作用は、ERタンパク質がどのようにして細胞表面に到達するのか、細胞内病原体からの抗原がどのようにしてMHCクラスI分子によって提示されるのかなど、これまでの多くの観察結果を説明する枠組みを提供するものである。
研究成果
カルネキシンが豊富な小胞体膜と初期ファゴソームとの会合
ERタンパク質が汚染物質なのか、それとも本物のファゴソーム構成要素なのかを区別するために、ウェスタンブロット分析を行った。その結果、よく知られたERタンパク質であるカルネキシン、カルレティキュリン、Sec61pは、全細胞溶解液および核後上清と比較して、ファゴソームに非常に濃縮されており(図1A)、これらのタンパク質が汚染から生じたとは考えられないことを示している。
ダウンロード 高解像度画像のダウンロード(1MB)Download : フルサイズ画像のダウンロード
図1. ERタンパク質はファゴソームに濃縮されている
(A) 30分後のファゴソーム(Phago)のタンパク質プロファイルを、マクロファージ全細胞溶解液(TCL)、マクロファージ核後上清(PNS)、マクロファージ全膜調製液(Memb)と比較した。各レーンに等量のタンパク質をロードした(15μg)。ウェスタンブロット解析により、ERタンパク質であるカルネキシン、カルレティキュリン、sec61pが、TCLおよびPNSと比較して、ファゴソームで濃縮されていることが示された。プロナーゼの存在下で37℃、30分間インキュベートした単離ファゴソームとしなかった単離ファゴソームも分析した。消化物からファゴソームを分離するために2回目の単離操作を行ったところ、カルネキシンの細胞質ドメインに対する抗体では、処理したオルガネラにこのタンパク質が存在することを確認できなかったことから、カルネキシンはネイティブな形でファゴソーム上に存在することが示された。一方、内腔ERタンパク質であるカルレティキュリンは処理による影響を受けず、ファゴソームの内腔に存在することが示された。
(B) カルネキシンの局在は、細胞質ドメインに対する抗体を用いて、免疫蛍光法または前埋め込み免疫金法により単離ファゴソーム上で行われた。挿入図(免疫蛍光法)は、カルネキシンがファゴソーム膜上のラテックスビーズ周辺に存在することを示している。EMレベルでの観察では、カルネキシンはファゴソーム膜の周囲に存在し(金粒子の88%がファゴソーム膜上にあった)、他の未同定の膜成分には存在しないことが確認された(アスタリスク)。カルネキシンは我々の調製品に加えたラット肝ミクロソーム(矢印)にも存在する(陽性対照)が、カルネキシンの内腔部に対する抗体を用いると、この部分は無傷のファゴソームでは抗体によって到達できないため、明らかにされない(陰性対照)。矢印は陰性ファゴソームを示す。
(C) 場合によっては、ファゴソーム上に薄い膜(大きな矢印で示す)と厚い膜(小さな矢印で示す)の2種類の膜が観察されることがある。埋め込み前の免疫標識により、カルネキシンは薄い膜に優先的に検出され(94%)、一方、LAMP1は厚い膜に明確に存在する(92%)ことがわかった。なお、陽性対照としてミクロソームも加えた(左図)。
ER小胞がファゴソーム調製物を汚染している場合、これらの小胞はファゴソーム内腔にあるか、ファゴソームの細胞質表面に緩く結合していると予想される。もし、ERが汚染物質ではなく、ファゴソームと直接融合した場合、ERの膜タンパク質がファゴソーム膜に移動し、内腔のERタンパク質がファゴソームの内腔に移動することが予想される。これらの可能性に対処するため、精製した無傷のファゴソームに対してプロナーゼ消化を行った。この処理では、これらのオルガネラの細胞質側に露出する全てのタンパク質部位が分解され、その後、ファゴソームを放出物質から分離するための第2の分離手順が行われた (Garin et al., 2001). この処理により、カルネキシンの細胞質ドメインが分解され、カルネキシンC末端特異的抗体に対するファゴソームの免疫反応性が失われたことが示された(図1A)。ファゴソームの細胞質側にカルネキシンのC末端ドメインが存在することから、ファゴソーム内腔にER小胞が存在し、プロナーゼが到達できないことが推察された。また、内腔内のER可溶性タンパク質カルレティキュリンはプロナーゼ処理に鈍感であったため、ファゴソーム表面でのER小胞の緩やかな結合も否定された。このような小胞はプロナーゼ処理により放出されるはずである。したがって、ERとファゴソームが直接融合した場合、カルネキシンとカルレティキュリンはファゴソーム内で本来の向きにあることが予想された。
ファゴソーム膜上のERエレメントの存在を直接示すために、ラテックスビーズを30分間内在化したマクロファージに対して、抗カルネキシン抗体を用いた共焦点解析を実施した。その結果、in situで細胞質内とラテックスビーズ含有ファゴソーム周辺に分散したカルネキシンが強く標識されていた(図らずも)。しかし、ファゴソームが本当に標識されているのか、それとも単にER陽性の強い領域に存在しているだけなのかを判断することは困難であった。そこで、ファゴソームを単離し、精製したオルガネラを用いて免疫蛍光分析を行った。この方法では、単離されたファゴソームの70%以上の周囲に標識が存在することが示された(図1Bの挿入部分)。カルネキシンの細胞質尾部に対する抗体を用いた電子顕微鏡(EM)レベルでの埋め込み前の免疫金標識を使って、カルネキシンとファゴソーム膜の直接的な結合を証明できた(図1B;数えた1095個の金粒子の88%がファゴソーム膜上にあった)。ポジティブコントロールとして試料に加えたラット肝ERミクロソームにも強い標識が観察された(図1B、右上パネル)。一方、ネガティブコントロールとして、カルネキシンの内腔ドメインに対する抗体を用いた場合、この部分は我々の条件下では抗体によってアクセスできないため、標識は観察されなかった(図1B、右下パネル)。これらの結果から、カルネキシンはファゴソーム膜の正真正銘の構成要素であることが明らかになった。ほとんどのファゴソームでは、カルネキシンの標識は膜全体で均一ではなく(図1C、左パネル)、特に薄い膜に多く見られた(大きな矢印;標識の94%は薄い膜、約6 nmの厚さに存在した)。後期エンドソームとリソソームのマーカーである抗LAMP1による並行免疫標識では、ファゴソーム膜の厚い部分に標識が見られた(図1C、右図、小さな矢印;92%の標識は約9 nmの厚さの膜に存在した)。これらの結果は、ERとエンドサイトーシス小器官の両方がファゴソーム膜に寄与していることを示唆している。
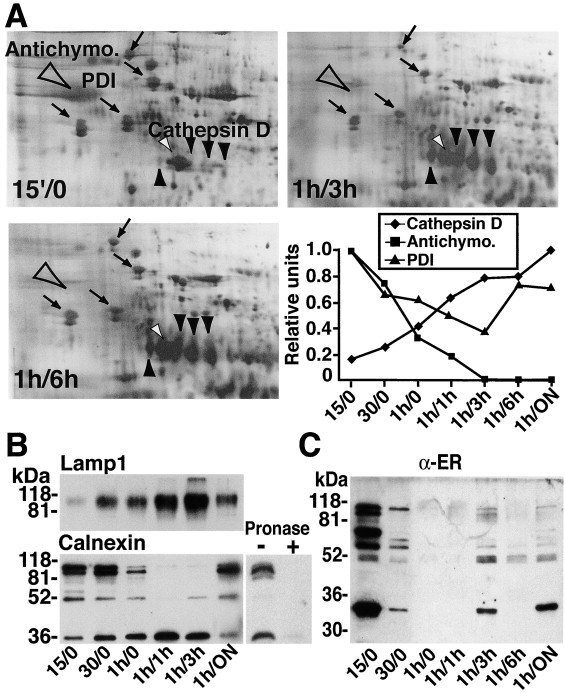
ERがいつファゴソームと結合したかを調べるために、マクロファージにラテックスビーズを添加した後、異なる時点で単離した食細胞構造上のカルネキシンの相対量を比較検討した。(1)ファゴサイトカップは、部分的に飲み込まれた粒子を取り囲む膜構造であり、(2)ファゴリソソーム経路に沿った様々な成熟レベルのファゴソームを含む種々の食細胞小器官の分離を可能にするために、様々な時点が選ばれた。これらの貪食構造の性質を明らかにするために、2つのアプローチを用いた。まず、各内包化時点の閉鎖ファゴソーム内に存在するビーズ数をEMで測定した。第二に、200以上のタンパク質スポットを含む2次元ゲルデータベースを利用して、様々な食細胞小器官の生化学的組成を分析した(Garin et al.、2001)。その結果、ラテックスビーズを15分間与えた細胞は、60分間ビーズを内包した細胞で観察されたファゴソーム数の10%以下であり、15分間で解析した貪食構造のごく一部が閉じたファゴソームであることが示された。さらに、本研究のために分離した食細胞の2次元ゲル解析から、我々の条件下で形成された最も初期の食細胞構造(15/0)は、成熟した食細胞(1時間/3時間および1時間/6時間)とは大きく異なることが明確に示された(図2A)。2次元ゲルのデンシトメトリー解析により、ラテックスビーズの表面に付着した血清タンパク質であるアンチキモトリプシンが15分区画で大量に観察されたのに対し、カテプシンDを含むカテプシンファミリーのメンバーは存在しなかった(図2A、右下)。これらの特徴は、貪食カップまたはごく初期のファゴソームから予想されるものである。驚くべきことに、15分後の貪食カップ/ファゴソームでは、ERタンパク質であるGRP 94、BiP、PDI、カルレティキュリンが高いレベルで観察された。それ以降の時間帯では、内在化したアンチキモトリプシンがファゴソーム成熟の過程で後天性ヒドロラーゼにより分解された。また、デンシトメトリー測定により、ERタンパク質(PDIなど)のレベルはファゴソーム成熟の初期に減少し、その後、ビーズ内在化後6時間後に増加することが示された。このことから、貪食カップから成熟したファゴリソソームまでの貪食構造が分離できること、そして貪食カップにはすでにERが存在していることが示された。
ダウンロード 高解像度画像のダウンロード(2MB)Download : フルサイズ画像のダウンロード
図2. カルネキシンはファゴリソソームの生合成中に分解される
(A)各時点で研究された貪食構造の生化学的性質は、それらの2次元ゲルパターンを比較することによって明らかにされた。最も早い時点(15′/0)では、ビーズに結合した血清タンパク質である未分解のアンチキモトリプシン(大きな空の矢じり)が多量に存在し、カテプシンDのようなヒドロラーゼ(小さな黒い矢じり)は存在しないことから、プレファゴソーム構造(ファゴサイトカップ)として同定された。一方、成熟ファゴソーム(1時間/3時間、1時間/6時間)では、ヒドロラーゼ(黒い小さな矢頭)が蓄積し、アンチキモトリプシン(空の大きな矢頭)を効率的に分解できるようになった。ERタンパク質の量もファゴリソソーム形成中に変化し、最も早い時点でより多くの量が観察された(矢印、時計回り:GRP94、BiP、PDI、カルレティキュリン)。小さな白い矢印はアクチンを示す。スポット強度のデンシトメトリー解析により、これらの観察結果が確認された(A、右下)。
(B)ファゴソームの成熟は、LAMP1の経時的な蓄積を示すことで確認した。カルネキシンを抗細胞質尾部抗体(90 kDa付近の二重鎖)で明らかにすると、貪食カップ(15分)および初期ファゴソーム(30分)に強いシグナルが観察された。1時間から4時間経過したファゴソームではシグナルが減少しており、ファゴリソソーム生合成中にカルネキシンが分解されたことが示された。プロナーゼの分解を受けやすい分子量の小さいペプチドも認識された。ファゴリソソームにはカルネキシンが観察されたが、LAMP1のシグナルは減少しており、成熟ファゴソームには第二波のER膜が動員されたことが示唆された。
(C) 精製ラット肝ミクロソームに対して上昇させたポリクローナル抗体を用いて、ER会合の連続的な波の発生を確認した。
ERのファゴソームへの会合の動態を確認するために、様々な貪食構造上のカルネキシンとLAMP1(ファゴソーム成熟のマーカー)の獲得状況をイムノブロッティングでモニターした。同じ数のオルガネラを分析したところ、調査した最も初期のコンパートメントがカルネキシンの最も強いシグナルを示し、LAMP1は低量で存在した(図2B)。このことから、ERはファゴソーム形成のごく初期に獲得されることが確認された。ファゴソーム成熟期(他の時点ではLAMP1が徐々に蓄積することで確認)には、全長カルネキシンの強度は減少し、抗細胞質尾部抗体によってまだ認識される小さな形態のタンパク質が蓄積した(36 kDa前後のバンドを含む)。このパターンは、ファゴリソソーム生合成中にカルネキシンの内腔側ドメインがファゴソーム内で分解されることと矛盾しない。成熟ファゴソーム(1時間/ON:15時間ビーズを一晩追跡)では、全長カルネキシンのシグナルが強く、LAMP1のシグナルは減少した。これは、成熟ファゴソームにさらにERが追加されてLAMP1含有量が希釈されていることを示唆するものである。ファゴリソソーム生合成中のERの連続した波のファゴソームへの結合は、高濃縮ラット肝臓ER画分に対して上げたポリクローナル抗体を用いて、いくつかのERタンパク質を追跡することで確認された(図2C)。これらの結果を総合すると、ERの結合はファゴソーム形成のごく初期に、またファゴリソソーム生合成中の様々な間隔で起こることが明確に示された。
新規に合成されたタンパク質とカルネキシンの基質がファゴソームへ迅速に輸送される
新しく合成されたタンパク質がファゴソームに速やかに運ばれるかどうかを調べるために、細胞を30分間ラテックスビーズに内在させ、最後の5分間は35S標識メチオニンを存在させた。これらの条件下で、単離されたファゴソームは、全細胞溶解液と比較して、放射性標識タンパク質の明確なセットを示した(補足図S1参照、http://www.cell.com/cgi/content/full/110/1/119/DC1 で入手可能)。ファゴソームに移行した新規合成タンパク質の一部がカルネキシンの基質であるかどうかを調べるために、これらの細胞から分離したファゴソームに対して抗C-末端カルネキシン抗体による免疫沈降を行った。新たに合成されたカルネキシン基質の共沈は、ファゴソームと全細胞溶解液の両方で同一であり、共通のER由来であることが示された。これらの結果の特異性は、コントロールのHepG2細胞(ヒト肝細胞)およびJ774マクロファージでプレ免疫血清を用いて免疫沈降を行った場合、主要なタンパク質が観察されないことを示すことで実証された。さらに、ツニカマイシンで前処理した細胞からのカルネキシン抗体による免疫沈降は、カルネキシンと関連した基質の糖タンパク質特異性と一致する、標識の減少を示した(Ouら、1993)。最後に、J774マクロファージを32P標識したオルトリン酸でin vivo標識したところ、ファゴソーム中にホスホカルネキシンが存在することが明らかになった。これらの結果は、機能的カルネキシンと結合した新しく合成された不完全な折り畳み状態の糖タンパク質がファゴソームに速やかに動員されることを示している(上記URLの補足図S1参照)。
ファゴソーム形成とファゴリソソーム生合成におけるERの会合には、ホスファチジルイノシトール3-キナーゼとプロトンポンプATPaseがその場で関与している。
食作用とオートファジーは、Ly294002、wortmannin、3-methyladenineなどのPI3キナーゼ阻害剤によって影響を受けることが知られている Blommaartら 1997, Coxら 1999. PI3KがERを介した食作用に関与しているかどうかを調べるために、細胞を様々な阻害剤で処理し、ファゴソームの形成と構成に対するそれらの効果を調べた。3-MA、wortmannin(図3A〜3E)、またはLy294002(図示せず)で前処理すると、貪食が急激に減少し(各薬剤で65%以上の阻害-3-MAを図3Bに示す)、細胞表面の仮足内のビーズが蓄積した(ファゴサイトカップの)。これらの構造をEMレベルで観察したところ、貪食の初期段階に起こる予期せぬ特徴が明らかになった。ビーズを内包した部位で、ERとPMの間に直接接触と連続性が観察され(図3C、3D)、ERが細胞表面に直接動員されてファゴソームを形成していることが示唆された。同様の現象は、ワートマニンでも観察された(図3E)。3-MA処理細胞で形成された少数のファゴソームの全体組成を、2次元ゲル電気泳動法を用いて無処理細胞で形成されたものと比較した。この結果、大きな違いはなく、非常に重要なことに、両方の条件で分離したファゴソームには、ERタンパク質に対応する既知のスポットが存在することが判明した。このことは、3-MAによる処理が、未処理細胞で起こるのとは異なる内在化プロセスを引き起こさないことを示した(図3F)。
ダウンロード 高解像度画像のダウンロード (2MB)Download : フルサイズ画像のダウンロード
図3. 小胞体による貪食はPI3Kに関与する
細胞は、ビーズ内在化の前に、PI3K阻害剤である3-メチルアデニン(1 mM)またはワートマニン(100 nM)で60分間処理するかしないかを決定した。その後、細胞にラテックスビーズ(LB)を60分間与え、阻害剤存在下で30分間チェイスし、EM用に準備した。
(A) 未処理の細胞は大量のビーズを内在化したが、細胞表面にはわずかなビーズしか観察されなかった。一方、3-MA処理細胞では、ほとんどのビーズが細胞表面の偽ポディア内に留まっていた。
(B)定量分析により、3-MAが仮足の形成に影響を与えることなく貪食を強く阻害することが確認され、この薬剤が貪食を遅くしていることが示唆された。
(CおよびD)3-MAおよび(E)wortmannin処理した細胞をEMレベルで観察すると、貪食カップの下でERと細胞膜が直接接触していることが確認された。挿入図は、ERと細胞表面膜が明らかに連続している領域(矢印)を高倍率で示したものである。ラテックスビーズ(0.8μm)は相対倍率を示す。
(F)3-MA処理が、正常細胞によって使用されるものとは異なる食作用の形態を引き起こしていないことを示すために、ファゴソームの2-Dゲル分析を実施した。両試料で得られた全体的に類似した2-Dゲルタンパク質パターンは、同様の内在化メカニズムが関与していると思われることを示した(矢印は時計回りにERタンパク質GRP94、BiP、PDI、およびカルレティキュリンを示す)。
貪食は、液胞プロトンポンプATPaseの阻害剤であるバフィロマイシンA1(Bidani and Heming, 1995)によっても顕著に減少する。J774マクロファージを処理すると、ラテックスビーズの貪食が著しく減少した(約95%の阻害)。ラテックスビーズが貪食カップ内に存在するものの、これらの構造をつなぐ小胞体膜は観察されなかった。しかし、ビーズを先に内在化させ、その後バフィロマイシンを処理した場合、EMレベルで観察すると、この条件ではファゴソームとリボソームを持たないER様構造体が多数連結していることが明らかになった。これらの構造のER性を確認するために、Epon切片のEMレベルでER酵素であるグルコース-6-ホスファターゼ(G-6-Pase)の活性を明らかにし、細胞の形態的特徴の高い保存を保証する細胞化学技術を利用した(Griffithsら、1983年)。予想通り、細胞全体のERと並置された核膜は強いG-6-Pase活性を示したが、他の細胞小器官やPMには標識が観察されず、この細胞化学的手法によるER同定の高い特異性が検証された(図5、図6、図7を参照)。このように、確立されたアプローチを用いることで、バフィロマイシン処理後のファゴソームに接続された網状構造体に、G-6-Pase活性によって生成した濃厚な沈殿物を観察することができ、そのER由来を確認することができた(図4A)。バフィロマイシン処理後にERとファゴソームの一部が直接接続されているかどうかを調べるために、次のような実験を行った。ラテックスビーズをプレロードした細胞を、エンドソーム-ファゴソーム融合とBSA-金粒子のファゴソームへの移動を可能にする期間である15分間、エンドサイトーシスによってBSA-金を内在化させた(Desjardins et al.、1997)。これらの細胞をバフィロマイシンで処理すると、ファゴソームに接続された網状構造(AのG-6-P活性を示すものと同様)にBSA-金が含まれ、この2つのオルガネラの連続性を示すようになった(図4B)。これらの結果は、ファゴソームと小胞体構造の融合/分裂が、少なくとも部分的にはプロトンポンプATPaseの活性によって制御されていることを示している。
ダウンロード 高解像度画像のダウンロード(1MB)Download : フルサイズ画像のダウンロード
図4. ER-ファゴソーム間の相互作用は、液胞プロトンポンプATPaseによって部分的に制御される
(A)ラテックスビーズを30分間内在化させ、バフィロマイシンA1存在下で60分間チェイスした。この処理後、グルコース-6-ホスファターゼ細胞化学を用いて、ERを明らかにした。バフィロマイシン処理した細胞では、ER(G-6-Pase陽性)とファゴソーム(LB)の接触が容易に観察された。挿入図は、相互作用の焦点と、2つの小器官の間の明白な膜の連続性を示している。
(B)これらの小器官の内腔が連続しているかどうかを調べるために、ラテックスビーズを30分間内在化させ、30分間追跡してファゴソームを形成させた。次に、BSA-金を細胞培養に15分間加え、エンドサイトーシスによる内在化を可能にし、その後、30分間追跡してファゴソームへの移行を可能にした。その後、細胞をバフィロマイシンとともに60分間インキュベートし、EM処理を行った。BSA-金粒子は、(A)で観察されたものと同様のER構造の内腔で観察され、明らかにファゴソームとつながっており、2つのオルガネラの間で直接融合現象が起こったことが示された。
小胞体による貪食は、マクロファージに広く利用されている内在化プロセスである。
貪食は、細胞膜に由来すると考えられる貪食杯と呼ばれる膜構造の形成から始まり、それが侵食・封鎖されてファゴソームが形成される。これまでの結果から、ERは貪食カップに直接動員され、ファゴソーム形成に必要な膜の一部を供給していると考えられる。この過程を可視化するために、4℃でラテックスビーズを細胞表面に遠心分離し、その後37℃で10分間インキュベートして貪食カプセルを形成した。共焦点顕微鏡(図5Aおよび5B)およびEM細胞化学(図5Cおよび5D)の両方により、ラテックスビーズ内在化中の貪食カップへのERの結合が確認された。抗カルネキシン抗体および抗LAMP1抗体を用いた共焦点解析により、ERはラテックスビーズを取り囲む仮足に非常に濃縮されていること(白矢印)、一方でLAMP1はまだ勧誘されていないことが示された。同じ実験のサンプルを処理し、EM レベルで可視化した。観察により、ファゴソーム形成に使用される膜の一部がERの性質を持つことが確認され、部分的に飲み込まれたラテックスビーズを囲む膜にG-6-Paseラベルが存在することが明らかになった(図5C)。ファゴソーム形成後、多くのファゴソームが強いG-6-Pase標識を示した(図5Dおよび表1)。
ダウンロード 高解像度画像のダウンロード (789KB)Download : フルサイズ画像のダウンロード
図5. 貪食中の擬似ポディアにはERエレメントが存在する
(A)ラテックスビーズ(3μm)を細胞表面で遠心分離して貪食カップを形成し、その後、37℃の培養液中で10分間インキュベートした。共焦点顕微鏡で連続光学スライスを観察すると(下から順に1〜3)、成長する仮足にER要素(赤のカルネキシン)が存在し(白矢印)、LAMP1(緑)はまだ採用されていないことがわかる。下図は、ラテックスビーズと可視マージを重ねたものである。
(B) 図は、(A)で見た3種類のスキャンをラテックスビーズの空間配置で再現したものである。
(C)3μmの部分的に飲み込まれたラテックスビーズ(LB)のEM画像は、貪食カップを形成する膜に関連したG-6-Pase活性の存在を示し、それらのERの性質を示す(挿入図は高倍率;矢印はG-6-Pase生成物を示す)。核膜(NE)と小胞体(ER)は強いG-6-Paseラベルを示すが、ミトコンドリア(M)はラベルされない。
(D)ラテックスビーズを含むファゴソーム(補体受容体を介して内包された0.8μmラテックスビーズをここに示す)は、G-6-Pase活性の強いラベルを示す。
表1. ERを介したファゴサイトーシスはマクロファージに広く利用されている侵入メカニズムである
粒子 マクロファージ G-6-Pase陽性区画(%) 好中球 G-6-Pase陽性区画(%)
核膜 100 100
3 μm LB 46 +/- 3 <2
3 μm LB-C3 57 +/- 2 ND
3 μm LB-IgG 54 +/- 2 ND
RBC-IgG 49 +/- 1 ND
S. typhimurium 43 +/- 2 ND
L. donovani WT 72 +/- 4 <2
L. donovani Ipg- 75 +/- 3 <2
様々な粒子を含むファゴソームをEMレベルでG-6-Pase活性の有無について分析した。核膜の強いラベル化を示す細胞のみを分析した。すべての実験について、n = 3(少なくとも100個のファゴソームをカウントした)。LB、ラテックスビーズ;RBC-IgG、IgG-オプソニン化ヒツジ赤血球。
生化学的分析のためにファゴソームを形成する標準的なプロトコルは、ほぼ飽和状態(培養液中の10%ビーズ懸濁液の1:10〜1:50希釈)でラテックスビーズを内在化させることを含む。この条件では、細胞あたり最大100個のビーズが内在化される。このような状況では、大量の膜が必要となり、ERの使用は食作用の「自然」プロセスを代表するものではない可能性がある。ERを介した貪食が単に極端なケースで使われるのではないことを示すために、1:10ではなく1:200の高希釈度でラテックスビーズを60分間内在化させた。この結果、細胞あたり5個以下のビーズが内在化された(結果は示さず)。これは、おそらく細胞膜のみを使用することで対応可能な、それほど要求の高くない状況であった。しかしながら、これらの条件下で形成されたファゴソームは、2次元ゲルにおいて、高レベルのERタンパク質を含む同じ全体的なタンパク質プロファイルを依然として示し(結果は示さず)、少量の膜が必要な場合でもERが貪食に利用されることが示された。
次に、ERを介した貪食がマクロファージにおける一般的な侵入方法であるかどうかを評価するための実験を行った。まず、2次元ゲル解析を用いて、通常のビーズ(熱不活性化ウシ胎児血清を含む培養液中でオプソニン化する)、あるいはアルブミンと抗アルブミンまたはマウス血清でそれぞれオプソニン化した後、Fcおよび補体受容体を介してビーズを内在化することによって形成されるファゴソームの全体構成を比較した(Duclos et al.、2000)。3種類のビーズを含むファゴソームは、既知のERタンパク質をすべて含み、類似した2次元パターンを示した(図示せず)。次に、形態学的解析により、強く標識されたG-6-Pase陽性ファゴソーム中に3種類のラテックスビーズが大きな割合で存在することが示された(表1)。Fcレセプターを介した侵入がER由来のファゴソームにつながることをさらに証明するために、IgG-オプセル化赤血球を用いて同様の分析を行った。この場合、赤血球の大部分は、G-6-Pase活性を示すファゴソーム内にあった(図6Eおよび表1参照)。
ダウンロード 高解像度画像のダウンロード(2MB)Download : フルサイズ画像のダウンロード
図6. ERを介したファゴサイトーシスは、マクロファージへの侵入の一般的な様式である
J774マクロファージにL. donovani(L)を30分間、Salmonella typhimurium(S)を5分間、またはIgG-opsonized red blood cell(RBC)を30分間内在化させ、ファゴソームを形成させた。細胞はその後、G-6-Pase活性を明らかにするために処理され、EM用に準備された。
(A)いくつかのケースでは、部分的に取り込まれたリーシュマニア寄生体(L)が観察された。これらの場合、寄生体の最内部はすでに強いG-6-Pase活性を示すER由来の要素に存在し(矢印は標識の終わりを示す)、寄生体の遠位端はまだ細胞外にあり(アスタリスク)、G-6-Pase標識をもたない膜に接触している(PM?)
(B)内在化部位において、リーシュマニアを含むファゴソームへの直接的なERの結合が観察された。挿入図は、ER-ファゴソーム間の直接結合の高倍率表示(矢印)。
(C)内在化後、リーシュマニア(L)はERに由来するコンパートメントに明確に存在し、強いG-6-Pase活性を示した。核膜(NE)とERは特異的に強く標識されていた。挿入図は、ファゴソーム膜(右矢印)が寄生体の表面(左矢印)に密着しており、ファゴソーム内腔にG-6-Pase産物が明瞭に存在していることを示している。
(D)細胞内病原体Salmonella typhimurium(S)と(E)赤血球も、Fc受容体を通して特異的に内在化され、G-6-Pase活性を示すファゴソーム内に存在した。
ERを介した貪食が病原体の内在化にも利用されているかどうかは不明なままであった。そこで、ERと相互作用することが知られていない大型の細胞内病原体Leishmania donovaniを細胞内に取り込む過程について検討した。野生型リーシュマニアを感染させた細胞を用いてG-6-Pase活性を解析したところ、寄生虫を含むファゴソームの内腔に強いラベルが観察され(図6A-6C、表1)、病原体の内在化にはERも関与していることが示された。また、細胞表面付近で新たに形成されたリーシュマニア含有ファゴソームとERシステナが直接接触することで、リーシュマニア内在化部位でERの直接結合が観察されることがある(図6B、黒矢印)。さらに、L. donovaniの貪食は、寄生体の侵入とその長い鞭毛によって始まるため、いくつかのケースでは、鞭毛がまだ細胞外にある間に、不完全に飲み込まれた寄生体の基部にすでにG-6-Pase陽性膜が存在することが観察された(図6、図7に2例を示す)、ラテックスビーズについて観察したように(図5Cを参照のこと)。いずれの場合も、鞭毛は短い仮足間に観察され、長い寄生体の周囲には伸びていないように見えた。また、表面にリポフォスフォグリカンの切断型を示す変異体寄生虫もG-6-Pase陽性コンパートメントで観察された。ERを介した貪食が一般的なプロセスであるかどうかをさらに明らかにするために、マクロファージ細胞株J774および上皮細胞株IEC-18にサルモネラ・チフスムリウムを感染させて、G-6-Pase活性を示すファゴソームの数を計測してみた。マクロファージ(図6D)と上皮細胞(図示せず)の両方が、G-6-Pase陽性コンパートメントに細菌を表示した。この場合も、サルモネラを含むファゴソームの大部分はG-6-Pase陽性であった(表1)。これらの結果から、マクロファージでは、貪食嚢が閉じる前に、細胞表面でERが貪食に利用されることがわかった。
ダウンロード 高解像度画像のダウンロード(1MB)Download : フルサイズ画像のダウンロード
図7. ERを介した貪食は、好中球のラテックスビーズとリーシュマニア寄生虫の取り込みに利用されない
(A)リーシュマニア寄生体(L)がマクロファージに取り込まれた状態。寄生体の本体はG-6-Paseを含む液胞内に存在するが、鞭毛(F)は短い仮足(矢印)の間に固定され、まだ細胞外に存在する。G-6-Paseは核膜(NE)および小胞体(ER)に特異的に存在する。マクロファージではリーシュマニア寄生体を含むファゴソームの70%以上がG-6-Pase活性を陽性としている。
(B) 一方、好中球では、リーシュマニア寄生体を含むファゴソームは、核膜(NE)と小胞体として現れるERに強いシグナルが検出されるにもかかわらず、G-6-Pase活性を示さない(2%以下のファゴソームが弱くラベルされる)。
(C) 好中球におけるリーシュマニアの貪食には、マクロファージで観察される短い仮足と比較して、大きな仮足(矢印)が関与している。
(D)マクロファージにおけるERを介した貪食の現在のモデルは、粒子が細胞表面に結合すると、粒子を細胞膜にしっかりと付着させる仮足が形成・伸長されることを提唱するものである。この過程で、小胞体は細胞表面近くに集められ、細胞膜と融合して粒子と接触する部位で開口する。そして、粒子は開いた小胞体に滑り込み、細胞膜は再密閉される。このようにして、ERを主成分とするファゴソームが形成される。
貪食作用は、好中球でも研究された。マクロファージ(図7A)とは対照的に、ラテックスビーズ粒子とリーシュマニア寄生虫は、ERと核膜に強い標識が観察されるにもかかわらず、G-6-Pase活性を示さないファゴソーム中に存在した(図7B)。また、マクロファージ(図7A)とは対照的に、リーシュマニア寄生体の周囲の仮足は明らかに大きな膜の延長でできており(図7C)、ERを介した貪食が好中球への微生物の侵入経路として好まれない可能性を示している。
考察
貪食は大量の膜を必要とすることがあり、高度に特化したPM以外のソースがファゴソーム形成に寄与している可能性がある。Vicker (1977) は代謝と表面放射性標識を使って、ファゴソームの一部だけがPMに由来し、重要な部分は起源が不明な新しく合成された膜でできているようであることを示した。Grinsteinらは、おそらくリサイクルエンドソームに由来する内膜の貪食部位またはその近傍でのエキソサイトーシスが、粒子の完全な内在化に必要であることを示している(Hackamら、1998)。研究はまた、リソソームがT. cruzi感染中の内在化部位でPMに急速に動員され得ることを明らかにした(Tardieuxら、1992)。しかし、マクロファージ内の微生物または不活性粒子を含むファゴソームのほとんどは、当初リソソームマーカーがないため、リソソームが膜採用の一般的プロセスの一部であるとは考えにくい(Méresseら, 1999; 図2Aの15/0も参照)。
我々の結果は、ERがマクロファージにおけるファゴソーム膜の重要な貢献者であることを明確に示している。ファゴソーム膜におけるカルネキシンのネイティブな配向での存在は、プレエンベディング免疫金標識によって直接示され、プロナーゼ消化によって確認された。さらにイムノブロッティングにより、ファゴソームへのカルネキシンの急速な動員は、ファゴリソソーム生合成中にその内腔ドメインの漸次分解に続いていることが示された。さらに、パルスチェイス実験により、カルネキシンの糖鎖基質は貪食後5分以内にファゴソームへ急速に動員されることが示された。この時点で、我々の結果の論理的な解釈は、ERがファゴソーム形成後、細胞膜の代替供給源として急速に利用されているというものであった。しかし、さらなる解析の結果、ERはファゴソーム形成時に細胞膜で直接利用されるという予想外の発見がなされた。キネティック研究により、ER分子は単離された貪食カップ(図2A-2Cの15/0)上に既に多量に存在していることが明らかになった。通常の状態では、ラテックスビーズやリーシュマニア寄生虫はG-6-Pase活性を示す膜(すなわちER)に囲まれていたが、ビーズや病原体の遠位部やその鞭毛はまだ細胞の外に出ていた。また、PI3K阻害剤であるwortmanninと3-MAで処理した細胞では、貪食カップの下のPMとER要素の密接な付着が観察された。3-MAはラテックスビーズの貪食の初期段階を遅らせ、その結果、細胞表面の仮足内にビーズが蓄積され、貪食速度が減少することが示された。正常細胞では、その急速で一時的な性質のためか、見かけ上の連続性を観察することは困難であった。実際、小胞体と細胞膜の融合は、刺激されたエキソサイトーシス中の分泌小胞と細胞膜の融合と同様に急速に起こると思われ、その過程をEMレベルで可視化することは稀である。しかし、2次元ゲル電気泳動法を用いて、コントロールと3-MA処理細胞の両方で形成された初期のファゴソームは非常によく似ており、したがって、異なるメカニズムによって誘導されたとは考えにくいことが確認された。
PI3Kは小胞体によるファゴソーム形成に関与している。PI3Kは、ダイナミンに関連し、ファゴソーム形成に必要なタンパク質であるアンフィフィシンIIの新生ファゴソームへの結合に関与している(Goldら、2000)。PI3Kはまた、ファゴソームの閉鎖に必要と思われるPAK1の不活性化にも関与している(Diakonovaら、2002年)。これらのデータは、PI3Kが外分泌膜の挿入と仮足伸展の調整に必要であるという提案を支持している(Coxら、1999)。Botelhoら(2000)は、PMで貪食カップと結合した粒子が周辺部のホスファチジルイノシトール-4,5-二リン酸(4,5-PIP2)を示し、貪食後に急速に消失すること、また初期のファゴソームはジアシルグリセロール(DAG)の強い周辺シグナルを示すことを示している。彼らは、ホスホリパーゼC、そしておそらくPI3Kが関与する脂質代謝の局所的なPM変化が、4,5-PIP2のDAGへの急速な変換に関与していると示唆した。これらの結果は、4,5-PIP2が濃縮されたPMからDAGが濃縮されたERへの粒子の急速な移動を示唆しているとも解釈される。実際、PMでphosphoinositides (PI) がDAGとphosphatidate (PA) に加水分解された後、ERにある2つの酵素 (CDP-DG synthaseとPI synthase) が順次機能してPAをPIに再び変換している。Whatmoreら(1999)は、PMでのER酵素によるPI再合成は、小胞輸送機構にも可溶性輸送タンパク質にも依存しないと結論づけた。彼らは、むしろ、2つのオルガネラの間の密接な接触部位で、膜タンパク質を介したプロセスによって起こることを示唆した。今回の結果は、このような密接な接触が食作用の際に存在することを明確に示唆している。
ERと貪食小器官の相互作用は、部分的には液胞プロトンポンプATPaseによって制御されているようである。ポンプ阻害剤であるBafilomycin A1は、ファゴソームと小胞体の間の膜結合を安定化し、これらの小器官の内腔の内容物の自由拡散とファゴソーム内腔から小胞体の内腔へのBSA-金の移送を可能にする。最近、酵母液胞の融合タンパク質としてV-ATPaseが同定された(Petersら、2001)ことから、このタンパク質もファゴソームの融合/分裂の特性のいくつかを制御している可能性がある。食細胞小器官と小胞体との融合現象の前段階としての局所的な接触は、V-ATPaseを含む融合タンパク質が以前に同定されている(Lafontら、1999)構造の脂質マイクロドメイン部位で起こる可能性がある(Dermineら、2001)。
ERを介した食作用は、ERが関与するいくつかの理解されていないプロセスを理解するための枠組みを提供する。ERと細胞質との直接的な融合は、カルネキシンやカルレティキュリンなどのERタンパク質が細胞表面で観察される理由を説明するかもしれない 岡崎ら 2000, ジョンソンら 2001. しかしながら、細胞表面におけるERタンパク質の役割については、まだ十分に解明されていない。外因的に添加されたBip/GRP78は貪食を刺激することが示された(Kakimura et al., 2001)。さらに、最近の研究では、カルレティキュリンがα-2-マクログロブリン受容体であるCD91とともに、アポトーシス細胞の貪食に必要であることが示されている(Ogdenら、2001年)。我々のデータはこれらの観察を拡張し、マクロファージにおけるリーシュマニアの侵入にはカルレティキュリンとカルネキシンも関与している可能性を示唆するものである。実際、寄生体表面の主要な糖タンパク質であるGP63は、末端Glc1Man6GlcNac2 (Olafson et al., 1990) を含み、この糖鎖構造はカルレティキュリンとカルネキシンの両方が認識している (Zapun et al., 1999)。また、Dictyosteliumでは、カルレティキュリンとカルネキシンの二重欠損変異体が貪食を阻害することから、これらのタンパク質が貪食に関与することが示唆されている(Müller-Taubenbergerら、2001年)。したがって、貪食カップの下でERが細胞膜と融合することにより、カルレティキュリンとカルネキシンが内在化する部位に届けられ、貪食受容体の一部として使用できるのではないかと推測される。
ERにおいて、カルネキシンは糖タンパク質の品質管理機構の主要な構成要素である(Zapunら、1999)。カルネキシンの基質がファゴソーム(およびリソソーム?)に運ばれることは、品質管理経路に沿った不適切に折り畳まれたタンパク質の分解への代替経路として利用される可能性がある。ERがファゴソーム形成に関与し、新しく合成されたペプチドがファゴソームに存在することは、細胞内病原体からの抗原がMHCクラスI分子によって提示されるという、通常ERで行われるまだよく分かっていないプロセスについての説明にもなる (Kleijmeer et al., 2001)。
Brucella属の細菌Anderson and Cheville 1986, Pizarro-Cerdá et al. 1998, Legionella pneumophiliaなどの細胞内病原体は、ERの特徴を示すコンパートメント内に存在する Horwitz 1983, Swanson and Isberg 1995, Tilney et al. 2001. これらの病原体はいずれも、(形態学的観察から)細胞膜由来の小胞を通過して小胞体に入ると考えられているが、リボソームを持たない小胞体が細胞表面での内在化に関与している可能性がある。実際、以前の形態学的観察では、ラテックスビーズを含むファゴソームのERとしての性質は明らかにできなかった(Desjardins et al.、1994a)。我々は、Salmonella typhimurium、Leishmania donovani(野生型およびlpg-mutant)が、ER由来のコンパートメント内に最初に存在することを示した(G-6-Pase細胞化学によって明らかにされる)。これらの病原体は、そのファゴソームの特性を異なる程度に変化させる(Méresseら、1999)。L. donovaniの寄生体は、共通してERに侵入するにもかかわらず、野生型は内在化後数時間は初期ファゴソームに維持されるが、lpg欠損変異体は速やかにファゴリソームに移行する(Scianimanico et al.、1999年)。
したがって、ERを介したファゴサイトーシスがマクロファージにおける一般的な侵入のメカニズムであることを提案する(図7D)。粒子が細胞表面に結合すると、仮足が形成され、伸長して、粒子を細胞膜にしっかりと付着させる。この過程で、ERは細胞表面近くに集められ、そこで細胞膜と融合し、粒子との接触部位で開口する。そして、粒子は開いた小胞体に滑り込み、侵入の最後に細胞質は再封鎖される。これにより、ERを主成分とするファゴソームが形成され、高度に特殊化した細胞内器官を最小にすることができる。新しく形成されたファゴソームは、高度に制御されたプロセスでエンドサイトーシス小器官と急速に相互作用し、ファゴリソソームの生合成を可能にする(Desjardins, 1995)。宿主細胞内での生存を確保するために、病原体はファゴリソソーム生合成の異なる段階でER由来のファゴソームの成熟を阻害し、ファゴリソームの溶菌環境を回避する方法を進化させた。レジオネラ菌やブルセラ菌のような病原体は、まだER由来のコンパートメントにいる、プロセスのごく初期にファゴリソソーム生合成に影響を及ぼすであろうし、サルモネラ菌、マイコバクテリア、リーシュマニアのような他の病原体はファゴソームの成熟開始を許し、後にこのプロセスの完了を阻害するであろう。
好中球では、ラテックスビーズもリーシュマニア寄生虫も、これらの粒子を収容するファゴソームでG-6-Pase活性がないことからわかるように、ERの関与は必要ない(図7B)。好中球では、ファゴリソソームの生合成は、閉鎖していない新生ファゴソームから始まる非常に速いイベントであることが知られている。この過程では、β-グルクロニダーゼなどのリソソーム酵素が細胞外培地に放出されることから(Cougoule et al., 2002)、アズロフィル顆粒が動員されて新生ファゴソームに膜を供給していることが示唆されている。血清でイオン化されたMycobacterium smegmatisとは対照的に、非オプソニン化マイコバクテリアの侵入は細胞表面で酵素を放出せずに行われる(Cougouleら、2002年)。この経路に沿って、最近の研究では、好中球がオプソニン/補体依存的および非依存的にリーシュマニアを取り込む機構を有することが示された(Laufs et al.、2002年)。オプソニン/補体依存的な取り込み機構は、寄生虫を速やかに取り込み死滅させるが、後者の機構は数時間を要し、ファゴソームへの寄生虫の取り込みに至り、長期間にわたって生存させる。好中球は初歩的な小胞体を持っているので、Laufsら(2002)が観察したリーシュマニアの遅いオプソニン/補体非依存性取り込みは、この小器官の新合成を必要とする長い過程の中で行われたのではないかと考えている。興味深いことに、Katz and Hashemi (1982) は、レジオネラはマクロファージのER様コンパートメントで生存・複製する一方、好中球ではERの特徴を示さないコンパートメントで速やかに死滅・分解されることを示している。したがって、ERを介した貪食は、細胞内病原体が宿主細胞内で生き残るための「トロイの木馬」として利用するために進化してきた安全な場所への入り口であるように思われる。
実験方法
細胞培養とファゴソーム単離
好中球は、標準的なプロトコルを用いて犬の血液から分離した(Merhi et al.) 0.8μmまたは3μmのラテックスビーズ(Sigma)を1:10、1:50、または1:200に希釈し、37℃で種々の時間にわたって取り込むことによって形成したファゴソームを、J774マウスマクロファージ(Desjardinsら、1994a)より単離した。ファゴソームはまた、ヒツジ赤血球を30分間内在化することにより形成され(Vieiraら、2001)、または細胞を細胞内寄生虫Leishmania donovaniで30分間、Salmonella Enterica serovar typhimurium Scianimanicoら、1999、Steele-Mortimerら、1999で5分間感染させることにより形成された。マクロファージまたは単離ファゴソーム中のカルネキシンおよびその関連タンパク質の免疫沈降は、タンパク質の細胞質尾部に対して向けられた抗カルネキシンまたは前免疫血清(Ouら、1993)を用いて行われた。
ウェスタンブロット解析のための2-Dゲル電気泳動とSDS-PAGE
ファゴソーム形成とファゴリソソーム生合成の動態解析は、2-Dゲル電気泳動または1-Dゲルでのイムノブロッティングを用いて評価した(Garin et al.、2001)。また、全細胞溶解液、核後上清(900×g遠心分離後に得られた上清)、または全膜調製物(10万×gペレット)と比較して、ファゴソーム上のいくつかのERタンパク質の相対的濃縮度をウェスタンブロットにより評価した。これは、各サンプルから等量のタンパク質(15μg)をSDS-PAGEにロードし、BioRad DC protein assayを使用して測定することによって行われた。使用した抗体は:タンパク質の細胞質尾部の最後の18アミノ酸に対して向けられたポリクローナル抗カルネキシン(Ouら、1993);Sec 61pに対するポリクローナル抗体(Ouら、, 1993);カルレティキュリンに対するポリクローナル抗体(Rokeachら、1991);ラットモノクローナル抗Lamp1(Desjardinsら、1994b);および精製ラット肝ミクロソームに対して上げたポリクローナル抗ER(PaimentとRoy、1988)。
PI3-K阻害剤とバフィロマイシンA1による細胞処理
ER媒介の食作用におけるPI3Kの関与の可能性を試験するために、細胞を、記載されているように10mMの3-メチルアデニン(3-mA)(Sigma)(Seglen and Gordon、1982)、200μM Ly294002および100nM wortmanninとともに60分間プレインキュベートした。その後、ラテックスビーズを60分間内在化させ、その後、薬剤の連続存在下、培養液中で30分間インキュベートした。ファゴソーム-ER相互作用における液胞プロトンポンプATPaseの関与の可能性は、以下のように検証した。ラテックスビーズを30分間内在化させ、その後30分間追跡してファゴソームを形成させた。次に、細胞を培養液に加えたBSA-金16nmに15分間内在化させ、その後30分間インキュベートして、BSA-金を初期エンドソームからファゴソームに移動させた(Desjardinsら、1997)。最後に、細胞をバフィロマイシンA1(0.5μM;カミヤ)を含む、または含まない培地で60分間インキュベートし、EM用に準備した。
免疫蛍光法およびEM
免疫蛍光法および共焦点顕微鏡法は、以前に記載したように行った Scianimanicoら1999、Dermineら2001。免疫蛍光のために、30′/0ファゴソームを単離し、抗細胞質尾抗体を用いてカルネキシンの存在を明らかにした。共焦点顕微鏡では、冷培地に加えた3μmラテックスビーズを57×gで3分間、細胞上に遠心分離した。その後、細胞を4℃で30分間インキュベートし、その後37℃で10分間インキュベートして、貪食カップの形成を可能にした。抗カルネキシン(細胞質または管腔ドメイン)および抗LAMP1(細胞質ドメイン;Méresseら、1997)を使用して、これらのタンパク質の存在を評価した。カルネキシンおよびLAMP1の包埋前免疫局在化は、単離ファゴソーム上で行われた(Lavoieら、2000)。いくつかの実験では、カルネキシン抗体の特異性を試験するために、前述(Paiement and Bergeron, 1983)のように単離した粗ミクロソーム(60μgタンパク質)を陽性対照としてファゴソーム調製物に添加した。グルコース-6-ホスファターゼ(G-6-P)活性は、EM細胞化学(Griffithsら、1983)を用いて明らかにした。
補足データ
ダウンロード: 画像ダウンロード(56KB)
図S1. ファゴソームにはカルネキシンの基質が存在する
(A) ラテックスビーズを30分間内挿し、最後の5分間で500μCiの標識メチオニンを5mlの培養液に添加した。マクロファージ細胞溶解液(M)またはファゴソーム(P)中に存在する全標識タンパク質を分析した(Total)。オルガネラを分離することによって得られる濃縮から予想されるように、タンパク質のパターンは2つのサンプル間で著しく異なっている。細胞溶解液またはファゴソーム調製液から行った抗カルネキシン抗体による免疫沈降(IP cnx)では、マクロファージ(M)とファゴソーム(P)に同様の放射性標識タンパク質が存在し、マクロファージのERでカルネキシンに結合する基質がファゴソームにも存在することが示された。アスタリスクはカルネキシンを示す。
(B) カルネキシン抗体の特異性の証明。免疫前血清(pre-imm.)を用い、HepG2細胞またはJ774マクロファージの全細胞溶解液から免疫沈降を行ったところ、主要なバンドは検出されなかった。一方、DMSOで処理した後、あるいは処理しない場合(Control)には、抗カルネキシンを用いた免疫沈降により、いくつかのカルネキシンの基質が検出された。これらの関連タンパク質は、糖鎖形成阻害剤であるツニカマイシン(Tunicamycin.)で処理した細胞からはそのほとんどが共沈しないことから、糖タンパク質であることが示された(TunicamycinはDMSOで希釈してある)。アスタリスクはカルネキシンを示す。
(C) ホスホカルネキシンはファゴソーム中に存在する。標識オルトリン酸で標識した細胞から2つの異なる時点(パルス/チェイス)で分離した全細胞溶解液(TCL)またはファゴソーム(Phago)からの免疫沈降により、どちらのサンプルにもホスホカルネキシンが存在することがわかった(P-Calnexin、曝露=60 hr)。また、免疫沈降後のウェスタンブロットを示す(α-カルネキシン)。
謝辞
Hojatollah Vali博士、J. Mui、Elizabeth Fischer、François St-Louisには、EMを手伝っていただき、感謝いたします。好中球の調製にはJean-Gilles Latour博士とClaudette Léger-Gauthier博士に、LAMP1の細胞質ドメインに対する抗体の提供にはStéphane Méresse博士に、calreticulinに対する抗体にはLuis Rokeach博士に、抗 Sec61p抗体にはChris Nicchitta博士に、それぞれ感謝する。Clarissa Desjardins博士とRoger Lippé博士の有益なコメントに感謝する。この研究は、CIHRからJ.J.M.BへのMT-5605、M.DへのG-15526およびMOP-12951の助成金によって支援された。また、Genome QuebecとGenome Canadaの支援に感謝する。
参考文献
AderemとUnderhill 1999
A. Aderem, D.M. Underhill(アデレム、アンダーヒル
マクロファージにおける貪食のメカニズム
Annu. Rev. Immunol., 17 (1999), pp.593-623
PDFを見るCrossRef記録を見る in ScopusGoogle Scholar
アンダーソンとチェビル1986
T.D. Anderson、N.F. Cheville
実験的胎盤炎におけるBrucella abortus感染絨毛膜細胞の超微細構造形態学的解析。細菌の複製は粗面小胞体で起こる
Am. J. Pathol., 124 (1986), pp.226-237
ScopusGoogle Scholarで記録を見る
ビダニとヘミング 1995
A. ビダニ、T.A.ヘミング
LPS活性化肺胞マクロファージの機能的能力に対するbafilomycin A1の効果
J. Leukoc. Biol., 57 (1995), pp.275-281.
CrossRefView レコードをScopusGoogle Scholarで見る
Blommaartら、1997年
E.F. Blommaart、U. Krause、J.P. Schellens、H. Vreeling-Sindelarova、A.J. Meijer
ホスファチジルイノシトール3キナーゼ阻害剤wortmanninとLY294002はラット単離肝細胞のオートファジーを阻害する。
Eur. J. Biochem., 243 (1997), pp.240-246.
Google Scholar
ボテリョら、2000
R.J. Botelho、M. Teruel、R. Dierckman、R. Anderson、A. Wells、J.D. York、T. Meyer、S. Grinstein
食作用部位におけるホスファチジルイノシトール-4,5-ビスリン酸の局所的な二相性変化
J. セルバイオロジー, 151 (2000), pp.1353-1368
Google Scholar
キャノンとスワンソン 1992
G.J. Cannon、J.A. Swanson
マクロファージの貪食能について
J. Cell Sci., 101 (1992), pp.907-913
CrossRefView Record in ScopusGoogle Scholar
キャロンとホール 1998
E. Caron, A. Hall
異なるRho GTPasesによって制御される2つの異なる食作用のメカニズムの同定
Science, 282 (1998), pp.1717-1721
ScopusGoogle Scholarで記録を見る
Cougouleら、2002
C. Cougoule, P. Constant, G. Etienne, M. Daffe, I. Maridonneau-Parini (Cougoule、P. Constant、G. Etienne、M. Daffe、I. マリドノー=パリニ
ヒト好中球によるMycobacterium smegmatisの貪食過程におけるアズロフィル顆粒とファゴソームの融合の欠如は、細菌によって積極的に制御されているのではない
Infect. Immun., 70 (2002), pp.1591-1598
ScopusGoogle Scholarで記録を見る
Coxら、1999
D. Cox, C.C. Tseng, G. Bjekic, S. Greenberg(コックス、C.C.ツェン、G.ビジェック、S.グリーンバーグ
仮足伸長におけるホスファチジルイノシトール3-キナーゼの必要性
J. Biol. Chem., 274 (1999), pp.1240-1247
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
Dermineら、2001
J.F. Dermine, S. Duclos, J. Garin, F. St-Louis, S. Rea, R.G. Parton, M. Desjardins (以下、Dermineと略す。
成熟ファゴソーム上に蓄積するフロティリン-1に富む脂質ラフトドメイン
J. Biol. Chem., 276 (2001), pp.18507-18512
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
Desjardinsら、1994a
M. デジャルダン、L.A.フーバー、R.G.パートン、G.グリフィス
ファゴリソソームの生合成は、エンドサイトーシス装置との連続した一連の相互作用を通して進行する
J. Cell Biol., 124 (1994), pp.677-688.
a
ScopusGoogle Scholarで記録を見る
Desjardinsら、1994b
M. Desjardins、J.E. Celis、G. van Meer、H. Dieplinger、A. Jahraus、G. Griffiths、L.A. Huber
ファゴソームの分子的特徴づけ
J. Biol. Chem., 269 (1994), pp.32194-32200
b
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
デジャルダン 1995
M. デジャルダン
ファゴリソソームの生合成:「キスアンドラン」仮説
トレンド・セル・バイオロジー, 5 (1995), pp.183-186
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
デジャルダンら、1997
M. デジャルダン、N.N.Nzala、R.Corsini、C.Rondeau
ファゴソームの成熟は、その融合特性の変化とエンドソームからの溶質物質のサイズ選択的取得を伴う
J. Cell Sci., 110 (1997), pp.2303-2314
CrossRefView Record in ScopusGoogle Scholar
Diakonovaら、2002
M. Diakonova, G. Bokoch, J.A. Swanson(ディアコノバ、G. ボコッチ、J.A. スワンソン
マクロファージにおけるFcγ受容体を介した貪食過程での細胞骨格タンパク質のダイナミクス
Mol. Biol. 細胞, 13 (2002), pp.402-411
ScopusGoogle Scholarで記録を見る
Duclosら、2000
S. Duclos, R. Diez, J. Garin, B. Papadopoulou, A. Descoteaux, H. Stenmark, M. Desjardins (Duclos, R. Diez, J. Garin, B. Papadopoulou, A. Descoteaux, H. Stenmark, M. Desjardins
Rab5はRAW264.7マクロファージにおけるファゴソームとエンドソームのキスアンドラン融合とファゴソームのリーシュマニア性獲得とを制御している
J. Cell Sci., 113 (2000), pp.3531-3541
CrossRefView Record in ScopusGoogle Scholar
ガリンら、2001
J. Garin, R. Diez, S. Kieffer, J.F. Dermine, S. Duclos, E. Gagnon, R. Sadoul, C. Rondeau, M. Desjardins, (以下「Garin」)。
ファゴソームプロテオーム:ファゴソーム機能への洞察
J. セルバイオロジー, 152 (2001), pp.165-180
ScopusGoogle Scholarで記録を見る
ゴールドら、2000年
E.S. Gold、N.S. Morrissette、D.M. Underhill、J. Guo、M. Bassetti、A. Aderem
新規のアンフィフィシンIIアイソフォームであるアンフィフィシンIImはマクロファージの貪食に必要である
免疫, 12 (2000), pp.285-292
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
グリフィスら、1983
G. Griffiths, P. Quinn, G. Warren(グリフィス、クイン、ウォレン
ゴルジ体複合体の解離。セムリキ森林ウイルスを感染させたベビーハムスター腎細胞において、モネンシンによる内側ゴルジ体から外側ゴルジ体へのウイルス膜タンパク質の輸送を阻害する。
J. Cell Biol., 96 (1983), pp.835-850.
ScopusGoogle Scholarで記録を見る
Hackamら、1998
D.J. Hackam, O.D. Rotstein, C. Sjolin, A.D. Schreiber, W.S. Trimble, S. Grinstein.
v-SNARE依存的な分泌は食作用に必要である
Proc. Natl. Acad. Sci. USA, 95 (1998), pp.11691-11696
ScopusGoogle Scholarで記録を見る
ハイネとシュナイトマン1971
J.W. Heine, C.A. Schnaitman
動物細胞の細胞膜の分離方法について
J. Cell Biol., 48 (1971), pp.703-707.
ScopusGoogle Scholarで記録を見る
Horwitz 1983
M.A. Horwitz
ヒト単球におけるLegionnaires病菌Legionella pneumophiliaによる新規ファゴソームの形成
J. Exp. Med., 158 (1983), pp.1319-1331
ScopusGoogle Scholarで記録を見る
Jahrausら、1998
A. ヤーラス、T.E.ティエル、T.ベルク、A.ハーバーマン、B.ストリー、O.ウルリッヒ、G.グリフィス
J774マクロファージ由来ファゴソームと異なるエンドサイトーシス小器官のin vitro融合
J. Biol. Chem., 273 (1998), pp.30379-30390
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
ジョンソンら、2001
S. ジョンソン、ミシャラク、オパス、エッグルトン、P.
カレティキュリンの内と外:ER内腔から細胞外腔へ
トレンド・セル・バイオロジー, 11 (2001), pp.122-129
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
柿村ら、2001
J. 柿村、北村、谷口、下濱、P.J. Gebicke-Haerter
Bip/GRP78によるミクログリアでのサイトカイン産生とアミロイドβ(1-42)ペプチドの取り込みの誘発
Biochem. Biophys. 共著, 281 (2001), pp.6-10
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
カッツとハシェミ 1982
S.M. カッツ、S. ハシェミ
モルモットにおけるLegionella pneumophilaに対する炎症反応の電子顕微鏡的検査
Lab. Invest., 46 (1982), pp.24-32
ScopusGoogle Scholarで記録を見る
Kleijmeerら、2001年
M.J. Kleijmeer, J.M. Escola, F.G. UytdeHaag, E. Jakobson, J.M. Griffith, A.D. Osterhaus, W. Stoorvogel, C.J. Melief, C. Rabouille, H.J. Geuze.
エンドサイトーシス管におけるMHCクラスI分子の抗原ローディング
トラフィック, 2 (2001), pp.124-137
ScopusGoogle Scholarで記録を見る
Lafontら, 1999
F. Lafont、P. Verkade、T. Galli、C. Wimmer、D. Louvard、K. Simons
Madin-Darby canine kidney細胞におけるアピカルトラフィッキングに作用するSNAPレセプターのラフトアソシエーション
Proc. Natl. Acad. Sci. USA, 9 (1999), pp.3734-3738
ScopusGoogle Scholarで記録を見る
ラウズと同僚たち 2002
H. Laufs, K. Muller, J. Fleischer, N. Reiling, N. Jahnke, J.C. Jensenius, W. Solbach, T. Laskay
好中性顆粒球に取り込まれたLeishmania majorの熱分解性血清因子非存在下での細胞内生存率
Infect. Immun., 70 (2002), pp.826-835
ScopusGoogle Scholarで記録を見る
Lavoieら、2000
C. Lavoie, E. Chevet, L. Roy, N.K. Tonks, A. Fazel, B.I. Posner, J. Paiement, J.J. Bergeron
p97のチロシンリン酸化はin vitroでの移行小胞体集合を制御する
Proc. Natl. Acad. Sci. USA, 97 (2000), pp.13637-13642
ScopusGoogle Scholarで記録を見る
Massolら、1998
P. Massol, P. Montcourrier, J.C. Guillemot, P. Chavrier (マソール、P. モンクリエ、J.C. ギルモット、P. シャブリエ
Fcレセプターを介した食作用にはCDC42とRac1が必要である
EMBO J., 17 (1998), pp.6219-6229
ScopusGoogle Scholarで記録を見る
メイとマチェスキー 2001
R.C. メイ、L.M. マチェスキー
ファゴサイトーシスとアクチン細胞骨格
J. Cell Sci., 114 (2001), pp.1061-1077.
CrossRefView Record in ScopusGoogle Scholar
Méresseら、1997
S. Méresse、P. André、Z. Mishal、M. Barad、N. Brun、M. Desjardins、J. P. Gorvel
後期エンドソームのrab7含有コンパートメントのフローサイトメトリーソーティングと生化学的特性評価
電気泳動, 18 (1997), pp.2682-2688
CrossRefView Record in ScopusGoogle Scholar
Méresseら, 1999
S. Méresse, O. Steele-Mortimer, E. Moreno, M. Desjardins, B.B. Finlay, J.P. Gorvel
病原体を含む液胞の成熟を制御する:生死を分ける問題
Nat. セルバイオロジー, 1 (1999), pp.E183-E188
Google Scholar
メルヒら、1999
Y. Merhi、P. Provost、P. Chauvet、J.F. Theoret、M.L. Phillips、J.G. Latour
セレクチン遮断は、ブタの血管形成術による深部動脈損傷部位での好中球と血小板の相互作用を減少させる。
Arterioscler. Thromb. Vasc. Biol., 2 (1999), pp.372-377.
ScopusGoogle Scholarで記録を見る
Müller-Taubenbergerら、2001年
A. Müller-Taubenberger、A.N. Lupas、H. Li、M. Ecke、E. Simmeth、G. Gerisch
小胞体のカルレティキュリンとカルネキシンは貪食に重要である
EMBO J., 20 (2001), pp.6772-6782
ScopusGoogle Scholarで記録を見る
オグデンら、2001
C.A. Ogden, A. deCathelineau, P.R. Hoffmann, D. Bratton, B. Ghebrehiwet, V.A. Fadok, P.M. Henson(オグデン、ドカテリノー、P.R.ホフマン、ブラットン、B.
C1qとマンノース結合レクチンが細胞表面のカルレティキュリンとCD91に結合すると、マクロピノサイトーシスとアポトーシス細胞の取り込みが開始される
J. Exp. Med., 194 (2001), pp.781-795
ScopusGoogle Scholarで記録を見る
岡崎ら、2000
Y. 岡崎陽一、大野宏樹、高瀬和彦、落合徹、斉藤忠夫
小胞体における分子シャペロン、カルネキシンの細胞表面での発現
J. Biol. Chem., 275 (2000), pp.35751-35758
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
オラフソンら、1990
R.W. Olafson, J.R. Thomas, M.A. Ferguson, R.A. Dwek, M. Chaudhuri, K.P. Chang, T.W. Rademacher.
Leishmania mexicana amazonensisの主要な表面糖タンパク質であるGp63のN-結合型オリゴ糖の構造
J. Biol. Chem., 265 (1990), pp.12240-12247
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
Ouら、1993
W.J. Ou, P.H. Cameron, D.Y. Thomas, J.J. Bergeron(オウ、キャメロン、トーマス、J.J.ベルジュロン
タンパク質の成熟過程における糖タンパク質の折り畳み中間体とカルネキシンの会合
ネイチャー, 364 (1993), pp.771-776
ScopusGoogle Scholarで記録を見る
PaiementとBergeron 1983
J. Paiement, J.J. Bergeron
GTP刺激によるコアグリコシル化の融合ミクロソームへの局在化
J. Cell Biol., 96 (1983), pp.1791-1796.
ScopusGoogle Scholarで記録を見る
PaiementとRoy 1988
J. Paiement, L. Roy
免疫細胞化学のための固定剤選択の補助としての電気泳動タンパク質ブロット
J. Histochem. 細胞化学, 36 (1988), pp.441-446
CrossRefView レコードをScopusGoogle Scholarで見る
ピータースら(Peters et al.
C. Peters, M.J. Bayer, S. Buhler, J.S. Andersen, M. Mann, A. Mayer
膜融合の最終段階におけるプロテオ脂質チャネルによるトランスコンプレックス形成
Nature, 409 (2001), pp.581-588
ScopusGoogle Scholarで記録を見る
Pittら、1992
A. Pitt, L.S. Mayorga, P.D. Stahl, A.L. Schwartz (英語)
成熟ファゴソームのタンパク質組成における変化
J. Clin. Invest., 90 (1992), pp.1978-1983
CrossRefView Record in ScopusGoogle Scholar
Pizarro-Cerdáら, 1998
J. Pizarro-Cerdá、S. Méresse、R.G. Parton、F.G. van der Goot、A. Sola-Landa、 I. Lopez-Goni、 E. Moreno、J.P. Gorvel
Brucella abortusはオートファジー経路を通過し、非専門家食細胞の小胞体で複製される
Infect. Immun., 66 (1998), pp.5711-5724
CrossRefView Record in ScopusGoogle Scholar
Rokeachら、1991
L.A. Rokeach、J.A. Haselby、S.O. Hoch
ヒト・カレティキュリンの高レベル細菌発現、精製および特性評価
プロテイン・エンジニアリング, 4 (1991), pp.981-987
CrossRefView レコードをScopusGoogle Scholarで見る
Scianimanicoら、1999
S. Scianimanico, M. Desrosiers, J.F. Dermine, S. Méresse, A. Descoteaux, M. Desjardins.
Leishmania donovani promastigotesによるファゴソーム成熟の阻害と低分子量GTPaseであるrab7の動員阻害は相関している
Cell. Microbiol., 1 (1999), pp.19-32
ScopusGoogle Scholarで記録を見る
セグレンとゴードン 1982
P.O. Seglen、P.B. Gordon
3-メチルアデニン:ラット単離肝細胞における自食作用/リソソームタンパク質分解の特異的阻害剤
Proc. Natl. Acad. Sci. USA, 79 (1982), pp.1889-1892
CrossRefView レコードをScopusGoogle Scholarで見る
Steele-Mortimerら、1999年
O. Steele-Mortimer、S. Meresse、J.P. Gorvel、B.H. Toh、B.B. Finlay
上皮細胞におけるSalmonella typhimurium含有空胞の生合成には、初期エンドサイトーシス経路との相互作用が関与する
Cell. Microbiol., 1 (1999), pp.33-49
ScopusGoogle Scholarで記録を見る
SwansonおよびIsberg 1995
M.S. Swanson、R.R. Isberg
Legionella pneumophiliaとマクロファージ小胞体との関連性
Infect. Immun., 63 (1995), pp.3609-3620
CrossRefView Record in ScopusGoogle Scholar
Tardieuxら、1992
I. Tardieux, P. Webster, J. Ravesloot, W. Boron, J.A. Lunn, J.E. Heuser, N.W. Andrews.
ライソゾームの動員および融合はトリパノソームの哺乳類細胞への侵入に必要な初期イベントである
細胞, 71 (1992), pp.1117-1130
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
ティルニーら、2001
L.G. Tilney、O.S. Harb、P.S. Connelly、C.G. Robinson、C.R. Roy
寄生性細菌Legionella pneumophilaはどのようにファゴソームを改変し、粗面小胞体へと変化させるのか:細胞膜から小胞体膜への変換の意味するところ
J. Cell Sci., 114 (2001), pp.4637-4650
CrossRefView Record in ScopusGoogle Scholar
ビッカー 1977
M.G.ビッカー
食細胞膜の起源について
Exp. 細胞研究, 109 (1977), pp.127-138
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
ヴィエイラら、2001
O.V. Vieira, R.J. Botelho, L. Rameh, S.M. Brachmann, T. Matsuo, H.W. Davidson, A. Schreiber, J.M. Backer, L.C. Cantley, S. Grinstein.
ファゴソームの形成と成熟におけるクラスIおよびクラスIIIホスファチジルイノシトール3-キナーゼの異なる役割
J. セルバイオロジー, 155 (2001), pp.19-25
ScopusGoogle Scholarで記録を見る
Whatmoreら, 1999
J. Whatmore、C. Wiedemann、P. Somerharju、P. Swigart、S. Cockcroft
ホスホリパーゼCβ活性化後の透過性好中球におけるホスファチジルイノシトールの再合成:ホスファチジルイノシトール再合成のための中間体ホスファチジン酸の細胞膜から小胞体への輸送は、可溶性脂質キャリアまたは小胞輸送に依存しない
Biochem. J., 341 (1999), pp.435-444
ScopusGoogle Scholarで記録を見る
ザプーンら、1999
A. ザプン、C.A.ヤコブ、D.Y.トーマス、J.J.ベルジュロン
特殊な区画におけるタンパク質の折り畳み:小胞体
構造. Fold. Des., 7 (1999), pp.R173-R182
記事ダウンロードPDF表示ScopusGoogle Scholarの記録
引用元: (564)
ファゴリソソームのリモデリングによるカンジダ・アルビカンスのマクロファージ内封じ込め
2022, トレンド・イン・マイクロバイオロジー
抄録を表示
TAPとその抗原提示および交差提示における重要な役割にスポットライトを当てる
2022年、分子免疫学
アブストラクトを表示
日本学術振興会特別研究員(PD)、日本学術振興会特別研究員(PD)、日本学術振興会特別研究員(PD)、日本学士院会員
2022, 計算構造生物学ジャーナル
要約を表示
食作用におけるユビキチンプロテアソーム経路の多機能な役割
2022, プログレス・イン・モレキュラー・バイオロジー・アンド・トランスレーショナル・サイエンス
アブストラクトを表示
マクロファージにおけるファゴソーム成熟化。食べて、消化し、適応し、繰り返す
2021, 生物学的制御の進歩
要約を表示する
定量的プロテオーム解析により、in vitroにおける象牙殻Babylonia areolataのヒアリン細胞および顆粒球の貪食殺生に関する知見を得ることができた
2021, 水産養殖
この記事が気に入ったらサポートをしてみませんか?
