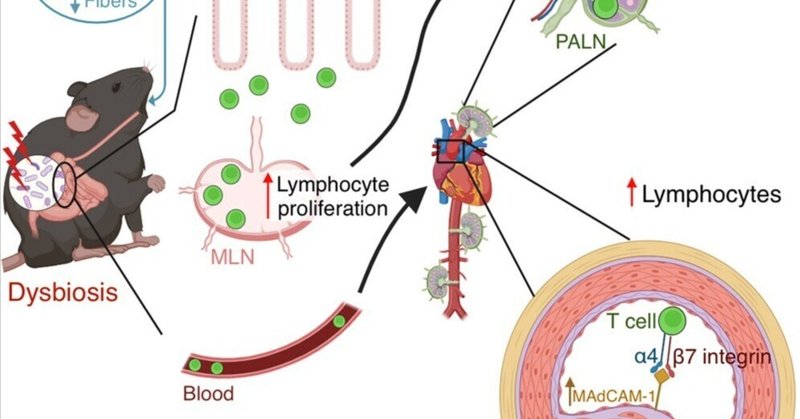
肥満促進食は、腸内細菌叢異常による腸管リンパ球の末梢への輸送を促進し、アテローム性動脈硬化症を増加させる
メインコンテンツへスキップ
セル・レポート
ログイン
検索...
論文|42巻11号113350号2023年11月28日
肥満促進食は、腸内細菌叢異常による腸管リンパ球の末梢への輸送を促進し、アテローム性動脈硬化症を増加させる
https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01362-1?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS2211124723013621%3Fshowall%3Dtrue
Ludivine Laurans
ニルマラ・モウトゥリンガム 14
Mouna Chajadine 14
ローレンス・ジトヴォーゲル
ハリー・ソコル
ソラヤ・タレブ 15
すべての著者を表示
脚注を表示オープンアクセス掲載:2023年10月31日DOI:https://doi.org/10.1016/j.celrep.2023.113350
ハイライト
HFDと高コレステロール食は微生物叢組成に異なる影響を与える
HFDまたはLF食を与えたマウスからの糞便微生物叢移行はアテローム性動脈硬化症を悪化させる
HFD型またはLF型の微生物叢はMLNにおける腸管リンパ球の増殖を促進する
HFDまたはLF型微生物叢は腸リンパ球を介してアテローム性動脈硬化症を悪化させる
要旨
高脂肪食(HFD)誘発性の腸内細菌叢異常症は動脈硬化に影響を及ぼすことが知られているが、その基礎となるメカニズムはまだ十分に解明されていない。ここでは、アテローム性動脈硬化症の進行は、高コレステロール(HC)食ではなくHFD食によって形成された腸内細菌叢に依存し、特に低繊維(LF)摂取に依存することを示す。メカニズム的には、HFDまたはLFによって誘導された腸内細菌叢異常の影響を受けた腸リンパ球は、腸間膜リンパ節(MLN)で非常に増殖し、MLNから末梢に移動する。これは、プラーク内での粘膜アドレスリン細胞接着分子1(MAdCAM-1)の誘導と、β7インテグリンを発現する腸管向性リンパ球の存在と関連している。MLNの切除やリンパ球の欠乏は、LFによって形成された微生物叢の動脈硬化促進作用を消失させる。我々の研究は、食餌によって形成された微生物叢、腸管免疫細胞、およびアテローム性動脈硬化症の間の病理学的関連を示しており、食餌によって調節された微生物叢が、アテローム性動脈硬化症を予防するための適切な治療標的となる可能性を示唆している。
図解抄録
図サムネイルfx1
大きな画像を見るダウンロード 高解像度画像
キーワード
高脂肪食
低食物繊維
微生物叢
アテローム性動脈硬化症
研究テーマ
CP: 代謝
CP: 免疫学
はじめに
肥満とメタボリックシンドロームの有病率は急増しており、心血管疾患(CVDs)の継続的な増加に寄与している。動脈硬化を抑制するためにコレステロール低下治療が行われているにもかかわらず、CVDは依然として世界最大の死因となっている。従って、欧米型の食事が引き起こす代謝性疾患がCVDにどのような影響を与えるかを理解することが最も重要である。
肥満患者の大多数が有害な代謝性合併症とそれに伴う動脈硬化に罹患する一方で、「代謝的に健康な肥満」のままである患者もいるが、それでも正常体重で代謝的に健康な患者よりもCVDリスクは高い1。この感受性は主に食事などの環境因子と関連している。最近では、腸内細菌叢が健康と疾病における役割を明らかにするために、広範な研究の対象となっている。腸内細菌叢は、食物の代謝と、短鎖脂肪酸(SCFA)や二次胆汁酸を含む無数の必須化合物の産生に関与している。腸内細菌叢は、病原体に対する直接的な防御や宿主を介した防御に大きな役割を果たしている2,3。
食事は、宿主への直接的な影響および/または腸内細菌叢の形成による間接的な影響を介して、CVDを引き起こすことが知られている4。これと一致して、炎症性腸疾患(IBD)のような腸内細菌叢異常症に関連する疾患に罹患している被験者は、アテローム血栓性合併症のリスク上昇を示す5。
動脈硬化を促進するトリメチルアミンN-オキシド(TMAO)の役割が発見されたことで、食事組成と腸内細菌叢由来の代謝産物との相互作用が浮き彫りになった6。しかし、HFDによる腸内細菌叢の変化がアテローム性動脈硬化症にどのような役割を果たすのかについては、まだよくわかっていない。ここでは、HFDによって形成された腸内細菌叢がアテローム性動脈硬化症に影響を及ぼすメカニズムを調べた。
結果
高脂肪食と高コレステロール食は腸内細菌叢のホメオスタシスに異なる影響を与える
低比重リポ蛋白質受容体ノックアウト(ldlr-/-)マウスはヒトに似たリポ蛋白質プロファイルを示し、食事誘発性動脈硬化症の実験モデルとして広く用いられている。食餌が腸内細菌叢に及ぼす影響を調べるため、ldlr-/-マウスを16週間、西洋型食餌に代表されるチャウ食(CD)、HC食、HFD、およびHFD+HC食の組み合わせに供した(図S1A)。予想通り、HFDまたはHFD+HC食を与えたマウスは、CDまたはHC食を与えた群に比べ、体重増加だけでなく、経口ブドウ糖負荷試験(OGTT)およびインスリン感受性試験(ITT)で評価した高血糖およびインスリン抵抗性、ならびに高いインスリン抵抗性指数(インスリン抵抗性の恒常性モデル評価、HOMA-IR)を示した(図S1B-S1E)。図S1Fに示すように、肝重量とトリグリセリド含量は、HFD-およびHC食を与えたldlr-/-マウスで有意に増加し、HFD+HC食を与えたldlr-/-マウスではCDを与えたマウスに比べてさらに増加したことから、HFD食とHC食は肝脂肪症の誘発において相加的な効果を持つことが示された。血漿中リポ多糖(LPS)濃度の増加は、おそらく腸管透過性の亢進が原因であり、肥満において報告されている9。我々は、HFD-およびHC食を与えたマウスで血漿中LPS濃度の増加を観察したが、HFD+HC食を与えたldlr-/-マウスで最も高かった(図S1G)。
宿主と微生物の相互作用は健康状態および疾患状態において重要である。我々は16S rDNA配列決定法を用いて、4群の糞便中の微生物叢の細菌組成を分析した。β多様性解析の結果、CD食、HC食、HFD食、HFD+HC食を与えたldlr-/-マウスの間に大きな違いがあることが明らかになった(図1A)。興味深いことに、HFD(HCの有無にかかわらず)を与えたマウスの群間の平均距離は、他の群間の距離よりもはるかに小さく(p = 0.036)、微生物叢プロフィールに対するHFDの支配的な効果を示していた(図1A)。驚くべきことに、HC食ではなくHFD食は、観察値とシャノン指数で評価した細菌の生物多様性の減少に大きな影響を及ぼした(図1B)。図1Cに示すように、門レベルでは、HFD(HCの有無にかかわらず)を与えたマウス群では細菌プロファイルが類似しており、腸内細菌叢の形成においてHC食よりもHFDが支配的な効果を持つことがさらに強調された。HC飼料を与えたマウスと比較してHFD+HC飼料を与えたマウスでより豊富であったプロテオバクテリアのうち、HFD誘発性の腸管免疫応答の変化に関与していることが以前に示された10であるDesulfovibrioが増加していた(図S2A)。
図サムネイルgr1
図1HC食ではなくHFD食が腸のホメオスタシスに有害な役割を果たす
キャプション
大きな画像を見るダウンロード 高解像度画像
酢酸および酪酸などのSCFAは、嫌気性腸内細菌叢による食物繊維の発酵の最終産物であり、健康に複数の有益な効果を及ぼすことが示されている11。HC食を与えたマウスではなく、HFD(HCありまたはなし)を与えたLdlr-/-マウスは、CDを与えたマウスと比較して糞便中の酢酸および酪酸レベルが有意に減少しており(図1D)、HC食ではなくHFDがSCFAレベルを低下させたことを示している。
インターロイキン-22(IL-22)は、特に再生膵島由来3β(Reg3β)およびReg3γを含む抗菌ペプチド12をコードする遺伝子の誘導を通じて、腸における粘膜恒常性の重要な調節因子および宿主防御のメディエーターとして浮上してきた。図1Eに示すように、HFDまたはHFD+HC食を与えたldlr-/-マウスでは、CDまたはHC食を与えたマウスと比較して、パイエル板(PP)におけるIL-22タンパク質の有意な減少が観察された。これと一致して、HFD食またはHFD+HC食を与えたldlr-/-マウスの腸では、CD食またはHC食を与えたldlr-/-マウスと比較して、IL-22標的遺伝子であるReg3βおよびReg3γのmRNA発現が低下していることも見いだされた(図1F)。これらの結果と一致して、腸管免疫遺伝子発現、特に防御反応(Gene Ontologyカテゴリー)に属する遺伝子発現は、HFD(HFDおよびHFD+HC食)給餌条件下ではCD給餌条件下と比較して減少した(図S2BおよびS2C)。このことは、HFDが腸管免疫防御、特にIL-22依存性のものをダウンレギュレートしていることを示している。
胆汁酸変換は、宿主の代謝に大きな影響を及ぼす腸内細菌叢のもう一つの重要な代謝機能である13。胆汁酸は肝臓で合成され、胆嚢に貯蔵されたコレステロール由来の化合物であり、一次胆汁酸(BA)の形で腸に排出され、そこで微生物叢によって二次BAに変換される。図S3Aに示すように、一次/二次胆汁酸比の増加は、HFD摂食条件下で観察され、HFD+HC食を与えたldlr-/-マウスではより顕著であった。このことは、HFDによって誘導された腸内細菌叢機能の変化が、一次胆汁酸の二次胆汁酸への変換を妨げている可能性をさらに示唆している。図S3Bに示すように、BAレベルと細菌の間に有意な相関が観察された。特に、一次BA(ムリコール酸b[MCA-b]など)とClostridiaのいくつかのメンバー(Christensenellaceae R-7グループ、Eubacterium ventriosumグループ、ファミリーXIII UCG-001、Clostridiales vadin BB60グループなど)との間には負の相関が観察された。逆に、クロストリジウムのメンバーと二次的なBA(リトコール酸[LCA]やムリコール酸w[MCA-w]など)との間には正の相関が見られた。
これらの結果を総合すると、HFD食とHC食は、腸内細菌叢のホメオスタシスおよび微生物叢由来の代謝産物に異なる影響を与えることが示された。
HFDによって形成された腸内細菌叢は動脈硬化を促進する
以前の研究で、離乳前に抗生物質(ATB)を用いて腸内細菌叢を枯渇させると、病理学的な細菌叢の変化が起こり、後年、大腸炎、アレルギー性炎症、がんに対する感受性が高まることが示された。この目的のために、3週齢の離乳までATBを使用し、その後20週間西洋型HFD+HC食に供した成体マウスの代謝パラメーターとアテローム性動脈硬化症を調べた(図S4A)。図S4Bに示されるように、ATBに前曝露したマウスは、成体期にHFD+HC食を与えた場合、非処置マウスに比べて体重増加が有意に少なかった。しかし、体重増加の減少にもかかわらず、OGTT、ITT、HOMA-IR、および血漿コレステロール値に有意差は観察されなかった(図S4C〜S4F)。HFD+HC食20週後のβ多様性解析では、離乳前のATB投与マウスと非投与マウスの腸内細菌叢に大きな違いが見られた(図S5A)。観察された種の数で評価される微生物の豊富さは、ATBsに曝露前のマウスではコントロールと比較して減少する傾向があったが、グループ間のシャノン多様性指数には変化がなかった(図S5B)。微生物組成には2群間で有意差が認められた(図S5C)。ATBに前曝露したマウスでは、未曝露マウスと比較して、オイルレッドO陽性面積で評価した大動脈洞のアテローム性動脈硬化病変における脂質面積の増加が認められた(図S5D)。大動脈洞プラーク中のマクロファージの割合(MOMA-2染色/プラーク表面)は、ATBを前投与したマウスでは未投与のマウスに比べて有意に増加した(図S5E)。また、病変部内のTリンパ球の集積(CD3染色/プラーク表面)は、無処置マウスと比較して、ATBに前曝露したマウスで有意に増加した(図S5F)。これらのデータは、HFD+HC食を与えたマウスでは、病的な腸内細菌叢の刷り込みが成体期の動脈硬化を促進することを示している。
HFDによって誘発された腸内細菌叢の変化がアテローム性動脈硬化症に及ぼす因果関係を明らかにするために、糞便微生物叢移植(FMT)実験を行った。CD食、HC食、HFD食、またはHFD+HC食を与えたldlr-/-マウスから得た糞便を、最後の6週間は同じHFD+HC食を与えたldlr-/-レシピエントマウスに、週3回、19週間経口投与で移植した(図2A)。HFD(HCの有無にかかわらず)によって形成された微生物叢は、HFD+HC食を6週間与えたldlr-/-レシピエントマウスの体重曲線に有意な影響を与えなかった(図S6A)。鼠径部白色脂肪組織(WAT)および精巣上体WATの重量は、CDまたはHC食と比較して、HFD(HCありまたはなし)によって形成された微生物叢を投与されたldlr-/-レシピエントマウスでわずかに増加した(図S6B)。さらに、OGTTおよびITTのような代謝パラメータには、群間で有意な変化は観察されなかった(図S6C)。このことは、レシピエントマウスに短期間(6週間)HFDを与えたことと一致しており、これは代謝変化を誘導するには不十分であることが知られている。興味深いことに、図2Bおよび2Cに示すように、CDまたはHC食と比較して、HFD(HCありまたはなし)によって形成された微生物叢を受けたマウスは、血漿コレステロールに有意な変化を示すことなく、大動脈洞における動脈硬化の増加を示した。このことは、HC食ではなくHFD食によって形成された腸内細菌叢が、観察されたアテローム性動脈硬化症の増加に関与していることを示している。
図サムネイルgr2
図2HFDによって形成された微生物叢がアテローム性動脈硬化症を増加させる
キャプション
大きな画像を見るダウンロード 高解像度画像
リーキーガット症候群を引き起こし、結果として全身性炎症を助長する可能性のある腸内炎症について検討した。HFD食またはHC食で形づくられた微生物叢を移植されたマウスの腸における免疫/炎症関連遺伝子の発現プロファイル(群間で発現に差のあるもの)は、CDのそれと類似していたが異なっていた(図S7A)。この観察と一致して、血漿中LPSには群間で有意差は観察されなかった(図S7B)。アテローム性動脈硬化プラーク内の免疫細胞の蓄積がHFD誘発微生物叢の変化によって影響を受けるかどうかを調べるために、大動脈洞プラーク内のマクロファージとTリンパ球を分析した。マクロファージ染色(MOMA-2染色/プラーク表面)は群間で有意差を示さなかったが、Tリンパ球染色(CD3染色/プラーク表面)はHFD-およびHFD+HC形状の微生物叢を摂取したマウス群ではCD形状の微生物叢と比較して有意に増加した(図S8)。
次に、FMTを行う前にレシピエントマウスをATBで処理する(微生物叢を枯渇させる)ことにより、微生物叢の移植時間を短縮しようとした。そこで、FMTプロトコルを用い、FMTの1週間前にldlr-/-レシピエントマウスにATBを投与した(図S9A)。7週間のHFD+HC食飼育後、体重およびWAT重量に群間で有意差は観察されなかった(データは示さず)。図S9BおよびS9Cに示すように、大動脈洞の病変サイズは、血漿コレステロール値に有意な変化はないが、HC食により形成された微生物叢を投与されたマウスと比較して、HFDにより形成された微生物叢を投与されたldlr-/-マウスで有意に増大した。HFDによって誘導されたアテローム性動脈硬化の亢進は、HFDによって形成された微生物叢を摂取したマウスの大動脈洞プラークでは、CDと比較してTリンパ球(CD3染色/プラーク表面)の有意な増加と関連していたが、マクロファージ染色(MOMA2染色/プラーク表面)には両群間で有意な変化は観察されなかった(図S9DおよびS9E)。これらの結果を総合すると、HFD型の微生物叢がアテローム性動脈硬化症の大きさとプラークT細胞の蓄積に大きな影響を及ぼすことが示された。
以前の研究で、HFDによる微生物叢への悪影響は、高脂肪よりもむしろ低食物繊維(LF)に起因することが示されている16。LFが今回の結果に寄与しているかどうかを調べるため、ldlr-/-マウスにCD、HFD、または水溶性食物繊維でSCFA産生菌の基質となるフラクトオリゴ糖(FOS)を添加したHFDのいずれかを与えた。予想されたように、HFDを与えたマウスは、CDを与えたマウスと比較して、酢酸、酪酸およびプロピオン酸レベルの顕著な減少によって示されるように、糞便中のSCFAs量が少なかった(図S10A)。注目すべきことに、HFDにFOSを補充すると、非補足HFDと比較して酪酸およびプロピオン酸レベルが有意に増加し、CD飼育マウスで観察されたレベルと同程度になった(図S10A)。FOSを補充したHFDまたは補充しないHFDによって形成された微生物叢がアテローム性動脈硬化症に及ぼす具体的な影響を調べるために、CD、HFD、またはHFD+FOSを与えたマウスからldlr-/-レシピエントマウスへのFMTを行った(図S10B)。図2Dに示すように、HFD+FOSで形づくられた微生物叢を投与されたマウスは、群間で血漿コレステロール値に変化はなく、HFDが介在する胸部大動脈の脂質面積の増加を消失させた(図S10C)。さらに、HFD形状の微生物叢によって誘導されたアテローム性動脈硬化病変内のT細胞蓄積の増加は、FOS補充によって消失した(図2E)ことから、HFD条件下で微生物叢を形成しアテローム性動脈硬化症を促進する上で、LF含量が大きな役割を果たすことが示された。
LF含量は微生物叢が介在するアテローム性動脈硬化症への影響に影響する
われわれは、HFDで形成された微生物叢の動脈硬化促進作用の根底にあるメカニズムを調べた。そして、微生物叢を介したアテローム性動脈硬化の亢進に対するLF食とHFD食の効果を比較したいと考えた。予想通り、LF食を与えたマウスは、CD食を与えたマウスと比較して、糞便中のSCFA(酢酸、酪酸、およびプロピオン酸)が顕著に減少した(図S10A)。次に、CD食、HFD食、またはLF食を与えたマウスの微生物叢をldlr-/-レシピエントマウスに移植してFMTを行った(図S10DおよびS10E)。CDおよびLF食によって形成された微生物叢を受け取ったldlr-/-マウスの微生物叢のβ多様性解析では、2群間で大きな違いが見られた(図3A)。さらに、LF食形状の微生物叢を移植されたレシピエントマウスでは、微生物叢組成の変化とともに、シャノン指数ではなく観察値で評価したα多様性の有意な減少が観察された(図3B)(図3CおよびS10F)。
図サムネイルgr3
図3低食物繊維は微生物叢が介在する動脈硬化に影響を与える
キャプション
大きな画像を見るダウンロード 高解像度画像
LF食によって形成された微生物叢は大動脈洞のアテローム性動脈硬化に有意な影響を与えなかった(データは示さず)。しかしながら、HFD形状の微生物叢条件下で見出されたように、LF食形状の微生物叢は、血漿コレステロール値に有意な変化を与えることなく、胸部大動脈におけるアテローム性動脈硬化症を有意に増加させた(図3D)(図S10G)。図3Eに示すように、大動脈における炎症関連遺伝子(群間で発現に差がある)の増加(主にリンパ球関連遺伝子)が観察され(図3FおよびS10H)、またLF食形状の微生物叢を摂取したldlr-/-マウスの大動脈洞プラークでは、CD形状の微生物叢と比較してCD3+ T細胞の集積が高かった(図3G)。
HFD食またはLF食形状の微生物叢を摂取したマウスで観察されたアテローム性動脈硬化の亢進にリンパ球が関与しているかどうかを評価するために、CD食、HFD食またはLF食を摂取したマウスの微生物叢をリンパ球欠損Rag1-/-ldlr-/-マウスに移植した。図3Hに示すように、HFD食またはLF食の形状の微生物叢を移植したRag1-/- ldlr-/-マウスでは、CD食の形状の微生物叢を移植したマウスと比較して、胸部大動脈の脂質面積は増加せず、むしろ低下する傾向がみられたが、血漿コレステロール値には有意な変化はみられなかった(データは示さず)。このことは、HFD食またはLF食の形状の微生物叢のアテローム促進作用におけるリンパ球の重要性を強調している。
以上より、HFD中のLF含量は微生物叢によるアテローム性動脈硬化に有害な影響を及ぼすことが示された。
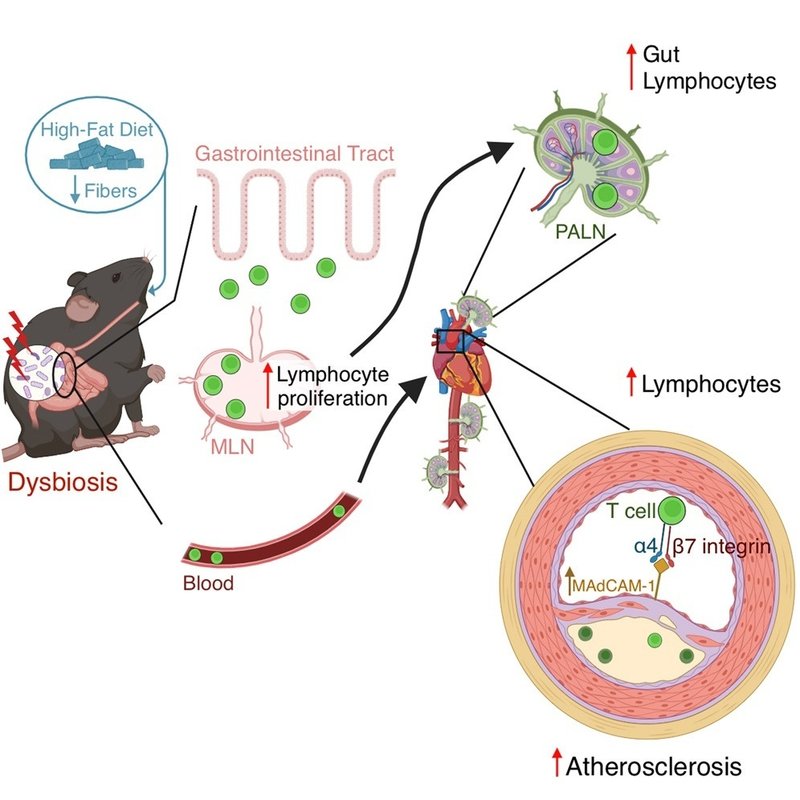
LF含量は、腸リンパ球の末梢への輸送に対する微生物叢媒介作用に影響する。
次に、HFD型およびLF型の微生物叢によって誘導されるアテローム性動脈硬化症の増加のメカニズムを調べた。これらの微生物群の影響を受けた腸管免疫細胞が、腸から末梢、特に動脈硬化に関連する傍大動脈リンパ節(PALN)に移動する可能性があるかどうかを検討した。
腸間膜リンパ節(MLN)は消化管の免疫細胞活性化部位であり、末梢の排膿リンパ節に向かうT/B免疫細胞の重要な出口部位である。我々は、CD-、HFD-、またはLF食を与えたマウスの微生物叢をldlr-/-レシピエントマウスに移植してFMTを行い、その後HFD+HC食を7週間与えた。消化管から末梢に向かう免疫細胞の移動を追跡するために、犠牲にする24時間前にMLNにカルボキシフルオレセインジアセテートスクシンイミジルエステル(CFSE)を注射し、その後MLN、血液、脾臓、PALNで追跡した。
図S11A-S11D、S4AおよびS4Bに示すように、リンパ系細胞のin vivo細胞追跡では、HFDおよびLF食は、CD型の微生物叢と比較して、MLN、血液およびPALNにおいて、CFSE+細胞の割合が増加し、その中でもT(CD4+、CD8+)細胞およびB(CD19+)細胞の割合が増加した。CD型微生物叢と比較して、LF食型微生物叢の条件下では、末梢におけるCFSE+細胞の増加(すなわち、同じ総細胞数および異なる区画間のCFSE+細胞数で評価した移動効率)が最も高かったのはPALNであった(図4C)。CFSE+細胞の割合の増加は、MLNおよびPALNにおける絶対細胞数の増加とも関連していた(図S12AおよびS12B)。CFSE注入5分後に、LF食またはCDによって形成された微生物叢で移植されたマウスの間で、MLNにおけるCFSE+細胞の割合に有意差は観察されなかったので(図S12C)、これはグループ間のCFSE注入の違いによる可能性は除外できる。さらに、非排泄性LN(鼠径LN)にCFSEを24時間注入した後、鼠径LN、血液、またはPALNにおいて、LF食またはCDによって形質転換された微生物叢を投与されたマウス間で有意差は観察されなかったので、末梢におけるCFSE+細胞の増加は、MLNにおける細胞増殖に限定された(図S12D)。
図サムネイルgr4
図4腸管免疫細胞輸送に対する微生物叢媒介効果に影響を及ぼすLF含有量
キャプション
大きな画像を見るダウンロード 高解像度画像
次に、Tヘルパー(Th)およびBサブセット(B1およびB2)を、CDおよびLF食餌形状の微生物叢条件下で分析した。LF食形状の微生物叢を摂取したマウスのMLNにおけるCD4+CFSE+細胞の増加(CD食形状の微生物叢と比較して)は、Th17細胞の系譜特異的マーカーであるRAR関連オーファン受容体γ(ROR)-γt+細胞であった(図S13)。Th1の系譜特異的マーカーであるCFSE+ T-box expressed in T cells (T-bet)+およびT調節(Treg)細胞サブセットの系譜特異的マーカーであるフォークヘッドボックスP3 (FOXP3)+には、2群間で有意差は認められなかった(図S13)。さらに、B細胞サブセットの解析では、LF食形状の微生物叢の条件下では、CD形状の微生物叢と比較して、MLNとPALNでCFSE+ B2細胞の増加が認められた(図S14)。
次に、HFD-またはLF食形状の微生物叢を摂取したマウスのMLNで観察されたCFSE+細胞の増加が、リンパ球増殖の増加によるものかどうかを評価した。興味深いことに、図4Dに示すように、HFD食またはLF食の微生物叢を摂取したマウスのMLNにおけるCD3+リンパ球は、CDで形作られた微生物叢を摂取したマウスと比較して、著しく高い増殖率(Ki67染色で評価)を示した。興味深いことに、リンパ球に発現する受容体α4β7インテグリンと相互作用し、炎症によって誘導されることが知られている粘膜アドレスリン細胞接着分子1(MAdCAM-1)17は、CD形状の微生物叢と比較して、HFD食またはLF食形状の微生物叢を摂取したマウスの大動脈洞のアテローム性動脈硬化病変内で発現が上昇した(図4E)。腸管MAdCAM-1遺伝子発現には、CD型微生物叢と比較して、HFD-またはLF食型の微生物叢を摂取したマウスの間で有意差は観察されなかった(図S15A)。注目すべき点として、HFD-またはLF食形状の微生物叢を受けたマウスのプラーク内には、腸向性のβ7インテグリン+ CD3+リンパ球がわずかに検出されたが、CD形状の微生物叢を受けたマウスでは、これらの細胞はほとんど認められなかった(図4F)。これらのデータは、LF食またはHFDによって形作られた微生物叢が、アテローム性動脈硬化プラークに腸向性リンパ球を優先的に引き寄せることを示している。
これらの結果を総合すると、HFDあるいはLF食で形成された微生物叢を摂取したマウスでは、CD食で形成された微生物叢を摂取したマウスに比べて、末梢に高いレベルの腸管由来免疫細胞が存在することが示され、これはおそらくMLN内のリンパ球の増殖率が高いためであろう。
そこで我々は、このようなMLNから末梢への腸管免疫細胞の移動亢進が、HFD食やLF食の形状の微生物叢が動脈硬化に及ぼす影響を説明できるかどうかを知りたいと考えた。MLNを部分的に外科的に除去し、残ったMLNにCFSEを注入すると、注入24時間後、偽手術マウスと比較して、手術したマウスのPALNではCFSE+細胞の割合が有意に減少したが、MLNでは減少しなかった(図S15B)。このことは、MLN由来細胞がPALNへの免疫細胞輸送に寄与していることを示している。次に、MLNの完全な外科的除去がHFD+HC食摂食下でのアテローム性動脈硬化症に影響を及ぼすかどうかを調べた。図5A-5CおよびS15C-S15Eに示すように、HFD+HC食を与えたldlr-/-マウスにおいて、鼠径LNではなくMLNを切除すると、血漿コレステロール値に有意な変化を与えることなく、胸部大動脈のアテローム性動脈硬化症が減少し、病変部T細胞の蓄積も減少したことから、HFD+HC食摂食条件下でのアテローム性動脈硬化症におけるMLNの重要性が示された。
図サムネイルgr5
図5LF含量が動脈硬化を修飾する腸由来細胞
キャプション
大きな画像を見るダウンロード 高解像度画像
LF食によって形成された微生物叢が観察された動脈硬化促進作用にMLNが関与しているかどうかを直接調べるために、MLN切除を行ったマウスでFMTを行った。図5D-5Fに示すように、MLN切除により、LF食形状の微生物叢を移植したマウスでは、CD形状の微生物叢と比較して、プラークサイズの増大と病変部T細胞の蓄積が抑制された。
全体として、我々のデータは、HFDにおける水溶性食物繊維の低含量が腸内細菌叢の変化の主要な促進因子であり、腸管免疫細胞の輸送および動脈硬化の全身的発症に重大な影響を及ぼすことを示している。
考察
高コレステロール血症は、特に炎症反応を促進することにより、アテローム性動脈硬化症の危険因子であることはよく知られている18。このよく知られたアテローム性促進因子の役割とは別に、他の食事関連因子も、特に腸内細菌叢の健康に影響を及ぼすことにより、アテローム性動脈硬化症に影響を及ぼす可能性がある。実際、食事の構成は、微生物叢の構成および機能の推進因子として浮上している19。これと一致して、これまでの実験的研究では、腸内細菌叢の形成において、宿主の遺伝的変異よりも食事の果たす役割が支配的であることが示されている4。
Casp1-/-マウスからldlr-/-マウスへの炎症性糞便微生物叢の移入によって示されたように、腸内細菌叢の異常はアテローム性動脈硬化を促進することが以前に示唆されている20。ここで我々は、離乳前のATB曝露による微生物叢異常が、西洋型HFD+HC食を与えた成体ldlr-/-マウスの大動脈洞内の血管炎症と脂質蓄積を促進することを示した。このことは、微生物叢異常がHFD+HC食の摂食条件下で動脈硬化促進作用を発揮しうることを示している。
しかし、HFDによって変化した腸内細菌叢とアテローム性動脈硬化症との因果関係は不明である。われわれの結果は、HC食ではなくHFD食が腸内細菌叢に好ましくない影響を及ぼし、有害なプロテオバクテリア22の増加と、SCFAsのような保護細菌が産生する代謝産物の減少によって評価された。HC食ではなくHFD食で形成された微生物叢を移植すると、CD食で形成された微生物叢に比べてアテローム性動脈硬化症が増加し、微生物叢依存的にHFDがアテローム性動脈硬化症を促進することが明らかになった。
HFDの摂取は、腸内細菌叢の異常だけでなく、代謝の乱れを誘発し、腸のバリア機能を低下させ、全身性の炎症を亢進させ、その結果、CVDのリスクを高める可能性がある。ここでは、HFD型の微生物叢を摂取したマウスは、CD型の微生物叢を摂取したマウスと比較して、OGTTおよびITTで評価した代謝パラメータに有意な変化はないものの、アテローム性動脈硬化症が増加することを示した。HFD+HC食の摂取期間が7週間であったことは、代謝パラメーターの変化を引き起こすには短すぎた。HFD+HC食の摂取期間が20週間であったことは、代謝パラメーターの変化を引き起こすには短すぎたからである。
HFDの有害な影響を研究する研究では、脂肪の役割に焦点が当てられ、疾患の結果に影響を及ぼす可能性のある食事の他の成分が見落とされることが多い。特に、食物繊維は腸内細菌叢と宿主の健康に好影響を及ぼすことが知られていることから、HFD中のLF含量は腸内細菌叢に大きな影響を与える可能性がある25。食物繊維は微生物叢によって優先的に発酵され、酢酸、酪酸、プロピオン酸などのSCFAsを生成するが、これらのSCFAsには複数の有益な活性が備わっている11。さらに、酪酸26やプロピオン酸27など、いくつかのSCFAは動脈硬化に対して保護的な役割を果たすことが以前に示されている。我々の研究は、SCFA産生を増加させることによる食物繊維の微生物叢とアテローム性動脈硬化症に対する保護効果をさらに支持するものである。ここで我々は、HFD中のLF含量を模倣した非共有異性化LF食16が、FMT後のレシピエントマウスにおいて、微生物叢が生成するSCFAを減少させ、血管炎症とアテローム性動脈硬化を促進することを示した。さらに、HFDを与えたマウスに水溶性食物繊維(FOS)を補充すると、糞便中のSCFAレベル(主に酪酸とプロピオン酸)が上昇し、微生物叢依存的なHFDによる動脈硬化促進作用が抑制されたことから、食物繊維が微生物叢依存的にHFD誘発性動脈硬化症から保護できることが示された。これらの結果を総合すると、HFD中のLF含量、ひいてはSCFA産生の減少が、HFDによる微生物叢依存的な動脈硬化促進作用に関与している可能性が高いことが示唆された。
微生物叢と免疫系との間のクロストークは、宿主生理学の制御において基本的な役割を果たしている。腸内細菌叢は免疫応答のレベルと質に影響を与える。また、免疫系は腸内細菌叢の組成形成に関与している。HFDは腸内細菌叢に重大な影響を及ぼし、宿主免疫に悪影響を及ぼすことが示されている29。先行研究24,30と一致して、今回の結果は、HFD誘発性腸内細菌叢異常症が、IL-22およびその標的である抗菌ペプチドReg3βおよびReg3γの腸管発現の低下によって証明されるように、腸管免疫応答、特に宿主防御に関連する応答を障害することを示した。しかしながら、高脂血症食餌マウスまたは高脂血症食餌マウスからのFMTは、CD食餌マウスとは異なるものの、レシピエントマウスにおいて同様の腸管免疫炎症プロファイルを誘導した。これらの知見から、HC食群とHFD食群の腸管免疫・炎症プロファイルが同様に変化したにもかかわらず、HC食群の微生物叢を投与したマウスではCD食群の微生物叢を投与したマウスと比較してアテローム性動脈硬化症は変化しなかったことから、HFD食群の微生物叢によって誘導されたアテローム性動脈硬化症の増加には、局所的な腸管炎症プロファイルが関与しているとは考えにくいことが示唆された。
腸は免疫細胞の最大の貯蔵庫のひとつであり、その細胞は腸と他のリンパ器官との間を双方向に行き来している可能性がある。特に、受容体α4β7インテグリンとそのリガンドであるMAdCAM-1は、腸関連リンパ組織(GALT)へのリンパ球のホーミングに重要な役割を果たしていることが示されている17。
先行研究では、定常状態および自己免疫性関節炎の誘発後における腸から脾臓への免疫細胞の移動が示されている31。われわれは、HFD-またはLF-形状の微生物叢を摂取したマウスで観察されたアテローム性動脈硬化の亢進に、腸から末梢への腸管免疫細胞の移動が関与しているのではないかという仮説を立てた。この仮説と一致するように、これまでの研究で、腸管由来の免疫細胞は標的臓器に移動し、そこで自己免疫性腎臓病32、心筋炎33、脳卒中34などの疾患の促進に寄与するという有害な役割が示されている。さらに、免疫細胞の腸管から末梢への排出に関与するメカニズムも不明である。その中で、SCFAは腸管免疫細胞の輸送を制御する上で大きな役割を果たしている可能性がある。興味深いことに、実験的自己免疫性ぶどう膜炎において、プロピオン酸がエフェクターT細胞の腸から眼球や脾臓などの腸外組織への遊走を抑制することが示されている35。
腸管免疫細胞の末梢への遊走を追跡するため、CD-、HFD-、LF-食餌形状の微生物叢を投与したマウスのMLNにCFSEトラッカーを注入した。低レベルのSCFAを含むHFD食またはLF食で形成された微生物叢を移植すると、腸からPALNを含むアテローム性動脈硬化症関連部位への腸由来免疫細胞(主にTおよびBリンパ球)の輸送が増加した。これはMLNにおけるリンパ球増殖の増加によるものと考えられ、HFD型あるいはLF型の微生物叢を摂取したマウスのMLNでは、CD型の微生物叢を摂取したマウスと比較して、CFSE+細胞の割合とKi67染色で評価したリンパ球増殖率が増加したことから明らかである。リンパ球の増加は主にTh17とB2サブセットによるもので、これらは動脈硬化に重要な役割を果たすことが以前に示されている15。
我々の知見は、腸内における微生物が誘発する免疫細胞の変化と、末梢部位における免疫主導性の影響との間に機能的な関係があることを示唆している。MLNを部分的に除去した結果、PALNにおける腸管由来免疫細胞が有意に減少したことから、腸管由来免疫細胞が末梢部位の移動に関与していることが証明された。アテローム性動脈硬化症におけるリンパ管を介した腸管由来免疫細胞の移動の重要性は、鼠径LNではなくMLNを切除することにより、胸部大動脈のプラーク内およびアテローム性動脈硬化症におけるT細胞の集積が減少するという我々の知見によっても示された。さらに、LF食型またはCD型の腸内細菌叢を摂取したマウスでMLNを切除すると、プラーク内のT細胞蓄積だけでなく、アテローム性動脈硬化病変の大きさの違いも消失したことから、LF食型の腸内細菌叢がアテローム性動脈硬化促進作用にMLNが重要な役割を果たしていることがさらに明らかになった。この表現型はリンパ球に大きく依存していた。なぜなら、HFDまたはLF食で形成された腸内細菌叢を移植されたリンパ球欠損マウスは、CD食で形成された腸内細菌叢を移植された免疫不全マウスと比較して、アテローム性動脈硬化症はむしろ減少し、増加しなかったからである。注目すべきは、HFDまたはLF形状の微生物叢を与えられたマウスのアテローム性動脈硬化病変内に、β7インテグリンを発現する腸管性リンパ球の存在と、そのリガンドであるMAdCAM-1のアップレギュレーションが検出されたことで、腸管性リンパ球がプラークに優先的にリクルートされていることが示唆された。しかし、プラーク内のリンパ球の大部分はβ7インテグリンを発現していなかったので、このことが観察された表現型全体を説明するとは考えにくい。さらに、アテローム性動脈硬化症は全身性の疾患であることが知られており、LNと大動脈壁の間を血液を介してリンパ球が移動することが主要な決定要因となっている36。
我々の結果は、自己免疫性腎臓病32や心筋炎33を含む複数の疾患の促進において、腸由来の免疫細胞のリンパ管移動が役割を果たしているという蓄積された証拠と一致している。また、我々の結果は、腸β7インテグリン+上皮内Tリンパ球(IEL)がアテローム性動脈硬化症を促進する可能性を示唆した先行研究37とも一致している。リンパ球が腸からPALNやアテローム性動脈硬化プラークを含む末梢に移動し、アテローム性動脈硬化症を促進するという証拠は、腸とアテローム性動脈硬化症の関連についての理解に新たな一面を加えるものである。さらに、HFDおよびLF食形状の微生物叢の動脈硬化促進作用の同定は、食物繊維が健康を促進することのさらなる証拠となる。
結論として、本研究は、HFDが介在する微生物叢への影響の根底にある機序に関する新たな洞察を提供し、LF含有量が微生物叢を形成することによって動脈硬化を促進する未認識の手がかりを明らかにした。
研究の限界
交絡効果によって表現型が緩和される可能性があるため、この研究で用いられた経口摂取法にはいくつかの限界があるかもしれない。特に、すべての微生物叢レシピエントマウスに同じ食餌を与えたという事実は、ドナーマウスの特定の食餌によって形成された微生物叢の影響を時間とともに克服する可能性がある。もう一つの限界は、粥腫プラーク内のリンパ球の数が少ないことで、我々のCFSE+染色法を用いて腸管由来リンパ球を検出することは技術的に困難である。さらに、CFSEを注入するプロトコールでは、免疫細胞の蓄積を24時間しかモニターできない。
STAR★メソッド
主要リソース表
試薬またはリソースのソース IDENTIFIER
抗体
ウサギ抗CD3ポリクローナル抗体 Agilent Dako Cat#A0452; RRID:AB_2335677
ウサギ抗 MAdCAM-1 ポリクローナル抗体 Bioss Antibodies Cat#bs-11179R; RRID:AB_3065216
ウサギ抗インテグリンβ-7 (ITGB7) ポリクローナル抗体 BiCell Scientific Cat#10027
ウサギ抗 Ki67 抗体(クローン SP6) Invitrogen Cat#MA5-14520; RRID:AB_10979488
ラット抗マクロファージ/単球抗体(クローン MOMA-2) Chemicon Cat#MAB1852; RRID:AB_94372
ラット抗マウス CD3 抗体(クローン 17A2) eBioscience Cat#14-0032-86; RRID:AB_467053
APC-eFluor 780 ラット抗マウス CD45 (30-F11) eBioscience Cat#47-0451-82; RRID:AB_1548781
FITC ラット抗マウス CD4(RM4-5) eBioscience Cat#11-0042-85; RRID:AB_464897
PerCP-eFluor 710 ラット抗マウス ROR γ(t)(B2D) eBioscience Cat#46-6981-80; RRID:AB_10717534
PE-Cyanine7 ラット抗マウス FOXP3 (FJK-16s) eBioscience Cat#25-5773-80; RRID:AB_891554
アレクサ蛍光 700 ラット抗マウス CD8(53-6.7) BD Pharmingen Cat#557959; RRID:AB_396959
APC ラット抗マウス CD19 (1D3) BD Pharmingen Cat#550992; RRID:AB_398483
Alexa Fluor 700 ラット抗マウス CD5 (53-7.3) BioLegend Cat#100636; RRID:AB_2687002
PerCP/Cyanine5.5 ラット抗マウス CD43 (S11) BioLegend Cat#143220; RRID:AB_2800667
PE マウス抗マウス T-ベット(4B10) BioLegend Cat#644810; RRID:AB_2200542
Cy5 AffiniPure Donkey 抗ウサギ IgG(H + L) Jackson ImmunoResearch Cat#711-175-152; RRID:AB_2340607
Cy3 AffiniPure Donkey anti-Rat IgG (H + L) Jackson ImmunoResearch Cat#712-165-153; RRID:AB_2340667
化学物質、ペプチド、組換えタンパク質
フラクトオリゴ糖(FOS)Sigma-Aldrich Cat#F8052
D-(+)-グルコース Sigma-Aldrich Cat#G7021
スクラロース Sigma-Aldrich Cat#69293
オイルレッド O Sigma-Aldrich Cat#O0625
TWEEN 20 シグマアルドリッチ Cat#P7949
トリトン X-100 Sigma-Aldrich Cat#T8532
ネオマイシン 50% Virbac N/A
メトロニダゾール Savetis N/A
アモキシシリン パンファーマ N/A
バンコマイシン マイラン N/A
インスリン ランタス ソロスター Sanofi Cat#MAT511722
細胞トレーサー CFSE 細胞増殖キット Invitrogen Cat#C34570
イソフルラン(Iso-VET) ピラマルクリティカルケア Cat#CIP1811180
リン酸緩衝生理食塩水(PBS) Gibco Cat#10010-015
リン酸緩衝生理食塩水 10X(PBS 10X) Euromedex Cat#ET330
トリス緩衝生理食塩水 10X(TBS 10X) Euromedex Cat#ET220
メタノール VWR Chemical Cat#20847.295
緩衝液 RLT Qiagen Cat#79216
パラホルムアルデヒド溶液 4% in PBS Santa Cruz Biotechnology Cat#sc-281692
Tissue-Tek O.C.T.コンパウンド Sakura Cat#4583
重要な市販アッセイ
超高感度マウスインスリン ELISA キット Crystal Chem Cat#90080
マウス IL22 ELISA Invitrogen Cat#88-7422-88
Pierce LAL 発色性エンドトキシン定量キット Thermo Scientific Cat#88282
コレステロール FS DiaSys Cat#113009910023
トリグリセリド FS DiaSys Cat#157109910021
RNA 抽出 Qiagen Cat#4034
逆転写キット Qiagen Cat#205313
寄託データ
微生物叢生シーケンスリード本論文 SRA: PRJNA1024086
実験モデル 生物/株
マウス:ldlr-/- (B6.129S7-Ldlrtm1Her/J) The Jackson Laboratory RRID:IMSR_JAX:002207
マウス Rag1-/- (B6.129S7-Rag1tm1Mom/J) The Jackson Laboratory RRID:IMSR_JAX:002216
マウス Rag1-/- ldlr-/- ラボブリード N/A
オリゴヌクレオチド
Gapdh-R, 5′-CGTCCCGTAGACAAAATGTGAA-3′ Eurofins Genomics N/A
Gapdh-L, 5′-GCCGTGAGTGGAGTCATACTGGAACA-3′ Eurofins Genomics N/A
Reg3g-R 5′-TTCCTGTCCTCCATGATCAAAA-3′ Eurofins Genomics N/A
Reg3g-L 5′-CATCCACCTCTGTTGGGTTCA-3′ Eurofins Genomics N/A
Reg3b-R 5′-ATGCTGCTCTCCTGCCTGATG-3′ Eurofins Genomics N/A
Reg3b-L 5′-CTAATGCGTGCGGAGGGTATTC-3′ Eurofins Genomics N/A
MAdCAM-1-R 5′-GTTCCTGGC CAGGTGACCCCGAAT-3′ Eurofins Genomics N/A
MAdCAM-1-L 5′-CCACAGGCGGTAGCAAGGAAGAC-3′ Eurofins Genomics N/A
16S(センス) 5′-TACGGRAGGCAGCAG-3′ GenoScreen N/A
16S(アンチセンス) 5′-CTACCNGGGTATCTAAT-3′ GenoScreen N/A
ソフトウェアとアルゴリズム
GraphPad Prism グラフパッドソフトウェア http://www.graphpad.com/RRID:SCR_002798
ImageJ NIH https://ImageJ.net/RRID:SCR_003070
FlowJo BD Biosciences https://www.flowjo.com/
Histolab Microvision Instruments https://www.microvision.fr/applications/sciences-de-la-vie-biologie/histologie/
R software R Foundation https://www.R-project.org/
nsolver ナノストリング https://nanostring.com/products/ncounter-analysis-system/ncounter-analysis-solutions/nsolver-data-analysis-support/
dada2 パイプライン(v1.16.0) Callahan et al. 38 https://benjjneb.github.io/dada2/index.html
Silva データベース(v138.1) Quast et al. 39 http://www.arb-silva.de
phyloseq package (v1.40.0) McMurdie et al. 40 https://www.bioconductor.org/packages/release/bioc/html/phyloseq.html
PERMANOVA with the adonis function Oksanen et al. 41 https://CRAN.R-project.org/package = vegan
ggplot2 (v3.4.1) Wickman et al. Ref. 42 ISBN:978-0-387-98140-6
ggpubr (v0.4.0) Kassambara et al. Ref. 43 https://cran.r-project.org/package = ggpubr
pheatmap パッケージ (v1.0.12) Callahan et al. 44 https://github.com/benjjneb/dada2
その他
ノーマルチョー食(CD) Safe Cat#A03
高脂肪食 (HFD) - 60% FAT ssniff Spezialdiäten GmbH Cat#E15742-347
高コレステロール食(HC) - コレステロール 1.25% ssniff Spezialdiäten GmbH Cat#E15106-3470
HFD + HC ssniff Spezialdiäten GmbH Cat#S9299-E710
低繊維食(LF) ssniff Spezialdiäten GmbH Cat#AIN76A
グルコメーター Accu-Chek GUIDE ロシュ糖尿病ケア Cat#07400942016
新しいタブで表を開く
リソースの有無
リード連絡先
リソースおよび試薬に関する詳細情報およびリクエストは、主担当者であるSoraya Taleb () までご連絡ください。
材料の入手可能性
本試験では新規の試薬は使用していない。
実験モデルおよび研究参加者の詳細
マウス
ldlr-/-、Rag1-/-マウスはJackson Laboratory(Jax)から購入し、我々の施設で飼育した。Rag1-/-マウスをldlr-/-マウスと交配し、Rag1-/-ldlr-/-マウスを得た。性ホルモンが経験結果に影響することを避けるため、本研究では雄マウスのみを使用した。
雄マウスには、通常のチャウ食(CD)(SAFE)、または60%FATを含む食餌誘発肥満(ssniff Spezialdiäten GmbH)、または1.25%コレステロールを含む高コレステロール(HC)食(ssniff Spezialdiäten GmbH)を与え、アテローム性動脈硬化症を誘発するか、HFD+HC食(ssniff Spezialdiäten GmbH)、または低繊維(LF)食(ssniff Spezialdiäten GmbH)の両方を組み合わせた。すべてのマウスに餌と水を自由摂取させた。特定の食餌は7週齢から開始し、水と餌を自由に摂取できる状態で20週齢以下まで継続した。一部の実験では、水溶性食物繊維源としてFOS(フラクトオリゴ糖)を飲料水で希釈した(7.5%)。これらの実験に使用したマウスはすべて、特定の病原体フリーバリア施設で飼育された。各実験で使用した動物の数は図の凡例に示した。動物実験は、欧州指令(2010/63/UE)およびフランス当局の地方倫理委員会である「動物実験倫理委員会」(CEEA)により承認された施設ガイドライン(下記番号18-112)に従って実施した。
方法の詳細
In vivo試験
経口ブドウ糖負荷試験(OGTT)では、1g/kgのブドウ糖を経口投与する前にマウスを一晩絶食させた。0、5、15、30、60、90、120分後に尾静脈から血液を採取し、グルコース濃度を測定した(Roche Diabetes Care)。0,15,30,60分後に尾静脈から採血し、血漿サンプルはインスリン濃度を分析するまで-20℃で保存した(Crystal Chem Inc.) インスリン負荷試験(ITT)は、1U/kgのインスリンを腹腔内に注射する5時間前から餌を絶ったマウスで行った。グルコース濃度を測定するため、0、5、15、30、60、90分後に尾静脈から血液を採取した。糞便経口投与実験は、前述24)と同様に、特定の飼料を与えたldlr-/-マウスの新鮮な便サンプルを用いて行った。簡単には、オートクレーブ滅菌した空のケージに入れたドナーマウス(n = 5)の各群から、新鮮な糞便を最低20個採取した。糞便をホモジナイズし、オートクレーブした濾過水に懸濁し、注射器のプランジャーヘッドを用いて70μmの孔径のフィルターで粉砕した。これらの糞便懸濁液をldlr-/-またはRag1-/-ldlr-/-レシピエントマウスに450μLを週3回、8週間または19週間経口投与で接種した。約10匹のレシピエントマウスに移植するために、約5匹のドナーから糞便材料を調製した。
腸管免疫細胞の末梢への移動を追跡するために、最近報告されたように、100μMのカルボキシフルオレセイン・スクシンイミジルエステル(CFSE)を犠牲の5分前または24時間前にMLNに注射した46。腹膜を1~2cm切開して盲腸を取り出し、MLNを可視化した。その後、CFSE溶液10μLを盲腸から最初のMLNに注入した。別の条件では、鼠径部LNにCFSEを注射した。対照マウスにはPBSを注射した。その後、マウスは縫合され、目覚めるまでヒートランプの下に置かれ、処置の数時間後にモニターされた。犠牲後、MLN、鼠径リンパ節、血液、脾臓、PALNの細胞を採取し、CFSE蛍光染色をフローサイトメトリーで解析した。腸間膜リンパ節切除のため、ldlr-/-マウスは麻酔され、手術中はイソフルラン下に維持された。小腸と盲腸をMLNとともに腹部に沿って1cm幅で切開し、PBSで加湿した。腸間膜リンパ節切除は、上腸間膜動脈から大動脈基部までの長さに沿ってマイクロダイセクションにより行った。手術後、小腸と盲腸を再び腹部に戻し、腹壁の病変部と外皮を糸で縫合した。偽マウスではリンパ節切除は行わなかった。別の条件では、左鼠径リンパ節を切除した。
代謝パラメータの分析
血糖値はグルコメーター(Roche Diabetes Care)を用いて測定した。血漿インスリンはELISA(Crystal Chem)により測定した。体重、グルコースおよびインスリンの曲線下面積(AUC)は、台形法を用いて算出した。血漿中の LPS は比色診断キット(Pierce)を用いて測定した。糞便中の短鎖脂肪酸(SCFA)の測定は、既述の方法で行った24,49。
アテローム性動脈硬化病変の広がりとプラーク組成
マウスは犠牲にする前にイソフルランで麻酔した。血漿コレステロールと肝臓トリグリセリドは、それぞれ市販のコレステロール測定キット(DiaSys)とトリグリセリド測定キット(DiaSys)を用いて測定した。腕頭動脈を含む心臓と大動脈を摘出し、4%パラホルムアルデヒドで2時間固定した。胸部大動脈の病変範囲は、オイルレッドO染色の割合を示した。免疫染色には、マクロファージとT細胞をそれぞれ検出するために、MOMA-2(Chemicon)とCD3(Agilent Dako)に対する抗体を用いた51。
動脈硬化病変内のMAdCAM-1はウサギMAdCAM-1一次抗体(Bioss Antibody)で検出し、Cy5 AffiniPure Donkey Anti-Rabbit IgG(Jackson ImmunoResearch)で明らかにした。冷メタノールで固定し、透過処理(Triton 0.1%)した後、アテローム性動脈硬化斑内のβ7インテグリン+CD3+細胞をウサギIntegrin β-7(BiCell Scientific)およびラット抗マウスCD3抗体(eBioscience)で検出し、それぞれ抗ウサギCy5および抗ラットCy3(Jackson ImmunoResearch)二次抗体で明らかにした。マウス1匹につき約6~8切片を分析し、適切な陰性コントロールを用いた。Histolabソフトウェア(Microvision)またはImageJソフトウェア(NIH)を用いて形態計測を行った。
MLNにおける免疫染色
MLN内の増殖率を評価するため、固定および透過処理後、ウサギ抗Ki67抗体(Invitrogen)およびラット抗マウスCD3抗体(eBioscience)と、それぞれ抗ウサギCy5(Jackson ImmunoResearch)および抗ラットCy3(Jackson ImmunoResearch)の二次抗体を用いて、増殖細胞(Ki67+)およびCD3+細胞を検出した。マウス1匹につき約20切片を分析し、適切な陰性コントロールを用いた。Histolabソフトウェア(Microvision)を用いて形態計測を行った。
定量的リアルタイムPCR
腸および大動脈を洗剤緩衝液RLTで溶解し、RNA抽出および逆転写(Qiagen)またはナノストリングテクノロジーにかけた。その後、定量的リアルタイムPCRをABI PRISM 7700(Applied Biosystems社製)を用いて3連で行った。Gapdhのサイクル閾値(プライマー: Gapdh-R 5′-CGTCCCGTAGACAAAATGTGAA-3';Gapdh-L 5′-GCCGTGAGTGGAGTCATACTGGAACA-3′)を用いて遺伝子発現を正規化した。Reg3g-R 5′-TTCCTGTCCTCCATGATCAAAA-3′およびReg3g-L 5′-CATCCACCTCTGTTGGGTTCA-3'のプライマー; Reg3b-R 5′-ATGCTGCTCTCCTGCCTGATG-3′およびReg3b-L 5′-CTAATGCGTGCGAGGGTATATTC-3';MAdCAM-1-R 5′- GTTCCTGGC CAGGTGACCCCGAAT-3';MAdCAM-1-L 5′-CCACAGGCGTAGCAAGGAAGAC-3'。PCR条件は95℃で10分、95℃で15秒、60℃で20秒、72℃で20秒を35サイクル、最終伸長は72℃で20秒であった。
ナノストリング
NanoString 解析は、製造元の推奨に従って実施し、解析した。データは、Nanostringデータ解析用Rパッケージを用いて、バックグラウンド補正、正規化、品質管理などの処理を行った。
フローサイトメトリー
フローサイトメトリー解析は、前述したように、血液、脾臓、LNの単一細胞懸濁液に対して行った: CD45(APC-eFluor780、eBioscience)、CD8(Alexa Fluor 700、BD Pharmingen)、CD4(FITC、eBioscience)、CD19(APC、BD Pharmingen)、CD5(Alexa Fluor 700、Biolegend)、CD43(PerCP/Cyanine5.5、Biolegend)。核内染色抗体は、ROR-γt(PerCP-eFluor 710, eBioscience)、FOXP3(PE/Cyanine7, eBioscience)、T-bet(PE, Biolegend)。サンプルはフローサイトメーター(LSRFortessa、Becton Dickinson)を用いて取得し、データはFlowJoソフトウェア(BD Bioscience)を用いて解析した。細胞のダブレットは、前方(FSC)および側方(SSC)の光散乱面積(A)対幅(W)を用いて除外した。
16s rDNA遺伝子の配列決定と解析
糞便DNAサンプルの16S rDNA遺伝子配列決定は、以前に記載されたように行った53。簡単に言うと、V3-V4領域(16S(センス)5′-TACGGRAGGCAGCAG-3′および(アンチセンス)5′-CTACCNGGGTATCTAAT-3′)を増幅し、Illumina MiSeqプラットフォーム(GenoScreen)を用いて配列決定を行った。生のペアエンドリードを以下のプロセスにかけた:(1)PRINSEQ-lite PERLスクリプト38を用いて、Phredアルゴリズムに基づく品質<30を示さない3′末端からの塩基を切り捨てることによる品質フィルタリング;(2)CutAdaptを用いて、プライマー配列にミスマッチを許容しない状態で、フォワードおよびリバースプライマー配列の両方を検索および除去。完全な順方向プライマーと逆方向プライマーが見つからない配列は除外された。解析はRバージョン4.2.2のdada2パイプライン38 v1.16.0を用いて行った。分類学的分類はSilvaデータベース(v138.1)を用いて行った39。ダウンストリーム解析はR (v 4.2.0)でphyloseqパッケージ(v1.40.0)を用いて行った40。α多様性はObserved ASVsとShannon indexを用いて計算した。β多様性はBray-Curtis非類似度尺度を用いて相対比率を計算し、主座標軸プロットとして表示した。β多様性に対する実験変数の影響は、Rパッケージvegan(v2.6.2)のadonis関数を用いたPERMANOVAで評価した41。プロットはggplot2(v3.4.1)42とggpubr(v0.4.0)43を用いて作成した。pheatmapパッケージ(v1.0.12)44を用い、スピアマン相関係数とHmiscパッケージを用いた相関関係をプロットし、絶対値が0.5を超える相関係数で名目上有意なものをプロットした。生シーケンスリードはSequence Read Archive (SRA)から入手可能。解析スクリプトはgithub (https://github.com/ajlavelle)から入手可能。
定量と統計解析
値は平均値±s.e.m.で表した。群間の差は図の凡例に示したように評価した。値はp < 0.05で有意とみなした。統計解析はGraphPad Prism(GraphPad Software)を用いて行った。
データとコード
本論文で報告されたすべてのデータは、要請があれば主担当者が共有する。
本論文で報告されたすべてのデータは、要請があれば主担当者が共有する。
本論文で報告されたデータの再分析に必要な追加情報は、要求があれば主担当者から入手可能である。
謝辞
本研究は、INSERM、Agence Nationale de la Recherche (ANR-22CE14-0014-01 to S.T.)、Fondation pour la Recherche Médicale (FRM) (to S.T.およびH.A.-O.)、Fédération Française de Cardiologie (FFC) (to S.T.)、Fondation de France (FDF) (to S.T.)の支援を受けた。N.M.とM.C.はFDFから学位論文のための奨学金を受けている。M.C.はNouvelle Societé Française d'Athérosclerose(NSFA)から4年目の学位論文に対して奨学金を授与された。SSNIFFのAnnette Schuhmacherには、食事の構成について協力していただいた。専門知識を共有し、ナノストリング分析に協力してくれたキュリー研究所(David Gentien、Audrey Rapinat、Laure Villoing-Gaude)に感謝する。サイトメトリー(Camille Knosp)、動物実験施設、組織学施設のメンバーに感謝する。図表はBioRenderで作成した。
著者の貢献
L.L.は実験デザインに関与し、ほとんどの実験を行い、データを解析した。N.M.、M.C.、B.E.、N.S.、E.B.、N.J.M.、L.C.、Y.H.は一部の実験に協力した。M.D.はいくつかの統計解析を手伝った。D.R.は胆汁酸の測定と実験結果の解釈を手伝った。J.-L.P.とW.L.G.は脂質測定を行い、議論した。A.T.とH.A.-O.は結果について議論した。L.Z.は、腸管免疫細胞の輸送に関する技術的および概念的な協力を行った。A.L.とH.S.は腸内細菌叢の解析を行い、結果を解釈し、議論した。S.T.は研究の立案、データの解析と解釈を行い、原稿を執筆した。
利害関係
著者らは競合する利害関係はないと宣言している。
インクルージョンと多様性
我々は、包括的で多様性があり、公平な研究実施を支持する。
補足情報
pdfをダウンロード (5.51 MB)
pdfファイルのヘルプ
資料S1. 図S1-S15
参考文献
Caleyachetty R.
トーマス G.N.
トゥーリス・K.A.
モハメドN.
ゴカレ K.M.
バラチャンドラン K.
ニランタラクマールK.
350万人の男女における代謝的に健康な肥満と心血管疾患発症イベント。
J. Am. Coll. Cardiol. 2017; 70: 1429-1437
https://doi.org/10.1016/j.jacc.2017.07.763
論文で見る
グーグル・スカラー
ソネンブルグ J.L.
Bäckhed F.
ヒトの代謝の調節因子としての食事-微生物叢相互作用。
Nature. 2016; 535: 56-64
https://doi.org/10.1038/nature18846
記事で見る
グーグル・スカラー
ラウンド J.L.
マズマニアン S.K.
腸内細菌叢は、健康時と疾患時の腸管免疫応答を形成する。
Nat. Immunol. 2009; 9: 313-323
https://doi.org/10.1038/nri2515
論文で見る
グーグル・スカラー
カーモディ R.N.
ガーバー G.K.
ルエバノJr.
ガッティ D.M.
ソームズ L.
スベンソン K.L.
ターンボー P.J.
マウス腸内細菌叢の形成において、食事は宿主の遺伝子型を支配する。
Cell Host Microbe. 2015; 17: 72-84
https://doi.org/10.1016/j.chom.2014.11.010
記事で見る
グーグル・スカラー
カインゾス-アキリカ M.
グラスナー K.
ザワヒール・H.S.
デイ A.K.
アグラワル T.
クイグリー E.M.M.
アブラハム B.P.
アッカ I.
ヤヤ T.
メータ N.N.
ナシルK.
炎症性腸疾患とアテローム性動脈硬化性心血管疾患: 今週のJACCレビュートピック。
J. Am. Coll. Cardiol. 2020; 76: 2895-2905
https://doi.org/10.1016/j.jacc.2020.10.027
論文で見る
Google Scholar
ブラウン J.M.
ヘイゼン S.L.
心血管疾患の微生物制御。
Nat. Rev. Microbiol. 2018; 16: 171-181
https://doi.org/10.1038/nrmicro.2017.149
論文で見る
グーグル・スカラー
リンスコグ・ヨンソン A.
シーザー R.
アクラミ・R.
ラインハルトC.
フォーク・ホレニウス F.
ボレン J.
Bäckhed F.
Apoe(-/-)マウスにおけるアテローム性動脈硬化症の発症に対する腸内細菌叢と食事の影響。
Arterioscler. Thromb. Vasc. Biol. 2018; 38: 2318-2326
https://doi.org/10.1161/ATVBAHA.118.311233
記事で見る
グーグル・スカラー
ターガー G.
バーンC.D.
肥満: 代謝的に健康な肥満とNAFLD。
Nat. Rev. Gastroenterol. Hepatol. 2016; 13: 442-444
https://doi.org/10.1038/nrgastro.2016.104
論文で見る
グーグル・スカラー
カニ・P.D.
アマール J.
イグレシアス M.A.
ポッジ M.
クナウフ C.
バステリカ D.
ネイリンク A.M.
ファバ F.
トゥオヒ K.M.
チャボ C.
他。
代謝性内毒素血症は肥満とインスリン抵抗性を引き起こす。
糖尿病。2007; 56: 1761-1772
https://doi.org/10.2337/db06-1491
論文で見る
Google Scholar
ピーターセン C.
ベル R.
クラッグ K.A.
リー S.H.
ソト・R.
ガザリャン A.
ブールケ K.
エキズ H.A.
オスト K.S.
ブディナ S.
他
T細胞を介した微生物叢の制御が肥満を防ぐ。
サイエンス。2019; 365eaat9351
https://doi.org/10.1126/science.aat9351
記事で見る
グーグル・スカラー
シュローダー B.O.
Bäckhed F.
生理と疾患における腸内細菌叢から遠隔臓器へのシグナル。
ナット。Med. 2016; 22: 1079-1089
https://doi.org/10.1038/nm.4185
論文で見る
グーグル・スカラー
ソネンバーグ G.F.
ファーザー L.A.
アーティスD.
国境パトロール:IL-22によるバリア表面での免疫、炎症、組織恒常性の制御。
Nat. Immunol. 2011; 12: 383-390
https://doi.org/10.1038/ni.2025
論文で見る
Google Scholar
Wahlström A.
サイン S.I.
マルシャル H.U.
Bäckhed F.
胆汁酸と微生物叢の腸内クロストークと宿主代謝への影響。
Cell Metabol. 2016; 24: 41-50
https://doi.org/10.1016/j.cmet.2016.05.005
論文で見る
Google Scholar
アル・ナバニ Z.
デュラロイ S.
マルケス R.
Cousu C.
アル・バウニー S.
デジャルダン F.
スパルワッサー T.
ベラール M.
セルフ=ベンスサン N.
Eberl G.
微生物叢に対する離乳反応は、成人における免疫病理学的抵抗性に必要である。
Immunity. 2019; 50: 1276-1288.e5
https://doi.org/10.1016/j.immuni.2019.02.014
論文で見る
グーグル・スカラー
Taleb S.
アテローム性動脈硬化症における炎症。
Arch. Cardiovasc. Dis. 2016; 109: 708-715
https://doi.org/10.1016/j.acvd.2016.04.002
論文で見る
グーグル・スカラー
モリソン K.E.
ジャシャレビッチ E.
ハワード C.D.
ベールT.L.
それは繊維であり、脂肪ではありません:腸内細菌叢に食事の挑戦の有意な影響。
マイクロバイオーム。2020; 8: 15
https://doi.org/10.1186/s40168-020-0791-6
記事で見る
Google Scholar
ベルリン C.
バーグ E.L.
ブリスキン M.J.
アンドリュー D.P.
キルショー P.J.
ホルツマン B.
ワイズマン I.L.
ハマーン A.
ブッチャー E.C.
α4β7インテグリンは、粘膜血管アドレジンMAdCAM-1へのリンパ球の結合を媒介する。
Cell. 1993; 74: 185-195
https://doi.org/10.1016/0092-8674(93)90305-a
論文で見る
Google Scholar
リビー P.
ハンソン G.K.
局所的脂質蓄積から全身性炎症へ: 今週のJACC総説トピック。
J. Am. Coll. Cardiol. 2019; 74: 1594-1607
https://doi.org/10.1016/j.jacc.2019.07.061
論文で見る
グーグル・スカラー
ゲッツ G.S.
Reardon C.A.
食事とネズミのアテローム性動脈硬化症。
Arterioscler. 血栓。Vasc. Biol. 2006; 26: 242-249
https://doi.org/10.1161/01.ATV.0000201071.49029.17
論文で見る
Google Scholar
ブランズマ E.
Kloosterhuis N.J.
コスター M.
デッカー D.C.
ガイベルス M.J.J.
ファン・デル・フェルデン S.
リオス・モラレス M.
ファン・ファーセン M.J.R.
ロレッティ M.G.
デ・ブルーインA.
他
炎症性腸内細菌叢は全身性炎症を増加させ、動脈硬化を促進する。
Circ. Res. 2019; 124: 94-100
https://doi.org/10.1161/CIRCRESAHA.118.313234
論文で見る
グーグル・スカラー
マルズッロ P.
ディ・レンゾL.
プグリエーセG.
デ・シエナM.
バレア L.
ムスコギウリ G.
コラオ A.
サバスタノS.
栄養教育研究と評価OPERAグループと評価の肥満プログラム
腸内細菌叢を介して肥満から心血管疾患へ:危険な旅。
イント。J.オブス。サプリメント。2020; 10: 35-49
https://doi.org/10.1038/s41367-020-0017-1
論文で見る
Google Scholar
シン N.R.
Whon T.W.
ベ J.W.
プロテオバクテリア:腸内細菌叢におけるディスバイオージスの微生物シグネチャー。
Trends Biotechnol. 2015; 33: 496-503
https://doi.org/10.1016/j.tibtech.2015.06.011
論文で見る
グーグル・スカラー
チャン X.
ジェラールP.
心血管疾患における食事と腸内細菌叢の相互作用。
Comput. Struct. Biotechnol. J. 2022; 20: 1528-1540
https://doi.org/10.1016/j.csbj.2022.03.028
論文で見る
グーグル奨学生
ローランス L.
ヴェンテクレフ N.
ハダド Y.
チャジャディンM.
アルザイド F.
メトガルチ S.
ソブラン B.
ドニ R.G.P.
デイルー J.
カルデリーニM.
他
インドールアミン2,3-ジオキシゲナーゼの遺伝子欠損は、腸内細菌叢を介した代謝の健康を促進する。
Nat. Med. 2018; 24: 1113-1120
https://doi.org/10.1038/s41591-018-0060-4
論文で見る
グーグル・スカラー
マッキ K.
ディーハン E.C.
ウォルター J.
Bäckhed F.
宿主の健康と疾患における腸内細菌叢に食物繊維の影響。
Cell Host Microbe. 2018; 23: 705-715
https://doi.org/10.1016/j.chom.2018.05.012
記事で見る
グーグル スカラー
カサハラ K.
クラウトクラマー K.A.
オーグ E.
ロマノ K.A.
カービー R.L.
ビバス E.I.
メハラビアン M.
デヌ J.M.
ベッケド F.
ルシス A.J.
レイ F.E.
マウスモデルにおけるRoseburia intestinalisと食事との相互作用がアテローム形成を調節する。
Nat. Microbiol. 2018; 3: 1461-1471
https://doi.org/10.1038/s41564-018-0272-x
論文で見る
グーグル・スカラー
バルトロマエウス H.
バログ A.
ヤコウブ M.
ホーマン S.
マルコー L.
ヘーゲス S.
ツヴェトコフ D.
クラニッチ A.
ヴンダーシッツ S.
エイブリー E.G.
ら
短鎖脂肪酸プロピオン酸は高血圧性心血管系障害から保護する。
Circulation. 2019; 139: 1407-1421
https://doi.org/10.1161/CIRCULATIONAHA.118.036652
記事で見る
グーグル・スカラー
ベルカイド Y.
ハンドT.W.
免疫と炎症における微生物叢の役割。
Cell. 2014; 157: 121-141
https://doi.org/10.1016/j.cell.2014.03.011
記事で見る
グーグル・スカラー
キリスト A.
ラウターバッハ M.
ラッツE.
西洋の食事と免疫システム: 炎症性の接続。
免疫。2019; 51: 794-811
https://doi.org/10.1016/j.immuni.2019.09.020
記事で見る
グーグル・スカラー
ゾウ・J.
シャセイン・B.
シン V.
ペリゾン M.
リッチ M.
ファイス M.D.
クマール M.V.
ゲヴィルツA.T.
食物繊維を介した腸内細菌叢の栄養補給は、IL-22を介した大腸の健康を回復させることにより、食事誘発性肥満から保護する。
Cell Host Microbe. 2018; 23: 41-53.e4
https://doi.org/10.1016/j.chom.2017.11.003
記事で見る
グーグル・スカラー
モートン A.M.
セフィク E.
ウパディヤイR.
ヴァイスレーダーR.
ベノイストC.
マティスD.
内視鏡的光電変換により、予期せぬほど広範な白血球の腸への、および腸からの輸送が明らかになった。
Proc. Natl. Sci. USA. 2014; 111: 6696-6701
https://doi.org/10.1073/pnas.1405634111
論文で見る
グーグル・スカラー
クレブス C.F.
パウスト H.J.
クローン S.
コイロ T.
ブリックス S.R.
リーデル J.H.
バルチ P.
ヴィエヒ T.
マイヤー=シュヴェジンガー C.
ホアン J.
他
自己免疫性腎疾患は、S1P受容体-1依存的な腸管Th17細胞の腎臓への遊走によって増悪する。
Immunity. 2016; 45: 1078-1092
https://doi.org/10.1016/j.immuni.2016.10.020
論文で見る
Google Scholar
ジル=クルス C.
ペレス-柴山C.
デ・マルタン A.
ロンキ F.
ファン・デル・ボルヒトK.
ニーダー R.
オンダー L.
リュトゲ M.
ノヴコヴィッチ M.
ニンドル V.
ら
微生物叢由来のペプチド模倣体が致死的炎症性心筋症を引き起こす。
Science. 2019; 366: 881-886
https://doi.org/10.1126/science.aav3487
論文で見る
グーグル・スカラー
ブレア D.
プーン C.
ベナキス・C.
ルビッツG.
マーフィー M.
イアデコラ C.
アンラザーJ.
脳卒中は中枢神経系への腸管免疫細胞輸送に影響を及ぼす。
脳行動。Immun. 2021; 96: 295-302
https://doi.org/10.1016/j.bbi.2021.05.008
論文で見る
グーグル
中村恭子
ジャノウィッツ C.
メテア C.
アスキスM.
カルステンス L.
ローゼンバウム J.T.
リン P.
短鎖脂肪酸は、腸からのリンパ球の遊走を部分的に変化させることにより、免疫介在性ぶどう膜炎を改善する。
Sci. Rep. 2017; 711745
https://doi.org/10.1038/s41598-017-12163-3
論文で見る
グーグル スカラー
リー・J.
Ley K.
アテローム性動脈硬化プラークへのリンパ球遊走。
Arterioscler. 血栓。Vasc. Biol. 2015; 35: 40-49
https://doi.org/10.1161/atvbaha.114.303227
論文で見る
グーグル スカラー
He S.
カーレス F.
ラティック S.
ナイアーズ M.
マカパイン C.S.
安西 A.
セルグレード D.
フェン A.M.
チャン C.T.
ミンダーJ.E.
ら
腸上皮内T細胞は代謝を調整し、心血管疾患を促進する。
Nature. 2019; 566: 115-119
https://doi.org/10.1038/s41586-018-0849-9
記事で見る
グーグル・スカラー
キャラハン B.
プロクター D.
リルマンD.
福山 J.
ホームズ S.
個別化ヒトマイクロバイオームデータ解析のためのRによる再現可能な研究ワークフロー。Pacific Symposium on Biocomputing.
Pac. シンポジウム。Biocomput. 2016; 21: 183-194
記事で見る
グーグル・スカラー
クアスト C.
プルエッセ E.
Yilmaz P.
ゲルケンJ.
シュヴェールT.
ヤルザ P.
ペプリーズ J.
Glöckner F.O.
SILVAリボソームRNA遺伝子データベースプロジェクト:改良されたデータ処理とウェブベースのツール。
Nucleic Acids Res.
https://doi.org/10.1093/nar/gks1219
論文で見る
Google Scholar
マクマーディ P.J.
ホームズ S.
phyloseq:マイクロバイオームセンサスデータの再現性のあるインタラクティブな解析とグラフィックスのためのRパッケージ。
PLoS One. 2013; 8e61217
https://doi.org/10.1371/journal.pone.0061217
記事で見る
Google Scholar
オクサネン J.
ヴィーガン: コミュニティ生態学パッケージ。
Rパッケージ版。2017; 2: 4-5
記事で見る
グーグル・スカラー
ウィッカム H.
ggplot2: データ分析のためのエレガントなグラフィックス。
シュプリンガー出版社2009
記事で見る
グーグル・スカラー
Kassambara A.
Ggpubr:「Ggplot2」ベースの出版準備済みプロット。
2019 (Rパッケージ・バージョン0.2.3)
https://cran.r-project.org/package=ggpubr
論文で見る
グーグル・スカラー
カラハン B.J.
マクマーディ P.J.
ローゼン M.J.
ハン A.W.
ジョンソン A.J.A.
ホームズ S.P.
DADA2:イルミナアンプリコンデータからの高分解能サンプル推定。
Nat. Methods. 2016; 13: 581-583
https://doi.org/10.1038/nmeth.3869
論文で見る
グーグル・スカラー
ソネンバーグ G.F.
アルティスD.
自然リンパ球と微生物叢との相互作用:腸の健康と病気への影響。
Immunity. 2012; 37: 601-610
https://doi.org/10.1016/j.immuni.2012.10.003
記事で見る
Google Scholar
フィデル M.
ラウバー C.
アルヴェス・コスタ・シルヴァC.
ティアン A.L.
ラーマー I.
デ・ラ・ヴァレンデ A.L.M.
Zhao L.
テレマク C.
Lebhar I.
メッサウデネM.
他
微生物叢が調節するチェックポイントが、免疫抑制性の腸管T細胞を癌に誘導する。
サイエンス。2023; 380eabo2296
https://doi.org/10.1126/science.abo2296
記事で見る
Google Scholar
ベルグルンド E.D.
Li C.Y.
ポッフェンバーガーG.
アヤラ J.E.
フエガー P.T.
ウィリス S.E.
ジュエル M.M.
パワーズ A.C.
ワッサーマン D.H.
一般的に使用されている4つの近交系マウス系統におけるin vivoでの糖代謝。
Diabetes. 2008; 57: 1790-1799
https://doi.org/10.2337/db07-1615
論文で見る
Google Scholar
アリソンD.B.
ランダム化臨床試験において、共変量を測定する価値があるのはどのような場合か?
J. Consult. Clin. Psychol. 1995; 63: 339-343
記事で見る
Google Scholar
フェルショー・ルーシェ V.
プトー E.
ピロケ H.
Zaïr Y.
クレンプM.
ラクチュロースからの大腸発酵は、太り過ぎの被験者における脂肪分解を阻害する。
Am. J. Physiol. Metab. 2005; 289: E716-E720
https://doi.org/10.1152/ajpendo.00430.2004
論文で見る
グーグル奨学生
タレブ S.
ロマン M.
ラムケラウォン B.
ウイッテンホーブ C.
パステルカンプ G.
ヘルバン O.
エスポジート B.
ペレス N.
ヤスカワ H.
ヴァン・スニックJ.
他。
T細胞におけるSOCS3発現の消失は、アテローム性動脈硬化症におけるインターロイキン-17の制御的役割を明らかにした。
J. Exp. Med. 2009; 206: 2067-2077
https://doi.org/10.1084/jem.20090545
論文で見る
グーグル・スカラー
マラット Z.
ゴジョバ A.
ブルン V.
エスポジート B.
フルニエ N.
コトレズ F.
テドゥギ A.
Groux H.
制御性T細胞1型反応の誘導はアポリポ蛋白Eノックアウトマウスにおけるアテローム性動脈硬化症の発症を抑制する。
Circulation. 2003; 108: 1232-1237
論文で見る
Google Scholar
Wang Y.
アイト-オウフェラH.
ヘルバン O.
ボナン P.
ラムケラウォン B.
タレブ S.
ホアン J.
オッフェンシュタット G.
コンバディエール C.
レニア L.
他
TGF-β活性はアンジオテンシンII注入マウスにおける炎症性大動脈瘤の進行と合併症を予防する。
J. Clin. Invest. 2010; 120: 422-432
https://doi.org/10.1172/JCI38136
記事で見る
Google Scholar
ラマス B.
リチャード M.L.
ルドゥック V.
ファム H.P.
ミシェル M.L.
ダ・コスタ G.
ブリドノー C.
ジェグー S.
ホフマン T.W.
ナティヴィダードJ.M.
他
CARD9は、トリプトファンのアリール炭化水素受容体リガンドへの腸内細菌叢代謝を変化させることにより、大腸炎に影響を与える。
Nat. Med. 2016; 22: 598-605
https://doi.org/10.1038/nm.4102
論文で見る
グーグル・スカラー
セガタ・N.
イザードJ.
ウォルドロンL.
ゲヴァースD.
ミロポルスキーL.
ギャレット W.S.
ハッテンハワーC.
メタゲノミックバイオマーカーの発見と説明。
Genome Biol.
https://doi.org/10.1186/gb-2011-12-6-r60
論文で見る
グーグル・スカラー
論文情報
出版履歴
オンライン公開 2023年10月31日
受理済み 受理:2023年10月11日
改訂版受理 2023年9月13日
受理:2023年9月13日 受理日:2022年9月12日
識別
DOI: https://doi.org/10.1016/j.celrep.2023.113350
著作権
© 2023 The Author(s).
ユーザーライセンス
クリエイティブ・コモンズ 表示 - 非営利 - 改変禁止 (CC BY-NC-ND 4.0) | 情報アイコンの再利用方法
サイエンスダイレクト
ScienceDirectでこの記事にアクセスする
図
図サムネイルfx1
グラフィカルアブストラクト
図サムネイルgr1
図1HC食ではなくHFD食は腸のホメオスタシスに有害な役割を果たす。
図サムネイルgr2
図2HFDによって形成された微生物叢はアテローム性動脈硬化症を増加させる
図サムネイルgr3
図3低食物繊維は微生物叢が介在する動脈硬化に影響を及ぼす
図サムネイルgr4
図4食物繊維含量は腸管免疫細胞輸送に対する微生物叢媒介作用に影響する
図サムネイルgr5
図5LF含量によって影響を受ける腸由来細胞はアテローム性動脈硬化症を修飾する。
関連記事
広告
研究ジャーナル
細胞
癌細胞
細胞化学生物学
細胞ゲノム
細胞宿主と微生物
細胞代謝
細胞レポート
セルレポーツ医学
セルレポートメソッド
セルレポート 物理科学
セルレポート サステイナビリティ
細胞幹細胞
細胞システム
化学
化学触媒
カレントバイオロジー
発生細胞
デバイス
ヘリオン
免疫
アイサイエンス
ジュール
マター
医学
分子細胞
ニューロン
一つの地球
パターン
STARプロトコル
構造
トレンドレビュージャーナル
生化学
バイオテクノロジー
癌
細胞生物学
化学
認知科学
生態学・進化学
内分泌学・代謝学
遺伝学
免疫学
微生物学
分子医学
神経科学
寄生虫学
薬理学
植物科学
パートナージャーナル
AJHG
生物物理ジャーナル
生物物理学レポート
HGGアドバンス
分子植物
分子治療ファミリー
ネクサス
植物通信
幹細胞レポート
イノベーション
コレクション
ベスト・オブ・セルプレス
セルプレスレビュー
セルプレスセレクション
コンソーシアムハブ
Nucleusコレクション
スナップショット・アーカイブ
ジャーナルを超えて
細胞キャリアネットワーク
細胞シンポジウム
ラボリンク
ウェビナー
論文を進化させる
図360
複数ジャーナル投稿
スニークピーク
STARメソッド
社会における科学
細胞写真ショー
セルプレスポッドキャスト
セルプレスビデオ
ぬりえ&コミック
リサーチ・アーク
コネクト
セルプレスについて
採用情報
お問い合わせ
ヘルプ&サポート
ニュースルーム
出版アラート
アクセス
購読申し込み
今すぐ読む
司書に薦める
インフォメーション
広告主の皆様へ
リクルーターの方へ
図書館員の方へ
利用規約
プライバシーポリシー
アクセシビリティ
本サイトのコンテンツは、あらゆる科学分野の医療従事者および研究者を対象としています。
当サイトでは、サービスの提供・向上やコンテンツのカスタマイズのためにクッキーを使用しています。クッキーの設定を更新するには、このサイトのクッキー設定をご覧ください。
このサイトのすべてのコンテンツ: 著作権 © 2023 Elsevier Inc.
テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビア社に帰属します。
すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
プライバシーポリシー 利用規約 アクセシビリティ ヘルプ&サポート お問い合わせ
RELX
この記事が気に入ったらサポートをしてみませんか?
