肝硬変における糞便微生物叢移植
MDPIオープンアクセスジャーナル
zoom_out_map検索メニュー
雑誌名 Biomedicines 第11巻 第11号 10.3390/biomedicines11112930
設定論文別刷り注文
オープンアクセス総説
肝硬変における糞便微生物叢移植
https://www.mdpi.com/2227-9059/11/11/2930


Adrian Boicean 1,2ORCID、Victoria Birlutiu 1,2、Cristian Ichim 1,2,*、Olga Brusnic 3、Danusia Maria Onișor 3 著
1
シビウ郡臨床救急病院、550245 シビウ、ルーマニア
2
シビウ・ルシアン・ブラガ大学医学部、ルーマニア、シビウ、550169
3
タルグ・ムレシュ医科薬科大学消化器科、540142 Târgu Mures、ルーマニア
*
著者宛先
Biomedicines 2023, 11(11), 2930; https://doi.org/10.3390/biomedicines11112930
受理された: 受理:2023年10月2日 / 改訂:2023年10月25日 / 受理:2023年10月26日 / 掲載:2023年10月30日
(この論文は、Section Microbiology in Human Health and Diseaseに属しています。)
Downloadkeyboard_arrow_down 図の閲覧 バージョン ノート
要旨
ヒトの消化管には多様なプロバイオティック細菌と病原性細菌が生息しており、この微生物組成に何らかの変化が生じると、個人の健康に大きな影響を及ぼす可能性がある。腸内細菌叢の不均衡が肝疾患の発症に極めて重要な役割を果たすことはよく知られている。このことから、肝疾患に対する新たな補助療法として、腸内細菌叢を調整することが考えられる。糞便微生物叢移植によって、マイクロバイオームが損なわれた患者に健康なドナーの便を投与することで、正常なマイクロバイオームを取り戻し、症状を緩和しようとする試みである。横断的研究と症例報告のレビューから、糞便微生物叢移植は慢性肝疾患に有効な治療法である可能性が示唆される。この新たな治療法の可能性に加えて、最近の研究では、糞便微生物叢移植が肝硬変に特化した治療アプローチとして有望であることが示されている。多様で有益な微生物を腸内に導入することで、この革新的な治療法は肝硬変患者でしばしば観察される微生物の不均衡に対処することを目的としている。さらなる検証が必要ではあるが、これらの予備的知見は、肝硬変を管理するための新規で的を絞った方法としての糞便微生物叢移植の潜在的な影響力を強調するものである。我々は、肝硬変に対する新たな治療法として、この方法に関する理解の現状をまとめるとともに、その臨床応用と将来の可能性について説明することを目的とした。
キーワード:糞便微生物叢移植;微生物叢;肝硬変;微生物叢移植
はじめに
慢性肝疾患による死亡率は指数関数的に増加しており、最近では世界全体で年間200万人が死亡している [1]。最も罹患者が多いのは男性で、死亡者の3人に2人が男性である。肝疾患は、社会に大きな経済的負担を強いることから、より重要な意味を持ち、米国では年間320億米ドルを超える支出がある [2] 。
腸内細菌叢のアンバランスは、肝疾患によって悪化する可能性があり、互いに有害である [3] 。肝臓と腸を直接つなぐ門脈により、細菌とその代謝産物は、健康な状態でも病気の状態でも肝臓に影響を及ぼす可能性がある [4] 。さらに、胆汁酸を胆道系に放出することで、肝臓は腸と双方向に連絡を取り合っている [5]。
近年、微生物叢を調節するための多くの新しいアプローチが提案されており、個別化された食事、抗生物質、プロバイオティクスやプレバイオティクス、胃の手術、ファージ療法、糞便微生物叢移植(FMT)など、有効性や臨床応用の面で多くの有望な成果を挙げている[6,7,8,9,10,11]。
本研究では、肝硬変(LC)に代表される最もよく知られた慢性肝疾患のひとつであり、肝性脳症(HE)のような肝硬変に関連する合併症に対する将来的な治療法として、FMTを検討する。
肝硬変の治療は、根本的な原因や重症度によって異なる。現在のところ、肝硬変は肝疾患の進行における最終段階と考えられており、最新の治療法では治癒は望めず、肝機能の有意な改善は見られていない。最初のステップは生活習慣の改善である。生活習慣の改善は、病気の進行を遅らせ、生活の質を向上させるが、生存率には直接影響せず、進行した肝硬変症例には十分ではないかもしれない [12] 。肝硬変の治療における薬剤の有効性は、原因や病期によって異なる。さらに、病気の予後は常に注意を要する最重要因子であるため、決して過小評価してはならないことを強調することが極めて重要である。ナノインデンテーション技術は、肝細胞の核の変形を評価・追跡することが可能であり、健康な集団から採取したサンプルと肝硬変疾患に罹患したサンプルの区別を可能にすることが、研究によって実証されている[13,14]。ウイルス性肝炎に対する抗ウイルス薬は病気の進行を遅らせることができるが [15]、薬物療法はまだ目を見張るような結果をもたらさない。肝移植は、進行した肝硬変に対する最も効果的な治療法であり、生存率も高い。命を救う治療法であるにもかかわらず、患者がこの治療を受けることは依然として困難であり、例外的な場合にのみ実施され、待ち時間は極めて長い。患者がこの治療を受けた場合、生存の可能性は著しく高まり、ある研究では、末期肝疾患の状態で肝移植を受けた患者は、移植を受けられなかった患者と比較して、生存期間が最大13~17年延長したことが示されている[16]。
先に述べたような要因から、現在ではこれまで以上に肝硬変の治療に対する解決策を見出す必要があり、FMTはその可能性のある選択肢として考えられている。肝硬変は公式にはFMTの禁忌ではないが、医学文献では、FMTを受けた肝硬変患者の報告は現在数件しかなく、それらの報告は詳細な記述がなく掲載されているだけである[17,18]。
本総説は、肝硬変におけるFMTの適応と方法に関する最新のエビデンスとデータを要約することを目的とする。糞便微生物叢移植(FMT)の歴史
クローン病や潰瘍性大腸炎に代表される炎症性腸疾患(IBD)は、CDIのような腸内細菌異常症とともに、FMTによく反応することが示されている[19,20,21,22,23]。
この治療法が数百年前に使用され始めたことは重要である。4世紀、葛洪(Ge Hong)博士の著書『周侯北記方(Zhou Hou Bei Ji Fang)』によると、食中毒、下痢、発熱の治療には発酵した糞便または糞便水を飲むことが処方されていた。1580年には、李時珍という中国の医師が『本草綱目』という本を書き、その中で発酵した糞便や糞便水を用いた20以上の症状に対する効果的な治療法が述べられている [24]。1958年に英文文献で初めて、糞便水浣腸が偽膜性大腸炎の治療に有効であると報告したのはEisemanらであった[24]。
当初は、新鮮な糞便から糞便微生物叢を調製し、内視鏡または非内視鏡ガイド下で消化管に直接投与していた[25,26,27]。近年、凍結保存された製剤がこれらのFMTに取って代わり、この治療法が主流医療に導入されるようになった[25]。最近では、大腸内視鏡や内視鏡、浣腸やカプセル療法など、さまざまな投与法が用いられている[26]。腸-肝臓軸
ヒトの消化管には微生物が多く生息しており、これらの微生物が健康な状態でも病気の状態でも重要な役割を果たしていることが認識されつつある。胃腸(GI)管とその微生物叢との共生関係のおかげで、後者は消化、ビタミン産生、病原体に対する抵抗力を助けるが、病気を引き起こす可能性のある細菌も含んでいる [28] 。加齢に伴い、腸内細菌叢は様々な環境要因によって劇的に変化する [29] 。高齢者では、ビフィドバクテリウムとバクテロイデス群の減少が観察されており、これは暗黙のうちに、特定の好ましくないタイプの細菌が優勢になるリスクの増大と、防御度の低下に関連している可能性がある [30] 。興味深いことに、微生物叢の安定性の維持は長寿と関連しているようである [30] 。
肥満、糖尿病、大腸がんなど、様々な病態が腸内細菌叢の変化と関連しており、このパターンは現在ではディスバイオーシスと呼ばれている [31,32,33]。この状態は、複雑な常在菌群集が乱れ、免疫のプライミングが不十分になることで起こる [4]。大腸菌や肺炎球菌は、腸内細菌叢と宿主との敏感な常在関係が乱れると、宿主の腸内細菌叢に過剰に付着するようになる [1,34] 。腸管透過性の亢進に加え、マイクロバイオームのアンバランスは細菌の移動を引き起こし、その結果、免疫反応が亢進し、腸管膜内のタイトジャンクションの完全性に悪影響を及ぼす可能性がある [1,35]。
研究者らは、消化管運動障害、全身および局所の免疫学的機能障害、門脈圧亢進症、胃酸産生および分泌の低下が、病原性細菌集団の増加と常在細菌集団の減少を引き起こす腸内細菌叢の異常や主な原因であることを発見している [36,37] 。LC、自己免疫疾患、パーキンソン病、自閉症、クロストリジオイデス・ディフィシル感染症(CDI)の患者では、腸内細菌叢が変化していることが多数の報告で明らかになっている [29,38,39] 。さらに、不安症、うつ病 [40]、多発性硬化症 [41]、不眠症 [42]、多嚢胞性卵巣症候群 [43]、糖尿病 [44]などの疾患における腸内細菌叢の重要な影響も、研究によって立証されている。このような広範な関与は、腸と腸以外の問題の両方に適用可能なアプローチを提供する糞便微生物叢移植(FMT)の多用途性を強調している。FMTは、代謝疾患、ホルモン疾患、神経変性疾患など幅広い疾患に対する貴重な介入となりうる。
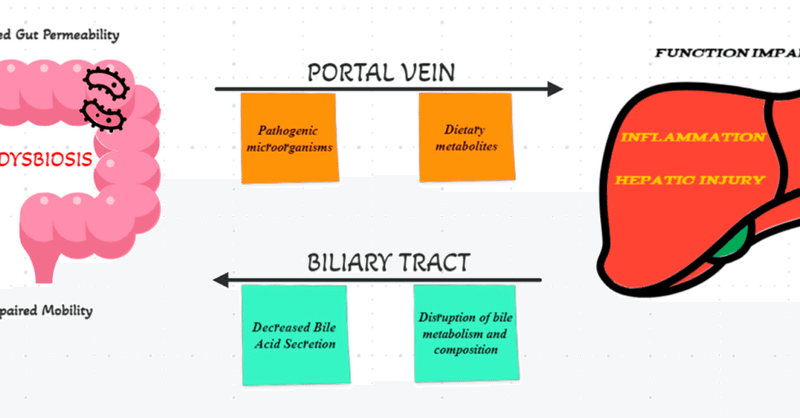
肝臓は、腸内細菌や摂取した食物が血流に入るとすぐに、最初の臓器としてその細菌に挑戦する[4]。腸内細菌叢は、肝臓の生理・機能に大きな影響を及ぼすだけでなく、肝疾患の発症や進行においても重要な役割を果たしている。門脈循環には潜在的に病原性のある微生物やその産物が浸潤し、炎症や肝障害を引き起こすことがある [31] 。一方、LC患者では、胆汁酸分泌の低下、腸管透過性の亢進、運動障害、免疫機能障害などの病理学的状態が起こり、腸内細菌叢に悪影響を及ぼし、ディスバイオシスにつながる可能性がある [31,45,46](図1)。シグナル伝達経路(ファルネソイドX受容体やGタンパク質共役型膜受容体5を含む)を通じて、腸内細菌叢は胆汁酸の組成と肝臓の機能の両方に大きな影響を及ぼしているようである[47]。肝硬変患者は、腸-肝臓軸の機能不全の結果、腸内細菌叢が根本的に変化している [48]。さらに、肝硬変患者の糞便を分析することにより、細菌の標的変化が同定され、以下の種が減少している: 腸球菌科、腸内細菌科、ブドウ球菌科の菌数が有意に増加しているのに加えて、ルミノコッカス科とラクリスピラ科が減少している [49]。
Biomedicines 11 02930 g001図1. 腸-肝臓軸の模式図。移植技術
医学界では、糞便微生物叢移植の理想的な方法について、いまだに議論が続いている。上部消化管(経鼻十二指腸、経鼻空腸など)と下部消化管(浣腸または盲腸までの大腸内視鏡)の両方から使用可能な、糞便を移植する様々な方法が詳細に記載されているが、その有効性に関する研究は分かれている[50,51]。Gulatiらは、患者の嗜好、利用可能な方法、患者の年齢、病態の重症度などを考慮し、複数の基準に基づいて移行法を選択すべきであると強調している。彼らの研究はまた、効率性という点で有望な結果を示した研究により浸透しつつある経口投与経路にも焦点を当てている [52,53] 。FDAはすでにVowstとして知られる製品の市場参入を承認しており、CDI患者のマイクロバイオームを改変する治療的意義がある。投与は経口で極めて簡単であり、将来的には肝硬変患者の微生物叢を調節する有望な治療法となる可能性がある [54] 。しかし、多くの施設では、大腸内視鏡検査が依然として好ましい方法であり、特にCDIでは、糞便を大腸レベルで直接投与できるため、大腸全体を横断することができる[51]。CDI以外の疾患におけるFMTの有効性に関する臨床研究のほとんどは、投与方法として大腸内視鏡を用いることを避ける傾向にある。その理由のひとつは、患者のコンプライアンスが低く、苦痛に対する恐怖心が強いこと、および研究医師がこの方法に関連するリスクを認識していることであろう。これらのリスクには、腹痛、腸管通過障害、鼓腸などの重篤でない有害反応だけでなく、穿孔や侵襲性の高い病原体の感染などの重篤な有害反応も含まれる [55,56] 。
現在、経口カプセルを用いたFMTの実施に大きな焦点が当てられている。上部消化管か下部消化管かに関係なく、この方法は侵襲的な手技に比べてはるかにリスクが低いことは間違いない [57,58] 。しかし、移植材料の調製の問題が生じる。これは投与経路によって異なり、最も重要なことは、ドナーの微生物叢を変化させ、手技の有効性を著しく低下させる可能性のある調製のレベルである。
Hamiltonらは、移植方法を標準化することで、手技の有効性を損なうことなく、実用的な利点をもたらすことを提案している [59] 。しかし、質の高いプロトコルを作成するためには、今後の研究で異なる移植方法とドナー材料の準備の有効性を比較する必要がある。それまでは、様々な溶液に溶かした新鮮な糞便や、-80℃で保存した糞便を移植する方法が、有効性を高めるために最も安全で、最も研究されている方法である[60]。
ドナーの選択は、ボランティアを見つけるのが難しいことや、リスクを最小限に抑えるために必要な複数の検査のために、多くの場合、依然として骨の折れるプロセスである[61,62]。大規模な施設では、便微生物叢バンクの開発がすでに始まっており、必要なときにこれらの備蓄に素早くアクセスでき、患者に適したドナーが見つからない場合に貴重な時間を節約できるという利点がある[63]。
ドナーの除外基準には、最近30日以内の抗生物質の使用、腫瘍、神経、自己免疫、感染症などが含まれる。ドナーは18歳未満であってはならないが、若いドナーは適合する確率が高く、ほとんどの場合病歴を示さない。医師は、未成年の患者に対する医事法的な影響を常に意識し、医療を実践している国の法律に忠実に従わなければならない [64] 。FMTの安全性
レトロスペクティブ研究や症例報告では、FMT が LC 患者にプラスの効果をもたらすことが示されている。長期的な安全性に関するデータは限られている。糞便微生物叢は、最も健康なドナーが選択され、微生物叢調製プロセスの前に実験室でドナーの材料が厳密に検査されることを保証するドナー選択プロセスを組み込んだ標準的な方法論に従って調製される[59,65]。詳細な診断書と病歴、便検査、血清学的検査、そして最も重要なことは、ドナーのインフォームド・コンセントを手術前に提供しなければならないことである [27,65,66]。表1に、ドナーのスクリーニングの概要を示す。
表1. ドナーのスクリーニング
特に重度の肝障害患者に対する移植を開始する場合、どの施設でも慎重な選択が不可欠である。肝硬変患者の移植に伴うリスクは、他の病態の患者とは異なる可能性がある [67] 。糞便微生物叢移植と肝硬変との間の具体的な相互作用については、十分な文献がないことに留意すべきである。この点を患者に説明し、潜在的なリスクを認識させる必要がある [68] 。肝障害の程度によって治療に対する反応が異なることがあり、FMTを受けた代償性肝硬変患者の死亡を報告している文献研究がある[17,69]。偶然の可能性もあり、この手技が患者の病状の悪化に直接影響し、好ましくない転帰を招いたわけではないかもしれないが、追加的な、特に侵襲的な手技は、利益よりもリスクの方が大きい可能性があることを認識することは極めて重要である。将来的には、各病態の違いが大きいため、各病態に応じたリスク設定が必要である。もちろん、病理は文脈の中で解釈されなければならないことを忘れてはならない。年齢、性別、肥満度、その他の個人的な病歴などの情報も考慮すべきであり、それらを無視することは患者にとって致命的なことになりかねない。
6. 肝硬変(LC)
慢性肝疾患は、ウイルス、アルコール乱用、肥満、自己免疫疾患、毒素のほか、遺伝や環境の影響に起因することがある [70] 。一方、腸内細菌叢のいかなる変化も、肝臓の恒常性維持機能に悪影響を及ぼし、肝機能障害やさらなる肝疾患の発症につながる可能性がある [4] 。疲労肝、肝炎、線維症、LCはすべて、慢性肝疾患に分類される疾患である[71]。
LCにおける壊死炎症と線維化の原因は、様々な機序により変化する。組織学的検査では、緻密な線維性隔壁の周囲に結節が増殖し、その後に実質が消失して肝構造が崩壊するため、肝血管構造が劇的に変化することが明らかである [72] 。LCのいくつかの合併症は腸内細菌叢と関連しているが、黄疸、HE、腹水、静脈瘤出血、自然細菌性腹膜炎、感染症などにも代表される [26,73] 。これらのうち、HEは最も頻繁に入院を引き起こすものであり、患者だけでなく介護者や医療システムにも大きな負担を強いるものである [74] 。肝硬変患者では、入院はより一般的で、抗生物質の使用も多く、CDIに罹患する可能性が高くなる [74]。
肝硬変の進行と生存の割合が同程度の患者を特定するためには、代償と代償解除が簡単で再現性のある方法として分類できる [73] 。肝硬変は、病因に関係なく、肝疾患の進行の最終段階であり、後に肝細胞がんの発生をもたらす可能性がある [75] 。
7. 肝性脳症(HE)
よく知られ、LCの最も一般的な合併症の一つでもあるHEは、病気の経過中に40%以上の累積発生率を示し、病気の診断時に14%以上の症例が発生し、21%の症例が病期が悪化した患者に発生する [48,76] 。全身の炎症、過剰なエンドトキシン、アンモニアの組み合わせが、HEの病因に寄与している [28,77] 。アンモニア中毒による慢性肝疾患では、代謝不全とポートアイシャントが原因と考えられている。
肝硬変およびHE患者の腸内細菌叢で数的増殖を起こしやすい病原性細菌は、主に腸内細菌科、ポルフィロモナド科、VeillonellaceaeおよびAlcaligenaceaeである。同時に、患者には、Lachonospiraceae、Ruminococcaceae、Blautiaなどの常在菌が減少している [28,37,79,80]。
HEは、不顕性変化から昏睡に至るまで、さまざまな精神神経系の問題を引き起こす可能性がある。HEは、主に腸-肝-脳軸の機能不全によって引き起こされるため、治療には通常、微生物叢の組成と機能を変えることが必要である [75,76]。HEが再発した結果、LC患者は標準治療にもかかわらず再入院のリスクが高くなる。これは、不可逆的な神経認知機能障害の一因となる可能性がある [4,81,82] 。ラクツロースやリファキシミンなどの非吸収性抗生物質のような従来の治療法に反応しない患者には、他の選択肢が必要かもしれない [76,83]。以前、FMTカプセルは、すでにラクチュロースやリファキシミンを服用しているHE罹患者の場合、認知機能の改善と入院の減少のための代替治療法であることがわかった [19,82]。認知機能の改善とドナーの粘膜や便への微生物叢の移行との間には相関関係があった [82]。HE患者では、これらを標準療法と併用することで、FMTは腸内細菌叢を調節することができる [37] 。FMTは、腸管バリアの完全性を回復させ、腸内細菌叢の変化を通じてアンモニアの腸への取り込みを減少させ、アンモニアクリアランスを減少させるために肝臓の機能を高めることによって、アンモニア産生を減少させるために用いることができる[78]。
8. LCにおけるFMTの影響
2015年にM. Grątらによって実施された研究では、肝移植前の候補者における腸内細菌叢異常の重要性に関する新たな情報を提供することを目的としていた。この研究では、FMTを受けた肝硬変患者40人が分析された。肝移植前の腸内細菌異常症を有する肝硬変患者では、ビフィドバクテリウムと腸球菌の量は関連しているにもかかわらず、腸球菌が肝移植前の腸内細菌異常症の最も影響力のある因子であった[31]。
再発性HEの男性に対する合理的由来の便ドナーの安全性を明らかにするため、2017年に無作為化非盲検臨床試験が実施された。HEを再発した肝硬変患者に対してFMTを実施したところ、入院の減少、認知機能の改善、およびディスバイオシスの減少が認められた[19]。
Philipsらによる2017年の別の研究では、アルコール性肝疾患を患う195人の患者を分析した。重度のアルコール性肝炎患者において、1週間のFMTは重症度と生存率を改善したという。この研究ではまた、手技の6~12ヵ月後にはドナーとレシピエントの種が共存していることが判明しており、この所見は2016年のLiらによっても確認されている[84,85]。
肝硬変患者の入院、予防的抗生物質投与、併存疾患は、CDIのリスクを増加させる [86]。抗生物質耐性の増加と抗生物質の不合理な使用は、世界的に重大な課題となっている。したがって、これらの薬剤の選択と使用には十分な根拠が必要である [87] 。Pringleらは2013年から2017年にかけて、LCが進行した再発性CDIに対して凍結FMTカプセルを投与した患者を対象に前向き研究を行った。研究者らは、再発性CDIを治癒させるためには、肝硬変患者において凍結経口FMTの投与回数を増やす必要があることを発見した[88]。
Mehtaらによる2018年のレトロスペクティブケースシリーズでは、1回のFMT治療で再発開腹HEを治療した。患者が特定した厳格なドナーからの糞便材料を用いて、25~65歳の患者10人が大腸内視鏡による単回FMTを受けた。治療後20週目に、6人の患者が1回のFMT治療を受けた後、持続的な臨床反応を示した[69]。
2019年にOlmedoらによって報告されたCDIを有するLCの症例は4例で、そのうちの3例は大腸内視鏡によるFMT処置を受け、1例は経鼻空腸チューブによるFMT処置を受けた。処置後、2人の患者が重篤な合併症に見舞われ、そのうちの1人は残念ながら死亡した。症例をより詳細に分析すると、死亡例で後に現れた胆管炎は単なる偶然であったようだ。FMTから生還した3例では、1ヵ月、5ヵ月、11ヵ月の継続追跡期間中、CDIの再発は見られなかった[17]。
Chengらによる2020年のレトロスペクティブ研究では、2012年から2018年の間にCDIのために大腸内視鏡検査によるFMTを受けたLCの成人63例を分析した。著者らは患者の人口統計学的情報を収集し、LC、CDI、FMTに関連する患者の特徴を調査し、LCの病期が異なる患者間で8週間後の患者の成功率を比較した[89]。これまで、非出血性CDI患者を対象としたメタアナリシスやシステマティックレビューでは、再発性CDIや治療抵抗性の重症CDIに対するFMTの成功率は同程度であると報告されていた[51,90,91]。このLC患者のコホートでは、感染症を含め、FMTに関連した重篤な有害事象の発生率は低かった。
TIPSまたは経頚静脈的肝内シャントは、門脈圧亢進症の合併症に対する最も効果的な治療法の一つとして確立されている。TIPSの術後合併症には、腹部出血、HE、心不全、非外科的感染症などがある。2021年に発表されたLiと共同研究者による論文では、TIPSを受けた2人のHE患者で肝機能が改善したことが示されている [92] 。表2は、肝硬変における糞便微生物叢移植の影響に関する文献からいくつかの主要な研究をまとめたものである。
表2. 肝硬変におけるF.M.T.の影響に関する研究
微生物叢の移植は、ウイルス感染による肝硬変患者、特にB型肝炎ウイルス感染患者を助ける可能性がある。Chauhanらは、十二指腸での移植後、B型肝炎e抗原(HBe抗原)のレベルが大幅に低下することを示した。さらに重要なことは、HBV感染患者においてDNAレベルの低下が観察されたことである [93]。
この他にも、アルコールが肝硬変の重大な原因のひとつであることはよく知られている。しかし、FMTは、少なくとも短期間はアルコールの必要性と使用量を減少させることによって、これらの患者にも利益をもたらす。長期的には、この悪習慣に関連した腹水形成、感染症、再発の減少が確認されている。標準的なステロイド治療に反応しない重症アルコール性肝炎患者にとって、FMTは有望な選択肢のようであり、将来のプロトコールにこの治療法が含まれるようになるかもしれない[97]。
9. 肝硬変と関連病態におけるFMT
肝硬変が単独の病態であることはほとんどなく、他の主要な疾患と共存していることは間違いない。その中で、糖尿病、高脂血症、動脈性高血圧を挙げることができるが、これらはすべて腸内細菌叢と相関がある。個人の病態がマイクロバイオームの構成にどのような影響を及ぼすかを調べた研究がいくつかある [98]。このような側面だけでなく、FMTはメタボリックシンドロームの改善にも大きな効果を示しており、肝硬変患者や肝硬変患者がこのような治療を受ける場合の利点となるであろう [99]。
J.S. Bajajらは、CDIにも罹患しているLC患者は治療に対してより抵抗性があり、より高用量が必要であることを強調しており、肝臓と腸の間に強い関連があることを示唆している [19] 。さらに、関連する病態では、微生物叢がさらに欠損し、微生物叢の移入が効果的でなくなる。炎症性腸疾患、黒色腫、大腸がん、パーキンソン病、多発性硬化症、さらにはCDIとSARS-CoV-2との関連[100,101,102]などの病態においても、有望な結果が観察されている(図2)。
Biomedicines 11 02930 g002図2. いくつかの主要な病態における糞便微生物叢移植の意味合い。
LCは肝細胞癌の危険因子であることがすでに証明されている。したがって、マイクロバイオームを修正することは、新生物の治療または予防のいずれかに利益をもたらす可能性がある。しかしながら、現在のところ、肝細胞がんに対する微生物叢の移植の効果が研究された具体的な症例は文献にない [103]。
10. NAFLD/NASHにおけるFMT
潜在的な肝硬変の前駆症状である肝脂肪症は、有病率が上昇している [104,105] 。このことは、移植が治療的手段としてだけでなく、予防的戦略としても機能し、それによって増大する医療費を抑制し、罹患者のQOLを向上させることができるかどうかについての考察を促している。注目すべきは、非アルコール性脂肪性肝疾患(NAFLD)、非アルコール性脂肪肝炎(NASH)、肝硬変、肝細胞がんなど、さまざまな病期を有する患者間で、ディスバイオーシスが顕著に異なることから、微生物のバランスを回復させることで、これらの病態を緩和したり、少なくともその進行を抑えたりする上で実質的な利益が得られる可能性があることである[106,107]。
2017年、Da Zhouはマウスモデルを用いて、高脂肪食によって誘発される脂肪肝炎の緩和における糞便微生物叢移植の有効性を立証した[108]。それから5年も経たない2022年、Lanfeng Xueらは、現在の文献の中でも間違いなく最もインパクトのある重要な臨床試験を実施し、NAFLDと診断された個体において、プロバイオティクスのみを摂取している個体と比較して、糞便微生物叢移植によってもたらされる具体的な利点を強調した[109]。この洗練された研究では、75人の参加者が登録され、そのうち47人が微生物叢移植を受けた。さらに、肝性脂肪症に関する肯定的な研究は、肝硬変患者における移植の成功にさらなる希望をもたらす可能性がある。
11. 考察と今後の展望
肝硬変におけるFMTの効果に関する臨床研究の数が増えているにもかかわらず、明確な答えのない多くの疑問が残っている。多施設臨床試験の必要性はこれまで以上に高まっている。文献に示された知見が一般化され、大規模な患者に適用できるかどうかを明らかにすることができるからである。このような試験を実施すれば、投与経路、最適なタイミング、移植材料の調製方法などに関連する限界に対処できるだけでなく、国際的なプロトコールの開発への道も開けるだろう。このプロトコールは、糞便微生物叢移植術に携わる臨床医に対して、医療法的保障を提供することができる。FMTに効果的に反応する肝疾患患者の類型についてはまだ不確定要素があり、Child-Turcotte-Pughスコアに基づく患者の反応率を分析する研究は重要な意義を持つだろう。分子生物学と細胞構造の相互作用の仕方は、近い将来、さらなる利益をもたらす可能性がある。このように、超解像蛍光顕微鏡とフェルスター共鳴エネルギー移動(FRET)は、生物学的システムの機能性を調査する能力を持ち、医学研究における将来の最も重要なツールの一つである [110,111] 。
FMTの安全性に関する懸念はかなり薄れてきており、FMTは満足のいく安全性と副作用の少ない治療法であると自信を持って言うことができる。特に、新しい投与方法とCDIに対するFMTの有意に高い有効性により、患者は治療へのコンプライアンスを高めており、このことは、患者にも、医療の進歩についてますます注意深く情報を得るようになっている個人にも楽観的な見方をもたらしている。
今後の研究により、微生物叢改変の長期的な効果に光が当てられることが期待され、FMTが肝不全の有効な治療法となり、生存率の向上や入院期間の短縮につながるかどうかが発見される可能性が高い。
12. 結論
糞便微生物叢移植は、肝硬変に対する将来の治療法の一つになる可能性が高い。肝脂肪症、B型肝炎ウイルスのウイルス感染、その他の重要な病態において、この治療法の真の有益性を示す具体的な研究が存在することは、進行した肝線維症の予防に貢献する可能性がある。確立された肝硬変におけるFMTのポジティブな効果に関する文献研究は、まだ完全には説得力がなく、新しい治療プロトコルを策定するための大規模な患者群に関する十分な研究が不足しているが、入手可能なデータ、特に腸と肝臓のつながりに関するデータは、この先駆的な治療法が有望であることを示唆している。今後数年のうちに、肝硬変治療へのアプローチに革命を起こす可能性がある。
医学研究の進歩の中で、糞便微生物叢移植を探求する多施設臨床試験に乗り出す研究者の意欲を高めることは、革新的な治療法の開発を促進するだけでなく、肝硬変とその関連疾患の分野における専門的文献の深さと重要性を高めることにもなるであろう。
著者貢献
構想: A.B.、V.B.、C.I.、データキュレーション: データキュレーション:A.B.、V.B.、C.I.: 形式分析:A.B.、V.B.、C.I.: 調査:A.B.とC.I.、方法論: 方法論:A.B.とV.B.、資源:A.B.とC.I: リソース:A.B.とC.I.、監督:A.B.とC.I: 監督:A.B.、C.I.、O.B.、D.M.O.、検証: A.B.、V.B.、C.I.、O.B.およびD.M.O.、執筆-原案: 原案執筆:A.B.、V.B.、C.I.: 著者全員が本原稿を読み、掲載版に同意した。
資金提供
本研究は、研究・イノベーション・デジタル化省より、プログラム1-国家研究開発システムの開発、サブプログラム1.2-研究開発における卓越した資金調達のための機関業績-プロジェクト、契約番号28PFE/30.12.2021の助成を受けた。シビウ大学ルシアン・ブラガ。
インフォームド・コンセント
該当なし。
データ利用声明
該当なし。
利益相反
両著者とも開示すべき利益相反はない。
参考文献
Lechner, S.; Yee, M.; Limketkai, B.N.; Pham, E.A. 慢性肝疾患に対する糞便微生物叢移植: 現在の理解と今後の方向性。Dig. Dig. Dis. Sci. 2020, 65, 897-905. [Google Scholar] [CrossRef].
Devarbhavi, H.; Asrani, S.K.; Arab, J.P.; Nartey, Y.A.; Pose, E.; Kamath, P.S. Global Burden of Liver Disease: 2023年最新版。J. Hepatol. 2023, 79, 516-537. [Google Scholar] [CrossRef].
肝疾患における糞便微生物移植の臨床応用と進歩: A Review. Semin. Liver Dis. 2021, 41, 495-506. [Google Scholar] [CrossRef].
Woodhouse, C.A.; Patel, V.C.; Singanayagam, A.; Shawcross, D.L. 総説: The Gut Microbiome as a Therapeutic Target in the Pathogenesis and Treatment of Chronic Liver Disease. Aliment. Pharmacol. Ther. 2018, 47, 192-202. [Google Scholar] [CrossRef].
Reuter, B.; Bajaj, J.S. Microbiome. Clin. Liver Dis. 2020, 24, 493-520. [Google Scholar] [CrossRef].
Suk, K.T.; Koh, H. 肝疾患における糞便微生物叢移植の新たな展望。J. Gastro Hepatol. 2022, 37, 24-33. [Google Scholar] [CrossRef].
Song, E.-J.; Shin, J.-H. 健康維持のターゲットとしての腸内細菌叢に基づく個別化食: 現在のエビデンスから将来の可能性まで。J. Microbiol. Biotechnol. 2022, 32, 1497-1505. [Google Scholar] [CrossRef].
Ponziani, F.R.; Scaldaferri, F.; Petito, V.; Paroni Sterbini, F.; Pecere, S.; Lopetuso, L.R.; Palladini, A.; Gerardi, V.; Masucci, L.; Pompili, M.; et al. 腸内細菌叢調節における抗生物質の役割: リファキシミンのユビオティック効果。Dig. Dis. 2016, 34, 269-278. [Google Scholar] [CrossRef].
Azcarate-Peril, M.A. 腸内マイクロバイオームの有益な調節: プロバイオティクスとプレバイオティクス。In How Fermented Foods Feed a Healthy Gut Microbiota; Azcarate-Peril, M.A., Arnold, R.R., Bruno-Bárcena, J.M., Eds.; Springer International Publishing: Cham, Switzerland, 2019; pp.309-324. ISBN 978-3-030-28736-8. [Google Scholar].
Georgiou, K.; Belev, N.A.; Koutouratsas, T.; Katifelis, H.; Gazouli, M. 腸内マイクロバイオーム: 肥満、肥満手術、および関連する臨床転帰を一つの焦点のもとに結びつける。WJGP 2022, 13, 59-72. [Google Scholar] [CrossRef].
Gentile, J.K.A.; Oliveira, K.D.; Pereira, J.G.; Tanaka, D.Y.; Guidini, G.N.; Cadona, M.Z.; Siriani-Ribeiro, D.W.; Perondini, M.T. 肥満手術を受けた患者における腸内マイクロバイオーム: システマティックレビュー。ABCD Arq。Bras. Cir. Dig. 2022, 35, e1707. [Googleスカラー] [Ref]。
Tandon, P.; Berzigotti, A. 肝硬変患者における生活習慣要因の管理: A Pragmatic Review. Semin. Liver Dis. 2020, 40, 020-028. [Google Scholar] [CrossRef].
原子間力顕微鏡と光ピンセットによるソフトマター・ナノメカニクスの研究: A Comprehensive Review. Nanomaterials 2023, 13, 963. [Google Scholar] [CrossRef].
Guixé-Muntet、S; Ortega-Ribera、M; Wang、C; Selicean、S; Andreu、I; Kechagia、J.Z; Fondevila、C; Roca-Cusachs、P; Dufour、J.-F; Bosch、J; et al. 核変形は肝硬変における肝細胞のメカノセンシングを媒介する。JHEP Rep. 2020, 2, 100145. [Google Scholar] [CrossRef].
Lu,L.G.B型肝炎ウイルス感染肝硬変の抗ウイルス療法.JCTH 2014, 2, 197. [Google Scholar] [Ref]。
ジャクソン、W.E.;マラモン、J.S.;カプラン、B.;サベン、J.L.;ショルド、J.D.;ポンポセリ、J.J.;ポンフレット、E.A.生体肝移植の生存利益。JAMA Surg. 2022, 157, 926. [Google Scholar] [CrossRef]。
肝硬変患者の再発性クロストリジウム・ディフィシル感染に対して糞便微生物叢移植を行うことは妥当か?J. Infect. Dis. Ther. 2018, 6, 384. [Google Scholar】【Ref
Bakken, J.S.; Borody, T.; Brandt, L.J.; Brill, J.V.; Demarco, D.C.; Franzos, M.A.; Kelly, C.; Khoruts, A.; Louie, T.; Martinelli, L.P.; et al. 糞便微生物叢移植によるクロストリジウム・ディフィシル感染症の治療。Clin. Gastroenterol. Hepatol. 2011, 9, 1044-1049. [Google Scholar] [CrossRef].
Bajaj, J.S.; Kassam, Z.; Fagan, A.; Gavis, E.A.; Liu, E.; Cox, I.J.; Kheradman, R.; Heuman, D.; Wang, J.; Gurry, T.; et al. 合理的な便ドナーからの糞便微生物叢移植は肝性脳症を改善する: 無作為化臨床試験。Hepatology 2017, 66, 1727-1738. [Google Scholar] [CrossRef].
Van Nood, E.; Vrieze, A.; Nieuwdorp, M.; Fuentes, S.; Zoetendal, E.G.; De Vos, W.M.; Visser, C.E.; Kuijper, E.J.; Bartelsman, J.F.W.M.; Tijssen, J.G.P.; et al. 再発性クロストリジウム・ディフィシルに対するドナー糞便の十二指腸注入。N. Engl. 2013, 368, 407-415. [Google Scholar] [Ref]。
Moayyedi、P.;Surette、M.G.;Kim、P.T.;Libertucci、J.;Wolfe、M.;Onischi、C.;Armstrong、D.;Marshall、J.K.;Kassam、Z.;Reinisch、W.;ら、無作為化対照試験において、活動性潰瘍性大腸炎患者における糞便微生物叢移植は寛解を誘導する。Gastroenterology 2015, 149, 102-109.e6. [Google Scholar] [CrossRef].
Popa, D.; Neamtu, B.; Mihalache, M.; Boicean, A.; Banciu, A.; Banciu, D.D.; Moga, D.F.C.; Birlutiu, V. Fecal Microbiota Transplant in Severe and Non-Severe Clostridioides Difficile Infection. 一次性重症CDIにおけるFMTの役割はあるか?Jcm 2021, 10, 5822. [Google Scholar] [CrossRef] [PubMed].
Crothers、J.W.、Chu、N.D.、Nguyen、L.T.T.、Phillips、M.、Collins、C.、Fortner、K.、Del Rio-Guerra、R.、Lavoie、B.、Callas、P.、Velez、M.、他 潰瘍性大腸炎における長期維持療法としての毎日経口FMT: 単施設、前向き、無作為化パイロット試験の結果。BMC Gastroenterol. 2021, 21, 281. [Google Scholar] [CrossRef] [PubMed].
FMT-standardization Study Group; Zhang, F.; Cui, B.; He, X.; Nie, Y.; Wu, K.; Fan, D. Microbiota Transplantation: 概念、方法論、およびその近代化のための戦略。Protein Cell 2018, 9, 462-473. [Google Scholar] [CrossRef].
Khoruts, A.; Sadowsky, M.J.; Hamilton, M.J. Development of Fecal Microbiota Transplantation Suitable for Mainstream Medicine. Clin. Gastroenterol. Hepatol. 2015, 13, 246-250. [Google Scholar] [CrossRef] [PubMed].
Bajaj, J.S.; Khoruts, A. Microbiota Changes and Intestinal Microbiota Transplantation in Liver Diseases and Cirrhosis. J. Hepatol. 2020, 72, 1003-1027. [Google Scholar] [CrossRef].
Boicean, A.; Birlutiu, V.; Ichim, C.; Anderco, P.; Birsan, S. 炎症性腸疾患における糞便微生物叢移植。Biomedicines 2023, 11, 1016. [Google Scholar] [CrossRef]。
Schnabl, B.; Brenner, D.A. Interactions Between the Intestinal Microbiome and Liver Diseases. Gastroenterology 2014, 146, 1513-1524. [Google Scholar] [CrossRef].
Bajaj, J.S. Alcohol, Liver Disease and the Gut Microbiota. Nat. Rev. Gastroenterol. Hepatol. 2019, 16, 235-246. [Google Scholar] [CrossRef].
Badal, V.D.; Vaccariello, E.D.; Murray, E.R.; Yu, K.E.; Knight, R.; Jeste, D.V.; Nguyen, T.T. The Gut Microbiome, Aging, and Longevity: 系統的レビュー。Nutrients 2020, 12, 3759. [Google Scholar] [CrossRef].
Grąt, M.; Hołówko, W.; Wronka, K.M.; Grąt, K.; Lewandowski, Z.; Kosińska, I.; Krasnodębski, M.; Wasilewicz, M.; Gałęcka, M.; Szachta, P.; et al. The Relevance of Intestinal Dysbiosis in Liver Transplant Candidates. Transpl. Infect. Dis. 2015, 17, 174-184. [Google Scholar] [CrossRef].
腸内細菌叢と疾患パラダイムにおける病態生理学。Dig. Dis. 2011, 29, 518-524. [Google Scholar] [CrossRef] [PubMed].
Harris、K.; Kassis、A.; Major、G.; Chou、C.J. Is the Gut Microbiota a New Factor Contributing to Obesity and Its Metabolic Disorders? J. Obes. 2012, 2012, 1-14. [Google Scholar】【CrossRef
Fleckenstein, J.M.; Kopecko, D.J. Stealthによる粘膜バリア突破: An Emerging Pathogenic Mechanism for Enteroadherent Bacterial Pathogens. J. Clin. Investig. 2001, 107, 27-30. [Google Scholar] [CrossRef].
Ponce De León-Rodríguez, M.D.C.; Guyot, J.-P.; Laurent-Babot, C. Intestinal in Vitro Cell Culture Models and Their Potential to Study the Effect of Food Components on Intestinal Inflammation. Crit. Rev. Food Sci. Nutr. 2019, 59, 3648-3666. [Google Scholar] [CrossRef] [PubMed].
Hong、A.S.;Tun、K.M.;Hong、J.M.;Batra、K.;Ohning、G. Decompensated Cirrhosisにおける糞便微生物叢移植: 安全性と有効性に関する系統的レビュー。Antibiotics 2022, 11, 838. [Google Scholar] [CrossRef] [PubMed].
HBV感染またはその他の慢性肝疾患患者における糞便微生物移植: 最新の知見と今後の展望。JCM 2021, 10, 2605. [Google Scholar] [CrossRef].
自閉症スペクトラムにおける腸内細菌叢とディスバイオシス。Curr. Neurol. Neurosci. Rep. 2018, 18, 81. [Google Scholar] [CrossRef].
Sampson, T.R.; Debelius, J.W.; Thron, T.; Janssen, S.; Shastri, G.G.; Ilhan, Z.E.; Challis, C.; Schretter, C.E.; Rocha, S.; Gradinaru, V.; et al. 腸内細菌叢はパーキンソン病モデルにおける運動障害と神経炎症を制御する。Cell 2016, 167, 1469-1480.e12. [Google Scholar] [CrossRef].
Kumar、A.; Pramanik、J.; Goyal、N.; Chauhan、D.; Sivamaruthi、B.S.; Prajapati、B.G.; Chaiyasut、C. 不安とうつ病における腸内細菌叢: 関係性と管理オプションの解明。Pharmaceuticals 2023, 16, 565. [Google Scholar] [CrossRef].
Preiningerova, J.L.; Jiraskova Zakostelska, Z.; Srinivasan, A.; Ticha, V.; Kovarova, I.; Kleinova, P.; Tlaskalova-Hogenova, H.; Kubala Havrdova, E. 多発性硬化症とマイクロバイオーム。Biomolecules 2022, 12, 433. [Google Scholar] [CrossRef]。
Versace, S.; Pellitteri, G.; Sperotto, R.; Tartaglia, S.; Da Porto, A.; Catena, C.; Gigli, G.L.; Cavarape, A.; Valente, M. A State-of-Art Review of the Vicious Circle of Sleep Disorders, Diabetes and Neurodegeneration Involving Metabolism and Microbiota Alterations. Int. J. Mol. Sci. 2023, 24, 10615. [Google Scholar] [CrossRef] [PubMed].
クルクミンと糞便微生物叢移植の併用療法: 多嚢胞性卵巣症候群の治療の可能性。Med. Hypotheses 2021, 154, 110644. [Google Scholar] [CrossRef] [PubMed].
Bastos、R.M.C.; Simplício-Filho、A.; Sávio-Silva、C.; Oliveira、L.F.V.; Cruz、G.N.F.; Sousa、E.H.; Noronha、I.L.; Mangueira、C.L.P.; Quaglierini-Ribeiro、H. Josefi-Rocha, G.R.; et al. 2型糖尿病、肥満、糖尿病性腎臓病の前臨床モデルにおける糞便微生物叢移植(Fecal Microbiota Transplant in a Pre-Clinical Model of Type 2 Diabetes Mellitus, Obesity and Diabetic Kidney Disease)。Int. J. Mol. Sci. 2022, 23, 3842. [Google Scholar] [CrossRef] [PubMed].
肝硬変および門脈圧亢進症の病態における腸肝軸の役割. Clin. Mol. Hepatol. 2012, 18, 337. [Google Scholar] [CrossRef] [PubMed].
肝疾患における微生物-肝軸: Chassaing、Etienne-Mesmin、Gewirtz。Hepatology 2014, 59, 328-339. [Google Scholar] [CrossRef].
Corrie、L.; Awasthi、A.; Kaur、J.; Vishwas、S.; Gulati、M.; Kaur、I.P.; Gupta、G.; Kommineni、N.; Dua、K.; Singh、S.K. 多嚢胞性卵巣症候群における腸内細菌叢の相互作用: 多嚢胞性卵巣症候群における腸内細菌叢の相互作用:腸内細菌叢の役割、機序経路および潜在的治療戦略。Pharmaceuticals 2023, 16, 197. [Google Scholar] [CrossRef].
Afecto, E.; Ponte, A.; Fernandes, S.; Silva, J.; Gomes, C.; Correia, J.; Carvalho, J. 肝性脳症における糞便微生物叢移植: 現在のエビデンスのレビューと今後の展望。Acta Gastro-Enterol. ベルギー。2021, 84, 87-90. [Google Scholar] [CrossRef].
肝硬変における微生物叢と肝硬変におけるその役割。J. Hepatol. 2021, 75, s67-s81。[Google Scholar] [CrossRef].
このような臨床研究は、肝硬変の治療において、肝硬変と肝硬変の両方の病態が関与していることを示唆している: 無作為化非盲検対照パイロット試験。Clin. Infect. Dis. 2014, 58, 1515-1522. [Google Scholar] [CrossRef].
Kassam、Z.; Lee、C.H.; Yuan、Y.; Hunt、R.H. クロストリジウム・ディフィシル感染症に対する糞便微生物叢移植: 系統的レビューとメタアナリシス。Am. J. Gastroenterol. 2013, 108, 500-508. [Google Scholar] [Ref]。
Gulati, M.; Singh, S.K.; Corrie, L.; Kaur, I.P.; Chandwani, L. 便微生物移植の送達経路: 利用可能な、予想される、そして期待される。Pharmacol. Res.2020、159、104954。[Google Scholar] [CrossRef] [PubMed].
多糖類、糞便微生物叢、クルクミンをベースとした新規経口大腸標的自己乳化固体デリバリーシステム: 製剤化、キャラクタリゼーション、およびin-Vitro抗がん評価。Mater. Today Chem. 2022, 26, 101165. [Google Scholar] [CrossRef].
FDA Approves Vowst, the First Oral Live Microbiota Treatment for rCDI. Hcplive. 26 April 2023. Available online: https://www.hcplive.com/view/fda-approves-ser-109-first-oral-live-microbiota-treatment-rcdi (accessed on 25 October 2023).
Kim, S.Y.; Kim, H.-S.; Park, H.J. 大腸内視鏡検査に関連する有害事象: 世界的傾向と今後の課題。World J. Gastroenterol. 2019, 25, 190-204. [Google Scholar] [CrossRef] [PubMed].
Michailidis, L. 便微生物移植の有害事象: 便微生物移植の有害事象:質の高い研究のメタアナリシス。Aog 2021, 34, 1-13. [Google Scholar] [CrossRef].
経口糞便微生物叢移植カプセルは、再発性クロストリジウム・ディフィシル感染症に対して安全かつ有効である: A Systematic Review and Meta-Analysis. J. Clin. Gastroenterol. 2021, 55, 300-308. [Google Scholar] [Ref]。
再発性クロストリジウム・ディフィシル感染症に対する経口凍結便微生物移植(FMT)カプセル。BMC Med. 2016, 14, 134. [Googleスカラー] [Ref]。
再発性クロストリジウム・ディフィシル感染症に対する糞便微生物叢移植のための標準化された冷凍製剤。Am. J. Gastroenterol. 2012, 107, 761-767. [Googleスカラー] [Ref]。
Damman, C.J.; Miller, S.I.; Surawicz, C.M.; Zisman, T.L. Microbiome and Inflammatory Bowel Disease: 糞便微生物叢移植に治療的役割はあるか?Am. J. Gastroenterol. 2012, 107, 1452-1459. [Google Scholar] [CrossRef].
Bibbò, S.; Settanni, C.R.; Porcari, S.; Bocchino, E.; Ianiro, G.; Cammarota, G.; Gasbarrini, A. 糞便微生物移植: 最適なドナーを選択するためのスクリーニングと選択。J. Clin. Med. 2020, 9, 1757. [Google Scholar] [CrossRef].
Woodworth、M.H.;Carpentieri、C.;Sitchenko、K.L.;Kraft、C.S.便ドナーの選択と糞便微生物叢移植のスクリーニングにおける課題: 総説。Gut Microbes 2017, 8, 225-237. [Google Scholar] [CrossRef].
Edelstein, C.; Daw, J.R.; Kassam, Z. 安全な便を求めて: Canada Needs a Universal Donor Model. cmaj 2016, 188, e431-e432. [Google Scholar] [CrossRef] [PubMed].
MacLellan, A.D.; Finlay, B.B.; Appel-Cresswell, S. Age-Matching in Pediatric Fecal Matter Transplants. Front. Pediatr. [Google Scholar] [CrossRef] [PubMed].
Van Nood, E.; Speelman, P.; Nieuwdorp, M.; Keller, J. 糞便微生物移植: 事実と論争。Curr. Opin. Gastroenterol. 2014, 30, 34-39. [Google Scholar] [CrossRef].
Wang, Z.-K. Intestinal Microbiota Pathogenesis and Fecal Microbiota Transplantation for Inflammatory Bowel Disease. World J. Gastroenterol. WJG 2014, 20, 14805. [Google Scholar] [CrossRef] [PubMed].
Park, S.-Y.; Seo, G.S. Fecal Microbiota Transplantation: 安全か?Clin. Endosc. 2021, 54, 157-160. [Google Scholar] [CrossRef].
Merrick、B.; Allen、L.; Masirah M Zain、N.; Forbes、B.; Shawcross、D.L.; Goldenberg、S.D. 糞便微生物移植の規制、リスクおよび安全性。Infect. Prev. Pract. 2020, 2, 100069. [Google Scholar] [CrossRef].
Mehta、R; Kabrawala、M; Nandwani、S; Kalra、P; Patel、C; Desai、P; Parekh、K. 再発性顕性肝性脳症の治療に対する単回糞便微生物叢移植の予備的経験-症例シリーズ。Indian. J. Gastroenterol. 2018, 37, 559-562. [Google Scholar] [CrossRef].
Albillos, A.; De Gottardi, A.; Rescigno, M. The Gut-Liver Axis in Liver Disease: The Gut-Liver Axis in Liver Disease: Pathophysiological Basis for Therapy. J. Hepatol. 2020, 72, 558-577. [Google Scholar] [CrossRef].
Cheemerla、S.; Balakrishnan、M. 慢性肝疾患の世界疫学。Clin. Liver Dis. 2021, 17, 365-370. [Google Scholar] [CrossRef].
Tsochatzis, E.A.; Bosch, J.; Burroughs, A.K. Liver Cirrhosis. Lancet 2014, 383, 1749-1761. [Google Scholar] [CrossRef].
D'Amico, G.; Garcia-Tsao, G.; Pagliaro, L. 肝硬変の自然史と生存の予後指標: 118の研究の系統的レビュー。J. Hepatol. 2006, 44, 217-231. [Google Scholar] [CrossRef] [PubMed].
肝硬変患者における肝性脳症およびClostridioides Difficile感染症の治療における糞便微生物叢移植の有効性および安全性に関する系統的レビュー。Cureus 2022, 14, e25537. [Google Scholar] [CrossRef] [PubMed].
慢性肝疾患と微生物-腸内細菌叢の知識を慢性肝疾患の管理に生かす-.Gastroenterology 2021, 160, 556-572. [Google Scholar] [CrossRef] [PubMed].
Vilstrup, H.; Amodio, P.; Bajaj, J.; Cordoba, J.; Ferenci, P.; Mullen, K.D.; Weissenborn, K.; Wong, P. 慢性肝疾患における肝性脳症: 米国肝臓病学会および欧州肝臓学会による2014年診療ガイドライン。Hepatology 2014, 60, 715-735. [Google Scholar] [CrossRef].
Tranah, T.H.; Vijay, G.K.M.; Ryan, J.M.; Shawcross, D.L. Systemic Inflammation and Ammonia in Hepatic Encephalopathy. Metab. Brain Dis. 2013, 28, 1-5. [Google Scholar] [CrossRef].
Madsen, M.; Kimer, N.; Bendtsen, F.; Petersen, A.M. 肝性脳症における糞便微生物叢移植: 系統的レビュー。Scand. J. Gastroenterol. 2021, 56, 560-569. [Google Scholar] [CrossRef].
肝硬変における腸内細菌叢による糞便中胆汁酸プロファイルの調節。J. Hepatol. 2013, 58, 949-955. [Google Scholar] [CrossRef].
肝硬変における腸内細菌叢関連合併症。World J. Gastroenterol. WJG 2014, 20, 15624. [Google Scholar] [CrossRef].
Bajaj, J.S.; Reddy, K.R.; Tandon, P.; Wong, F.; Kamath, P.S.; Garcia-Tsao, G.; Maliakkal, B.; Biggins, S.W.; Thuluvath, P.J.; Fallon, M.B.; et al. The 3-month Readmission Rate Remains Unacceptably High in a Large North American Cohort with Cirrhosis. Hepatology 2016, 64, 200-208. [Google Scholar] [CrossRef].
Bajaj, J.S.; Salzman, N.H.; Acharya, C.; Sterling, R.K.; White, M.B.; Gavis, E.A.; Fagan, A.; Hayward, M.; Holtz, M.L.; Matherly, S.; et al. 便微生物移植カプセルは肝性脳症において安全である: 第1相、無作為化、プラセボ対照試験。Hepatology 2019, 70, 1690-1703. [Google Scholar] [CrossRef].
Bajaj, J.S.; Salzman, N.; Acharya, C.; Takei, H.; Kakiyama, G.; Fagan, A.; White, M.B.; Gavis, E.A.; Holtz, M.L.; Hayward, M.; et al. Microbial Functional Change Is Linked with Clinical Outcomes after Capsular Fecal Transplant in Cirrhosis. JCI Insight 2019, 4, e133410. [Google Scholar] [CrossRef] [PubMed].
Philips, C.A.; Pande, A.; Shasthry, S.M.; Jamwal, K.D.; Khillan, V.; Chandel, S.S.; Kumar, G.; Sharma, M.K.; Maiwall, R.; Jindal, A.; et al. ステロイド不適格重症アルコール性肝炎における健康ドナー糞便微生物移植: パイロット研究。Clin. Gastroenterol. Hepatol. 2017, 15, 600-602. [Google Scholar] [CrossRef] [PubMed].
Li,S.S.;Zhu,A.;Benes,V.;Costea,P.I.;Hercog,R.;Hildebrand,F.;Huerta-Cepas,J.;Nieuwdorp,M.;Salojärvi,J.;Voigt,A.Y.;他。 糞便微生物叢移植後のドナー株とレシピエント株の耐久性のある共存。Science 2016, 352, 586-589. [Google Scholar] [CrossRef].
Trifan, A.; Stoica, O.; Stanciu, C.; Cojocariu, C.; Singeap, A.-M.; Girleanu, I.; Miftode, E. 肝疾患患者におけるクロストリジウム・ディフィシル感染症: A Review. Eur. J. Clin. Microbiol. Infect. Dis. 2015, 34, 2313-2324. [Google Scholar] [CrossRef].
Vintila, B.I.; Arseniu, A.M.; Butuca, A.; Sava, M.; Bîrluțiu, V.; Rus, L.L.; Axente, D.D.; Morgovan, C.; Gligor, F.G. Adverse Drug Reactions Relevant to Drug Resistance and Ineffectiveness Associated with Meropenem, Linezolid, and Colistin: An Analysis Based on Spontaneous Reports from the European Pharmacovigilance Database. Antibiotics 2023, 12, 918. [Google Scholar] [CrossRef].
肝硬変患者の難治性・再発性クロストリジウム・ディフィシル感染症の治療には、より多くの糞便微生物カプセルを必要とする。Clin. Gastroenterol. Hepatol. 2019, 17, 791-793. [Google Scholar] [CrossRef].
Cheng,Y.-W.;Alhaffar,D.;Saha,S.;Khanna,S.;Bohm,M.;Phelps,E.;Ghabril,M.;Orman,E.;Sashidhar,S.;Rogers,N.;他。 クロストリジオイデス(Clostridioides Difficile)感染症および肝硬変患者における糞便微生物叢移植は安全かつ有効である。Clin. Gastroenterol. Hepatol. 2021, 19, 1627-1634. [Google Scholar] [CrossRef] [PubMed].
クロストリジウム・ディフィシル感染症治療のための糞便微生物叢移植後の早期失敗の予測因子(多施設共同研究):Fischer, M.; Kao, D.; Mehta, S.R.; Martin, T.; Dimitry, J.; Keshteli, A.H.; Cook, G.K.; Phelps, E.; Sipe, B.W.; Xu, H.; et al: 多施設共同研究。Am. J. Gastroenterol. 2016, 111, 1024-1031. [Google Scholar】【Ref
Ianiro, G.; Valerio, L.; Masucci, L.; Pecere, S.; Bibbò, S.; Quaranta, G.; Posteraro, B.; Currò, D.; Sanguinetti, M.; Gasbarrini, A.; et al. クロストリジウム・ディフィシル感染症再発患者における単回糞便微生物叢移植後の失敗の予測因子: 3年間の単一施設コホート研究の結果。Clin. Microbiol. Infect. 2017, 23, 337.e1-337.e3. [Google Scholar] [CrossRef].
Li, J.; Wang, D.; Sun, J. Application of Fecal Microbial Transplantation in Hepatic Encephalopathy after Transjugular Intrahepatic Portosystemic Shunt. Medicine 2022, 101, e28584. [Google Scholar] [CrossRef].
Chauhan, A.; Kumar, R.; Sharma, S.; Mahanta, M.; Vayuuru, S.K.; Nayak, B.; Kumar, S. B型慢性肝炎患者におけるシャリマー糞便微生物移植: パイロット研究。Dig. Dig. Dis. Sci. 2021, 66, 873-880. [Google Scholar] [CrossRef] [PubMed].
Huang, D.Q.; Mathurin, P.; Cortez-Pinto, H.; Loomba, R. Alcohol-Associated Cirrhosis and HCC: 傾向、予測、危険因子。Nat. Rev. Gastroenterol. Hepatol. 2023, 20, 37-49. [Google Scholar] [CrossRef] [PubMed].
Bajaj,J.S.、Gavis,E.A.、Fagan,A.、Wade,J.B.、Thacker,L.R.、Fuchs,M.、Patel,S.、Davis,B.、Meador,J.、Puri,P.、他。 アルコール使用障害に対する糞便微生物叢移植の無作為臨床試験。Hepatology 2021, 73, 1688-1700. [Google Scholar] [CrossRef] [PubMed].
Philips、C.A.;Ahamed、R.;Rajesh、S.;Abduljaleel、J.K.P.;Augustine、P. アルコール関連肝炎における便移植の長期成績-臨床成績、再発、腸内細菌叢および標準治療との比較の解析-。J. Clin. Exp. Hepatol. 2022, 12, 1124-1132. [Google Scholar] [CrossRef] [PubMed].
Shasthry, S.M. アルコール関連肝疾患における糞便微生物叢移植. Clin. Mol. Hepatol. 2020, 26, 294-301. [Google Scholar] [CrossRef] [PubMed].
日本人の腸内細菌叢の変化は高血圧、高脂血症、2型糖尿病と関連する。ニュートリエンツ2020, 12, 2996. [Google Scholar] [CrossRef].
De Groot, P.F.; Frissen, M.N.; De Clercq, N.C.; Nieuwdorp, M. Fecal Microbiota Transplantation in Metabolic Syndrome: History, Present and Future. Gut Microbes 2017, 8, 253-267. [Google Scholar] [CrossRef].
Boicean、A.; Bratu、D.; Bacila、C.; Tanasescu、C.; Fleacă、R.S.; Mohor、C.I.; Comaniciu、A.; Băluță、T.; Roman、M.D.; Chicea、R.; et al. 消化器疾患および新生物における微生物叢移植の治療的展望-文献レビュー。Pathogens 2023, 12, 766. [Google Scholar] [CrossRef].
Gupta, S.; Allen-Vercoe, E.; Petrof, E.O. 糞便微生物叢移植: In Perspective. Ther. Adv. Gastroenterol. 2016, 9, 229-239. [Google Scholar] [CrossRef].
Boicean、A.; Neamtu、B.; Birsan、S.; Batar、F.; Tanasescu、C.; Dura、H.; Roman、M.D.; Hașegan、A.; Bratu、D.; Mihetiu、A.; et al. SARS-CoV2とClostridioides Difficileに共同感染した患者における糞便微生物叢移植。Google Scholar] [CrossRef].
肝疾患における糞便微生物移植の研究進展。J. Clin. Med. 2023, 12, 1683. [Google Scholar] [CrossRef] [PubMed].
Estes, C.; Razavi, H.; Loomba, R.; Younossi, Z.; Sanyal, A.J. Modeling the Epidemic of Nonalcoholic Fatty Liver Disease Demonstrates an Exponential Increase in Burden of Disease. Hepatology 2018, 67, 123-133. [Google Scholar] [CrossRef] [PubMed].
Del Barrio, M.; Lavín, L.; Santos-Laso, Á.; Arias-Loste, M.T.; Odriozola, A.; Rodriguez-Duque, J.C.; Rivas, C.; Iruzubieta, P.; Crespo, J. Faecal Microbiota Transplantation, Paving the Way to Treat Non-Alcoholic Fatty Liver Disease. Int. J. Mol. Sci. 2023, 24, 6123. [Google Scholar] [CrossRef].
Abenavoli、L.; Maurizi、V.; Rinninella、E.; Tack、J.; Di Berardino、A.; Santori、P.; Rasetti、C.; Procopio、A.C.; Boccuto、L.; Scarpellini、E. NAFLD治療における糞便微生物叢移植。Medicina 2022, 58, 1559. [Google Scholar] [CrossRef]。
Boursier, J.; Mueller, O.; Barret, M.; Machado, M.; Fizanne, L.; Araujo-Perez, F.; Guy, C.D.; Seed, P.C.; Rawls, J.F.; David, L.A.; et al. The Severity of Nonalcoholic Fatty Liver Disease Is Associated with Gut Dysbiosis and Shift in the Metabolic Function of the Gut Microbiota. Hepatology 2016, 63, 764-775. [Google Scholar] [CrossRef].
Zhou, D.; Pan, Q.; Shen, F.; Cao, H.; Ding, W.; Chen, Y.; Fan, J. Total Fecal Microbiota Transplantation Alleviates High-Fat Diet-Induced Steatohepatitis in Mice via Beneficial Regulation of Gut Microbiota. Sci. Rep. 2017, 7, 1529. [Google Scholar] [CrossRef].
Xue, L.; Deng, Z.; Luo, W.; He, X.; Chen, Y. Effect of Fecal Microbiota Transplantation on Non-Alcoholic Fatty Liver Disease: 無作為臨床試験。Front. Cell. Infect. Microbiol. 2022, 12, 759306. [Google Scholar] [CrossRef].
Armingol, E.; Officer, A.; Harismendy, O.; Lewis, N.E. Deciphering Cell-Cell Interactions and Communication from Gene Expression. Nat. Rev. Genet. 2021, 22, 71-88. [Google Scholar] [CrossRef].
Szalai, A.M.; Zaza, C.; Stefani, F.D. 超解像FRET測定。Nanoscale 2021, 13, 18421-18433. [Google Scholar] [CrossRef].
免責事項/発行者注:すべての出版物に含まれる声明、意見およびデータは、著者および寄稿者個人のものであり、MDPIおよび/または編集者のものではありません。MDPIおよび/または編集者は、コンテンツで言及されたアイデア、方法、指示、製品に起因する人または財産の損害について、一切の責任を負いません。
著者による© 2023。ライセンシー MDPI, Basel, Switzerland. 本論文は、クリエイティブ・コモンズ 表示(CC BY)ライセンス(https://creativecommons.org/licenses/by/4.0/)の条項および条件の下で配布されるオープンアクセス論文である。
共有と引用
MDPIおよびACSスタイル
Boicean, A.; Birlutiu, V.; Ichim, C.; Brusnic, O.; Onișor, D.M. 肝硬変における糞便微生物叢移植。Biomedicines 2023, 11, 2930. https://doi.org/10.3390/biomedicines11112930
AMAスタイル
Boicean A, Birlutiu V, Ichim C, Brusnic O, Onișor DM. 肝硬変における糞便微生物叢移植。Biomedicines. 2023; 11(11):2930. https://doi.org/10.3390/biomedicines11112930
シカゴ/トゥラビアンスタイル
Boicean, Adrian, Victoria Birlutiu, Cristian Ichim, Olga Brusnic, and Danusia Maria Onișor. 2023. "Fecal Microbiota Transplantation in Liver Cirrhosis" Biomedicines 11, no. 11: 2930. https://doi.org/10.3390/biomedicines11112930
他のスタイルを探す
出版社名、ジャーナル名、書式名を入力してください
なお、2016年創刊号より、本誌はページ番号の代わりに論文番号を使用しています。詳細はこちらをご覧ください。
論文指標
引用
この記事の引用は見つかりませんでしたが、Google Scholarで確認することができます。
論文アクセス統計
記事アクセス統計
記事閲覧数
30. 10月
31. 10月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
11月
0
100
200
300
400
500
ジャーナル統計の詳細については、こちらをクリックしてください。
同一IPアドレスからの複数のリクエストは1ビューとしてカウントされます。
Biomedicines, EISSN 2227-9059, MDPI発行 RSSコンテンツアラート
その他の情報
論文処理料金
請求書の支払い
オープンアクセスポリシー
MDPIへのお問い合わせ
MDPIの求人
ガイドライン
著者の方へ
査読者の方へ
編集者の方へ
ライブラリアンの方へ
出版社の方へ
学会の方へ
学会主催者の方へ
MDPIの取り組み
サイフォーラム
MDPI書籍
Preprints.org
サイリット
サイプロファイルズ
百科事典
JAMS
プロシーディングスシリーズ
MDPIをフォローする
LinkedIn
フェイスブック
ツイッター
MDPIジャーナルからの発行通知やニュースレターを購読する
オプションを選択
メールアドレスを入力してください
購読する
© 1996-2023 MDPI (スイス、バーゼル) 特に断りのない限り免責事項 ご利用規約 プライバシーポリシー
この記事が気に入ったらサポートをしてみませんか?
