IgA腎症における単核食細胞系の役割:病態と予後
81総閲覧数
2ダウンロード
記事のインパクトを見る
レビュー記事
Front. 免疫学、2023年07月03日
Sec.自己免疫疾患および自己炎症性疾患:自己免疫疾患
第14巻-2023年|https://doi.org/10.3389/fimmu.2023.1192941
IgA腎症における単核食細胞系の役割:病態と予後


Yiwen Liu1,2、Yang Gong3*、Gaosi Xu1*
1中国江西省南昌市南昌大学第二附属病院腎臓内科
2中国江西省南昌市、南昌大学第二臨床医学院
3中国江西省南昌市、南昌大学第二附属病院脳神経外科。
IgA腎症(IgAN)の病態として「マルチプルヒット」説が広く受け入れられているが、単核球/マクロファージ系がIgANの進行に重要な役割を果たしていることを示唆する証拠が増えてきている。本研究では、15件の研究において1,067人の患者を調査し、糸球体あたりのマクロファージ数は血尿の程度と正の相関があり、糸球体中のマクロファージは主に腎生検におけるメサンギウム増殖(M)と関連していることを見出した。尿細管間質では、マクロファージは尿細管間質のα-SMAおよびNF-kB発現、尿細管間質病変、尿細管萎縮/間質線維化(T)、分節性糸球体硬化症(S)と有意に並行していた。糸球体および尿細管間質では、Oxford MEST-CによるM分類ではM1が85.41%を占めたが、血液中ではM1が100%を占め、CD89+単球の平均蛍光強度が低い患者ほど重篤な病理学的特徴(S1およびT1-2)と臨床症状を示した。M1(CD80+)マクロファージは急性期には炎症促進に関与していたが、M2(CD163+)マクロファージは組織の修復とリモデリングに関与しており、慢性炎症と相関していた。糸球体では、M2マクロファージはIL-10や腫瘍壊死因子β(TGF-β)などのサイトカインを分泌して糸球体マトリックスの膨張を活性化し、M0(CD68+)マクロファージは糸球体の高細胞化を刺激した。尿細管間質では、M2マクロファージが腎線維化と硬化に極めて重要な役割を果たしていた。マクロファージは抗原提示細胞として働いてT細胞を活性化し、多様なサイトカインを放出して炎症反応を刺激していると推測される。糸球体に浸潤したマクロファージは、尿細管の損傷だけでなく、血管間膜-小体細胞-尿細管クロストークを介してポドサイトの完全性を破壊する。
1 はじめに
IgA腎症(IgAN)は世界的な原発性糸球体疾患であり、メサンギウム過形成とメサンギウムマトリックスの膨張を伴う糸球体領域へのIgA1免疫複合体の沈着を特徴とする(1-4)。中国では、IgANは末期腎不全(ESRD)の重大な原因であり、IgAN患者の15%から20%が診断後10年以内に慢性腎不全を発症する(5, 6)。
現在、「マルチプルヒット」説が広く受け入れられている(7)。研究が進むにつれ、単核球/マクロファージ系がIgANの進行に極めて重要な役割を果たしていることが示唆された。マクロファージの浸潤は、炎症性サイトカインやケモカインの放出と関連しており、これらは腎疾患の病因における重要な構成要素とみなされている(8-10)。糸球体では、IgANではCD206+マクロファージよりもCD68+マクロファージの数が多い。しかし、尿細管間質では、CD68+マクロファージの数はCD206+マクロファージと同程度である(11)。このことは、腎臓のさまざまな部位に、さまざまなサブクラスと多数のマクロファージが浸潤していることを意味している。糸球体に浸潤するマクロファージは血尿の重症度や三日月形成と並行しており、尿細管間質に浸潤するマクロファージは24時間尿蛋白定量、腎尿細管、間質病変の程度を高める(12-14)。糸球体マクロファージ浸潤の強さは、免疫抑制療法に対する反応性の予測因子とみなされている(11)。
しかしながら、マクロファージの数、サブタイプ、浸潤部位と、IgANの発症機序、臨床症状、予後との関係は、依然として不明である(15)。本研究では、IgANのマクロファージについて、尿細管間質と比較して糸球体で認められる異なる特徴を調べ、それらの特徴と臨床転帰を関連付けるとともに、IgANの病態および予後における単核球/マクロファージ系の役割について検討した。
2 IgANにおけるマクロファージ亜集団とその機能
マクロファージは異種集団として知られ、その表面分子と機能に基づいて異なるグループに細分化される(16)。IgANでは、これらのマクロファージ群はそれぞれ異なる存在様式を示し、IgANの腎障害に多様な影響を及ぼす可能性がある(17)。M1マクロファージは、急性腎障害(AKI)後48時間の急性期における炎症性反応に関連するが、慢性炎症に関連するM2マクロファージは、組織の修復とリモデリングに関与し、それ以降の時点で優勢となる(18, 19)。M2マクロファージは3つのサブクラスに分類される。M2aマクロファージはCD206で示される創傷治癒に関与し、M2bマクロファージはCD86で示される免疫応答に関与し、M2cマクロファージはCD163で示される制御細胞である(20)。光学顕微鏡では、メサンギウムマトリックスの膨張、メサンギウムや毛細血管内膜の増殖、線維化や三日月形成など、あらゆる種類の形態学的変化が観察される。慢性期には、全体的または分節的な糸球体硬化、腎尿細管萎縮、尿細管間質線維化がみられる(21)。
マクロファージの量とサブタイプは、IgAN患者の臨床症状および病理と相関している。M0マクロファージはTNF-αおよびIFN-γの刺激後、核因子-κB(NF-κB)経路を介してM1マクロファージに分極し、糸球体に動員されたM1マクロファージは炎症反応とメサンギウム線維化の過程を促進するが、M2マクロファージの分極はIL-10、TGF-βなどの活性化後、PI3K経路を介して刺激される、 そしてサイトカインを分泌し、メサンギウム細胞の増殖と間質線維化を促進し、血管新生を刺激することによって腎障害を修復する(22, 23)。IL-4やIL-13によって刺激されるM2aマクロファージは、腎修復や腎線維化の過程に関係している。免疫反応を調節できるM2bマクロファージはIL-1βによって活性化される。IL-10やTGF-βによって誘導されるM2cマクロファージは、図1に示すように、プロフィブロシスや抗炎症の機能を持つ(20)。
図1
図1 腎臓におけるマクロファージ亜集団とその機能。マクロファージは異種集団であり、腎臓では2つの亜集団に分けられる。M1マクロファージの表面マーカーはCD86であり、TNF-α、IL-6、IL-1βなどを分泌して、急性損傷後48時間の急性期に炎症性表現型を示すのが特徴である。対照的に、M2マクロファージはCD163であり、慢性炎症に関連し、組織の修復とリモデリングに関与し、IgANでは後の時点で優勢となる。IL-4とIL-13の刺激により、M2aマクロファージは細胞増殖と組織修復を促進し、M1、S1、T1、およびLeeのグレードIV-VのTNF-α、IL-1β、IL-6などを分泌する腎組織傷害と並行する。M2bは三日月形成を亢進し、抗原提示細胞としてT細胞を活性化するが、M2cはT0、G0、Lee grade II-IIIの軽度の糸球体傷害に関連する。
3 糸球体における単核食細胞系の役割
3.1 マクロファージの異なるサブタイプと臨床的特徴の関係
マクロファージの浸潤は、糸球体傷害を有するIgAN患者では普遍的な特徴である。表1に示すように、糸球体にマクロファージが浸潤しているIgAN患者の臨床的および病理学的特徴をまとめた。糸球体へのマクロファージ浸潤に関するIgANに関する論文は12件あり、患者の87.5%がOxford MEST-CによるとM1に属していた。血尿と蛋白尿はIgAN患者の通常の症状である。Kawasakiらは、41人の患者の臨床症状と腎生検によるマクロファージ浸潤との関連を示した(17)。患者一人当たりの平均糸球体マクロファージ数(ANM/P)は血尿および白血球尿の重症度と正の相関があり(p < 0.01)(29)、マクロファージのサブタイプはMEST-Cによると病理学的サブクラスと関連していた。糸球体あたりのCD68+マクロファージ数は、Cスコア(r = 0.346)、Mスコア(r = 0.325)、MEST-C最終スコア(r = 0.337)と関連していた(12)。糸球体中のCD163+マクロファージは、推定糸球体濾過量(eGFR)(r = -0.523)およびクレセント(r = 0.730)と関連していた(18)。
表1
表1 IgA腎症における単核食細胞系に関する文献の要約。
ある論文によると、活性化マクロファージはMPR14+マクロファージとMPR8+マクロファージの2つのサブクラスに分類でき、その機能はM1マクロファージとM2マクロファージに類似している(25)。MPR14+マクロファージは急性炎症反応に関与し、MPR8+マクロファージは機能的にはM2マクロファージと同様で、慢性炎症に関与する(9)。Yangらは、IgAN患者の腎臓組織におけるM0(CD68+)、M1(CD80+)、M2(CD163+)マクロファージの量が明らかに増加していることを明らかにしたが(24)、これらのIgAN患者の検体ではM2マクロファージの浸潤がほとんどであったことから、マクロファージの極性は主にM2表現型であることが示唆された。M2マクロファージは血清クレアチニン(Scr)、24時間蛋白尿、線維化領域と正の相関がある。しかし、M0およびM1マクロファージにはこのような相関がないことから、M2マクロファージがIgANの線維化の過程で重要であることがわかる。また、糸球体中のM0マクロファージは、メサンギウムおよび毛細血管内膜の高細胞性のマーカーとみなすことができる(32)。さらに、M2a(CD206+)、M2b(CD86+)、M2c(CD163+)に関するM2マクロファージの異なる亜集団は、IgANの進行に関与する際に特徴的な性質を持つ。M2bおよびM2cマクロファージはいずれも、図1に示すように、クレセントの割合、eGFRの低下、蛋白尿の程度と密接に関連しており、M2マクロファージがクレセントを伴う糸球体疾患のAKIに関与していることを示唆している(33)。
IgANでは、糸球体傷害はマクロファージによる免疫反応とも関連している。マクロファージは補体系の活性化を刺激する(34)。M1マクロファージは、M2マクロファージよりも多くのC3を産生し、その強度は血清中の高度酸化蛋白産物(AOPP)のレベルと相関する(12)。AOPPsはIgANの進行過程や尿蛋白と関連していることから、M1マクロファージはIgAN患者の進行過程における免疫・炎症反応を促進することで重要な役割を果たしていると考えられる。
3.2 IgANにおける単核食細胞系の病態
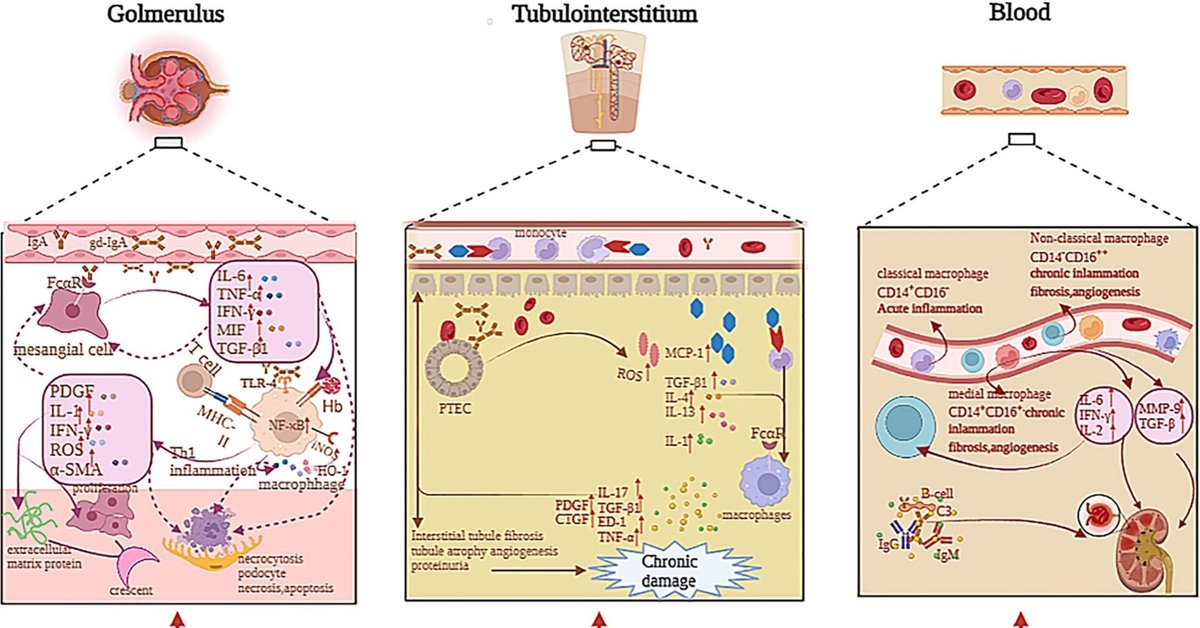
マクロファージの浸潤はIgANでよく研究されているが、この現象を引き起こすメカニズムは不明である。いくつかの研究では、IgAN患者の腎障害は、主にGd-IgA1や相対的免疫複合体、活性化された補体の沈着に寄与していることが示唆されている(2, 4)。これらの沈着物は、C3bi受容体(C3biR)やFc受容体、あるいはMHCクラスII抗原を介してメサンギウム細胞やマクロファージを刺激する可能性がある(35)。Ootakaらは、IgANを2つの免疫組織型に分類した:補体の沈着が優勢なC型とフィブリン関連抗原(FRA)の糸球体沈着が優勢なF型である。FRAはICAM1/LFA1と相互作用し、糸球体へのマクロファージ浸潤と免疫細胞の活性化を誘導する。F型では、活性化マクロファージはそのFcレセプターやMHCクラスII抗原、あるいはT細胞とマクロファージの相互作用によって引き起こされる。C型では、図2に示すように、C3biレセプターを介した補体を介した機序によってマクロファージが活性化され、蛋白尿が誘発される(35, 36)。
図2
図2 IgANにおける糸球体、尿細管間質、血液中の単核食細胞系の病態。Gd-IgA1および相対的免疫複合体の沈着は、Fcレセプターを介してメサンギウム細胞を刺激する。したがって、メサンギウム細胞はサイトカインを分泌し、糸球体におけるマクロファージの浸潤と免疫細胞の活性化を誘導し、自分自身を刺激する。IL-1、TNF-α、MIFはNF-κB経路を活性化し、細胞増殖、アポトーシス、炎症反応に影響を与えた。Gd-IgA1免疫複合体の沈着とメサンギウム細胞からのサイトカイン放出はマクロファージを刺激し活性化する。したがって、マクロファージはIL-1、IFN-γ、α-SMAなどを分泌し、メサンギウム増殖、細胞外マトリックス蛋白、分節性病変を伴う傍メサンギウム破壊性病変、毛細血管内増殖性病変、三日月形成、巨視的血尿を引き起こす。マクロファージはHbの取り込みを媒介し、HO-1合成による抗炎症経路を誘導し、ポドサイトの完全性の破壊に関与し、メサンギオ-ポドサイト-尿細管クロストークを介して、腎尿細管は様々なサイトカインやケモカインを介して損傷を受ける。尿細管間質では、IgA1免疫複合体とHbがPTECを刺激して活性酸素、MCP-1、IL-1などを放出させ、マクロファージが尿細管間質に浸潤してサイトカインを分泌し、尿細管間質の線維化、尿細管の萎縮、タンパク尿、血管新生を促進し、腎機能低下を引き起こす。血液中の単球は、非古典的単球(CD14-CD16++)、古典的単球(CD14+CD16-)、および内側単球(CD14+CD16+)を含む様々なサブクラスに分けられる。単球は血液中で様々なサイトカインを放出し、IgANの腎障害に寄与する可能性がある。
一部の研究者は、糸球体内のメサンギウム細胞を非常に密接に結合させて沈着させたグリコシル化度の低いIgA1が、単球走化性蛋白-1(MCP-1)、血小板由来増殖因子(PDGF)、マクロファージ遊走阻止因子(MIF)、TGF-β、α-SMAなどのプロフィブロティックサイトカイン産生とメサンギウム細胞増殖をIgAN患者に誘導すると考えた(37)。これらのサイトカインはM1マクロファージの糸球体への浸潤を促進する。M1マクロファージが放出するMIFは、急性炎症時にグルココルチコイドの拮抗作用を介してNF-κBの発現を増加させることがある(39)。IgANでは、増殖性糸球体腎炎におけるMIFの発現は、マクロファージやT細胞の浸潤と並行しており、また腎機能障害、組織傷害、白血球浸潤の重症度と関連しているが、蛋白尿の程度とは関連していない(40, 41)。血清中のMIFは健常群と試験群との間に有意差はないが、尿中および腎生検中のMIFは健常群より試験群で高い(41)。IL-1、TNF-α、MIFはNF-κB経路を活性化し、IgANにおける細胞分化、プログラム死、炎症反応に影響を与える(42)。周知のように、NF-κBは核DNAの特異的配列である応答エレメントに結合することにより、遺伝子の転写を制御する(43)。これまでの研究で、白血球細胞の活性化におけるNF-κBの役割や、IgAN患者の尿細管間質に移動するマクロファージとNF-κBの活性化の関係が明らかにされている(44, 45)。O-ガラクトシル化IgA1免疫複合体の沈着とメサンギウム細胞のサイトカイン放出の両方が、マクロファージの活性化を刺激する。初期段階では、M1マクロファージはIL-1、IFN-γ、IL-6、α-SMAなどの複数のサイトカインを放出し(1, 2)、好中球が病原体を殺すのをサポートし、他の免疫細胞をケモカインを分泌するようにリクルートし、糸球体のアポトーシスや壊死を促進する。
メサンギウム領域に浸潤するマクロファージは、メサンギウム増殖、メサンギウム破壊性病変とそれに伴う分節性病変、および毛細血管内増殖性病変にも関与する。また、活性化マクロファージは、IgANの初期には主に糸球体に浸潤する。M1マクロファージはPDGFや炎症性因子IL-6などの因子を分泌し、腎障害の初期段階で再生を促進することができる。永田正樹は、ANM/Pと増殖性病変を比較することにより、マクロファージがメサンギウム細胞の表現型変化を活性化することにより、硬化症の発症に関与している可能性を推測した(29)。メサンギウム細胞の表現型の変化は、線維化と硬化を促すα-SMAを放出する可能性がある。図2に示したように、メサンギウムα-SMAの発現は、IgAN患者における腎機能の低下過程を予測する(26, 29)。
さらに、多くのアポトーシス細胞や壊死細胞はM2マクロファージを刺激して活性化させ、TGF-βやその他のプロフィブロティックサイトカインを大量に分泌することで、後の段階で線維芽細胞の増殖や線維化を促進する。M2マクロファージはまた、糸球体マトリックスの膨張には関与するが、糸球体過形成には関与せず(13)、IgANの病態に関与するマクロファージのアポトーシス抑制因子(AIM)とTGF-β1を放出する(37)。AIMはCD5Lとも呼ばれ、マクロファージから分泌されるタンパク質で、免疫炎症反応に重要な機能を持つ(46)。最近の研究で、腎線維症におけるその役割が明らかになった。例えば、慢性腎臓病(CKD)患者では、AIMとマクロファージ浸潤の面積は、蛋白尿やeGFRの低下度合いと正の相関があり、AIMが腎障害を悪化させる作用があることを示している(46, 47)。IgANでは、AIMの発現は、M2マクロファージ、TGF-β1、および腎線維化の重症度と正の相関がある。TGF-β1は腎尿細管間質線維症を促進する重要なサイトカインである(24)。腎線維症におけるTGF-β1の機序は、細胞外マトリックスの合成を促進し、細胞外マトリックスの分解低下を引き起こし、炎症反応を促進し、コラーゲンを分泌し、上皮細胞やポドサイト細胞を損傷することによってメサンギウム細胞の増殖を促進することである。TGF-β1はまた、筋線維芽細胞のトランス分化と増殖を促進する可能性がある(21, 24)。ある研究では、糸球体のマクロファージが凝固促進因子である組織因子を分泌することによって、IgANの発症と進行に関与し、外因性凝固経路を引き起こし、フィブリンの沈着に寄与していることが示された(28)。とりわけ、M2マクロファージは一種のプロフィブロティック・マクロファージとして、IgANの線維化過程に関与していると考えられる。M2マクロファージはまた、クレセントの形成にも重要な役割を果たしている。
腎障害に伴い、IgAN患者では肉眼的血尿が起こる。肉眼的血尿は、IgANにおけるAKIと関連している(48)。肉眼的血尿のある被験者の検体では、CD163+マクロファージと酸化ストレスに関連する分子の存在率が高く、これは腎転帰の悪化を意味する。CD163+マクロファージはヘモグロビン(Hb)の排泄を仲介し、Hb含量を減少させ、ヘムオキシゲナーゼ-1(HO-1)の組成を増加させることで抗炎症経路を誘導する(49)。Gutiérrez Eらは、IgANの肉眼的血尿に伴うAKI患者において、CD163の発現と酸化ストレスが腎機能の不完全な回復の重要な予後因子であることを発見した(30, 49)。
以上のことから、M1マクロファージは初期段階で急性炎症反応に関与し、病原体を除去するだけでなく、正常組織球のアポトーシスと壊死を引き起こすという仮説が成り立つ。糸球体内の細胞のアポトーシスは、後の段階でM2マクロファージを刺激して活性化させ、いくつかの増殖因子や線維化因子を分泌させ、腎硬化や線維化を促進させる。マクロファージはまた、抗原提示細胞としてのT細胞を活性化することによって免疫反応に関与し、細胞の壊死、メサンギウム細胞の増殖、細胞外マトリックスの拡張、三日月形成を引き起こす。糸球体に浸潤したマクロファージは、傍メサンギウム破壊性傷害の進行や糸球体基底膜(GBM)の低下(17)、ポドサイトの完全性の破壊に関与する可能性がある。ポドサイトは様々な炎症カスケード、免疫反応、酸化ストレスによって損傷を受ける。間膜-ポドサイト-尿細管クロストークを通じて、腎尿細管は様々なサイトカインやケモカインによって傷害される(50)。
4 IgAN尿細管間質における単核食細胞系の役割
4.1 マクロファージの異なるサブタイプと臨床的特徴の関係
尿細管間質の線維化は、IgANにおける将来の進行の強い証拠である(51)。IgANの尿細管間質に浸潤するマクロファージに関する13の論文によると、マクロファージが尿細管間質に浸潤している場合、患者は蛋白尿、eGFR低下、尿細管萎縮、尿細管間質硬化を有していた(12, 52)。Silva GEらは、M0マクロファージがScr、24時間尿蛋白、腎障害の進行、および転帰の悪化と正の相関があることを示唆した。尿細管間質に浸潤するマクロファージの程度は、IgAN患者の予後を予測することができる(14)。Hu Wらは、尿細管間質のM2aマクロファージ数がScr(r = 0.363)、24時間尿蛋白(r = 0.329)、病変部位の硬化度(r = 0.457)、尿細管間質線維化(r = 0.327)と関連していることを示した。また、IgAN患者の腎組織像では、M2aおよびM2bマクロファージの数がM2cの数よりも多いことも見いだした(20)。M2aマクロファージは腎機能障害、病変部の硬化、尿細管間質線維化と正の関係を示すが、M2cマクロファージと糸球体の硬化、尿細管間質線維化との関係は否定的である。主に尿細管間質に分布するM2aマクロファージは、Oxford MEST-CとLeeのグレードIV-Vのうち、M1、S1、T1に接続している。M2cマクロファージの数は、図1に示すように、T0、G0、LeeのグレードII-IIIと平行している。我々は、尿細管間質に浸潤するマクロファージが尿細管の線維化に関係しているという仮説を立てることができる。尿細管間質の線維化は慢性腎臓病の発症によく見られる症状である(53)。
4.2 IgANにおける単核食細胞系の病態
腎障害に伴い、尿細管にはより多くのマクロファージが浸潤する。マクロファージはFcαRを介して近位尿細管上皮細胞(PTEC)や集合管上皮細胞(CDEC)と相互作用することができる(54)。そして、より多くのMCP-1がPTECから放出される(55)。可溶性エポキシドヒドロラーゼ(sEH)はエポキシエイコサトリエン酸(EETs)を代謝し、血管拡張、抗炎症反応など様々な生物学的機能を持つことがある。Wang Qらは、IgAN患者の近位尿細管上皮細胞でsEHの発現が上昇していることを示した(22)。従って、尿細管ではsEHはIgANの進行と相関していた。尿細管間質では、マクロファージの表現型によって、炎症性障害と腎修復に関与することができる。M1マクロファージは炎症反応を亢進させ、M2マクロファージは抗炎症と血行再建を促す(56-58)。Li Bらの研究から、CD4メモリーT細胞とM2マクロファージが尿細管間質にかなりの割合で存在していることがわかった(50)。より多くのM2マクロファージが尿細管周囲腔に浸潤すると、尿細管間質の線維化の進行は強く悪化する。実際、尿細管間質に浸潤するM2マクロファージは、TGF-β、エンドセリン-1、TNF-αなどのプロ線維化因子の供給源となり、永久実質細胞によるマトリックス組成の程度を誘導し、組織メタロプロテアーゼ阻害因子-1やプラスミノーゲン活性化因子阻害因子などのマトリックス分解プロテアーゼ阻害因子を分泌することができる(59)。いくつかの研究で、M2マクロファージはTGF-βと結合組織成長因子(CTGF)を増加させることにより、線維性傷害の進行を促進することが支持された。M2マクロファージは、IgAN患者の腎線維化領域に局在していた(13)。これらの炎症因子は尿細管上皮細胞の壊死、間質線維化、尿細管硬化を促進する。つまり、マクロファージは尿細管の線維化と関連しており、図2に示すように腎機能低下を引き起こす可能性がある。
肉眼的血尿に伴うAKIは、急性尿細管壊死による二次的なもので、尿細管内赤血球(RBC)鋳型からのHb分泌によって促進される(60)。尿細管間質において、腎機能の回復が不完全なIgANのいくつかの症例では、赤血球鋳型で満たされた尿細管に鉄沈着が上位レベルで認められ、これは急性尿細管障害を悪化させるp22-NADPHによる高い酸化ストレスと相関していた(30, 61)。
5 病態と臨床的特徴における血液中の単核食細胞系の役割
マクロファージが糸球体や尿細管間質に浸潤していることは多くの論文で報告されているにもかかわらず、IgANにおける末梢血単球の活性化と腎障害との関連についてはほとんど知られていない。われわれは、IgAN患者の臨床的および病理学的特徴と血液中の単核球の浸潤との関連を結論づけた。ある論文では、22人のIgAN患者(31)でOxford MEST-Cの100%をM1が占め、全員が蛋白尿、血尿、低CD89+単球(平均蛍光強度<4,000)、より重症の腎生検(S1およびT1-2)および臨床症状を有していた。IgAN患者において、還元的レベルの非典型的単球におけるCD89の発現は、腎臓の予後を悪化させる。Arima Sらは、血液中の単球がIgANにおけるメサンギウム増殖、非可逆性糸球体傷害、尿細管間質組織傷害の病態形成に重要な役割を果たしていることを示唆した(27)。
血液中では、単球はその表面マーカーによって、非古典的単球(CD14-CD16++)、古典的単球(CD14+CD16-)、および内側単球(CD14+CD16+)を含む様々なサブクラスに分けられる。図2に示すように、古典的単球は急性組織炎症と相関し、他の2つのタイプは慢性炎症、血管新生、線維化と関連している(31)。血液中の単球はFcαRを介して血清IgAをクリーニングすることができ(62, 63)、IgANでは単球がFcαR転写産物を優先的に発現する(64)。末梢血単球はメタロプロテアーゼ(MMP)、主にMMP-9を放出し、IgANの炎症過程において極めて重要な役割を果たしている(65)。c-fosやc-junを含むがん原遺伝子の発現亢進は、IgANの進行に寄与する可能性がある(66)。MMP-9の誘導は、IgANにおけるc-fosおよびc-jun mRNA発現の促進と関連している(67)。また、単球はエンドセリン-1 mRNAの発現を亢進させ、これはIgANの進行と正の相関を示した(68)。単核球は、IL-2、IFN、IL-6を含むサイトカインを大量に分泌し、リンパ球の機能や炎症に影響を与える可能性がある(69)。したがって、単球のサブタイプや非古典的単球のCD89の発現レベル、さらに末梢血中のエンドセリン-1などのサイトカインを分析することで、IgAN患者を非侵襲的に診断することができる。
6 単核球貪食系の臨床的特徴と各種治療スケジュールに対する役割
表1によると、尿細管間質に浸潤するマクロファージは、IgANにおけるScr、24時間蛋白尿、eGFRの低下と正の相関があり(11、12、24)、尿細管間質における主なサブタイプはM2マクロファージである(13、18、20、24)。Li Jらは、尿細管間質のCD163+マクロファージはeGFRと逆相関(r = -0.718)し、蛋白尿(r = 0.520)すると報告している(18)。主に尿細管間質に移動するM2aマクロファージは、Oxford MEST-CによるとM1、S1、T1に関連し、病理学的にはLeeのグレードIV-Vである。しかし糸球体では、M2cマクロファージはT0、G0、Lee grade II-III(20)、crescents(r = 0.730)と関連している(18)。Ikezumi Yらは、M0マクロファージはCD204+マクロファージ(r = 0.56)と同様に、糸球体の高細胞性(r = 0.86)と相関していると述べている(13)。糸球体のANM/Pは血尿および白血球尿の程度と正の相関がある(p < 0.001)(29)。
臨床症状と腎生検によって、適切な治療法を選択することができる。Soaresらは、毛細血管内過形成は糸球体の炎症反応を反映し、CD68+マクロファージの量はEスコアの強い徴候であることを示した(32)。腎生検でクレセントまたは毛細血管内過形成(E)が認められた患者は、ステロイド/免疫抑制(IS)療法を受け入れる可能性が高かった(70-73)。糸球体マクロファージは、CD206+細胞やCD68+細胞を含み、Oxford MEST-Cスコアと臨床データに基づいて、疾患進行のリスクが高く、持続性蛋白尿が1g/日を超える患者に使用される免疫抑制剤に対する反応の可能性を予測するための徴候を示す(11)。Xie Dらは、糸球体へのCD206+マクロファージ浸潤が多いと、少ない場合に比べて免疫抑制反応が起こる確率が40倍高くなることを示唆した。糸球体に浸潤しているCD68+マクロファージの数が多いIgAN患者では、免疫抑制に対する反応の可能性が13倍増加した(11)。一方、副腎皮質ステロイド療法は、eGFRが60ml/分/1.73m2未満のIgAN患者に特に有効である。IgANの腎障害は、マクロファージが関与する炎症反応と関連しており、腎臓の炎症を制御し、上皮/血管の修復を促進することが、腎線維化を標的とし、腎機能を維持するための最適な治療法であろう(74, 75)。メサンギウム細胞やPTECから分泌されるMCP-1は、尿細管間質だけでなく糸球体にもマクロファージを浸潤させることがある(37, 38, 55)。アンジオテンシンIIは、NF-κBの活性化を介してMCP-1の産生を促すことができる(76)。したがって、IgANにおいてアンジオテンシン変換酵素阻害薬(ACEI)またはアンジオテンシンII1型受容体拮抗薬を投与すると、糸球体および尿細管間質へのマクロファージの浸潤を抑制することができる(77-81)。
免疫抑制剤の一種であるミゾリビンが、活性化マクロファージの蓄積を防ぐことによって間質線維症を緩和することができるという研究もある(82)。池住義人らは、ミゾリビンがCD163+マクロファージの量を減少させることによって腎線維症の発症を阻止し、単球のアポトーシスを阻害するマクロファージ上のCD300Eの発現を阻害できることを、2つのグループを比較することによって示した。一方はプレドニゾロン単独投与群(P群;n=42)、もう一方はプレドニゾロン+ミゾリビン併用投与群(PM群;n=48)で2年間の治療を行い、PM群の患者にはミゾリビンを1日5mg/kg、1年以内に150mg/日を超えない用量で投与した。このレトロスペクティブな研究から、ミゾリビンはIgANにおいてP群と比較して、ステロイドによって誘導されるマクロファージ上のプロフィブロティック分子の発現を抑制し、糸球体の分節性または硬化、間質性線維化などの慢性病変を減少させることがわかった(p<0.01)。
7 結論
M1マクロファージはAKI後48時間の急性期における炎症反応に関与する急性炎症細胞であり、M2マクロファージはIgANにおける線維化と血管新生を促進する慢性炎症に関与する。尿細管間質に存在するM2マクロファージは、IgAN患者の慢性経過を示す慢性炎症において重要な役割を果たしており、糸球体における糸球体マトリックスの膨張に関係している。M0マクロファージは糸球体の高細胞化とクレセント形成に関係する。この病態によれば、患者はステロイドで治療できる。マクロファージ浸潤後のIgANの病態がさらに解明されれば、最終的にはマクロファージがIgANの進行を評価し、新たな治療標的を同定するためのバイオマーカーとして利用されるようになるかもしれない。
著者貢献
YLはデータ収集と原稿執筆を行った。YGはデータ収集を行った。GXはアイデアと論文の修正を担当した。すべての著者が論文に貢献し、提出された原稿を承認した。
資金提供
本研究は、中国国家自然科学基金(第81970583号および第82060138号)、江西省自然科学基金重点プロジェクト(第20224ACB206008号)、江西省腎臓病工程技術研究センター基金(第20164BCD40095号)の支援を受けた。
利益相反
著者らは、本研究が潜在的な利益相反と解釈されうる商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
参考文献
IgA腎症患者の血清中のガラクトース欠損IgA1は、IgGとの複合体として存在する。腎臓(1997)52:509-16.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarIgA腎症の多発性病態に基づくバイオマーカー.Clin Exp Nephrol (2019) 23:26-31. doi: 10.1007/s10157-018-1582-2.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarChauveau D, Droz D. ネッカー病院で最初に報告されたIgA腎症患者の追跡評価。Drozは、ネッカー病院で報告された最初のIgA腎症患者の追跡評価を行った。
PubMed Abstract|全文|Google ScholarIgA腎症における糸球体IgA1のO-グリコシル化不足を質量分析で証明した。Kidney Int (2001) 59:1077-85. doi: 10.1046/j.1523-1755.2001.0590031077.x
PubMed Abstract|クロスリファレンス全文|Google ScholarVelo M, Lozano L, Egido J, Gutierrez-Millet V, Hernando L. スペインで10年以上追跡調査した患者におけるIgA腎症の自然歴。Semin Nephrol (1987) 7:346-50.
PubMed Abstract|Google Scholar15年以内の原発性糸球体疾患のスペクトルの変化:中国の単一センターにおける3331例の調査。腎臓透析移植(2009)24:870-6. doi: 10.1093/ndt/gfn554
PubMedアブストラクト|RefRefフルテキスト|Google ScholarLai KN, Tang SC, Schena FP, Novak J, Tomino Y, Fogo AB, et al. IgA腎症。Nat Rev Dis Primers (2016) 2:16001. doi: 10.1038/nrdp.2016.1
PubMed Abstract|クロスリファレンス全文|Google ScholarTopaloglu R, Orhan D, Bilginer Y, Karabulut E, Ozaltin F, Duzova A, et al. 小児期IgA腎症における臨床病理学的および免疫組織学的特徴:単一施設での経験。臨床腎臓J(2013)6:169-75。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar小児IgA腎症における骨髄関連蛋白8を発現するマクロファージの集積と硬化性変化の進行。東北大学大学院医学系研究科・医学部附属病院, 東北大学(2009) 218:49-55.
パブコメ要旨|全文|Google Scholar日本における免疫グロブリンa腎症の自然史と危険因子。進行性腎疾患研究班。免疫グロブリン腎症の自然史と危険因子。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar糸球体におけるマクロファージ浸潤の強さは、IgA腎症患者における免疫抑制療法に対する反応を予測する。J Am Soc Nephrol (2021) 32:3187-96. doi: 10.1681/ASN.2021060815.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarIgA腎症における酸化ストレスとマクロファージ浸潤。J Nephrol (2022) 35:1101-11. doi: 10.1007/s40620-021-01196-7
PubMedアブストラクト|RefRefフルテキスト|Google Scholar新規発症の小児および成人免疫グロブリンa腎症における交互に活性化されたマクロファージの同定:メサンギウムマトリックスの膨張における潜在的役割。組織病理学(2011)58:198-210. doi: 10.1111/j.1365-2559.2011.03742.x
PubMed Abstract|クロスリファレンス全文|Google Scholar腎マクロファージ浸潤はIgA腎症の予後不良と関連する。臨床(サンパウロ)(2012)67:697-703. doi: 10.6061/clinics/2012(07)01
PubMed Abstract|RefRef Full Text|Google Scholar原発性IgA腎症における単球-マクロファージ系の機能。Doi:10.1159/000409740。
PubMed Abstract|全文|Google Scholar小児IgA糸球体腎炎におけるマクロファージサブクラスと増殖。(2001年) 37:712-9. doi: 10.1016/S0272-6386(01)80119-0.
PubMed Abstract|全文|Google Scholar川崎由美子. 小児期重症IgA腎症に対する多剤併用療法と扁桃摘出パルス療法による治療戦略。Clin Exp Nephrol (2022) 26:501-11. doi: 10.1007/s10157-022-02187-z
PubMedアブストラクト|RefRefフルテキスト|Google ScholarLi J, Liu CH, Gao B, Xu DL. クレセントを有するIgA腎症患者におけるCD163陽性マクロファージの臨床病理学的意義。Int J Clin Exp Med (2015) 8:9299-305.
PubMed Abstract|Google Scholar腎臓の傷害と修復に寄与するマクロファージの表現型の違い。J Am Soc Nephrol (2011) 22:317-26. doi: 10.1681/ASN.2009060615.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarHu W, Lin J, Lian X, Yu F, Liu W, Wu Y, et al. 腎臓組織ではM2aおよびM2bマクロファージが優勢であり、M2亜集団はIgAN患者の重症度と関連していた。Clin Immunol (2019) 205:8-15. doi: 10.1016/j.clim.2019.05.005
PubMedアブストラクト|RefRefフルテキスト|Google ScholarPattrapornpisut P, Avila-Casado C, Reich HN. IgA腎症:コアカリキュラム2021。論文タイトル:IgA腎症:コアカリキュラム(2021年)、Am J Kidney Dis (2021) 78:429-41.
パブコメ抄録|クロスリファレンス全文|Google Scholar腎尿細管上皮細胞における可溶性エポキシドヒドロラーゼの発現は、IgA腎症におけるマクロファージの浸潤と分極を制御する。Am J Physiol Renal Physiol 315 F915-f926 (2018). doi: 10.1152/ajprenal.00534.2017
クロス・リーフ・フルテキスト|Google ScholarBosco MC. マクロファージ極性化:通路を越えて到達する?J Allergy Clin Immunol (2019) 143:1348-50. doi: 10.1016/j.jaci.2018.12.995.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarIgAN患者の腎線維症進行における腎マクロファージ、AIM、TGF-β1発現の役割。論文タイトル:Front Immunol(2021)12:646650.doi:10.3389/fimmu.2021.646650。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar非クレンズ性IgA腎症におけるCD25陽性細胞とマクロファージの意義。腎不全 (2006) 28:229-35. doi: 10.1080/08860220600580373
PubMed Abstract|全文|Google ScholarIgA腎症の進行におけるα-平滑筋アクチンのメサンギウム発現の意義。Am J Kidney Dis (1999) 34:902-10. doi: 10.1016/S0272-6386(99)70049-1
PubMed Abstract|全文|Google ScholarIgA腎症における単核食細胞の意義。腎臓(1991)39:684-92.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarAlexopoulos E, Seron D, Hartley RB, Nolasco F, Cameron JS. IgA腎症における間質浸潤の役割:モノクローナル抗体を用いた研究。腎臓病における間質浸潤の役割:モノクローナル抗体による研究。
PubMed Abstract|全文|Google Scholar小児IgA腎症におけるマクロファージ。腎臓(1995)48:527-35.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar酸化ストレス、マクロファージ浸潤およびCD163発現は、IgA腎症の巨赤芽球性尿誘発急性腎障害における長期腎転帰の決定因子である。ネフロン Clin Pract (2012) 121:c42-53.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarEsteve Cols C, Graterol Torres FA, Quirant Sánchez B, Marco Rusiñol H, Navarro Díaz MI, Ara Del Rey J, et al. IgA腎症における免疫学的パターン。IgA腎症における免疫学的パターン。
パブコメ抄録|クロスリード全文|Google Scholar腎CD68(+)浸潤とIgA腎症のOxford分類との関係。Histopathology (2019) 74:629-37. doi: 10.1111/his.13768.
PubMed Abstract|クロスリファレンス全文|Google ScholarLi J, Yu YF, Liu CH, Wang CM. Crescents を伴う糸球体腎炎における M2 マクロファージの意義。Pathol Res Pract (2017) 213:1215-20. doi: 10.1016/j.prp.2017.04.011.
PubMed Abstract|クロスリファレンス全文|Google ScholarIgA腎症の進行における尿酸と補体活性化の臨床的意義。Kidney Blood Press Res (2016) 41:148-57. doi: 10.1159/000443415.
PubMed Abstract|RefRef Full Text|Google ScholarIgA腎症における糸球体単球/マクロファージの浸潤および活性化の機序。相馬潤一郎, 相馬潤一郎, 相馬潤一郎, 遊佐晃一郎, 阿部和彦.
PubMed Abstract|全文|Google ScholarIgA腎症における高分子λ-IgAの白血球への結合の特徴。J Am Soc Nephrol (2002) 13:2309-19. doi: 10.1097/01.ASN.0000026497.82930.73
PubMedアブストラクト|RefRefフルテキスト|Google ScholarLeung JC, Tang SC, Chan LY, Tsang AW, Lan HY, Lai KN. 高分子IgAは、IgA腎症におけるヒトメサンギウム細胞によるマクロファージ遊走阻止因子の合成を増加させる。腎臓透析移植(2003)18:36-45.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar趙MH、張YK、李XM、王HY。IgA腎症患者由来IgA1のヒト糸球体メサンギウム細胞に対する結合能と病態生理学的効果。また、IgA腎症患者由来のIgA1がヒト糸球体メサンギウム細胞に結合することを明らかにした。
PubMedアブストラクト|クロスリファレンス全文|Google ScholarDaun JM, Cannon JG. マクロファージ遊走阻止因子は、ヒドロコルチゾンによって誘導される細胞質IkappaBalphaの増加に拮抗する。このような研究は、日本ではほとんど行われていない。
PubMedアブストラクト|クロスリファレンス全文|Google Scholarヒト糸球体腎炎におけるマクロファージ遊走阻止因子の発現。腎臓(2000)57:499-509.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar尿マクロファージ遊走阻止因子はヒト糸球体腎炎における腎障害の重症度を反映する。このような疾患は、腎臓の機能低下や腎臓の機能障害につながる可能性があり、腎臓の機能低下や腎臓の機能障害につながる可能性がある。
PubMedアブストラクト|RefRefフルテキスト|Google ScholarMuller DN, Dechend R, Mervaala EM, Park JK, Schmidt F, Fiebeler A, et al. NF-κB阻害はラットのアンジオテンシンII誘導性炎症性障害を改善する。高血圧 (2000) 35:193-201. doi: 10.1161/01.HYP.35.1.193
PubMedアブストラクト|RefRefフルテキスト|Google ScholarNF-κb:誘導性および組織特異的遺伝子制御の多面的メディエーター。細胞 (1989) 58:227-9. doi: 10.1016/0092-8674(89)90833-7
PubMedアブストラクト|RefRefフルテキスト|Google Scholar核因子κB:慢性炎症性疾患における極めて重要な転写因子。この論文では、慢性炎症性疾患における核内因子κBの重要な転写因子であることを明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google ScholarKrappmann D, Wulczyn FG, Scheidereit C. 生体内におけるNF-κB阻害剤IkappaBαのシグナル誘導性分解と基底ターンオーバーを制御する異なるメカニズム。EMBO J (1996) 15:6716-26. doi: 10.1002/j.1460-2075.1996.tb01061.x
PubMed Abstract|クロスリファレンス全文|Google ScholarIgA腎症およびヘノッホ・シェーンライン紫斑病性腎炎の日本人小児における疾患活動性のバイオマーカーとしてのマクロファージのアポトーシス抑制因子。日本人のIgA腎症およびヘノッホ-シェーンライン紫斑病性腎炎の疾患活動性バイオマーカーとしてのマクロファージ細胞死抑制因子。
PubMedアブストラクト|クロスリファレンス|Google Scholarスカベンジャー受容体システインリッチドメインスーパーファミリーに属する新規マウスマクロファージ由来可溶性因子AIM欠損マウスにおける胸腺細胞のアポトーシス感受性の亢進。J Exp Med (1999) 189:413-22. doi: 10.1084/jem.189.2.413
PubMedアブストラクト|RefRefフルテキスト|Google ScholarKveder R, Lindic J, Ales A, Kovac D, Vizjak A, Ferluga D. 免疫グロブリンa腎症における急性腎障害:巨視的血尿と急性尿細管間質障害の潜在的役割。Ther Apher Dial (2009) 13:273-7. doi: 10.1111/j.1744-9987.2009.00723.x.
PubMedアブストラクト|RefRefフルテキスト|Google Scholarヘモグロビンのスカベンジャー受容体CD163は、インターロイキン10の放出とヘムオキシゲナーゼ-1の合成を仲介する。
PubMed Abstract | CrossRef Full Text | Google ScholarIgA腎症患者の糸球体および尿細管間質コンパートメントにおける免疫細胞の特徴を明らかにした。また、IgA腎症患者の糸球体および尿細管間質コンパートメントにおける免疫細胞の特徴を明らかにした。
PubMedアブストラクト|RefRefフルテキスト|Google ScholarPawluczyk IZA, Soares MSF, Barratt WA, Brown JR, Bhachu JS, Selvaskandan H, et al. マクロファージと集合管上皮細胞との相互作用は、免疫グロブリンa腎症における尿細管間質の炎症と線維化を促進する可能性がある。この論文では、免疫グロブリン腎症における尿細管間質の炎症と線維化を促進するサイトカインと集合管上皮細胞との相互作用について検討した。
PubMedアブストラクト|RefRefフルテキスト|Google Scholar尿中可溶性CD163値はIgA腎症の寛解状態を予測する。論文タイトル:Front Immunol(2021)12:769802.doi:10.3389/fimmu.2021.769802。
PubMedアブストラクト|クロスリファレンス全文|Google Scholar慢性腎臓病の世界的負担:推定値、変動性、落とし穴。Nat Rev Nephrol (2017) 13:104-14. doi: 10.1038/nrneph.2016.163.
PubMed Abstract|クロステキスト|Google Scholar腎集合管上皮細胞は尿細管間質障害における炎症を制御する。J Clin Invest (2011) 121:3425-41. doi: 10.1172/JCI57582.
パブコメ抄録|クロスリファレンス|Google ScholarProdjosudjadi W, Gerritsma JS, Klar-Mohamad N, Gerritsen AF, Bruijn JA, Daha MR, et al. ヒト近位尿細管上皮細胞による単球走化性蛋白質-1の産生とサイトカインを介した制御。腎臓(1995)48:1477-86.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarRicardo SD, van Goor H, Eddy AA. 腎障害および修復におけるマクロファージの多様性。J Clin Invest (2008) 118:3522-30. doi: 10.1172/JCI36150.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarWang Y, Wang YP, Zheng G, Lee VW, Ouyang L, Chang DH, et al. Ex vivo programmed macrophages ameliorate experimental chronic inflammatory renal disease. Kidney Int (2007) 72:290-9. doi: 10.1038/sj.ki.5002275.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarアトキンスRC、ホールズワースSR、ハンコックWW、トムソンNM、グラスゴーEF。ヒト糸球体腎炎における細胞性免疫機構:単核白血球の役割。(1982)5:269-96.DOI:10.1007/BF01892089.SpringerSeminImmunopathol(1982)5:269-96.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarEddy A. 蛋白尿に対する細胞浸潤の役割。腎臓病(2001)37:S25-29.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarGutiérrez(グティエレス)E、González(ゴンサレス)E、Hernández(エルナンデス)E、Morales(モラレス)E、Martínez(マルティネス)MA、Usera(ウセラ)G、他。IgA腎症の大排尿誘発性急性腎不全における腎機能の不完全な回復を決定する因子。臨床J Am Soc Nephrol (2007) 2:51-7. doi: 10.2215/CJN.02670706
PubMedアブストラクト|RefRefフルテキスト|Google ScholarSowers JR. 高血圧、アンジオテンシンII、酸化ストレス。高血圧、アンジオテンシンII、酸化ストレス。
PubMedアブストラクト|RefRefフルテキスト|Google ScholarMonteiro RC, Kubagawa H, Cooper MD. ヒトにおけるfcα受容体の細胞分布、制御および生化学的性質。このような背景のもと、ヒトのfcα受容体の細胞内分布、制御、および生化学的性質が明らかにされた。
パブコメ要旨|全文|Google ScholarIgAに対するヒトfcレセプターの発現クローニング。この論文では、IgAのヒトfcレセプターの発現クローニングを行った。
パブコメ抄録|クロスリファレンス全文|Google ScholarIgA腎症に特異的な血液貪食細胞上のIgA fcレセプター(CD89)の発現。Clin Exp Immunol (1997) 110:226-32. doi: 10.1111/j.1365-2249.1997.tb08321.x
PubMedアブストラクト|RefRefフルテキスト|Google ScholarThompson RW, Holmes DR, Mertens RA, Liao S, Botney MD, Mecham RP, et al.腹部大動脈瘤における92キロダルトン型ゼラチナーゼの産生と局在。J Clin Invest (1995) 96:318-26. doi: 10.1172/JCI118037
PubMed Abstract|クロスリファレンス全文|Google ScholarIgA腎症における末梢血単核球のがん原遺伝子発現。腎臓(1991)39:946-53.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar免疫グロブリンa腎症患者の末梢血単球におけるメタロプロテアーゼ-9のmRNA発現の増加。免疫グロブリン腎症患者の末梢血単球におけるメタロプロテアーゼ-9の発現増加。
PubMed Abstract|全文|Google ScholarIgA腎症における末梢血単球によるエンドセリン-1 mRNA発現。Lancet (1993) 342:1147-8. doi: 10.1016/0140-6736(93)92126-E
PubMed Abstract|全文|Google Scholarde Caestecker MP, Bottomley M, Telfer BA, Hutchinson IV, Vose BM, Ballardie FW. ヒトIgA腎症における末梢血単核球サイトカインネットワーク異常の検出。腎臓(1993)44:1298-308.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarIgA腎症のオックスフォード分類:根拠、臨床病理学的相関、および分類。腎臓(2009)76:534-45。
PubMedアブストラクト|RefRefフルテキスト|Google ScholarCoppo、Troyanov、Bellur、Cattran、Cook、HT、Feehally、J、他:異なる病態と治療を有するコホートにおけるIgA腎症のOxford分類の検証。Kidney Int(2014)86:828-36。
PubMedアブストラクト|RefRefフルテキスト|Google ScholarEdström Halling S、Söderberg MP、Berg UB。小児IgA腎症における臨床的および病理組織学的変数(オックスフォード分類)に関する転帰の予測因子。腎臓透析移植(2012)27:715-22。
PubMed Abstract|全文|Google ScholarIgA腎症のOxford分類の検証。Kidney Int (2011) 80:310-7. doi: 10.1038/ki.2011.126.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar腎臓の微小環境とマクロファージの表現型が、腎臓の炎症と線維化の進行と消失を決定する。Kidney Int (2011) 80:915-25. doi: 10.1038/ki.2011.217.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarIhm CG, Jeong KW, Lee SH, Lee TW, Park JK. IgA腎症における炎症および線維化因子に対する治療薬の効果。John H. (2007) 12 Suppl 3:S25-26. doi: 10.1111/j.1440-1797.2007.00878.x.
CrossRef 全文|Google Scholar腎臓病における樹状細胞とマクロファージ。Clin Exp Nephrol (2010) 14:1-11. doi: 10.1007/s10157-009-0218-y
PubMedアブストラクト|RefRefフルテキスト|Google ScholarFloege J, Rauen T, Tang SCW. IgA腎症の現在の治療法。本書は、IgA腎症の治療法について解説したものである。
PubMed Abstract|RefRef Full Text|Google ScholarLiu Y. 腎線維症:病因と治療法に関する新たな知見。腎臓病学(2006)69:213-7.
PubMed Abstract|RefRef Full Text|Google ScholarCheung CK, Rajasekaran A, Barratt J, Rizk DV. IgA腎症の管理と臨床試験の現状に関する最新情報。J Clin Med (2021) 10. doi: 10.3390/jcm10112493
PubMedアブストラクト|RefRefフルテキスト|Google ScholarIgA腎症に対する現在の治療法。J Am Soc Nephrol (2011) 22:1785-94.
PubMedアブストラクト|RefRefフルテキスト|Google ScholarMyllymäki JM, Honkanen TT, Syrjänen JT, Helin HJ, Rantala IS, Pasternack AI, et al. 免疫グロブリンa腎症における尿細管間質性炎症の重症度と予後。免疫グロブリンA腎症における尿細管間質性炎症の重症度と予後。
PubMedアブストラクト|RefRefフルテキスト|Google Scholarステロイド抵抗性小児IgA腎症に対するレスキュー薬としてのミゾリビンの使用。Pediatr Nephrol (Berlin, Germany) (2008) 23:645-50.
CrossRef 全文|Google Scholarミゾリビンは小児IgA腎症における腎線維化を阻止する:M2型マクロファージの調節との関連。小児腎臓病(ドイツ、ベルリン)(2023)38:1831-42. doi: 10.1007/s00467-022-05786-w
クロスリファレンス全文|Google Scholar
キーワード IgA腎症、単核食細胞系、M1マクロファージ、M2マクロファージ、病因
引用 Liu Y, Gong Y and Xu G (2023) IgA腎症における単核食細胞系の役割:病態と予後。Front. Immunol. doi: 10.3389/fimmu.2023.1192941.
受理された: 2023年3月24日;受理された: 2023年6月12日;
発行:2023年7月3日
編集者
Steven O'Reilly, STipe Therapeutics, デンマーク
査読者
Dominic John Ciavatta, ノースカロライナ大学チャペルヒル校, 米国
Colin Reily, アラバマ大学バーミンガム校, アメリカ合衆国
Copyright © 2023 Liu, Gong and Xu. これは、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*文責 Yang Gong, gongyan_123@163.com; Gaosi Xu, gaosixu@163.com
免責事項:本論文で表明されたすべての主張は、あくまでも著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではない。
こんな人も見ています
ヤギミルク細胞外小胞:in vitroにおけるブタ単球由来マクロファージに対する免疫調節効果
ジュリア・フランツォーニ, サマンタ・メコッチ, キアラ・グラツィア・デ・チウシス, ロレーナ・ムーラ, フィリッポ・デルアンノ, スザンナ・ジネル, フロリアーナ・フルッシオーネ, リヴィア・デ・パオリス, タニア・カルタ, アントニオ・G・アンフォッシ, シルヴィア・デイ・グイディチ, エリザベッタ・キアラディア, ルイザ・パスクッチ, アナリサ・オッジアーノ, カティア・カッペッリ, エリザベッタ・ラッツオーリ
小児敗血症性ショックにおけるシグネチャー遺伝子の解析と免疫細胞浸潤との関連性
范佳杰、史山山、邱雲祥、劉明南、周強
無菌性炎症における損傷を介したマクロファージ極性化
Gábor Koncz、Viktória Jenei、Márta Tóth、Eszter Váradi、Balázs Kardos、Attila Bácsi、Anett Mázló
そう痒性皮膚疾患における好塩基球
Daniela Wiebe、Maren M. Limberg、Natalie Gray、Ulrike Raap
マウスにおけるリポ多糖誘発うつ病様モデル:メタアナリシスと系統的評価
尹倫、張凱玲、李英明、唐子磊、鄭瑞玉、馬岳、陳宗漢、娜雷、熊磊、郭培心、李剛、謝玉環
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー|利用規約
この記事が気に入ったらサポートをしてみませんか?
