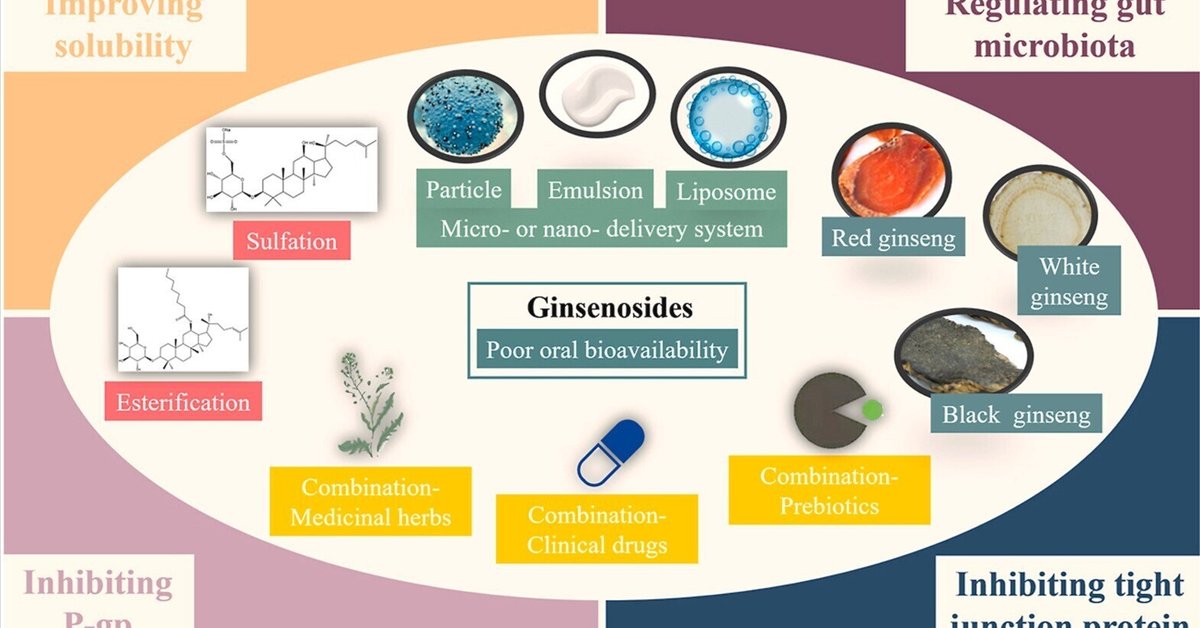
ジンセノサイドの低い経口バイオアベイラビリティの改善に関する方法: 前処理、構造修飾、薬剤配合、マイクロ・ナノ送達システム
本文へスキップ記事へスキップ
エルゼビアのロゴ
高麗人参研究ジャーナル
第47巻 第6号 2023年11月 694-705ページ
総説
ジンセノサイドの低い経口バイオアベイラビリティの改善に関する方法: 前処理、構造修飾、薬剤配合、マイクロ・ナノ送達システム
https://www.sciencedirect.com/science/article/pii/S1226845323000799#abs0010

著者リンク オーバーレイパネルを開く Qi-rui Hu b, Huan Hong a, Zhang Zhi-hong a, Hua Feng a, Ting Luo b, Jing Li b, Ze-yuan Deng b, Fang Chen a
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.jgr.2023.07.005
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
要旨
田七人参は、アジアで滋養強壮剤として広く用いられている伝統的な漢方薬である。高麗人参の主な薬理活性成分はダンマラン型ジンセノサイドであり、抗がん作用、抗炎症作用、免疫調節作用、神経保護作用、代謝調節作用が示されている。さらに、ジンセノサイドの一部(Rh2やRg3など)は栄養補助食品として開発されている。しかし、ジンセノサイドは細胞内への浸透性が悪く、ヒト体内での生物学的利用能が低いため、臨床での利用は制限されている。明らかに、ジンセノサイドのダンマラン骨格とグリコシルがこれらの制限の原因となっている。したがって、ジンセノサイドの経口バイオアベイラビリティを改善することが喫緊の課題となっている。ここでは、ジンセノサイドの構造に基づいて、ジンセノサイドの経口バイオアベイラビリティに影響を与える要因の理解をまとめ、経口バイオアベイラビリティを向上させる方法を紹介し、ジンセノサイドの経口バイオアベイラビリティ向上に関する今後の展望を提案した。
図抄録
画像1
ダウンロード 高解像度画像ダウンロード(352KB)
ダウンロード フルサイズ画像のダウンロード
前へ 次へ
キーワード
ジンセノサイドP-糖タンパク質経口バイオアベイラビリティ腸内細菌叢
はじめに
一般に高麗人参として知られるオタネニンジンの根は、伝統的な漢方薬であり、現代ではアダプトゲンの原料として人気を博している [1]。高麗人参には、抗酸化作用、抗炎症作用、抗菌作用、抗がん作用など、さまざまな有益な特性がある [2]。その結果、高麗人参をベースにした製品が強壮剤として市販されている(Celestial Seasonings Ginseng、Centrum Herbals Ginseng、Nature MadeのChinese Red Panax Ginseng、Nature's WayのKorean Ginseng Extractなど)[3]。食品業界では、高麗人参は特にチューインガム、キャンディー、飲料の原料としても使用されている[4]。
高麗人参の主な活性化合物はジンセノサイドであり、様々な薬理学的活性を示す。ジンセノサイドは、ダンマラン型、オレアナン型、オコチロール型に分類することができ[5]、ダンマラン型のジンセノサイド(以下、ジンセノサイドと略す)が主な薬理活性成分である[2]。従来、ジンセノサイドは抗がん剤、抗炎症剤、免疫調節剤として研究されてきた[6]。一方、最近の研究では、関節リウマチ(化合物Kなど)[7]、メタボリックシンドローム(ジンセノサイドRg3、Rg1、Rb、Rh1など)[8]、神経疾患(ジンセノサイドRdなど)[9]、心血管系疾患(ジンセノサイドRg1、Rb1、F1など)[10]など、他の疾患の治療薬としての可能性が明らかにされつつある。
興味深いことに、ジンセノサイドの生理活性と物理化学的特性の間には矛盾がある。ジンセノサイドは、細胞膜における様々な生物学的プロセスに関与し [11]、細胞質内のタンパク質と相互作用する [12]。さらに、転写因子と相互作用し、その転写活性を制御することができる [13]。このことは、ジンセノサイドがバイオフィルムの層に浸透するためには、優れた親油性を有していなければならないことを示している。しかし、ジンセノサイドのダンマラン骨格は親水性に乏しく、一方、グリコシルは親油性を低下させるため、大部分の溶媒に対する溶解度が制限される。その結果、ジンセノサイドの腸管透過性および経口バイオアベイラビリティは比較的低い。具体的には、ジンセノサイドRb 1、Rb 2、Rb 3、Rd、Rg 3、Rh2、化合物K(CK)、ReおよびRg1の経口バイオアベイラビリティはすべて15%以下であり、ジンセノサイドPPDのみが40%以上の経口バイオアベイラビリティを有する[14]。
したがって、ジンセノサイドの経口バイオアベイラビリティを向上させることは重要である。しかしながら、ジンセノサイドの腸管吸収機構は不明確であり、その結果、ジンセノサイドの経口バイオアベイラビリティを向上させる方法はまだ十分に確立されていない。そこで、本総説では、(1)ジンセノサイドの経口バイオアベイラビリティに影響を及ぼす要因(ジンセノサイドの構造、排出、腸内細菌叢など)を要約し、(2)関連するメカニズムに基づくジンセノサイドの経口バイオアベイラビリティを向上させる方法を紹介し、(3)ジンセノサイドの腸管吸収を促進するその他の潜在的な方法を提案する。
ジンセノサイドの経口バイオアベイラビリティに影響する因子
2.1. ジンセノサイドの構造
プロトパナキサジオール(PPD)タイプとプロトパナキサトリオール(PPT)タイプである。これらはC-6位の置換基の有無によって特徴づけられる: PPD型ジンセノサイドにはこの置換基がなく、PPT型ジンセノサイドにはヒドロキシルまたはグリコシド結合がある(図1)。(図1)。両者とも抗がん活性、抗炎症活性、免疫調節活性を示すことから、構造の違いが生理活性の決定要因とは考えにくい。しかしながら、構造の違いは、これら2種類のジンセノサイドの経口バイオアベイラビリティに影響を与える可能性がある。これまでの研究で、経口投与後のラットの血漿中濃度はPPDがPPTより高いことが示されている。PPDは、血漿中の排泄速度が低く[15]、その結果、PPDの絶対バイオアベイラビリティはPPTのそれよりも高かった。興味深いことに、PPD型ジンセノサイドであるジンセノサイドRb1は、ジンセノサイドRg1(PPT型ジンセノサイド)よりも低い絶対的バイオアベイラビリティを有することが証明されている[16,17]。
図1
ダウンロード 高解像度画像ダウンロード(769KB)
ダウンロード フルサイズ画像のダウンロード
図1. ダンマラン型ジンセノサイドの構造。
図1に示すように、Rb1は4つのグリコシルを含むのに対し、Rg2は2つのグリコシルしか含まず、グリコシルによって運ばれるヒドロキシルはジンセノサイドの親油性を低下させる。その結果、Rb1はRg2よりも腸管の細胞を通過するのが難しくなる。また、Caco2細胞によるPPD(糖鎖を含まない)の取り込みは、ジンセノサイドRh2(糖鎖を1個含む)よりも高いことが確認されている[18,19]。Niuら[20]は、Caco2細胞モデルでの透過性に関して、様々な人参サポニン類の吸収性を比較し、人参サポニンCK(グリコシル1個含有)、Rd(グリコシル3個含有)、Rb1(グリコシル4個含有)の順にランク付けした。まとめると、グリコシル数が少ないジンセノサイドは親油性が高く、経口バイオアベイラビリティが高い。一方、グリコシル数が多いほど分子量が高くなり、分子量の低いジンセノサイドよりも吸収性が低くなる。
PPD-/PPT-タイプとグリコシル数の両方を考慮し、Kimら[21]は透過性ランキングを以下のように結論づけた: Rg1(PPTタイプ、グリコシル数2)≧Rf(PPTタイプ、グリコシル数2)、Re(PPTタイプ、グリコシル数3)≧Rc(PPDタイプ、グリコシル数4)>Rb1(PPDタイプ、グリコシル数4)>Rb2(PPDタイプ、グリコシル数4)。このことは、ピラノースと比較してフラノースの方がCaco2細胞を通過するのに有利であることを示唆している。さらに、C-20位のグリコシド結合は、C-3位やC-6位と比較して透過性を向上させる(図1)。このことは、CKがRh2よりも容易に細胞膜を透過することを発見したHaら[22]によっても支持される。
以上のことから、PPD型ジンセノサイドはPPT型ジンセノサイドよりも高い経口バイオアベイラビリティを有するが、グリコシル(特にC-3位とC-6位)は一般に経口吸収に不利であると考えられている。
2.2. 排出
P-糖タンパク質(P-gp)は、ATP結合カセットスーパーファミリーの一員であり、細胞外マトリックスに排出する活性を有する。P-gpが活性化されると、ジンセノサイドの吸収率が低下する(図2)。ベラパミルやシクロスポリンA(P-gp阻害剤)は、ジンセノサイドRh2の排出比率を低下させることから、P-gpがRh2の排出に関与していることが示唆された[24,25]。しかし、すべてのジンセノサイドがP-gpの基質となるわけではない。ジンセノサイドRb1、Rb2、Rc、Rd、Rg2、Rg3の吸収はP-gpによって阻害される可能性があるが、Rh1、F1、Re、Rg1の吸収はP-gp阻害剤によって影響を受けないことが証明されている[26]。このことから、PPT型ではなくPPD型のジンセノサイドがP-gpの基質となる可能性が高いことが明らかになった。図3に示すように、P-gp基質の結合部位は、2つの末端に緩い結合ポケットがあり、中央にはコンパクトな空洞がある[23]。そのため、PPT型ジンセノサイドのC-6位のグリコシルに対して、P-gp基質の結合部位が十分なスペースを提供することは困難である。
図2
ダウンロード 高解像度画像ダウンロード(685KB)
ダウンロード フルサイズ画像のダウンロード
図2. ジンセノサイドの腸管吸収に関与する可能性のあるメカニズム。
図3.
ダウンロード 高解像度画像ダウンロード(482KB)
ダウンロード フルサイズ画像のダウンロード
図3. P-糖タンパク質基質結合部位の立体構造。
興味深いことに、ジンセノサイドはP-gp基質であるだけでなく、P-gp阻害剤でもある。ジンセノサイドはアジドピン部位でP-gpタンパク質と相互作用し、他のP-gp基質の細胞内蓄積を増加させる可能性がある[27]。Rh2は、ジゴキシン [28,29]、フェキソフェナジン [28]、エトポシド [28]、リトナビル [30]の吸収を促進することが証明されている。ジンセノサイドPDQ、CK、PPDおよびPPTも、ローダミン123またはジゴキシンの吸収を改善することが確認されている[26,31]。さらに、ジンセノサイドRg1、Re、Rc、およびRdは、薬物排出ポンプを適度に阻害し、薬物蓄積を増加させることも判明した[27]。これらの結果は、ダンマラン骨格がP-gp阻害に寄与するファーマコフォアであるが、側鎖はP-gp阻害活性に影響を及ぼさない可能性があることを示している [32]。しかし、グリコシルはP-gp阻害作用を弱める可能性がある。なぜなら、P-gp阻害剤としての結合には疎水性が必要であり(Log P ≥ 2.92)、グリコシルは親水性を増加させるからである[33]。
2.3. 身体状態と腸内細菌叢
身体状態が体内の代謝に影響を及ぼす可能性があることは認められている。予想されるように、ジンセノサイドの経口バイオアベイラビリティは、生理学的状態(食事介入や疾患など)によって影響を受ける可能性がある。高脂肪食品による食事介入後、ヒトの体内ではジンセノサイドCKおよびPPDの経口バイオアベイラビリティが増加した [34]。これはおそらく、高脂肪食が薬物のミセル可溶化と濡れ性を高めるためであろう[34]。また、糖尿病ラットでは、Rb1の経口バイオアベイラビリティが向上し、Rb1の尿中排泄が減少した[35]。ウォーカー256腫瘍を有するラットにジンセノサイドRg3を経口投与したところ、Rg3とRh2の血漿中濃度/時間曲線下面積(AUC)がともに減少したことから、Rg3からRh2への変換も阻害される可能性が示唆された[36]。興味深いことに、腫瘍環境では常に免疫抑制が見られるにもかかわらず、ジンセノサイドF2、Rg3、Rd、Rh1、Rg1およびCKは免疫抑制ラットでより豊富に存在することが判明した [37]。さらに、精神疾患もジンセノサイドの経口バイオアベイラビリティに影響を与える可能性がある。うつ病のラットでは、ジンセノサイドRh1、Rb1、RcおよびRdの吸収が正常ラットと比較して亢進していた[38]。アルツハイマー病モデルラットでは、Rdの吸収は改善されたが、Rb1とReの吸収は正常ラットと同レベルにとどまった [39]。
これらの現象は、腸内細菌叢に起因している可能性がある。多くの文献で、健康状態が腸内細菌叢に影響を及ぼし、それがジンセノサイドの吸収に影響を及ぼすことが示されている [35,37, [40], [41], [42], [43]。代謝状態は健康状態の違いによって変化する可能性があり、代謝状態が異なれば腸内細菌叢の構成も多様になる [40]。最終的に、腸内細菌叢は3つの方法でジンセノサイドの経口バイオアベイラビリティを制御する可能性がある: 1)腸内細菌叢は、食物/薬物マトリックス(食物繊維、タンパク質など)に結合した(または捕捉された)ジンセノサイドを放出し、遊離ジンセノサイドの量を増加させる可能性がある[44];2)腸内細菌叢は、ジンセノサイドの代謝過程(脱グリコシル化など)を制御する可能性がある[45];3)腸内細菌叢は、腸管透過性を制御する可能性がある[35](図2)。Bifidobacterium animalis GM1はin vitroでジンセノサイドの脱グリコシル化を促進することが確認されているが[40]、ジンセノサイドの経口バイオアベイラビリティを高める特定の菌株についてはまだ解明されていない。少なくとも、今後の研究では、腸内細菌叢とジンセノサイドの吸収との相関関係を探る必要がある。
さらに、ジンセノサイドは腸内細菌叢を制御して、元のジンセノサイドから代謝性の二次的ジンセノサイドへの変換を促進することが証明されており [41]、これはジンセノサイドと腸内細菌叢の間の順方向フィードバックループを示している。
ジンセノサイドの経口バイオアベイラビリティを向上させる戦略
3.1. 前処理
腸内細菌叢は、脱グリコシル化またはマトリックスからの放出により、ジンセノサイドの経口バイオアベイラビリティを高める可能性があるため、原料に特定の前処理を施せば、腸内細菌叢の段階で吸収が高まる可能性がある(表1)。試験管内発酵が適切な代替手段となりうることは間違いない。Ryuら[46]は紅参をPhellinus linteusで発酵させ、発酵させた紅参では発酵させない紅参よりもジンセノサイド(特に二次代謝産物)の腸管透過性が高いことを観察した。Lactobacillus sakei HY7802も紅参の発酵に利用され、ラットおよびヒトにおけるCKの経口バイオアベイラビリティを向上させた[47]。今後の研究では、発酵に使用する菌株のスクリーニングをさらに精緻化し、遺伝子工学を利用して高い脱糖活性を有する菌株を得ることができる。
表1. ジンセノサイドの経口バイオアベイラビリティを改善するための高麗人参の前処理
製品 前処理 モデル 効果 参考文献
AUC(in vivo) 経上皮輸送(in vitro) 空細胞
白参 生の高麗人参を水分含量が12%以下になるまで天日乾燥した。 ラット ↑ 3.0倍 (Rg1)
↑ 1.2倍 (Re)
↑ 2.1倍 (Rb1)
↑ 2.7 倍(Rd)[49,50]。
冷凍高麗人参 新鮮な高麗人参を-80 °C の条件下で水分含量が 12% 未満になるまで凍結乾燥した。 ラット ↑ 3.7 倍 (Rg1)
↑ 5.4倍 (Re)
↑ 3.0倍 (Rb1)
↑ 1.9 倍 (Rd)
紅参 新鮮な紅参を洗浄し、98℃で3時間蒸した後、水分含量が12%未満になるまで65℃で乾燥させた。 ラット ↑ 3.6倍 (Rg1)
↑ 1.5倍 (Re)
↑ 2.8倍 (Rb1)
↑ 1.4 倍 (Rd)
ヒト [49]
黒高麗人参 新鮮な高麗人参を洗浄し、98℃で3時間蒸した後、65℃で乾燥させることを9回繰り返した。 ヒト ↑ 1.8倍(総ギセノシド、紅参と比較)。
硫黄で燻蒸した高麗人参 硫黄粉末で48時間燻蒸した後、40℃で12時間通気乾燥した。
↑ 1.2倍(Re)[52]。
発酵高麗人参 滅菌した紅参抽出液にPhellinus linteusを接種した。発酵は25℃、通気度1.0 vvm、振とう速度150 rpmで5日間行った。 常在性腸嚢 ↑ 1.2倍(総ジンセノサイド) [46].
Lactobacillus sakei HY7802を用い、0.8% CytolasePCL5、0.8% Sumizyme AC、0.8% Rapidase C80Maxと50℃で72時間プレインキュベートした紅参エキスを発酵させた。
↑ 6.3倍(CK、ラット)[47]。
AUC:血漿中濃度時間曲線下面積。
一方、熱処理は、食品マトリックス中の植物化学物質の放出を促進し、脱グリコシル化を改善することも実証されている [48]。紅参は、新鮮な高麗人参を高温(> 65 °C)で蒸して乾燥させることで製造される。この手順を9回繰り返すと、黒人参が得られる。Yooら[49]は、黒人参のRg3、Rg5、Rk1、Rh2の吸収量が紅参のそれよりも6~24倍高いことを発見した。さらに、黒人参の総ジンセノシドのAUCも紅参のそれよりも高かった。凍結乾燥もまた、植物化学物質の生物学的利用能を高めることが報告されている。凍結乾燥した高麗人参のRg1、Re、Rb1、Rdは、未処理のジンセノサイドよりも血漿に吸収されやすかった[50]。硫黄燻蒸は高麗人参の伝統的なポストハーベスト処理であり、ジンセノサイドの化学変化を誘発する可能性がある [51]。Shenら[52]は、硫黄燻蒸した高麗人参ではRg1とReの取り込みが増加し、Rg1とReの流出比率が減少することを発見した。
3.2. 構造修飾
ジンセノサイドの構造は経口バイオアベイラビリティに大きな影響を与えるため、ジンセノサイドの構造を改変することで経口バイオアベイラビリティを改善できる可能性がある。構造改変により、ジンセノサイドの生物活性(抗がん作用、抗炎症作用など)が向上することが確認されている[53]。一方、ある種の修飾は、ジンセノサイドの吸収を改善することもできる。細胞膜は主に脂質で構成されているため、親油性を高めることは膜透過性を改善するための有効な方法である(図5)。例えば、CKのオクチルエステルは、CKよりもCaco2細胞への取り込み率が高く、排出率が低かった[54]。同様に、Rh2のオクチルエステル化もRh2の排出率を低下させる[25]。P-gpの基質結合部位の中心領域は、C-12位の長鎖脂肪族基と相互作用するように限定されているため、長鎖脂肪族基がこの違いの原因かもしれない(図2)。
しかしながら、ジンセノサイドの経口バイオアベイラビリティを向上させることを目的とした構造の改変は、体系的に研究されていない。現在の研究では、主にジンセノサイドのエステル化に焦点が当てられている。一方、水酸基を減少させる脱離反応や分子内環化縮合は、いずれも分子の親油性を高める可能性があり、今後注目されるかもしれない。確かに、親油性を高めることだけが唯一の解決策ではないだろう。硫酸化Rh2は、元のタイプよりも高い生物学的利用能を有することが証明されている[55](図5)。このような修飾がジンセノサイドの経口バイオアベイラビリティに及ぼす影響をさらに調査し、ジンセノサイドと経口バイオアベイラビリティの構造活性相関をまとめることができるであろう。
3.3. 薬剤の組み合わせ
3.3.1. プレバイオティクス
プレバイオティクス繊維は腸内細菌叢の組成を変化させることができ、このことはプレバイオティクスがジンセノサイドの経口バイオアベイラビリティを高める可能性を示している[[56]、[57]、[58]](図4および表2)。当初、プレバイオティクス繊維(NUTRIOSEなど)がジンセノサイドの二次代謝産物(ジンセノサイドCKなど)の経口バイオアベイラビリティを高めることが確認された[56]。その後、NUTRIOSE含有食は、ラットにおけるRdの吸収を促進することが証明された [57]。14日間のプレバイオティクス介入(フラクトオリゴ糖、ガラクトオリゴ糖、またはファイバーソール-2)により、Rb1、F2、およびCKの吸収と同様にRdの吸収も増加した [58]。注目すべきことに、高麗人参の多糖類もまた、腸内微生物の代謝に対する効果を通じてジンセノサイドの吸収を刺激することが見出されており、これは正常ラットと過疲労および急性寒冷ストレスモデルに暴露したラットの両方で観察された[42,43]。
図4
ダウンロード 高解像度画像ダウンロード(952KB)
ダウンロード フルサイズ画像のダウンロード
図4. ジンセノサイドの経口バイオアベイラビリティを向上させる方法とそのメカニズム。
図5
ダウンロード 高解像度画像ダウンロード(531KB)
ダウンロード フルサイズ画像のダウンロード
図5. ジンセノサイド誘導体の構造。
表2. ジンセノサイドの経口バイオアベイラビリティを改善する薬剤の組み合わせ
追加刺激 ジンセノシド モデル 投与効果 参考文献
AUC (in vivo) 経上皮輸送 (in vitro)
NUTRIOSE CKラット 食餌介入は、2.5%、5%または10%のNUTRIOSE含有食餌で14日間行った。 ↑ 2.8倍[56]。
Rd ラット NUTRIOSEで2週間の食餌介入後、ジンセノサイドRb1、高麗人参抽出物、またはビヒクルをラットに経口投与した。 ↑ 1.3倍[57]。
フラクトオリゴ糖 ガラクトオリゴ糖
ファイバーソル-2 Rb1 ラット FOS、GOS、ファイバーソル-2(1g/日)をそれぞれ2週間投与した。そして最終日にRb1(100 mg/kg)を胃内投与した。 ↑ 2.2〜3.1倍(Rb1)
↑ 1.8〜2.4倍(CK、代謝産物)
↑ 1.2 ∼ 1.9 倍 (F2、代謝産物)
↑ 1.7 ∼ 2.1 倍 (Rd, 代謝産物) [58].
高麗人参多糖体 Rb1 ラットに高麗人参多糖体(228 mg/kg/day)を1週間経口投与した。その後、ラットにRb(110 mg/kg)を胃内投与した。 ↑ 2.2倍(Rb1)
↑ 3.2倍(CK、代謝産物)
↑ 1.3倍 (PPD、代謝産物)
↑ 1.4倍(Rd、代謝物) [42] 。
Rb1 Caco-2細胞 Rb1(10μM)をトランスウェルプレートの頂側または底側に、高麗人参多糖体(250μg/ml)を反対側に無添加または添加した。 ↑ 1.6倍[42]。
混合ラット(過疲労および急性寒冷ストレスモデル) ラットにオリゴフルクトース(200 mg/kg)または高麗人参多糖類抽出物(200 mg/kg)を14日間経口投与した。14日目にジンセノサイド溶液(500 mg/kg)を胃内投与した。 ↑ 1.5倍(Rg2)
↑ 2.2倍(Rd)
↑ 2.3 倍 (Rg3) [43] 。
ボルネオール混合物 ウサギ ラットに Panax notoginseng (3.0mL/kg) を単独またはボルネオール (1.42g to 50mL ginseng extract) と組み合わせて経口投与 ↑ 2.6 倍 (Rg1)
2.6 倍(Re) [60] ↑ 2.6 倍(Re
混合物 ヒト ボルネオールの有無にかかわらず、丹参 90粒相当を経口投与。 ↑ 1.8 倍 (Rg1)
3.3 倍 (Rb1) [61] ↑ 3.3 倍 (Rb1)
ピペリンRh2 ラット ラットにRh2 (10 mg/kg)を単独またはピペリン (10 または 20 mg/kg)と組み合わせて経口投与した。 2 倍 ↑ [63]
アスピリン混合物 ラットに田七人参サポニン(31.25 mg/kg) を単独またはアスピリン(20.83 mg/kg) と組み合わせて経口投与した。
↑ 1.6倍(Rb1)
2.6 倍 (Rd) [64] ↑ 2.6 倍 (Rd)
アドレナリン Rg1 Caco-2細胞 Rg1 (1 mg/ml)をアドレナリン(0.01-10 mM)の非存在下または存在下で各ウェルに添加した。 ↑ 6.2倍[65]。
ラット Rg1(200mg/kg)をアドレナリン(4mg/kg)の有無にかかわらず経口投与した。 ↑ 28 倍。
Acorus gramineus 混合物 ラット Panax quinquefolius (0.54 g/kg) を単独または AG (0.54 g/kg) と共に経口投与した。 ↑ 1.4倍 (Rb1)
↑ 2.0倍(Rb2)
↑ 1.3倍(Rd)
↑ 1.5 倍 (Re) [69].
シサンドラ・リグナン混合物 Caco-2細胞 Caco-2細胞をシサンドラ・リグナン抽出物(2.0および10.0 mg/mL)と1時間インキュベートした後、高麗人参抽出物(100 mg/mL)を添加した。 ↑ 2.1倍(Rb2)
↑ 2.9倍(Rc)
↑ 2.6倍 (Rg2)
↑ 2.7倍 (Rg3)
↑ 3.0倍(Rd)
2.5 倍 (Rb) [70] ↑ 2.5 倍 (Rb)
ラット 急性作用:高麗人参エキス(120 mg/kg)の経口投与の2時間前に、スキサンドラ・リグナンエキス(500 mg/kg)をラットに投与した。
長期効果:ラットにスキサンドラ・リグナン抽出物(500 mg/kg)を10日間経口投与した後、高麗人参抽出物(120 mg/kg)を胃内投与した。 ↑ 1.9倍(Rb2)
↑ 2.0倍(Rc)
↑ 1.7倍 (Rg2)
↑ 2.4倍 (Rg3)
↑ 2.5倍(Rd)
2.1倍 (Rb) [70] ↑ 2.1倍 (Rb)
AUC:血漿中濃度時間曲線下面積。
3.3.2. 臨床薬物
ジンセノサイドはP-gp基質であるため、P-gp阻害剤によりジンセノサイドの吸収が促進される可能性がある(表2)。ベラパミルとジンセノサイドの併用は、前述のようにジンセノサイドの経口バイオアベイラビリティを改善することが証明されている。ボルネオールは伝統的な漢方薬であり、P-gp阻害剤であることも証明されている [59]。多くの研究により、ボルネオールはジンセノサイドRg1、Re、Rb1、Rdの腸管吸収を促進することが明らかにされている[60,61]。さらに、この促進作用はジンセノサイドの状態には依存しないようである。すなわち、ボルネオールは、フリーフォームのジンセノサイド、高麗人参エキス、さらには伝統的な漢方薬の配合レシピにおいても、ジンセノサイドの吸収を促進することができる。ピペリンもまた、P-gp阻害剤として古くから研究されている [62]。そして、Rh2をピペリンと共投与すると、Rh2の経口バイオアベイラビリティが向上することが観察された [63]。
実は、P-gp阻害剤だけでなく、他の薬物(例えば、アスピリンやアドレナリン)も、異なるメカニズムで吸収促進機能を発揮することができる(表2)。ラットモデルにおいて、アスピリンはRb1、Rg1およびRdの吸収性および透過性を改善することができた[64]。アスピリンは、タイトジャンクションタンパク質の発現を阻害し、その結果、腸管透過性を増加させることが報告されている [64]。Xiongら[65]は、アドレナリンとの共投与がRg1の吸収を促進する効率的な方法であることを見出した。フロリジンとNa+の枯渇は、アドレナリンによる吸収促進を逆転させることがわかった [66]。アドレナリンは、腸上皮細胞におけるSGLT1(Na+とグルコースに依存するトランスポーター蛋白)の発現を増加させることができる。しかしながら、フロリジンはグリコシド結合体の活性を阻害することができ、Na+はSGLT1基質の取り込みに潜在的な差異を与える可能性がある[66]。以上のことから、SGLT1はジンセノサイドRg1の活性輸送に関与している可能性がある(図2)。これらの知見にもかかわらず、SGLT1が大部分のジンセノサイドの腸管吸収に関与していることを証明するには、さらなる証拠を提供する必要がある。
3.3.3. 薬草
多くの薬草(高麗人参そのものを含む)が、P-gpまたはタイトジャンクションタンパク質に対する阻害作用を有することが実証されている [27]。また、薬草に含まれる多糖類は、腸内細菌叢を制御する能力を示している [67]。したがって、薬用ハーブは、ジンセノサイドの経口バイオアベイラビリティを高めるために、高麗人参と組み合わせる可能性がある(表2)。
アコルス・グラミネウス(Acorus gramineus)は、加齢性疾患の治療に利用される伝統的な漢方薬であり、細胞間のタイトジャンクションを阻害することが証明されている [68]。そのため、アコルス・グラミネウスと高麗人参を併用することで、ジンセノサイドの経口バイオアベイラビリティが向上する可能性がある [69]。シサンドラ・チネンシスに含まれるリグナンは、P-gp阻害剤であることが証明されている [70]。したがって、シサンドラ・リグナン抽出物は、ラットにおけるRb2、RcおよびRdのAUCを増加させ、Caco-2モデルにおけるジンセノサイドRb2、Rc、Rg2、Rg3、RdおよびRb1の排出比率を減少させることが判明した[70]。伝統的な漢方薬の配合レシピは、様々な薬草を特定の比率で組み合わせたものである。丁子小半(朝鮮人参根茎、茯苓、多年草根茎、アコルス・タタリノウィ根茎からなる)に含まれるジンセノサイドは、単一の薬草に含まれるものよりも、Caco2モデルにおいて高い透過性と低い流出率を有することが証明されている[71]。前処理もまた、伝統的な漢方薬の配合レシピにおけるジンセノサイドの経口バイオアベイラビリティに影響を与える可能性がある。伝統的な煎じ薬である七雪升飲(朝鮮人参根茎・根茎、オウギ根茎、トウキ根茎、オウバク根茎、リュウキュウ果実、多年草根茎、多年草根茎、多年草根茎、シトリレチクラタエ根茎からなる)を得るために、七雪升飲を調製し、沸騰水で煎じた [72]。また、七種荘布を酒で煎じると複合チンキが得られた[73]。このチンキ剤に含まれるジンセノサイドは、伝統的な煎じ薬に含まれるものより血漿に吸収されやすかった[72]。
実際、高麗人参に含まれる他の成分も、ジンセノサイドの吸収促進剤として作用する可能性がある。Baeらは、Rh2とRg3が高麗人参エキスで投与された場合、ラットの血漿中により容易に吸収されることを発見した[74]。また、ReのAUCも、高麗人参の実エキスと共投与すると増加する可能性がある[75]。
3.4. マイクロまたはナノ送達システム
マイクロカプセル化またはナノエマルションは、化合物を安定化させ、バイオアベイラビリティを向上させる効率的な方法である(表3)。一方では、微小粒子は容易に体内に吸収される。マイクロ(またはナノ)システムの微小な液滴サイズは、界面表面積が大きく、化合物の放出と吸収を促進する[76]。例えば、超微粒子粉末の高麗人参に含まれるRb、Rc、Rd、Reのバイオアベイラビリティは、一般的な粉末のそれよりも高い [77]。また、微粉化Rh2はネイティブRh2よりも血漿に吸収されやすい[78]。一方、マイクロ・デリバリー・システムやナノ・デリバリー・システムは、化合物の親油性や親水性を変化させ、化合物の浸透性を高めることもできる(図4)。
表3. ジンセノサイドの経口バイオアベイラビリティを向上させるマイクロまたはナノデリバリーシステム
デリバリーシステム 添加物 ジンセノサイドまたは原料 モデル 効果 参考文献
AUC(in vivo) 吸収または経上皮輸送(in vitro)
マイクロまたはナノ粒子 Soluplus CK ラット (35 mg/kg) ↑ 2.0-fold [79].
二酸化ケイ素、高麗紅参抽出物 ラット (375 mg /kg) ↑ 1.6 倍 (Rb1)
↑ 1.6 倍 (Rb2)
↑ 1.8 倍 (Rc)
1.7 倍 (Rd) [80] ↑ 1.7 倍 (Rd)
PEG-PLGA ポリマー 25-OCH3-PPD Caco-2 細胞 (1 または 5 μg/mL) ↑ 6.0-fold [81].
ラット (100 mg/kg) ↑ 26倍 [81].
BSA、FAのN-ヒドロキシスクシンイミドエステル Rg5 MCF-7細胞 ↑ 1.8倍(取り込み)[82]。
γ-シクロデキストリン CKラット(30 mg/kg) ↑ 1.7倍[83]。
Re ラット(100 mg/kg) ↑ 1.6倍[84]。
トリステアリン酸グリセリル、大豆油、 Tween 80 および Span 80 F1 Caco-2
細胞 (300 μg/ml) ↑ 1.5倍[85]。
マイクロまたはナノエマルジョン リン脂質および PEG400 25-OCH3-PPD ラット (20 mg/kg) ↑ 3.6-fold [86].
Cremophor® EL、グリセリン、Labrafil® M1944 25-OCH3-PPD ラット (5 mg/kg) ↑ 9.8-fold [76].
Miglyol, Tween-20, and labrasol Rh1, Rh2 Rats (18.75 mg/kg) ↑ 2.6-fold (Rh1)
↑ 2.8 倍 (Rh2) [87] リポソーム
リポソーム リン脂質、plurololeique CC 497、 Labrafac cc、Capmul MCM Panax notoginsengsaponins 抽出物 ラット (600 mg/kg) ↑ 10.8 倍 (Rg1)
↑ 6.5倍 (Rb1) [89].
卵黄ホスファチジルコリン、 コレステロール Rg3 ラット(0.25、0.5、1 mg/kg) ↑ 1.5 倍[91]。
PEG:ポリエチレングリコール、AUC:血漿中濃度時間曲線下面積。
3.4.1. マイクロ・ナノ粒子
セルフナノミセル化固体分散システムは、様々な有効成分を固体ポリマーマトリックス内に埋め込む技術である(表3)。ジンセノサイドCKをSoluplusに封入することに成功し、CKの経口バイオアベイラビリティが向上することがわかった[79]。二酸化ケイ素もまた、ジンセノサイドを包埋し、Rb1、Rb2、Rc、Rdの腸管透過性を高めることができる[80]。ポリエチレングリコール(PEG)も広く使用されているカプセル化材料であり、Vorugantiら [81] は、ジンセノサイド25-OCH3-PPDを担持したPEG-ポリ(乳酸-co-グリコール酸)ナノ粒子を調製し、ラットの血漿および組織における25-OCH3-PPDの存在量を増加させた。三大栄養素(タンパク質、炭水化物、脂質)は、人体内で容易に分解・利用されるため、粒子の壁材として適している。Dongら[82]は、葉酸で修飾したウシ血清アルブミンにRg5をカプセル化し、Rg5の取り込みを促進した。Igamiら[83]とLiら[84]は、それぞれCKとReのコーティングにガンマ-シクロデキストリンを用いた。両者とも、カプセル化後にラットにおけるジンセノサイドのAUCが上昇することを見いだした。また、ジンセノサイドF1は、ダイズ油とトリステアリン酸グリセリルでカプセル化すると、Caco2をより容易に透過することが証明されている[85]。
3.4.2. マイクロエマルジョンとナノエマルジョン
乳化は、非両親媒性化合物のバイオアベイラビリティを向上させるための一般的な戦略である(表3)。ジンセノサイド25-OCH3-PPDは、リン脂質とPEGで調製したエマルションに分散させることができ、その結果、遊離型と比較して25-OCH3-PPDのAUCが有意に高くなった [86]。25-OCH3-PPDを含む自己乳化型ドラッグデリバリーシステムは、界面活性剤としてCremophor® EL、共界面活性剤としてグリセリン、油剤としてLabrafil® M1944を用いることによっても得ることができる。予想通り、これにより25-OCH3-PPDのバイオアベイラビリティが向上した[76]。ジンセノサイドRh1、Rh2、Miglyol(油相)、Tween-20(乳化剤)、およびLabrasol(共乳化剤)が混合され、ジンセノサイドを含むエマルジョンが形成された。この結果、Rh1とRh2の透過性が向上し、ラットの血漿中と組織中のRh1とRh2の濃度が上昇した [87]。
3.4.3. リポソーム
リポソームは主にリン脂質とコレステロールから構成されており、バイオフィルムと類似した構造を有している [88] ため、腸管を通過する薬物の輸送に有利である(表3)。薄膜水和法は、リポソームを調製する古典的な方法であり、Rg1、Rg2、Rg3、Rb1はすべて、この方法でリポソームへの封入に成功した[[88]、[89]、[90]]。ポリカーボネート膜の押し出し法も、リポソーム調製の代替法である: Yuら[91]は、この方法で卵黄ホスファチジルコリンからなるジンセノサイドRg3含有リポソームを得た。その結果、Rg1、Rg2、Rg3およびRb1の細胞内取り込みまたは生物学的利用能は、リポソームの送達によって著しく向上した。
さらに、プロバイオティクスの繁殖を促進するプレバイオティクスは、ジンセノサイドの経口バイオアベイラビリティにとって有益であることが示されている。一方、様々なプレバイオティクスは、マイクロ(またはナノ)システムのコーティング材料として広く使用されている。従って、プレバイオティクス(例えば、イヌリンやペクチン)をマイクロあるいはナノ・デリバリー・システムの調製時に利用することは、将来的にジンセノサイドの経口バイオアベイラビリティを向上させる可能性がある。
これらを総合すると、ドラッグデリバリーシステムは、様々なジンセノサイドの経口バイオアベイラビリティを向上させるために一般的に応用できる可能性がある(図6)。一方、複数のグリコシル基を持つジンセノサイドを扱う場合、構造修飾には限界がある(図6)。なぜなら、分子量の高さが経口吸収の主な障害となり、構造修飾では十分に対処できないからである。発酵技術による脱グリコシル化は、複数のグリコシル化部位を有するジンセノサイドの経口バイオアベイラビリティを改善し、薬理効果を増強するための解決策を提供する可能性がある(図6)。
図6
ダウンロード 高解像度画像ダウンロード(340KB)
ダウンロード フルサイズ画像のダウンロード
図6. ジンセノサイドの生物学的利用能を改善する方法を選択するためのプログラムフローチャート。注:提案された技術は唯一の選択肢ではないが、強く推奨されるものである。
結論
ジンセノサイドは高麗人参の主な薬理活性成分であり、アジア全域で高い需要がある。しかし、ジンセノサイドの経口バイオアベイラビリティの低さは、その実用化にとって大きな課題である。P-gpによる排出と、グリコシルに起因する親油性の低さの両方が、経口バイオアベイラビリティの低さの一因となっている。幸いなことに、P-gp阻害剤や腸内細菌叢を制御する化合物は、ジンセノサイドの経口バイオアベイラビリティを改善することが証明されている。一方、ジンセノサイドの親油性を改変する方法(例えば、構造改変やデリバリーシステム)も腸管吸収の改善に有望である。これらの知見を踏まえると、P-gp阻害剤やプレバイオティクスを含むマイクロあるいはナノデリバリーシステムは、今後、ジンセノサイドの経口バイオアベイラビリティを高めるための有力な戦略となるかもしれない。
謝辞
以下の資金提供者に感謝したい: The Academic and Technical Leaders Training Program of Major Disciplines in Jiangxi Province-Young Talents Programme (NO. 20204BCJ23025)、江西省自然科学基金 (NO. 20224BAB206109)。
参考文献
[1]
I.S.リー、K.S.カン、S.Y.キム
田七人参の薬理作用:研究の現状と今後の課題
Biomolecules, 10 (1) (2019), p. 33
CrossRefGoogle Scholar
[2]
Z.A.ラタン、M.F.ハイデレ、Y.H.ホン、S.H.パーク、J.O.リー、J.リー、J.Y.チョー
高麗人参とその主要成分ジンセノサイドの薬理学的可能性
J Ginseng Res, 45 (2) (2021), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[3]
D. Kiefer, T. Pantuso
朝鮮人参
Am Fam Physician, 68 (8) (2003), pp.
スコープで見るGoogle Scholar
[4]
C. Mancuso, R. Santangelo
オタネニンジンとオタネニンジン:薬理学から毒性学へ
Food Chem Toxicol, 107 (Pt A) (2017), pp.
PDFを見る記事を見るScopusGoogle Scholarで見る
[5]
M. Wang、H. Li、W. Liu、H. Cao、X. Hu、X. Gao、F. Xu、Z. Li、H. Hua、D. Li
創薬のためのダンマラン型リード化合物panaxadiolとprotopanaxadiol:生物活性と構造修飾
Eur J Med Chem, 189 (2020), Article 112087
PDFで記事を見るScopusで記事を見るGoogle Scholar
[6]
呉浩慈、胡喬瑞、羅卓、魏稚慈、呉宏慈、李捷、鄭麗芬、徐喬瑞、鄧晓、陳福祥
H22腫瘍マウスの脾臓リンパ球に対するジンセノサイド誘導体Rh2-Oの免疫調節作用は部分的にTLR4を介する
Int Immunopharmacol, 101 (Pt B) (2021), Article 108316
PDFで記事を見るScopusで記事を見るGoogle Scholar
[7]
M. 唐、X.謝、Y.ヤン、F.リー
ジンセノサイド化合物K-関節リウマチ治療薬の可能性
Pharmacol Res, 166 (2021), Article 105498
PDFで記事を見るScopusで記事を見るGoogle Scholar
[8]
H. Lee、G. Kong、Q. Tran、C. Kim、J. Park、J. Park
ジンセノサイドRg3とメタボリックシンドロームの関係
Front Pharmacol, 11 (2020), p. 130
スコープで見るGoogle Scholar
[9]
Y.Y.チェン、Q.P.リウ、P.アン、M.ジャ、X.ルアン、J.Y.タン、H.チャン
ジンセノサイドRd:有望な天然神経保護剤
Phytomedicine, 95 (2022), Article 153883
PDFで記事を見るScopusで記事を見るGoogle Scholar
[10]
W. ファン、Y.ホァン、H.チェン、S.リー、Z.リー、L.ユアン、X.チェン、C.ヘー、J.サン
メタボリックシンドロームと心血管疾患の治療のためのジンセノサイド:薬理学とメカニズム
Biomed Pharmacother, 132 (2020), Article 110915
PDFで記事を見るScopusで記事を見るGoogle Scholar
[11]
S.L. Verstraeten、J.H. Lorent、M.P. Mingeot-Leclercq
ジンセノサイドの薬理作用の重要な標的としての脂質膜
Front Pharmacol, 11 (2020), Article 576887
スコープで見るGoogle Scholar
[12]
M. Ben-Eltriki、S. Deb、M. Hassona、G. Meckling、L. Fazli、M.Y. Chin、N. Lallous、T. Yamazaki、W. Jia、P.S. Rennie、他。
20(S)-プロトパナキサジオールは、アンドロゲン受容体を位置選択的に標的化する:去勢抵抗性前立腺腫瘍における抗がん効果
オンコターゲット, 9 (30) (2018), pp.20965-20978
CrossRefスコープで見るGoogle Scholar
[13]
L. L.Yang、X.Y.Zhang、K.Li、A.P.Li、W.D.Yang、R.Yang、P.Wang、Z.H.Zhao、F.Cui、Y.Qin、et al.
プロトパナキサジオールはSTAT3経路を標的とすることにより、肝細胞癌の上皮間葉転換を阻害する。
Cell Death Dis, 10 (9) (2019), p. 630
スコープで見るGoogle Scholar
[14]
W. 潘(Pan)、薛(B.Xue)、楊(C.Yang)、苗(L.Miao)、周(L.Zhou)、陳(Q.Chen)、蔡(Q.Cai)、劉(Y.Liu)、劉(D.Liu)、何(H.He)、他。
ジンセノサイドの生物薬剤学的特性とバイオアベイラビリティ改善戦略
Fitoterapia, 129 (2018), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[15]
L.T.コン、Q.ワン、B.X.シャオ、Y.H.リャオ、X.X.ヘー、L.H.イェー、X.M.リュー、Q.チャン
プロトパナキサトリオールとプロトパナキサジオールという構造的に類似した2つのダンマランサポゲニンのラットにおける薬物動態の違い
Fitoterapia, 86 (2013), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[16]
J.ホァン、J.チャン、J.バイ、W.シュー、D.ウー、X.チュウ
ラット腸管吸収に基づく漢方薬丹参耆の主成分のLC-MS/MS測定と相互作用
Biomed Chromatogr, 30 (12) (2016), pp.
CrossRefView in ScopusGoogle Scholar
[17]
Q.F.シュー、X.L.ファン、D.F.チェン
ラットにおけるPanax notoginseng由来ジンセノサイドRb1およびRg1の薬物動態とバイオアベイラビリティ
J Ethnopharmacol, 84 (2-3) (2003), pp.187-192
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
[18]
T. 太田、前田、小田島聡
ジンセノサイドRh2の作用機序:培養B16メラノーマ細胞によるジンセノサイドRh2の取り込みと代謝
J Pharm Sci, 80 (12) (1991), pp.
PDFを見るCrossRefを見るGoogle Scholarを見る
[19]
ジンセノサイドRh2およびそのアグリコンであるプロトパナキサジオールのCaco-2細胞による取り込みと代謝
Biol Pharm Bull, 28 (2) (2005), pp.
CrossRefScopusで見るGoogle Scholarで見る
[20]
T. Niu、D.L. Smith、Z. Yang、S. Gao、T. Yin、Z.H. Jiang、M. You、R.A. Gibbs、J.F. Petrosino、M. Hu
ジンセノサイドの生理活性とバイオアベイラビリティは、パイロシークエンシングによって定義されたA/Jマウス腸内細菌叢のグリコシダーゼ活性に依存する
Pharm Res, 30 (3) (2013), pp.
CrossRefスコープで見るGoogle Scholar
[21]
キム・イーオー, チャ・ケイヒ, イ・イーヒ, キム・エム, チェ・S・W, パン・C・H, ウン・B・H.
模擬消化モデルにおける白参と紅参のジンセノサイドのバイオアベイラビリティ
J Agric Food Chem, 62 (41) (2014), pp.
CrossRefView in ScopusGoogle Scholar
[22]
Y.W.ハ、K.S.アン、J.C.リー、S.H.キム、B.C.チョン、M.H.チェ
MCF-7ヒト乳がん細胞におけるジンセノサイドの選択的細胞内取り込みの液体クロマトグラフィー質量分析による定量検証
Anal Bioanal Chem, 396 (8) (2010), pp.
CrossRefView in ScopusGoogle Scholar
[23]
K. プレバン、S. コップ、E. チャザール、M. ピア、T. ハレビチェク、A. リッツィ、G.F. エッカー、千葉 勉
P-糖タンパク質基質結合ドメインは膜貫通ドメイン/膜貫通ドメイン界面に位置する:光親和性標識とタンパク質ホモロジーモデリングを組み合わせたアプローチ
薬物動態, 67 (2) (2005), pp.
スコープで見るGoogle Scholar
[24]
Z. ヤン、ガオ、ワン、イン、テン、ウー、ユー、ジャン、フー
20(S)-ジンセノサイドRh2の吸収・排出機構の解明による経口バイオアベイラビリティの向上
薬物代謝学, 39 (10) (2011), pp.1866-1872
CrossRefScopusで見るGoogle Scholarで見る
[25]
B. 李 浩煜、邵 玲、邓 婷、Z.Y.Deng、鄭 奕婷、W.Li
ヒト臍帯静脈内皮細胞(HUVEC)におけるH₂O₂誘発細胞傷害に対する保護効果に影響を与えることなく、エステル化によりCaco-2細胞におけるジンセノサイドRh2の腸管吸収が促進された。
J Agric Food Chem, 62 (9) (2014), pp.
CrossRefView in ScopusGoogle Scholar
[26]
W. Wang、X. Wu、L. Wang、Q. Meng、W. Liu
20(S)-プロトパナキサジオールオコチロール型エピマーの立体選択的性質は、その吸収およびP-糖タンパク質阻害に影響する。
PLoS One, 9 (6) (2014), Article e98887
CrossRefScopusで見るGoogle Scholar
[27]
S. 周、L.Y.リム、B.チョウベイ
P糖タンパク質の薬草による調節
Drug Metab Rev, 36 (1) (2004), pp.
スコープで見るGoogle Scholar
[28]
J. 張、周、呉、谷、艾、鄭、李、張、昊、孫、他。
20(S)-ジンセノサイドRh2はin vitroおよびin vivoでP-糖タンパク質を非競合的に阻害する:ハーブと薬物の相互作用の場合
薬物メタボディスポ, 38 (12) (2010), pp.2179-2187
CrossRefView in ScopusGoogle Scholar
[29]
J. 張(Zhang)、周(Zhou)、牛(Niu)、陸(Lu)、呉(Wu)、孫(Sun)、王(Wang)
ジンセノサイドRh2エピマーによるP糖タンパク質の立体選択的制御と薬物動態からみた潜在的メカニズム
PLoS One, 7 (4) (2012), Article e35768
CrossRefScopusで見るGoogle Scholar
[30]
J. ザー、X.L.ウー、L.S.リュー、W.J.シャオ、R.R.グー、R.B.サン、X.Y.ユー、T.チェン、他。
20(S)-ジンセノサイドRh2とHIVプロテアーゼ阻害剤リトナビルとのin vitroおよびin vivoにおける薬物動態学的相互作用
Acta Pharmacol Sin, 34 (10) (2013), pp.1349-1358
CrossRefView in ScopusGoogle Scholar
[31]
N. Li、D. Wang、Ge、X. Wang、Y. Liu、L. Yang
ジンセノサイド代謝物はin vitroおよびin situで3つの吸収モデルを用いてP糖タンパク質を阻害する
Planta Med, 80 (4) (2014), pp.
スコープで見るGoogle Scholar
[32]
W. Guo、Z. Li、M. Yuan、G. Chen、Q. Li、H. Xu、X. Yang
プロトパナキサジオールのC20-24エピマーエポキシドの立体選択的ADME特性に関するドッキング解析による分子的洞察
Biomolecules, 10 (1) (2020)
Google Scholar
[33]
S. Mollazadeh, A. Sahebkar, F. Hadizadeh, J. Behravan, S. Arabzadeh
P糖タンパク質とその阻害剤の構造的・機能的側面
生命科学, 214 (2018), 118-123頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[34]
L. 陳、L. 周、Y. 王、G. 楊、J. 黄、Z. タン、Y. 王、G. 周、J. 廖、D. 欧陽
健常人におけるジンセノサイド化合物Kの単回投与の薬物動態に対する食物および性別に関連した影響
Front Pharmacol, 8 (2017), p. 636
Google Scholar
[35]
C. Liu、M. Hu、H. Guo、M. Zhang、J. Zhang、F. Li、Z. Zhong、Y. Chen、Y. Li、P. Xu、et al.
糖尿病ラットにおけるジンセノシドRb1の経口投与による曝露促進には、腸管透過性の亢進と腸管における脱グリコシル化の阻害が複合的に寄与していること
Drug Metab Dispos, 43 (11) (2015), pp.1702-1710
CrossRefView in ScopusGoogle Scholar
[36]
H. ファン、シャオ・リン、ヤリウ、ミン・ミン、シュエ、シアン・シェン、リー・フー
正常およびwalker 256腫瘍担癌ラットにおけるジンセノサイドRg3およびジンセノサイドRh2の経口投与後の薬物動態比較
Pharmacogn Mag, 12 (45) (2016), pp.
スコープで見るGoogle Scholar
[37]
J.H.朱、J.D.徐、S.S.周、X.Y.張、J.周、M.孔、Q.毛、H.朱、S.L.李
高麗人参の腸内代謝における正常ラットと免疫抑制ラットの違い
Eur J Drug Metab Pharmacokinet, 46 (1) (2021), pp.93-104
CrossRefScopusで表示Google Scholar
[38]
L.Y.ドゥ、T.ジャン、K.ウェイ、S.チュー、Y.L.シェン、P.イェ、H.E.チャン、C.B.チェン、E.P.ワン
UHPLC-MS/MSを用いたラット血漿中4種のジンセノサイドの同時定量と正常ラットおよびうつ病ラットの薬物動態比較試験への応用
J Anal Methods Chem, 2021 (2021), Article 4488822
スコープで見るGoogle Scholar
[39]
C. Lv、Q. Li、Y. Zhang、Z. Sui、B. He、H. Xu、Y. Yin、X. Chen、K. Bi
ラット血漿中のポリガラキサントンIII、4種のジンセノサイドおよびツムロシン酸の同時定量を目的としたスイッチングイオン化モードによるUFLC-MS/MS法:正常ラットとアルツハイマー病ラットの薬物動態比較試験への応用
J Mass Spectrom, 48 (8) (2013), pp.
CrossRefView in ScopusGoogle Scholar
[40]
W.W. Dong, F.L. Xuan, F.L. Zhong, J. Jiang, S. Wu, D. Li, L.H. Quan
ジンセノサイド代謝活性の異なる動物におけるラット腸内細菌叢組成の比較解析
J Agric Food Chem, 65 (2) (2017), pp.327-337
CrossRefView in ScopusGoogle Scholar
[41]
T.
大建中湯(TU-100)は腸内細菌叢の構造を形成し、ジンセノサイド代謝物化合物Kの産生を増加させる。
Pharmacol Res Perspect, 4 (1) (2016), Article e00215
グーグル スカラー
[42]
H. シェン、X.J.ガオ、T.リー、W.H.ジン、B.L.ハン、Y.M.ジャ、N.フー、Z.X.ヤン、S.L.リー、R.ヤン
高麗人参多糖体は、腸管吸収を促進し、腸内微生物の代謝に影響を与えることで、ジンセノサイドRb1および微生物代謝物の曝露を促進した。
J Ethnopharmacol, 216 (2018), 47-56頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[43]
S.S. Zhou, J. Xu, H. Zhu, J. Wu, J.D. Xu, R. Yan, X.Y. Li, H.H. Liu, S.M. Duan, Z. Wang, et al.
高麗人参煎じ薬に共存する多糖類によるジンセノサイドの全身曝露促進における腸内細菌が関与するメカニズム
Sci Rep, 6 (2016), Article 22474
ScopusGoogle Scholarで見る
[44]
G.アルベス、L.A.ロボ、R.ドミンゲス、M.モンテイロ、D.ペローネ
コーヒーとパンからの遊離およびメラノイジン結合フェノール化合物の生物学的アクセス性と腸内代謝
Front Nutr, 8 (2021), Article 708928
スコープで見るGoogle Scholar
[45]
A. ブラウネ、M. ブラウト
ヒト腸内における食事性フラボノイドの変換に関与する細菌種
腸内細菌, 7 (3) (2016), 216-234頁
CrossRefView in ScopusGoogle Scholar
[46]
J.S. Ryu, H.J. Lee, S.H. Bae, S.Y. Kim, Y. Park, H.J. Suh, Y.H. Jeong
高麗人参を発酵させた紅参エキスのバイオアベイラビリティについて
J Ginseng Res, 37 (1) (2013), pp.
CrossRefView in ScopusGoogle Scholar
[47]
I.D. Choi, J.H. Ryu, D.E. Lee, M.H. Lee, J.J. Shim, Y.T. Ahn, J.H. Sim, C.S. Huh, W.S. Shim, S.V. Yim, et al.
健康な韓国人ボランティアおよびラットにおける発酵紅参エキス(HYFRG™)経口投与後のジンセノサイド化合物K(20-O-β-(D-Glucopyranosyl)-20(S)-protopanaxadiol)の吸収促進試験
Evid Based Complement Alternat Med, 2016 (2016), Article 3908142
スコープで見るGoogle Scholar
[48]
Q.R.フー、P.W.ライ、F.チェン、Y.F.ユー、B.チャン、H.リー、R.リュー、Y.ファン、Z.Y.デン
有望な機能性食品としての桑の葉:噴霧乾燥およびin vitro消化におけるフェノール化合物の変化から
J Food Sci, 87 (3) (2022), pp.1230-1243
CrossRefView in ScopusGoogle Scholar
[49]
S. Yoo, B.I. Park, D.H. Kim, S. Lee, S.H. Lee, W.S. Shim, Y.K. Seo, K. Kang, K.T. Lee, S.V. Yim, et al.
健康成人における紅参に対する黒人参(CJ EnerG)のジンセノシド吸収率および程度増強効果
薬剤学、13 (4) (2021)
Google Scholar
[50]
J. 陳、李、陳、王、李、張、張麗、宋、劉、華、他。
経口投与された高麗人参の薬物動態と組織分布に及ぼす加工方法の影響
J Ginseng Res, 42 (1) (2018), pp.27-34
PDFを見る記事を見るGoogle Scholar
[51]
H. Zhu、H. Shen、J. Xu、J.D. Xu、L.Y. Zhu、J. Wu、H.B. Chen、S.L. Li
硫黄燻蒸した高麗人参と燻蒸していない高麗人参の生体内におけるジンセノサイドの腸内代謝および吸収に関する超高速液体クロマトグラフィー四重飛行時間型質量分析に基づく化学的プロファイリング法による比較研究
Drug Test Anal, 7 (4) (2015), pp.
CrossRefView in ScopusGoogle Scholar
[52]
H. 硫黄薫蒸処理による硫黄の薫蒸効果、硫黄薫蒸処理による硫黄の薫蒸効果、硫黄薫蒸処理による硫黄の薫蒸効果、硫黄薫蒸処理による硫黄の薫蒸効果、硫黄薫蒸処理による硫黄の薫蒸効果、硫黄薫蒸処理による硫黄の薫蒸効果。
高麗人参における硫黄燻蒸処理の効果:代謝および吸収の証拠
J Ethnopharmacol, 256 (2020), Article 112799
PDFで記事を見るScopusで記事を見るGoogle Scholar
[53]
J.-N. フー、K.-T. リー
親油性ジンセノサイド誘導体の生産
C.T. Hou, J.F. Shaw (Eds.), Biocatalysis and biomolecular engineering, John Wiley & Sons, Inc.
CrossRefScopusで見るGoogle Scholarで見る
[54]
B. 朱旭、胡錦濤、葉赫、羅婷婷、劉旭瑞、李赫婷、李吴、鄭毓婷、鄧毓婷
ジンセノサイド化合物KおよびそのブチルエステルおよびオクチルエステルプロドラッグのCaco-2細胞における吸収機構
J Agric Food Chem, 60 (41) (2012), 10278-10284頁
CrossRefView in ScopusGoogle Scholar
[55]
傅炳徳, 兪兪兪, 丙玲, 朱伟, 沈淇兪, 李鵬菲, 王玲, 王大兪, 魏X.B.
20(S)-ジンセノサイドRh2の硫酸化誘導体とLPS誘発炎症性サイトカインおよびメディエーターに対する抑制効果
Fitoterapia, 84 (2013), 303-307頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[56]
K.A. Kim、H.H. Yoo、W. Gu、D.H. Yu、M.J. Jin、H.L. Choi、K. Yuan、L. Guerin-Deremaux、D.H. Kim
プレバイオティック食物繊維は、ラットにおける高麗人参経口投与後の化合物Kの生成およびその後の吸収を増加させる。
J Ginseng Res, 39 (2) (2015), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[57]
K.A. Kim、H.H. Yoo、W. Gu、D.H. Yu、M.J. Jin、H.L. Choi、K. Yuan、L. Guerin-Deremaux、D.H. Kim
水溶性プレバイオティック食物繊維NUTRIOSEが高麗人参経口投与ラットにおけるジンセノサイドRdの吸収に及ぼす影響
J Ginseng Res, 38 (3) (2014), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[58]
X. Zhang、S. Chen、F. Duan、A. Liu、S. Li、W. Zhong、W. Sheng、J. Chen、J. Xu、S. Xiao
プレバイオティクスは、腸内細菌叢を調節することにより、ラットにおけるジンセノサイドの生体内変換および生物学的利用能を増強する。
J Ginseng Res, 45 (2) (2021), pp.334-343
PDFで記事を見るScopusで記事を見るGoogle Scholar
[59]
H. He, Q. Shen, J. Li
ラットにおける2種類のP-糖タンパク質基質の腸管輸送および吸収に対するボルネオールの効果
Arch Pharm Res, 34 (7) (2011), pp.
CrossRefをScopusで表示Google Scholar
[60]
S. Wang, W. Zang, X. Zhao, W. Feng, M. Zhao, X. He, Q. Liu, X. Zheng
ウサギにおける田七人参のノトジンセノサイドR1およびジンセノサイドRg1、Reの薬物動態および組織分布に及ぼすボルネオールの影響
J Anal Methods Chem, 2013 (2013), Article 706723
スコープで見るGoogle Scholar
[61]
D. 鄭、Y. Chu、S. Li、S. Zhou、W. Li、Y. Xie、H. Sun
ボルネオール(Borneol)は、健常人において、丹心配合錠剤経口投与後のジンセノサイドRb(1)、ジンセノサイドRg(1)およびノトジンセノサイドR(1)の薬物動態に及ぼす作用を増強する。
Biomed Chromatogr, 36 (5) (2022), Article e5311
スコープで見るGoogle Scholar
[62]
Y. ハン、T.M.チンタン、L.Y.リム
ピペリンがP-gpの機能と発現に及ぼす影響のin vitroおよびin vivo評価
Toxicol Appl Pharmacol, 230 (3) (2008), pp.283-289
PDFで記事を見るScopusで記事を見るGoogle Scholar
[63]
Z.H. Jin、W. Qiu、H. Liu、X.H. Jiang、L. Wang
ピペリンとの共投与によるジンセノサイドRh2の経口バイオアベイラビリティと免疫反応の増強
Chin J Nat Med, 16 (2) (2018), 143-149頁
PDFで記事を見るScopusで記事を見るGoogle Scholar
[64]
Z. 蔡 琛(J.Bai)、李 鵬(P.Li)、李 迪(D.Li)、趙 昌(M.Zhao)、他。
アスピリンが田七人参サポニンの薬物動態および吸収に及ぼす影響
J Chromatogr B Analyt Technol Biomed Life Sci, 1074-1075 (2018), pp.25-33
PDFで記事を見るScopusで記事を見るGoogle Scholar
[65]
J. Xiong、M. Sun、J. Guo、L. Huang、S. Wang、B. Meng、Q. Ping
アドレナリンによるジンセノサイドRg1のCaco-2細胞における輸送およびラットにおける経口吸収の促進
J Pharm Pharmacol, 61 (3) (2009), pp.347-352
スコープで見るGoogle Scholar
[66]
J. Xiong, M. Sun, J. Guo, L. Huang, S. Wang, B. Meng, Q. Ping
ジンセノサイドRg1のin vitroおよびin vivoにおける活性吸収:ナトリウム依存性グルコース共輸送体1の役割
J Pharm Pharmacol, 61 (3) (2009), pp.
CrossRefScopusで見るGoogle Scholar
[67]
L. 崔玲, 関暁, 丁詠, 羅怡, 王詠, 武郁, 宋淳, 譚暁, 孫詠, 寧琪, 他。
腸管バリア機能を改善し、腸内細菌叢を調節することにより、Scutellaria baicalensis Georgi多糖はDSS誘発潰瘍性大腸炎を改善する。
Int J Biol Macromol, 166 (2021), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[68]
W. Wang、Q.P. Liao、L.H. Quan、C.Y. Liu、Q. Chang、X.M. Liu、Y.H. Liao
ラットにおける海信山製剤経口投与後のジンセノサイドRg1、ReおよびRb1のバイオアベイラビリティおよび脳内濃度に対するAcorus gramineusの影響
J Ethnopharmacol, 131 (2) (2010), pp.313-320
PDFで記事を見るScopusで記事を見るGoogle Scholar
[69]
H. 謝赫(H.Xie)、王大(D.Wang)、張稚(W.Zhang)、閻X.(X.Yan)、趙Y.
panax quinquefolius-acorus gramineusおよびpanax quinquefolius抽出物の経口投与後のUPLC-MS/MSによるラット血漿中の4種のジンセノサイドの比較薬物動態学的研究
J Anal Methods Chem, 2019 (2019), Article 4972816
スコープで見るGoogle Scholar
[70]
Y. Liang、Y. Zhou、J. Zhang、T. Rao、L. Zhou、R. Xing、Q. Wang、H. Fu、K. Hao、L. Xie、et al.
生脈散におけるジンセノサイドとシサンドラリグナンの薬物動態学的適合性:p-糖タンパク質の観点から
PLoS One, 9 (6) (2014), Article e98717
CrossRefView in ScopusGoogle Scholar
[71]
Y. 鄭、G.馮、Y.孫、S.劉、Z.π、F.宋、Z.劉
Caco-2単分子膜を介した主成分輸送特性に基づく処方Ding-Zhi-Xiao-Wanの相溶性相互作用に関する研究
J Pharm Biomed Anal, 159 (2018), 179-185頁
PDFを見る記事を見るGoogle Scholar
[72]
L. チェン、リウ、ワン、ジャン、ティアン
UPLC-MS/MSによる柴胡加竜骨牡蛎湯の2剤型間における6有効成分の薬物動態比較試験
Biomed Chromatogr, 35 (10) (2021), p. e5179
スコープで見るGoogle Scholar
[73]
L.W.チェン、Q.ワン、K.M.チン、X.L.ワン、B.ワン、D.N.チェン、B.C.カイ、T.カイ
エレクトロスプレーイオン化四重極飛行時間型高精細質量分析計(UPLC-QTOF/MS)付き超高速液体クロマトグラフィーによる七雪双布チンキの化学的プロファイリング
Chin J Nat Med, 14 (2) (2016), pp.141-146
PDFで記事を見るScopusで記事を見るGoogle Scholar
[74]
S.H.Bae、J.B.Park、Y.F.Zheng、M.J.Jang、S.O. Kim、J.Y. Kim、Y.H. Yoo、K.D. Yoon、E. Oh、S.K. Bae
高麗人参精製乾燥エキスBST204のラット経口投与によるジンセノサイドRh2およびRg3エピマーの薬物動態と組織分布
ゼノバイオティカ, 44 (12) (2014), pp.
CrossRefView in ScopusGoogle Scholar
[75]
K.M. Joo、J.H. Lee、H.Y. Jeon、C.W. Park、D.K. Hong、H.J. Jeong、S.J. Lee、S.Y. Lee、K.M. Lim
超高速液体クロマトグラフィー/質量分析法を用いたジンセノサイドReと高麗人参果実抽出物のマウスにおける薬物動態研究
J Pharm Biomed Anal, 51 (1) (2010), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[76]
S. Cai, C.H. Shi, X. Zhang, X. Tang, H. Suo, L. Yang, Y. Zhao
20(S)-25-メトキシル-ダンマラン-3β, 12β, 20-トリオールの経口バイオアベイラビリティを改善するための自己乳化型薬物送達システム:調製と評価
Int J Nanomedicine, 9 (2014), pp.
スコープで見るGoogle Scholar
[77]
S. チェン、シュー、ジャン、ワン、リウ、ペン、チェン、リュー、L.H.、J.L.
秦の始皇帝(Panax quinquefolius L)の超微粒粉末、一般的な粉末および伝統的な断片の形態における4種のジンセノサイドの溶解性および相対的バイオアベイラビリティに関するin vitroおよびビーグルでの系統的研究
J Ethnopharmacol, 185 (2016), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholar
[78]
Y. Gu、G.J. Wang、J.G. Sun、Y.W. Jia、W. Wang、M.J. Xu、T. Lv、Y.T. Zheng、Y. Sai
高麗人参由来抗がん栄養素ジンセノサイドRh2のラットおよびイヌにおける薬物動態学的特性評価
Food Chem Toxicol, 47 (9) (2009), pp.
PDFを見る記事を見るScopusで見るGoogle Scholar
[79]
L. Zhao、L. Wang、L. Chang、Y. Hou、C. Wei、Y. Wu
ジンセノサイドCKを担持したセルフナノミセル化固体分散体の溶解性と経口バイオアベイラビリティの向上
医薬品開発技術, 25 (9) (2020), pp.1127-1138
CrossRefScopusで見るGoogle Scholarで見る
[80]
S. ジン、C.H.リー、D.Y.イム、J.リー、S.J.パク、I.S.ソン、M.K.チェ
二酸化ケイ素を用いた紅参抽出物固体分散体の吸湿性と生物学的利用能の改善
薬剤学, 13 (7) (2021), p. 1022
CrossRefView in ScopusGoogle Scholar
[81]
S. Voruganti、J.J. Qin、S. Sarkar、S. Nag、I.A. Walbi、S. Wang、Y. Zhao、W. Wang、R. Zhang
癌遺伝子MDM2の天然阻害剤ジンセノサイド25-OCH3-PPDの経口ナノ送達:ナノ粒子の調製、特性評価、in vitroおよびin vivo抗前立腺癌活性、および作用機序
オンコターゲット, 6 (25) (2015), 21379-21394頁
CrossRefScopusで見るGoogle Scholar
[82]
Y. Dong、R. Fu、J. Yang、P. Ma、L. Liang、Y. Mi、D. Fan
葉酸修飾ジンセノシドRg5担持ウシ血清アルブミンナノ粒子によるin vitroおよびin vivo標的がん治療
Int J Nanomedicine, 14 (2019), pp.6971-6988
CrossRefView in ScopusGoogleスカラー
[83]
K. 伊神慶一郎、小澤雅之、井上聡、猪原大輔、宮﨑俊郎、篠田正樹、安楽正人、平山文雄、上釜健一郎
ジンセノサイドの代謝産物である化合物Kとγ-シクロデキストリンとの包接複合体の形成とその溶出特性
J Pharm Pharmacol, 68 (5) (2016), 646-654頁
CrossRefView in ScopusGoogle Scholar
[84]
H. Li、G. Zhang、Wang、C. Chen、L. Jiao、Wu
ジンセノサイドReとγ-シクロデキストリンとのホスト-ゲスト包接体の調製、特性評価およびバイオアベイラビリティ
分子, 26 (23) (2021), p. 7227
CrossRefView in ScopusGoogle Scholar
[85]
T. カン, ソ, ジョ, チョ, チェ, K.O.
ナノ構造脂質キャリアに取り込まれたジンセノサイドF1の物理的、化学的および生物学的特性評価
J Food Biochem (2021), Article e13860
スコープで見るGoogle Scholar
[86]
X. Zhang、Y. Zhang、S. Guo、F. Bai、T. Wu、Y. Zhao
(R)-25-methoxyl-dammarane-3β,12β,20-triolの経口バイオアベイラビリティの向上:リン脂質複合体をベースとしたナノエマルジョンの設計、特性評価、およびラットにおけるin vivo薬物動態解析
Drug Des Devel Ther, 10 (2016), pp.3707-3716
CrossRefView in ScopusGoogle Scholar
[87]
F. 楊、周、胡、余、劉、潘、張、劉X、廖Y.
ジンセノサイドRh1およびRh2のバイオアベイラビリティを改善するための自己マイクロエマルションの調製と評価
Drug Deliv Transl Res, 7 (5) (2017), pp.
CrossRefView in ScopusGoogle Scholar
[88]
B. 張、潘、Y.Deng、何、J.Gou、Y.Wang、Y.Zhang、T.Yin、D.Liu、X.Tang
薬物受動充填法により調製したPanax quinquefoliumサポニンリポソームによる腸管吸収の改善
日本薬学会雑誌, 46 (10) (2020), 1684-1694頁
CrossRefScopusで表示Google Scholar
[89]
J. 郭捷, 黄玲, 孟炳, 平喆
ラットへの単回経口投与による田七人参サポニンの経口バイオアベイラビリティを高めるための脂質ベースの製剤の使用
Drug Dev Ind Pharm, 34 (1) (2008), pp.65-72
CrossRefScopusで見るGoogle Scholarで見る
[90]
Y. Zhu、J. Liang、C. Gao、A. Wang、J. Xia、C. Hong、Z. Zhong、Zuo、J. Kim、H. Ren、他。
神経膠腫標的治療のための多機能性ジンセノシドRg3ベースリポソーム
J Control Release, 330 (2021), 641-657頁
PDFを見る記事を見るGoogle Scholar
[91]
H. ユー、L.テン、Q.メン、Y.リー、X.サン、J.ルー、J.L.R、L.テン
リポソームジンセノサイドRg3の開発:製剤の最適化と抗がん効果の評価
Int J Pharm, 450 (1-2) (2013), pp.
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
引用元: (0)
© 2023 The Korean Society of Ginseng. エルゼビアB.V.による出版サービス。
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイトのすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はElsevier B.V.に帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
