腸管粘膜免疫における腸内細菌叢と自然リンパ系細胞のクロストーク
494件閲覧総数
14ダウンロード
記事のインパクトを見る
レビュー記事
Front. イムノル、2023年5月25日
第2巻 微生物免疫学
第14巻-2023年|https://doi.org/10.3389/fimmu.2023.1171680
腸管粘膜免疫における腸内細菌叢と自然リンパ系細胞のクロストーク




郭裕玲、劉玉嘉、瑞斌基、雷曾傑、寧錫熙、劉殷慧*、李明*。
大連医科大学基礎医学院微小生態学教室(中国・大連市
ヒトの消化管粘膜には何千もの微生物が生息しており、様々な生理的機能に関与している。腸内細菌の異常は、いくつかの疾患の病因と密接に関連している。自然リンパ球(ILC)は、NK細胞、ILC1s、ILC2s、ILC3s、LTi細胞を含む自然免疫細胞の一種である。生体の粘膜組織に豊富に存在し、近年、注目されています。腸内細菌叢とその代謝産物は、炎症性腸疾患(IBD)、アレルギー疾患、がんなど、さまざまな腸管粘膜疾患に重要な役割を担っている。そのため、ILCと腸内細菌叢の相互作用に関する研究は、関連する複数の疾患に対する薬物療法のターゲットを特定する可能性があるため、臨床的に大きな意義があります。本総説では、ILCの分化と発達、腸内細菌叢の生物学的機能、および疾患におけるILCとの相互作用に関する研究の進展を解説し、将来の疾患治療のための新しいアイデアを提供することを目的としている。
1 腸内細菌叢と腸管粘膜免疫
ヒトの腸管粘膜には、真菌、ウイルス、細菌など様々な微生物がコロニーを形成しており、これらをまとめて腸内細菌叢と呼んでいます。生後間もない頃の腸内細菌叢の発達は、分娩方法、摂食形態、生活習慣など様々な周産期条件の影響を受けるダイナミックなプロセスであり(1)、数多くの生理機能に寄与している(2)。腸内細菌叢は、腸管上皮細胞(IEC)やパネス細胞を介して宿主の栄養利用に影響を与え、さらには免疫細胞の増殖や機能を制御することができます(3, 4)。腸内細菌叢は、腸粘膜の免疫系と相互作用し、包括的な腸の防御機構を生成しています。この相互作用は、腸粘膜の免疫機能を制御するシグナル伝達経路をサポートし、防御システムは共同で、直接的および間接的に外来病原体の侵入に抵抗します(5)。ヒト粘膜組織に豊富に存在する自然免疫細胞の一種であるILCは、地域免疫と恒常性の制御に重要な役割を果たすことから、近年大きな注目を集めている(6)。
1.1 腸内細菌叢(ちょうないさいきんそう
腸は、消化に伴う栄養や水分の吸収の主要な場であり、外部環境からの有害物質や病原体に対する基本的な障壁を構成している。腸内細菌叢は、腸のバリア機能を支える重要な役割を担っている(7)。ヒトの腸内には数百兆個もの有益な細菌が存在し、数百万年にわたる共進化から生まれた共生関係を表しています。これらの細菌は、炭水化物の消化・発酵、ビタミン産生(9)、上皮細胞の成熟(4、10)、血管新生(11)、リンパ球の発達(12-14)などの生理機能に寄与し、ヒトの腸の健康に大きく貢献しています(8)。また、腸内細菌叢は、病原性感染症から宿主を守るためにも不可欠である。例えば、腸内細菌叢は、食餌性栄養素の競合によって腸内細菌性病原体の内腔コロニー形成を制限することができる(15)。また、腸内常在菌は、樹状細胞(DC)を介して寄生虫に対する防御的な免疫応答を誘発する。TLR11が存在しない場合、寄生虫に対する免疫応答は、常在細菌による樹状細胞への間接的な刺激に依存する。腸内細菌は、TLR2、TLR4、TLR9を介してMyD88を活性化し、寄生虫に反応しうるIL-12を生成する(16)。さらに、腸内細菌がエネルギー恒常性の調節に関与していることがいくつかの研究で示されています。例えば、エネルギー恒常性に関与する腸内ペプチド(GLP-1、PYY)が合成されます。高脂肪食による肥満や代謝異常は、自然免疫系と関連している可能性がある(2)。
しかし、ヒトと腸内細菌叢の間には共生関係があるにもかかわらず、これらの微生物の影響は必ずしも穏やかではない。宿主と腸内細菌叢のバランスのとれた相互関係が破壊されると、腸内細菌が病気を引き起こすことがある(17、18)。例えば、Enterococcus faecalisはグラム陽性の腸内常在菌ですが、粘膜組織に侵入して日和見的に菌血症や心内膜炎を引き起こすことがあります(19)。また、過敏性腸症候群(IBS)は、微生物叢の著しい変化と関連しており、特にファーミキューテス属とプロテオバクテリアのいくつかのグループが関与していた(20、21)。腸内細菌由来のリポ多糖(LPS)は、肥満や関連する代謝(インスリン抵抗性や2型糖尿病など)の誘因の一つとして認識されている(22)。微生物が病気や健康に果たす役割についての理解は広がり続けており、小さな障害でもこの共生関係を壊し、微小環境の不均衡を引き起こすことが判明しています。
蓄積された証拠は、腸内細菌叢と人間の病気との間に密接な関係があることを証明している。例えば、IBD患者は腸内細菌叢が変化していることが様々な研究で示されています(23-26)。IBD患者の腸内細菌が産生する短鎖脂肪酸(SCFA)濃度の低下は、腸の恒常性維持に重要なTreg細胞の分化・発達やIECの増殖に影響を与える(27)。食物アレルギーのある人では、クロストリジウムによって大腸のラミナプロプリアが大量のTGF-βを産生し、Foxp3+Tregの分化を促進します(28)。その後、Foxp3+Treg細胞はTGF-β、IL-10、IL-35を介して炎症反応を抑制し、食物に対する経口耐性を維持し(29)、吐き気、嘔吐、下痢、掻痒感などの本現象を緩和させる。また、微生物叢は、がんの文脈でも特別な意味を持つ。腸内細菌叢は免疫系を制御することができ、その結果、抗がん作用をもたらす。ある研究では、肝細胞がん(HCC)モデルマウスにおいて、腸内のラクトバチルス・ロイテリおよびSCFA、特に酢酸が著しく減少していることが明らかになりました。さらに、HCCマウスにおいて、Lactobacillus reuteriの補充や野生型マウスの糞便菌の移植が有意な抗腫瘍効果を示すことが示された(30)。
1.2 腸管粘膜免疫
多細胞生物は、気道粘膜、口腔粘膜、消化器・泌尿器粘膜、皮膚粘膜など複数のニッチで外部環境と相互作用しており、これらは一体となって粘膜関連リンパ組織(MALT)を構成しています。腸は最も表面積が大きく、粘膜界面が広い臓器であり(31、32)、食餌性抗原や様々な微生物と絶えず相互作用しうる。そのため、腸管粘膜の表面は、自然免疫と適応免疫の調節に重要な部位である(33)。MALTは、腸管関連リンパ組織(GALT)、鼻腔関連リンパ組織、気管支関連リンパ組織を含む末梢免疫器官であり、その機能は脾臓やリンパ節と同様である。GALTは、最大のリンパ系器官の一つで、主に腸管とその周辺組織に存在する。その表面積は230~300平方メートルで、腸管粘膜免疫の「第一防衛ライン」を担っている。組織学的に、GALTにはパイエル板、クリプトパッチ、孤立性リンパ濾胞(ILF)、腸間膜リンパ節(MLN)などがある(34、35)。GALTには、M細胞(36)などの非免疫細胞や、ヘルパーT(Th)細胞、Treg細胞、細胞障害性Tリンパ球、IgA産生B細胞などの免疫細胞も含まれる。ILC、食細胞、DC、マクロファージ(37)などは、いずれも単発のリンパ球である。腸内細菌叢がGALTの発生と成熟に重要であることは、数多くの実験的研究により明らかになっている(17)。無菌マウス(GF)、特異的病原体除去マウス(SPF)ともにGALTの発達に障害があり、主にクリプトパッチやILFに現れる(38、39)。しかし、微生物叢移植によりGFマウスの腸内微生物系を再構築すると、GALTが再生され(40)、粘膜免疫系が回復する(41)。近年、研究者は腸管粘膜免疫系において、従来のTリンパ球やBリンパ球とは異なる新しいタイプの免疫細胞を発見した。ILCと呼ばれるこれらの細胞は、新たな研究ホットスポットとなっている(42)。ILCは、リンパ系臓器と非リンパ系臓器に存在し、アレルゲン、常在菌、病原体にさらされる粘膜バリアで濃縮されている(43)。
2 ILCs
2.1 ILCの分化と発生
2009年から2010年にかけて、リンパ球様非T細胞、非B細胞、ナチュラルキラー(NK)細胞がいくつかの論文で報告された(44-47)。これらの細胞を表す「ILCs」という名称は、2013年に初めて提案されました(48)。ILCは、よく知られたNK細胞やリンパ組織誘導細胞、最近発見された非細胞毒性ILC集団などを含む、自然免疫細胞の新しくユニークなファミリーを構成しています(49)。ILCは、ほぼすべての臓器・組織(肺、肝臓、胃、腸、膵島、脂肪組織、脾臓、リンパ節など)に存在するが(50-52)、粘膜組織に富み、恒常性の維持や組織修復に重要な役割を担っている。
ILCは、中枢免疫臓器の骨髄に存在する共通リンパ系前駆細胞(CLP)に由来し(53)、リンパ系の形態を示す。ILCの分化は、DNA結合阻害因子2(ID2)や核因子、インターロイキン3調節因子(Nfil3)、GATA結合因子3(GATA3)など、様々な転写因子によって制御されている。CLPはID2、Nfil3、GATA3の作用でコモンヘルパー自然リンパ系前駆細胞(CHILP)に分化し、前骨髄球性白血病亜鉛指(PLZF)の作用で自然リンパ系細胞前駆細胞(ILCP)に分裂する(54、55)。T-bet、GATA3、RORγtなどの転写因子によって駆動され、ILCPはそれぞれILC1s、ILC2s、ILC3sに分化する(56, 57)。CHILPはリンパ組織誘導前駆細胞(LTiP)に分化し、さらにLTi細胞へと分化する。ヒトやマウスでは、NK細胞はCILPからNK細胞前駆体(NKP)を経て発達し、ILC1はCILPからILCPを経て発達します(55)。ILCは、組換え装置なしで成熟することができ、TCRを発現しない。ILCは、環境中の活性化シグナルによってその機能を制御され、大量のサイトカインを産生する(58)。同様に、ILCは、特に上皮のバリア面において、細胞の変化や感染に対する初期の免疫反応において重要な保護的役割を担っている(59)。一方、炎症性疾患はILCsの機能不全の一因となる可能性がある(60, 61)。
ILCは、適応免疫機能を持つ自然免疫細胞である(55)。そのサブセットはリンパ球の典型的な形態的特徴を持つが(58)、抗原特異的レセプターを持たない。したがって、適応型リンパ球(T細胞やB細胞など)とは区別されます(62)。しかし、ILCはCD4 Th細胞の「鏡の細胞」であり、ILC1がTh1の生得的な対応、ILC2がTh2の対応、ILC3/ILCPがTh17の対応であることが明らかにされている。研究結果によると、長鎖非コードRNA(lncRNA)は、自然細胞と適応細胞で異なる発現をしており、ヒトILCの生物学的形成にlncRNAが関与している可能性を主張しています。ILCは、冗長な遺伝的組織ではなく、免疫応答のダイナミクス、微調整、空間的組織においてユニークである(63)。Th細胞のように、ILCは遺伝子の再配列を受けません(64)。ILCのサブセットは表現型的に不安定で、微小環境の変化に応じて自身の機能や関連する表現型を変えることができます(65)。この現象は可塑性と呼ばれる。
可塑性は、マウスにおけるILCs亜集団の終末分化期以前に始まる(66)。ILC3s, ILC2s, ILC1sのin vitroでの形質転換は可逆的である。例えば、ヒトのILC3は、IL-12の作用によりILC1に変換される。一方、この過程はIL-1βとIL-23によって逆転し、ビタミンAの代謝物であるレチノイン酸によって促進される(67)。ILC2sはin vitroでIL-1βとIL-12の影響下でILC1sに変化させることができるが、IL-4はこのプロセスを逆転させることができる(68)。さらに、NK細胞はToxoplasma gondii感染時にILC1へ一方的に転換することができる(69)。原理的には、Tbx21プロモーターの働きでEOMESを強制発現させると、マウスILC1がNK細胞へと変化するが、この過程は生理的条件下では起こらない(70)。Salmonella enterica subsp.感染後、NKp46+ILC3はIL-12の作用によりRORγtの発現を低下させ、ILC1へ分化し、細菌感染に対する防御に貢献する(71、72)。しかし、クローン病患者の炎症組織では、ILC1やIL-17産生ILC3の集積が観察され(73、74)、IL-22産生ILC3の減少を伴っている。このようなILCsの組成の変化は、疾患の重症度と関連している(75)。さらに、乾癬患者の炎症皮膚では、NKp44-ILC3sからNKp44+ILC3sへの変換が観察され、NKp44+ILC3sの数の増加をもたらし、これは乾癬の重症度と相関している(76、77)。このことは、ILCの可塑性に依存した形質転換が、その抗感染機能や自己免疫機能に必要であることを示唆している。
2.2 ILCの分類と機能的特徴
2.2.1 NK細胞およびILC1s
細胞傷害性CD8+T細胞と同様に、NK細胞も細胞傷害性機能を持つ(78)。NK細胞は、白血病を含む様々ながん細胞を排除することができる(79)。さらに、NK細胞は、がんの治療、特に骨髄移植の際に有用であることが証明されている(80)。ILC1は通常、Th1細胞のように細胞毒性を持たないか、弱い細胞毒性を持つが(74、81、82)、ウイルス感染や一部の細菌性病原体に対する防御の第一線を担っている。NK細胞とILC1細胞は、重要な転写因子であるT-betに依存している。例えば、NK細胞はパーフォリンを発現する細胞傷害性細胞であるが、ILC1sは低レベルのパーフォリンしか発現しないなど、NK細胞とILC1sは機能が若干異なる。マウスでは、ILC1sは出生前に検出されるが、NK細胞は出生後2〜3週間で出現する(83)。さらに、転写因子の産生と依存性にも違いがある。マウスでは、ILC1sはT-betに厳密に依存しているが、NK細胞はT-bet欠損宿主にも存在することができる(84)。また、NK細胞は転写因子Eomesを必要とするが、ILClはEomesの非存在下でも発生する。そのため、Eomesの発現はNK細胞のマーカーとして用いられることが多いが、一定の割合でILC1にも発現することがある(55)。しかし、IL-12、IL-15、IL-18で刺激されると、腫瘍壊死因子(TNF)やインターフェロン-γ(IFN-γ)を産生し、ウイルス(85)、細胞内細菌(81)、寄生虫(72)に対する防御免疫を提供します。
2.2.2 ILC2s
Th2細胞については、RAR関連オーファン受容体α(RORα)、T細胞因子1(TCF1)、GATA-3(55、86-88)がILC2sの発達と維持、2型サイトカインの産生を誘導していることが分かっています。マウスでは、ILC2sのマーカーは通常CD25、KLRG1、ICOSまたはST2であり、ヒトでは、ILC2sはCD161、ST2、CRTH2の発現によって認識される(89)。IL-25、IL-33、胸腺間質リンパポエチン(TSLP)による刺激を受けて、ILC2sはIL-5、IL-13、IL-6、IL-9を産生し(86、89-92)、線虫や他の虫の感染に対する防御に役割を果たす(93、94)。また、ILC2はアンフィレグリンを産生し、組織損傷後の上皮バリアの完全性を回復させることができる(95)。さらに、インフルエンザウイルスの急性感染後、ILC2は上皮成長因子ファミリーメンバーのアンフィレグリンを産生し、それにより呼吸器組織の治癒を促進する(96)。また、インフルエンザウイルスに急性感染すると、ILC2が上皮成長因子ファミリーメンバーであるアンフィレグリンを産生し、それによって呼吸器組織の治癒が促進される(86、89)。さらに、最近の研究では、ILC2が皮膚に存在し、皮膚の炎症(アトピー性皮膚炎[AD]など)に寄与する可能性があることが明らかになっている(97、98)。
2.2.3 ILC3sとLTi細胞
Th17細胞やTh22細胞(55)と同様に、ILC3はその分化、発達、機能発現に転写因子RORγt(RORγt)とアリール炭化水素受容体(AHR)を必要とする(99)。ILC3は、IL-17A、IL-22、TNF、顆粒球マクロファージコロニー刺激因子(GM-CSF)などのサイトカインを分泌することができる(51、100、101)。その結果、これらは、体が細胞外細菌に抵抗するのを助け、リンパ組織の発達と修復を促進し(102)、腸の恒常性を維持することができる(101、103)。IL-22は、IECによるムチンの産生を促進し、腸管陰窩幹細胞(104)の増殖を維持し、それによって腸管上皮バリアの完全性を保護することができる(105)。IL-17は、タイトジャンクションタンパク質の合成を促進することによってIECを保護し、それによって腸の恒常性を維持することができる(106)。さらに、IL-17は、IECや内皮細胞の分泌因子や成長因子を活性化して好中球の分化を誘導し、炎症に対する免疫反応に影響を与えることができる(107)。ILC3は、微生物叢に対する免疫寛容を生み出し、抗原特異的なRORγt+ Treg細胞やTh17細胞を介して腸の健康を守る(108)。また、腸内微小生態系のホメオスタシスを維持し、そのダウンレギュレーションは大腸炎を引き起こす可能性がある(109, 110)。さらに、ILC3はSalmonella typhi (111), Candida albicans (112), Streptococcus pneumoniae (113) に対する防御にも関与し、共生のトランスロケーションと全身性の炎症を防ぐ(96)。さらに、ILC3が炎症を起こした腸の再生を促進すること(114)や、肺のアレルギー性気道過敏性を制御すること(115)を発見した研究もあり、ILC3が炎症や損傷時の組織の恒常性維持に関与していることが示されています(116)。
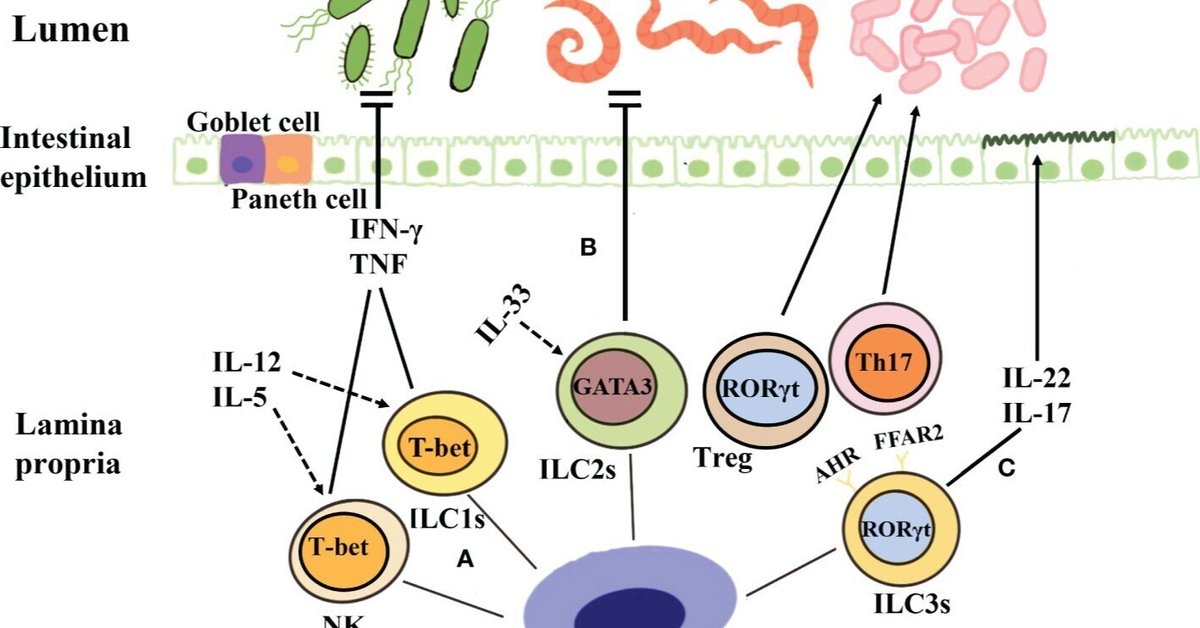
LTi細胞は1997年に初めて報告され(117)、c-kitとCCR6を発現し、転写因子RORγtに依存している(55)。TNF-αとリンパカインβの影響により、LTi細胞は胚発生過程において二次リンパ節とパイエル斑の形成に重要な役割を果たす(118, 119)。成体マウスでは、LTi細胞、B細胞、DCが一緒になってILFを構成している(120)。近年、いくつかの研究により、LTi細胞がNF-κBおよびToll様受容体2シグナルを通じてIL-22を発現することが示された(121)。さらに、LTi細胞はIL-17AやIL-22も分泌し、病原体から消化管を保護することを可能にしている(122)(図1、表1)。
図1
図1 ILCの分類と機能。(A)NK細胞もILC1も重要な転写因子T-betに依存し、IL-12やIL-5などの刺激を受けると腫瘍壊死因子やIFN-γを分泌し、ウイルスや細胞内細菌、寄生虫に対する防御免疫力を発揮する。(B)ILC2の発生は転写因子GATA3に依存しており、この細胞はIL-33の作用によりIL-5やIL-13などのサイトカインを産生し、寄生虫の感染予防に貢献する。(C)ILC3は、転写因子ROR-γに依存し、IL-17やIL-22を分泌し、急性炎症期には腸粘膜上皮細胞の保護、腸の恒常性維持、粘膜修復を助けることができる。さらに、ILC3は、抗原特異的なRORγt+TregやTh17細胞を通じて、微生物叢に対する免疫寛容を確立し、腸の健康を促進することもできる。
表1
表1 さまざまな自然免疫サブセットの主な機能とその表現型の関連性をまとめたもの。
3 ILCと腸内細菌叢の相互作用
健康な人では、粘膜免疫系は腸内細菌叢と共生的な関連を示している。腸管前膜のほとんどのリンパ球は、上皮細胞1層によって常在菌のマイクロバイオームと隔てられているだけである。腸管上皮バリアと共生菌の安定した関係は、免疫系に依存している。さらに、常在細菌は、哺乳類の免疫系の恒常性や発達にも深い影響を与えます。免疫系の重要な一部として、ILCはこの共生の均衡を保つために重要な役割を担っています。したがって、個体レベルと群集レベルの両方で微生物に影響を与えることができます(表1)。
3.1 腸内細菌叢がILCを制御する
3.1.1 正常な腸内細菌叢はILCを制御する
腸内細菌叢は、ほとんどのILC群の発達に必要なものではないようです。しかし、常在菌からのシグナルは、腸内のサイトカインの良好な発現を促進し、ILCの機能に大きく影響する。NK細胞の分化と発達には微生物叢の役割は必要ないが、共生がない場合、NK細胞の機能は変化する。GFや抗生物質を投与したマウスでは、NK細胞の細胞傷害活性とサイトカイン産生がともに低下している(123)。その理由はおそらく、樹状細胞やマクロファージが産生する1型インターフェロンがIL-15の産生を促進し(137、138)、それがさらにNK細胞の成熟を促進するためであろう。したがって、共生微生物叢は間接的にNK細胞の生成を制御していることになる(139、140)。研究者らは、胎児の腸内に存在するILC1の数が極めて少ないことを明らかにしており(67、73)、ILC1の発生が常在細菌に依存していることを示している。同時に、共生微生物が存在しない場合、ILC3sからILC1sへの形質転換が阻害されることがわかった(125)。GFマウスとSPFマウスでは、ILC2sとそのマーカー(IL-25とIL-33受容体、IL-7RαとT1/ST2とc-kit受容体)における量と割合に有意差はない(95)。このことは、ILC2sの発生に微生物叢は必要ないことを示している(139)。しかし、常在菌の欠如は、腸内のILC2の割合を有意に増加させた(127)。研究により、微生物叢はIL-25の放出を促進することで腸内のILC2sの機能を調節し、それによってILC2sが介在する腸管バリアが改善されることが示されています(133、141)。近年の研究で、LTi細胞もToll様受容体2を発現し、NF-κBシグナル伝達経路を通じてIL-22を発現できることが分かってきた(121)。これは、LTi細胞がグラム陽性菌の細胞壁成分を直接感知している可能性があることを意味する。グラム陰性菌のペプチドグリカンによって、LTi細胞は腸管陰窩パッチの薄層プロプリアに集積することができる(39)。GFマウスの腸ではILFの成熟が損なわれており、LTi様RORγt+ ILCの機能の一部が損なわれていることを示している(39、142)。腸内細菌叢は、マウスの組織において骨髄系細胞によるIL-1β産生を促進し、IL-1βはILC3を刺激してIL-2を生成し、それによってTregの生成と食物抗原に対する腸管耐性を促進する(143)。CD11c+骨髄性樹状細胞は、腸内細菌叢に応答してIL - 1βとIL - 23を産生し、ILC3のIL22産生に関与する(144)。樹状細胞のTLR5を細菌タンパク質のフラジェリンで刺激すると、IL - 23の産生が促進され、それによってILC3sを介したIL - 22の産生につながる(145)。
3.1.2 病原性細菌はILCを制御する
ILCは粘膜表面に近接しているため、様々な共生菌や病原性細菌の影響を受けやすくなっています。ILCは、宿主を保護し、組織の完全性を維持するために、様々な病原体に対応することができる。例えば、Clostridium Rodentiaeに感染すると、小腸のILC1の数が増加する(146)。これは、腸内のILC1とILC3の可塑性に起因すると考えられる。最近の研究で、ヘリコバクター・ピロリ感染により、ヒトやマウスの胃組織でILC2が増加し、IL-5の産生とB細胞数の増加を伴うことが示されている(147、148)、ヘリコバクター・ピロリに感染したGFマウスに抗IL-5中和抗体を投与すると、B細胞の割合が著しく低下することが判明した。適応免疫を持たないマウスの大腸では、ヘリコバクター種Helicobacter ApodemusとHelicobacter pyloriの導入によりILCが活性化し、腸の生態系障害が誘発される(149)。しかし、Helicobacter pyloriはT-betの発現を有意に抑制し、T-bet陰性ILC3s細胞は有意な変化を示さないが、増殖能は有意に低下した(150)。Salmonella typhimuriumは、ILC3sを選択的に増強し、感染を促進しうるIL-22を産生させた(151)。さらに、Salmonella typhimuriumはILC3sに侵入し、Caspase-1を介したILC3s pyroptosisを引き起こすことができる(151)。逆に、ILC3sのカスパーゼ-1の消失は、ILC3sの生存率とIL-22産生の増加をもたらし、それによってマウスのSalmonella typhimurium感染を促進する。また、サルモネラ感染症は、NKp46-ILC3sをILC1sに分化誘導することができる。Buonocoreら(152)は、Helicobacter hepaticaがIL-23依存性の大腸炎を誘発することを発見した。ILC3によるIL-17およびIFN-γの産生の増加は、大腸炎の発症と関連している。炭疽菌は、炭疽菌の致死毒素により体内のILC3の機能を破壊し、MAPKシグナル経路で産生されるIL-22が減少し、腸内細菌叢のバランスをさらに崩してしまう(153)。Citrobacter感染時には、ILC3はリンパ毒素を分泌し、樹状細胞上のLTβRに結合し、IL-23の産生を誘発することができる。IL-23はILC3sを刺激してIL-22を産生させ、宿主を保護することができる(154)。また、Citrobacter感染時には、LTi細胞上のGPR183の発現がLTi細胞のパイエル板やILFへの移動を促進し(155)、ILC3を介したCitrobacter感染に対する防御にも重要であることが分かっている(156)。Citrobacter感染後、ILC3におけるSTAT3の発現は亢進し、IL-22と結合して抗感染作用を発揮する(157)。
3.1.3 食事は腸内細菌叢を介してILCを制御する
ILCが食事やその代謝物に関連していることを示唆する証拠が増えてきている。食事性ビタミンAの不足は、ILC3sの異常減少、IL-22産生の深刻な欠乏、Citrobacter rodentsの消化管感染への感受性を高めると予想される(158)。腸管lamina propriaの樹状細胞が産生するビタミンA代謝物であるレチノイン酸(RA)は、ILC1sとILC3sのgut homing receptorの発現を促進し(159)、RORγtのアップレギュレーションによりILC3s機能を高め(160)、IL-22の産生を高める(161)。逆に、RAはIL-7Raを上昇させることでILC2sの増殖を促進し、ビタミンA欠乏症成体マウスの腸内のILC3sの量は減少する。ビタミンA欠乏時にILC2が増加することで、虫の排出効率を高めることができる(158)。既存の研究では、微量栄養素の欠乏期には、脂肪酸代謝によってILC2sが維持され、IL-13の産生を維持できることが示されている(162)。このように、宿主の食事状態によってILCのバランスが変化し、免疫応答が選択的に最適化され、それによって感染傾向が変化することがある。
大腸微生物叢における未消化の炭水化物の主な代謝産物はSCFA(酢酸、プロピオン酸、酪酸を含む)である。SCFAは体のエネルギー源となるだけでなく(163)、宿主細胞との相互作用を通じて免疫動態のバランスを促進します(164)。例えば、乳酸菌はトリプトファンを利用して、ILC3におけるIL-22の産生を増加させることができる(126)。トリプトファン代謝によって生成されたリガンドはAHRを活性化し、それによってILC3sの機能を促進することができる(129、165)。SCFAは、その受容体である遊離脂肪酸受容体2(FFAR2)を介して、Citrobacter rodentに対する宿主防御を仲介することができる(166、167)。FFAR2のILC3特異的ノックアウトマウスでは、CCR6+ILC3の数とIL-22の産生が減少し、ムチンや抗菌ペプチドの産生が低下し、Clostridium difficile腸炎を悪化させる。逆に、デキストラン硫酸ナトリウム(DSS)誘発大腸炎マウスにSCFAやFFAR2アゴニストを与えると、マウスの大腸でILC3やIL-22の産生が増加し、腸の傷害に対する保護作用がある(99, 167, 168)。GFまたは抗生物質処理マウスでは、ILC3sのIL-22産生能が増強され(114)、逆にILC3sに酪酸を添加するとin vitro実験でIL22の産生を制限する(169)。さらに、一部のSCFAはAKT - STAT3およびERK - STAT3シグナル経路を刺激し、ILC3sのIL - 22産生を誘導することができる(167)。産生されたIL - 22は、微生物群集の豊かさを維持するだけでなく、Candida albicansなどの真菌のコロニー形成に抵抗し、それによって粘膜を炎症から守ります(135)。
3.2 ILCは腸内細菌叢に影響を与える
3.2.1 NK細胞とILC1sの腸内細菌叢への影響
NK細胞とILC1sは、ヒト腸管上皮単層における細胞の透過性を高め、共生細菌の移動を促進することが実証されている(124)。CNK細胞は主に血液中を循環しているか、骨髄やリンパ管に存在している。トキソプラズマ・ゴンディ感染後にIL-12が大量に産生されると、NK細胞のILC1s様表現型(Eomes CD49a Ly6C)への移行が誘導される。腸内細菌叢はNK細胞と相互作用する。例えば、マウスに高塩分食を与えると腸内のビフィズス菌の存在量が増え、腸管透過性が高まり、腫瘍内にビフィズス菌が局在するため、NK細胞の機能が高まり腫瘍が退縮する、ビフィズス菌を腫瘍に注入するとNK細胞が活性化し腫瘍増殖が抑制される(170)。高カロリー食は腸管免疫系を過剰に活性化させ、マイクロバイオームと上皮細胞の機能を破壊する。高カロリー食を与えたマウスでは、ILC1sの枯渇はAkkermansia muciniphilaの増加とBilophila属の減少とも関連していることが新しい研究により明らかになった。 炎症性のマクロファージとILC2がILC1を必要とし、ILC1s枯渇はILC3s-IL-22経路を誘導し、結果としてムチン、抗菌ペプチドを増産し、さらに腸の細菌叢に影響を与える (171).
3.2.2 ILC2sの腸内細菌叢への影響
ILC2は、IL-33シグナルに関与する自然免疫細胞の一種で、特に2型免疫反応を促進する(172)。ILCはバリアー表面で増強され、感染症の場合、粘膜修復に不可欠な部分であることが示されている(173)。IL-33は腸内のILC2を活性化し、他の粘膜部位のILC2よりも有意にAregを産生する(130)。IL-33欠損マウスは、生態学的に不平衡であるか、あるいはマイクロバイオームを構成する炎症性細菌の濃度が高いことがわかった。具体的には、IL-33欠損マウスはSegmental filamentous bacteria(SFB)が多く、炎症性腸疾患モデルマウスでも炎症性細菌の濃度が高く、特に粘液を分解するAkkermansia muciniphilaの増加が見られた(131)。原因として考えられるのは、IL-33の不足によりIL-33/ILC2s経路が活性化されず、腸内細菌叢の構造が変化し、炎症性細菌が増加することであろう。上皮バリアが破壊されると、ILC2が産生するAREGがDSS誘発の腸管障害を軽減し、腸内共生菌の末梢臓器へのトランスロケーションを引き起こすことができる(129)。ちょうど腸内細菌叢が腸肺軸を介して腸から肺へのILC2sの移動を指示するように。腹部感染時にプロテオバクテリアの存在量が腸内で増加すると、IL-33の産生が刺激され、IL-33-CXCL16シグナルが肺への自然なILC2の集積を促し、肺を感染から保護する。ILC2sがある程度まで蓄積すると、腸内細菌叢の組成が変化する(174)。
3.2.3 ILC3sとLTi細胞は腸内細菌叢に影響する
ILC3は直接的に微生物叢に影響を与えるわけではないが、上皮細胞の機能を変化させたり、他の免疫・非免疫細胞の機能特性を介して間接的に微生物叢を形成し、それによってその組成に影響を及ぼす。IL-22をブロックしたり、ILCを減少させたりすると、肝臓や脾臓でAlcaligenes(通常はパイエル板やMLNに存在する)が増殖し、全身性の炎症が引き起こされることがある(96)。ILC3が発現するIL-22は、IECの表面でフコースを作るのに必要である。この機構は細菌の感染を防ぐのに役立ち、腸管サルモネラ菌感染の予防に関係している(111)。さらに、ILC3sが産生するIL-22は、上皮細胞における抗菌ペプチドや粘液の産生を促進し(175、176)、Citrobacter rodentiaeなどの病原体に対する宿主防御をもたらします(46、175)。IL-22が欠損すると、抗菌ペプチドや粘液が著しく減少し、それによって乳酸菌の割合が減少するなど、腸内細菌叢の構成に影響を与えることになる(177)。IL-22が産生する抗菌レクチンのReg3ファミリー、例えばReg3γやReg3βは、それが宿主組織と常在菌の間の空間的分離を維持し、腸内細菌の総数、特に粘膜に関連する細菌数を制限し、微生物が上皮バリアを通過しMLNや肝臓に広がるのを防ぎ、炎症を抑制できる(178-180)。IL-17AとIL-17Fを欠損したマウスは黄色ブドウ球菌の自然感染を起こし、IL-22-/-マウスは黄色ブドウ球菌のコロニー形成が増加し、抗菌タンパク質の発現が10%低下することが研究で示されている。IL-17とIL-22の産生は、ILC3と関連している。このことは、IL-17A、IL-17F、IL-22が黄色ブドウ球菌(181、182)、カンジダ・アルビカンス(112、183、184)のコロニー形成を制御できることを示している。プログラムデス1(PD-1)は大腸LTi細胞に多く発現しており、癌患者における抗PD-1免疫療法は、大腸炎などの免疫関連有害事象を引き起こす可能性がある。DSSによる大腸炎では、LTi細胞の活性化に伴い、PD-1の発現が増加し、同時に乳酸菌の激減が確認された(185)。また、別の研究では、LTiの増殖がClostridium difficile感染に対して抵抗性を示すことが報告されている(186)。以上のことから、腸内細菌叢とILCの相互作用は、腸内環境の恒常性を維持する上で重要な役割を担っていると考えられます。
4 疾患下でのILCと共生菌の相互作用
哺乳類の腸管に生息する微生物とその宿主との相互作用は、免疫系の発達と維持に不可欠である。ヒトの炎症性疾患や慢性感染症の多くは、共生菌の組成やコロニー形成が変化し、共生関係が機能不全に陥ることが関係しています。ここ数年、ILCと腸内細菌叢の相互作用が研究により明らかにされています。腸内細菌叢はILCの数を調節し、その結果、ILCの発達と機能に影響を与える。また、ILCは腸内細菌叢のバランスを調整するのに不可欠であり、ILCと腸内細菌叢が疾患発症に重要な役割を果たす可能性が示唆されています。例えば、IBD、アレルギー疾患、癌、寄生虫感染症などの微生物関連疾患の病態にILCが関与している。
4.1 炎症性腸疾患
IBDは腸の主要な病理であり、主にクローン病(CD)と潰瘍性大腸炎(UC)を含む(142、187、188)。IBDは、単に環境、ゲノム、微生物、免疫学的要因によって引き起こされる腸管粘膜異常である(189)。炎症組織におけるNKP44+ILC3sの割合はIBD患者で減少し、ILC1sとILC2sの割合とGM-CSFのレベルはすべてIBD患者で増加し(190、191)、それは病気の重症度と相関している。IL-33は、大腸のILC2sの活性化を促進し、毒素を介した上皮の損傷を回避するために、2型免疫修復経路を誘導することができる(192)。ILCに特異的なT-betが存在しない場合、IL-7RαはILCの増殖と蓄積を促進し、2型腸管免疫応答を媒介するためにILC2sの発達を促進することができる。この過程で免疫系の異常な活性化を防ぎ、宿主は大腸炎から守られることになる(193)。
ILC3は、腸管粘膜の安定性を制御する上で重要な役割を担っている。IBD患者の腸管粘膜に付着した分節化した糸状菌や浸潤性大腸菌が、ILC3によるIL-22の産生を促進することが複数の研究で示されている(194, 195) 。CX3CR1+単核食細胞では、これらの因子は急性炎症時の粘膜修復に関与するTNF様リガンド1Aの発現も誘導することができる(196)。遊離脂肪酸受容体2(FFAR2)はSCFAの受容体であり、大腸ILC3sの表面に高発現している。RORγtの発現を上昇させ、IL-22に作用して腸管IECの修復を促進し、小腸粘膜の抗菌ペプチドの分泌を制御し、病原性細菌による侵入を防ぎ、炎症を抑制することができる(105, 197)。酢酸やプロピオン酸などの天然FFAR2リガンドやFFAR2アゴニストは、マウス大腸におけるILC3やIL-22の産生増加に役立ち、DSSによる大腸損傷やC. rodentium感染から守ることができる(167)。AHRは、ILC3sを制御する重要な転写因子として、ILC3sの表面に発現している。AHR欠損マウスは、腸内のILC3sの障害とIL-22の低下により、大腸炎やCitrobacter rodentium感染に対する感受性が高まり(198-200)、上皮内リンパ球の数が減少している(201)。Lactobacillus reuteriは、AHRを活性化しIL-22の産生を高めるAHRリガンドであるインドール3-アルデヒドなどのトリプトファン代謝物を介して、マウスのDSS誘発大腸炎を予防することができます(202-205)。
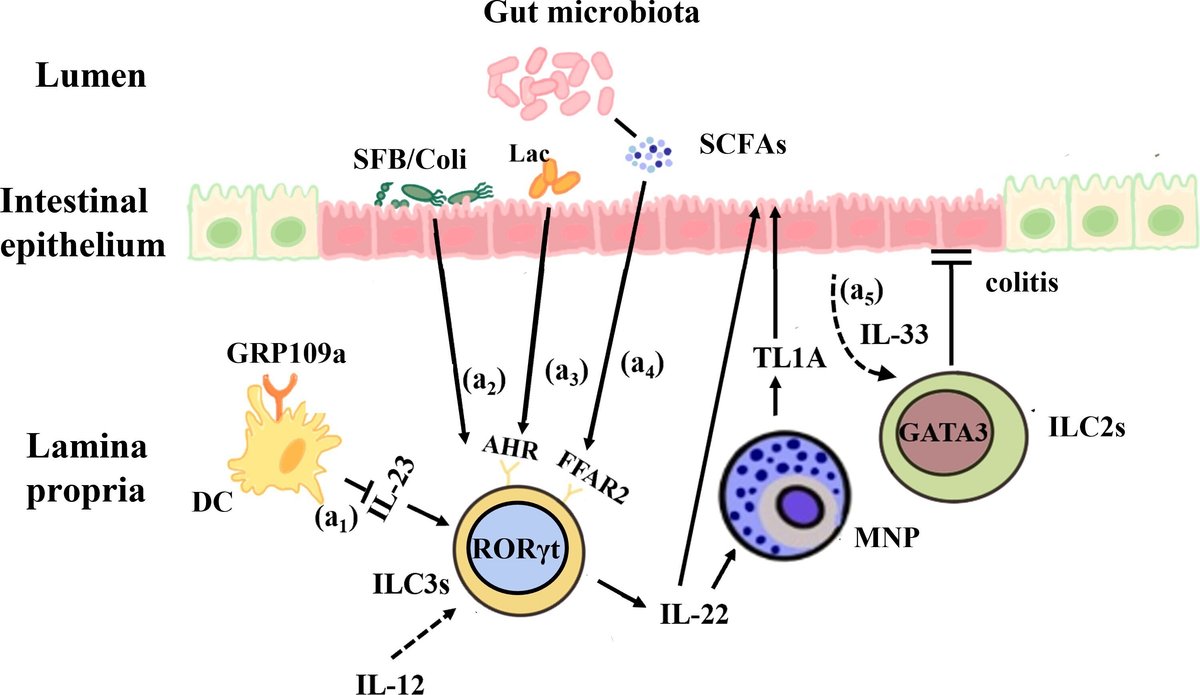
しかし、IL-22を産生するILC3は、マウスの急性先天性大腸炎の発症にもつながる(206)。健康なコントロールと比較して、軽度から中等度のIBD患者はIL-22のレベルが高いことがわかります。また、CD患者でもIL-22レベルが有意に上昇する(207)。この増加は、疾患活動性と正の相関があります(208)。初期の研究では、Helicobacter hepaticus誘発IBDモデルの大腸でNCR-ILC3から炎症性サイトカインIL-17とIFN-γの分泌が上昇すると、腸の炎症がさらに促進されることが判明している。しかし、これらの細胞を枯渇させると、疾患活動性は減弱した(152)。また、Gpr109a-/-Rag1-/-マウスは自然大腸炎を発症し、Rag1-/-マウスと比較して、腸管ILC3におけるIL-17産生が高いことが判明した。このことから、GPR109aは微生物が誘導するIL-23の産生を抑制することでILC3sを抑制し、腸のホメオスタシスを制御することができることがわかった(209)。免疫チェックポイント阻害(ICB)免疫療法は、臨床上一般的な抗がん剤治療であるが、重篤な副作用を引き起こすこともある。最も一般的な副作用は、免疫チェックポイント阻害剤関連大腸炎(ICB-associated colitis)です。Lactobacillus reuteriを補充することで、腸内細菌叢の組成を変化させ、ILC3の数を減少させ、そして大腸炎の発症を抑制し、ICB治療によって引き起こされる体重減少や炎症状態を改善することができます。ILC3の炎症促進作用は、ILC3の異常な活性化により、IL-22やIL-17が過剰に産生され、IECによる好中球ケモカインの産生を誘導し、結果として炎症反応を増悪させるためと考えられる(210)。腸内細菌叢が乱れると、Th17細胞がIL-22を大量に分泌し、IL-22の産生が正常値をはるかに超えてしまう。これが大腸上皮細胞の増殖を促進し、異常な粘膜異形成を刺激し、大腸炎を誘発する(211、212)(図2)。
図2
図2 IBDにおける腸内細菌叢とILCsの相互作用。(a1)GPR109aは、ILC3sを抑制するために、腸管樹状細胞のIL-23産生を抑制し、腸の恒常性を制御する。(a2)IBD患者の腸管粘膜に付着した分割型糸状菌(SFB)や侵襲性大腸菌は、ILC3sによるIL-22産生を増強し、急性炎症期の粘膜修復に寄与するMNP誘導型TL1Aの発現を促進する。(a3)ラクトバチルス・ロイテリは、トリプトファン代謝産物によりAHRを活性化し、IL-22の産生を促進することにより、マウスのDSS誘発大腸炎を予防できる。(a4)大腸ILC3の表面に受容体FFAR2が高発現しているSCFAの微生物代謝産物は、IL-22に作用して腸管上皮細胞や粘膜修復を促進させる。(a5) IL-33はILC2sの活性化を促進し、Clostridium-induced colitisから保護する。
4.2 食物アレルギー
アトピー性皮膚炎、食物アレルギー(FA)、環境アレルギーなどのアトピー性疾患は、世界的に重要な公衆衛生問題になっている(213)。FAは、経口摂取した食物や食物由来成分への曝露によって生じる抗原特異的な生体反応である。アナフィラキシーでは、肥満細胞の脱顆粒がIgEを介することもあるが、死に至ることもある反応である。これまでの研究で、腸内細菌叢の構造が変化すると、部分的に恒常性が失われ、Th1/Th2バランスが崩れ、Th2反応に偏るため、アレルギー反応が誘発されることが明らかになっています(214、215)。腸内細菌、特にクロストリジウムは、粘膜免疫やアレルギー疾患の制御に大きな役割を担っている。Stefkaらは、クロストリジウムのコロニー形成が、腸管ラミナプロプリアのILC3やT細胞においてIL-22産生を誘導し、粘液や抗菌ペプチドの産生を高める杯細胞やパネス細胞への影響を介して上皮バリア機能を高めることを明らかにした(28、134)。IL-22は、経口食餌性抗原の全身循環への侵入を媒介する経路を阻害し、食物アレルギーの回避に寄与する。さらに、クロストリジウムが産生するSCFAは、大腸におけるTregの産生を誘導し、腸管上皮の完全性を促進し、腸内細菌叢の組成を変化させ、マウスモデルにおいてアレルギー症状を改善することができる(216、217)。Ha-Jung Kimのグループの研究によると、マウスの初期生活において、腸内細菌叢は、CD4+IL17+T細胞/CD4+FOXP3+Treg細胞のバランスを調節し、それによってSCFAs産生の調節を介して腸粘膜のILC3のレベルに影響を与えることによって、ADの発症に重要な役割を果たすことができます(218)。
しかし、食事や細菌代謝から得られる代謝産物であるトリプトファンから産生されるリガンドは、ILC3sの表面にあるAHRと相互作用します。これは、IL-22の産生を刺激して、上皮バリアの透過性を調節することもできる(135)。腸管粘膜バリアが傷つき、腸管透過性が高まると、腸管内腔から病原微生物、抗原、炎症促進因子などの有害物質が循環系に入り込み、さらに腸管粘膜バリアが傷つくと、腸管内腔から病原微生物、抗原、炎症促進因子などの有害物質が流入する。その結果、食物アレルギー症状を引き起こすことがあります。また、腸内微生物は、マクロファージ、DC、ILCと直接相互作用してディフェンシンの産生を促進し、バリア機能を強化し、粘膜免疫バランスを維持することができます(219)。
腸内細菌叢は、直接的および間接的な経路で腸-皮膚軸を制御することができる。腸内細菌叢の組成や割合の変化は、皮膚バリア機能障害や免疫系障害を引き起こす可能性があり、これらはAD発症の重要な病態生理学的メカニズムである。トリプトファンは腸内細菌叢の代謝産物であり、ILCのAHRを活性化してIL-22の分泌を誘導し、抗菌ペプチド(AMP)の放出を促進し、病原体による感染から保護するリガンドとして働く(220)。乳酸菌やビフィズス菌はγ-アミノ酪酸(GABA)を産生し、抑制性介在ニューロンが神経伝達物質として、掻痒反応ニューロンを抑制するのに利用されると考えられる。また、ひっかき傷は、棘上構造へ投射する上行性侵害受容性ニューロンを刺激し、それが下行性調節経路に直接または間接的に接続して、痒み発生反応ニューロンを抑制し、かゆみを和らげる(221)。
OVA/alumまたはピーナッツ/コレラ毒素(PN/CT)FAマウスモデルにおいて、OVAまたはピーナッツを経口投与すると、2型炎症、下痢、肥満細胞脱顆粒による体温低下などのアナフィラキシー症状が出現することがある。ILC2の活性化に関与するIL-25やIL-33が上昇すると、FAモデルマウスにおいて腸管ILC2の数が増加することがわかり、ILC2がFAの病態に関与していることが示唆されました(222)。また、IL-25の増加は、直接刺激またはIL-25受容体陽性Th2細胞を介した間接的活性化により、ILC2からのIL-13産生を誘導し、肥満細胞症や下痢症状を誘発することが報告されている(223). 皮膚バリアの破壊は、IL-33を介して腸管ILC2の活性化を誘導し、OVA誘発FAモデルにおける肥満細胞症やアナフィラキシーを増強する可能性がある(224)。このことは、ILC2sの有害な活性化がアレルギー反応に関与していることを示唆している。また、IL-4αノックアウトによるPN/Ct誘発FAモデルマウスでは、免疫受容体チロシン阻害モチーフ(ITIM)の非制限型が欠損しており、ILC2sがIL-4を産生することにより抗原特異的Tregを阻害する。IL-4/IL-13の産生により肥満細胞のIgE反応性がさらに亢進し、アナフィラキシーを増悪させる(225, 226)。しかし、他の視点もあり、Chuらは、PN/CT誘発FAモードでThy1中和抗体を用いたILC2sは、FA誘発腹部2型炎症をもたらすが、IgE産生、消化器症状、アレルギー反応には至らないことを報告している(227)。これらの違いは、使用するFAモデルやマウス系統の違い、あるいは腸内細菌叢の影響によるものであると考えられる(図3)。
図3
図3 食物アレルギーにおける腸内細菌叢とILCsの相互作用。(b1)クロストリジウムのコロニー形成により、腸管lamina propriaのILC3がIL-22を産生し、杯細胞やパネス細胞を制御して粘液や抗菌ペプチド産生を増加させ、上皮のバリア機能を高める。(b2)食事や細菌由来の代謝物トリプトファンから産生されるリガンドがILC3上のAHRに結合してIL-22の産生を促し、上皮バリアの透過性を調節して有害物質の血液循環への侵入を防いでいます。(b3)腸内細菌叢は、腸管上皮細胞と直接相互作用してディフェンシンを産生し、そのバリア機能を強化することができる。(b4)腸内細菌叢が産生するトリプトファンはそう痒症を引き起こし、乳酸菌やビフィドバクテリウムが産生するγ-アミノ酪酸(GABA)はそう痒症を抑制する。(b5)OVA/alumやピーナッツ/コレラ毒素(PN/CT)FAマウスでは、ILC2がIL-4を産生して抗原特異的Tregを抑制し、アレルギー反応を増悪させる。(b6)IL-33とIL-25は、ILC2からのIL-13産生を誘発し、OVA/alumまたはPN/CT FAマウスの肥満細胞症や下痢症状を誘導することがわかった。
4.3 大腸がん
ILC、微生物叢、癌の間には複雑な相互作用があることが示唆されている。がんや腫瘍の発生リスクは、ILCが産生する炎症性メディエーターの増加と関連している(228)。正常な状況では、ILC3から分泌されるIL-22は、上皮の損傷と修復を促進することができる。しかし、腫瘍発生時には、IL-22が高発現し、IL-22結合タンパク質(IL-22BP)の発現が制限されるため、IL-22が過剰に分泌され、がんの発生を促進する。例えば、IL-22がマウスの腫瘍増殖を抑制する抗腫瘍性サイトカインであることを示す研究がある。Huberらは、IL22-/-マウスが大腸がんを発症しやすいことを発見し、IL-22が大腸の腫瘍形成と上皮細胞増殖を制御する重要な役割を担っていることを明らかにした。しかし、IBD患者はCRCのリスクがかなり高く、IL-22はIECのSTAT3を活性化して細胞増殖を促進し、腫瘍の発生を維持する上で大きな役割を果たす(229、230)。別の研究では、IL-22がHelicobacter hepaticus誘発腫瘍モデルにおいてCRCの発生を促進することが示された(230)。さらに、IL-17とIL-22の減少が、炎症性異形成のマウスモデルにおいて浸潤性大腸癌の発生を予防できることを示した研究もある(228)。さらに、病的な状況下では、抗生物質などの理由による腸内細菌の異常によって、ILCがIL-17やIL-22などのサイトカインを放出し、慢性炎症や癌を引き起こす可能性があります。大腸のILC3が分泌するIL-22やIL-17が、炎症の発生や腫瘍の増殖に関与しているためと考えられる。ILC3は、抗原提示因子である主要組織適合性複合体-II(MHC-II)を発現しており、MHC-II依存的に微生物特異的Th17細胞の活性を制限することで腸の炎症を抑える。CRCではILC3の割合が著しく減少し、腸内のTh17細胞の炎症活性が亢進する。ILC3特異的MHC-IIを欠損したマウスでは腸内細菌叢の組成が変化し、腸内のTh1細胞や1型免疫が間接的に制限され、抗腫瘍Th1細胞や抗PD-1免疫療法に反応しない攻撃性のCRCがさらに発症する(231、232)。ILCから分泌されるサイトカインは、Enterococcus hirae、Barnesiella intestinihominis、Bacteroides fragilis、Bacteroides thetaiotaomicron、Bifidobacterium breve、Bifidobacterium longumなどの細菌の増殖を促進し、がんの治療効果を高めることが証明されている(233, 234)。しかし、Escherichia coli、Bacteroides fragilis、ϵとγ proteobacteriaのようないくつかの微生物は、癌を促進する効果もある。彼らはコリシン、Bacteroides fragilis毒素、致死性細胞催涙毒素を産生することができる。これらの分子は臨床的にも実験的にも大腸がんに関連しており(235, 236)、活性酸素の誘導により宿主のDNAを直接または間接的に損傷することがある(237, 238)。さらに、ILCは、大腸菌やヘリコバクター・ピロリ菌などの常在菌のニッチを制限する可能性もあり、これらの菌が癌の発生を促進することが実証されている(236, 239)。最近、トランスクリプトーム研究により、健康な腸にはILC1、ILC3、ILC3/NKが存在するが、ILC2は存在しないことがわかった。また、CRC患者において、腫瘍特異的なILC1s-likeとILC2サブセットが同定された。シグナル伝達リンパ球活性化分子ファミリーメンバー1(SLAMF1)は、腫瘍特異的なILCに選択的に発現し、CRCにおける抗腫瘍バイオマーカーとなる(240)。定常的な環境では、ILCは腸管免疫環境を制御し、共生菌の腫瘍促進作用と腫瘍抑制作用のバランスを保つ重要な役割を担っている(図4)。
図4
図4 大腸がんにおける腸内細菌叢とILCsの相互作用。(c1) H. hepaticusはILC3を刺激してIL-22を産生し、誘導腫瘍モデルで大腸がんを促進する。(c2)IL-22は腸管上皮細胞のSTAT3活性化を刺激し、腫瘍の発生を維持する。(c3)IL-22は、大腸腫瘍の発生と上皮細胞の悪性増殖を制御する。(c4)IL-17とIL-22は浸潤性大腸癌の発生を促進する。(c5)ILC3は、MHC-II依存的に微生物特異的Th17細胞の活性を抑制することにより、腸の炎症を抑える。(c6)マウスにおいて、ILC3特異的MHC-IIは、抗腫瘍Th1細胞免疫だけでなく、抗PD-1免疫療法をサポートする。(c7) 大腸菌、Bacteroides fragilis、ϵ-Proteus、γ-Proteusは、大腸がんに関連するコリシン、BFT、CDTを分泌し、ホストDNAを損傷することができる。
4.4 寄生虫による感染
自然免疫応答は、寄生虫感染を速やかに制御するために不可欠であり、ILCを含む様々な自然免疫細胞で構成されている。トキソプラズマ・ゴンディ(Toxoplasma gondii)は広範な原虫で、その性発生は最終宿主の腸管上皮で起こる(241)。この病原体は、人獣共通感染症であるトキソプラズマ症を引き起こし、慢性化することがある。実際、慢性トキソプラズマ症は世界中で最も一般的な感染症の1つである(242)。感受性の高いC57BL/6マウスに経口感染すると、T. gondiiはIECと前膜に侵入し、腸内で豊富なサイトカインとTh1媒介免疫反応の産生をもたらす。このモデルはIBDをシミュレートすることができる(242)。すべての炎症性サイトカインの中で、IFN-γはT. gondii感染を排除するために最も顕著な役割を果たす。T. gondiiはMyD88アダプタータンパク質を介してTLR-11依存性のシグナル伝達経路を活性化してIL-12の生産を開始し、ILC1、およびNK細胞におけるIFN-γの発現を刺激し、後者は細胞飢餓とT. gondiiの成長の制限につながる。野生型マウスにT. gondiiを経口感染させると、前庭のILC3が減少し、RORγtの発現がダウンレギュレーションされる。これは主にIL-12シグナルがRORγtの発現をダウンレギュレートし、ILC3のIFN-γ発現ILC1への転換を誘導し、IFN-γ産生を促進するためで(71)、Toxoplasma感染の抑制に寄与している(81)。T. gondiiの大量投与モデルでは、IL-23がIL-22を介してmatrixmetalloproteinase-2(MMP-2)の局所的なアップレギュレーションを誘導し、炎症促進作用を持つため、腸の炎症をさらに増悪させることがある(243)。また、最近の研究では、トキソプラズマ感染による回腸炎がIL-22欠損マウスで減弱することが報告されている(244)。ヒトでは、まず原虫のスポロゾイトが蚊の唾液腺から宿主の血液中に注入され(245)、その後肝臓に感染する。ヒトとマウスの両方の感染モデルにおいて、NK細胞は、原虫感染の早期および持続的な制御のための重要な免疫細胞として働く(246)。このことは、炎症におけるIL-22の役割が組織特異性を持つ可能性があること、組織におけるその量と期間に基づいて異なる機能を発揮することができることを示している。例えば、IL-22はケラチノサイトや小腸上皮細胞では病原性の役割を果たし、結腸・直腸上皮細胞、肺上皮細胞、肝細胞では保護的な役割を果たす可能性がある。同時に、様々な実験モデル(病原体や化学的に誘導されたもの)によっても、IL-22の作用が異なる可能性がある。
C57BL/6マウスの実験的脳マラリア(ECM)に関する研究では、IL-33が2型サイトカイン(IL-4、IL-5、IL-13)を産生するILC2sの拡大を促進し、炎症メディエーターのIFN-γ、IL-12、TNF-αを減少させて抗炎症M2マクロファージの生産を導くことが示されました。これにより、Foxp3+Tregが増幅され、ECMの発生が抑制される(247)。クリプトスポリジウム感染は、主に汚染された水中のオーシストを摂取することで起こる(248)。この寄生虫はIECに生息し、ヒトに下痢を引き起こすことがある。研究によると、感染中、IL-15は末梢血単核細胞(PBMC)を活性化し、NK細胞の発現を高め、上皮性T細胞とNKマーカー発現細胞の両方でより大きな殺傷能力を促進し、それによってクリプトスポリジウムを除去することがわかりました(249)。また、エイメリア属菌の感染は、寄生虫のオーシストを含む糞便を摂取することで起こり、腸管粘膜に激しい炎症を引き起こします(250)。本研究では、Eimeria falciformis感染初期に、ニワトリの体内でIL-17が大量に産生され、盲腸病変の発生・進展を促進するために、濃縮顆粒球のリクルートやIL-12やIFN-γ(Th1型サイトカイン)の発現抑制、炎症反応の増悪が達成されていると考えられる(251)。これは、ILC3がエイメリア感染に対応できることを示唆している。また、アイメリア属菌に感染したIFN-γ-/-マウスでは、IL-17AやIL-22を枯渇させると体重減少が大きくなり、腸管組織病理学がより重篤化することが明らかになった研究があります。逆に、野生型マウスでは抗体中和は有意な効果を示さない(252)(図5)。
図5
図5 寄生虫感染症における腸内細菌叢とILCの相互作用。(d1) T. GondiiはMyD88アダプタータンパク質を介してTLR-11依存性のシグナル伝達経路を活性化し、IL-12の生産を開始し、ILC1およびNK細胞におけるIFN-γの発現を刺激し、後者はT. Gondiiの成長を制限する。(d2)IL-15はNK細胞の発現を高め、より大きな殺傷能力を促進し、それによってクリプトスポリジウムを除去する。(d3)IL-12シグナルは、RORγtの発現をダウンレギュレートし、ILC3のIFN-γ発現ILC1への転換を誘導し、IFN-γ産生を促進し、トキソプラズマ感染の抑制に寄与する。(d4)IL-23は、IL-22を介してmatrixmetalloproteinase-2(MMP-2)のアップレギュレーションを誘導し、腸の炎症をさらに悪化させる可能性がある。(d5)IL-33は、ILC2の拡大を促進し、炎症メディエーターを減少させ、抗炎症性M2マクロファージの産生を促進し、Foxp3+Tregを増幅し、ECMの発生を防止することができる。(d6) Eimeria falciformis感染時には、ニワトリの体内でIL-17が大量に産生され、濃縮顆粒球をリクルートしてIL-12やIFN-γの発現を抑制し、炎症反応を増悪させることで達成できると考えられる。
5 まとめ
近年、ILCは免疫学や細胞生物学の分野で研究のホットスポットとなっている。このリンパ球は、その割合の少なさにもかかわらず、細菌、寄生虫、ウイルスからの防御を行い、また粘膜の組織修復や再生にも関与している。しかし、ILCは双方向性を持っており、その炎症作用が腸の炎症を悪化させ、さらには癌を引き起こすこともある。ILCは、腸管バリアーの表面で対応するサイトカインを誘導し、迅速な反応を実現することが特徴である。したがって、ILCと腸内細菌叢との相互作用をどのように平衡化し、微生物叢との内部恒常性をどのように維持して、ILCから分泌されるサイトカインが保護的役割を果たすようにするかは、さらなる探求に値すると思われる。とはいえ、ILCに関連するいくつかの課題は残されている。例えば、in vivoにおけるILCのトランス分化のプロセスが可逆的であるかどうかを検討する必要がある。さらに、従来の発生過程で産生されるサブグループ間の違いについても、さらに明らかにする必要がある。また、ILCと様々な疾患との相関を探り、疾患の診断や治療に新たな戦略を提供するためには、ILCの生体内における双方向制御機構を解明する必要がある。そのため、ILCと腸内細菌叢の相互作用を研究するための包括的な解析手法が求められており、今後、臨床疾患の治療における重要なテーマとなる可能性があります。ILCと疾患との関係をより深く理解し、より包括的な理解を得るために、革新的なILCに基づく介入を検討する必要があります。これは、人類の健康を守ることに役立つと思われる。
著者の貢献
YGは文献調査を行い、論文本編を執筆した。YiLとMLは、このレビューの仕上げを共同監修した。YL、BR、ZL、XNはアイデアを構築し、MLは原稿に貴重なコメントを寄せた。すべての著者がこの論文に貢献し、提出されたバージョンを承認した。
資金提供
MLは、中国遼寧省自然科学基金(2023-MS-260)、中国遼寧省基礎医学トップ分野プログラム、中国栄養学会科学研究基金-飛河身体栄養健康特別基金(CNS-飛河2021-132)の支援を受けている。YiLは、小核生物技術大連有限公司の科学研究基金(505622)の支援を受けた。資金提供者は、研究デザイン、データの収集、分析、解釈、本論文の執筆、出版への投稿の決定には関与していない。
利益相反について
著者らは、潜在的な利益相反と解釈され得る商業的または金銭的関係がない状態で研究が実施されたことを宣言する。
出版社からのコメント
本論文で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体、出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または承認されるものではありません。
参考文献
Planer JD, Peng Y, Kau AL, Blanton LV, Ndao IM, Tarr PI, et al. 双子およびgnotobioticマウスにおける腸内細菌叢の発達と粘膜IgA応答. ネイチャー (2016) 534:263-6. doi: 10.1038/nature17940
PubMed Abstract|CrossRef Full Text|Google ScholarカニPD、デルゼンヌNM. エネルギー代謝と代謝性疾患における腸内細菌叢の役割(The role of the gut microbiota in energy metabolism and metabolic disease). (2009年) 15:1546-58. doi: 10.2174/138161209788168164.
PubMed Abstract | CrossRef Full Text | Google ScholarFredrik Bäckhed HD, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, et al. The gut microbiota as an environmental factor that regulates fat storage. このような背景のもとで、私たちは、このような研究を進めてきました。
PubMed Abstract | CrossRef Full Text | Google ScholarHooper LV, Stappenbeck TS, Hong CV, Gordon JI. アンジオジェニン:自然免疫に関与する新しいクラスの微生物殺傷性タンパク質。そのため、このような現象が起こる可能性があります。
PubMed Abstract|CrossRef Full Text|Google ScholarClemente JC, Ursell LK, Parfrey LW, Knight R. The impact of the gut microbiota on human health: an integrative view. Cell (2012) 148:1258-70. doi: 10.1016/j.cell.2012.01.035.
PubMed Abstract | CrossRef Full Text | Google ScholarBuela KA, Omenetti S, Pizarro TT. 炎症性腸疾患における3型自然リンパ球と腸内細菌叢の間のクロストーク。Curr Opin Gastroenterol (2015) 31:449-55. doi: 10.1097/MOG.000000000217.
PubMed Abstract|CrossRef Full Text|Google ScholarKonig J, Wells J, Cani PD, Garcia-Rodenas CL, MacDonald T, Mercenier A, et al. Human intestinal barrier function in health and disease. Clin Transl Gastroenterol (2016) 7:e196. doi: 10.1038/ctg.2016.54
PubMed Abstract|CrossRef Full Text|Google ScholarHooper LV, Macpherson AJ. 腸内細菌叢との恒常性を維持する免疫適応。Nat Rev Immunol (2010) 10:159-69. doi: 10.1038/nri2710
PubMed Abstract | CrossRef Full Text | Google ScholarStecher B, Hardt WD. 腸の病原体コロニー形成を制御するメカニズム。(2011年) 14:82-91. doi: 10.1016/j.mib.2010.10.003.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarHooper LV, Wong MH, Thelin A, Hansson L, Falk PG, Gordon JI. 腸内常在菌の宿主-微生物関係の分子解析。サイエンス(2001)291:881-4 doi: 10.1126/science.291.5505.881.
PubMed Abstract | CrossRef Full Text | Google ScholarStappenbeck TS, Hooper LV, Gordon JI. パネス細胞を介した常在微生物による腸管血管新生の発生的制御。(2002年) 99(24):15451-5. doi: 10.1073/pnas.202604299.
PubMed Abstract | CrossRef Full Text | Google Scholar腸内細菌は、サイトカインAPRILの上皮細胞分泌を誘導することにより、T細胞非依存的な免疫グロブリンA(2)クラスの切り替えを誘発する。免疫 (2007) 26:812-26. doi: 10.1016/j.immuni.2007.04.014
PubMed Abstract | CrossRef Full Text | Google ScholarIvanov II, Frutos Rde L, Manel N, Yoshinaga K, Rifkin DB, Sartor RB, et al. 特定の微生物相が小腸粘膜のIL-17産生Tヘルパー細胞の分化を指示する。細胞宿主微生物(2008)4:337-49 doi: 10.1016/j.chom.2008.09.009
PubMed Abstract | CrossRef Full Text | Google Scholar宿主DNAは制御性T細胞への転換を制限し、腸管免疫応答の天然アジュバントである。免疫 (2008) 29:637-49. doi: 10.1016/j.immuni.2008.08.009
PubMed Abstract | CrossRef Full Text | Google ScholarStecher B, Macpherson AJ, Hapfelmeier S, Kremer M, Stallmach T, Hardt WD, et al. 生殖不能マウスとストレプトマイシン前処理マウスにおけるサルモネラ腸管チフスムリウム大腸炎の比較。Infect Immun (2005) 73:3228-41. doi: 10.1128/IAI.73.6.3228-3241.2005.
PubMed Abstract | CrossRef Full Text | Google ScholarBenson A, Pifer R, Behrendt CL, Hooper LV, Yarovinsky F. 腸内常在菌はtoxoplasma gondiiに対する保護免疫応答を誘導する。その結果、腸内常在菌がトキソプラズマ・ゴンディに対する防御的な免疫反応を誘導することが明らかになった。
PubMed Abstract|CrossRef Full Text|Google ScholarLittman DR, Pamer EG. 正常および病原性の宿主免疫応答における常在細菌叢の役割。細胞宿主微生物(2011)10:311-23. doi: 10.1016/j.chom.2011.10.004
PubMed Abstract|CrossRef 全文|Google Scholar本田恭子、Littman DR. 感染症や炎症におけるマイクロバイオーム。本田和彦, リットマンDR.
PubMed Abstract | CrossRef Full Text | Google ScholarKlare I, Werner G, Witte W. 腸球菌:生息地、感染症、病原性因子、抗生物質に対する耐性、耐性決定基の移動。寄生微生物学(2001)8:108-22.
PubMed Abstract | CrossRef Full Text | Google ScholarChassard C, Dapoigny M, Scott KP, Crouzet L, Del'homme C, Marquet P, et al. 便秘症-過敏性腸症候群患者の腸内細菌叢における機能的ディスバイオシス。(2012年) 35:828-38. doi: 10.1111/j.1365-2036.2012.05007.x.
PubMed Abstract|CrossRef Full Text|Google Scholar過敏性腸症候群患者の糞便サンプルにおける微生物叢シグネチャーのグローバルかつ深い分子解析(Rajilic-Stojanovic M, Biagi E, Heilig HG, Kajander K, Kekkonen RA, Tims S, et al. 胃腸病学(2011)141:1792-801. doi: 10.1053/j.gastro.2011.07.043
PubMed Abstract | CrossRef Full Text | Google ScholarCani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, et al. Metabolic endotoxemia initiates obesity and insulin resistance. 糖尿病(2007)56:1761-72 doi: 10.2337/db06-1491
PubMed Abstract | CrossRef Full Text | Google Scholar潰瘍性大腸炎患者における糞便微生物群の多様性に関する末端制限断片長多型解析。Inflammation Bowel Dis (2007) 13:955-62. doi: 10.1002/ibd.20151
クロスレフフルテキスト|Google Scholarクローン病の腸内細菌叢における faecalibacterium prausnitzii の存在量の減少。J Gastroenterol Hepatol (2013) 28:613-9. doi: 10.1111/jgh.12073.
PubMed Abstract|CrossRef Full Text|Google ScholarNishino K, Nishida A, Inoue R, Kawada Y, Ohno M, Sakai S, et al. 内視鏡ブラシサンプルの解析により炎症性腸疾患における粘膜関連ディスバイオシスが特定された。J Gastroenterol (2018) 53:95-106. doi: 10.1007/s00535-017-1384-4
PubMed Abstract|CrossRef Full Text|Google Scholar高橋和彦、西田明彦、藤本哲也、藤井稔、塩谷真、今枝裕之、他:クローン病における糞便微生物群集の酪酸産生菌種の存在量の減少。消化 (2016) 93:59-65. doi: 10.1159/000441768
PubMed Abstract|CrossRef Full Text|Google Scholarヒトの微生物叢から合理的に選択されたクロストリジウム菌株の混合物によるTreg誘導。ネイチャー (2013) 500:232-6.
PubMed Abstract|CrossRef Full Text|Google ScholarStefka、Feehley T、Tripathi P、Qiu J、McCoy K、Mazmanian SK、et al. 通常細菌は食物アレルゲン感作から保護する. Proc Natl Acad Sci USA (2014) 111:13145-50. doi: 10.1073/pnas.1412008111.
PubMed Abstract|CrossRef Full Text|Google ScholarBollrath J, Powrie FM. フロンティアを制御する:制御性T細胞と腸のホメオスタシス。(2013年) 25:352-7. doi: 10.1016/j.smim.2013.09.002.
PubMed Abstract|CrossRef Full Text|Google ScholarHu C, Xu B, Wang X, Wan WH, Lu J, Kong D, et al. 腸内細菌叢由来の短鎖脂肪酸は、HCCにおける3群自然リンパ系細胞を制御する。Hepatology (2022) 77:48-64. doi: 10.1002/hep.32449.
PubMed Abstract|CrossRef Full Text|Google Scholar滝石 徹、フェネロ CIM、カマラ NOS. 腸管バリアと腸内細菌叢:生涯を通じて私たちの免疫反応を形成する。Tissue Barriers (2017) 5:e1373208. doi: 10.1080/21688370.2017.1373208.
PubMed Abstract|CrossRef 全文|Google ScholarO'Hara AM, Shanahan F. The gut flora as a forgotten organ. EMBO Rep (2006) 7:688-93. doi: 10.1038/sj.embor.7400731
PubMed Abstract|CrossRef Full Text|Google ScholarターナーJR. 健康および疾患における腸管粘膜バリア機能。(注) 1.本データはこの書籍が刊行された当時に掲載されていたものです。
PubMed Abstract | CrossRef Full Text | Google ScholarRandall TD, Mebius RE. 粘膜リンパ組織の発達と機能:微生物とのバランス調整。粘膜免疫学(2014)7:455-66. doi: 10.1038/mi.2014.11.
PubMed Abstract|CrossRef Full Text|Google ScholarPabst O, Herbrand H, Friedrichsen M, Velaga S, Dorsch M, Berhardt G, et al. Solitary intestinal lymphoid tissue in response to microbiota and chemokine receptor CCR7 signaling, Adaptation of Solitary intestinal lymphoid tissue. J Immunol (2006) 177:6824-32. doi: 10.4049/jimmunol.177.10.6824
PubMed Abstract | CrossRef Full Text | Google ScholarMabbott NA, Donaldson DS, Ohno H, Williams IR, Mahajan A. Microfold (M) cells: Important immunosurveillance posts in the intestinal epithelium. Mucosal Immunol (2013) 6:666-77. doi: 10.1038/mi.2013.30.
PubMed Abstract | CrossRef Full Text | Google ScholarMin YW, Rhee PL. 腸管免疫における微生物叢の役割(The role of microbiota on the gut immunology). Clin Ther (2015) 37:968-75. doi: 10.1016/j.clinthera.2015.03.009.
PubMed Abstract|CrossRef Full Text|Google ScholarBouskra D, Brezillon C, Berard M, Werts C, Varona R, Boneca IG, et al. NOD1を通じて常在菌が誘導するリンパ組織発生は腸の恒常性を制御している. ネイチャー (2008) 456:507-10.
PubMed Abstract | CrossRef Full Text | Google ScholarGordon HA, Bruckner-Kardoss E, Wostmann BS. 無菌マウスの生命表と自然死時に観察される病変の加齢。J Gerontol (1966) 21(3):380-7. doi: 10.1093/geronj/21.3.380.
PubMed Abstract | CrossRef Full Text | Google ScholarPollard M, Sharon N. 抗原刺激に対する無菌マウスのパイエルパッチの反応。Infect Immun (1970) 2(1):96-100.doi: 10.1128/iai.2.1.96-100.1970.
PubMed Abstract | CrossRef Full Text | Google Scholar梅崎義雄、松本聡、今岡明、瀬戸山秀樹:微生物学と免疫学-1995年8月-梅崎-分節性糸状菌は腸内常在菌である。微生物免疫学 (1995) 39(8):555-62. doi: 10.1111/j.1348-0421.1995.tb02242.x
PubMed Abstract | CrossRef Full Text | Google ScholarSpits H, Cupedo T. Innate lymphoid cells: Emerging insights in development, lineage relationships, and function. (2012年) 30:647-75. doi: 10.1146/annurev-immunol-020711-075053.
PubMed Abstract|CrossRef Full Text|Google ScholarPanda SK, Colonna M. Innate lymphoid cells in mucosal immunity. Front Immunol (2019) 10:861. doi: 10.3389/fimmu.2019.00861.
PubMed Abstract|CrossRef Full Text|Google ScholarNeill DR, Wong SH, Bellosi A, Flynn RJ, Daly M, Langford TK, et al. Nuocytes represent a new innate effector leukocyte that mediates type-2 immunity. ネイチャー (2010) 464:1367-70.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarプライスAE、リャンHE、サリバンBM、ラインハルトRL、アイズリーCJ、エールDJ、他、2型免疫における全身に分散した自然免疫IL-13発現細胞。(2)は、(3)は、(4)は、(5)は、(6)は、(7)を意味する。
PubMed Abstract | CrossRef Full Text | Google ScholarCella M, Fuchs A, Vermi W, Facchetti F, Otero K, Lennerz JK, et al. Human natural killer cell subset provides an innate source of IL-22 for mucosal immune. ネイチャー (2009) 457:722-5.
PubMed Abstract | CrossRef Full Text | Google Scholarヒト胎児リンパ組織誘導細胞は、RORC+ CD127+ナチュラルキラー様細胞に対するインターロイキン17産生前駆体である。Nat免疫学 (2009) 10:66-74.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarSpits H, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, et al. Innate lymphoid cells-a proposal for uniform nomenclature. Nat Rev Immunol (2013) 13:145-9. doi: 10.1038/nri3365
PubMedアブストラクト|クロスリファレンス全文|Google ScholarBostick JW, Zhou L. Innate lymphoid cells in intestinal immunity and inflammation. Cell Mol Life Sci (2016) 73:237-52. doi: 10.1007/s00018-015-2055-3.
PubMed Abstract|CrossRef Full Text|Google ScholarMackley EC, Houston S, Marriott CL, Halford EE, Lucas B, Cerovic V, et al. CCR7依存のRORγ(+)ILCsのトラフィッキングは粘膜排毒リンパ節内に独自の微環境を作り出す。Nat Commun (2015) 6:5862. doi: 10.1038/ncomms6862.
PubMed Abstract|CrossRef Full Text|Google Scholar佐藤-高山、Vosshenrich CA、Lesjean-Pottier S、Sawa S、Lochiner M、Rattis F、et al. 微生物叢は、自然粘膜免疫防御を行う腸管NKp46+細胞におけるインターロイキン22の産生を促進する。免疫学 (2008) 29:958-70.
PubMed Abstract | CrossRef Full Text | Google Scholar脂肪組織関連c-Kit(+)Sca-1(+)リンパ系細胞によるT(H)2サイトカインの自然産生。ネイチャー(2010)463:540-4。
PubMed Abstract | CrossRef Full Text | Google ScholarMontaldo E, Juelke K, Romagnani C. Group 3 innate lymphoid cells (ILC3s): origin, differentiation, and plasticity in humans and mice. Eur J Immunol (2015) 45:2171-82. doi: 10.1002/eji.201545598.
PubMed Abstract|CrossRef Full Text|Google ScholarYu X, Wang Y, Deng M, Li Y, Ruhn KA, Zhang CC, et al. Basic Leucine Zipper転写因子NFIL3は、共通の自然リンパ系細胞前駆体の発生を指示する。Elife (2014) 3:e04406. doi: 10.7554/eLife.04406.
PubMed Abstract|CrossRef Full Text|Google ScholarVivier E, Artis D, Colonna M, Diefenbach A, Di Santo JP, Eberl G, et al. Innate lymphoid cell: 10 years on. Cell (2018) 174:1054-66. doi: 10.1016/j.cell.2018.07.017.
PubMed Abstract|CrossRef Full Text|Google Scholarメロ-ゴンザレスF、ヘップワースMR。グループ3自然リンパ球の機能的・表現的異質性。免疫学(2017)150:265-75. doi: 10.1111/imm.12697.
PubMed Abstract|CrossRef Full Text|Google ScholarBlom B, Spits H. Human lymphoid cellsの発生。(2006年) 24:287-320. doi: 10.1146/annurev.immunol.24.021605.090612.
PubMed Abstract|CrossRef Full Text|Google Scholarアレルギー性炎症と非アレルギー性炎症における自然免疫系リンパ球.J Allergy Clin Immunol (2016) 138:1253-64. doi: 10.1016/j.j.jaci.2016.09.011.
PubMed Abstract|CrossRef Full Text|Google ScholarニールDR、フリンRJ. 自然リンパ球の起源と進化:バリア免疫の監視役。パラサイト・イミュノール(2018)40:e12436. doi: 10.1111/pim.12436
クロスレフフルテキスト|Google ScholarMcKenzie ANJ, Spits H, Eberl G. Innate lymphoid cells in inflammation and immune. Immunity (2014) 41:366-74. doi: 10.1016/j.immuni.2014.09.006.
PubMed Abstract|CrossRef Full Text|Google ScholarSonnenberg GF, Artis D. Innate lymphoid cells in the initiation, regulation and resolution of inflammation. Nat Med (2015) 21:698-708. doi: 10.1038/nm.3892.
PubMed Abstract|CrossRef Full Text|Google ScholarTait Wojno ED, Artis D. Innate lymphoid cells: Balancing immunity, inflammation, and tissue repair in the intestine. Cell Host Microbe (2012) 12:445-57. doi: 10.1016/j.chom.2012.10.003.
PubMed Abstract | CrossRef Full Text | Google ScholarErcolano G, Wyss T, Salome B, Romero P, Trabanelli S, Jandus C. Human innate versus adaptive helper lymphoid cellsのDistinct and shared gene expression. J Leukoc Biol (2020) 108:723-37. doi: 10.1002/JLB.5MA0120-209R
PubMed Abstract|CrossRef Full Text|Google ScholarCherrier DE, Serafini N, Di Santo JP. Innate lymphoid cell development: a T cell perspective. Immunity (2018) 48:1091-103. doi: 10.1016/j.immuni.2018.05.010.
PubMed Abstract|CrossRef Full Text|Google ScholarKorchagina AA、Koroleva E、Tumanov AV. 粘膜感染症における自然リンパ球の可塑性。微生物 (2023) 11:461. doi: 10.3390/microorganisms11020461
PubMed Abstract|CrossRef Full Text|Google ScholarShih HY, Sciume G, Mikami Y, Guo L, Sun HW, Brooks SR, et al. Regulomesの発生的獲得が自然リンパ系細胞の機能性を支配する. Cell (2016) 165:1120-33. doi: 10.1016/j.cell.2016.04.029.
PubMed Abstract|CrossRef Full Text|Google ScholarBernink JH, Krabbendam L, Germar K, de Jong E, Gronke K, Kofoed-Nielsen M, et al. Interleukin-12 and -23 control plasticity of CD127(+) group 1 and group 3 innate lymphoid cells in the intestinal lamina propria. Immunity (2015) 43:146-60. doi: 10.1016/j.immuni.2015.06.019.
PubMed Abstract | CrossRef Full Text | Google ScholarSilver JS, Kearley J, Copenhaver AM, Sanden C, Mori M, Yu L, et al. COPDの増悪に伴う炎症性トリガーは、肺の第2群自然リンパ系細胞の可塑性をオーケストレートする。Nat Immunol (2016) 17:626-35. doi: 10.1038/ni.3443
PubMed Abstract|CrossRef Full Text|Google ScholarPark E, Patel S, Wang Q, Andhey P, Zaitsev K, Porter S, et al. Toxoplasma gondii感染によりNK細胞のILC1様細胞への転換が促される。Elife (2019) 8:e47605. doi: 10.7554/eLife.47605.
PubMed Abstract|CrossRef Full Text|Google ScholarPikovskaya O, Chaix J, Rothman NJ, Collins A, Chen YH, Scipioni AM, et al. Cutting edge: eomesodermin is sufficient to direct type 1 innate lymphocyte development into the conventional NK lineage. J Immunol (2016) 196:1449-54. doi: 10.4049/jimmunol.1502396.
PubMed Abstract|CrossRef Full Text|Google ScholarVonarbourg C, Mortha A, Bui VL, Hernandez PP, Kiss EA, Hoyler T, et al. Regulated expression of nuclear receptor RORgammat confers distinct functional fates to NK cell receptor-expressing RORgammat(+) innate lymphocytes. 免疫 (2010) 33:736-51. doi: 10.1016/j.immuni.2010.10.017.
PubMed Abstract | CrossRef Full Text | Google ScholarT-bet勾配は、CCR6-RORgammat+自然リンパ系細胞の運命と機能を制御する。ネイチャー (2013) 494:261-5.
PubMed Abstract|CrossRef Full Text|Google ScholarBernink JH, Peters CP, Munneke M, te Velde AA, Meijer SL, Weijer K, et al. Human type 1 innate lymphoid cells accumulate in inflamed mucosal tissues. Nat Immunol (2013) 14:221-9. doi: 10.1038/ni.2534
PubMed Abstract | CrossRef Full Text | Google Scholar上皮内1型自然リンパ球は、IL-12およびIL-15応答性のIFN-γ産生細胞のユニークなサブセットである。免疫 (2013) 38:769-81. doi: 10.1016/j.immuni.2013.02.010.
PubMed Abstract | CrossRef Full Text | Google ScholarLi J, Doty AL, Tang Y, Berrie D, Iqbal A, Tan SA, et al. IL-17A(+) IFN-gamma(+) and IL-22(+) IFN-gamma(+) T細胞サブセットの濃縮は、クローン病患者の終回腸におけるNKp44(+) ILC3sの減少と関連しています。Clin Exp Immunol (2017) 190:143-53. doi: 10.1111/cei.12996.
PubMed Abstract|CrossRef Full Text|Google ScholarDyring-Andersen B, Geisler C, Agerbeck C, Lauritsen JP, Gudjonsdottir SD, Skov L, et al. 非病変性乾癬皮膚における第3群自然リンパ系細胞の数と頻度の増加.Br J Dermatol (2014) 170:609-16. doi: 10.1111/bjd.12658.
PubMed Abstract | CrossRef Full Text | Google ScholarTeunissen MBM, Munneke JM, Bernink JH, Spuls PI, Res PCM, te Velde A, et al. Composition of innate lymphoid cell subsets in the human skin: enrichment of NCR(+) ILC3 in lesional skin and blood of psoriasis patients. J Invest Dermatol (2014) 134:2351-60. doi: 10.1038/jid.2014.146.
PubMed Abstract|CrossRef Full Text|Google ScholarSun JC, Lanier LL. NK細胞の発生、恒常性、機能:CD8(+)T細胞との類似性(parallels). NK細胞の発生、ホメオスタシス、機能:CD8(+)T細胞との類似性。
PubMedアブストラクト|クロスリファレンス全文|Google ScholarNKG2D欠損マウスは、自然発生した悪性腫瘍のモデルにおいて、腫瘍監視に欠陥がある。免疫 (2008) 28:571-80. doi: 10.1016/j.immuni.2008.02.016
PubMed Abstract | CrossRef Full Text | Google ScholarFoley B, Felices M, Cichocki F, Cooley S, Verneris MR, Miller JS. NK細胞とその受容体の生物学は、造血細胞移植(HCT)後の臨床転帰に影響を与える。Immunol Rev (2014) 258:45-63. doi: 10.1111/imr.12157.
PubMed Abstract|CrossRef Full Text|Google ScholarKlose CSN, Flach M, Mohle L, Rogell L, Hoyler T, Ebert K, et al. 共通の前駆細胞からオールヘルパー様自然リンパ系細胞系へのタイプ1 ILCの分化(Differentiation of type 1 ILCs from a common progenitor to all helper-like innate lymphoid cell lineages. Cell (2014) 157:340-56. doi: 10.1016/j.cell.2014.03.030.
PubMed Abstract|CrossRef Full Text|Google ScholarMaloy KJ, Uhlig HH. ILC1集団は国境警備に参加する。免疫 (2013) 38:630-2. doi: 10.1016/j.immuni.2013.03.005.
PubMed Abstract | CrossRef Full Text | Google ScholarDiefenbach A, Colonna M, Koyasu S. Development, differentiation, and diversity of innate lymphoid cells. Immunity (2014) 41:354-65. doi: 10.1016/j.immuni.2014.09.005.
PubMed Abstract|CrossRef Full Text|Google ScholarDussy C, Faure F, Mayol K, Viel S, Gasteiger G, Charrier E, et al. T-Bet and eomes instruct the development of two distinct natural killer cell lineages in the liver and in the bone marrow. J Exp Med (2014) 211:563-77. doi: 10.1084/jem.20131560
PubMed Abstract|CrossRef Full Text|Google ScholarBiron CA, Nguyen KB, Pien GC, Cousens LP, Salazar-Mather TP. 抗ウイルス防御機能におけるナチュラルキラー細胞と生得的サイトカインによる制御。(1999年) 17:189-220. doi: 10.1146/annurev.immunol.17.1.189
PubMed Abstract | CrossRef Full Text | Google ScholarハリムTY、マクラーレンA、ロマニッシュMT、ゴールドMJ、マクナニーKM、武井F. レチノイン酸受容体関連オーファン核内受容体αは、ナチュラルヘルパー細胞の発達とアレルギー性炎症に必要である。免疫 (2012) 37:463-74. doi: 10.1016/j.immuni.2012.06.012.
PubMed Abstract | CrossRef Full Text | Google ScholarT細胞因子1は、グループ2の自然リンパ球の生成に必要である。免疫 (2013) 38:694-704. doi: 10.1016/j.immuni.2012.12.003.
PubMed Abstract | CrossRef Full Text | Google ScholarMjosberg J, Bernink J, Golebski K, Karrich JJ, Peters CP, Blom B, et al. 転写因子GATA3はヒト2型自然リンパ系細胞の機能に必須である。免疫 (2012) 37:649-59. doi: 10.1016/j.immuni.2012.08.015.
PubMed Abstract | CrossRef Full Text | Google ScholarMjosberg JM, Trifari S, Crellin NK, Peters CP, van Drunen CM, Piet B, et al. Human IL-25 and IL-33-responsive type 2 innate lymphoid cell are defined by expression of CRTH2 and CD161. Nat Immunol (2011) 12:1055-62. doi: 10.1038/ni.2104
PubMed Abstract | CrossRef Full Text | Google ScholarYang Q, Saenz SA, Zlotoff DA, Artis D, Bhandoola A. Cutting edge: Natural Helper Cell derive from lymphoid progenitors. J Immunol (2011) 187:5505-9. doi: 10.4049/jimmunol.1102039.
PubMed Abstract | CrossRef Full Text | Google Scholarインフルエンザによる気道の過反応は、適応免疫とは無関係に自然リンパ球が媒介する。Natイミュノール(2011)12:631-8.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarEiwegger T, Akdis CA. IL-33は、喘息モデルマウスにおいて、組織細胞、樹状細胞、Th2細胞の発達を結びつける。Eur J Immunol (2011) 41:1535-8. doi: 10.1002/eji.201141668.
PubMed Abstract | CrossRef Full Text | Google Scholar蠕虫駆除の開始時にIL-4、IL-5、IL-13を供給するインターロイキン(IL)-25依存性細胞集団の同定(Fallon PG, Ballantyne SJ, Mangan NE, Barlow JL, Dasvarma A, Hewett DR, et al. J Exp Med (2006) 203:1105-16. doi: 10.1084/jem.20051615.
PubMed Abstract | CrossRef Full Text | Google ScholarIL-9運命レポーターは、肺の炎症における生得的なIL-9反応の誘導を示す。Nat Immunol (2011) 12:1071-7. doi: 10.1038/ni.2133.
PubMed Abstract | CrossRef Full Text | Google Scholarインフルエンザウイルス感染後の肺組織のホメオスタシスを促進する自然リンパ系細胞。Nat Immunol (2011) 12:1045-54. doi: 10.1031/ni.2131.
PubMed Abstract|CrossRef Full Text|Google ScholarSonnenberg、Monticelli LA、Alenghat T、Fung TC、Hutnick NA、Kunisawa J、et al. Innate lymphoid cells promote anatomical containment of lymphoid-resident commensal bacteria. サイエンス (2012) 336:1321-5.
PubMed Abstract|CrossRef Full Text|Google ScholarRoediger、Kyle R、Yip KH、Sumaria N、Guy TV、Kim BS、et al. 皮膚免疫サーベイランスとグループ2自然リンパ系細胞による炎症の制御. Nat Immunol (2013) 14:564-73. doi: 10.1038/ni.2584.
PubMed Abstract | CrossRef Full Text | Google ScholarTSLP は IL-33 非依存的な自然リンパ球の応答を誘発し、皮膚の炎症を促進する。Sci Transl Med (2013) 5(170):170ra16. doi: 10.1126/scitranslmed.3005374
PubMed Abstract|CrossRef Full Text|Google ScholarQiu J, Zhou L. アリール炭化水素受容体はRORgammat(+)グループ3 ILCを促進し、腸管免疫と炎症を制御する。このような背景のもと、"Semin Immunopathol (2013) 35:657-70 "と題した論文が発表されました。
PubMed Abstract|CrossRef Full Text|Google Scholarリンパ組織誘導因子様細胞は、IL-17とIL-22の生得的な供給源である。J Exp Med (2009) 206:35-41. doi: 10.1084/jem.20072713.
PubMed Abstract | CrossRef Full Text | Google ScholarMortha A, Chudnovskiy A, Hashimoto D, Bogunovic M, Spencer SP, Belkaid Y, et al. Microbiota-dependent crosstalk between macrophages and ILC3 promotes intestinal homeostasis. Science (2014) 343:1249288. doi: 10.1126/science.1249288.
PubMed Abstract|CrossRef Full Text|Google ScholarScandella E, Bolinger B, Lattmann E, Miller S, Favre S, Littman DR, et al. リンパ組織誘導細胞とT細胞帯の間質との相互作用によるリンパ器官の完全性の回復。Nat Immunol (2008) 9:667-75. doi: 10.1038/ni.1605
PubMed Abstract | CrossRef Full Text | Google ScholarCD4(+)リンパ組織誘導細胞は、腸の自然免疫力を促進する。免疫 (2011) 34:122-34. doi: 10.1016/j.immuni.2010.12.009.
PubMed Abstract | CrossRef Full Text | Google ScholarAparicio-Domingo P, Romera-Hernandez M, Karrich JJ, Cornelissen F, Papazian N, Lindenbergh-Kortleve DJ, et al. Type 3 innate lymphoid cells maintaining intestinal epithelial stem cells after tissue damage. J Exp Med (2015) 212:1783-91. doi: 10.1084/jem.20150318
PubMed Abstract|CrossRef Full Text|Google Scholar溝口明彦、矢野明彦、氷室宏、江崎由美子、貞永智、溝口英明:IBDにおけるIL-22カスケードの臨床的重要性.J Gastroenterol (2018) 53:465-74. doi: 10.1007/s00535-017-1401-7
PubMed Abstract|CrossRef Full Text|Google ScholarGuo XK, Ou J, Liang S, Zhou X, Hu X. Epithelial Hes1は、微生物のディスバイオシスを防ぐことによって腸のホメオスタシスを維持する。粘膜免疫(2018)11:716-26. doi: 10.1038/mi.2017.111.
PubMed Abstract|CrossRef Full Text|Google ScholarホークスJE、ヤンBY、チャンTC、クルーガーJG. IL-23/IL-17シグナル伝達経路の発見と乾癬の治療。J Immunol (2018) 201:1605-13. doi: 10.4049/jimmunol.1800013.
PubMed Abstract|CrossRef Full Text|Google ScholarLyu M, Suzuki H, Kang L, Gaspal F, Zhou W, Goc J, et al. ILC3は、微生物特異的制御性T細胞を選択して腸内の寛容を確立する。ネイチャー (2022) 610:744-51. doi: 10.1038/s41586-022-05141-x
PubMed Abstract|CrossRef Full Text|Google ScholarPearson C, Thornton EE, McKenzie B, Schaupp AL, Huskens N, Griseri T, et al. ILC3 GM-CSF産生と動員は急性腸炎をオーケストレートする. Elife (2016) 5:e10066. doi: 10.7554/eLife.10066.
PubMed Abstract|CrossRef Full Text|Google ScholarSong C, Lee JS, Gilfillan S, Robinette ML, Newberry RD, Stappenbeck TS, et al. 腸炎モデルにおけるNKp46+ ILC3のユニークかつ冗長な機能。J Exp Med (2015) 212:1869-82. doi: 10.1084/jem.20151403.
PubMed Abstract|CrossRef Full Text|Google Scholar後藤恭子、小畑毅、国沢淳、佐藤聡、Ivanov II、Lamichhane A, et al. Innate lymphoid cell regulate intestinal epithelial cell glycosylation. Science (2014) 345:1254009. doi: 10.1126/science.1254009.
PubMed Abstract|CrossRef Full Text|Google ScholarGladiator A, Wangler N, Trautwein-Weidner K, LeibundGut-Landmann S. Cutting edge: IL-17分泌自然リンパ球は、真菌感染に対する宿主防御に必須である。J Immunol (2013) 190:521-5. doi: 10.4049/jimmunol.1202924.
PubMed Abstract|CrossRef Full Text|Google ScholarVan Maele L, Carnoy C, Cayet D, Ivanov S, Porte R, Deruy E, et al. 肺炎球菌感染時の肺における3型自然リンパ系細胞の活性化とインターロイキン22分泌。J Infect Dis (2014) 210:493-503. doi: 10.1093/infdis/jiu106
PubMed Abstract|CrossRef Full Text|Google ScholarRORgammat+ 自然リンパ系細胞は、共生微生物群からのネガティブシグナルを統合することで腸の恒常性を制御している。Nat Immunol (2011) 12:320-6. doi: 10.1038/ni.2002
PubMedアブストラクト|クロスリファレンス全文|Google ScholarIL-22は自然リンパ系細胞で産生され、アレルギー性気道疾患における炎症を抑制する。PloSワン(2011)6:e21799. doi: 10.1371/journal.pone.0021799.
PubMed Abstract|CrossRef Full Text|Google ScholarIL-22BPはインフラマソームによって制御され、腸の腫瘍形成を調節する。
PubMed Abstract|CrossRef Full Text|Google Scholarマウス胚のパイエルスパッチ形成における3つの特徴的なステップ。Int Immunol (1997) 9(4):507-14. doi: 10.1093/intimm/9.4.507.
PubMed Abstract | CrossRef Full Text | Google ScholarMebius RE RP, Weissman IL. 発育中のリンパ節は、APC、NK細胞、濾胞細胞に分化できるが、T細胞やb細胞には分化できないCD4+CD3- LTβ+細胞を集めている。免疫 (1997) 7(4):493-504. doi: 10.1016/s1074-7613(00)80371-4
PubMed Abstract | CrossRef Full Text | Google ScholarBuettner M, Lochner M. 小腸と結腸における二次および三次リンパ器官の発達と機能。Front Immunol (2016) 7:342. doi: 10.3389/fimmu.2016.00342.
PubMed Abstract|CrossRef Full Text|Google ScholarShiu J, Piazuelo MB, Ding H, Czinn SJ, Drakes ML, Banerjee A, et al. 胃LTi細胞はリンパ濾胞形成を促進するが、IRAK-mによって制限され、微生物の増殖を変えない。Mucosal Immunol (2015) 8:1047-59. doi: 10.1038/mi.2014.132
PubMed Abstract|CrossRef Full Text|Google ScholarCrellin NK, Trifari S, Kaplan CD, Satoh-Takayama N, Di Santo JP, Spits H. Regulation of cytokine secretion in human CD127(+) LTi-like innate lymphoid cells by toll-like receptor 2. 免疫 (2010) 33:752-64. doi: 10.1016/j.immuni.2010.10.012.
PubMed Abstract | CrossRef Full Text | Google ScholarCording S, Medvedovic J, Lecuyer E, Aychek T, Dejardin F, Eberl G. Mouse models for the study of fate and function of innate lymphoid cells. Eur J Immunol (2018) 48:1271-80. doi: 10.1002/eji.201747388
PubMed Abstract|CrossRef Full Text|Google ScholarBartizal KF SC, Pleasants JR, Balish E. The effect of microbial flora, diet, and age on the tumoricidal activity of natural killer cell. J Leukoc Biol (1984) 36(6):739-50. doi: 10.1002/jlb.36.6.739.
PubMed Abstract | CrossRef Full Text | Google Scholarインターフェロンガンマは、脂質ラフトを介したプロセスにより、腸上皮細胞を介した常在性エシェリヒア・コリのトランスロケーションを誘導する。胃腸病学(2005)128:1258-67.
PubMed Abstract | CrossRef Full Text | Google ScholarGury-BenAri M, Thaiss CA, Serafini N, Winter DR, Giladi A, Lara-Astiaso D, et al. The spectrum and regulatory landscape of intestinal innate lymphoid cell are shaped by the microbiome. Cell (2016) 166:1231-46.e13. doi: 10.1016/j.cell.2016.07.043
PubMed Abstract | CrossRef Full Text | Google ScholarPowell N, Walker AW, Stolarczyk E, Canavan JB, Gokmen MR, Marks E, et al. 転写因子T-betはインターロイキン7受容体+自然リンパ系細胞によって媒介される腸の炎症を制御している. 免疫 (2012) 37:674-84. doi: 10.1016/j.immuni.2012.09.008.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarKernbauer E, Ding Y, Cadwell K. An enteric virus can replace the beneficial function of commensal bacteria. ネイチャー(2014)516:94-8. doi: 10.1038/nature13960.
PubMed Abstract|CrossRef Full Text|Google ScholarThio CL, Chi PY, Lai AC, Chang YJ. 酪酸による2型自然リンパ球依存性気道過反応の制御。J Allergy Clin Immunol (2018) 142:1867-1883.e12. doi: 10.1016/j.j.jaci.2018.02.032.
PubMed Abstract|CrossRef Full Text|Google ScholarGrobeta P, Doser K, Falk W, Obermeier F, Hofmann C. IL-33 attenuates development and perpetuation of chronic intestinal inflammation. 炎症性腸疾患(2012)18:1900-9.
クロスレフフルテキスト|Google ScholarMonticelliLA、OsborneLC、Noti M、Tran SV、Zaiss DM、Artis D. IL-33は、アンフィレグリン-EGFR相互作用に依存する腸管組織保護の自然免疫経路を促進します。Proc Natl Acad Sci USA (2015) 112:10762-7. doi: 10.1073/pnas.1509070112
PubMed Abstract|CrossRef Full Text|Google ScholarMalik A, Sharma D, Zhu Q, Karki R, Guy CS, Vogel P, et al. IL-33はIgA-微生物叢軸を制御してIL-1α依存性の大腸炎および腫瘍形成を抑制する。J Clin Invest (2016) 126:4469-81. doi: 10.1172/JCI88625
PubMed Abstract|CrossRef Full Text|Google ScholarRORgammat と常在性微生物叢は、粘膜のインターロイキン 22 産生 NKp46+ 細胞の分化に必要である。Nat Immunol (2009) 10:83-91. doi: 10.1038/ni.1684
PubMed Abstract | CrossRef Full Text | Google ScholarRORγt+自然リンパ系細胞は、共生微生物群からのネガティブシグナルを統合することで腸の恒常性を制御する。Nat免疫学 (2011) 12(4):320-6.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarサバットR、オウヤンW、ウォルクK.IL-22-IL-22R1システムの治療機会。Nat Rev Drug Discov (2014) 13:21-38. doi: 10.1038/nrd4176
PubMed Abstract|CrossRef Full Text|Google ScholarZelante T, Iannitti RG, Cunha C, De Luca A, Giovannini G, Pieraccini G, et al. 微生物のトリプトファン異化物はアリール炭化水素受容体に関与し、インターロイキン22を介して粘膜反応性のバランスをとる。免疫 (2013) 39:372-85. doi: 10.1016/j.immuni.2013.08.003.
PubMed Abstract|CrossRef Full Text|Google Scholar腸管における孤立性濾胞形成とT細胞非依存性免疫グロブリンa生成におけるリンパ系組織誘導細胞の必要性. 免疫 (2008) 29:261-71. doi: 10.1016/j.immuni.2008.05.014.
PubMed Abstract | CrossRef Full Text | Google ScholarAbt、Osborne、Monticelli LA、Doering TA、Alenghat T、Sonnenberg GF、et al. 通常性細菌は自然抗ウイルス免疫の活性化閾値を調整する。免疫 (2012) 37:158-70. doi: 10.1016/j.immuni.2012.04.011.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar非粘液性単核食細胞によるナチュラルキラー細胞のプライミングには、常在細菌からの指示信号が必要である。免疫学 (2012) 37:171-86. doi: 10.1016/j.immuni.2012.05.020
PubMedアブストラクト|クロスリファレンス全文|Google ScholarConstantinides MG. 微生物叢と自然界および自然界様リンパ球の相互作用。J Leukoc Biol (2018) 103:409-19. doi: 10.1002/JLB.3RI0917-378R
PubMed Abstract|CrossRef Full Text|Google Scholar上村陽子、Lanier LL. ナチュラルキラー細胞系におけるメモリー細胞前駆体の恒常的な制御。Cell Rep (2015) 10:280-91. doi: 10.1016/j.celrep.2014.12.025.
PubMed Abstract|CrossRef Full Text|Google Scholarvon Moltke J, Ji M, Liang HE, Locksley RM. Tuft-cell由来のIL-25は、腸のILC2-上皮反応回路を制御している。Nature (2016) 529:221-5. doi: 10.1038/nature16161.
PubMed Abstract|CrossRef Full Text|Google ScholarLiu TC, Stappenbeck TS. 炎症性腸疾患の遺伝学と発症機序。Annu Rev Pathol (2016) 11:127-48. doi: 10.1146/annurev-pathol-012615-044152.
PubMed Abstract|CrossRef Full Text|Google ScholarZhou L, Chu C, Teng F, Bessman NJ, Goc J, Santosa EK, et al. Innate lymphoid cell support regulatory T cells in the intestine through interleukin-2. ネイチャー(2019)568:405-9. doi: 10.1038/s41586-019-1082-x
PubMed Abstract|CrossRef Full Text|Google ScholarCastleman MJ、Dillon SM、Purba CM、Cogswell AC、Kibbie JJ、McCarter MD、et al. 常在菌および病原性細菌は、複数のメカニズムを通じてヒト大腸ILC3sからIL-22ではなくIFNγ産生を間接的に誘導する。Front Immunol (2019) 10:649. doi: 10.3389/fimmu.2019.00649.
PubMed Abstract|CrossRef Full Text|Google ScholarSaez A、Gomez-Bris R、Herero-Fernandez B、Mingorance C、Rius C、Gonzalez-Granado JM. 腸のホメオスタシスと炎症性腸疾患における自然リンパ系細胞。Int J Mol Sci (2021) 22. doi: 10.3390/ijms22147618
クロスレフフルテキスト|Google ScholarSepahi A, Liu Q, Friesen L, Kim CH. 食物繊維の代謝産物が自然リンパ球の応答を制御する。Mucosal Immunol (2021) 14:317-30. doi: 10.1038/s41385-020-0312-8.
PubMed Abstract|CrossRef Full Text|Google Scholar佐藤・高山・加藤・本村・影山・田口・明石・木下・大徳・他 胃の細菌誘導性2群自然リンパ球はIgAの誘導により免疫保護を行う。Immunity (2020) 52:635-649.e4. doi: 10.1016/j.immuni.2020.03.002
PubMed Abstract|CrossRef Full Text|Google ScholarLi R, Jiang XX, Zhang LF, Liu XM, Hu TZ, Xia XJ, et al. Group 2 innate lymphoid cells are involved in skewed type 2 immunity of gastric diseases induced by helicobacter pylori investment. Mediators Inflamm (2017) 2017:4927964. doi: 10.1155/2017/4927964
PubMed Abstract|CrossRef Full Text|Google ScholarBostick JW, Wang Y, Shen Z, Ge Y, Brown J, Chen Z-m, et al. Dichotomous regulation of group 3 innate lymphoid cell by nongastric helicobacter species. Proc Natl Acad Sci USA (2019) 116:24760-9. doi: 10.1073/pnas.1908128116
PubMed Abstract|CrossRef Full Text|Google ScholarLeupold T, Wirtz S. ILCs-crucial players in enteric infectious diseases(腸管感染症における重要なプレーヤー)。Int J Mol Sci (2022) 23. doi: 10.3390/ijms232214200
PubMed Abstract|CrossRef Full Text|Google ScholarXiong L, Wang S, Dean JW, Oliff KN, Jobin C, Curtis R III, et al. Group 3 innate lymphoid cell pyroptosis represents a host defense mechanism against salmonella infection. (1)サルモネラ菌の感染に対する宿主の防御機構、(2)サルモネラ菌の感染に対する宿主の防御機構、(3)サルモネラ菌の感染に対する宿主の防御機構。
PubMed Abstract|CrossRef Full Text|Google ScholarBuonocore S, Ahern PP, Uhlig HH, Ivanov II, Littman DR, Maloy KJ, et al. Innate lymphoid cells drive interleukin-23-dependent innate intestinal pathology. ネイチャー(2010)464:1371-5.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarSeshadri S, Allan DSJ, Carlyle JR, Zenewicz LA. Bacillus anthracis lethal toxinは、IL-23を介したMAPKシグナルの摂動を通じてILC3機能を負に調節する。PloS Pathog (2017) 13:e1006690. doi: 10.1371/journal.ppat.1006690.
PubMed Abstract|CrossRef Full Text|Google ScholarTumanov AV, Koroleva EP, Guo X, Wang Y, Kruglov A, Nedospasov S, et al. Lymphotoxin controls the IL-22 protection pathway in gut innate lymphoid cells during mucosal pathogen challenge. 細胞宿主微生物 (2011) 10:44-53. doi: 10.1016/j.chom.2011.06.002
PubMed Abstract | CrossRef Full Text | Google ScholarEmgard J, Kammoun H, Garcia-Cassani B, Chesne J, Parigi SM, Jacob JM, et al. 受容体GPR183によるオキシステロールセンシングは、自然リンパ球のリンパ組織誘導機能および大腸炎を促進します。Immunity (2018) 48:120-32.e8. doi: 10.1016/j.immuni.2017.11.020
PubMed Abstract|CrossRef Full Text|Google ScholarChu C, Moriyama S, Li Z, Zhou L, Flamar AL, Klose CSN, et al. 腸関連リンパ組織におけるグループ3自然リンパ球の抗微生物機能はG-Protein-Coupled receptor 183によって制御される。セルレップ(2018)23:3750-8. doi: 10.1016/j.celrep.2018.05.099
PubMed Abstract|CrossRef Full Text|Google ScholarGuo X, Qiu J, Tu T, Yang X, Deng L, Anders RA, et al. Induction of innate lymphoid cell-derived interleukin-22 by the transcription factor STAT3 mediates protection against intestinal infection. Immunity (2014) 40:25-39. doi: 10.1016/j.immuni.2013.10.021.
PubMed Abstract|CrossRef Full Text|Google ScholarSpencer SP, Wilhelm C, Yang Q, Hall JA, Bouladoux N, Boyd A, et al. 微量栄養素の欠乏に対する自然リンパ球の適応は、2型バリア免疫を促進する. Science (2014) 343:432-7. doi: 10.1126/science.1247606.
PubMed Abstract|CrossRef Full Text|Google ScholarKim MH, Taparowsky EJ, Kim CH. レチノイン酸は、自然リンパ系細胞サブセットの腸への移動を差動的に制御する。Immunity (2015) 43:107-19. doi: 10.1016/j.immuni.2015.06.009.
PubMed Abstract|CrossRef Full Text|Google Scholarvan de Pavert SA, Ferreira M, Domingues RG, Ribeiro H, Molenaar R, Moreira-Santos L, et al. 母性レチノイドは3型自然リンパ系細胞を制御して子孫の免疫力を設定する。Nature (2014) 508:123-7. doi: 10.1038/nature13158.
PubMed Abstract|CrossRef Full Text|Google ScholarMielke LA, Jones SA, Raverdeau M, Higgs R, Stefanska A, Groom JR, et al. Retinoic acid expression associates with enhanced IL-22 production by gammadelta T cells and innate lymphoid cells and attenuation of intestinal inflammation. J Exp Med (2013) 210:1117-24. doi: 10.1084/jem.20121588
PubMed Abstract|CrossRef Full Text|Google ScholarWilhelm C, Harrison OJ, Schmitt V, Pelletier M, Spencer SP, Urban JF Jr, et al. 栄養不良および蠕虫感染時のILC2介在バリア保護における脂肪酸代謝の重要な役割. J Exp Med (2016) 213:1409-18. doi: 10.1084/jem.20151448.
PubMed Abstract|CrossRef Full Text|Google ScholarZhou W, Sonnenberg GF. 腸内におけるグループ3自然リンパ球の活性化と抑制。Trends Immunol (2020) 41:721-33. doi: 10.1016/j.it.2020.06.009.
PubMed Abstract|CrossRef Full Text|Google ScholarベルカイドY、ハンドTW. 免疫と炎症における微生物叢の役割。Cell (2014) 157:121-41. doi: 10.1016/j.cell.2014.03.011.
PubMed Abstract|CrossRef 全文|Google Scholar微生物が誘導する三次リンパ組織は、RORγt細胞やLTi細胞の非存在下で炎症性疾患を悪化させる。J Exp Med (2011) 208:125-34. doi: 10.1084/jem.20100052.
PubMed Abstract | CrossRef Full Text | Google ScholarRooks MG, Garrett WS. 腸内細菌叢、代謝産物、宿主免疫。Nat Rev Immunol (2016) 16:341-52. doi: 10.1038/nri.2016.42.
PubMed Abstract|CrossRef Full Text|Google ScholarChun E, Lavoie S, Fonseca-Pereira D, Bae S, Michaud M, Hoveyda HR, et al. メタボライト感知受容体Ffar2は、大腸3群自然リンパ球と腸管免疫を調節する。Immunity (2019) 51:871-884.e6. doi: 10.1016/j.immuni.2019.09.014
PubMed Abstract|CrossRef Full Text|Google ScholarFachi JL, Secca C, Rodrigues PB, Mato FCP, Di Luccia B, Felipe JS, et al. 酢酸はFFAR2を通じてc. difficileに対する好中球およびILC3応答を調整する。J Exp Med (2020) 217(3):e20190489. doi: 10.1084/jem.20190489.
クロスレフフルテキスト|Google ScholarキムSH、チョBH、キヨノH、ジャンYS. 微生物叢由来の酪酸は、終末回腸パイエルパッチにおける3群自然リンパ球を抑制する。Sci Rep (2017) 7:3980. doi: 10.1038/s41598-017-02729-6
PubMed Abstract|CrossRef Full Text|Google ScholarRizvi ZA, Dalal R, Sadhu S, Kumar Y, Kumar S, Gupta SK, et al. 高塩分食はNK細胞と腸内細菌叢の相互作用を仲介して強力な腫瘍免疫を誘発する。Sci Adv (2021) 7:eabg5016. doi: 10.1126/sciadv.abg5016.
PubMed Abstract|CrossRef Full Text|Google ScholarLiebana-Garcia R, Olivares M, Frances-Cuesta C, Rubio T, Rossini V, Quintas G, et al. Intestinal group 1 innate lymphoid cells drive macrophage-induced inflammation and endocrine defects in obesity and promote insulinemia. 腸内細菌(2023)15:2181928.
PubMed Abstract|CrossRef Full Text|Google ScholarLiew FY, Girard JP, Turnquist HR. 健康および疾患におけるインターロイキン-33。Nat Rev Immunol (2016) 16:676-89. doi: 10.1038/nri.2016.95.
PubMed Abstract|CrossRef Full Text|Google ScholarKlose CSN, Artis D. Innate lymphoid cells as regulators of immunity, inflammation and tissue homeostasis. Nat Immunol (2016) 17:765-74. doi: 10.1038/ni.3489.
PubMed Abstract|CrossRef Full Text|Google ScholarPu Q, Lin P, Gao P, Wang Z, Guo K, Qin S, et al. 腸内細菌叢はILC2コンパートメント移動を媒介して腸-肺軸炎症反応を制御する。J Immunol (2021) 207:257-67. doi: 10.4049/jimmunol.2001304
PubMed Abstract|CrossRef Full Text|Google Scholarインターロイキン22は、付着・離脱する細菌病原体に対する初期の宿主防御を媒介する(Zheng Y, Valdez PA, Danilenko DM, Hu Y, Sa SM, Gong Q, et al. (2008年) 14:282-9. doi: 10.1038/nm1720
PubMedアブストラクト|クロスリファレンス全文|Google ScholarSonnenberg GF, Fouser LA, Artis D. Border patrol: regulation of immunity, inflammation and tissue homeostasis at barrier surfaces by IL-22。Nat Immunol (2011) 12:383-90. doi: 10.1038/ni.2025
PubMedアブストラクト|クロスリファレンス全文|Google ScholarZenewiczLA、Yin X、Wang G、Elinav E、Hao L、Zhao L、et al. IL-22欠損は大腸微生物叢を変化させ、伝達性および大腸原性である。J Immunol (2013) 190:5306-12. doi: 10.4049/jimmunol.1300016
PubMed Abstract|CrossRef Full Text|Google ScholarCash HL, Whitham CV, Behrendt CL, Hooper LV. 共生細菌が腸内殺菌レクチンを直接発現させる。科学(2006)313:1126-30.doi: 10.1126/science.1127119.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar抗菌レクチンRegIIIgammaは、腸内の微生物と宿主の空間的分離を促進する。サイエンス(2011)334:255-8 doi: 10.1126/science.1209791
PubMedアブストラクト|クロスリファレンス全文|Google ScholarWang L, Fouts DE, Starkel P, Hartmann P, Chen P, Llorente C, et al. Intestinal REG3 lectins protect against alcoholic steatohepatitis by reducing mucosa-associated microbiota and preventing bacterial translocation. Cell Host Microbe (2016) 19:227-39. doi: 10.1016/j.chom.2016.01.003.
PubMed Abstract|CrossRef Full Text|Google Scholarインターロイキン17Aおよび-17Fの粘膜上皮細菌感染に対する宿主防御およびアレルギー反応における異なる役割。免疫 (2009) 30:108-19. doi: 10.1016/j.immuni.2008.11.009.
PubMed Abstract | CrossRef Full Text | Google ScholarMulcahy ME, Leech JM, Renauld JC, Mills KH, McLoughlin RM. インターロイキン22は、抗菌ペプチドの発現とケラチノサイトの分化を制御して、鼻粘膜の黄色ブドウ球菌のコロニー形成を制御する。粘膜免疫学(2016)9:1429-41. doi: 10.1038/mi.2016.24.
PubMed Abstract|CrossRef Full Text|Google ScholarConti HR, Peterson AC, Brane L, Huppler AR, Hernandez-Santos N, Whibley N, et al. Oral-resident natural Th17 cells and gammadelta T cells control opportunistic candida albicans infections. J Exp Med (2014) 211:2075-84. doi: 10.1084/jem.20130877.
PubMed Abstract|CrossRef Full Text|Google ScholarConti HR, Bruno VM, Childs EE, Daugherty S, Hunter JP, Mengesha BG, et al. 口腔上皮細胞におけるIL-17受容体シグナルは、口腔咽頭カンジダ症に対する保護に重要である。Cell Host Microbe (2016) 20:606-17. doi: 10.1016/j.chom.2016.10.001.
PubMed Abstract|CrossRef Full Text|Google ScholarWu D, Hu L, Han M, Deng Y, Zhang Y, Ren G, et al. PD-1シグナルは、脂肪酸酸化を抑制することでリンパ系組織誘導細胞の活性化を促進する。Nat Metab (2022) 4:867-82. doi: 10.1038/s42255-022-00595-9
PubMed Abstract|CrossRef Full Text|Google ScholarSecca、Bando JK、Fachi JL、Gilfillan S、Peng V、Di Luccia B、et al. 腸管粘膜におけるLTi様細胞の空間分布が3型自然免疫を制御する。Proc Natl Acad Sci USA (2021) 13:67-78. doi: 10.1073/pnas.2101668118
クロスレフフルテキスト|Google ScholarPeloquin JM, Goel G, Villablanca EJ, Xavier RJ. 小児炎症性腸疾患のメカニズム。Annu Rev Immunol (2016) 34:31-64. doi: 10.1146/annurev-immunol-032414-112151
PubMed Abstract|CrossRef Full Text|Google ScholarTorres J, Mehandru S, Colombel J-F, Peyrin-Biroulet L. Crohn's Disease. ランセット(2017)389:1741-55. doi: 10.1016/s0140-6736(16)31711-1.
PubMed Abstract|CrossRef Full Text|Google Scholarde Souza HSP, Fiocchi C, Iliopoulos D. The IBD interactome: an integrated view of aetiology, pathogenesis and therapy. Nat Rev Gastroenterol Hepatol (2017) 14:739-49. doi: 10.1038/nrgastro.2017.110.
PubMed Abstract|CrossRef Full Text|Google ScholarForkel M, van Tol S, Hoog C, Michaelsson J, Almer S, Mjosberg J. Distinct alterations in the composition of mucosal innate lymphoid cells in newly diagnosed and established crohn's disease and ulcerative colitis. J Crohns Colitis (2019) 13:67-78. doi: 10.1093/ecco-jcc/jjy119
PubMed Abstract|CrossRef Full Text|Google ScholarコマンD、コアレスI、ロバーツLB、ネベスJF. 炎症性腸疾患におけるヘルパー様タイプ1自然リンパ系細胞。Front Immunol (2022) 13:903688. doi: 10.3389/fimmu.2022.903688.
PubMed Abstract|CrossRef Full Text|Google ScholarFrisbee AL, Saleh MM, Young MK, Leslie JL, Simpson ME, Abhyankar MM, et al. IL-33 drives group 2 innate lymphoid cell-mediated protection during clostridium difficile infection. Nat Commun (2019) 10:2712. doi: 10.1038/s41467-019-10733-9
PubMed Abstract|CrossRef Full Text|Google ScholarGarrido-Mesa N、Schroeder JH、Stolarczyk E、Gallagher AL、Lo JW、Bailey C、他、T-Betは2型自然リンパ球機能の抑制を介して腸管粘膜免疫応答を制御する。Mucosal Immunol (2019) 12:51-63. doi: 10.1038/s41385-018-0092-6
PubMed Abstract|CrossRef Full Text|Google ScholarSano T, Huang W, Hall JA, Yang Y, Chen A, Gavzy SJ, et al. IL-23R/IL-22 circuit regulates epithelial serum amyloid a to promote local effector Th17 response. Cell (2015) 163:381-93. doi: 10.1016/j.cell.2015.08.061.
PubMed Abstract|CrossRef Full Text|Google ScholarViladomiu M, Kivolowitz C, Abdulhamid A, Dogan B, Victorio S, Castellanos JG, et al. クロウン病脊椎関節炎に濃縮されたIgAコーティング大腸菌がT h 17依存性の炎症を促進する。Sci Transl Med (2017) 9(376). doi: 10.1126/scitranslmed.aaf9655
PubMed Abstract|CrossRef Full Text|Google ScholarCastellanos JG, Woo V, Viladomiu M, Putzel G, Lima S, Diehl GE, et al. Microbiota-induced TNF-like ligand 1A drives group 3 innate lymphoid cell-mediated barrier protection and intestinal T cell activation during colitis. Immunity (2018) 49:1077-89.e5. doi: 10.1016/j.immuni.2018.10.014
PubMed Abstract|CrossRef Full Text|Google ScholarCochez PM, Michiels C, Hendrickx E, Van Belle AB, Lemaire MM, Dauguet N, et al. AhR modulates the IL-22-producing cell proliferation/recruitment in imiquimod-induced psoriasis mouse model.Eur J Immunol (2016) 46:1449-59. doi: 10.1002/eji.201546070
PubMed Abstract|CrossRef Full Text|Google ScholarKiss EA, Vonarbourg C, Kopfmann S, Hobeika E, Finke D, Esser C, et al. Natural aryl hydrocarbon receptor ligands control organogenesis of intestinal lymphoid follicle. サイエンス(2011)334:1561-5 doi: 10.1126/science.1214914.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarQiu J, Heller JJ, Guo X, Chen ZM, Fish K, Fu YX, et al. アリール炭化水素受容体は、自然リンパ系細胞の調節を通じて腸管免疫を制御する。免疫 (2012) 36:92-104. doi: 10.1016/j.immuni.2011.11.011.
PubMed Abstract | CrossRef Full Text | Google ScholarAHRは、ノッチに依存する経路と依存しない経路を経由して、腸管ILC22細胞および出生後のリンパ組織の発達を促進する。Nat Immunol (2011) 13:144-51. doi: 10.1038/ni.2187.
PubMed Abstract | CrossRef Full Text | Google ScholarLiY、Innocentin S、Withers DR、Roberts NA、Gallagher AR、Grigorieva EF、et al. 外来刺激により上皮内リンパ球がアリル炭酸ガス受容体活性化により維持される。細胞 (2011) 147:629-40. doi: 10.1016/j.cell.2011.09.025.
PubMed Abstract | CrossRef Full Text | Google ScholarHou Q, Ye L, Liu H, Huang L, Yang Q, Turner JR, et al. Lactobacillus accelerates ISCs regeneration to protect the integrity of intestinal mucosa through activation of STAT3 signaling pathway induced by LPLs secretion of IL-22. セルデス・ディファー(2018)25:1657-70. doi: 10.1038/s41418-018-0070-2
PubMed Abstract|CrossRef Full Text|Google ScholarLamas B, Richard ML, Leducq V, Pham HP, Michel ML, Da Costa G, et al. CARD9 impacts colitis by altering gut microbiota metabolism of tryptophan into aryl hydrocarbon receptor ligands. Nat Med (2016) 22:598-605. doi: 10.1038/nm.4102.
PubMed Abstract|CrossRef Full Text|Google ScholarSun MC, Zhang FC, Yin X, Cheng BJ, Zhao CH, Wang YL, et al. Lactobacillus reuteri f-9-35 is prevent DSS-induced colitis by inhibiting proinflammatory gene expression and restoring the gut microbiota in mice. J Food Sci (2018) 83:2645-52. doi: 10.1111/1750-3841.14326.
PubMed Abstract|CrossRef Full Text|Google ScholarAhl D, Liu H, Schreiber O, Roos S, Phillipson M, Holm L. Lactobacillus reuteriは粘液の厚さを増加させ、マウスのデキストラン硫酸ナトリウム誘発大腸炎を改善する。Acta Physiol (Oxf) (2016) 217:300-10. doi: 10.1111/apha.12695.
PubMed Abstract|CrossRef Full Text|Google ScholarEken A, Singh AK, Treuting PM, Oukka M. IL-23R+ innate lymphoid cells induce colitis via interleukin-22-dependent mechanism. Mucosal Immunol (2014) 7:143-54. doi: 10.1038/mi.2013.33.
PubMed Abstract|CrossRef Full Text|Google ScholarLongman RS, Diehl GE, Victorio DA, Huh JR, Galan C, Miraldi ER, et al. CX(3)CR1(+) mononuclear phagocytes support colitis-associated innate lymphoid cell production of IL-22。J Exp Med (2014) 211:1571-83. doi: 10.1084/jem.20140678.
PubMed Abstract|CrossRef Full Text|Google ScholarSchmechel S, Konrad A, Diegelmann J, Glas J, Wetzke M, Paschos E, et al. クローン病の遺伝的感受性とTh17細胞機能との関連性: クローン病ではIL-22血清レベルが上昇し、疾患活動性およびIL23R遺伝子型の状態と相関している。Inflamm Bowel Dis (2008) 14:204-12. doi: 10.1002/ibd.20315
PubMed Abstract | CrossRef Full Text | Google ScholarBhatt B、Zeng P、Zhu H、Sivaprakasam S、Li S、Xiao H、et al. Gpr109aは、ILC3媒介の大腸炎症を抑制するために微生物が誘発するIL-23産生を制限する。J Immunol (2018) 200:2905-14. doi: 10.4049/jimmunol.1701625.
PubMed Abstract|CrossRef Full Text|Google ScholarWang T、Zheng N、Luo Q、Jiang L、He B、Yuan X、et al. プロバイオティクス乳酸菌ロイテリは、3群自然リンパ球を阻害することによって免疫チェックポイントブロック関連大腸炎を中止させる。Front Immunol (2019) 10:1235. doi: 10.3389/fimmu.2019.01235.
PubMed Abstract|CrossRef Full Text|Google ScholarEberl G. RORgammat, a multitask nuclear receptor at mucosal surfaces. 粘膜免疫(2017)10:27-34. doi: 10.1038/mi.2016.86.
PubMed Abstract|CrossRef Full Text|Google ScholarOmenetti S, Bussi C, Metidji A, Iseppon A, Lee S, Tolaini M, et al. 腸は機能的に異なる恒常性組織常在細胞および炎症性Th17細胞を保有する。Immunity (2019) 51:77-89.e6. doi: 10.1016/j.immuni.2019.05.004
PubMed Abstract|CrossRef Full Text|Google ScholarLoh W, Tang MLK. 世界的な文脈における食物アレルギーの疫学。Int J Environ Res Public Health (2018) 15(9):2043. doi: 10.3390/ijerph15092043.
PubMed Abstract|CrossRef Full Text|Google ScholarFeehley T, Nagler CR. 常在細菌が食事性抗原に対する感作を調節する細胞および分子経路。Curr Opin Immunol (2014) 31:79-86. doi: 10.1016/j.coi.2014.10.001.
PubMed Abstract|CrossRef Full Text|Google ScholarAitoro R, Paparo L, Amoroso A, Di Costanzo M, Cosenza L, Granata V, et al. Gut microbiota as a target for preventive and therapeutic intervention against food allergy. ニュートリエンツ(2017)9(7):672. doi: 10.3390/nu9070672
PubMed Abstract|CrossRef 全文|Google Scholar古澤由美子、小畑由美子、福田聡美、遠藤太一、中藤剛、高橋大輔、他 通常性微生物由来の酪酸は大腸制御性T細胞の分化を誘導する。ネイチャー (2013) 504:446-50.
PubMed Abstract|CrossRef Full Text|Google ScholarTan J, McKenzie C, Vuillermin PJ, Goverse G, Vinuesa CG, Mebius RE, et al. Dietary fiber and bacterial SCFA enhance oral tolerance and protect against food allergy through diverse cellular pathways. セルレップ(2016)15:2809-24. doi: 10.1016/j.celrep.2016.05.047
PubMed Abstract|CrossRef 全文|Google ScholarKim HJ, Lee SH, Hong SJ. 抗生物質による腸内細菌叢の異常は、短鎖脂肪酸の変化によりマウスのアトピー性皮膚炎を増悪させる。Allergy Asthma Immunol Res (2020) 12:137-48. doi: 10.4168/aair.2020.12.1.137.
PubMed Abstract|CrossRef Full Text|Google ScholarIweala OI, Burks AW. 食物アレルギー:その病因、予防、および治療に関する我々の進化した理解。Curr Allergy Asthma Rep (2016) 16:37. doi: 10.1007/s11882-016-0616-7.
PubMed Abstract|CrossRef Full Text|Google ScholarLevy M, Blacher E, Elinav E. Microbiome, metabolites and host immunity. Curr Opin Microbiol (2017) 35:8-15. doi: 10.1016/j.mib.2016.10.003.
PubMed Abstract|CrossRef Full Text|Google Scholar秋山貴之、Iodi Carstens M、Carstens E. ひっかきなどの対抗刺激による脊髄かゆみシグナルニューロンの抑制を媒介する伝達物質と経路(Transmitters and pathways mediating the inhibition of spinal itch-signaling neurons by scratch and other counterstimuli. PLos One (2011) 6(7):e22665. doi: 10.1371/journal.pone.0022665.
PubMedアブストラクト|クロスリファレンス全文|Google ScholarIL-33は、胸腺間質リンパポエチンやIL-25ではなく、ダニやピーナッツのアレルギー感作の中心である。J Allergy Clin Immunol (2013) 131:187-200.e1-8. doi: 10.1016/j.j.jaci.2012.08.002.
PubMed Abstract|CrossRef Full Text|Google ScholarLee JB, Chen CY, Liu B, Mugge L, Angkasekwinai P, Facchinetti V, et al. IL-25 と CD4(+) TH2 細胞が 2 型自然リンパ球由来の IL-13 産出を増強し、これが IgE を介した実験的食物アレルギーを促進する。J Allergy Clin Immunol (2016) 137:1216-1225.e5. doi: 10.1016/j.j.jaci.2015.09.019
PubMed Abstract|CrossRef Full Text|Google ScholarLeyva-Castillo JM, Galand C, Kam C, Burton O, Gurish M, Musser MA, et al. 機械的皮膚損傷は、腸内肥満細胞拡大を促進することにより食物アナフィラキシーを促進する。Immunity (2019) 50:1262-1275.e4. doi: 10.1016/j.immuni.2019.03.023
PubMed Abstract|CrossRef Full Text|Google ScholarBurton OT, Medina Tamayo J, Stranks AJ, Miller S, Koleoglou KJ, Weinberg EO, et al. IgEはマウス食物アレルギーにおいて2型自然リンパ系細胞を促進する。Clin Exp Allergy (2018) 48:288-96. doi: 10.1111/cea.13075.
PubMed Abstract|CrossRef Full Text|Google ScholarNoval Rivas M, Burton OT, Oettgen HC, Chatila T. グループ2自然リンパ系細胞によるIL-4産生は、制御性T細胞機能を阻害することにより食物アレルギーを促進する。J Allergy Clin Immunol (2016) 138:801-811.e9. doi: 10.1016/j.j.jaci.2016.02.030
PubMed Abstract|CrossRef Full Text|Google ScholarChu DK, Mohammed-Ali Z, Jimenez-Saiz R, Walker TD, Goncharova S, Llop-Guevara A, et al. T ヘルパー細胞 IL-4 drives intestinal Th2 priming to oral peanut antigen, under the control of OX40L and independent of innate-like lymphocytes. Mucosal Immunol (2014) 7:1395-404. doi: 10.1038/mi.2014.29.
PubMed Abstract|CrossRef Full Text|Google ScholarNowarski R, Gagliani N, Huber S, Flavell RA. 炎症とがんにおける自然免疫細胞。がん免疫研究(2013)1:77-84. doi: 10.1158/2326-6066.CIR-13-0081
PubMedアブストラクト|クロスリファレンス全文|Google ScholarBergmann H, Roth S, Pechloff K, Kiss EA, Kuhn S, Heikenwälder M, et al. Card9依存性のIL-1βは、グループ3の自然リンパ系細胞からのIL-22産出を制御し、大腸炎関連癌を促進する。Eur J Immunol (2017) 47:1342-53. doi: 10.1002/eji.201646765
PubMed Abstract|CrossRef Full Text|Google ScholarKirchberger S, Royston DJ, Boulard O, Thornton E, Franchini F, Szabady RL, et al. Innate lymphoid cell sustain colon cancer through production of interleukin-22 in a mouse model. J Exp Med (2013) 210:917-31. doi: 10.1084/jem.20122308.
PubMed Abstract | CrossRef Full Text | Google ScholarGoc J, Lv M, Bessman NJ, Flamar AL, Sahota S, Suzuki H, et al. Dysregulation of ILC3s unleashes progression and immunotherapy resistance in colon cancer. Cell (2021) 184:5015-5030.e16. doi: 10.1016/j.cell.2021.07.029
PubMed Abstract|CrossRef Full Text|Google ScholarGoc J LM, Bessman NJ, Flamar AL, Sahota S, Suzuki H, et al. Glioblastoma is dependent on tRNA pseudouridylation. Cancer Discov (2021) 11:2367. doi: 10.1158/2159-8290.CD-RW2021-123
クロスレフフルテキスト|Google ScholarVétizou M PJ, Daillère R, Lepage P, Waldschmitt N, Flament C, Rusakiewicz S, et al. CTLA-4 blockadeによる抗がん免疫療法は腸内細菌叢に依存する。Science (2015) 350(6264):1079-84. doi: 10.1126/science.aad1329.
PubMed Abstract|CrossRef Full Text|Google ScholarSivan A CL, Hubert N, Williams JB, Aquino-Michaels K, Earley ZM, Benyamin FW, et al. Commensal bifidobacteriumは抗腫瘍免疫を促進し、抗PD-L1効力を促進させる。Science (2015) 350(6264):1084-9. doi: 10.1126/science.aac4255.
PubMed Abstract|CrossRef Full Text|Google ScholarArthur JC, Gharaibeh RZ, Muhlbauer M, Perez-Chanona E, Uronis JM, McCafferty J, et al. Microbial genomic analysis reveals the essential role of inflammation in bacteria-induced colorectal cancer. Nat Commun (2014) 5:4724. doi: 10.1038/ncomms5724
PubMed Abstract|CrossRef Full Text|Google ScholarArthur JC, Perez-Chanona E, Muhlbauer M, Tomkovich S, Uronis JM, Fan T-J, et al. Intestinal inflammation targets cancer-inducing activity of the microbiota. サイエンス (2012) 338:120-3. doi: 10.1126/science.1224820
PubMed Abstract | CrossRef Full Text | Google Scholar腸内細菌科におけるコリバクチンゲノムアイランドの遺伝的構造および分布。このような背景のもと、本学科では、平成21年4月1日から平成22年3月31日までの間に、本学科の学生を対象として、コリバクティンのゲノムアイランドに関する研究会を開催し、その成果を発表しました。
PubMedアブストラクト|クロスリファレンス全文|Google ScholarNougayrede JP, Homburg S, Taieb F, Boury M, Brzuszkiewicz E, Gottschalk G, et al. Escherichia coli induces DNA double-strand breaks in eukaryotic cell. サイエンス(2006)313:848-51.
PubMedアブストラクト|クロスリファレンス全文|Google Scholarヘリコバクター・ピロリCagAはe-カドヘリンと相互作用し、胃上皮細胞の腸管分化を促進するβ-カテニンシグナルを調節する. オンコジーン(2007)26:4617-26. doi: 10.1038/sj.onc.1210251
PubMed Abstract | CrossRef Full Text | Google ScholarQi J, Crinier A, Escaliere B, Ye Y, Wang Z, Zhang T, et al. Single-cell transcriptomic landscape reveals tumor specific innate lymphoid cells associated to colorectal cancer progression. Cell Rep Med (2021) 2:100353. doi: 10.1016/j.xcrm.2021.100353.
PubMed Abstract|CrossRef Full Text|Google ScholarDunay IR, Diefenbach A. トキソプラズマ・ゴンディ感染におけるグループ1自然リンパ系細胞. パラサイト・イミュノール(2018)40(2):e12516. doi: 10.1111/pim.12516.
クロスレフフルテキスト|Google ScholarMunoz M, Liesenfeld O, Heimesaat MM. トキソプラズマ・ゴンディーの免疫学。免疫学(2011)240:269-85. doi: 10.1111/j.1600-065X.2010.00992.x
PubMedアブストラクト|クロスリファレンス全文|Google Scholarインターロイキン(IL)-23は、マトリックスメタロプロテアーゼ-2およびIL-22を介し、IL-17とは独立して、トキソプラズマ・ゴンジイによる腸の免疫病理を仲介する。を介したトキソプラズマ・ゴンディによる免疫病理を媒介するが、IL-17には依存しない。
PubMed Abstract | CrossRef Full Text | Google ScholarMunoz M, Eidenschenk C, Ota N, Wong K, Lohmann U, Kuhl AA, et al. Interleukin-22 induces interleukin-18 expression from epithelial cells during intestinal infection. Immunity (2015) 42:321-31. doi: 10.1016/j.immuni.2015.01.011.
PubMed Abstract|CrossRef Full Text|Google ScholarGazzinelli RT、Kalantari P、Fitzgerald KA、Golenbock DT. マラリア寄生虫のイネイトセンシング。Nat Rev Immunol (2014) 14:744-57. doi: 10.1038/nri3742
PubMed Abstract|CrossRef Full Text|Google ScholarWolf AS, Sherratt S, Riley EM. NK細胞:マラリアに対する不確かな味方。Front Immunol (2017) 8:212. doi: 10.3389/fimmu.2017.00212.
PubMed Abstract|CrossRef Full Text|Google ScholarBesnard AG、Guabiraba R、Niedbala W、Palomo J、Reverchon F、Shaw TN、et al. IL-33による実験的脳マラリアに対する保護は、2型自然リンパ系細胞、M2マクロファージおよび制御T細胞の誘導に関連しています。PloS Pathog (2015) 11:e1004607. doi: 10.1371/journal.ppat.1004607.
PubMed Abstract|CrossRef Full Text|Google ScholarCertad G、Viscogliosi E、Chabe M、Caccio SM. クリプトスポリジウムとジアルジアの病原性メカニズム。Trends Parasitol (2017) 33:561-76. doi: 10.1016/j.pt.2017.02.006.
PubMed Abstract|CrossRef Full Text|Google ScholarDann SM, Wang HC, Gambarin KJ, Actor JK, Robinson P, Lewis DE, et al. Interleukin-15 activates human natural killer cells to clear the intestinal protozoan cryptosporidium. そのため、このような事態が発生する可能性がある。
PubMed Abstract | CrossRef Full Text | Google ScholarLillehoj HS, Trout JM. 鳥類の腸管関連リンパ組織とエイメリア寄生虫に対する腸管免疫応答。臨床微生物学(1996)9:349-60.doi: 10.1128/CMR.9.3.349
PubMed Abstract | CrossRef Full Text | Google ScholarEimeria tenella: Interleukin 17は実験的感染時の腸管における宿主免疫病理に寄与している。(2013年) 133:121-30. doi: 10.1016/j.exppara.2012.11.009.
PubMed Abstract|CrossRef Full Text|Google ScholarIL-22は、IFN-γの非存在下で、Th17駆動の免疫病理を犠牲にして、腸内細胞性寄生虫に対する宿主防御を仲介する。J Immunol (2012) 188:2410-8. doi: 10.4049/jimmunol.1102062.
PubMed Abstract | CrossRef Full Text | Google Scholar
キーワード:腸内細菌叢、自然リンパ球、ラミナプロプリア、疾患、腸管粘膜免疫
引用元 Guo Y, Liu Y, Rui B, Lei Z, Ning X, Liu Y and Li M (2023) Crosstalk between the gut microbiota and innate lymphoid cells in intestinal mucosal immune. Front. Immunol. 14:1171680. doi: 10.3389/fimmu.2023.1171680
Received: 22 February 2023; Accepted: 2023年5月02日;
発行:2023年5月25日。
編集者
Anuradha Rajamanickam, International Centers for Excellence in Research (ICER), インド
査読者:ブレンダン・ラス(モナシュ大学
Brendan Russ, モナシュ大学, オーストラリア
Sweta Ghosh, ルイビル大学, 米国
Copyright © 2023 Guo, Liu, Rui, Lei, Ning, Liu and Li. これは、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス記事です。他のフォーラムでの使用、配布、複製は、原著者および著作権者のクレジットを記載し、本誌の原著を引用することを条件に、学術的に認められた慣例に従って許可されます。本規約を遵守しない使用、配布、複製は許可されません。
*Correspondence: Yinhui Liu, yhliu_dl@163.com; Ming Li, vivianmarat@163.com
免責事項:本記事で表明されたすべての主張は、あくまでも著者のものであり、必ずしも所属団体や出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはその製造元が主張する可能性のある主張は、出版社によって保証または承認されるものではありません。
こんな人たちも見ています
無細胞のISG15を発現するMVAベースのベクターはIFN-Iの産生を増加させ、HIV-1特異的CD8 T細胞免疫応答を改善させる
スサナ・ゲラ、ミケーラ・ファルキ、ベアトリス・ペルディゲーロ、ロシオ・コロマ、マヌエル・アルバート、ラウラ・マルコス、ジョセフ・パトリック・マクグレイル、カルロス・オスカー・ソルサノ・サンチェス、マリアノ・エステバン、カルメン・エレーナ・ゴメス
論説 ウイルス免疫学と免疫療法におけるNK細胞
Sachin Mulik、Pranay Dogra、Nabila Jabrane-Ferrat
腫瘍免疫と自然免疫におけるエリアニンの役割と免疫療法におけるその展望
Zhen Yang, Ruxue Liu, Minghan Qiu, Hanwei Mei, Jie Hao, Teng Song, Ke Zhao, Dandan Zou, Huaqing Wang および Ming Gao
微生物-腸-脳軸におけるToll様受容体のパーキンソン病への影響
張子怡、劉志慧、呂蒼、范晨慧
フッター
ガイドライン
探検する
アウトリーチ
接続する
フォローする
© 2023 Frontiers Media S.A. All rights reserved.
プライバシーポリシー|利用規約
この記事が気に入ったらサポートをしてみませんか?
