生育成績とルーメン微生物叢の多様性は飼料の種類によって異なる
166
総閲覧数
記事のaltmetricスコアは1です
ORIGINAL RESEARCH(オリジナル研究)論文
Front. Sustain. Food Syst.、2022年11月24日
Sec.アグロエコロジーと生態系サービス
https://doi.org/10.3389/fsufs.2022.1004373
生育成績とルーメン微生物叢の多様性は飼料の種類によって異なる
Shuai Du1*、Zhenkun Bu2、Sihan You3、Jian Bao3、およびYushan Jia3*
1農業農村部生物飼料安全汚染防止国家工程実験室,分子栄養学重点実験室,浙江省動物栄養飼料科学重点実験室,教育部飼料科学研究所,浙江大学,杭州,中国
2中国農業科学院深圳農業ゲノム研究所嶺南現代農業広東研究所深圳分室
3農業部飼料栽培・加工・効率高利用重点実験室、教育部草地資源重点実験室、内蒙古農業大学草地・資源・環境学院、中国・フフホト市
食事は子羊の成長成績と微生物群集に影響を与える主要な要因である。本研究では、多様な飼料が子羊の成長成績とルーメン微生物叢にどのような影響を与えるかを調べることを目的とした。90頭の雄の子羊を、完全無作為化計画において、対照飼料としてペレット化されていない原生牧草乾草(HA)、実験飼料としてペレット化した原生牧草乾草(GP)およびペレット化し濃厚飼料を加えたもの(GPC)の3群に等配置した。HA、GP、GPC群の子羊のルーメン液サンプルを用いて、16S rDNAハイスループットシーケンスによるルーメン微生物相の多様性を調査した。本研究では、最終体重、乾物摂取量、1日平均増体量は、HA群、GP群、GPC群で有意に異なった(p<0.05)。HA群に比べ、GP群では最終体重、乾物摂取量および1日平均増体量が高いことが確認された。同様に、GPC群ではGP群よりも優れた動物成績が観察された。主座標分析により、3群のルーメン微生物叢の組成は、互いに明確に分離していることが示された。HA群とGP群ではBacteroidetesとFirmicutesが、GPC群ではBacteroidetes、Firmicutes、Proteobacteriaが優勢な群集メンバーであった。これらの群間の比較では、Rikenellaceae_RC9_gut_group, Prevotella_1, Ruminococcaceae_NK4A214_group, Succiniclasticumで有意な差(p < 0.05)が見られた。これらの結果は、GP および GPC 飼料が HA 飼料よりも成長成績に有益であることを示唆しており、また、ルーメン微生物叢が異なる飼料の種類に反応して変化することを示 唆している。結論として、これらの結果は、モンゴル高原におけるより良い成長とより健全な生態系のためにルーメン微生物叢に影響を与える戦略を提供し、ペレット状の原生牧草飼料を与えるための理論的基礎を築くことが可能である。
はじめに
中国のモンゴル高原に生息するウジムキンヒツジは、何千年もの間、そのユニークな環境と自然条件によって選ばれてきた。この動物は、中国における粗毛羊の重要な品種である。多くの解剖学的および生理学的形質により、ウジムキン羊は厳しい生活条件の中で消費者に十分な羊毛と肉を生産することができます(Zeng et al.、2017)。
他の反芻動物と同様に、子羊のルーメン微生物叢は、細菌、原生動物、古細菌、真菌からなり(Guo et al., 2020; Mizrahi et al., 2021)、微生物が炭水化物、リグノセルロースなどを効率的に生物変換して、タンパク質、ビタミン、短鎖有機酸を動物に供給している(Xing et al., 2020; Bhujbal et al., 2022)。このマイクロバイオームのうち、細菌は反芻動物の生存に不可欠であり、消化への貢献度が最も高い(Kimら、2015)。これまでに発表された研究では、動物のパフォーマンスとルーメン微生物叢の健康、組成、代謝は、動物の年齢、飼料の種類、給餌システムに強く影響されることが明らかにされています(Zenedら、2013年、Trabiら、2019年)。
伝統的に、ウジムーチンの子羊は、夏と秋に在来の草地で放牧すると強く太り、冬と春に干し草だけを食べると痩せて弱くなる(死に至ることさえある)(Du et al.、2020年)。羊の生産システムにおいて乾物摂取量(DMI)と平均日増体量(ADG)を増加させることにより、ペレット、混合飼料、濃厚飼料による補助飼料が一般的になってきた。しかし、全混合比率は通常、動物の選択によって妥協され(Sarkerら、2019)、その結果、労働コストが高くなる(Trabiら、2019)。その結果、これらの給餌システムは飼料の無駄を減らし、管理を容易にすることができるため、濃厚飼料を用いたペレットまたはサプリメントが広く適用されている(Masoudzadehら、2020年)。これまでの報告では、ペレット飼料はルーメン内の細菌濃度を低下させる可能性があることがわかったが(McClements and Xiao, 2012)、ペレット-ヘイ飼料は細菌濃度がより高くなることがわかったものもあった(Ishaq et al, 2019)。
さらに、高濃度飼料がルーメン微生物叢の構成に影響を与える可能性を示した研究もあり(Plaizierら、2012)、高収量飼料はFirmicutes属の微生物など、一部の微生物に有益である(Khafipourら、2009)。また、これまでの報告では、子羊の成長成績、枝肉形質、肉質がモンゴル高原の在来草食飼料に大きく影響されることが分かっている(Duら、2019、2022;Buら、2021)。しかし、濃厚飼料やペレットを用いない、あるいは用いた非ペレット化した在来牧草がルーミーナル微生物叢に及ぼす影響に関する関連研究はまだ限られている。
そこで本研究では、濃厚飼料やペレットを用いない、あるいは用いた非ペレット化天然草乾草が、子羊のルーメン微生物叢および成長成績に直接影響を及ぼす可能性があると仮定した。本研究では、濃厚飼料やペレット飼料を用いない、あるいは用いた場合の子羊のルーメン微生物叢および成長成 績を明らかにすることを目的とした。
材料および方法
倫理的記述
この動物実験は、中国・内モンゴル農業大学草地・資源・環境学部の承認を得た。すべての実験は「実験動物に関する事務管理規則」に従って行われた。
動物および飼料
給餌実験は、2020 年 8 月から 11 月にかけて、中国西林暑の Lvye 草原畜産開発有限公司で実施した。実験期間は75日間で、飼料と環境の適応期間は15日間、サンプル採取のデータは60日間であった。原料の影響を最小限にするため、典型的な草原にある同じ草原から干し草を選びました。この草地では Stipa gigantea L., Leymus chinensis (Trin.) Tzvel. が優占種であり,Lespedeza davurica (Laxm.) Schindl, Allium mongolicum Regel, Thalictrum petaloideum Linn, Bupleurum chinensis DC., Serratula centauroides Linn, Caragana microphylla Lam 等も含まれている.この実験では、体重(BW)26.83 ± 0.26 kgの6ヶ月齢の雄のウジムキン子羊を合計90頭選び出した。すべての子羊は、完全無作為化計画において、朝の給餌前の類似したBWに基づいて、18ユニット(1ユニットあたり5頭)に無作為に割り当てられた。次に、この18ユニットを3つの処理区に無作為に割り当て、1処理区あたり6ユニットとした。実験では3種類の飼料を使用した(表1)。子羊には、対照飼料としてペレット化されていない在来草本草(HA)、実験飼料としてペレット化した在来草本草(GP)およびペレット化した在来草本草に濃縮飼料(GPC)を与えた。ペレットは、長さ 2~3cm の牧草乾草からペレット機 (H.S. 508 Pellets Mill; Liyang Weifang Equipment Co Ltd., Liyang, China) で製造した。濃厚飼料は地元企業(瑞源農畜産有限公司、中国・錫林浩特)から購入した。濃厚飼料は、トウモロコシ、大豆粕、可溶分を含むジスチラーズ・ドライ・グレイン、小麦ふすまをそれぞれ25、8、4、3%で構成した。自発的な摂取量を評価するために,飼料は予想摂取量の110%で提供した.飼料、給餌、管理、化学組成の分析は、既報の研究(Buら、2021)に従った。
表1
www.frontiersin.org
表1. 実験用飼料の成分および化学組成。
飼料摂取量、成長成績、ルーメンサンプル採取
自発的な飼料摂取量を計算するために、実験では毎日、提供した飼料の量と残留物を記録し、乾物(DM)基準で表した。すべての子羊の体重は、朝の給餌前に空腹で、実験期間中は絶食させずに測定した(06:00-07:00 h)。7日ごとに、初期体重と最終体重を記録した。成長性能は、最終BWと初期BWの差に基づいて分析した(Duら、2022)。実験終了後、すべての子羊を移送し、商業屠殺場(中国・西林辣)で屠殺した。すべての子羊からルーメンサンプルを採取し、同じペンの各子羊のルーメン内容物サンプルをまずホモジナイズし、次に、局所的な影響を減らすために同量のルーメン内容物を混合し、4層のチーズクロスで濾した。最後に、滅菌したポリプロピレン遠心管に、〜40mlのルーメン液を採取した。したがって、合計18個のルーメン液サンプルを直ちに液体窒素で凍結し、その後、さらなる分析のために-80℃で保存した(Wang et al.、2019)。
DNA 抽出
E.Z.N.A. ®Stool DNAKit (D4015, Omega, Inc., USA) を用いて、メーカーの説明書に従ってルーメンサンプルのDNAを抽出した。抽出した DNA の濃度と純度の測定には NanoDrop 2000 UV-vis Spectrophotometer (Thermo Scientific, Wilmington, USA) を、抽出した DNA の品質評価には 1% アガロースゲル電気泳動法を用いた (Bai et al., 2020)。
PCR増幅と16S rDNAの塩基配列決定
ポリメラーゼ連鎖反応(PCR)増幅およびバイオインフォマティクス解析は、LC-Bio Technology Co. (Hang Zhou, China)で行った。細菌16S rDNA遺伝子の可変領域V3〜V4は、プライマー341F(5′-CCTACGGNGGCWGCAG-3′)および805R(5′-GACTACHVGGTATCTAATCC-3′)(Logueら、2016)を若干改変したものにより増幅された。16S増幅は、以前の報告(Tanja and Salzberg, 2011)の記述に準じて行った。配列はBioProject accession number PRJNA825331でSequence Read Archive (SRA)に寄託されている。
バイオインフォマティクス解析
ペアエンドリードは、ユニークなバーコードに基づいてサンプルに割り当てられ、バーコードとプライマー配列を切り取ることによって切り詰められ、FLASH (v1.2.8) (Tanja and Salzberg, 2011)でマージされた。類似度97%カットオフ(Liu et al., 2019)の操作的分類単位(OTU)をUPARSE(version 7.1, http://drive5.com/uparse/) でクラスタリングし、類似度97%以上の高品質配列を同一の操作的分類単位(OTU)に割り当てた(Rognes et al., 2016)。OTUの分類はSILVAデータベース(https://www.arbsilva.de/)を用い、信頼度閾値70%で行った。偽発見率(FDR)調整済みのクラスカル・ワリス多重比較(p<0.05)を用いて細菌群集構造を検出し、門と属のレベルで分析した(Omontese et al.、2022)。R(バージョン2.5.4)を用いて、並べ替え多変量分散分析(PERMANOVA)検定で有意差を検定した(Chambers and Hastie, 1992)。主座標分析(PCoA)は、重み付きUniFrac距離に基づいてR(バージョン3.3.1)ソフトウェアによってOTUレベルで行われ、楕円はフィッティングの信頼度を表している。共通OTUとユニークOTUは、R(バージョン1.6.2)によりベン図を作成した。これらのサンプルのα多様性は、Chao1値とShannon indexを用いて豊かさと多様性を評価し(Muwonge et al, 2021)、QIIMEソフトウェアによりGoodのカバー率を算出した。主な差異量属は、効果量と連動した線形識別分析(LEFSe)法(Segata et al.、2011)により分析した。16S rRNA データをもとに代謝系遺伝子を予測するために PICRUSt を適用した。また、代謝経路への遺伝子の割り当てには、Kyoto Encyclopedia of Genes and Genomes (KEGG) データベースを使用した (Su et al., 2021)。Rのヒートマップパッケージ(R Core Team, 2014)を適用して、属とレベル3予測される微生物遺伝子の機能のヒートマップを作成した。棒グラフはGraphPad Prism 7 (San Diego, CA, United States)で作成した。
統計解析
ADI および DMI データは、実験単位として用いた単位ごとの完全無作為化計画として、SAS ソフトウェア(バージョン 9.0)(SAS Inst., Inc.、Cary, NC)を用いて解析した。データは、SASのPROC UNIVARIATE手続き(SAS Inst., Inc.、Cary、NC)を用いて正規性を確認した。ADIおよびDMIデータは、研究を通じて収集した測定値から算出し、SASのPROC MIXED手順(SAS Inst., Inc.) 処理間の有意差は、統計モデル、Y=μ+α+ε、ここでY=観察、μ=全体平均、α=食事効果、ε=誤差、およびダンカン検定に従って一元配置分散分析を用い、p<0.05を統計的有意性とし、SAS ver. 9.0.
結果
飼料の分析
本研究で使用した飼料の化学組成を表 1 に示す。HA群、GP群およびGPC群のDM含量はそれぞれ93.90、91.30および92.94%であった。3 群の有機物およびエーテル抽出物は同程度であったが,GPC 群の粗タンパク質および代謝エネルギーは HA および GP 群より高く,酸性デタージェント繊維および中性デタージェント繊維含量は HA および GP 群より低 かった.また、飼料中の脂肪酸の含有量および組成は様々であった。
動物成績
異なる飼料を給与した子羊の摂取量および成長成績の結果を表2に示す。子羊の成長成績に及ぼす飼料の種類の影響を検討した結果、飼料の種類はDMIおよびADGに有意に影響し得ることが明らかになった。予想通り、初期 BW については HA 群、GP 群、GPC 群の間で有意差は認められなかった(p > 0.05)。最終的なBW、DMIおよびADGは、HA、GPおよびGPC群で有意に異なった(p<0.05)。HA 群および GP 群の最終的な BW(30.00 および 31.75 kg)、DMI(1.53 および 1.58 kg)および ADG(52.08 および 81.25 g/d) と比較して、GPC 群の最終 BW(34.13 kg),DMI(1.67 kg)および ADG(122.92 g/d) は最も高い値を示していた。
表2
www.frontiersin.org
表2. 子羊に自生草の乾草をペレット化せず、濃厚飼料またはペレットを添加して給与した場合の摂取量および成長成績。
ルーメン微生物相の多様性分析
HA 群、GP 群、GPC 群の子羊から採取した合計 18 個のルーメン液サンプルを用いて、16S rDNA 配列決定によるルーメン微生物叢の多様性の評価を行った。本研究では、HA、GP、GPC群間のルーメン細菌多様性の差異を解析し、αおよびβ多様性も算出した。18 個のルーメンサンプルについて、合計 1,520,890 個の raw read が得られ、各ルーメンサンプルの平均配列数は 84,494 であった。全体で 1,347,069 個の有効リードが得られ、各ルーメンサンプルの平均配列数は 74,837 、配列決定深度は 20,000 であった (Table 1).希釈曲線がプラトーになる傾向のあるサンプリング深度によると、すべてのサンプルは、97%以上の類似性が確認されたOTU番号1,338 (HA group), 1,134 (GP group), 1,020 (GPC group) に希釈されており (Table 3) 、3グループ間でOTU番号に関する統計的有意差 (p > 0.05) は観察されていない。同様に、Good's coverage indexはすべてのルーメンサンプルで99%以上であり、配列決定深度が各ルーメン細菌群集を表現するのに十分であることが示された。3つのグループ間で有意な(p > 0.05)差は観察されなかった。しかし、シャノン指数には有意な差が認められ、HA群では種の豊富さが高く、GP群およびGPC群では種の豊富さが低いことが示された(表3)。
表3
www.frontiersin.org
表3. 濃厚飼料やペレットを与えず、また与えた子羊のラムナーマイクロバイオームの多様性指標。
ラムナルマイクロバイオータの系統解析
飼料の種類がOTU分析に及ぼす影響を図1に示す。Venn Diagramでは、3つのグループに共通するOTUとユニークなOTUが示された。また、主座標分析(PCoA)プロファイルは、グループ内のルーメン微生物叢の構造が互いに明確に分かれていることを表示した(Figure 2)。HA群、GP群、GPC群の試料は共にクラスター化し、3群間の相互作用は認められなかった。

図1
www.frontiersin.org
図1. 各食餌で見つかった共通および固有のOTUを表すベン図 (n = 6)。HA、ペレット化されていないネイティブグラス干草飼料、GP、ペレット化されたネイティブグラス干草飼料、GPC、ペレット化されたネイティブグラス干草に濃厚飼料を加えた飼料。

図 2
www.frontiersin.org
図2. UniFrac 距離に基づくルーメン微生物群集の主座標分析 (PCoA) (n = 6)。HA、ペレット状在来草本草乾草飼料、GP、ペレット状在来草本草乾草飼料、GPC、ペレット状在来草本草乾草と濃厚飼料の混合飼料。

図 3 に、飼料の種類が分類群および属レベルの相対現存量に与える影響を示す。リードの分類学的解析により、26門に属する425属に分類された。門レベルでは7つの門が検出された細菌門と呼ばれた。HA群とGP群ではBacteroidetesとFirmicutesが、GPC群ではBacteroidetes、Firmicutes、Proteobacteriaが優占していた(図3A)。また、FirmicutesとProteobacteriaの存在比は3つのグループ間で有意な差があった(Figure 3B)。
図3
www.frontiersin.org
図3. 濃厚飼料またはペレットを与えず、または与えた子羊のルーミナルマイクロバイオームの細菌門の相対存在度(%)(少なくとも1つのグループで1%)。(A) 門レベル。(B) HA群、GP群、GPC群の間で有意差のあった門脈レベルの細菌を示す拡張エラーバープロット。(C)属のレベル。(D)HA、GP、GPCグループ間で有意差のあった属レベルの細菌を示す拡張エラーバー・プロット。HA、ペレット化されていない牧草飼料、GP、ペレット化された牧草飼料、GPC、ペレット化された牧草飼料と濃厚飼料。
属レベルでは,HA群ではRikenellaceae_RC9_gut_group, Prevotella_1, F082_unclassified, WCHB1-41_unclassified, GP群ではRikenellaceae_RC9_gut_group, Prevotella_1, F082_unclassified, Succinivibrio, Succinivbrionaceae_UCG-002 が最も多く含まれる.GPC群では、Rikenellaceae_RC9_gut_group、Prevotella_1、F082_unclassified、Muribaculaceae_unclassifiedが主要な属であった(図3C)。また、Rikenellaceae_RC9_gut_group、Prevotella_1、Ruminococcaceae_NK4A214_group、Succiniclasticumでは3群間で有意(p<0.05)な差が観察された(図3D)。
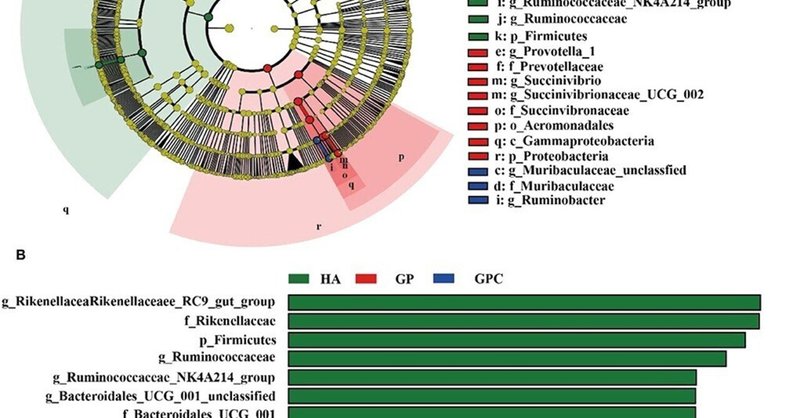
線形判別分析(LDA)効果量(LEFSe)の結果、3種類の飼料を与えた子羊のルーメン微生物相の間で、有意に異なる分類群が認められた(図4)。HA群ではRikenellaceae_RC9_gut_groupとRuminococcaceae属が、GP群の微生物叢ではSuccinivibrio、Succinivibrionaceae_UCG-002、Prevotella_1が濃縮されていた。一方、GPC群の微生物叢はRuminobacterとMuribaculaceae_unclassifiedに富んでいた。

図4
www.frontiersin.org
図4. HA、GP、GPC 群(n = 6)の子羊のルーメン微生物群集の線形識別分析(LDA)と効果量(LEFSe)連動分析。(A) 3つの処理間で有意差のある微生物種を示すクラドグラム。赤、緑、青はそれぞれ異なるグループを表す。内層から外層に向かって、門、綱、目、科、属レベルの種分類が表示されている。赤、緑、青のノードは、それぞれHA群、GP群、GPC群で重要な役割を果たす系統樹の微生物種を表している。黄色のノードは、種間で有意な差がないことを表す。(B)LDAスコアが推定値(デフォルトスコア=4)よりも大きい有意差のある生物種。ヒストグラムの長さは、3つのグループにおける異なる種のLDAスコアを表している。HA、ペレット化されていない在来種乾草飼料、GP、ペレット化された在来種乾草飼料、GPC、濃縮飼料を含むペレット化された在来種乾草飼料。
ルーメン微生物叢の予測される代謝機能
ルーメン細菌群の予測機能遺伝子は、PICRUSTS に依存した Kyoto Encyclopedia of Genes and Genomes (KEGG) パスウェイデータベースを用いて予測した。3つのグループのレベル1で予測された主な機能遺伝子は、それぞれ代謝(55.72-56.61%)、遺伝情報処理(26.59-26.79%)、環境情報処理(11.05-11.60%)に割り当てられ(図5A)、異なるパスウェイを示していた(図5B)。特に、アミノ酸代謝、糖質代謝、エネルギー代謝、ヌクレオチド代謝は、3種類の飼料を与えた子羊の濃縮パスウェイの5%より高い値を示していた。さらに、アミノ酸代謝、エネルギー代謝、テルペノイドとポリケチドの代謝に関連する配列は、HAグループで有意に(p < 0.05)濃縮され、フォールディング、ソーティング、分解、細胞プロセスとシグナル伝達は、GPグループで統計的に(p < 0.05)濃縮されていることが示された。さらに、HAとGPグループは遺伝情報処理に著しく富んでいた(p < 0.05)。細菌の機能を予測する微生物遺伝子のレベル3では、3つのグループでいくつかの違いが観察された(図5C)。アミノ酸代謝(アミノ酸関連酵素、アラニン、アスパラギン酸、グルタミン酸代謝、アルギニン、プロリン代謝、フェニルアラニン、チロシン、トリプトファン生合成)、解糖・糖新生、ピルビン酸代謝、アミノ糖・核酸糖代謝)関連の大半の遺伝子量がHAグループで劇的に増加した(p < 0.05).同様に、リボソーム生合成、転写装置、シャペロン、折り畳み触媒などの翻訳、転写、複製と修復、折り畳み、選別、分解に関連する遺伝子は、GPグループで顕著に(p < 0.05)濃縮されていた。興味深いことに、アミノ酸代謝、ヌクレオチド代謝、エネルギー代謝に割り当てられたほとんどの遺伝子の存在量は、GPCグループで減少していた。

図5
www.frontiersin.org
図5. PICRUSt を用いて解析した、異なる飼料を摂取したルーメン細菌予測機能プロファイルのダイナミクス(n = 6)。(A) レベル 1 の代謝経路。(B) レベル2のKyoto Encyclopedia of Genes and Genomes (KEGG) オーソログ機能予測で、上位20の代謝機能の相対的存在度。(C) レベル3のKEGGオーソログによる上位30代謝機能の相対的存在量の機能予測。HA:ペレット化されていないネイティブグラス乾草飼料、GP:ペレット化されたネイティブグラス乾草飼料、GPC:ペレット化されたネイティブグラス乾草と濃厚飼料の混合飼料。
考察
本研究では、HA群と比較して、GP群では最終BWおよびADGが統計的に増加し、これは、粉砕およびペレット化工程が直接的に飼料粒径を小さくし、摂取量を増加させることができるとしたDuら(2019)およびTrabiら(2019)の研究とも一致している。牧草とペレットの物理的特性(鮮度、風味、色、質感)と形状の違いが、摂取量増加の理由と考えられる(Prachumchaiら、2021, 2022)。そのため,GP 群では最終的な BW と ADG が高いことが確認された.さらに、ADGはGP群と比較してGPC群で増加したが、これはGP飼料を給与した子羊と比較してGPC群のDMIとエネルギー摂取量が高いことで説明できる(Trabi et al.)
飼料は、ルーメン微生物叢の組成に支配的な影響を及ぼす(Zhou et al.、2010;Chen et al.、2011)。本研究では、HA群と比較して、GP群およびGPC群でOTU数、種の豊かさ推定値(Chao1値)、およびシャノン指数が減少し、これは高濃縮飼料またはペレット飼料を用いたルーメンにおける様々な研究(Maoら, 2013; Huoら, 2014; Trabiら, 2019)と一致するものであった。これらの結果は、細菌群の多様性と豊かさが、飼料の種類によって影響を受け得ることを示した。また、これまでの報告では、微生物群集の減少は、飼料割合やペレットの減少と関連していることが分かっており(Hookら、2011;Hendersonら、2015)、これは、細菌の増殖速度に直接影響を与えるDMIの増加とエネルギー摂取量の増加によって説明できる(Dagaewら、2020;Prachumchaiら、2022)と考えられています。ベータ多様性に対する食餌の影響に対処するため、すべてのルーメンサンプルにわたる非加重UniFrac距離に基づいて、ルーメン細菌群集を特徴付けた。3 群間の細菌群集の変化を表示するために、PCoA 図を使用した。マクロ的に、異なる飼料は、3群間の細菌群に区別できる分離をもたらし、これは、ペレット飼料、濃厚飼料、および飼料飼料間で微生物構造の顕著な分離が観察され(Zhangら、2017;Trabiら、2019;Lin L. ら、2021)、種々の飼料は、主因と考えられる多様なpH環境を駆動した(Logueら、2016)、という先行報告と一致する。
多様性の変化は、系統的な修正と緊密に相関していた(Amin et al.、2021)。本研究では、FirmicutesおよびBacteroidetesという門が優勢な門として検出されたが、これは、同じくFibrobacter succinogenes、Ruminococcus flavefaciens、およびRuminococcus albusなどのセルロース分解者を含む羊のルーメン微生物相として特定した既報の研究に倣ったものである(Henderson et al, 2015; Zhang et al., 2019; Mizrahi et al., 2021)。一方、これらの菌門には、3つのグループ間でいくつかの違いが見られた。炭水化物とタンパク質の分解に関連する優勢な細菌門であるBacteroidetesは、すべてのグループで観察され、この門の最も高い相対量がHAグループで検出され、これはBacteroidetesが羊ルーメンマイクロバイオームにおける優勢な門であるとしたLopesら(2015)の研究とも一致する。ペレット化プロセスまたは高濃度飼料が、Bacteroidetesの相対的存在量の減少につながる主な理由である可能性がある(Trabiら、2019;Chaoら、2020)。ファーミキューテスは、繊維とセルロースの分解において重要な役割を果たし、多糖類の組成とエネルギーの利用に関連している(Singhら、2012年;Crisol-Martínezら、2017年)。ペレットを与えるとFirmicutesの存在量が低下する可能性があるという過去の報告に従い、GP群ではFirmicutesの存在量が低下した(Trabi et al.)
GPC群ではFirmicutesの存在量が多く検出されたが,これは濃厚飼料比率の上昇に伴い存在量が増加することを示した以前の報告と同様である(Lourenco et al.,2020)。興味深いことに、Proteobacteriaは炎症進行のバイオマーカーであり、疾患の進行を促進することが知られている(Larsen et al.) HA群と比較してGP群およびGPC群でProteobacteriaの相対量が高いことが確認されたが、これはHA群がルーミン発酵速度を高め、ルーミンpHを低下させ、Proteobacteriaの増殖を抑制することに起因すると考えられる(Larsen et al.2015; Shin et al.2015)。さらに、水素添加は菌体構造による脂肪酸組成にも影響を与え、ルーメン微生物相は多様であった(Harfoot, 1978; Martin et al.、2016)。
本研究では、属レベルで分類群の変化も解析した。属レベルでは、ヘミセルロースや構造性糖質の分解効率が高いPrevotella_1、Rikenellaceae_RC9_gut_group、F082_unclassfied、Succinivibrioが最も多く存在した(Zenedら、2013;Morais and Mizrahi、2019;Liら、2021;Mizrahiら、2021)。属レベルでは、Rikenellaceae_RC9_gu_groupが最も豊富な細菌群であった。飼料給与系の子羊でRikenellaceae_RC9_gut_groupが多いというEbeidらの研究(Ebeidら、2020)に続き、GP群、GPC群で有意に減少していた。Wangら(2016)は、ルーミナルマイクロフローラの違いは、おそらく物理的な影響に由来すると報告している。Prevotella属のメンバーは、利用可能な繊維を消化することを可能にし得るより広い繊維関連酵素レパートリーのため、繊維のヘミセルロース部分のコロニー形成および分解における支配種として特に研究されてきた(Jamiら、2013;Piaoら、2014;Huwsら、2016)。Prevotella_1 属は、子羊のルーメンで最も豊富な細菌属であり、これは Vibart ら(2019)および Zhang ら(2019)により報告された。GPおよびGPC群でPrevotella_1の存在量が増加したが、これは、飼料割合に対する感受性(Liら、2015;Soldenら、2016;Bainbridgeら、2018)、ならびに適切なルーメン発酵を効果的に確保しない繊維含有量の不足(Kleefischら、2017)に起因している可能性があった。以前に発表された研究では、C16:0とC18:0がPrevotella属とButyrivibrio属に影響を与えることがわかりました(Maczulak et al.、1981)。本研究では、C16:0 と C18:0 の含有量が Prevotella 属の存在量を増加させる可能性があり (Maczulak et al., 1981)、GP 群では HA 群に比べて C16:0 と C18:0 の含有量が高いことも確認された。しかし、HA群に比べ、GPC群では摂取量が著しく多いため、C16:0とC18:0の摂取量が増加した。そのため、Prevotella_1 の存在量は GP および GPC 群で増加した。また、Bacteroidetes unclassified family F082は、HA群に比べ、GP群およびGPC群で減少した。これらの結果から、本属および未分類のファミリー内では、宿主および飼料の種類に大きな生態学的多様性が存在することが示唆された。しかし、Bacteroidetes未分類のファミリーF082のルーメンでの役割はまだ不明であり(Chiariotti et al., 2020)、今後の研究で明らかにされるであろう。そのほか、短鎖脂肪酸産生菌であるSuccinivibrioの存在量がGP群で有意に増加していることを発見し(Louis and Flint, 2009; Ticinesi et al., 2017)、これはペレット加工時に使用したデンプン顆粒によりルーメン内での滞在時間が長くなったためであろう(Lin T. et al., 2021)。Succiniclasticum属は、反芻動物におけるグルコースの重要な前駆体であるプロピオン酸の生産に主に参加している(Van Gylswyk, 1995; Liu et al.、2019年)。本研究では、Succiniclasticum_UCG-002はGP群で有意に増加しており、ペレット飼料でSucciniclasticumが増加したという過去の報告と一致する。ペレット化に寄与している(Trabi et al.,2019)。実際、飼料の基質の違いは、ルーメン微生物叢の増殖に影響を与える(Maslowski and Mackay, 2011; Li et al., 2012; Kasparovska et al., 2016)。これまでの報告では、Prevotella_1、Rikenellaceae_RC9_gut_group、F082_unclassfied、Succinivibrioがコア微生物群の属であることがわかった(Du et al.、2022;Zhou et al.、2022)。本研究では、これらの属は物理的形態と化学組成の影響を受け、一方、最も豊富な細菌の安定性は属-コアマイクロバイオームの存在を反映することができる(Hendersonら、2015; Lin T.ら、2021)。ルーメンの微生物生態系は、反芻動物が必要とするエネルギーの〜70%を提供することができ、ルーメンのマイクロバイオームは、宿主の飼料効率および動物成績に関連している(Andersonら、2017;BickhartおよびWeimer、2018;RosenbergおよびZilber-Rosenberg、2018)。しかし、先行研究では、子羊の優占属と動物成績の間に有意な正または負の相関は認められなかった(Duら、2022年)。
遺伝子レベル1~3でのKEGG解析の結果は一貫していた。GP群およびGPC群と比較して、アミノ酸および炭水化物代謝遺伝子の存在量が減少しており、これはセルロース代謝に寄与し、ヘミセルロースは細菌の増殖に有益な多くの化合物を提供し得る(Toledoら、2017;Suら、2021)。また、アミノ酸代謝は、細菌にエネルギー源と炭素源を提供する(Sanchez et al.) これらの結果から、大きな炭水化物とタンパク質の分解により、HA群では微生物相が利用できるアミノ酸の量が増加したことが明らかになりました。HA群では食物繊維の存在量が多いことが主な理由と考えられる。折りたたみ、選別、分解、細胞プロセスおよびシグナル伝達の遺伝子量はGP群で増加したが、これは高収量食の細胞プロセスおよび遺伝情報処理に集中する先行研究(Lin L. et al, 2021)を踏襲したものである。これらの予測された代謝機能は、化合物生成や細胞プロセスに関連しており、酵素合成が示唆されました。GP群では細胞代謝と遺伝情報処理に関連する活性が高いことが、より高いDMIに寄与していると考えられ、高収量飼料は主に成長のための基本的な生存能力の維持に専念する(Lamendellaら、2011;Lin L. ら、2021年)。アミノ酸代謝、ヌクレオチド代謝、エネルギー代謝に関連する存在量は、HA群およびGP群と比較してGPC群に検出された。最終BW重量が高く、成長速度が低いことが主な理由と考えられる(Flint et al.、2012;Furman et al.、2020)。また、細菌は異なる種類の代謝経路と相関しており、異なる種類の飼料に対応するために複数の代謝経路が活性化していることが明らかとなった。
結論
本研究では、子羊の成長成績とルーメン細菌叢に及ぼす飼料の種類の影響について検討した。HA 群と比較して、GP および GPC 群は子羊の DMI および ADG を増加させることができ、GPC 群は 3 群の中で最も成績が良く、ルーメン細菌叢の組成および機能を変化させたと結論づけることができる。本研究の限界の一つは、分析のためにルーメン試料を均質化し、子羊の微生物相を反映させたことである。とはいえ、本研究の知見は、給餌タイプに反応するルーメン微生物叢の直接的な視点と基礎知識を提供することができる。さらなる研究において、ルーメン微生物叢が宿主の成長と肉質に貢献できるかどうかを明らかにするために、ルーメン微生物叢と機能の飼料タイプおよび肉質との関係を調査する必要がある。
データの利用可能性に関する記述
本研究で提示したデータセットは、オンラインリポジトリで見ることができる。リポジトリ名とアクセッション番号は以下の通り。https://www.ncbi.nlm.nih.gov/genbank/, PRJNA825331.
倫理に関する声明
本動物実験は、中国内蒙古農業大学草地資源環境学院の承認を得た。すべての実験は、「実験動物に関する事務管理規則」に従って行われた。
著者による貢献
構想、方法論、データキュレーション、執筆-原案作成、執筆-校閲・編集。SD。調査・資料提供:SD: 調査・資料提供:ZB. 執筆-原案作成。執筆-原案作成:SY. 方法論。方法論:JB. プロジェクト管理、資金獲得。プロジェクト管理および資金獲得:YJ. すべての著者はこの原稿を読み、同意している。
資金提供
本研究は,中国国家酪農革新センター重点計画(2021-国家酪農革新センター-1),国家自然科学基金(32260346),内モンゴル自治区教育部プロジェクト(NJZY21238)により資金提供されたものである。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
出版社からのコメント
本論文で述べられたすべての主張は、著者個人のものであり、必ずしも所属団体、出版社、編集者、査読者のものを代表するものではありません。この記事で評価される可能性のある製品,あるいはそのメーカーによる主張は,出版社によって保証または承認されたものではありません.
参考文献
Amin, N., Schwarzkopf, S., Kinoshita, A., Trscher-Muotter, J., Danicke, S., Camarinha-Silva, A., et al (2021). 子牛のルーメンおよび口腔内細菌叢の進化は、年齢と離乳時期に影響される。アニム.Microb. 3, 1-15. doi: 10.1186/s42523-021-00095-3.
PubMed Abstract|CrossRef Full Text|Google Scholar
Anderson, C. L., Sullivan, M. B., and Fernando, S. C. (2017). Dietary energy drives the dynamic response of bovine rumen viral communities(食事エネルギーはウシのルーメンウイルス群の動的応答を駆動する)。マイクロバイオーム5、155.doi: 10.1186/s40168-017-0374-3
PubMed Abstract|CrossRef Full Text|Google Scholar
Bai, J., Xu, D., Xie, D., Wang, M., Li, Z., Guo, X., et al.(2020年)。アルファルファサイレージの発酵、好気的安定性、微生物群集に対する抗菌ペプチド産生バチルス・サブチリスとラクトバチルス・ブチネリの効果。Bioresour. Technol. 315, 123881.
PubMed Abstract|CrossRef Full Text|Google Scholar
Bainbridge, M. L., Saldinger, L. K., Barlow, J. W., Alvez, J. P., Roman, J., Kraft, J., and al. (2018). 牛の乳の生物活性脂肪酸含量を高めるためのツールとしての放牧体制によるルーメン細菌および原生動物の変化。Front. Microbiol. 9, 904-916. doi: 10.3389/fmicb.2018.00904.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Bhujbal, S. K., Ghosh, P., Vijay, V. K., Rathour, R., Kumar, M., Singh, L., et al.(2022年)。リグノセルロース系廃棄物のバイオ燃料および付加価値製品への持続可能なバイオコンバージョンに向けたルーメン微生物群のバイオテクノロジー的可能性。Sci. Total Environ. 814, 152773.
PubMed Abstract|CrossRef Full Text|Google Scholar
Bickhart, D. M., and Weimer, P. J. (2018). シンポジウムレビュー:乳牛の生産性を向上させるために、宿主とルーメン微生物の相互作用を活用することができる。J. Dairy Sci. 101, 7680-7689. doi: 10.3168/jds.2017-13328.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Bu, Z. K., Ge, G. T., Jia, Y. S., and Du, S. (2021). 内モンゴル高原のウジムキン子羊の成長成績と肉質に及ぼす濃厚飼料またはペレット入り干草の効果.Anim. を用いた。
抄録|全文|Google Scholar
Chambers, J. M., and Hastie, T. J. (1992). 統計モデル. Grove, CA: WadsworthおよびBrooks/Cole.
Google Scholar
Chao, R., Xia, C., Pei, C., Huo, W., Liu, Q., Zhang, C., and al. (2020). トウモロコシ茎と濃厚飼料を3種類の割合で配合した飼料を与えたアルパカと羊の微生物群集の比較。J. Anim. Physiol. Anim. Nutr. 1, 26-34. doi: 10.1111/jpn.13442.
PubMed Abstract | CrossRef Full Text | Google Scholar
陳奕迅、ペナー、G.B.、李、M.、大庭、M.、およびグアン、L.L. (2011). 肉牛ルーメンの上皮組織に関連する細菌多様性の高粒粉飼料への移行に伴う変化。Appl. Environ. Microbiol. 77, 5770-5781.
PubMed Abstract|CrossRef Full Text|Google Scholar
Chiariotti, A., Edwards, J. E., Hermes, G. D. A., Catillo, G., Zilio, D. M., Giovanni, S. D., et al.(2020).。アーバスキュラー菌根菌の使用によるトウモロコシ穀物生産の持続可能性の向上は、乳牛(Bos taurus)と水牛(Bubalus bubalis)のルーメンに影響を与えない。Front. Vet. Sci. 7, 556764.
PubMed Abstract|CrossRef Full Text|Google Scholar
Crisol-Martínez, E., Stanley, D., Geier, M. S., Hughes, R. J., and Moore, R. J. (2017). 動物生産における亜鉛バシトラシンおよびアビラマイシンのメカニズムの理解:ニワトリの腸内細菌叢と成長性能の関連性。Appl.Microbiol. Biot. 101, 4547-4559. doi: 10.1007/s00253-017-8193-9
PubMed Abstract|CrossRef Full Text|Google Scholar
Dagaew, G., Cherdthong, A., Wanapat, M., and Chanjula, P. (2020). 新鮮なキャッサバ根と飼料ブロックの硫黄濃度による試験管内ルーメンガス生成速度、青酸濃度、発酵特性。Anim. Prod. Sci. 60, 659-664. doi: 10.1071/AN18784.
クロスレフフルテキスト|Google Scholar
Du, S., You, S. H., Bao, J., Ge, G. T., Jia, Y. S., Cai, Y. M., et al.(2019)。内モンゴル原産の牧草、干し草、ペレットを給与したモンゴル産子羊の成長成績と肉質の評価。Small Ruminant. Res. 181, 34-38. doi: 10.1016/j.smallrumres.2019.10.008.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Du, S., You, S. H., Bao, J., Ge, G. T., Jia, Y. S., Cai, Y. M., et al.(2020年)。内モンゴル高原で在来種の牧草または乾草を濃厚飼料とともに、または濃厚飼料なしで給与したモンゴル子羊の成長成績、枝肉特性、肉質。Can. J. Anim. Sci. 100, 470-478. doi: 10.1139/cjas-2019-0126
クロスレフフルテキスト|Google Scholar
杜, S., 君, S. H., 孫, L., 賈, Y. S., そして周, Y. L. (2022). 仔羊の物理化学的パラメータ、脂肪酸プロファイルおよびルーメン微生物叢に及ぼすペレット化全混合飼料中のアルファルファ干草と在来草干草の置換の効果。Front. Microbiol. 13, 861025.
PubMed Abstract|CrossRef Full Text|Google Scholar
Ebeid, H. M., Hassan, F., Li, M. W., Peng, L. J., Peng, K. P., Liang, X., et al.(2020)。Camelina sativa L. Oil mitigates enteric in vitro methane production, modulates ruminal fermentation, and ruminal bacterial diversity in Buffaloes(カメリアサティバオイルは水牛の腸内メタン生成、ルーミナル発酵、ルーミナル細菌多様性を調節する。Front. Vet. 7, 550. doi: 10.3389/fvets.2020.00550
PubMed Abstract|CrossRef Full Text|Google Scholar
Flint, H. J., Scott, K. P., Duncan, S. H., Louis, P., and Forano, E. (2012). 腸内における複合糖質の微生物分解。Gut Microbes. 3, 289-306.
PubMed Abstract|CrossRef Full Text|Google Scholar
ファーマン、O.、シェンハブ、L.、サッソン、G.、コウコウ、F.、ホニッグ、H.、ジャコビー、S.、その他 (2020). ルーメンのマイクロバイオーム集合ダイナミクスを駆動する食事と年齢の決定論的効果によって制約された確率性。Nat. Commun. 11, 1904. doi: 10.1038/s41467-020-15652-8
PubMed Abstract|CrossRef Full Text|Google Scholar
Guo, W., Zhou, M., Ma, T., Bi, S., Wang, W., Zhang, Y.、他(2020年)。異なる成長段階における家畜放牧ヤクのルーメン微生物叢の調査により、4つの主要微生物群の新規成熟パターンとそれらの動的相互作用が明らかになった。アニム.Microb. 2, 23. doi: 10.1186/s42523-020-00042-8
PubMed Abstract|CrossRef Full Text|Google Scholar
ハーフット、C. G. (1978). ルーメンにおける脂質代謝。Prog. Lipid. 17, 2154.
PubMed Abstract | CrossRef Full Text | Google Scholar
Henderson, G., Cox, F., Ganesh, S., Jonker, A., Young, W., Global, R. C. C., et al.(2015年)。ルーメン微生物群集の構成は食事や宿主によって異なるが、コアマイクロバイオームは広い地理的範囲に存在する。サイエンス・リップ 5, 14567-14581.
PubMed Abstract|CrossRef Full Text|Google Scholar
Hook, S. E., Steele, M. A., Northwood, K. S., Dijkstra, J., France, J., Wright, A. D.、他 (2011). 亜急性ルーメンアシドーシス(SARA)の適応と回復が乳牛のルーメン内細菌の密度と多様性に与える影響。FEMS Microbiol. Ecol. 78, 275-284. doi: 10.1111/j.1574-6941.2011.01154.x
PubMed Abstract|CrossRef Full Text|Google Scholar
Huo, W., Zhu, W., and Mao, S. (2014). 亜急性のルミナルアシドーシスがヤギのルーメン内の液体および固体関連細菌の多様性に与える影響。ワールド.J. Microbiol. Biotechnol. 30, 669-680. doi: 10.1007/s11274-013-1489-8
PubMed Abstract|CrossRef Full Text|Google Scholar
Huws, S. A., Edwards, J. E., Creevey, C. J., Stevens, P. R., Lin, W. C., Girdwood, S. E., and al. (2016). 新鮮なペレニアルライグラスにコロニー形成する代謝活性の高いルーメンバクテリアの時間的動態。FEMS Microbiol. Ecol. 92, 137. doi: 10.1093/femsec/fiv137
PubMed Abstract|CrossRef Full Text|Google Scholar
Ishaq, S. L., Lachman, M. M., Wenner, B. A., Baeza, A., Butler, M., Gates, E., et al.(2019).(英語)。ペレット化ヘイアルファルファ飼料は、ルースヘイアルファルファ飼料よりもヒツジウェザーの体重増加およびルーメン細菌リッチネスを増加させる。PLoS ONE. 14, e0215797. doi: 10.1371/journal.pone.0215797.
PubMed Abstract|CrossRef Full Text|Google Scholar
Jami, E., Israel, A., Kotser, A., and Mizrahi, I. (2013). ウシのルーメン細菌群集の誕生から成熟期までの探索。ISME. J. 7, 1069-1079.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Kasparovska, J., Pecinkova, M., Dadakova, K., Krizova, L., Hadrova, S., Lexa, M., et al.(2016年)。乳牛のルーメン微生物叢に対するイソフラボン強化飼料の効果。PLoS ONE. 11, e0154642. doi: 10.1371/journal.pone.0154642.
PubMed Abstract|CrossRef Full Text|Google Scholar
Khafipour, E., Li, S. C., Plaizier, J. C., and Krause, D. O. (2009). 亜急性ルーメンアシドーシスの 2 つの栄養モデルを用いて決定したルーメン微生物群構成。Appl. Environ. Microb. 75, 7115-7124.
PubMed Abstract | CrossRef Full Text | Google Scholar
Kim, M., Morrison, M., and Yu, Z. (2015). ルーミナルマイクロバイオームの系統的多様性センサスの状況。FEMS Microbiol. Ecol. 76, 49-63. doi: 10.1111/j.1574-6941.2010.01029.x.
PubMed Abstract|CrossRef Full Text|Google Scholar
Kleefisch, M. T., Zebeli, Q., Humer, E., KrÖger, I., Etrl, P., and Klevenhusen, F. (2017). 濃厚飼料と繊維質の多い干し草を高品質干し草に置き換えることが、非泌乳ホルスタイン牛の咀嚼、反芻、栄養消化率に与える影響。アーチ.Anim. Nutr. 71, 21-36. doi: 10.1080/1745039X.2016.1253227.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Lamendella, R., Domingo, J. W., Ghosh, S., Martinson, J., and Oerther, D. B. (2011). 比較糞便メタゲノム解析により、豚の腸のユニークな機能的能力が明らかになった。BMC Microbiol. 11, 103.
PubMed Abstract|CrossRef Full Text|Google Scholar
Larsen, J. M., Musavian, H. S., Butt, T. M., Ingvorsen, C., Thysen, A. H., Brix, S., et al. (2015). 慢性閉塞性肺疾患と喘息に関連するProteobacteriaは、常在のPrevotella属ではなく、Toll様受容体2非依存性の肺の炎症と病理を促進する。免疫学144, 333.doi: 10.1111/imm.12376
PubMed Abstract|CrossRef Full Text|Google Scholar
Li, R. W., Connor, E. E., Li, C. J., Baldwin, R. L., and Sparks, M. E. (2012). メタゲノム解析ツールを用いた反芻前子牛のルーメン微生物叢の特性評価。Environ. Microbiol. 14, 129-139. doi: 10.1111/j.1462-2920.2011.02543.x
PubMed Abstract|CrossRef Full Text|Google Scholar
Li, S., Dong, L., Lian, W. H., Lin, Z. L., Lu, C. Y., Xu, L., et al.(2021年)。高選択的培養戦略によるグルバントゥングット砂漠のストレプトマイセス属菌の未開拓ポテンシャルの探索。Sci. Total. Environ. 790, 148235.
PubMed Abstract|CrossRef Full Text|Google Scholar
Li, Z. P., Wright, A. D. G., Liu, H. L., Bao, K., Zhang, T., Wang, K. Y., et al.(2015)。3種類の飼料を与えたニホンジカ(Cervus nippon)のルーメンにおける細菌群集組成と発酵パターン。Microb. Ecol. 2, 307-318. doi: 10.1007/s00248-014-0497-z
PubMed Abstract | CrossRef Full Text | Google Scholar
林玲子・トラビ・E・B・謝・F・毛・S. (2021). 低穀物飼料、非ペレット飼料、ペレット高穀物飼料を与えた胡羊の大腸における発酵と細菌群集の比較。Appl.Microbiol. Biotechnol. 105, 2071-2080.
PubMed Abstract|CrossRef Full Text|Google Scholar
Lin, T., Wu, P., Lin, Y., and Huang, S. (2021). 血液透析患者における腸内細菌の異常と死亡率。NPJ Biofilms. マイクロバイオーム. 7, 20. doi: 10.1038/s41522-021-00191-x
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, C., Wu, H., Liu, S. J., Chai, S. T., Meng, Q. X., Zhou, Z. M., et al. (2019). 飼料の種類に応じたヤクのルーメン細菌群集とメタボローム特性の動的変化。Front. Microbiol. 10, 1116. doi: 10.3389/fmicb.2019.01116.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Logue, J. B., Stedmon, C. A., Kellerman, A. M., Nielsen, N. J., Andersson, A. F., Laudon, H., et al. (2016). 溶存有機物の分解における水生細菌群集組成の重要性に関する実験的洞察. ISME J. 10, 533-545. doi: 10.1038/ismej.2015.131.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Lopes, L. D., Lima, A. O. D. S., Taketani, R. G., Darias, P., Silva, L. R. F. D., Romagnoli, E. M., et al. (2015). 羊のルーメン微生物群の炭水化物活性酵素を探索する。アントン.Leeuw. 108, 15-30. doi: 10.1007/s10482-015-0459-6
PubMed Abstract|CrossRef Full Text|Google Scholar
Louis, P., and Flint, H. J. (2009). ヒト大腸由来の酪酸産生菌の多様性、代謝および微生物生態。FEMS Microbiol. 294, 1-8. doi: 10.1111/j.1574-6968.2009.01514.x
PubMed Abstract|CrossRef Full Text|Google Scholar
Lourenco, J. M., Kieran, T. J., Seidel, D. S., Glenn, T. C., Silveira, M. F. D., Callaway, T. R., et al.(2020).。濃厚飼料を給与した肉用子牛と給与していない肉用子牛におけるルーミナルおよび糞便微生物相の比較。PLoS ONE. 15, e0231533. doi: 10.1371/journal.pone.0231533.
PubMed Abstract|CrossRef Full Text|Google Scholar
Maczulak, E., Dehority, B. A., and Palmquist, D. L. (1981). 長鎖脂肪酸がルーメンバクテリアの増殖に及ぼす影響。Appl. Environl. Microb. 42, 856-862.doi: 10.1128/aem.42.5.856-862.1981
PubMed Abstract | CrossRef Full Text | Google Scholar
茂、Y. S. 、張、R. Y. 、王、D. S. 、朱、W. Y. (2013). パイロシーケンスを用いた乳牛の亜急性ルミナルアシドーシス(SARA)適応のルーメン微生物叢への影響。Anaerobe 24, 12-19. doi: 10.1016/j.anaerobe.2013.08.003.
PubMed Abstract|CrossRef Full Text|Google Scholar
Martin, C., Ferlay, A., Mosoni, P., Rochette, Y., Chilliard, Y., Doreau, M., et al.(2016)。干し草またはコーンサイレージをベースとした乳牛の飼料における亜麻仁供給の増加:腸内メタン排出、ルーメン微生物発酵、および消化への影響。J. Dairy. Sci. 99, 3445-3456. doi: 10.3168/jds.2015-10110.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
マスロフスキー、K.M.、およびマッケイ、C.R. (2011). 食事、腸内細菌叢、免疫応答。Nat. Immunol. 12, 5-9.
PubMed Abstract|CrossRef Full Text|Google Scholar
Masoudzadeh, S. H., Mohammadabadi, M., Khezri, A., Stavetska, R. V., Oleshko, V. P., Babenko, O. I., et al.(2020)。フェンネル(Foeniculum vulgare)種子粉末を異なるレベルで配合した飼料がケルマーニ産子羊の脳、脂肪組織、大腿筋、ルーメンにおけるDLK1遺伝子発現に与える影響。Small Ruminant Res. 193, e106276. doi: 10.1016/j.smallrumres.2020.106276.
クロスレフフルテキスト|Google Scholar
McClements, D. J., and Xiao, H. (2012). 摂取されたナノエマルションの潜在的な生物学的運命:粒子特性の影響。Food Funct. 3, 202-220.
PubMed Abstract|CrossRef Full Text|Google Scholar
ミズラヒ、I.、ウォレス、R.J.、およびモラス、S. (2021). ルーメン・マイクロバイオーム:食糧安全保障と環境影響のバランスをとる。Nat. Rev. Microbiol. 19, 553-566. doi: 10.1038/s41579-021-00543-6
PubMed Abstract|CrossRef Full Text|Google Scholar
モライス、S.、ミズラヒ、I. (2019). Islands in the stream: From individual to communal fiber degradation in the rumen ecosystem. FEMS Rev. Microbiol. 43, 362-379. doi: 10.1093/femsre/fuz007.
PubMed Abstract | CrossRef Full Text | Google Scholar
ムウォンジ、A.、カルッパナン、A.K.、およびオプリスニッヒ、T. (2021). プロバイオティクスを介した腸内細菌叢の多様性シフトは、ローソニア・イントラセルラリスの組織病理学および排出の低減と関連している。アニム.Microb. 3, 22. doi: 10.1186/s42523-021-00084-6
PubMed Abstract|CrossRef Full Text|Google Scholar
オモンテーゼ、B. O.、シャーマ、A. K.、デイヴィソン、S.、ジェイコブソン、E.、ディコンスタンゾ、A.、ウェブ、M. J.、他(2022). ルーメンのマイクロバイオームネットワーク形質が、異なるバックグラウンドシステム下での肉牛の平均日増体を予測する。Anim. Microb. 4, 25. doi: 10.1186/s42523-022-00175-y
PubMed Abstract|CrossRef Full Text|Google Scholar
Piao, H., Lachman, M., Malfatti, S., Sczyrba, A., Knierim, B., Auer, M., et al.(2014)。16S rRNA遺伝子プロファイリングによって決定されたスイッチグラスのin situ培養中の繊維分解性およびメタン生成性クルメン微生物の時間的動態。Front. Microbiol. 5, 307. doi: 10.3389/fmicb.2014.00307.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Plaizier, J. C., Khafipour, E., Li, S., Gozho, G. N., and Krause, D. O. (2012). 亜急性ルーミナルアシドーシス(SARA)、エンドトキシンと健康への影響。Anim. Feed Sci. Technol. 172, 9-21. doi: 10.1016/j.anifeedsci.2011.12.004.
クロスレフフルテキスト|Google Scholar
Prachumchai, R., Cherdthong, A., and Wanapat, M. (2021). ルーメン由来のシアン化物利用菌のスクリーニングと高硫黄飼料を含むペレットを用いた新鮮キャッサバ根利用率のin vitro評価。Vet. 8, 10. doi: 10.3390/vetsci8010010
PubMed Abstract|CrossRef Full Text|Google Scholar
このような場合、「畜産業に携わる者」であることが重要である。キャッサバチップに代わる新鮮なキャッサバ根は、高硫黄含有ペレットをベースとした飼料を与えた泌乳牛の乳量を高めることができた。硫黄含有率の高いペレットを用いた飼料を給与した乳牛の乳量を増加させることができる。
PubMed Abstract | CrossRef Full Text | Google Scholar
R Core Team. (2014). R: A Language and Environment for Statistical Computing. ウィーン: R Foundation for Statistical Computing.
Google Scholar
Rognes, T., Flouri, T., Nichols, B., Quince, C., and Mah,é, F. (2016). Vsearch: a versatile open source tool for metagenomics. ピアJ. 4, e2584. doi: 10.7717/peerj.2584
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Rosenberg, E., and Zilber-Rosenberg, I. (2018). 10年後の進化のホロゲノムの概念。マイクロバイオーム 6, 78. doi: 10.1186/s40168-018-0457-9
PubMed Abstract|CrossRef Full Text|Google Scholar
Sanchez, O. J., Ospina, D. A., and Montoya, S. (2017).(サンチェス、O. J., オスピーナ、D. A., およびモントーヤ、S. 堆肥化プロセスにおける栄養素と微生物による堆肥の補充。Waste Manag. 69, 136-153. doi: 10.1016/j.wasman.2017.08.012.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Sarker, N. R., Yeasmin, D., Habib, M. A., and Tabassum, F. (2019). 赤色チッタゴン牛の乳量、栄養摂取量、消化率、ルーメン環境に対する全混合飼料の給餌効果。Asian J. Medical and Biological Res. 5, 71-77.
Google Scholar
セガタ、N.、イザード、J.、ウォルドロン、L.、ゲバース、D.、ミロポリスキー、L.、ギャレット、W.、他(2011)。メタゲノムバイオマーカーの発見と解説。Genome Boil. 12, R60. doi: 10.1186/gb-2011-12-6-r60
PubMed Abstract|CrossRef Full Text|Google Scholar
Shin, N. R., Whon, T. W., and Bae, J. W. (2015). Proteobacteria: microbial signature of dysbiosis in gut microbiota(プロテオバクテリア:腸内細菌叢におけるディスバイオーシスの微生物的シグネチャー)。Trends. Biotechnol. 33, 496-503. doi: 10.1016/j.tibtech.2015.06.011
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Singh, K. M., Shah, T., Deshpande, S., Jakhesara, S. J., Koringa, P. G., Rank, D. N., 他 (2012). High through put 16S rRNA gene-based pyrosequencing analysis of the fecal microbiota of high FCR and low FCR broiler growers(高 FCR および低 FCR ブロイラー生産者の糞便微生物群のパイロシークエンス解析)。Mol. Biol. 39, 10595-10602.
PubMed Abstract|CrossRef Full Text|Google Scholar
Solden, L. M., Hoyt, D. W., Collins, W. B., Plank, J. E., Daly, R. A., Hildebrand, E., and al. (2016). 未培養のバクテロイデテス科BS11のヘミセルロース系糖発酵における新たな役割. ISME J. 11, 691-703. doi: 10.1038/ismej.2016.150.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Su, W., Jiang, Z., Hao, L., Li, W., Gong, T., Zhang, Y., et al.(2021)。大豆粕とトウモロコシ混合基質の物理化学的特性と二段階固体発酵中の微生物相の変化。Front. Microbiol. 12, 688839. doi: 10.3389/fmicb.2021.688839.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
タニヤ、M.およびサルツバーグ、S.L. (2011). FLASH: Fast Length Adjustment of Short Reads to improve genome assemblies(FLASH:ショートリードの高速長さ調整によるゲノムアセンブリの改善)。バイオインフォマティクス 27, 2957-2963.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Ticinesi, A., Lauretani, F., Milani, C., Nouvenne, A., Meschi, T., Rio, D. D., et al. (2017). 栄養、身体的虚弱、サルコペニアの交差点における加齢腸内細菌叢:腸-筋肉軸は存在するのか?ニュートリエンツ30、1303.doi: 10.3390/nu9121303
PubMed Abstract|CrossRef Full Text|Google Scholar
Toledo, M., Gutiérrez, M. C., Siles, J. A., García-Olmo, J., and Martín, M. A. (2017). 異なる原料の堆肥化中の臭気の影響を評価するための化学分析およびNIR分光法。J. Clean. Prod. 7, 154-162. doi: 10.1016/j.jclepro.2017.08.163.
クロスレフフルテキスト|Google Scholar
Trabi, E. B., Seddik, H. E., Xie, F., Lin, L. M., and Mao, S. Y. (2019). 低穀物、ペレットまたは非ペレット高穀物全混合飼料を与えた肥育子羊のルーメン細菌群集、ルーメン発酵および成長成績の比較。Anim. 飼料科学技術. 3, 1-12. doi: 10.1016/j.anifeedsci.2019.05.001.
クロスレフフルテキスト|Google Scholar
ヴァン・ギルスウィック、N. O. (1995). Succiniclasticum ruminis gen.nov, sp.nov, aruminal bacterium converting succinate to propionate as the sole energy yielding mechanism(コハク酸をプロピオン酸に変換する唯一のエネルギー生産機構を持つ細菌). Int. J. Syst. Bacteriol. 45, 297-300.
PubMed Abstract | CrossRef Full Text | Google Scholar
Vibart, R. E., Ganesh, S., Kirk, M. R., Kittelmann, S., Leahy, S. C., Janssen, P. H., et al. (2019). 午前または午後に提供されるライグラスベースの牧草を放牧した羊のルーメンにおける時間的な発酵と微生物群集の動態。アニマル2、2251.doi: 10.1017/S1751731119000168
PubMed Abstract | CrossRef Full Text | Google Scholar
Wang, B., Ma, M. P., Diao, Q. Y., and Tu, Y. (2019). Saponin-Induced shifts in the rumen microbiome and metabolome of young cattle(サポニンが誘発する若牛のルーメン微生物とメタボロームのシフト). Front. Microbiol. 10, 356. doi: 10.3389/fmicb.2019.00356.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Wang, L., Xu, Q., Kong, F., Yang, Y., Wu, D., Mishra, S., et al.(2016)。7日から2年までのヤギのルーメン微生物群の探索。PLoS ONE. 11, e0154354. doi: 10.1371/journal.pone.0154354
PubMed Abstract|CrossRef Full Text|Google Scholar
Xing, B. S., Cao, S. F., Han, Y. L., Wang, X. C. C., Wen, J. W., Zhang, K. D., and al. (2020). トウモロコシ藁と食品廃棄物の人工牛と羊のルーメン発酵の比較研究。バッチ運転と連続運転。Sci. Total Environ. 745, 140731. doi: 10.1016/j.scitotenv.2020.140731.
PubMed Abstract|CrossRef Full Text|Google Scholar
Zened, A., Combes, S., Cauquil, L., Mariette, J., Klopp, C., Bouchez, O.、他 (2013). 454 GS FLXパイロシークエンスで評価したルーメンの微生物生態は、飼料のデンプンおよびオイル補給に影響される。FEMS Microbiol. Ecol. 83, 504-514.
PubMed Abstract|CrossRef Full Text|Google Scholar
Zeng, Y., Zeng, D., Ni, X., Zhu, H., Jian, P., Zhou, Y., et al.(2017)。Illumina MiSeqシーケンスによる中国モンゴル羊の消化管内の微生物群集組成から、高い微生物多様性が明らかになった。AMB Exp. 7, 75. doi: 10.1186/s13568-017-0378-1
PubMed Abstract|CrossRef Full Text|Google Scholar
Zhang, J., Shi, H. T., Wang, Y. J., Li, S. L., Cao, Z. J., Ji, S. K., and al. (2017). ホルスタイン未経産牛のルーミナル微生物叢と代謝産物の動的プロファイル変化と相互作用に対する飼料と濃厚飼料の比率の効果(Effect of dietary forage to concentrate ratio on dynamic profile changes and interactions of ruminal microbiota and metabolites in Holstein heifer. Front. Microbiol. 8, 2206. doi: 10.3389/fmicb.2017.02206.
PubMed Abstract|CrossRefフルテキスト|Google Scholar
Zhang, Q., Li, C., Niu, X., Zhang, Z., and Li, F. (2019). 子羊のパフォーマンス、栄養素消化率、およびルーミナル微生物群に対する乳代用飼料投与量と離乳年齢の影響。Anim. Feed. Sci. Technol. 257, 114263. doi: 10.1016/j.anifeedsci.2019.114263.
クロスレフフルテキスト|Google Scholar
Zhou, M., Hernandez-Sanabria, E., and Guan, L. L. (2010). PCR-変性剤濃度勾配ゲル電気泳動分析による、異なる食餌および宿主の飼料効率条件下でのルーメンメタン生成生物群集の変動の特徴付け。Appl. Environ. Microbiol. 76, 3776-3786.
PubMed Abstract|CrossRef Full Text|Google Scholar
モンゴル高原の子羊のルーメン細菌群集と成長成績に及ぼすペレット入りアルファルファまたは在来草の全混合飼料の影響。小反芻動物研究207, 106610.doi: 10.1016/j.smallrumres.2021.106610.
クロスレフフルテキスト|Google Scholar
キーワード:子羊、原生草食、濃厚飼料、ルーメン微生物叢、成長成績
引用元 Du S, Bu Z, You S, Bao J and Jia Y (2022) Growth Performance and rumen microbiotaの多様性は飼料の種類によって異なる。Front. Sustain. Food Syst. 6:1004373. doi: 10.3389/fsufs.2022.1004373
Received: 2022年7月27日; 受理: 2022年10月28日;
掲載:2022年11月24日
編集者
ユー・リウ、ノースウェストA&F大学、中国
査読者
Blaz Stres, University of Ljubljana, Slovenia(リュブリャナ大学、スロベニア
Huan Li, 蘭州大学, 中国
Yan Tu, 飼料研究所(CAAS), 中国
著作権 © 2022 Du, Bu, You, Bao and Jia. これは、クリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文です。原著者および著作権者のクレジットを表示し、本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。本規定に従わない使用・配布・複製は認めない。
*Correspondence: Shuai Du, dushuai_nm@sina.com; Yushan Jia, jys_nm@sina.com
免責事項:本論文で表明されたすべての主張は,著者個人のものであり,必ずしも所属機関のもの,あるいは出版社,編集者,査読者のものを代表するものではありません。この記事で評価される可能性のある製品、またはそのメーカーが行う可能性のある主張は、出版社によって保証または承認されるものではありません。
こんな人も見ています
COVID-19パンデミック時の農村部における食品の購買行動
ジョアッキーノ・パッパラルド,ロベルタ・セルバッジ,ミケーラ・ピッタラ,クラウディオ・ベリア
持続可能な都市政策の矛盾への応答としてのコミュニティガーデン。スイスのチューリッヒ市とローザンヌ市からの洞察
イングリッド・ヤール、オリヴィエ・エジュデリアン、ジョエル・サロモン・カヴァン
マルトースを基質とする培地におけるMonascus ruber CCT0302による顔料の生産
Camila Fernanda Dias Oliveira、Lígia Alves da Costa Cardoso、Francielo Vendruscolo
フッター
ガイドライン
探索
アウトリーチ
接続
フォローする
© 2022 Frontiers Media S.A. All rights reserved
個人情報保護方針
|
ご利用条件
この記事が気に入ったらサポートをしてみませんか?
