
プラトーピカ糞便微生物叢移植は大腸炎モデルマウスにおける炎症性腸疾患の症状を改善する
本文へスキップ
トップバーナビゲーション
微生物学のフロンティア
セクション
論文
研究トピックス
編集委員会
ジャーナルについて
私たちについて
すべてのジャーナル
すべての記事
研究を投稿する
386
総閲覧数
記事のインパクトを見る
記事のaltmetricスコアは1
オリジナル研究論文
Front. 微生物学、2023年9月19日
第2章 脊椎動物の消化器系における微生物
第14巻-2023年|https://doi.org/10.3389/fmicb.2023.1228778
この論文は次の研究テーマの一部です。
ワンヘルスと微生物叢の出会い:消化管微生物叢、宿主、環境の相互作用
全12記事を見る
プラトーピカ糞便微生物叢移植は大腸炎モデルマウスにおける炎症性腸疾患の症状を改善する
https://www.frontiersin.org/articles/10.3389/fmicb.2023.1228778/full?utm_source=S-TWT&utm_medium=SNET&utm_campaign=ECO_FCIMB_XXXXXXXX_auto-dlvrit
Yayuan Yang1† Baiqiang Cui2† Yanan Lv1 Xiangnan Lu3 Wenxiang Shen1 Min Feng1 Xuezhi Ding1* Pengcheng Dong1* Yu Wang1* 1.
1中国農業科学院蘭州畜産薬業研究所、農業農村部、動物用医薬品開発重点実験室、中国蘭州市
2中国甘粛省蘭州病院胸部外科
3中国甘粛省蘭州市甘粛農業大学食品科学工程学院
炎症性腸疾患(IBD)は、世界的な公衆衛生上の重大な問題である。この疾患の病因は現在のところ不明であるが、腸内細菌叢と炎症性メディエーターの両方が関連していることが報告されている。プラトー種のナキウサギの糞便が胃腸の傷害や痛みの治療に有用であることを示唆する証拠がある。糞便微生物叢移植はIBD予防に非常に有効な介入であるが、病原性微生物や有毒物質が移行する可能性は潜在的に危険である。幸いなことに、ドナーの糞便を微細孔フィルターでろ過することで、細菌感染のリスクを最小限に抑え、残存バクテリオファージの治療効果を保持することができる。ここで我々は、プラトー種のナキウサギの糞便がIBD症状を緩和するだけでなく、腸内細菌叢の最適な構造と組成を促進することを実証した。さらに、プラトーピカ糞の移植は、体重、疾患活動性指数、組織学的スコアなどの表現型の特徴も向上させた。結論として、プラトー種のナキウサギの糞は、デキストラン硫酸ナトリウムによって誘発される大腸炎からマウスを保護することが判明した。これらの知見は、IBDの代替療法としてのプラトーピカ糞の可能性を示唆している。
はじめに
炎症性腸疾患(IBD)は、寛解と再発を繰り返すことを特徴とする進行性の免疫関連疾患であり、大腸がんのリスクを高める(Cleynen et al.) 本疾患の罹患率は現在増加傾向にあり、特に最近の先進国に多い(Gecse and Vermeire, 2018; Xiao et al., 2019)。IBDの危険因子には、細菌由来の抗原に対する粘膜免疫応答の調節異常が含まれ、炎症性サイトカインの産生増加につながる(Olén et al.) 病原体を寄せ付けず、全身の健康を維持する上で腸内細菌叢が極めて重要であることを考慮すると、より良い身体的健康を達成するために健康的な微生物生態系をサポートし、強化することへの研究関心が高まっている(Jessら、2012年)。さらに、これらの介入は潰瘍性大腸炎(UC)やクローン病(CD)の臨床症状の緩和にも役立つ可能性がある。チベット高原の高山草原に生息する小型のラゴモーフである高原ナキウサギ(Ochotona curzoniae)は、捕食者の餌となり、巣穴に営巣する小型の小鳥に隠れ家を提供するため、要となる種である(Olén et al.)
病原体感染などの有害な状況に対する全体的な防御作用にもかかわらず、炎症はしばしば病原プロセスを悪化させる経路を含み、それによってさらなる攻撃に対する宿主の脆弱性を増大させる(Ng et al.) TNF-α、IL-6、IL-1などの多くのサイトカインは、NF-кB経路の標的である(Nadeemら、2020)。インヒビタータンパク質(IB)は通常、細胞質におけるNF-кBの活性を制限するが、NF-кBはタンパク質の核への移行後、一連の複雑なリン酸化と分解を促進し、下流の標的遺伝子の発現とそれに続く炎症性シグナル伝達を引き起こす(Kuipersら、2015)。NF-кB軸は、ヒトおよび動物におけるUCとCDの両方の病因と密接に関連していると報告されている(Odenwald and Turner, 2017; Schirmer et al.)
UCにおける腸内細菌叢と炎症性因子との相互作用は複雑である(Xavier and Podolsky, 2007)。先行研究では、UC症状の緩和は、有益な細菌、宿主の遺伝的因子、共通の環境刺激の間の複雑なバランスを介して起こることが明らかにされている。最近導入された糞便微生物叢移植(FMT)という技術は、腸内細菌叢の構造的調節を効果的に強化し、IBDと持続性胃腸内細菌異常症を緩和することが示されている(Rodaら、2016;Na and Moon、2019)。とはいえ、FMT治療がUC症状を緩和する正確なメカニズムは未解明のままであり、これまでに発表された情報の大半は症例報告や関連研究によるものである。
これまでの研究で、プラトー種のナキウサギの糞、宿主の遺伝的要因、共通の環境ストレスがバランスよく相互作用すると、UCのリスクが低下することが示されている(Paramsothy et al.) ここでは、大腸炎モデルマウスのIBD緩和におけるプラトーピカFMTの役割を探索した。
材料と方法
動物
C57BL/6 Jマウスを含むすべてのプロトコルは、実験動物の飼育と使用(甘粛省動物飼育委員会、蘭州、中国)のガイドラインに従い、本研究は蘭州畜産薬学研究所(CAAS)の倫理承認を得た。マウスは、温度(20~24℃)と湿度が一定で、12時間/12時間の明暗サイクルの環境下で飼育された。餌と水は自由摂取とした。
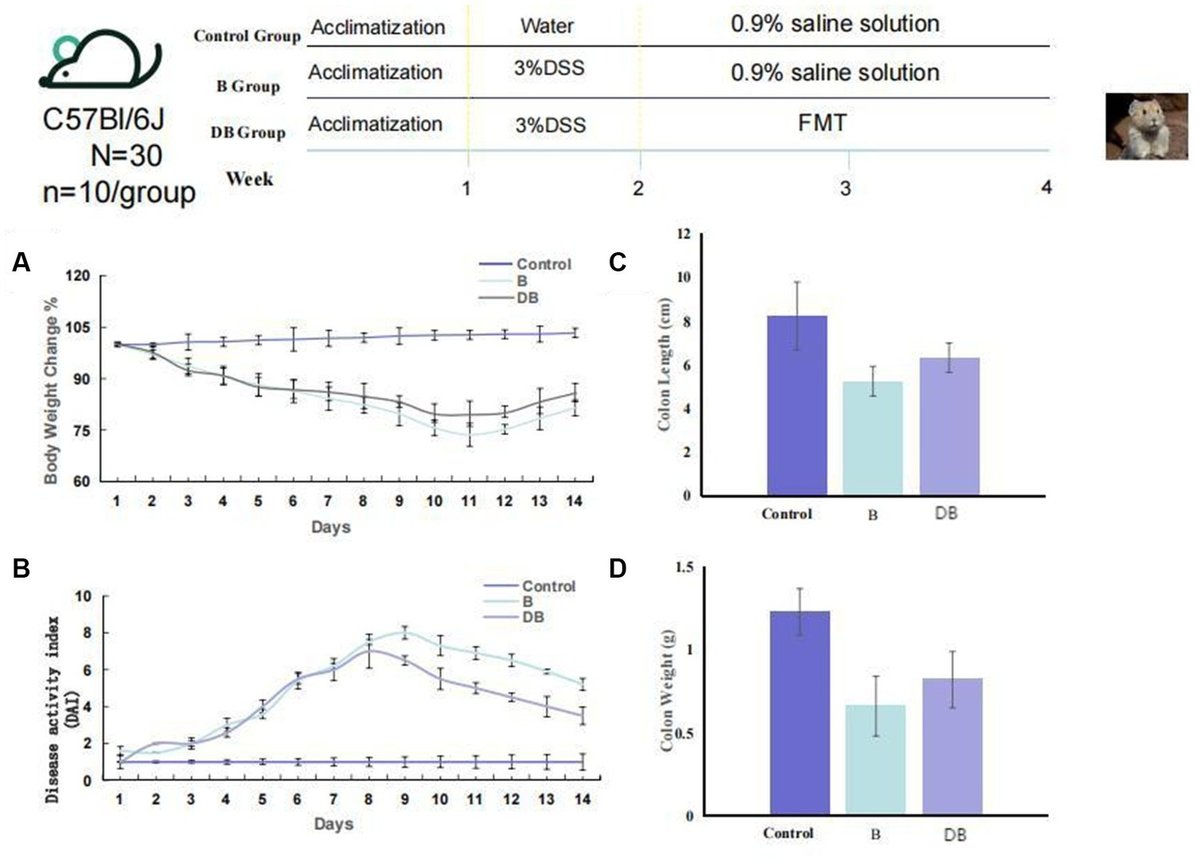
動物プロトコルを図1に示す。すなわち、(i)対照群、(ii)デキストラン硫酸ナトリウム(DSS)投与群、(iii)FMT投与群である。最初の7日間、コントロール以外のすべてのマウスに3%DSS溶液を含む飲料水を与え、UCモデルを確立した。その後、10匹のプラトーピカの糞便内容物を採取し、10%滅菌グリセロールで穏やかにホモジナイズし、凍結した。実用的なFMT溶液を調製するため、凍結した糞便を解凍し、滅菌生理食塩水で0.05g/mlに希釈した後、ホモジナイズし、遠心分離(5,000g 30分、4℃)し、0.45μmのPESフィルター(Minisart® High Flow Syringe Filter、Sartorius™、ドイツ;Slackら、2022)を用いて上清をろ過した。マウスは2週間にわたり1日1回、プラトーピカ糞便サンプルの上清200μlを経口投与し、FMTを受けた。一方、コントロールおよびDSSマウスには0.9%生理食塩水200μlを経口投与した。大腸炎モデルマウスを作製するため、滅菌水に3%の黄砂を7日間添加し、さらに黄砂を含まない水を7日間添加した。FMTマウスにはピカの糞便上清を経口投与し、対照マウスには0.9%の生理食塩水を投与した。体重、糞便の硬さの変化、糞便中の血液の有無などのパラメータを毎日モニターした。16S rRNA遺伝子の塩基配列決定を用いて腸内細菌叢を解析するため、14日目にマウスから糞便を採取し、安楽死後に大腸組織を採取した(図1)。DAIは先に述べたようにスコア化した(補足表S1;Murthyら、1993;Camuescoら、2004)。
図1
www.frontiersin.org
図1. FMTは大腸炎モデルマウスの大腸障害を軽減した。マウスのDSS誘発大腸炎に対するFMT治療の実験デザイン。(A)体重減少(n = 10)。(B)DAI(n=6)。(C)結腸長、(D)結腸重量。統計は両側スチューデントのt検定で計算した。*, p < 0.01; **, p, 0.01 (C,D)。データは平均値6 SEMで示した。
治療終了後、すべての動物をまずペントバルビタールナトリウム(5%)で麻酔し、解剖直前に頸椎脱臼により犠牲にした。大腸を開き、鉗子を用いて糞便を静かに移動させた。遠位結腸(約30mm)とその他の腸管部位をそれぞれヘマトキシリン・エオジン(HE)染色による組織学的分析に用いた。また、炎症性サイトカイン評価のための結腸サンプルも採取した。
病理組織学的分析とHE染色
マウスの大腸を10%緩衝ホルマリンで固定した後、パラフィン包埋、5μm切片、HE染色、光学顕微鏡で観察した。
大腸酸化ストレス(OS)パラメータの評価
大腸パラメータ、すなわちマロンジアルデヒド(MDA)レベル、総抗酸化能(T-AOC)、カタラーゼ(CAT)およびスーパーオキシドジスムターゼ(SOD)活性は、適切なキット(南京建成生物工学研究所、中国)を用いて測定した。
16S rRNA遺伝子アンプリコンシークエンス
次に、NextSeq(Illumina United States)プラットフォームのNextSeq v2 MID、300サイクル、ペアエンドケミストリーを用いた16S rRNA遺伝子(V3領域)アンプリコンシークエンシングを用いて、回腸遠位粘膜および腸管内腔における腸内微生物群集の構成を決定した。全DNAはBead-Beat® Micro AX Gravity Kit(A&A Biotechnology、ポーランド)を用い、添付の指示に従って単離した。ライブラリーは、以前に報告されたように作成した(Slackら、2022)。サンプルあたりの平均アンプリコン配列決定深度は35,840リード(最小9,286リード、最大63,584リード)であった。
統計解析
データはGraphPad PrismおよびSPSSを用いて解析した。p < 0.05を有意閾値とした。データは平均値±標準偏差(SD)で示し、一元配置分散分析(ANOVA)とダンカン検定を用いて比較した。
結果
FMTを介したマウス大腸炎発症および臨床病理学的発現の制御
とりわけ、黄砂が引き金となる大腸炎は腸上皮に潰瘍を形成し、粘膜内層の破壊をもたらし、急性免疫細胞や炎症性免疫細胞の侵入を促進する(Dasら、2020;Bellら、2022)。IBDの代表的なバイオマーカーは、体重、疾患活動性指数(DAI)スコアリング、および長さ/結腸重量比である(Niら、2017;Chenら、2021)。そこで本研究では、これらの変数を用いて、FMTを介したin vivoでの大腸炎の発症と進行の制御を評価した。その結果、DSSを投与したマウスでは、3つの変数すべてがコントロールと比較して有意に減少していた(p < 0.01)(図1)。FMT投与後、有意な体重増加が観察され、対照マウスの体重と同等であった(p < 0.05)。FMT投与マウスはDAIスコアも大幅に減少した。これらの結果は、これまでの知見(Weingarden and Vaughn, 2017)と一致しており、FMTによる治療が黄砂によるIDBをうまく予防できることを示した。
プラトーピカ糞は黄砂誘発実験的UCの病理学的症状を緩和した
プラトーピカによる微生物叢移植がUCに及ぼす影響を明らかにするため、14週齢のC57BL/6 Jマウスを用いてDSS誘発UCモデルマウスを開発した。コントロールマウスと比較して、プラトーピカ糞便微生物叢移植を受けたマウスの大腸は有意な改善を示した(図1)。FMTを投与したマウスの体重の変化も中程度であった。また、FMT投与により、対照マウスに比べて体重減少が強く抑制された(p = 0.038;図1A)。さらに、FMTを投与したマウスのDAIスコアは、対照マウスと比較して大幅に減少した(p = 0.027;図1B)。
FMTを介した結腸の病理組織学的変化の制御
各群のマウスの結腸組織像の代表画像を図2に示す。予想通り、コントロールマウスは正常な結腸組織形態を示した(図2)。一方、DSSを投与したマウスでは、腸壁の肥厚、粘膜下浮腫、粘膜浸潤、細胞質ムチンの減少、結腸の潰瘍化が認められた(図2)。これらのUCの特徴的な症状は、FMT投与後に有意に減少した(図3)。これらの結果は、Newmanら(2017)の結果と一致している。
図2
www.frontiersin.org
図 2. マウス大腸組織学的変化に対するFMT介入の効果(代表的ヘマトキシリン・エオジン染色)(対照)Control群、(B)B群、(DB)DB群。
図3
www.frontiersin.org
図3. FMTは大腸組織におけるDSS誘発NF-κB活性化を調節した。大腸組織におけるNF-κBタンパク質レベルは免疫組織化学的に解析した。
FMTを介した大腸組織における酸化状態の制御
今回の研究および先行するUCの研究により、腸管OSと疾患との関連性が示された(図4)。活性酸素種(ROS)は通常、炎症性因子が食細胞を活性化する際に産生される(Sunら、2017)。したがって、細胞の抗酸化能を増強するような介入を行えば、UCの発症と重症化を予防できる可能性がある(Paramsothyら、2017;Mishraら、2022)。DSSマウスでは、CAT、SOD、T-AOCの著しい減少が、MDAレベルの有意な上昇とともに観察された。CATは、スーパーオキシドアニオンを分解して、O2のH2O2への還元、およびH2O2の水への変換を触媒する必要があり(Ortiz-Riveraら、2017)、一方、T-AOCは身体機能と特定の疾患に対する感受性を調節する(Özçamら、2019)。MDA含量はOSの指標として確立されている(Özçamら、2022)。この証拠は、結腸がUC中にOSを受けることを示唆している。ここで、FMT治療後、CAT、SOD、T-AOCレベルは有意に上昇し(p < 0.05)、一方、MDAのレベルは急激に低下した(p < 0.01)ことから、FMT治療はOSをうまく減少させることができることがわかった。
図4
www.frontiersin.org
図4. DSS誘発大腸炎マウスの大腸酸化ストレスパラメーターに対するFMT介入の効果。 (A)T-AOC、(B)MDA、(C)CAT、(D)SOD。データは平均値±SDで示した。##p < 0.01および#p < 0.05は対照群と比較した。**p<0.01および*p<0.05 vs. Bモデル群。
プラトーピカ糞はDSS誘発UCモデルマウスにおいて腸内細菌叢の組成を調節した。
大腸炎は、腸内細菌叢の組成および組織の改変と密接に関連している(Sartor and Wu, 2017)。我々は、DSS投与2週間後に採取した糞便サンプルの16S rRNA配列決定を用いて、DSS誘発大腸炎モデルマウスにおける腸内細菌叢の制御に対するプラトーピカ糞便の意義を探索した。希薄化分析の結果、細菌組成はかなり多様であることが示された(Zhu et al.) 3群すべての腸内細菌叢は、その種組成において異なっていた(図5)。シンプソン指数を用いて、14日目に採取した3群すべてのサンプルにおけるアルファ多様性を種レベルで評価した。その結果、FMT投与マウスのシンプソン指数は、対照マウスのそれとは著しく異なっていた(図5)。プラトーピカ糞による処置は、慢性炎症期を通じて微生物叢の組成と多様性を増加させ、ひいては治癒を促進した。Bray Curtis距離測定法を用いた主座標分析(P-CoA)を用いてβ多様性を測定したところ、FMTマウスと対照マウスで2つの異なるクラスターが認められた(図5)。このことは、FMT投与マウスでは、14日目までに微生物組成が、種の多様性においても有意に変化していることをさらに示している。以上の結果から、FMT投与は腸炎症の慢性期から回復期にかけて腸内細菌叢を強く制御することが明らかになった。さらに、FMTを投与したマウスは、腸炎症からの回復期を通じて、DubosiellaとLactobacillusが存在する一方で、Ileibacterium、unclassified_f_Lachnospiraceae、Bifidobacterium、Turicibacter、Lachnospiraceae_NK4A136_group、およびCandidatus_Saccharimonasが14日目により多く存在するという、通常とは異なる微生物組成を示した。
図5
www.frontiersin.org
図5. FMT投与が腸内細菌叢β多様性に及ぼす影響。(A)重み付きUniFrac距離の階層的クラスタリングツリー、(B)ASVレベルの主座標分析(PCoA)。(C)ASVレベルのNMDS。(D) 属レベルの系統樹。(E) 群集バープロット分析。(F) クラスカル・ワリスH検定バープロット。データは平均値±SDで表示。対照群に対して##p < 0.01および#p < 0.05。**p < 0.01および*p < 0.05対DSSモデル群。
考察
この調査の目的は、DSS誘発大腸炎モデルマウスにおいて、プラトーピカ糞が腸の炎症からの回復に及ぼす総合的な効果を明らかにすることであった。UC症状の緩和は、腸の構造、機能、微小環境の回復からもたらされた可能性がある。本研究で得られた知見は、機能性プロバイオティクスを用いた大腸炎症の代替治療法およびIBDにおけるプラトーピカ糞の使用に関する重要な情報を提供するものである。
我々は、プラトーピカ糞が、以前の論文(Parkら、2018;Wangら、2020、2021;Jeongら、2022)で文書化されたように、結腸長、体重減少、DAIスコア、粘膜損失、炎症細胞の浸潤の減少で示された、黄砂誘発性大腸炎の症状を緩和することを実証した。
重要なことに、プラトーピカ糞コホートは、体重変動、DAI、および大腸組織学的スコアの最小化という点で、単系統マウスを上回った(Kühlら、2015;Gasalyら、2021)。これは、腸内への侵入後、細菌株が粘膜上皮細胞との相互作用とは別に、微生物ネットワーク全体を調節することにより、炎症を直接抑制する可能性があるためと考えられる(Liang et al.) 我々はまた、大腸炎マウスの大腸炎症発症8日目と治癒14日目に、プラトーピカ糞が微小生態系異常を効果的に救済することを確認した。報告によれば、微生物叢の変化は大腸炎の進行を防ぐ可能性がある。αおよびβの多様性から、FMTマウスの腸内細菌叢の構造組成が対照群と有意に異なることが明らかになった(Sunら、2020;Wangら、2021)。単一株を用いた腸内細菌叢の回収は、ほとんどが14日目に行われたため、プラトーピカ糞便と比較して効果が低かった。宿主に入った代謝物はすぐに腸内に吸収される。それらは小腸上皮細胞にも到達し、利用がさらに促進される。
代謝物には著しい抗菌活性を持つバクテリオシンが含まれるため、腸内細菌叢は代謝物によって直接調節される(Salminenら、2021年)。論理的な結論として、代謝産物は消化管に吸収された後、微生物群集をさらに制御することにより、間接的な抗炎症活性を示す可能性がある。
FMTで治療した大腸炎における微生物叢のこのような有意な変化を考慮すると、プラトーピカ糞による治療はUCの治療に大きな可能性があると考えられる。その結果、RFCVは11のユニークな細菌分類群を発見した。その結果、乳酸桿菌科Lactobacillus属、固形桿菌科Dubosiella属、リケネラ科Rikenellaceaeの3つの分類群のみが単一菌株の影響を強く受けていたことから、単一菌株は腸内細菌叢の強化にはあまり有益ではないことが示唆された。プラトー種のナキウサギの糞便は、他の8つの分類群によって特に制御されている。その結果、ムリバキュラ科Muribaculaceae、バクテロイデス科Bacteroides、オシロスピラリス科UCG.005、ラクノスピラリス科Ruminococcus、ティシエレラリス科Anaerovoracaceae、クロストリジウム科Clostridiaの6つの分類群が、コントロール群に対してFMT処理群に多いことがわかった。Muribaculaceaeは、炎症を抑える効果、危険な微生物を抑制する効果、抗がん免疫を促進する効果で知られている(Setoyama et al., 2003)。バクテロイデス類は、短鎖脂肪酸とスフィンゴ脂質を産生するユニークな能力を持ち、腸管バリアの完全性をサポートするとともに、免疫反応を調節し、ひいては腸管損傷を修復することから、次世代プロバイオティクスの有力な候補である(Brownら、2019;Wangら、2022)。他の4種は酪酸を産生し、Oscillospirales UCG.005とL. ruminococcusはUC患者とCRC患者において比較的低い存在量を示す(Mancabelliら、2017)。残りの2つのクロストリジウム属は、制御性T細胞の増殖と分化を亢進し、IBDやアレルギー性下痢症を緩和する(Atarashi et al.、2013)。逆に、DSS投与はマウスにおいてParasutterella BurkholderialesとBacteroidales Tannerellaceaeの相対量を強く増加させ、先行論文(Silvestri et al.)
IBD患者ではP. burkholderialesの数が増加しており、これは持続的な大腸炎症と相関している(Chenら、2018;Zhaoら、2021)。重要なことは、代謝物介入実験における8分類群の相対存在量には、混合群と対照群の間で有意な変動がないことであり、混合代謝物は大腸微生物叢を完全に制御できないことを示している。その結果、代謝物の投与が小腸の微生物生態系に影響を及ぼすという仮説を立てた。Acidiferrobacteralesアシジフェロバクター科、Sphingomonadaceaeスフィンゴモナド科、およびReyranellaceaeレイラネラ科の相対的な存在量は、対照群で著しく減少しており、代謝物が小腸の微小環境のバランスをとることによって作用するという仮説を確認した。
IBDが腸内細菌叢の組成および代謝の変化と相関していることは広く認識されているにもかかわらず、ヒトにおける腸内細菌叢異常症とIBDの因果関係の報告はない(Ni et al.) 腸内細菌叢とIBD表現型との関連に関する研究は非常に限られている。ここで、我々のRDAは、プロバイオティクスFMT群における微生物と大腸炎の表現型データとの関連についての強力な証拠を提供し、それにより、中核的な種レベルの微生物データは、疾患の重症度や大腸病理学などの必須の表現型データを提供した。表現型データと微生物学的マーカーとの関係を調べるために共起ネットワークを構築した。FMT投与マウスでは、8日目にB. bacteroides、M. muribaculaceae、B. tannerellaceae、P. burkholderialesの存在が明確に確認され、より強力で広範な相互作用ネットワークも確認された。代謝物介入実験における多くの微生物マーカーは単体の分類単位であり、共生コミュニティではないため、明らかに表現型パラメーターには影響しなかった。すべての介入実験において、M. muribaculaceaeは共起ネットワークにおいて極めて重要であることが判明し、一般的な微生物叢と疾患表現型の相互作用における重要性が示された。総合すると、我々の知見と他の発表された研究結果を総合すると、プラトー種のナキウサギの糞は、大腸炎動物モデルにおいて腸の炎症を効果的に抑制し、機能を回復させる可能性があることが示された。
結論
ここで我々は、プラトーピカFMTが腸内細菌叢の構造と組成を変化させることにより、大腸炎に伴う腸の炎症症状を緩和することを実証した。我々の発見は、腸内細菌叢と大腸炎の表現型との間に強い関連性があることを実証した。動物モデルにおけるこれらの知見は、腸の健康維持におけるプラトーピカFMTの利用の可能性を強調するものであり、IBDや他の腸炎症性疾患に対する臨床的に適用可能なプラトーピカFMTに基づく介入の開発に向けて貢献する可能性がある。
研究の限界
今回の研究にはいくつかの限界がある。第一に、細菌群集組成の評価にメタゲノミクスを採用しなかったことである。これは今後の調査で行う予定である。第二に、適切な治療標的を同定するためには、腸内細菌と炎症に関連する経路をさらに検討する必要がある。最後に、メタボロミクスをさらに研究して、混合代謝産物の介入によって作用する重要な成分の精製と同定の方法を明らかにする必要がある。
重要性
IBDは慢性の非特異的炎症性疾患である。IBDは大腸粘膜の潰瘍形成とびらんを特徴とし、しばしば大腸全体に影響を及ぼす他の様々な病変を引き起こすこともある。本研究では、プラトーピカ糞の投与による腸内炎症の軽減と腸内ミクロエコロジー回復の有効性を検討した。その結果、プラトー種のナキウサギの糞は対照群と比較して、炎症を有意に抑制し、回復を促進することが示された。これらの知見は、IBDの代替治療アプローチとしてのプラトーピカ糞の使用を支持するものである。
データ利用声明
本研究で発表されたデータは、NIHリポジトリ(アクセッション番号SUB13763520)に寄託されている。
倫理声明
この動物実験は、蘭州畜産薬学研究所(Lanzhou Institute of Husbandry and Pharmaceutical Sciences, CAAS)により承認された。本研究は、現地の法律および施設要件に従って実施された。
著者貢献
XD、PD、YWが実験を計画し、助成金を獲得した。YY、BC、WS、MFが実験を行った。YY、YL、XLはデータの収集と解析を行った。YYは原稿の起草と編集を行った。すべての著者が論文に貢献し、提出された原稿を承認した。
資金提供
本研究は、甘粛省青年科学基金プロジェクト(助成金番号22JR5RA043)、中央レベル科学研究院基礎研究開発特別基金(番号1610322023010)、甘粛省科学技術計画プロジェクト(助成金番号22JR5RA039)、国家重点研究開発計画(助成金番号2021YFF0702405)の支援を受けた。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言する。
発行者注
本論文で表明された主張はすべて著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本論文で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のある主張も、出版社によって保証または支持されるものではない。
補足資料
本論文の補足資料は、https://www.frontiersin.org/articles/10.3389/fmicb.2023.1228778/full#supplementary-material。
参考文献
アタラシ, K., タノウエ, T., オオシマ, K., スダ, W., ナガノ, Y., ニシカワ, H., et al. ヒト微生物叢から合理的に選択されたクロストリジウム菌株の混合物によるTreg誘導。Nature 500, 232-236.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Bell, H. N., Rebernick, R. J., Goyert, J., Singhal, R., Kuljanin, M., Kerk, S. A., et al. 健康な腸内細菌叢のロイテリンは、酸化還元バランスの変化を通じて大腸癌の増殖を抑制する。癌細胞40, 185-200.e6. doi: 10.1016/j.ccell.2021.12.001.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Brown, E. M., Ke, X., Hitchcock, D., Jeanfavre, S., Avila-Pacheco, J., Nakata, T., et al. バクテロイデス由来のスフィンゴ糖脂質は、腸内恒常性の維持と共生に重要である。Cell Host Microbe 25, 668-680.e7. doi: 10.1016/j.chom.2019.04.002.
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Camuesco, D., Comalada, M., Rodríguez-Cabezas, M. E., Nieto, A., Lorente, M. D., Concha, A., et al. ケルシトリンの腸管抗炎症作用は、iNOS発現抑制と関連している。Br. J. Pharmacol. 143, 908-918. doi: 10.1038/sj.bjp.0705941.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chen, Y., Cui, W., Li, X., and Yang, H. (2021). 炎症性腸疾患における常在細菌、免疫応答および腸管バリア間の相互作用。Front. Immunol. 12:761981. doi: 10.3389/fifimmu.2021.761981.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Chen,Y.-J.、Wu,H.、Wu,S.-D.、Lu,N.、Wang,Y.-T.、Liu,H.-N.、他(2018)。過敏性腸症候群および腸の慢性炎症に関連するパラシュートテレラ(Parasutterella)。J. Gastroenterol. Hepatol. 33, 1844-1852. doi: 10.1111/jgh.14281
パブコメ抄録|クロスリファレンス全文|Google Scholar
Cleynen, I., Boucher, G., Jostins, L., Schumm, L. P., Zeissig, S., Ahmad, T., et al. クローン病と潰瘍性大腸炎の表現型の遺伝的決定因子:遺伝的関連研究。Lancet 387, 156-167. doi: 10.1016/S0140-6736(15)00465-1
パブコメ抄録|クロスリファレンス全文|Google
Das, N. K., Schwartz, A. J., Barthel, G., Inohara, N., Liu, Q., Sankar, A., et al. 全身の鉄ホメオスタシスには微生物代謝物シグナルが必要である。Cell Metab. 31, 115-130.e6. doi: 10.1016/j.cmet.2019.10.005
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Gasaly, N., de Vos, P., and Hermoso, M. A. (2021). 腸管バリア機能と宿主免疫に対する細菌代謝産物の影響:細菌代謝と腸管炎症との関連性に焦点を当てて。Front. Immunol. 12:658354. doi: 10.3389/fifimmu.2021.658354
パブコメ抄録|全文|Google Scholar
Gecse, K. B., and Vermeire, S. (2018). 炎症性腸疾患の鑑別診断:模倣と合併症。Lancet Gastroenterol. Hepatol. 3, 644-653. doi: 10.1016/S2468-1253(18)30159-6
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Jeong, Y., Kim, D. H., and Lee, K. (2022). デキストラン硫酸ナトリウム誘発大腸炎マウスにおけるLactobacillus gasseri 4M13による発酵メイラード反応産物のホメオスタシス効果。J. Sci. Food Agric. によるメイラード反応産物発酵物によるデキストラン硫酸ナトリウム誘発性大腸炎マウスへの有効性を検討した。
パブコメ抄録|クロスリファレンス全文|Google Scholar
Jess, T., Rungoe, C., and Peyrin-Biroulet, L. (2012). 潰瘍性大腸炎患者における大腸がんのリスク:集団ベースのコホート研究のメタアナリシス。Clin. Gastroenterol. Hepatol. 10, 639-645. doi: 10.1016/j.cgh.2012.01.010.
CrossRef 全文|Google Scholar
Kühl, A. A., Erben, U., Kredel, L. I., and Siegmund, B. (2015). 炎症性腸疾患における腸管マクロファージの多様性。Front. Immunol. 6:613. doi: 10.3389/fifimmu.2015.00613
CrossRef フルテキスト|Google Scholar
Kuipers, E. J., Grady, W. M., Lieberman, D., Seufferlein, T., Sung, J. J., Boelens, P. G., et al. 大腸がん。Nat. Rev. Dis. Primers. 1:15065. doi: 10.1038/nrdp.2015.65
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Liang,Y.、Liu,M.、Pu,J.、Zhu,Z.、Gao,Z.、Zhou,Q.、他(2021年)。プロバイオティクスとその代謝物は炎症性腸疾患を改善する:批判的レビュー。Infect. Microbes. Dis. 3, 4-13. doi: 10.1097/IM9.000000000046
CrossRef 全文|Google Scholar
Mancabelli, L., Milani, C., Lugli, G. A., Turroni, F., Cocconi, D., van Sinderen, D., et al. メタアナリシスによる一般的なヒト腸疾患の普遍的な腸内細菌バイオマーカーの同定。FEMS Microbiol. Ecol. 93:fifix153. doi: 10.1093/femsec/fifix153.
クロスレフ・フルテキスト|Google Scholar
Mishra, J., Stubbs, M., Kuang, L., Vara, N., Kumar, P., and Kumar, N. (2022). 炎症性腸疾患治療薬:プロバイオティクス工学を中心に。Med. 2022:9621668.DOI:10.1155/2022/9621668.
パブコメ抄録|全文|Google Scholar
Murthy, S. N., Cooper, H. S., Shim, H., Shah, R. S., Ibrahim, S. A., and Sedergran, D. J. (1993). 大腸内シクロスポリンによるデキストラン硫酸ナトリウム誘発マウス大腸炎の治療。Dig. Dis. Dig.Dis.Sci.38、1722-1734。
抄録|全文|Google Scholar
Na, S.-Y., and Moon, W. (2019). 炎症性腸疾患の現在の治療法と新規治療法の展望。Gut Liver 13, 604-616.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Nadeem, M. S., Kumar, V., Al-Abbasi, F. A., Kamal, M. A., and Anwar, F. (2020). 炎症性腸疾患における大腸癌のリスク。Semin. DOI: 10.1016/j.semcancer.2019.05.001.
クロスレフ・フルテキスト|Google Scholar
Newman, K. M., Rank, K. M., Vaughn, B. P., and Khoruts, A. (2017). 炎症性腸疾患患者における糞便微生物叢移植を用いた再発性クロストリジウム・ディフィシル感染症の治療。Gut Microbes 8, 303-309. doi: 10.1080/19490976.2017.1279377.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ng, S. C., Shi, H. Y., Hamidi, N., Underwood, F. E., Tang, W., Benchimol, E. I., et al. 21世紀における炎症性腸疾患の世界的発生率と有病率:集団ベースの研究の系統的レビュー。Lancet 390, 2769-2778. doi: 10.1016/S0140-6736(17)32448-0
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Ni, J., Wu, G. D., Albenberg, L., and Tomov, V. T. (2017). 腸内細菌叢とIBD:因果関係か相関関係か?Nat. Rev. Gastroenterol. Hepatol. 14, 573-584. doi: 10.1038/nrgastro.2017.88
PubMed Abstract|クロスリファレンス全文|Google Scholar
Odenwald, M. A., and Turner, J. R. (2017). 腸管上皮バリア:治療標的?Nat. Rev. Gastroenterol. Hepatol. 14, 9-21. doi: 10.1038/nrgastro.2016.169
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Olén, O., Erichsen, R., Sachs, M. C., Pedersen, L., Halfvarson, J., Askling, J., et al. 潰瘍性大腸炎における大腸癌:スカンジナビアの集団ベースのコホート研究。doi: 10.1016/S0140-6736(19)32545-0
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Ortiz-Rivera, Y., Sánchez-Vega, R., Gutiérrez-Méndez, N., León-Félix, J., AcostaMuñiz, C., and Sepulveda, D. R. (2017). Lactobacillus reuteriによる発酵乳製品におけるロイテリンの生産:病原菌、腐敗微生物、乳酸菌の阻害。日本酪農科学会誌 100, 4258-4268.
PubMed Abstract|RefRef Full Text|Google Scholar
Özçam, M., Oh, J.-H., Tocmo, R., Acharya, D., Zhang, S., Astmann, T. J., et al. 細胞壁アセチル化によって抑制される腸内共生生物において、二次代謝産物が種内拮抗を引き起こす。細胞宿主微生物 30, 824-835.e6. doi: 10.1016/j.chom.2022.03.033
パブコメ抄録|クロスリファレンス全文|Google Scholar
Özçam, M., Tocmo, R., Oh, J.-H., Afrazi, A., Mezrich, J. D., Roos, S., et al. 腸内共生細菌Lactobacillus reuteri R2lcおよび2010は、哺乳類アリール炭化水素受容体を活性化するポリケチド合成酵素クラスターをコードする。Appl. Environ. Microbiol. 85, e01661-e01618.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Paramsothy, S., Kamm, M. A., Kaakoush, N. O., Walsh, A. J., van den Bogaerde, J., Samuel, D., et al. 活動性潰瘍性大腸炎に対するマルチドナー集中糞便微生物叢移植:無作為化プラセボ対照試験。Lancet 389, 1218-1228. doi: 10.1016/S0140-6736(17)30182-4.
クロスレフ・フルテキスト|Google Scholar
Paramsothy, S., Nielsen, S., Kamm, M. A., Deshpande, N. P., Faith, J. J., Clemente, J. C., et al. 潰瘍性大腸炎患者における糞便微生物叢移植に対する反応に関連する特異的細菌および代謝産物。Gastroenterology 156, 1440-1454.e2. doi: 10.1053/j.gastro.2018.12.001.
PubMed Abstract|RefRef Full Text|Google Scholar
Park, J.-S., Choi, J. W., Jhun, J., Kwon, J. Y., Lee, B.-I., Yang, C. W., et al. ラクトバチルス・アシドフィルスは、Th17およびTreg細胞バランスおよびフィブロシスの発生を制御することにより、急性大腸炎マウスモデルにおける腸炎を改善する。J. Med. Food 21, 215-224. doi: 10.1089/jmf.2017.3990.
クロスレフフルテキスト|Google Scholar
Roda, G., Jharap, B., Neeraj, N., and Colombel, J.-F. (2016). 抗TNFsに対する反応消失:定義、疫学、および管理。Clin. Transl. Gastroenterol. 7:e135. doi: 10.1038/ctg.2015.63
PubMedアブストラクト|クロスリーフフルテキスト|Google Scholar
Salminen,S.、Collado,M. C.、Endo,A.、Hill,C.、Lebeer,S.、Quigley,E. M. M.、他(2021)。ポストバイオティクスの定義と範囲に関する国際プロバイオティクス・プレバイオティクス科学協会(ISAPP)のコンセンサス・ステートメント。Nat. Rev. Gastroenterol. Hepatol. 18, 649-667.
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Sartor, R. B., and Wu, G. D. (2017). 炎症性腸疾患の発症における腸内細菌、ウイルス、真菌の役割と治療アプローチ。Gastroenterology 152, 327-339.e4. doi: 10.1053/j.gastro.2016.10.012
PubMedアブストラクト|クロスリファレンス全文|Google Scholar
Schirmer, M., Garner, A., Vlamakis, H., and Xavier, R. J. (2019). 炎症性腸疾患における微生物遺伝子と経路。Nat. Rev. Microbiol. 17, 497-511. doi: 10.1038/s41579-019-0213-6
PubMedアブストラクト|全文|Google Scholar
瀬戸山秀樹、今岡明宏、石川博之、梅崎泰弘 (2003). 潰瘍性大腸炎患者から分離されたバクテロイデス株とデキストラン硫酸処理したノトビオティックマウスにおけるビフィズス菌による腸炎予防効果。Microbes Infect. 5, 115-122. doi: 10.1016/S1286-4579(02)00080-1
PubMedアブストラクト|クロステキスト|Google Scholar
Silvestri, C., Pagano, E., Lacroix, S., Venneri, T., Cristiano, C., Calignano, A., et al. 魚油、カンナビジオールと腸内細菌叢:大腸炎のマウスモデルにおける調査。Front. Pharmacol. doi: 10.3389/fphar.2020.585096.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Slack, R. J., Macdonald, S. J. F., Roper, J. A., Jenkins, R. G., and Hatley, R. J. D. (2022). インテグリン阻害剤の新たな治療機会。Nat. Drug Discov. 21, 60-78. doi: 10.1038/s41573-021-00284-4
PubMedアブストラクト|全文|Google Scholar
Sun,M.、Liu,Y.、Song,Y.、Gao,Y.、Zhao,F.、Luo,Y.、他(2020)。ラクトバチルス・プランタラム-12の黄砂誘発マウス大腸炎に対する改善効果。Food Funct. 11, 5205-5222.
パブコメ要旨|全文|Google Scholar
Sun, M., Wu, W., Liu, Z., and Cong, Y. (2017). 微生物叢代謝産物短鎖脂肪酸、GPCR、および炎症性腸疾患。J. Gastroenterol. 52, 1-8. doi: 10.1007/s00535-016-1242-9
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
王暁(Wang, G., Huang, S., Cai, S., Yu, H., Wang, Y., Zeng, X., et al.) ラクトバチルス・ロイテリは、デキストラン硫酸ナトリウム誘発マウス大腸炎において、腸炎を改善し、腸内細菌叢と代謝障害を調節する。(株)日本ニュートリエンツ12:2298.doi: 10.3390/nu12082298.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
(2021)。ビフィズス菌の大腸炎緩和効果。デキストラン硫酸ナトリウム誘発大腸炎に対するビフィズス菌XLTG11の緩和効果。微生物 9:2093.
パブコメ抄録|全文|Google Scholar
Wang,C.、Xiao,Y.、Yu,L.、Tian,F.、Zhao,J.、Zhang,H.、他(2022)。リポ多糖誘発急性腸傷害に対するバクテロイデス属の異なる菌株の保護作用とその基盤となる機能遺伝子。J. Adv. このような背景のもと、Bacteroides vulgatus株のリポポリサッカライドによる急性腸管傷害に対する保護作用とその背景にある機能遺伝子について検討した。
パブコメ抄録|全文|Google Scholar
Weingarden, A. R., and Vaughn, B. P. (2017). 腸内細菌叢、糞便微生物叢移植、炎症性腸疾患。Gut Microbes 8, 238-252. doi: 10.1080/19490976.2017.1290757.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Xavier, R. J., and Podolsky, D. K. (2007). 炎症性腸疾患の病態解明。Nature 448, 427-434.
CrossRef 全文|Google Scholar
Xiao, P., Zhang, H., Zhang, Y., Zheng, M., Liu, R., Zhao, Y., et al. リン酸化酵素Shp2は、インターロイキン-10に対するマクロファージの応答性を阻害することにより、腸の炎症を悪化させる。J. Exp. Med. 216, 337-349.
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
Zhao, L., Tian, W., Qu, W., Li, T., Zhu, J., and Ma, H. (2021). プロテアーゼ加水分解物は、DSS誘発大腸炎マウスにおける炎症および腸内細菌叢の不均衡を改善する。J. Food Qual. doi: 10.1155/2021/5536148.
クロスレフフルテキスト|Google Scholar
Zhu、J.、Liao、M.、Yao、Z.、Liang、W.、Li、Q.、Liu、J.、他(2018)。閉経後女性の乳がんは、腸内メタゲノム変化と関連している。doi: 10.1186/s40168-018-0515-3
PubMedアブストラクト|RefRefフルテキスト|Google Scholar
キーワード:炎症性腸疾患、プラトーピカ糞便、糞便微生物叢移植、腸内細菌叢、大腸炎マウスモデル
引用 大腸炎モデルマウスにおいて、プラトーピカ糞便微生物叢移植は炎症性腸疾患の症状を改善する。Front. Microbiol. 14:1228778.
受理された: 2023年5月26日;受理:2023年8月21日;
発行:2023年9月19日
編集者
Xiaodan Huang, 蘭州大学, 中国
査読者
Na Zhao, 中国科学院(CAS), 中国
Jing Yang, 中国・国家伝染病予防研究所(中国CDC
Copyright © 2023 Yang, Cui, Lv, Lu, Shen, Feng, Ding, Dong and Wang. これはクリエイティブ・コモンズ表示ライセンス(CC BY)の条件の下で配布されるオープンアクセス論文です。原著者および著作権者のクレジットを明記し、学術的に認められている慣行に従って本誌の原著を引用することを条件に、他のフォーラムでの使用、配布、複製を許可する。これらの条件に従わない使用、配布、複製は許可されない。
*通信: Xuezhi Ding, dingxuezhi@caas.cn; Pengcheng Dong, dongpengceng@caas.cn; Yu Wang, wangyu02@caas.cn.
これらの著者は本研究に等しく貢献している。
免責事項:本論文で表明されたすべての主張は、あくまで著者個人のものであり、必ずしも所属団体や出版社、編集者、査読者の主張を代表するものではない。本記事で評価される可能性のあるいかなる製品、またはその製造元が主張する可能性のあるいかなる主張も、出版社によって保証または支持されるものではありません。
こんな人も見ています
アルカリアルギニンはNADH濃度とプロトン起電力を増加させることにより、薬剤耐性サルモネラのゲンタマイシン媒介殺傷を促進する
Chunyang Zhu, Yanhong Zhou, Jian Kang, Heng Yang, Jinglin Lin and Binghu Fang
鉄-ファー複合体はCyclo-(Phe-Pro)-シグナル制御経路の構成要素の発現を抑制する
Keun-Woo Lee, Soyee Kim, Sora Lee, Minjeong Kim, Suji Song and Kun-Soo Kim
重金属を含む廃水処理のための微生物燃料電池における生物学的カソード利用に関する研究の進展
王輝、崔鵬祥、龍錫子、馬江宏、李玉、劉博、徐志強
Saccharomyces cerevisiae boulardiiは腸内細菌叢の成熟を促進し、新生仔牛の分泌性IgA産生増加と相関する
Lautaro Rostoll Cangiano、Clothilde Villot、Rocio Amorin-Hegedus、Nilusha Malmuthuge、Robert Gruninger、Le Luo Guan、Michael Steele
植物タンニンの生物学的機能と動物健康への応用
トン・ジェンカイ、何文峰、シャオ・ファン、グオ・アイウェイ
フッター
ガイドライン
探索
アウトリーチ
コネクト
フォローする
© 2023 Frontiers Media S.A. 無断複写・転載を禁じます。
プライバシーポリシー
|
利用規約
この記事が気に入ったらサポートをしてみませんか?
