
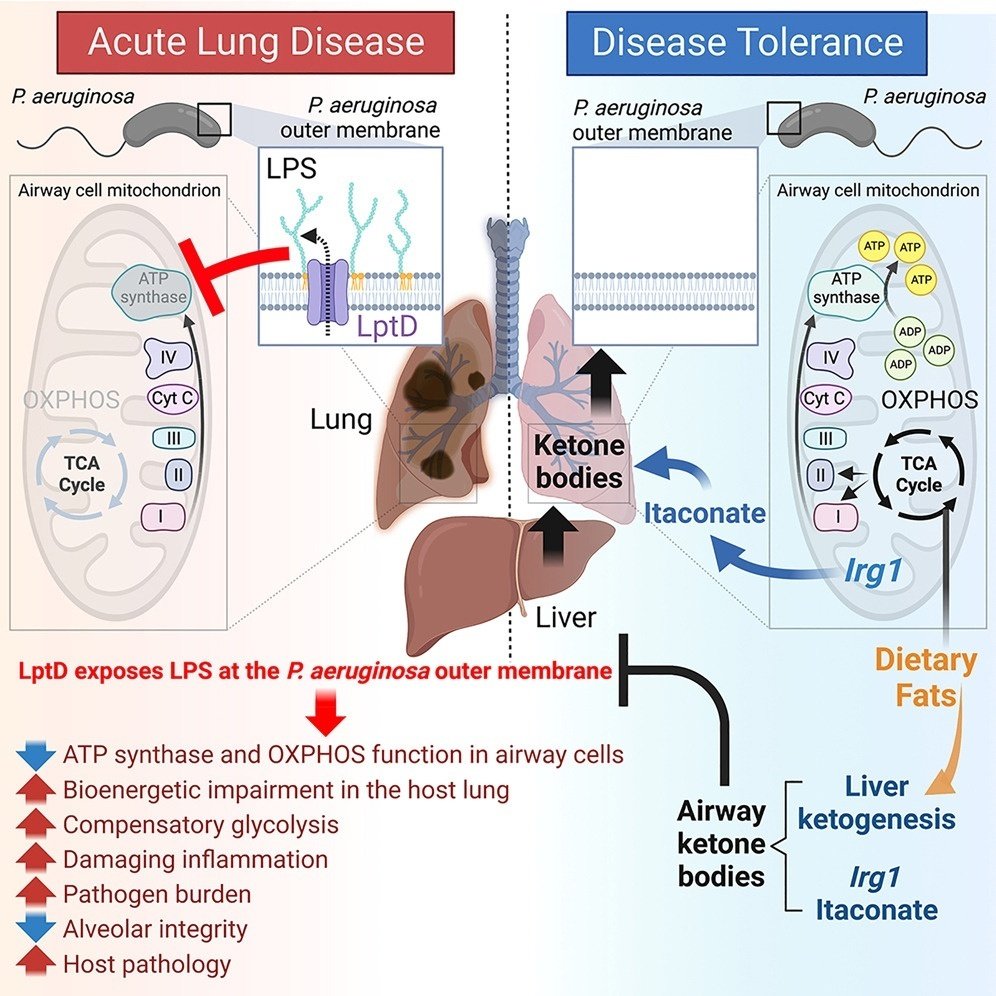
ケトジェネシスは緑膿菌肺感染に対する耐性を促進する
本文へスキップ記事へスキップ
エルゼビアロゴ
細胞代謝
35巻 10号 2023年10月3日 1767-1781.e6ページ
論文
ケトジェネシスは緑膿菌肺感染に対する耐性を促進する
https://www.sciencedirect.com/science/article/pii/S1550413123003327
著者リンク オーバーレイパネルを開くKira L. Tomlinson 1, Ying-Tsun Chen 1, Alex Junker 1, AndreaCarola Urso 1, Tania Wong Fok Lung 1, Danielle Ahn 1, Casey E. Hofstaedter 2, Swikrity U. Baskota 3, Robert K. Ernst 2, Alice Prince 1, Sebastián A. Riquelme 1 4
もっと見る
概要
シェア
引用
https://doi.org/10.1016/j.cmet.2023.09.001
権利とコンテンツの取得
クリエイティブ・コモンズ・ライセンス
オープンアクセス
ハイライト
緑膿菌表面LPSは気道細胞のATP合成酵素機能を阻害する
この生体エネルギー障害は有害な炎症と肺胞障害を引き起こす
宿主はケトジェネシスをアップレギュレートすることで、ATP合成酵素阻害に反応する。
ケトン体は緑膿菌LPSの形成を抑制し、有害な炎症を抑える。
まとめ
緑膿菌は肺感染症の一般的な原因である。グラム陰性病原体である緑膿菌は、活発で非常に破壊的な炎症反応を引き起こすが、ほとんどの宿主は細菌負荷に耐性となり、慢性感染を発症する。我々は、マウス肺炎モデルを用いて、この炎症から耐病性への移行がケトジェネシスによって促進されることを証明した。肺感染に応答して、ケトン体は肝臓で生成され、肺に循環し、そこで表面リポ多糖(LPS)を示さない緑膿菌株を選択する。このようなケトン体に適応したLPS株は、解糖や組織にダメージを与えるサイトカインを活性化せず、代わりに脂肪のミトコンドリア異化と酸化的リン酸化(OXPHOS)を促進し、気道の恒常性を維持する。肺内では、緑膿菌は宿主の免疫代謝産物であるイタコン酸を悪用して、ケトジェネシスをさらに刺激する。このような環境は、宿主と緑膿菌の共存を可能にし、緑膿菌の病態適応的変化とOXPHOSによる呼吸器系の健全性維持の両方を支えている。
グラフィカル抄録
ダウンロード 高解像度画像ダウンロード(306KB)
ダウンロード フルサイズ画像のダウンロード
前の記事次の記事
キーワード
耐病性ケトジェン性健食OXPHOS生体エネルギー緑膿菌肺炎感染症タコン酸炎症
はじめに
緑膿菌は、強力な毒素やプロテアーゼの発現によって肺の実質的な破壊をもたらす急性の炎症性感染症に関連する肺病原体として恐れられている1。しかし、より一般的には、嚢胞性線維症(CF)2,3、気管支拡張症4,5、慢性閉塞性肺疾患6,7、原発性毛様体ジスキネジア8,9の患者において、基礎的な免疫機能障害を伴わない持続感染を伴う。これらの患者は、感染に対する寛容を獲得する。これは、感染因子に対する炎症反応を制限することにより、感染組織の損傷を制御する進化的に保存された防御戦略であり、疾患寛容としても知られている10,11,12。炎症を抑えることにより、感染に対する寛容は臓器機能を維持するだけでなく、病原体と宿主の共存を可能にする。
通常、肺の恒常性を維持する生理学的プロセスは、主に酸化的リン酸化(OXPHOS)によって維持されている13,14,15。OXPHOSはミトコンドリアでATPを産生するが、このプロセスは通常、食事から摂取される脂肪を燃料としている16,17。OXPHOSによって供給されるエネルギーは、気道細胞の生存能力を支えるだけでなく、ガス交換、気道粘液クリアランス、界面活性剤の産生など、正常な肺機能に不可欠な多くのプロセスを促進する。23,25この急性炎症は肺の完全性を損ない、制御されないと致命的となる可能性がある。29,30。したがって、肺感染に耐性のある宿主は、肺の完全性を守るために、OXPHOS、解糖、ケトン体生成、炎症のバランスを厳密に制御しなければならない。
細菌もまた気道の生体エネルギー構成に適応しなければならない。寛容な被験者の肺から分離された緑膿菌の臨床分離株は、多くのLPSの変化を示しており3,31、特に不活性化lptD変異が多い32。このような良好な環境では、緑膿菌は局所のマイクロバイオーム内に生着する個別の群集として持続するように進化する2,3,4,5,6,7,36,37。慢性感染患者由来の緑膿菌株で観察される適応的な変化は、肺の完全性を維持する生体エネルギーの設定と同期していなければならない: OXPHOSである。
ここで我々は、緑膿菌肺感染に対する耐性が、気道細胞におけるOXPHOSの維持と密接に関連していることを立証した。我々は、感染した寛容な宿主が、脂肪代謝によって肺のOXPHOSに燃料を供給することで、解糖と気道にダメージを与えるサイトカインの放出を抑制することを証明した。ケトジェネシスと局所の免疫代謝産物により、LPSの発現が制限され、耐性環境を維持する能力が向上した緑膿菌株が選択される。このような環境は、呼吸器の完全性を守るだけでなく、病原体の生存を促進し、感染に対する耐性の特徴である宿主と緑膿菌の共存を可能にする。
結果
緑膿菌表面LPSは、ATP合成酵素の枯渇を介して気道OXPHOS障害を引き起こす
緑膿菌PAO1のLptD変異体(ΔlptD PAO1)32,38を用いて、外膜に固定されたLPSが肺OXPHOS機能障害を引き起こすことを示した。ΔlptD PAO1(コロニー形成単位[CFUs]約106個;図S1A)に暴露されたマウスとは対照的に、野生型(WT)PAO1に感染した動物の肺タンパク質抽出物は、ATPを生成するOXPHOS装置であるATP合成酵素(複合体Vとしても知られる)の主要構成要素であるATP5Aの枯渇を示した39(図1A)。Sdhb(複合体II:コハク酸デヒドロゲナーゼ)やMtco1(複合体IV:シトクロムcオキシダーゼ)40,41など、OXPHOSに関与する他のミトコンドリア複合体には大きな変化は見られなかった(図1A)。予想されたように、緑膿菌表面LPSに反応したATP合成酵素の枯渇は、解糖などの代償経路の活性化と相関し、解糖促進酵素ヘキソキナーゼ2(HK2)42の発現の増大(図1A)および気管支肺胞洗浄(BAL)液中のグルコース濃度の上昇(図1B)によって示された。
ダウンロード 高解像度画像ダウンロード(693KB)
ダウンロード フルサイズ画像のダウンロード
図1. 緑膿菌LPSディスプレイは肺ATP合成酵素を阻害する
マウスをPBS、WT PAO1、またはΔlptD PAO1で処理した。
(AおよびB)以下を測定した:(A)肺のOXPHOS(ATP5A、MTCO1、SDHB)および解糖(HK2);(B)BALグルコース。
(C)Biologプレートを介したWTおよびΔlptD PAO1におけるNADHおよびFADH2の存在量。
(D)コハク酸リッチ最小培地におけるWTおよびΔlptD PAO1の増殖。
(E)PBS、WT PAO1、またはΔlptD PAO1に暴露したマウスにおける肺ATP5Aの発現。ATP5/β-アクチン比を示す。
(FおよびG)BDMDs酸素消費率(OCR)。
データは2-3回の独立した実験の平均±SEMで示す。
(B)-(C):スチューデントのt検定。(D)、(F)、(G):二元配置ANOVA。∗:p<0.05;∗:p<0.01;∗∗:p<0.0001;ns:有意でない。
データS1も参照。
我々は、緑膿菌表面LPSが病原体負荷を介してATP合成酵素の肺枯渇を引き起こすことを見出した。ΔlptD変異体と比較して、WT PAO1株はコハク酸とその前駆体α-ケトグルタル酸43から生成されるプロATP NADHおよびFADH2中間体をより容易に消費した(図1C)。この生物エネルギー効率の増加は、コハク酸での緑膿菌のバイオマス生成を増大させた(図1D)。宿主気道におけるΔlptD PAO1負荷を増幅するために、マウスをこの菌株の増加する接種量に曝した。低用量(例えば約105 CFU)では、ΔlptD PAO1はATP合成酵素の構成成分であるATP5Aの実質的な枯渇を引き起こさなかったが、高用量(例えば約106 CFU以上)ではATP5Aの枯渇を引き起こした(図1E)。
我々はこれらの所見をin vitroで確認した。骨髄由来マクロファージ(BMDM)を、PBS、あるいはWT PAO1またはΔlptD PAO1の同程度の接種量のいずれかに曝露し、シーホース(Seahorse)技術を用いてOXPHOS反応を解析した。ΔlptD PAO1を投与したBMDMと比較すると、WT PAO1に暴露した細胞は酸素消費率(OCR)が高く(図1F)、これはLPS刺激によるミトコンドリアOXPHOS障害の特徴である32,44,45(図1G)。しかし、PBSで処理したBMDMと比較すると、いずれの病原体に曝露した細胞も、アッセイ期間を通じて有意に高いOCRを示したことから(図1F)、緑膿菌LptDがLPSの発現と細菌負荷の両方を介して宿主のOXPHOS阻害を引き起こすという考えが支持された。
緑膿菌による宿主ATP合成酵素の阻害は有害な炎症を引き起こす
我々は、急性肺炎モデルにおいて、緑膿菌が宿主のATP合成酵素を阻害することによる有害な結果を確認した。約105 CFUのWT PAO1に感染させる前に、ATP合成酵素の特異的阻害剤であるオリゴマイシン(約0.2 mg/kg)を亜致死量投与した46。オリゴマイシンは、IL-1βと腫瘍壊死因子α(TNFα)の蓄積を増幅し(図2A)、組織損傷に関連するサイトカインを増加させ、WT PAO1の負荷を増加させた(図2B)。宿主のミトコンドリア生体エネルギーの遮断が感染時の肺炎症ストレスを悪化させることをさらに証明するために、宿主のATP合成酵素活性を促進するOXPHOSの上流経路である脂肪酸β酸化(FAO)を遮断した47。FAOは、トランスポーターCpt1aによってミトコンドリア内に輸送された脂肪酸を代謝する47。次いで、これらの輸送された代謝物はβ酸化され、OXPHOSとATP合成酵素機能の燃料となるトリカルボン酸(TCA)サイクルに入る中間体を生成する。宿主のFAOを阻害するために、特異的なCpt1a遮断剤であるエトモキシルでマウスを処理した48。コントロールとは対照的に、エトモキシルで処理し、WT PAO1に感染させたマウスは、IL-6とTNFαのレベルが有意に高く(図2C)、細菌負荷が増加した(図2D)。同様の所見はΔlptD PAO1に暴露された動物でも観察され(図2Eおよび2F)、宿主のATP合成酵素に燃料を供給する経路の障害が気道疾患を強めることが確認された。
ダウンロード 高解像度画像ダウンロード(986KB)
ダウンロード フルサイズ画像のダウンロード
図2. 宿主のOXPHOS障害は肺の炎症と緑膿菌の負荷を悪化させる。
(AおよびB)マウスにビヒクルまたはオリゴマイシン(ATP合成酵素阻害剤)を投与し、PBSまたはWT PAO1に曝露した。以下が分析された:(A)BALサイトカイン、(B)BALおよび肺における細菌負荷。動物はビヒクルまたはエトモキシル(FAOブロッカー)で処理され、PBS、WT PAO1、またはΔlptD PAO1に曝露された。
(C-F)以下を調べた:(C)WT PAO1のBALサイトカイン;(D)WT PAO1のBALおよび肺における細菌負荷;(E)ΔlptD PAO1のBALサイトカイン;および(F)ΔlptD PAO1のBALおよび肺における細菌負荷。
データは2-3回の独立実験±SEM、合計4-7匹のマウスの平均値として示した。
(A)-(F): 一元配置分散分析。∗はp<0.05;**はp<0.01;nsは非有意。
図S1およびデータS1も参照。
宿主のATP合成酵素干渉の間に産生されたサイトカインが、肺の完全性を悪化させる炎症性フィードバックループを引き起こすことが観察された。IL-1βを介したシグナル伝達ができないIl1r-/-マウスと比較して、WT PAO1に暴露されたIl1r+/+動物は、IL-6(約2.7倍)とTNFα(約1. 8倍)(図S1B)、BAL中の細菌負荷が増大し(約27倍)(図S1C)、血管バリア損傷の指標である気道液中へのアルブミン漏出が大きかった(図S1D)49,50。これらの所見は、WT株とΔlptD PAO1株を用いてさらに裏付けられた(図S1E~S1G)。
耐性宿主由来の緑膿菌株は肺炎の間、肺のOXPHOSを維持する
次に、寛容な宿主から分離された緑膿菌の臨床株が、実際に宿主のOXPHOSを維持しているかどうか、そしてそれがLptDの抑制と関連しているかどうかを調べた。その結果、集中治療室(ICU)にいる13人の被験者の気道から分離された緑膿菌株の約85%が、WT PAO1とは対照的に、lptDのmRNA発現が大幅に低下していることがわかった(図3A)。同様の所見は、2人の慢性CF感染者(CF#1およびCF#2)の肺から分離された緑膿菌の縦断的コレクションでも観察された。CF#1から分離された14株の緑膿菌株を解析した結果、感染の進行段階において、これらの病原体の100%がlptDの低発現を示した(図3B、左)。CF#2の緑膿菌17株を調べたところ、lptDの発現はゼロであった(図3B、右)。これらのデータから、緑膿菌感染に対する耐性とLptD阻害の関連性が確認された。
ダウンロード 高解像度画像ダウンロード(2MB)
ダウンロード フルサイズ画像のダウンロード
図3. 緑膿菌分離株は気道OXPHOSを維持し、宿主と病原体の共存を可能にする。
(AおよびB)緑膿菌株におけるLptD mRNAレベル:(A)ICU患者13人および(B)CF寛容者。CF#1:14株、CF#2:17株。動物は、PBS、WT PAO1、またはCF#2から分離された17株の緑膿菌の混合物に曝露された。
(C-I)以下を解析した:(C)肺におけるOXPHOS(ATP5A、MTCO1、SDHB)および解糖(HK2);(D)scRNA-seqによって同定された肺細胞サブセット;(E)および(F)各病原体に反応した肺集団ごとのΔOXPHOSトランスクリプトームスコア;(G)マウスの生存率;(H)BALサイトカイン;および(I)肺およびBALにおける細菌負荷(黒十字はすべての動物が死亡したことを示す)。
(JおよびK)緑膿菌単離株の約106または約107CFUに曝露した後、亜致死量(J)または致死量(K)のオリゴマイシンで処理した動物の生存率。WTおよびΔlptD PAO1についても調べた。
(L)コハク酸の増加における細菌の終点増殖。
データは平均±SEMで示す。
(C)-(I): 2-3回の独立実験、合計3-7匹。
(J)と(K): 2つの独立した実験、合計5匹のマウス。(I)と(L):二元配置ANOVA;(G)、(J)、(K): Kaplan-Maier;(H):一元配置分散分析。∗:p<0.05;∗:p<0.01;∗:p<0.001;∗:p<0.0001;ns:有意でない。
図S1とS2、表S1とS2、データS1も参照。
次に、耐性被験者の肺から分離した緑膿菌が、肺ATP合成酵素にどのような影響を与えるかを解析した。WTのPAO1に曝露した動物と比較して、CF#2から分離された17株の混合物(以下、「緑膿菌分離株」と呼ぶ)に感染したマウス(図3B、右;図S1H)は、肺組織におけるATP5Aの発現を維持した(図3C)。これらはミトコンドリア複合体IIおよびIVにいかなる変化も引き起こさず、HK2を介した炎症性解糖代謝を増加させなかった(図3C)。
細菌感染のストレスが細胞レベルでミトコンドリアの生体エネルギーにどのような影響を与えるかをよりよく理解するために、PBS、WT PAO1、緑膿菌分離株のいずれかに暴露した動物の全肺組織の単一細胞RNA配列決定(single-cell RNA-sequencing:scRNA-sequq)を行った。特に、免疫細胞集団と間質細胞集団における生体エネルギーの変化を明らかにすることに関心があった。統合されたscRNA-seqデータの最初のクラスタリングにより、肺胞マクロファージ、1型および2型肺細胞、繊毛細胞、線維芽細胞、血管および毛細血管内皮細胞などの気道内腔と直接接触している細胞と、中皮細胞や平滑筋細胞などの気道に直接露出していない細胞を含む、特徴的なトランスクリプトームシグネチャーを持つ23の集団が同定された(図3D、S1I、S1J、表S1)。ATP合成酵素や電子伝達鎖(ETC)の複合体I~IVなど、この経路に関連する171遺伝子を用いて、すべての細胞についてOXPHOSスコアを計算した(表S2)51。次に、感染していないPBS処理マウスと比較したΔOXPHOSスコアを計算し、ボルケーノプロットを作成して、各細胞クラスターにおいて、緑膿菌株の違いがこの生体エネルギー経路にどのような影響を与えたかを視覚化した。予想されたように、WT PAO1は、緑膿菌分離株ではなく、主要な呼吸細胞におけるOXPHOSを著しく阻害した。WT PAO1は同定された23個体群のうち13個体群(約57%)でOXPHOSを抑制したが(図3E)、緑膿菌分離株は5個体群(約22%)でしかOXPHOSのダウンレギュレーションを起こさなかった(図3F)。WT PAO1感染マウスで最も大きな影響を受けた細胞集団のひとつは肺胞マクロファージで、次いで2型肺細胞、血管、毛細血管内皮細胞など、肺ガス交換と界面活性剤産生を維持するのに必要な細胞集団が続いた13(図3E)。逆に、緑膿菌分離株はこれらの細胞サブセットのOXPHOSを損なわなかった(図3F)。その代わりに、緑膿菌分離株は、末梢血好中球、顆粒球、および制御性骨髄系細胞を含む、リクルートされた食細胞におけるOXPHOSを損なった(影響を受けた細胞の約60%)ことから、緑膿菌分離株は、常在呼吸細胞の生体エネルギー恒常性を維持することが示された。
宿主のATP合成酵素機能の維持が疾患耐性を可能にする
WTのPAO1とは対照的に、臨床株は致死的でなく(図3G)、炎症を抑え(図3H)、低体温を抑制し(図S2A)、血管機能障害を抑制した(図S2B)。この分離株は、24時間後にはWT PAO1よりも病原体負荷が約10倍低く、これは宿主と病原体の共存が長く続くことと相関していた(図3Iおよび3G)。
我々は、緑膿菌分離株による感染に対する寛容応答は、ATP合成酵素の機能が維持されることによって可能になると仮定した。臨床株に感染し、亜致死量のATP合成酵素阻害剤オリゴマイシン(約0.2 mg/kg)を投与したマウスと比較すると(図3J)、同じ接種量でより高用量のオリゴマイシン(約1. 0mg/kg)で処理した宿主は、低体温(図S2C)および死亡(図3K)を含む疾病を急速に発症した。このことは、これらの臨床病原体に感染している間、宿主にとって機能的なOXPHOSを維持することが重要であることを示している。緑膿菌分離株によって生じた緩慢な感染は、ΔlptD PAO1によって引き起こされた疾患によりよく似ていた(図3K)。実際、この変異体で観察されたように(図1D)、臨床株はWT PAO1ほど増殖に成功しておらず(図3L)、これらの生物に対する耐性が病原体負荷の軽減と関連している可能性が示唆された。緑膿菌分離株の接種量を10倍(約107 CFU)に増やしてin vivoモデルで病原体バイオマスを増加させたところ、低体温と死亡によって示される病気がより多く観察された(図S2Dと3K)。このように、緑膿菌分離株に対する耐性反応は、宿主のATP合成酵素の維持によって支えられている。
緑膿菌分離株は、食餌性脂肪の異化を介して気道細胞のエネルギー生成を促進する。
肺ATP合成酵素を刺激し、気道の炎症を緩和するために、緑膿菌分離株は宿主の脂肪の異化を可能にすると仮定した。16,17。臨床病原体に感染している間、宿主による食餌性脂肪の異化は、肺へのグルコースの動員を妨げ、解糖に依存するサイトカインの合成を制限する。肺ATP合成酵素を枯渇させるWT PAO1感染では、その逆のことが起こる。食餌性脂肪は肺ミトコンドリアでのエネルギー生産に燃料を供給できず、代償的な解糖とサイトカイン放出を促す。
食餌によってOXPHOSを刺激するために、脂肪酸が豊富で糖質が少ない食餌(脂肪酸:約89%;糖質:約0.1%;タンパク質:約10%)を1週間マウスに自由摂取させた。コントロールとして、脂肪酸が少なく炭水化物が豊富な摂取(脂肪酸:約10%;炭水化物:約80%;タンパク質:約10%)を用いたところ、脂肪酸が豊富な食事と同様の動物体重が誘導された(図S3A)。次に、これらのマウスをWT PAO1あるいは緑膿菌分離株のいずれかに暴露した。予想されたように、脂肪酸を与えた宿主の気道グルコースレベルは、病原体が宿主のATP合成酵素を保存する能力によって変化した。WT PAO1感染では、BALの糖質レベルが有意に増加したが、緑膿菌分離株感染ではその逆であった(図4A)。気道グルコース量の差は、病原体負荷(図4Bおよび4C)や血糖値(図4D)の変動によるものではなかったことから、気道グルコース濃度は緑膿菌が宿主のOXPHOSを維持する能力に依存していることが確認された。
ダウンロード 高解像度画像のダウンロード(3MB)
ダウンロード フルサイズ画像のダウンロード
図4. 食餌脂肪は緑膿菌肺感染に対する宿主の耐性を調節する
脂肪酸リッチ(F. Acids)または炭水化物リッチ(Carbs)のいずれかの飼料を与えたマウスを、PBS、WT PAO1、ΔlptD PAO1、または緑膿菌分離株に曝露した。A)BALグルコース;(B)および(C)細菌負荷;(D)血糖;(E)-(G)BALサイトカイン濃縮;(H)血中BHB(明周期の開始);(I)および(J)BALおよび肺における食細胞の動員;(K)肺H&E;(L)および(M)体温;(N)および(O)動物の生存。
データは2~3回の独立したアッセイ、合計4~8匹のマウスによるもので、平均±SEMで示した。
(A)-(D)、(H)-(J):一元配置分散分析。(L)と(M):二元配置分散分析。(N)と(O): Kaplan-Maier。(E)-(G): Studentのt検定。∗:p<0.05;∗:p<0.01;∗:p<0.001;ns:有意でない。
図S3およびデータS1も参照。
IL-1β、IL-1α、TNFα、MIP-1α、MIP-1β、リポ多糖誘発CXCケモカイン(LIX)、活性化制御型正常T細胞発現・分泌型(RANTES)、モノカイン誘発γインターフェロン(MIG)などである(図4E)。逆に、緑膿菌分離株の感染時には、宿主の脂肪摂取時の気道グルコースレベルの低下により、TNFα、MIP-1β、IL-6、IL-12p70、G-CSFなどの主要サイトカインの産生が制限された(図4F)。
ΔlptD PAO1株を用いて、脂肪摂取マウスの気道におけるグルコース存在量とサイトカイン放出が、肺ATP合成酵素の維持によって調節されることを確認した。対照食を与えた動物に比べ、脂肪酸を多く摂取しΔlptD PAO1に暴露した動物は、気道のグルコース(図4Aおよび4D)およびIL-17、MCP-1、MIP-2、IL-6、ケラチノサイト化学誘引物質(KC)17,23,25,53,54を含むサイトカインの減少を示した(図4G)。この栄養学的アプローチは、緑膿菌感染中の宿主ATP合成酵素の保存が、脂肪の異化を介した気道エネルギー生成だけでなく、炎症性解糖を制限するためにも中心的であることを示している。
食餌性脂肪によって誘導されるケトジェネシスは、緑膿菌肺炎中の炎症性疾患を制限する。
我々が用いた脂肪酸が豊富で糖質の少ない食事は、β-ヒドロキシ酪酸(BHB)などのケトン体の生成を促す「ケトジェニック食」である29,55。ケトン体は、末梢組織におけるOXPHOSを刺激するだけでなく、骨髄細胞のリクルート56,57や低体温などの炎症性疾患に関連する経路も抑制する28。我々は、緑膿菌分離株とWT PAO1の両方に感染している間、ケトジェニック食が全身のBHBレベルを有意に増加させることを観察した(図4H)。緑膿菌分離株の感染中、この食事はBAL中の単球レベルと肺中の好中球レベルを減少させた(図4IおよびS3B)。WT PAO1感染では、BAL単球が有意に減少した(図4JおよびS3C)。免疫細胞の動員におけるこの減少を確認するために、ヘマトキシリン-エオシン(H&E)染色した肺切片を分析した。ケトジェニック食は、WT PAO1感染時の血管周囲(図4K、黒矢印)および肺胞周囲(図4K、青矢印)における骨髄細胞の蓄積を軽減した。この貪食負担の軽減は肺水腫の減少と相関していた(図4K、青矢印)。同様の所見は緑膿菌分離株の感染時にも観察された(図4K、黒/青矢印)。
肺への貪食細胞流入の抑制に加えて、ケトジェニック食は両病原菌による肺炎の初期時点において宿主の体温を維持することがわかった(図4Lおよび4M)。しかし、WT PAO1に感染した動物は依然として高い死亡率を示したことから、体温調節の利点は緑膿菌のヒト肺への適応の程度に依存していた(図4Nおよび4O)。
ケトン体は宿主ATP合成酵素の阻害に反応して気道に動員される
OXPHOSの燃料となり肺の炎症を抑制するケトン体の重要性を考慮し、緑膿菌肺炎に反応して宿主がどのようにこれらの代謝物を産生するかを評価した。通常の餌を与えた動物は、緑膿菌の気道感染に反応して、肝ケトン生成の代用物質であるBHBの血中への放出を著しく増加させた29。しかし、WTまたはΔlptD PAO1に感染した動物は、食物の消費量(図S4A)、血糖値(図S4B)、体重減少(図S4C)および肝臓の病原体負荷(図S4D)が同程度であったことから、LptDは別の経路でケトン体放出を刺激したことが示された。LptDが肝BHB産生を誘導するもう一つのメカニズムは、LPSが循環に入り、全身的にATP合成酵素活性に影響を与えることである58。LptDによって細菌表面に輸送された後、LPSは遊離分子または小胞の一部として排出され、59,60,61感染者の気道に蓄積する62,63。この可溶性LPSは血流に移行し、62,63 肝細胞を含む多くの組織に影響を及ぼす可能性がある。緑膿菌LptD-LPS軸が宿主ATP合成酵素の遮断を介して肝ケトジェネシスを誘発するかどうかを調べるために、亜致死量のオリゴマイシンをマウスに投与した。予想通り、ATP合成酵素阻害剤に暴露された動物はBHBの血中濃度が上昇し(図S4E)、WT PAO1感染時の肝ケト生成の増加がLPSによる生体エネルギー障害に反応していることが確認された。
ダウンロード 高解像度画像ダウンロード(2MB)
ダウンロード フルサイズ画像のダウンロード
図5. 気道ケトン体は緑膿菌LPS経路適応を促進する。
(A-D)マウスをPBS、WT PAO1、またはΔlptD PAO1に曝露した。(A)血液中のBHB、(B)-(D)BAL中のBHBとAcAcの量。(D)では、Kyoto Encyclopedia of Genes and Genomes (KEGG)プラットフォームをデータベースとして用い、Metaboloanalyst 5.0を用いてパスウェイ濃縮解析を行った。
(E)HCおよびCF患者の喀痰中のケトン体。
(F-H)各緑膿菌分離株で見つかったLPS生合成に関連する経路の非同義変異(NSM)の数。
(I)LPSアセンブリー遺伝子のmRNAレベル。WT PAO1をグルコースに富む最小培地で培養し、AcAc、BHB、または両方のケトンで補完した。
(J-L)以下を測定した:(J)LPSアセンブリーに関与する遺伝子クラスターのmRNAレベル;(K)MALDI-TOFによる脂質Aのリン酸化;および(L)O-抗原の存在量。
データは2~3回の独立したアッセイによる平均±SEMで示す。
(A)-(D):各群合計5-6匹。(A)-(C)および(J):一元配置分散分析。(D)と(E):Studentのt検定: ∗:p<0.05;∗:p<0.01;∗∗:p<0.001;∗∗:p<0.0001;ns:有意でない。
図S4およびデータS1も参照。
我々は、肝性ケトン体が感染気道に蓄積することを発見した。BAL代謝物の不偏パスウェイ濃縮解析では、ΔlptD PAO1曝露動物と比較して、BHBとアセト酢酸(AcAc)を含むケトン体が、WT PAO1感染マウスの気道で最も有意に増加した代謝物であることが示された(図5B-5D)。このケトン体の蓄積は、宿主のATP合成酵素活性の遮断によって促進された。オリゴマイシンで処置した動物も、BAL液中のケトン体のレベルがより高かったからである(図S4F)。
耐性宿主の肺にケトン体が蓄積しているかどうかを調べるため、CF患者の気道液中のケトン体を定量化した2,3。これらの患者は、緑膿菌を含む様々な病原体による長期的なコロニー形成を示した(図S4G)。健常対照群(HC)と比較して、CF患者の喀痰は有意に高いレベルのBHBを示し(図5E)、ケトン体が耐性患者の気道に蓄積していることが確認された。
ケトン体は、LPSの会合とLptDを介した細菌表面への輸送を阻害する。
気道におけるケトン体の蓄積は、細菌にとって代謝のプレッシャーとなる。我々は、耐性者から分離された緑膿菌のLPS機構における適応的な変化は、気道に濃縮されたケトン体に対応したものであると仮定した。LPSは、共有結合した2つのサブユニット、リピドAとO-抗原によって形成される64。O-抗原が病原体の最も身近な環境と相互作用する多糖シールドの役割を果たすのに対し、リピドAは外膜に埋め込むことで毒素を細菌表面に付着させる64。LPSを効率よく外膜に固定するために、リピドAは1′と4′の位置に、arnTを介したアラビノース分子やキナーゼlpxTを介したリン酸基などの「装飾」を必要とする。非同義変異(NSM)を同定したところ、arnTとlpxTの両遺伝子座が最も影響を受けており、それぞれ3個と2個のNSMを保有していた(図5F)。これらのNSMは、緑膿菌分離株におけるarnTおよびlpxT mRNA発現の低下と相関していた(図5I)。緑膿菌分離株では、O-抗原を合成し、脂質Aに共有結合させるために、多くの糖転移酵素とリガーゼが用いられている64。これらのルートで最も変異した遺伝子は、O-抗原を重合するWbpZとWbpX、および脂質Aに結合するWaaLで、それぞれ7個、2個、3個のNSMを持つことが観察された(図5Gと5H)。これらの遺伝的に不活性化されたクラスターのほとんどは、緑膿菌分離株でも転写が抑制されていた(図5I)。
我々は、WT PAO1をケトン体に暴露すると、LPSアセンブリー経路に変化が生じることを明らかにしたが、これは寛容な被験者の緑膿菌分離株で見られた適応的な変化と一致する。LPS産生を促進するグルコースリッチ最小培地64にAcAc、BHB、またはその両方を添加すると、WT PAO1が脂質Aの装飾に関与するarnT遺伝子座を発現する能力が著しく制限された(図5J)。これらのケトン体はまた、リピドAキナーゼlpxTの翻訳を抑制した(図5J)。このlpxTの機能低下は、MALDI-TOFによって確証され、m/z = 1526、m/z = 1542、m/z = 1696(図5K、赤矢印)の質量電荷比ピークが小さくなっていることが示され、これはlpxT活性低下の特徴であった65。同様に、WT PAO1をケトン類に暴露すると、O-抗原の合成が制限され(図5L)、脂質Aへの結合が阻害された。これらのLPS成分を共有結合するリガーゼ64であるWaaLは、AcAc、BHB、またはその両方の存在下で有意に減少した(図5J)。ケトジェニック圧はO-抗原の重合に関与する糖転移酵素であるWpbXとWbpZも抑制した(図5J)。このLPS集合体の障害はlptDの発現低下と対応していた(図5J)。
耐性のある人から分離された緑膿菌は、宿主の免疫代謝産物を利用して肺のケトン体を濃縮する。
緑膿菌に選択圧をかける可能性のある多くの代謝産物は、感染の経過とともに気道に蓄積する。免疫応答性遺伝子1(Irg1)により産生されるイタコン酸は、FAO66とLPSによる炎症に対する耐性を促進する主要な宿主免疫制御性カルボン酸である67,68,69,70。WTのPAO1ではなく、緑膿菌分離株による感染では、ケトン体がBAL液中でイタコン酸とともに最もアップレギュレートされた代謝産物としてクラスター化した(図S5AおよびS5B)ことから、これらの分離株はこの免疫代謝産物を利用してケトン体の濃縮と病態適応を促進している可能性が示唆された。
イタコン酸を産生できない動物(Irg1-/-)と対照動物(Irg1+/+)を用いて(図6A)、気道におけるBHBの蓄積は、緑膿菌分離株の感染時にはIrg1依存的であるが、WT PAO1には依存しないことを見出した(図6B)。このIrg1に関連したBHBの蓄積は、Irg1+/+マウスとIrg1-/-マウスの両方が同程度のBHB血中濃度を示したことから、全身ケトン体の増加によって引き起こされるものではなかった(図S5C)。実際、WT PAO1に曝露された宿主とは対照的に、緑膿菌分離株への感染は循環中のBHBの減少に関連しており(図S5D)、これは食物消費、低血糖、体重減少、および肝臓感染の違いとは無関係であった(図S5E〜S5H)。これらの結果から、耐性のある被験者の肺の菌株は、ケトン体を気道に濃縮することによってIrg1に応答することが確認された。
ダウンロード 高解像度画像ダウンロード(1MB)
ダウンロード フルサイズ画像のダウンロード
図6. イタコン酸は緑膿菌感染時に肺のケトン濃縮を促進する。
(A-L)Irg1+/+およびIrg1-/-マウスをPBS、WT PAO1、または緑膿菌分離株に曝露した。以下が測定された:(A)および(B)BAL代謝産物;(C)scRNA-seqによって同定された各肺細胞サブセットにおけるケトジェニックスクラスターのmRNA発現;(D)緑膿菌感染中の各肺細胞サブセットのΔケトジェニックスコア(「Irg1+/+」-「Irg1-/-」)のボルケーノプロット;(D)緑膿菌感染中の各肺細胞サブセットのΔケトジェニックスコア(「Irg1+/+」-「Irg1-/-」)のボルケーノプロット。緑膿菌分離株感染時の各肺細胞サブセットのΔケト生成スコア(「Irg1+/+」-「Irg1/-」)、(E)線維芽細胞におけるケト生成トランスクリプトームスコア、(F)線維芽細胞におけるケト生成クラスターの発現、(G)BAL FGF21、(H)-(I)緑膿菌分離株感染時の呼吸器病原体負荷、(J)動物生存率、(K)BALサイトカイン、および(L)体重変化。
データは2~3回の独立した実験(合計3~10匹)の平均±SEMで示した。
(A)、(B)、(E)、(G)-(I):一元配置分散分析、(L):二元配置分散分析、(D):スチューデントのt検定。(J): Kaplan-Maier。∗:p<0.05;∗:p<0.01;∗:p<0.001;∗:p<0.0001;ns:有意でない。
図S5とS6、表S2、データS1も参照。
イタコン酸は肺線維芽細胞におけるケトン生成遺伝子の発現変化を促進する
緑膿菌感染時のケトン代謝と一致する局所の調整を同定するために、各肺細胞集団におけるケトン生成遺伝子の発現を解析した。ケトン生成はHmgcs2によって制御されており、この経路の律速段階であり、ケトン生成細胞の同定に用いられている29,71。Hmgcs2はCpt1a、Ppara、Acat1、Hmgcl、Bdh1などの他のケトン生成遺伝子と協調して働き、AcAcとBHBの合成を促進する29。我々のscRNA-seq解析(図S6A)では、線維芽細胞、好塩基球、2型肺細胞、中皮細胞、および平滑筋細胞がHmgcs2を発現しており(図6C)、これらのサブセットにおけるケトン代謝が示唆された。PBSまたは緑膿菌単離株のいずれかに曝露したIrg1+/+マウスまたはIrg1-/-マウスのscRNA-seqデータを解析し、各細胞サブセットのケトジェニックスコアを算出した(表S2)。次に、Δケト生成スコア("Irg1+/+"-"Irg1-/-")を計算した。これらのスコアのボルケーノプロットは、緑膿菌分離株の感染中、Irg1シグナルが線維芽細胞におけるケトジェニック遺伝子の発現を有意に増加させることを示した(図6Dおよび6E)。このケトジェニックスコアの増加は、AcAcを生成するAcat1、Hmgcs2、およびHmgcl、ならびにAcAcをBHBに変換するBdh1の発現増加によって引き起こされた(図6F)29。しかし、WT PAO1感染中、線維芽細胞はIrg1とは無関係に、Hmgcs2、Cpt1a、およびBdh1を含む多くのケトジェニック遺伝子の発現低下を示した(図6Eおよび6F)。従って、寛容な被験者の肺で進化した緑膿菌分離株のみが、線維芽細胞におけるケトン生成遺伝子の発現を促進するためにイタコン酸を共用していた。
ケトジェネシスは、線維芽細胞増殖因子21(FGF21)によって促進される72,73。Irg1は、緑膿菌分離株の感染中に気道FGF21の蓄積を可能にしたが(図6G)、WT PAO1ではそうではなかった(図S6B)ことから、寛容環境におけるケトジェネシスに関連するイタコン酸と線維芽細胞経路の関連性が裏付けられた。
Irg1は緑膿菌肺感染時の疾患耐性を可能にする
ケトジェネシスを通じて緑膿菌の気道への適応を促進する役割を考えると、我々はイタコン酸が緑膿菌疾患に対する宿主の耐性を促進すると仮定した。Irg1-/-マウスと比較して、Irg1+/+動物は緑膿菌分離株の感染中に病原体負荷が増加した(図6Hおよび6I)。この細菌負荷の増加にもかかわらず、Irg1+/+マウスは、同一の動物生存率(図6J)、同程度のIL-1β、IL-6、およびTNFαレベル(図6K)、気道への同程度のアルブミン浸潤(図S6C)、および同等の体温調節(図S6D)によって証明されるように、より悪い炎症病態を示さなかった。Irg1シグナル伝達は、緑膿菌分離株の感染経過にわたって宿主の体重回復を改善した(図6L)。我々は、WT PAO1感染に対するIrg1の影響を調べた。イタコン酸は病原体負荷、IL-6、TNFα、またはアルブミン浸潤には影響しなかったが(図S6E-S6H)、IL-1β放出を抑制した(図S6I)。しかしながら、Irg1+/+マウスおよびIrg1-/-マウスの両方がWT PAO1感染に急速に屈服した(図S6J)ため、この炎症シグナル伝達の減弱は、免疫病理学を防ぐのに十分ではなかった。
考察
我々の知見は、ヒト肺における疾患耐性が、宿主と病原体の代謝リモデリングに基づく両側プロセスであることを強く示唆している。LPSを表面に持つ緑膿菌に感染すると、気道細胞はOXPHOSによるATP産生に失敗し、重篤な炎症と肺胞破壊を引き起こす。この有害な環境は病原体の負担を悪化させ、生体エネルギー障害を悪化させ、宿主の死滅を加速させる。緑膿菌LPSによって引き起こされるOXPHOSの阻害に反応して、肝細胞はケトン体を循環中に放出し、このケトン体が透過性の高い気道コンパートメントに入り込む。これらのケトン体は緑膿菌LPSの集合を制限し、気道細胞のOXPHOS機能に適合する代謝活性の低い株を選択する。このようなケトン体に適応した緑膿菌株は、炎症性メディエーターの産生を制限し、肺胞の緊張を守り、宿主の生存期間を延長する。このような良好な環境において、緑膿菌は局所の免疫代謝産物を利用してケトン体量を維持し、細菌の適応、宿主と病原体の共存、耐病性を強化している。
OXPHOSの維持は、肺の健全性に不可欠な要素である。健康な宿主では、このプラットフォームはFAOによって燃料供給され、緑膿菌肺炎の際には、解糖と有害な炎症の両方を制限するために、FAOが基本的な役割を果たすことが示されている。ケトジェネシスは、OXPHOSを阻害する毒素を産生できない緑膿菌株を選択し、感染組織を損傷する代謝-炎症経路、すなわち解糖を阻止する。したがってケトジェネシスは、緑膿菌感染に対する耐性を可能にする肺の生体エネルギー構成を維持する上で中心的な役割を担っている10,11,12。
我々の発見は、急性感染によって開始される肺の生体エネルギーストレスに対して、宿主だけでなく病原体も積極的に応答することを示している。肺炎の際に引き起こされる気道ケトジェニック再構成に応答して、緑膿菌は自らの表面構造を変化させ、ミトコンドリアの生体エネルギーを維持する低成長株を生成する。その他の表現型適応は、プロバイオフィルム多糖類、クオラムセンシング制御因子、薬剤排出ポンプなど、緑膿菌の慢性持続性を維持する。我々が示したように、食事は気道メタボロームの構成にも影響を与え、栄養がヒト肺における多様な病原体の進化と持続を制御している可能性を示している。
我々の研究は、ケトン体が感染症の際に粘膜のOXPHOSをどのように保護するかという理解に、新たな複雑な層を提供するものである。この寛容化機構は、可溶性LPS58,74で中毒を起こした際のインフラマソームの抑制や、Hcar2(Gpr109a)のような抗酸化レセプターの刺激など、これまでに確立されたケトン体生成の役割と協調して働く可能性が高い。例えばCOVID-19では、ケトン体は感染を封じ込め、粘膜の修復を促進する有能なリンパ球の生成をサポートする76。ケトン体がさまざまな炎症性疾患状態の進行にどのように影響するかをよりよく理解するためには、さらなる研究が必要である。
全身的なケトン体生成から気道におけるケトン体の濃縮に切り替えることで、緑膿菌分離株に対する宿主の反応は、長期にわたるケトン血症の有害な結果を抑制した。これらの知見は、癌のような他の長期炎症環境において、腫瘍関連線維芽細胞が異化代謝の結果としてケトン体を放出する、これらの細胞のケトン生成の役割と一致する。
我々は、ケトジェネシス、肺OXPHOSの維持、および緑膿菌肺感染に対する耐性の間に関連性を確立した。我々の知見は、炎症性気道疾患に対する新規治療戦略は、感染時に呼吸器細胞がどのようにATPを産生するか、そしてこの生体エネルギー構成を、OXPHOSと解糖のバランスに影響を与える食事または他のアプローチによって、どのように標的にできるかを考慮すべきであることを示唆している。
研究の限界
本研究で用いた肺炎の動物モデルは、必ずしもヒトの肺の複雑な免疫代謝マトリックスを反映していない可能性がある。血液や気道のようなマウス体液中に見られる多くの代謝物の濃度は、ヒト組織におけるこれらの決定因子の存在量を必ずしも表していないかもしれない。同様に、健常人やCF患者の喀痰中 にケトン体が濃縮されているのは、粘液の蓄積、骨 髄細胞浸潤、脱水、病原体負荷の程度が異なる結 果かもしれない。緑膿菌分離株に対するケトン体によるLPS順応は、ヒトの呼吸器系で起こる多くの共同プロセスを示唆しており、今後の研究では、疾患耐性をよりよく理解するために、これらの並行経路を調べる必要があることを示唆している。同様に、ケトン体が緑膿菌のLPSの集合と表面への輸送にどのような影響を与えるかをin vitroでは調べたが、in vivoでは調べなかったという点でも、我々のアッセイには限界がある。我々の研究では、ケトン体生成とイタコン酸、脂肪酸酸化、栄養などの他の代謝ネットワークとの相互作用について検討したが、これらの経路が疾患寛容に関与する他の免疫調節プラットフォームとどのように関連するかについては研究しなかった。耐性緑膿菌に暴露されたマウスの肺線維芽細胞におけるケトジェニック遺伝子発現の変化が同定されたからといって、ヒトの肺においても他の多くの呼吸器系サブセットが同様の変化を示す可能性を否定するものではない。寛容、ケトジェネシス、緑膿菌感染間のクロストークを評価する、より包括的な研究がこの原稿の結論を支持するであろう。
STAR★方法
主要リソース表
試薬またはリソースのソース IDENTIFIER
抗体
抗マウス CD45 AF700 Biolegend Cat 103128; RRID:AB_493715
抗マウス CD11c Bv605 Biolegend Cat 117333; RRID:AB_11204262
抗マウス SiglecF Biolegend Cat 562680; RRID:AB_2687570
抗マウス CD11b AF594 Biolegend Cat 101254; RRID:AB_2563231
抗マウス MHC II APC/Cy7 Biolegend Cat 107628; RRID:AB_2069377
抗マウス Ly6C Bv421 Biolegend Cat 128032; RRID:AB_2562178
抗マウス Ly6G PerCP/Cy5.5 Biolegend Cat 127616; RRID:AB_1877271
抗β-アクチン Sigma Cat A5441; RRID:AB_476744
OXPHOS げっ歯類 WB 抗体カクテル Thermo Fisher Scientific Cat 45-8099; RRID:AB_2533835
ヘキソキナーゼ 2 ポリクローナル抗体 Thermo Fisher Scientific Cat 22029-1-AP; RRID:AB_11182717
ヤギ抗 Ms IgG HRP Santa Cruz Cat sc-2005; RRID:AB_631736
ヤギ抗Rb IgG HRP Santa Cruz Cat sc-2004; RRID:AB_631746
生物学的サンプル
CF喀痰サンプル
化学物質、ペプチド、組換えタンパク質
オリゴマイシン Selleckchem S1478
エトモキシル Sigma Aldrich E1905
コハク酸 Sigma Aldrich 14160
D-グルコース Sigma Aldrich G8270
Trizol™ 試薬 サーモフィッシャーサイエンティフィック 15596026
Novex™ 10-20% Tricine タンパク質ゲル Thermo Fisher Scientific EC6625BOX
Pro-Q™ Emerald 300 リポ多糖ゲル染色キット Thermo Fisher Scientific P20495
ライブ/デッド DAPi 染料 Thermo Fisher Scientific Cat L34962
ホルマリンフリー組織固定剤 Sigma Aldrich Cat A5472
パラホルムアルデヒド 32% Electron Microscopy Sciences Cat 15714-S
メタノール Thermo Fisher Scientific Cat A456-1
メタノール Alpha Aesar Cat 22909
トリパンブルー染色 Invitrogen Cat T10282
グルコース Agilent Cat 103577-100
コラゲナーゼ I Gibco 1100-017
エラスターゼ Worthington LS006365
ディスパーゼ Gibco 17105-041
BSA サーモフィッシャーサイエンティフィック BP9705
重要な市販アッセイ
マウスサイトカインアレイ/ケモカインアレイ 31-Plex Evetechnologies MD31
シーホース XFe24 フラックスパック アジレント・テクノロジー 102340-100
RNeasy Mini Kit Qiagen Cat 74104
E.Z.N.A.® Total RNA Kit I Omega Biotek R6834-01
DNA フリー除去キット Thermo Fisher Scientific AM1906
高容量 cDNA 逆転写キット Applied Biosystems 4368813
Power SYBR™ Green PCR マスターミックス Applied Biosystems 4368577
Biolog ミトプレート S-1 Biolog Cat 14105
Biolog Redox Dye Mix MC Biolog Cat 74353
実験モデル 生物/株
マウス C57BL/6 ジャクソン研究所 JAX: 000664
マウス C57BL/6J/N ジャクソン研究所 JAX: 005304
マウス マウス:C57BL/6 Irg1-/- (Acod1-/-) Jackson Laboratories JAX: 029340
マウス B6.129S7-Il1r1tm1Imx/J (Il1r-/-) Jackson Laboratories JAX: 003245
細菌およびウイルス株
P. aeruginosa WT PAO1 当研究室 N/A
P. aeruginosa WT PAO1 CJ Balibar博士より提供; Balibar and Grabowicz38 N/A
P. aeruginosa ΔlptD PAO1 (mutant 4213) CJ Balibar博士提供; Balibar and Grabowicz38 N/A
CF 被験者 2 緑膿菌 Riquelme ら 32 N/A
CF 被験者 1 緑膿菌分離株 Dr. Barbara Kahl より提供 N/A
ICU 緑膿菌分離株 Dr. A.C. Uhlemman より提供 N/A
オリゴヌクレオチド
rpsL-F: CGGCACTGCGTAAGGTATGC Riquelmeら32 N/A
rpsL-R: CGTACTTCGAACGACCCTGCT Riquelme et al.32 N/A
lptD-F: CCTGCCCTACAACCCAGGTG Riquelme et al.32 N/A
lptD-R: ATGCTGCCGTCGTCATTGAA Riquelme et al.32 N/A
waaL-F: CTACGCCAGATCAGCGAGCA Riquelme et al.32 N/A
waaL-R: CCTCCAGCGAAAAGCACACC Riquelme et al.32 N/A
wbpX-F: GAGACCATCCGCGACGAAGT Riquelme et al.32 N/A
wbpX-R: TCCTCCACCAGGTCCAGCTC Riquelme et al.32 N/A
wbpZ-F: GCTCCGCCAGTACCGAGAAA Riquelme et al.32 N/A
wbpZ-R: ATCACCCCGACGAACAGGAA Riquelme et al.32 N/A
lpxT-F: CTGACCTTCGGCTTCATCGT Nowicki et al.65 N/A
lpxT-R: TGGAGCGTCCTTGATTTCC Nowicki et al.65 N/A
arnT-F: GGCTATGCCAACCTCGACCC Nowicki et al.65 N/A
arnT-R: GCGAGGAAGCCCTTGGTCAG Nowicki et al.65 N/A
ソフトウェアとアルゴリズム
GraphPad Prism 9 グラフパッドソフトウェア https://www.graphpad.com/
FlowJo X フローサイトメトリー FlowJo https://www.flowjo.com
FIJI フィジ http://imagej.net
Seurat v4, Seurat v5 Seurat ライブラリー https://satijalab.org
MetaboloAnalyst 5.0 メタボロアナリスト https://www.metaboanalyst.ca
京都遺伝子百科事典 KEGG https://www.genome.jp/kegg/
Adobe Photoshop 24.5.0 Adobe https://www.adobe.com/
寄託データ
scRNA-seq 肺組織 GEO アクセス番号 GSE203352
生メタボロミクスBAL組織 MetaboLights アクセス番号 MTBLS4922、MTBLS4923、MTBLS4924
緑膿菌分離ゲノム NIH SRA アクセス番号 PA270(SRR8775051)、PA338(SRR8775050)、PA339(SRR8775058)、PA599(SRR8775057)、PA600(SRR8775065)、PA601(SRR8775054)、PA602(SRR8775055)、PA603(SRR8775053)、PA604(SRR8775056)、 PA605(SRR8775052)、PA606(SRR8775060)、PA607(SRR8775059)、PA608(SRR8775062)、PA683(SRR8775061)、PA684(SRR8775064)、PA685(SRR8775063)、PA686(SRR8775066)。
生データ データS1 N/A
その他
グルタミン入り RPMI 1640 1x Corning 10-040-CV
抗生物質 Penicillin-Streptomycin Corning 30-002-CI
ウシ胎児血清 Gibco 26140-079
KetoBM ケトンストリップス KBM ASIN: B087JYC6JD
KetoBM 血中ケトン体測定キット ケトダイエット検査用 KetoBM ASIN: B07QWMM4M6
AUVON I-QARE DS-W ドローイン血糖測定用試験紙 AUVON ASIN: B09T6CHZVZ
AUVON DS-W 糖尿病検査メーター AUVON ASIN: B081ZY1LHV
照射脂肪酸リッチ食 リサーチダイエッツ D10070801i
照射済み炭水化物リッチフード Research Diets, Inc D19082304i
照射ピュリナレギュラーチャウ ピュリナ5053
リソースの有無
リードの連絡先
資料およびリソースの要請は、主任連絡担当者 Sebastián A. Riquelme (sr3302@cumc.columbia.edu) までお願いします。
材料の入手可能性
本試験で使用した細菌株は、主担当者から制限なく入手可能である。
実験モデルおよび研究参加者の詳細
マウス実験
すべての動物実験はコロンビア大学の機関指針に従って行われた。マウス実験はプロトコールIACUC AABE8600により承認された。8-10週齢のWT C57bl/6マウス(20-25grs)をThe Jackson Laboratoriesから入手した。Irg1-/-マウス(Acod1-/-)およびIlr1-/-マウスもThe Jackson Laboratoriesから入手し、コロンビア大学メディカルセンターの我々の施設で繁殖させた。WTマウス、Irg1-/-マウス、およびIlr1-/-マウスは免疫不全動物であり、感染前に医療処置や薬物処置は受けていない。各in vivo実験は、50%雌性動物および50%雄性動物を用いて行われ、結果は雌雄による影響はないと考えられた。動物は無作為にケージに割り当てられ、18℃~23℃の通常のげっ歯類の明暗サイクル下で維持された。特に指示のない限り、マウスには通常の照射飼料であるピュリナ5053(タンパク質約25%、炭水化物約62%、脂肪約13%)を与えた。
ヒトサンプル
ヒト検体中のケトン体は、健常対照者5名(HC)と CF患者9名(すべて成人)の喀痰から測定した。男女比は50%ずつである。これらのサンプルは、イェール大学のClemente Britto-Leon博士の好意により提供された。インフォームド・コンセントには、サンプルを提供したすべての被験者が署名した。これらの研究は、IRBが承認したプロトコールAAAR1395に基づいて実施された。
緑膿菌株
WT PAO1とΔlptD PAO1をLBで一晩培養し、エクスポネンシャル期まで継代培養した。CF#1の緑膿菌は、10年間慢性感染していたCF患者由来の緑膿菌であった。CF#2から分離された緑膿菌は、12年間慢性感染しているCF患者から分離された。CF#1およびCF#2から分離された緑膿菌はすべて、縦断的コレクションの一部であった。10人のICU患者から分離された緑膿菌は、コロンビア大学アービング医療センターの施設で入手された。これらの被験者は少なくとも3~5日間急性感染していた。これらの研究は、当院で承認されたIRBプロトコールAAAR1395およびAAAS6553の下で実施された。これらの菌株はすべてLB寒天培地にプレーティングされ、その表現型は小コロニー変異体またはムコイド形態に関して特徴づけられた。これらの臨床分離株の感染実験は、一晩培養した株から得られた指数関数増殖期のLBサブカルチャーから行った。一晩培養およびサブカルチャーは、37℃、遮光下で培養した。
方法の詳細
マクロファージにおける酸素消費率の測定
マウス骨髄由来マクロファージ(BMDM)を、37℃で3時間、PBS、50ug/ml LPS、WT PAO1、ΔlptD PAO1のいずれかに、感染多重度(MOI)=10で曝露した。その後、Seahorseテクノロジーにより、製造元が推奨する市販のプレートを用いて、これらの細胞の酸素消費率(OCR)を追跡した。
緑膿菌によるNADHとFADH2の消費
WT PAO1とΔlptD PAO1の両方を指数期まで増殖させ、各ウェルに単一の炭素源(Mitoplate S1)を含むBiolog 96ウェルプレートアレイに同じ濃度で適用した。これらのアッセイでは、製造元から提供された説明書に従った。プレートは37℃で48~72時間インキュベートした後、OD400nmで吸光度を測定した。
緑膿菌マウスへの感染
WT, Irg1-/- (Acod1-/-), Il1r-/- C57bl/6マウスを用いた。動物はPBS、WT PAO1、ΔlptD PAO1、または緑膿菌分離株のいずれかに曝露された。指示されている場合、細菌の投与量は実験に応じて変化した。約105、約106、約107 CFU、またはPBS単独(非感染)。緑膿菌分離株の混合では、各株を等量ずつ用いて目的の接種量を形成した。指示された場合、動物に0.2mg/kgまたは1.0mg/kgのオリゴマイシンを感染中に投与した。同様に、指示された場合、感染の24時間前および感染中に、動物に20mg/kgのエトモキシルを投与したりしなかったりした。マウスの生存を5日間モニターした。指示された場合、動物の体温を赤外線温度計で追跡し、表面温度と体内温度を測定した。感染に対する宿主の免疫反応を評価するため、病原体曝露24時間後にマウスを犠牲にし、BALと肺を採取した。CFU量はLB寒天培地プレーティングにより定量した。検出限界(組織あたり102 CFU)以下のCFUは「非検出」(ND)としてグラフに表した。免疫細胞(フローサイトメトリー)とサイトカイン(ELISA)をBALと肺で定量した。フローサイトメトリー:肺胞マクロファージはCD45+CD11blow/-SiglecFhighCD11c+CD193-Ly6G-Ly6C-、好中球はCD45+CD11bhighSiglecFlow/-CD11c-MHCII-CD193-Ly6G+Ly6Clow/-、単球はCD45+CD11bhighSiglecFlow/-CD11c-MHCII-CD193-Ly6G-Ly6Clow/highであった。サンプルはFlowJo, vXで解析した。細胞生存率は、生死DAPI染色(Thermo Fisher Scientific、L34962)を用いて決定した。これらの動物は、KetoBMケトンストリップスおよびケトダイエット検査用KetoBM血中ケトンメーターキットを用いて、明周期の開始時(午前8時から午前9時の間)にβ-ヒドロキシ酪酸(BHB)を定量することによりケトーシスを制御した。また、AUVON I-QARE DS-W Draw-in Blood Glucose Test StripsシステムとAUVON DS-W Diabetes Sugar Testing Meterを併用して血糖値を測定した。メタボロミクス研究のため、指示された場合、BALをMass-Specで分析した。
緑膿菌マウス感染時の食物消費量
マウスの食餌消費量と体重を追跡するため、マウスを個別にケージに入れた(1匹/ケージ)。これらの動物をPBSに曝露した後、またはWT PAO1、ΔlptD PAO1、または緑膿菌分離株(CF#2由来)のいずれかに感染させた後、24時間ごとに感染前後の餌の量を量り、餌の消費量をモニターした。消費されたとカウントされた餌がケージ内にないことを確認するため、各ケージを徹底的に調べた。同様に、デジタルスケールを用いて日々の体重を追跡した。
気道メタボロミクス
非感染マウスまたは24時間感染マウスのBALを3mLの滅菌PBSで採取した。サンプルは直ちに氷上に置いた。その後、サンプルを100%メタノールで1:1の割合で希釈し、混合して-80℃で保存し、将来のメタボローム解析に備えた。質量分析の直前に、サンプルを解凍し、窒素気流下で乾燥させ、HPLCグレードの水に4:1希釈(元のBAL容量に対して)で再懸濁した。高分解能質量分析データは、Thermo Fisher Exactive Mass spectrometerのネガティブモードで、25分間の逆相グラジエントとイオンペアリングクロマトグラフィーを用いて取得した。標準物質の既知のクロマトグラフィー保持時間を使用して代謝物を同定し、MAVEN を使用して代謝物シグナルを定量した。代謝物シグナル強度は、BALおよびPBS処理動物に対する処理間の差を定量するために使用された。
肺組織病理学的研究
8~10週齢のマウスを、PBS、WT PAO1、または緑膿菌分離株のいずれかに経鼻曝露した。その後24時間後に動物を犠牲にし、カニューレを気管に挿入して縫合糸で縛った。開胸し、マウス上方5cmに設置した注射器からカニューレを通してホルマリンを含まない組織固定液を静かに注入し、肺を固定した。肺全体を摘出し、ホルマリンを含まない組織固定液中に24時間置いた後、70%エタノールに移した。組織をパラフィン化し、5mmの切片を25mm間隔で2枚採取した。切片はヘマトキシリンとエオジンで染色し、サンプルの同一性を盲検化した病理医が採点した。免疫細胞の浸潤と浮腫を光学顕微鏡で観察した。
in vivoアッセイ用の飼料
ケトジェニック食(D10070801i, Research Diets, Inc)または炭水化物に富んだ対照食(D19082304i, Research Diets, Inc)を1週間与えた(ad libitum)。ケトジェニック食はタンパク質約10%、炭水化物約0.1%、脂肪約88.9%(%Kcal)。対照食はタンパク質約10%、炭水化物約80%、脂肪約10%(%Kcal)であった。1週間後、マウスに緑膿菌、WT PAO1、ΔlptD PAO1を約106 CFU経鼻感染させた。24時間後、動物を処理した。指示された場合、これらの動物の尾から血液を採取し、グルコースとβ-ヒドロキシ酪酸についてそれぞれドローイン血液検査ストリップを用いて血糖値とケトーシスを測定した。
単一細胞RNA配列解析のためのマウス肺処理
WTまたはIrg1-/- C57bl/6マウス(8-10週齢)をPBSで処理するか、WT PAO1または緑膿菌臨床分離株(50uL中、マウス1匹あたり約106CFU)に感染させた。感染から24時間後にマウスを安楽死させ、肺を採取し、肺の単細胞懸濁液を記載通りに調製した。簡単に言うと、肺を、PBS中のコラゲナーゼI(2mg/mL)、ディスパーゼ(20mg/mL)、エラスターゼ(1mg/mL)、およびDNAse(1μL/mL)の酵素消化液を含むエッペンドルフチューブに入れた。肺をチューブ内でミンチにし、37℃で30分間振盪しながらインキュベートした。10%FBS添加PBSを4容量加えて消化を停止させ、消化液を70ミクロンのフィルターで濾した。細胞懸濁液を4℃、1400rpmで7分間スピンダウンした。赤血球溶解はInvitrogen RBC lysis bufferを用いて行った。得られた細胞ペレットを、10X Genomics Chromium Single Cell Controllerにロードする前に、0.04% BSA添加PBSに再懸濁した。細胞生存率分析はサンプルをロードする前に行われ、サンプルあたり95%以上であった。サンプルあたり合計約8000個の細胞を分析した。FASTQファイルの生成、アライメント、フィルタリング、バーコードカウント、UMIカウントは10X Cell Rangerソフトウェアを用いて行った。
単一細胞RNAシーケンス解析
scRNA-seqによって生成されたマトリックスデータは、R Studio (https://www.rstudio.com)のSeurat library (https://satijalab.org)を用いて解析した。データはミトコンドリアRNA(サンプルあたり5%未満)についてクリーニングされ、不偏的細胞クラスタリングが行われた。Seuratアルゴリズムは、ユニークなトランスクリプトームシグネチャーを持つ23の細胞クラスターを同定した。これらのクラスターそれぞれの生物学的性質を決定するために、SingleRアルゴリズム(参照データセットとしてImmGenを使用)を用いて、各クラスターのトランスクリプトームプロファイルを利用可能なデータベースと比較解析した。さらに、このクラスターの特徴を、各クラスターの上位10マーカーを用いて、公開されているデータセットの細胞マーカーと手作業でクロスチェックした。ケトジェニックルートのスコアは、SeuratのAddModuleScore関数を用いて計算した。簡単に言うと、ケトジェニックスコアには以下の遺伝子が含まれる:Hmgcs2、Bdh1、Hmgcl、Acat1、Ppara、Cpt1a。WTまたはIrg1-/-肺サブセットそれぞれについて、WT PAO1または緑膿菌分離株への曝露の有無にかかわらず、ケトジェニックスコアを計算した。次に、MAST統計学的検定によって、同じ肺サブセットにおける処理間の差異を決定し、「-Log(p-value)」を計算した。Irg1が特定の肺サブセットにおいてこのケトジェニックスコアの減少の濃縮を促進するかどうかを確立するために、WT対照からIrg1-/-バックグラウンドで得られたケトジェニックスコアを差し引いた(Δケトジェニックスコア(「Irg1+/+」-「Irg1-/-」))。次に、各肺細胞タイプについて、Y軸に「-Log(p-value)」、X座標にΔケトジェネシススコアを示すボルケーノプロットを行った。
ケトン類に暴露された緑膿菌の遺伝子のqRT-PCR
WT PAO1をLBで一晩培養した後、グルコース、グルコース+BHB、グルコース+AcAc、またはグルコース+BHB+AcAc(各代謝物7mM)を添加したM9で指数期まで継代培養した。E.Z.N.A. Total RNA Kit1またはRNeasy Mini Kitを用いて全RNAを抽出した。その後、RNAをDNaseで処理した。cDNAはHigh-Capacity cDNA Reverse Transcription Kit(Applied Biosystems)を用いて合成し、POWER SYBR Green PCR Master Mix(Applied Biosystems)を用いてStepOnePlus Real-Time PCR System(Applied Biosystems)でqPCRを行った。qRT-PCRに使用したプライマーの配列をKey Resource Tableに示す。相対遺伝子発現は2-ΔΔCT法により算出した。rpsL転写物を参照ハウスキーピング遺伝子として用い、グルコース中で増殖させたWT PAO1株をキャリブレーターとして用いた。臨床分離株を調べる場合、これらの株はLBで一晩培養した後、同じ条件で指数期まで継代培養した。その後、全RNAを抽出し、qRT-PCRを行った。
WT PAO1におけるLPSアセンブリー研究
ケトン類に暴露されたWT PAO1におけるO-抗原と脂質Aを可視化するために、まず、1:10希釈後のOD600=0.5で標準化した一晩培養から、ホットフェノール抽出を用いてLPSを単離した。サンプルは37℃で30分間DNaseとRNaseで処理し、59℃で一晩Proteinase Kで処理した。Trizolで熱フェノール抽出後、単離したLPSをTricine 10%-20%ゲルで泳動した。ゲルをPro-Q Emerald 300 Lipopolysaccharide Gel Stain Kitで染色し、Protein Simple imagerでUV光を用いて画像化した。
気道液のパスウェイ解析
コントロールマウスと細菌曝露マウスの気道液から得られたキュレーションされたメタボロミクスデータをMetaboloAnalyst 5.0(https://www.metaboanalyst.ca)に提出しました。データは、Kyoto Encyclopedia of Genes and Genomes (KEGG)データベースを参照としてEnrichment Analysisにより解析した。データの偏りのない解釈を維持するため、プラットフォームが提供するグラフを利用した。
緑膿菌脂質Aの単離と解析
緑膿菌WT PAO1をLBで一晩培養した後、洗浄し、グルコース(7mM)単独、またはグルコース(7mM)、BHB(7mM)、AcAc(7mM)を含むM9培地で継代培養した。菌は37℃で振盪しながら指数期まで増殖させた。水酸化アンモニウム-イソ酪酸ベースの手順で細胞ペレットから脂質Aを抽出した。約5mLの細胞培養物をペレット化し、400μLの70%イソ酪酸(Sigma, I1754)と1M水酸化アンモニウム(Sigma, 221228)(5:3v/v)に再懸濁した。サンプルを100℃で1時間インキュベートし、8,000×gで5分間遠心した。上清を回収し、エンドトキシンを含まない水(1:1 v/v)に加え、ドライアイス上でスナップ凍結し、一晩凍結乾燥した。得られた物質を1mLのメタノール(Thermo Fisher Scientific、A456-1)で2回洗浄し、クロロホルム(Thermo Fisher Scientific、C606SK-4)、メタノール、および水(3:1:0.25 v/v/v)の混合物80μLを用いて脂質Aを抽出した。抽出後、濃縮液1μLをスチール製の再使用可能なMALDIプレート(Hudson Surface Technology社製、PL-PD-000040-P)にスポットし、続いてクロロホルム-メタノール(2:1 v/v、Sigma社製)中の10 mg/mLノルハーマンマトリックス(Sigma社製、NG252)1μLをスポットし、風乾した。すべてのサンプルは、Bruker Microflex質量分析計(Bruker Daltonics社製)を用いて、リフレクトロンモードのマイナスイオンモードで分析した。質量校正にはエレクトロスプレーチューニングミックス(Agilent、G2421A)を使用した。スペクトルデータはBruker Daltonics FlexAnalysisソフトウェア(v4.30)で解析した。得られたスペクトルを用いて、予測される構造と分子量に基づいて、各条件に存在する脂質A構造を推定した。
肺タンパク質の抽出とウェスタンブロット
PBS、WT PAO1、ΔlptD PAO1、または緑膿菌分離株のいずれかに24時間曝露したWTマウスから肺全組織を摘出した。単細胞画分を調製し、洗浄後、プロテアーゼ/ホスファターゼ阻害剤を含む300uLのRIPA緩衝液に4℃で30分間再懸濁した。サンプルを15,000gで25分間遠心し、上清を回収して-80℃で保存した。ウエスタンブロットを行うため、サンプルを37℃で20分間変性させ、MES緩衝液中の4-12%ゲルで泳動した。アクチンの染色には、マウスで作製したモノクローナル抗β-アクチン抗体(Sigma, Cat A5441)を用いた。OXPHOS成分をマークするために、OXPHOSげっ歯類WB抗体カクテル(Thermo Fisher Scientific, 45-8099)を用いた。ヘキソキナーゼ-2の検出には、ヘキソキナーゼ2ポリクローナル抗体(Thermo Fisher Scientific, 22029-1-AP)を用いた。膜はiblotを用いて転写し、一次抗体で一晩染色した。その後、サンプルを洗浄し、HRP標識二次抗体で1時間インキュベートした。膜を明らかにしてタンパク質発現を解析した。
緑膿菌分離株の全ゲノム配列決定と一塩基多型(SNP)コール
緑膿菌分離株をLBブロス中で37℃で一晩培養した。ゲノムDNAは、Wizard Genomic DNA Purification Kit(Promega)を用いて、製造元の指示に従って抽出した。Nextera XTキットを用いてゲノムDNAライブラリーを調製し、HiSeq 2500シーケンサー(イルミナ社製)を用いて125bpペアエンドリードで塩基配列を決定した。ゲノムアセンブリはABySSのペアエンド実装を用いて行った。一塩基多型(SNP)コールのために、分離株とWT PAO1間のSNPを比較した。これは、Burrows-Wheeler alignment (bwa)ツール(http://bio-bwa.sourceforge.net)を用いて、PAO1のゲノム(GenBank: AE004091)をリファレンスとしたショートレッドアラインメントによって行った。SNPコールはsamtools(http://samtools. sourceforge.netで入手可能)を用いて行った。ヘテロ接合としてリストされておらず、塩基あたりのQスコアが20以上のSNPを高品質と定義した。サンプルは以下のコードでNIH SRAにある: PA270(SRR8775051)、PA338(SRR8775050)、PA339(SRR8775058)、PA599(SRR8775057)、PA600(SRR8775065)、PA601(SRR8775054)、PA602(SRR8775055)、PA603(SRR8775053)、PA604(SRR8775056)、 PA605(SRR8775052)、PA606(SRR8775060)、PA607(SRR8775059)、PA608(SRR8775062)、PA683(SRR8775061)、PA684(SRR8775064)、PA685(SRR8775063)およびPA686(SRR8775066)。
定量化と統計解析
統計解析専用コンピュータプログラムJMPを用いて、群間で有意差を得るために必要な独立実験数をモデル化した。このシミュレーションは予備データ、実験デザイン、過去の経験に基づいて行った。これらの解析は、20%の標準偏差(SD)を仮定し、群内の分散は同等とした。検出力0.8の有意差(p < 0.05)を用いた。本研究の実験は盲検法では行われなかった。すべての解析とグラフはGraphPad Prism 9ソフトウェアを用いて行った。グラフ中のデータは平均値±SEMで示し、データは正規分布に適合すると仮定した。2群以上の平均値間の比較には、多重事後比較による一元配置分散分析を行った。時間軸に沿って2群以上の研究を行う場合は、多重事後比較を伴う二元配置分散分析を用いてデータを分析した。サンプルの平均値における2群間の差は、正規分布データの場合は分散分析(パラメトリック)またはStudentのt検定、それ以外の場合はMann-Whitney検定またはKruskal-Wallis検定を用いて分析した。有意差は、p値(両側)が0.05未満(p<0.05)のときに有意とみなされた。有意差のp値と独立した実験および反復の量は、各図の凡例に示した。
謝辞
K.L.T.はNIH助成金1F30AI161801、T.W.F.L.はNIH助成金K99HL157550、A.P.はNIH助成金1R35HL135800およびCFF助成金003028G221の助成を受けた。コロンビア大学ゲノムセンターSingle Cell Coreおよび同大学分子病理学コアのご協力に感謝する。メタボローム研究に協力してくれたカナダ・アルバータ州カルガリー大学のIan Lewis博士とMarija Drikic博士に感謝する。細菌ゲノムシーケンス解析に協力してくれた米国フィラデルフィア小児病院のPaul Planet博士とAhmed Moustafa博士に感謝する。喀痰サンプルを提供してくれた米国Yale大学のClemente Britto-Leon博士に感謝する。本論文は、CUIMCのCCTIフローサイトメトリーコア(NIH S10RR027050)の支援も受けている。
著者貢献
概念化、K.L.T.およびS.A.R.、方法論、K.L.T.およびS.A.R.、ソフトウェア、K.L.T.およびS.A.R.、検証、K.L.T.およびS.A.R.、形式的解析、K.L.T.、 調査、K.L.T.、Y.-T.C.、S.U.B.、C.E.H.、S.A.R.、リソース、S.A.R、 リソース、S.A.R.、R.K.E.、A.P.、データキュレーション、K.L.T.、S.A.R.、執筆-原案、K.L.T.、S.A.R.、執筆-校閲・編集、K.L.T.、A.P、 視覚化、K.L.T.およびS.A.R.、監修、S.A.R.およびA.P.、プロジェクト管理、K.L.T.およびS.A.R.、資金獲得、S.A.R.およびA.P.。
利害関係
著者らは、競合する利益はないと宣言している。
インクルージョンと多様性
私たちは、包括的で多様性があり、公平な研究実施を支持する。
補足情報
すべての補足ファイルをダウンロードする
これは何ですか?
ダウンロード アクロバットPDFファイルのダウンロード (4MB)
資料S1。図S1-S6および表S2。
ダウンロード スプレッドシートのダウンロード(1MB)
表S1. 図3に関連する肺細胞のscRNA-seqクラスタリング。
ダウンロード ダウンロード:zipファイル(2MB)
データS1. 図1、2、3、4、5、6に関連する未処理ゲルとグラフ値。
ダウンロード ダウンロード:PDFファイル(11MB)
資料S2。論文と補足情報。
データとコード
シングルセルRNA-seqデータはGEOに寄託されており(アクセッション番号:GEO: GSE203352)、発表日現在一般に入手可能である。メタボロミクスデータはMetabolightsで入手可能(アクセッション番号:MTBLS4922、MTBLS4923、MTBLS4924)。分離株のゲノムはNIH SRAで入手可能である(アクセス番号: PA270(SRR8775051)、PA338(SRR8775050)、PA339(SRR8775058)、PA599(SRR8775057)、PA600(SRR8775065)、PA601(SRR8775054)、PA602(SRR8775055)、PA603(SRR8775053)、PA604(SRR8775056)、 PA605(SRR8775052)、PA606(SRR8775060)、PA607(SRR8775059)、PA608(SRR8775062)、PA683(SRR8775061)、PA684(SRR8775064)、PA685(SRR8775063)およびPA686(SRR8775066)。アクセッション番号も主要リソース表に記載されています。
本論文はオリジナルコードを報告していない。
データS1は、論文中のすべてのグラフ、および図1A、1E、3C、5Lのゲルの作成に使用した値を含むExcelファイルである。本論文で報告されたデータを再分析するために必要な追加情報は、要請があれば、主担当者から入手可能である。
参考文献
1
C.K. Lin、B.I. Kazmierczak
炎症: 緑膿菌感染に対する両刃の剣
J. Innate Immun., 9 (2017), 250-261頁, 10.1159/000455857
スコープで見るGoogle Scholar
2
E. フォーレ、K. クォン、D. グエン
慢性肺感染症における緑膿菌: 宿主内でいかに適応するか?
Front. Immunol., 9 (2018), p. 2416, 10.3389/fimmu.2018.02416
スコープで見るGoogle Scholar
3
C. ウィンスタンリー、S.オブライエン、M.A.ブロックハースト
嚢胞性線維症慢性肺感染症における緑膿菌の進化的適応と多様化
トレンド微生物学、24(2016)、327-337頁、10.1016/j.tim.2016.01.008
PDFで記事を見るScopusで記事を見るGoogle Scholar
4
Y. ヒリアム、M.P.ムーア、I.L.ラモント、D.ビルトン、C.S.ハワース、J.ファワーカー、M.J.ウォルショー、D.ウィリアムズ、J.L.フォザーギル、A.デ・ソイザ、C.ウィンスタンリー
非嚢胞性線維症気管支拡張症肺における緑膿菌の適応と多様化
Eur. Respir. J., 49 (2017), Article 1602108, 10.1183/13993003.02108-2016
Scopusで見るGoogle Scholar
5
J.D.チャルマーズ、A.T.ヒル
非嚢胞性線維症気管支拡張症における免疫機能障害と細菌持続性のメカニズム
Mol. Immunol., 55 (2013), 27-34頁, 10.1016/j.molimm.2012.09.011
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
6
L. マルティネス・ソラノ、M.D.マシア、A.ファハルド、A.オリバー、J.L.マルティネス
慢性閉塞性肺疾患における慢性緑膿菌感染症
Clin. Infect. Dis., 47 (2008), 1526-1533頁, 10.1086/593186
スコープで見るGoogle Scholar
7
A. ロドリゴ-トロヤノ、V.メロ、P.J.マルコス、E.レーザーナ、M.ペイロ、G.スアレス-クアルティン、L.ペレア、A.フェリウ、V.プラザ、P.ファベリオ、他。
入院増悪頻度の高い慢性閉塞性肺疾患患者における緑膿菌: 前向き多施設研究
Respiration, 96 (2018), 417-424頁, 10.1159/000490190
スコープで見るGoogle Scholar
8
C.D.ワイジャース、J.F.シュミエル、B.M.ガストン
原発性毛様体ジスキネジア患者における細菌感染: 嚢胞性線維症との比較
Chron. Respir. Dis., 14 (2017), 392-406頁, 10.1177/1479972317694621
スコープで見るGoogle Scholar
9
M. Cohen-Cymberknoh, N. Weigert, A. Gileles-Hillel, O. Breuer, N. Simanovsky, M. Boon, K. De Boeck, A. Barbato, D. Snijders, M. Collura, et al.
原発性毛様体ジスキネジア患者における緑膿菌コロニー形成の臨床的影響
Respir. Med.、131(2017)、241-246頁、10.1016/j.rmed.2017.08.028
PDFで記事を見るScopusで記事を見るGoogle Scholar
10
R. マルティンス、A.R.カルロス、F.ブラザ、J.A.トンプソン、P.バストス-アマドール、S.ラモス、M.P.ソアレス
免疫の本質的構成要素としての耐病性
Annu. Rev. Immunol., 37 (2019), 405-437頁, 10.1146/annurev-immunol-042718-041739
Scopusで見るGoogle Scholar
11
D.S.シュナイダー、J.S.エアーズ
感染症を生き延びる2つの方法:抵抗性と耐性が感染症治療について教えてくれること
Nat. Rev. Immunol., 8 (2008), 889-895頁, 10.1038/nri2432
Google Scholar
12
M.P.ソアレス、L.テイシェイラ、L.F.モイタ
感染に対する宿主防御における疾患寛容と免疫
Nat. Rev. Immunol., 17 (2017), 83-96頁, 10.1038/nri.2016.136
ScopusGoogle Scholarで見る
13
G.リュー、R.サマー
肺の健康と疾患における細胞代謝
Annu. Rev. Physiol., 81 (2019), 403-428頁, 10.1146/annurev-physiol-020518-114640
Scopusで見るGoogle Scholar
14
E. Tsitoura, E. Vasarmidi, E. Bibaki, A. Trachalaki, C. Koutoulaki, G. Papastratigakis, S. Papadogiorgaki, G. Chalepakis, N. Tzanakis, K.M. Antoniou
IPFにおけるOXPHOS関連遺伝子発現低下を伴う肺胞マクロファージにおける損傷ミトコンドリアの蓄積
Respir. Res., 20 (2019), p. 264, 10.1186/s12931-019-1196-6
Scopusで見るGoogle Scholar
15
S.M.クルーナン、K.キム、P.エステベス、T.トリアン、P.J.バーンズ
肺の老化と疾患におけるミトコンドリア機能障害
Eur. Respir. Rev., 29 (2020), Article 200165, 10.1183/16000617.0165-2020
スコープで見るGoogle Scholar
16
E.L. Mills, B. Kelly, A. Logan, A.S.H. Costa, M. Varma, C.E. Bryant, P. Tourlomousis, J.H.M. Däbritz, E. Gottlieb, I. Latorre, et al.
コハク酸デヒドロゲナーゼは炎症性マクロファージを駆動するミトコンドリアの代謝的再利用をサポートする
Cell, 167 (2016), 457-470.e13頁, 10.1016/j.cell.2016.08.064
PDFを見る記事を見るScopusGoogle Scholarで見る
17
G.M. Tannahill, A.M. Curtis, J. Adamik, E.M. Palsson-McDermott, A.F. McGettrick, G. Goel, C. Frezza, N.J. Bernard, B. Kelly, N.H. Foley, et al.
コハク酸はHIF-1αを介してIL-1βを誘導する炎症シグナルである
Nature, 496 (2013), 238-242頁, 10.1038/nature11986
スコープで見るGoogle Scholar
18
S.M.クルーナン、A.M.K.チョイ
肺疾患におけるミトコンドリア
J. Clin. Invest., 126 (2016), pp.809-820, 10.1172/JCI81113
スコープで見るGoogle Scholar
19
H.S.ナム、E.イズムチェンコ、S.ダスグプタ、M.O.ホーク
慢性閉塞性肺疾患と肺がんにおけるミトコンドリア:我々は今どこにいるのか?
Biomark. Med., 11 (2017), pp.475-489, 10.2217/bmm-2016-0373
Scopusで見るGoogle Scholar
20
J. カンダサミー、G.レゾンゼフ、T.ジリング、S.バリンジャー、N.アンバラバナン
ミトコンドリアDNAの変異は、高酸素に曝露された新生マウスにおける肺胞の発達を調節する
Am. J. Physiol. Lung Cell Mol. Physiol., 317 (2019), pp.L740-L747, 10.1152/ajplung.00220.2019
Scopusで見るGoogle Scholar
21
M. アガプール、A.H.V.レメルス、S.D.プーウェルス、D.ブルーダー、P.S.ヒームストラ、S.M.クルーナン、I.H.ハイヒンク
ミトコンドリア:慢性閉塞性肺疾患における肺上皮細胞機能制御の岐路に立つ
Am. J. Physiol. Lung Cell Mol. Physiol., 318 (2020), pp.L149-L164, 10.1152/ajplung.00329.2019
スコープで見るGoogle Scholar
22
R.J.メイソン
肺胞II型細胞の生物学
Respirology, 11 (Suppl) (2006), pp.S12-S15, 10.1111/j.1440-1843.2006.00800.x
スコープで見るGoogle Scholar
23
B. Everts, E. Amiel, S.C.C. Huang, A.M. Smith, C.H. Chang, W.Y. Lam, V. Redmann, T.C. Freitas, J. Blagih, G.J.W. van der Windt, et al.
キナーゼTBK1-IKKvarepsilonを介したTLR駆動型初期解糖再プログラミングは、樹状細胞活性化の同化要求をサポートする
Nat. Immunol., 15 (2014), 323-332頁, 10.1038/ni.2833
スコープで見るGoogle Scholar
24
B. エバーツ、E.アミエル、G.J.W.ファン・デル・ヴィント、T.C.フレイタス、R.チョット、K.E.ヤラシスキー、E.L.ピアース、E.J.ピアース
解糖へのコミットメントがNO産生炎症性樹状細胞の生存を維持する
Blood, 120 (2012), 1422-1431頁, 10.1182/blood-2012-03-419747
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
25
D.G.ライアン、L.A.J.オニール
マクロファージ免疫代謝で生まれ変わるクレブスサイクル
Annu. Rev. Immunol., 38 (2020), pp.289-313, 10.1146/annurev-immunol-081619-104850
スコープで見るGoogle Scholar
26
T.S.コーエン、A.S.プリンス
急性緑膿菌肺炎の病態を媒介するインフラマソームシグナル伝達の活性化
J. Clin. Invest., 123 (2013), 1630-1637頁, 10.1172/JCI66142
スコープで見るGoogle Scholar
27
S.A.Riquelme、B.D.Hopkins、A.L.Wolfe、E.DiMango、K.Kitur、R.Parsons、A.Prince
嚢胞性線維症膜貫通伝導制御因子は腫瘍抑制因子PTENを膜に付着させ、抗緑膿菌免疫を促進する
Immunity, 47 (2017), pp.1169-1181.e7, 10.1016/j.immuni.2017.11.010
PDFで記事を見るScopusで記事を見るGoogle Scholar
28
K. ガネーシャン、J. ニッカネン、K. マン、Y.A. レオン、Y. ソガワ、J.A. マシェック、T. バン・ライ、D.N. チャグウェデラ、J.E. コックス、A. チャウラ
エネルギートレードオフと低代謝状態が疾患耐性を促進する
Cell, 177 (2019), pp.399-413.e12, 10.1016/j.cell.2019.01.050
PDFで記事を見るScopusで記事を見るGoogle Scholar
29
P. プチャルスカ、P.A.クロフォード
燃料代謝、シグナル伝達、治療におけるケトン体の多次元的役割
Cell Metab., 25 (2017), pp.262-284, 10.1016/j.cmet.2016.12.022
PDFで記事を見るScopusで記事を見るGoogle Scholar
30
G.F. Cahill Jr.
飢餓状態における燃料代謝
Annu. Rev. Nutr., 26 (2006), pp. 1-22, 10.1146/annurev.nutr.26.061505.111258
Google Scholar
31
プラネット
嚢胞性線維症肺における病原体の適応と進化
J. Pediatric Infect. Dis. Soc., 11 (2022), pp.S23-S31, 10.1093/jpids/piac073
スコープで見るGoogle Scholar
32
S.A. Riquelme, K. Liimatta, T. Wong Fok Lung, B. Fields, D. Ahn, D. Chen, C. Lozano, Y. Sáenz, A.C. Uhlemann, B.C. Kahl, et al.
緑膿菌は宿主由来のイタコン酸を利用して代謝を転換し、バイオフィルム形成を促進する
Cell Metab., 31 (2020), 1091-1106.e6頁, 10.1016/j.cmet.2020.04.017
PDFで記事を見るScopusで記事を見るGoogle Scholar
33
A. ロ・スキウト、A.M.マルトラーナ、R.フェルナンデス-ピニャール、C.マンコーネ、A.ポリッシ、F.インペリ
緑膿菌LptEはLptDのアセンブリー、細胞エンベロープの完全性、抗生物質耐性および病原性に極めて重要である
Virulence, 9 (2018), pp.1718-1733, 10.1080/21505594.2018.1537730
スコープで見るGoogle Scholar
34
A. コノバロワ、D.E.カーン、T.J.シルハビー
外膜バイオジェネシス
Annu. Rev. Microbiol., 71 (2017), pp. 539-556, 10.1146/annurev-micro-090816-093754
スコープで見るGoogle Scholar
35
K.E.フース、J.ジョセフ、L.チャン、A.ウォン、S.D.アーロン、T.F.マー、S.サド
慢性的に感染した嚢胞性線維症患者からの緑膿菌臨床分離株は、安定感染時および肺増悪時の両方でインフラマソームを活性化しない。
J. Immunol., 196 (2016), 3097-3108頁, 10.4049/jimmunol.1501642
スコープで見るGoogle Scholar
36
A.Y. Bhagirath、Y. Li、D. Somayajula、M. Dadashi、S. Badr、K. Duan
嚢胞性線維症の肺環境と緑膿菌感染症
BMC Pulm. Med., 16 (2016), p. 174, 10.1186/s12890-016-0339-5
スコープで見るGoogle Scholar
37
M.S. Muhlebach、B.T. Zorn、C.R. Esther、J.E. Hatch、C.P. Murray、L. Turkovic、S.C. Ranganathan、R.C. Boucher、S.M. Stick、M.C. Wolfgang
嚢胞性線維症肺マイクロバイオームの初期獲得および継代は、乳児および就学前児童における疾患進行と関連している。
PLoS Pathog., 14 (2018), Article e1006798, 10.1371/journal.ppat.1006798
スコープで見るGoogle Scholar
38
C.J.バリバー、M.グラボヴィッチ
lptDの変異型対立遺伝子は緑膿菌の透過性を増加させ、抗生物質に対する本質的耐性の決定因子を明らかにする
Antimicrob. Agents Chemother., 60 (2016), 845-854頁, 10.1128/AAC.01747-15
スコープで見るGoogle Scholar
39
J. Song、L. Steidle、I. Steymans、J. Singh、A. Sanner、L. Böttinger、D. Winter、T. Becker
ミトコンドリアHsp70はF(1)F(O)-ATP合成酵素の集合を制御する
Nat. Commun., 14 (2023), p. 39, 10.1038/s41467-022-35720-5
スコープで見るGoogle Scholar
40
J. Smeitink、L. van den Heuvel、S. DiMauro
酸化的リン酸化の遺伝学と病理学
Nat. Rev. Genet., 2 (2001), 342-352頁, 10.1038/35072063
スコープで見るGoogle Scholar
41
D.F.ウィルソン
酸化的リン酸化:細胞および組織代謝における制御と役割
J. Physiol., 595 (2017), 7023-7038頁, 10.1113/JP273839
スコープで見るGoogle Scholar
42
A.J. Wolf、C.N. Reyes、W. Liang、C. Becker、K. Shimada、M.L. Wheeler、H.C. Cho、N.I. Popescu、K.M. Coggeshall、M. Arditi、D.M. Underhill
ヘキソキナーゼは細菌ペプチドグリカンを検出する自然免疫受容体である
Cell, 166 (2016), 624-636頁, 10.1016/j.cell.2016.05.076
PDFで記事を見るScopusで記事を見るGoogle Scholar
43
S. メイラン、C.B.M.ポーター、J.H.ヤン、P.ベレンキー、A.グティエレス、M.A.ロブリッツ、J.パーク、S.H.キム、S.M.モスコウィッツ、J.J.コリンズ
炭素源はトリカルボン酸サイクル制御を介して緑膿菌の抗生物質感受性を調節する
Cell Chem. Biol., 24 (2017), pp.195-206, 10.1016/j.chembiol.2016.12.015
PDFで記事を見るScopusで記事を見るGoogle Scholar
44
N. ジョーンズ、J.ブラギ、F.ザニ、A.リース、D.G.ヒル、B.J.ジェンキンス、C.J.ブル、D.モレイラ、A.I.M.バンタン、J.G.クローニン、他。
フルクトースはグルタミン依存性酸化代謝を再プログラムし、LPS誘発性炎症をサポートする。
Nat. Commun., 12 (2021), p. 1209, 10.1038/s41467-021-21461-4
スコープで見るGoogle Scholar
45
V. V. Vijayan、P. Pradhan、L. Braud、H.R. Fuchs、F. Gueler、R. Motterlini、R. Foresti、S. Immenschuh
ヒトとマウスのマクロファージはリポ多糖に対する代謝応答が異なる - 解糖の役割は異なる
Redox Biol., 22 (2019), Article 101147, 10.1016/j.redox.2019.101147
PDFで記事を見るScopusで記事を見るGoogle Scholar
46
J. シマースキー、D.オソウスキー、D.E.ウォルターズ、D.M.ミューラー
オリゴマイシンはATP合成酵素に共通する薬物結合部位をフレーム化する
Proc. Natl. Acad. Sci. USA, 109 (2012), 13961-13965頁, 10.1073/pnas.1207912109
スコープで見るGoogle Scholar
47
I.R.シュレープファー、M.ジョシ
CPT1Aを介した脂肪酸化、そのメカニズム、および治療の可能性
Endocrinology, 161 (2020), Article bqz046, 10.1210/endocr/bqz046
スコープで見るGoogle Scholar
48
A.S. Divakaruni, W.Y. Hsieh, L. Minarrieta, T.N. Duong, K.K.O. Kim, B.R. Desousa, A.Y. Andreyev, C.E. Bowman, K. Caradonna, B.P. Dranka, et al.
エトモキシルはCoAのホメオスタシスを破壊することでマクロファージの分極を阻害する
Cell Metab., 28 (2018), 490-503.e7頁, 10.1016/j.cmet.2018.06.001
PDFで記事を見るScopusで記事を見るGoogle Scholar
49
M.L.コワルスキー、A.ディディエ、M.A.カリナー
気道における神経原性炎症。I.神経原性刺激によるラット気道内腔への血漿タンパク質の滲出
Am. Rev. Respir. Dis., 140 (1989), 101-109頁, 10.1164/ajrccm/140.1.101
スコープで見るGoogle Scholar
50
Y. 南方陽一郎、中西正人、平野友樹、松永健一郎、山形達男、一ノ瀬真理子
COPD気道における微小血管透過性亢進
Thorax, 60 (2005), p. 882, 10.1136/thx.2005.045765
スコープで見るGoogle Scholar
51
I. Tirosh, B. Izar, S.M. Prakadan, M.H. Wadsworth 2nd, D. Treacy, J.J. Trombetta, A. Rotem, C. Rodman, C. Lian, G. Murphy, et al.
シングルセルRNA-seqによる転移性黒色腫の多細胞生態系の解明
Science, 352 (2016), pp.189-196, 10.1126/science.aad0501
スコープで見るGoogle Scholar
52
J.L.マッカーヴィル、J.S.エアーズ
疾患耐性:概念とメカニズム
Curr. Opin. Immunol., 50 (2018), 88-93頁, 10.1016/j.coi.2017.12.003
PDFで記事を見るScopusで記事を見るGoogle Scholar
53
R. ベチャラ、M.J.マクギーチー、S.L.ガッフェン
健康および疾患におけるIL-17シグナルの代謝調節活性
J. Exp. Med., 218 (2021), Article e20202191, 10.1084/jem.20202191
スコープで見るGoogle Scholar
54
N. シャンムガム、M.A.レディ、M.グハ、R.ナタラジャン
単球系細胞における高グルコース誘導性炎症性サイトカインおよびケモカイン遺伝子の発現
糖尿病, 52 (2003), 1256-1264頁, 10.2337/diabetes.52.5.1256
スコープで見るGoogle Scholar
55
L. クロスビー、B.デイビス、S.ジョシ、M.ジャーディン、J.ポール、M.ネオラ、N.D.バーナード
ケトジェニックダイエットと慢性疾患: リスクとベネフィットの秤量
フロント。Nutr., 8 (2021), Article 702802, 10.3389/fnut.2021.702802
スコープで見るGoogle Scholar
56
Y. Y.Song、Y.Yang、W.Zeng、J.J.Loor、Q.Jiang、Z.Peng、Y.Li、S.Jiang、X.Feng、X.Du、et al.
β-ヒドロキシ酪酸は、ケトーシス牛におけるプロテインキナーゼCおよびミオシン軽鎖2シグナル伝達経路の活性化を介して好中球の遊走距離を障害する。
J. Dairy Sci., 105 (2022), 761-771頁, 10.3168/jds.2021-20875
PDFで記事を見るScopusで記事を見るGoogle Scholar
57
Z. 東、孫、唐、羅、賈、徐、江、J.J.ロアー、徐、徐丙
β-ヒドロキシ酪酸はケトーシス牛において、ROS-NLRファミリー・ピリン・ドメイン含有3インフラマソーム(NLRP3)経路を介して単球機能を障害する。
Front. Vet. Sci., 9 (2022), Article 925900, 10.3389/fvets.2022.925900
スコープで見るGoogle Scholar
58
A. Wang, S.C. Huen, H.H. Luan, S. Yu, C. Zhang, J.D. Gallezot, C.J. Booth, R. Medzhitov
細菌性およびウイルス性炎症における組織寛容に対する絶食代謝の相反する効果
Cell, 166 (2016), 1512-1525.e12頁, 10.1016/j.cell.2016.07.026
PDFで記事を見るScopusで記事を見るGoogle Scholar
59
J.L.カドゥルガムワ、T.J.ビバリッジ
緑膿菌は通常増殖時およびゲンタマイシン曝露時に膜小胞と結合して病原因子を放出する:酵素分泌の新規メカニズム
J. Bacteriol., 177 (1995), 3998-4008頁, 10.1128/jb.177.14.3998-4008.1995
スコープで見るGoogle Scholar
60
T.N.エリス、S.A.ライマン、M.J.キューン
緑膿菌から自然に産生される外膜小胞は、リポ多糖とタンパク質の両成分を複合的に感知することにより、強力な自然免疫応答を惹起する。
Infect. Immun., 78 (2010), 3822-3831頁, 10.1128/IAI.00433-10
スコープで見るGoogle Scholar
61
S.K. Vanaja、A.J. Russo、B. Behl、I. Banerjee、M. Yankova、S.D. Deshmukh、V.A.K. Rathinam
細菌外膜小胞はLPSの細胞質局在とカスパーゼ-11活性化を媒介する
Cell, 165 (2016), pp.1106-1119, 10.1016/j.cell.2016.04.015
PDFで記事を見るScopusで記事を見るGoogle Scholar
62
O.J. McElvaney、Z. Zaslona、K. Becker-Flegler、E.M. Palsson-McDermott、F. Boland、C. Gunaratnam、E. Gulbins、L.A. O'Neill、E.P. Reeves、N.G. McElvaney
嚢胞性線維症における抗炎症戦略としてのNLRP3インフラマソームの特異的阻害
Am. J. Respir. Crit. Care Med., 200 (2019), pp.1381-1391, 10.1164/rccm.201905-1013OC
スコープで見るGoogle Scholar
63
R. del Campo, E. Martínez, C. del Fresno, R. Alenda, V. Gómez-Piña, I. Fernández-Ruíz, M. Siliceo, T. Jurado, V. Toledano, F. Arnalich, et al.
嚢胞性線維症患者の循環単球において、トランスロケーションされたLPSがエンドトキシン耐性を引き起こす可能性
PLoS One, 6 (2011), Article e29577, 10.1371/journal.pone.0029577
スコープで見るGoogle Scholar
64
J.D. King、D. Kocíncová、E.L. Westman、J.S. Lam
総説: 緑膿菌におけるリポ多糖生合成
Innate Immun., 15 (2009), 261-312頁, 10.1177/1753425909106436
スコープで見るGoogle Scholar
65
E.M. Nowicki、J.P. O'Brien、J.S. Brodbelt、M.S. Trent
緑膿菌LpxTのキャラクタリゼーションにより、二重位置リピドAキナーゼ活性と外膜修飾の協調的制御が明らかになった。
Mol. Microbiol., 94 (2014), 728-741頁, 10.1111/mmi.12796
スコープで見るGoogle Scholar
66
J.M.ワイス、L.C.デイビーズ、M.カルワン、L.イレバ、尾崎正和、R.Y.チェン、L.A.リドナー、C.M.アヌンツィアータ、D.A.ウィンク、D.W.マクビカー
イタコン酸はマクロファージ代謝と腹膜腫瘍のクロストークを媒介する
J. Clin. Invest., 128 (2018), 3794-3805頁, 10.1172/jci99169
スコープで見るGoogle Scholar
67
M. Bambouskova, L. Potuckova, T. Paulenda, M. Kerndl, D.A. Mogilenko, K. Lizotte, A. Swain, S. Hayes, R.D. Sheldon, H. Kim, et al.
イタコン酸は後期NLRP3インフラマソーム活性化に対する耐性を与える
Cell Rep., 34 (2021), Article 108756, 10.1016/j.celrep.2021.108756
PDFで記事を見るScopusで記事を見るGoogle Scholar
68
V. Lampropoulou, A. Sergushichev, M. Bambouskova, S. Nair, E.E. Vincent, E. Loginicheva, L. Cervantes-Barragan, X. Ma, S.C.C. Huang, T. Griss, et al.
イタコネートはコハク酸デヒドロゲナーゼの阻害とマクロファージの代謝リモデリングおよび炎症の制御を関連付ける
Cell Metab., 24 (2016), 158-166頁, 10.1016/j.cmet.2016.06.004
PDFで記事を見るScopusで記事を見るGoogle Scholar
69
L.A.J.オニール、M.N.アルチョモフ
イタコン酸:マクロファージ機能における代謝リプログラミングの申し子
Nat. Rev. Immunol., 19 (2019), 273-281頁, 10.1038/s41577-019-0128-5
Scopusで見るGoogle Scholar
70
C.G.ピース、L.A.オニール
宿主防御と炎症におけるイタコン酸の役割
J. Clin. Invest., 132 (2022), Article e148548, 10.1172/JCI148548
Google Scholar
71
S. Asif, R.Y. Kim, T. Fatica, J. Sim, X. Zhao, Y. Oh, A. Denoncourt, A.C. Cheung, M. Downey, E.E. Mulvihill, K.H. Kim
Hmgcs2を介したケトジェネシスは、高脂肪食誘発性肝肉食症を調節する
Mol. Metab., 61 (2022), Article 101494, 10.1016/j.molmet.2022.101494
PDFで記事を見るScopusで記事を見るGoogle Scholar
72
M.K.バッドマン、P.ピシオス、A.R.ケネディ、G.コウコス、J.S.フリアー、E.マラトス-フリアー
肝線維芽細胞増殖因子21はPPARαによって制御され、ケトーシス状態における肝脂質代謝の重要なメディエーターである。
Cell Metab., 5 (2007), 426-437頁, 10.1016/j.cmet.2007.05.002
PDFで記事を見るScopusで記事を見るGoogle Scholarで記事を見る
73
M.K. Badman、A. Koester、J.S. Flier、A. Kharitonenkov、E. Maratos-Flier
線維芽細胞増殖因子21欠損マウスはケトーシスに対する適応障害を示す
内分泌学, 150 (2009), 4931-4940頁, 10.1210/ja.2009-0532
スコープで見るGoogle Scholar
74
Y.H. Youm, K.Y. Nguyen, R.W. Grant, E.L. Goldberg, M. Bodogai, D. Kim, D. D'Agostino, N. Planavsky, C. Lupfer, T.D. Kanneganti, et al.
ケトン代謝物β-ヒドロキシ酪酸は、NLRP3インフラマソームを介する炎症性疾患をブロックする
Nat. Med., 21 (2015), pp.263-269, 10.1038/nm.3804
スコープで見るGoogle Scholar
75
E.C.グラフ、H.ファン、D.ワンダース、R.L.ジャッド
ヒドロキシカルボン酸受容体2の抗炎症作用
メタボリズム, 65 (2016), 102-113頁, 10.1016/j.metabol.2015.10.001
PDFで記事を見るScopusで記事を見るGoogle Scholar
76
F. Karagiannis, K. Peukert, L. Surace, M. Michla, F. Nikolka, M. Fox, P. Weiss, C. Feuerborn, P. Maier, S. Schulz, et al.
COVID-19におけるケトジェネシスの障害が代謝とT細胞の機能障害を結びつけている。
Nature, 609 (2022), 801-807頁, 10.1038/s41586-022-05128-8
スコープで見るGoogle Scholar
77
E. Armeni, U. Aziz, S. Qamar, S. Nasir, C. Nethaji, R. Negus, N. Murch, H.C. Beynon, P. Bouloux, M. Rosenthal, et al.
COVID-19における高血糖緊急症例における遷延性ケトナ血症:後方視的症例シリーズ
Lancet Diabetes Endocrinol., 8 (2020), 660-663頁, 10.1016/S2213-8587(20)30221-7
PDFを見る記事を見るScopusGoogle Scholarで見る
78
P. カニカルラ-マリー、S.K.ジャイン
高ケトン血症とケトーシスは1型糖尿病の合併症リスクを高める
Free Radic. Biol. Med., 95 (2016), pp.268-277, 10.1016/j.freeradbiomed.2016.03.020
PDFを見る記事を見るScopusで見るGoogle Scholarで見る
79
M. エルシェイク、G.S.コンウェイ
ターナー症候群における肥満が心血管危険因子に及ぼす影響
Clin. Endocrinol., 49 (1998), 447-450頁, 10.1046/j.1365-2265.1998.00552.x
スコープで見るGoogle Scholar
80
U.E. Martinez-Outschoorn、M. Peiris-Pagés、R.G. Pestell、F. Sotgia、M.P. Lisanti
がん代謝:治療の視点
Nat. Rev. Clin. Oncol., 14 (2017), p. 113, 10.1038/nrclinonc.2017.1
Google Scholar
81
U.E. Martinez-Outschoorn、Z. Lin、D. Whitaker-Menezes、A. Howell、F. Sotgia、M.P. Lisanti
ケトン体の利用が腫瘍の増殖と転移を促進する
細胞周期, 11 (2012), 3964-3971頁, 10.4161/cc.22137
スコープで見るGoogle Scholar
82
P.P. Ogger, G.J. Albers, R.J. Hewitt, B.J. O'Sullivan, J.E. Powell, E. Calamita, P. Ghai, S.A. Walker, P. McErlean, P. Saunders, et al.
イタコン酸は肺線維症の重症度を制御する
Sci.Immunol.、5(2020)、記事eabc1884、10.1126/sciimmunol.abc1884
スコープで見るGoogle Scholar
引用 (0)
4
リードコンタクト
© 2023 The Author(s). 発行:エルゼビア社
エルゼビアのロゴとワードマーク
サイエンスダイレクトについて
リモートアクセス
ショッピングカート
広告掲載
お問い合わせとサポート
利用規約
プライバシーポリシー
当社は、サービスの提供・向上、コンテンツや広告のカスタマイズのためにクッキーを使用しています。続行することで、クッキーの使用に同意したことになります。
このサイト上のすべてのコンテンツ: 著作権 © 2023 Elsevier B.V.、そのライセンサー、および寄稿者。テキストマイニング、データマイニング、AIトレーニング、および同様の技術に関するものも含め、すべての権利はエルゼビアに帰属します。すべてのオープンアクセスコンテンツには、クリエイティブ・コモンズのライセンス条件が適用されます。
RELXグループホームページ
フィードバック
この記事が気に入ったらサポートをしてみませんか?
