
人気講師ノート15 ランベルト・ベールの法則の適用限界について
こんにちわ。コロナ禍の中,急遽立ち上げたオンデマンド授業・Zoomによる双方向授業,良い機会となりました。どのようなツールを用いたかは,別の記事で書いていこうかと思います。
さて,前回の記事「ランベルト・ベールの法則から導かれる吸光度の最適値」に続いて,これらの理論をもとに,吸光度と濃度の関係について,適用限界について述べさせていただきます。
ランベルト・ベールの法則
A=εcl
(A:吸光度, ε:モル吸光係数、c:モル濃度、l:セルの長さ)
吸光度Aは,セルの長さ(溶液の厚み)と濃度cに比例します。
これを踏まえまして,適用限界を考えてきましょう。
適用限界① 試料濃度
前回の記事でも書いたが,試料濃度が高い場合,正確に測定できているとは理論的に言えない。
また,試料濃度が,0.01M以上になると溶液全体の屈折率が変化したり,溶質である物質がほかの物質(溶媒分子)等によって摂動を受けることが考えられます。これらは,測定物質のモル吸光度εの値に影響を与えるため,正および負のどちらかにずれが生じる原因となります。
適用限界② 化学平衡
溶質の解離・会合・錯体形成または溶媒分子との相互作用など,化学平衡が存在する場合,スペクトルは溶質濃度によって大きく変化することが予想される。以下に,代表的な例を挙げておきたい。
(1) 多量体の形成
ベンジルアルコールのOH伸縮振動の吸収帯は四塩化炭素溶媒中で濃度によって大きく変化することが知られている。これは,モノマーとオリゴマーの平衡関係が存在するためである。
4C6H5CH2OH ⇔ (C6H5CH2OH)4
単体 4量体
3700cm-1 3400cm-1
3700cm-1で吸光度を測定すると高濃度ほど,オリゴマーが生成するために負のズレが生じ,3400cm-1では正のズレが生じる。
(2) pHによる構造変化
ニクロム酸塩とクロム酸塩は水溶液中でpHによって、以下のような化学平衡の関係がある。
Cr2O7^2- + H2O ⇔ 2CrO4^1- + 2H^+
348nm 372nm
緩衝液を用いてpH一定条件下で標準溶液を調整しない限り,348nmおよび372nmで吸光度を測定するときに正あるいは負のズレが生じる。
一方,等吸収点(isosbestic point)で測定するとベールの法則は成立します。吸光度は平衡濃度に比例するのではなく,分析濃度に比例することになります。弱酸や弱塩基の溶液の吸光度測定も定量分析の場合には等吸収点で行われることをお忘れなく。
適用限界③ 装置に依存
測定装置の波長純度が悪く多色光となる場合、負の誤差が生じやすい。また、極大吸収波長以外で測定を行うと負の誤差が生じる。
迷光の場合、測定波長の光と迷光とで試料に対する吸収の度合いが異なるために負の誤差が生じやすい。
等吸収点(isosbestic point)
等吸収点(isosbestic point)という新しい言葉が出てきたので、次回はこれについて説明します。指示薬、皆さんお聞きしたことありますよね。
試料の物理的・化学的変化にかかわらず全てのサンプルが同じ吸光度を示す光の波長のことを等吸収点という。よくわからないと思いますので,下記の図を見てみましょう。
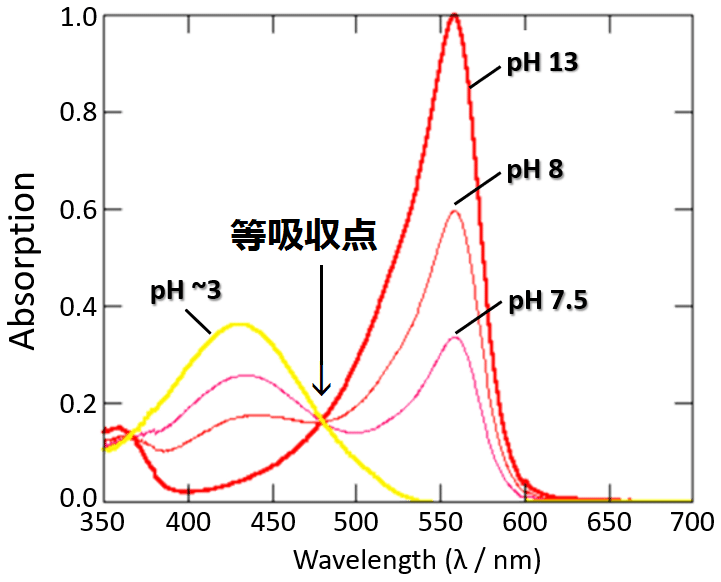
pH指示薬であるフェノールレッドの等吸収点を示す。pHを変更した際の吸収波長において,475nm付近の吸光度(縦軸)に変化は見られない。このように,pHを変更しても他の波長の吸光度は変化しているが,変化しない吸光度の波長(横軸)を等吸収点という。
では,フェノールレッドを例に等吸収点を見てみよう。
ここから先は
¥ 200
学生から大好評だった授業ノートを公開します。役立てていただければ幸いです。また,家でできる実験も書いていきますね。
