
高校化学から熱化学方程式が廃止!めでたい! 何が問題で、どう教えるか。きちんと、エンタルピーで教えるようになります。
※2021年8月に【追記】;YouTube動画と巻末に「エンタルピーの問題と解答(有料)」を追記しました。閲覧数が万越えしました。これからもよろしくお願いします。
▼
当ラボにも教員志望者がおり,時折「学習指導要領」の議論をします。昨日学生から質問されて知ったことなのですが,
なんと
高校化学から熱化学方程式が【廃止】
されました。
これは、めでたいことなんです。
高校化学では,化学エネルギーを「熱化学方程式」を通して教えていましたが,これからは「エンタルピー変化」で教えることになりそうです(すぐには無理でしょうか・・・)。Noteにも教員志望者がいると思いますので,①熱化学方程式の問題点と②エンタルピーでの解説(教え方)も含めて備忘録を投稿したいと思います。
熱化学方程式の問題点
「実際!?これがなんの影響があるの?」と思いの方について,
極々、簡潔に説明すると,日本の高校では「-1」と教えていたのが,日本の大学(海外の高等学校含)では「1」と教えます。
「1」を「-1」と書いたら,「バツ」ですよね?
もう「-1」って教えるのやめて,大学進学後・留学後でも使える知識で教えましょう。というのが今回の改訂です。
祝!
私の解説なんて読みたくない!という方は,「後飯塚由香里, 化学と教育, 66(9), pp. 454-455 (2018)」をご覧ください。
高校の先生へ
高校教員や受験関係の対応は大変かと思います。ただ,「日本の常識,世界の非常識」のひとつが解消され,もやもやする必要がなくなりました。以下の学習指導要領部分も引用しておきますので,【生徒】に対して,是非とも留学後・大学進学後にも通じる「正確な」化学エネルギーの考え方を教えてください。よろしくお願いします。
改訂された学習指導要領
高等学校学習指導要領を引用させていただきます。新旧比較からも化学エネルギーの差を「熱化学方程式」から「エンタルピー変化とエントロピー」での説明に切り替わっていることがわかります。
(URLを変えるの何とかなりませんか?リンクが切れちゃうんです。文部科学省様)
(新) 高等学校学習指導要領解説 理科編 理数編 平成30年7月 P103

(旧) 高等学校学習指導要領解説 理科編 平成21年7月 P64-65

反応熱とは
反応熱とは「定圧反応下において、化学反応に伴い,発生あるいは吸収される熱」のことです。発生する熱反応を発熱反応といい,吸収される熱反応を吸熱反応といいます。この発熱反応と吸熱反応について,
「プラス」と「マイナス」が高校と大学で逆転するという状態です。これを修正したのが、今回の改定となります。
具体例を通して、何が問題なのか考えてみる
①ハーバーボッシュ法として高校化学で学ぶアンモニア合成法や②日本近郊に埋蔵されているメタンハイドレートを例にして,熱化学方程式とエンタルピー変化を説明します。
① アンモニアは,窒素ガス(N2)と水素(H2)が反応して,アンモニア(NH3)が合成され、合成時に92kJの【発熱】があります。
② 吸熱反応の例として,メタン(CH4)と水(H2O)が反応して,水素と一酸化炭素(CO)が生成され、生成時に208kJの【吸熱】があります。
熱化学方程式での表記
発熱反応を【プラス】,吸熱反応を【マイナス】とします。
N2(g) + 3H2(g) = 2NH3 + 92 kJ
CH4(g) + H2O(g) = 3H2(g) + CO(g) - 208 kJ
「=(イコール)」があるように,左辺と右辺はエネルギー的に等しいことを示しています。「=(イコール)」が化学反応式で出てくるのは,熱化学方程式のみです。
エンタルピー変化による表記
発熱反応を【マイナス】,吸熱反応を【プラス】とします。
N2(g) + 3H2(g) → 2NH3 ; ΔH = ー92 kJ
CH4(g) + H2O(g) → 3H2(g) + CO(g) ; ΔH = + 208 kJ
熱化学方程式とは違って,「→(矢印)」で反応の進む方向を示します。反応熱を示すエンタルピー変化(ΔH)は,化学反応式の右(あるいは下)に記載します。
もうお分かりだとは思いますが,反応熱の【符号】が逆転します。
この「=(イコール)」や符号の逆転は日本の高校のみの特殊な教え方です。これが、やっと改訂されました。めでたいでしょ!?
大学で化学エネルギーを取り扱うとき,「熱化学方程式」から「エンタルピー変化」への切り替えは、日本の大学で毎年のように扱われており,学生の混乱をまねき,膨大な無駄な時間を消費していました。
近々,学部3-4年は私の物理化学の講義でも、この不毛な変換をやり続ける必要があります。
さて,何が問題だったのか?
ギブスエネルギー等いろいろと説明する必要があるのですが,初学者でも直感的に「おかしくない?!熱化学方程式!??」と感じるように説明していきたいと思います。あるいは,直感に優れた生徒は,このあたりが「ん??」であり、高校で納得した授業と逆のために,「わからなくなり,大学の物理化学が、嫌いになるのかもしれません」。
物理化学が嫌いになる原因! 非常に罪深い!
では,近年の日本近海でも採掘できるメタンハイドレート(CH4)の燃焼反応を通して,説明していきたいと思います。
メタンの燃焼反応を通して、どこがおかしいか,直感的に感じましょう。
メタン(CH4)は空気中の酸素(O2)と反応して,二酸化炭素(CO2)と水 (H2O)を生成し,その際に熱が発生します。つまり、発熱反応です。
熱化学方程式: CH4(g) + 2O2 (g) = CO2(g) + 2H2O (l) + 891kJ
エンタルピー: CH4(g) + 2O2 (g) → CO2(g) + 2H2O (l) ΔH = ー891 kJ
高校化学でも学ぶエネルギー図で反応を記すと下記のように書けます。
① 水と同じように,エネルギーは高いところから低いところへ自発的に変化します。
② メタンという燃料が酸素と結合して【自発的に】燃えることで,熱を放出します。
③ 反応することで、二酸化炭素と水という地球上に沢山ある物質に安定化する
のは、直感的にわかると思います。下記が模式図です。
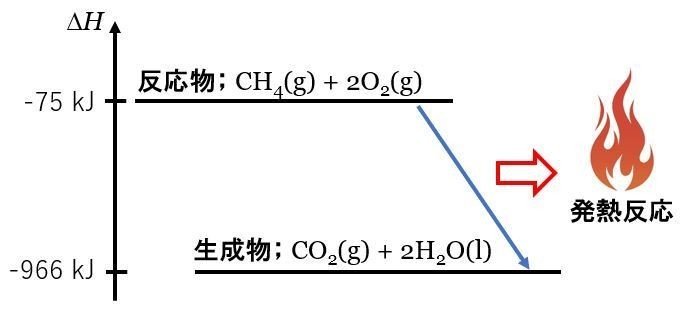
熱化学方程式として上記の図を理解すると,生成物(CO2とH2O)は,反応物(CH4とO2)に比べて891kJエネルギーが低い。そのため,「=(イコール)」で左辺と右辺のエネルギーを等しくするために,反応熱を「プラス」としています。
つまり,反応物 = 生成物 ± 反応熱 と考えるわけです。
しかし,メタンが燃えることで熱化学方程式ではエネルギー的にプラス(増えた?)なのに,エネルギー位置としては低下?しています。式はプラスなのに位置関係としてはマイナスじゃん。縦軸のエネルギーの概念って何?のように,このプラスはなんか変だよ?
直感的には「非常に気持ち悪いのです」。
水の流れを例にしてエネルギー循環を理解
さて、エンタルピーで考える際には、エネルギー循環として【水の流れ】を例にするとわかりやすいです。以下の絵は,水循環を表しています。

この水の流れを、エネルギー図にあてはめたものが,下の図となります。

山の上にある水は川や海へ流れていきます。この時,高い位置にある水はエネルギーを持っているので,低所に移動する際に水車などを設置すれば,水の位置エネルギーを受けて水車が回ります。この水車を回す原理を利用しているのが水力発電です。
高いエネルギーは,低いエネルギーへ移動する際に、外にエネルギーを放出することができます。(これが化学変化を伴う熱反応であれば発熱です。)
海へ流れ込んだ水は,太陽光などからエネルギーを受け取り,水蒸気となって山へ戻っていきます。つまり、エネルギーを受けて、高いエネルギー状態に移動します。(化学変化を伴うのであれば、熱というエネルギーを吸収(吸熱)して高いエネルギー状態に戻ります。これが吸熱です。)
これで、循環するわけです。
低いエネルギーは、外からエネルギーを加えることで,高いエネルギーへと変化します。
これを「熱」で考えると、こうなります。
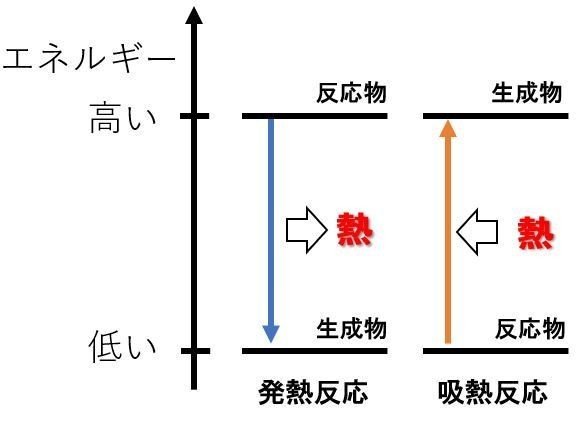
エネルギーが下がる反応では,熱(エネルギー)を放出する発熱反応であり,エネルギーが上がる反応では,熱(エネルギー)を吸収する吸熱反応です。
エンタルピー変化とは、このやり取りする「熱」の事です。
エンタルピー変化で考える場合,反応前後の変化量(ΔH)を考えます。変化量の算出方法には,ルールがあって
生成物(ゴール)-反応物(スタート)=ΔH
なぜ,反応物から生成物を引くのかは,マラソンの距離を考えてみるとわかります。東京駅から箱根までの距離を考える際に,箱根ー東京駅となりますよね。必ず,ゴールからスタートを引くことで「やり取りする熱」の量が算出されます。
さて,発熱反応の場合,生成物(ゴール)-反応物(スタート)を計算すると,ΔHは必ず【負】の値になります。小さい値(エネルギーの低い値)から高い値(エネルギーの高い値)を引くためです。
一方,吸熱反応の場合,生成物(ゴール)-反応物(スタート)を計算すると,ΔHは必ず【正】の値になります。高い値から小さい値を引くためです。
エンタルピー変化で考えると,発熱反応は【負】となり,吸熱反応は【正】となります。先ほどの熱化学方程式であった図で考えるモヤモヤ感もなくなります。燃えることでエネルギー的に安定化し,エネルギーが下がることと,符号が一致しますよね。
ただ,発熱と吸熱だけで,反応の【自発】を判断することはできずに,エントロピーを考慮する必要があります。
エントロピーについて
エンタルピーの発熱反応および吸熱反応を眺めると,発熱反応が水の流れと同様に【自発的】な反応のように思えます。
しかしながら,中学理科で習うように「塩化アンモニウムと水酸化バリウムの反応」や「氷から水への融解反応」は吸熱反応に関わらず自発的に反応が進みます。
吸熱や発熱だけでは,自発性を説明することは出来ません。
氷から水への変化は熱エネルギーを吸収してでも自発的に進むのは,氷から水へのエントロピーの増加が要因です。
この融解反応は,温度をコントロールすることで自発反応を止めることができます。具体的には,温度をゼロ℃にすれば融解反応を止めることができます。つまり,エントロピーは温度と深い関係があることを生徒に説明することにつながります。
結果として,エンタルピー変化と温度で変化するエントロピー変化のバランスによって自発か否かを判断できます。
このバランスの反応が【ギブズエネルギーの式】ということです。
ΔG = ΔH ー TΔS
ギブズエネルギーをどこまで説明するかは,先生たちの判断ですが,ギブズエネルギーを説明せずともエンタルピー変化と温度によって変化するエントロピー変化で自発性は説明できるかと思います。
YouTube動画の紹介
さて、PV数が万越えしましたので,YouTubeによる授業動画を公開しました。
ざっと長文を書き上げましたが,内部エネルギーやエントロピーなどまだまだ触れていないところもあるかと思います。大学時代に学んだことを思い出すには助けになれば幸いかと思います。
科学は面白い!
十分にわかったかと思いますが、さらに下記の良本を読み返すと理解が深まるかと思います。最近の本は説明も丁寧となりましたのでだいぶわかりやすいです。(私が学部生の頃のアトキンスはハードカバーでちょっと意味わかりずらかったですよね(笑))
問題と解答編
さて,エンタルピーでの【問題と解答】を準備しました。これで,新しい教科書にも対応できるかと思います。
ここから先は
¥ 450
学生から大好評だった授業ノートを公開します。役立てていただければ幸いです。また,家でできる実験も書いていきますね。
