BA.1 によるヒト受容体認識の構造的基礎(2022年3月)
Structural Basis for Human Receptor Recognition by SARS-CoV-2 Omicron Variant BA.1
SARS-CoV-2 オミクロン変異体 BA.1 によるヒト受容体認識の構造的基礎
元→Structural Basis for Human Receptor Recognition by SARS-CoV-2 Omicron Variant BA.1 (asm.org)

ABSTRACT
SARS-CoV-2の感染力が非常に強く、急速に広がるオミクロン変異体は、呼吸器系に効率的に感染します。
オミクロンスパイクタンパク質の受容体結合ドメイン(RBD)は、ヒトアンジオテンシン変換酵素2(ACE2)を受容体として認識し、SARS-CoV-2の組織向性において重要な役割を果たします。
ここでは、オミクロンRBD(株BA.1)が、元の武漢株のプロトタイプRBDよりも強くACE2に結合することを示しました。
また、個々のオミクロン変異がACE2結合にどのように影響するかを測定しました。
さらに、ACE2と複合したオミクロンRBD(結晶化を促進するように設計)の結晶構造を2.6Åで決定しました。
構造は、オミクロン変異がRBD/ACE2インターフェースの2つの変異ホットスポットの重要な構造再配置を引き起こしたことを示しており、各オミクロン変異がACE2結合にどのように影響するかを解明しています。
オミクロンRBDによるACE2結合の強化は、ACE2発現レベルが低い呼吸器系へのオミクロン変異体の感染を促進する可能性があります。
私たちの研究は、オミクロン変異体の受容体認識と組織向性についての洞察を提供します。
INTRODUCTION
オミクロン変異株は、COVID-19パンデミックの新たな段階を示しています。
これまでのSARS-CoV-2株は主に肺に感染して重篤な病気を引き起こしたが、オミクロン変異株は主に呼吸器に感染し、症状はより軽度です。
この新しいウイルスの向性により、オミクロン変異体の拡散が加速し、米国では毎日100万人もの新規感染者が出ています。
しかし、オミクロン変異体の呼吸器系向性は不可解です。
ウイルス表面のスパイクタンパク質は、コロナウイルスの宿主細胞への侵入を媒介します。
コロナウイルスの種および組織への親和性と感染性の決定的な要因は、スパイクタンパク質の受容体結合ドメイン(RBD)とその宿主受容体との間の結合相互作用です。
SARS-CoV-2 RBD は、ヒトアンジオテンシン変換酵素 2 (ACE2) を受容体として認識します。
ACE2 は肺で発現しているが、呼吸器ではほとんど発現していません。
オミクロンRBDとACE2の結合相互作用を解明することは、オミクロン変異体の組織向性と感染性を理解する上で重要です。
構造研究により、SARS-CoV-2 RBDとヒトACE2の詳細な相互作用が明らかにされています。
SARS-CoV-2 の RBD と、それに近縁の SARS-CoV-1 の RBD は、どちらもコア構造と受容体結合モチーフ (RBM) という 2 つのサブドメインを含んでいます。
これらのコロナウイルスのRBMは、ACE2とのウイルス相互作用を媒介します。
SARS-CoV-1 RBD/ACE2 インターフェースと SARS-CoV-2 RBD/ACE2 インターフェースの両方で、次の 3 つの変異ホットスポットが特定されています。そのうち 2 つは ACE2 の Lys353 と Lys31 を中心としており (それぞれホットスポット 353 とホットスポット 31)、3 つ目は RBM の受容体結合リッジに関係しています (ホットスポット リッジ) (図 1A)。
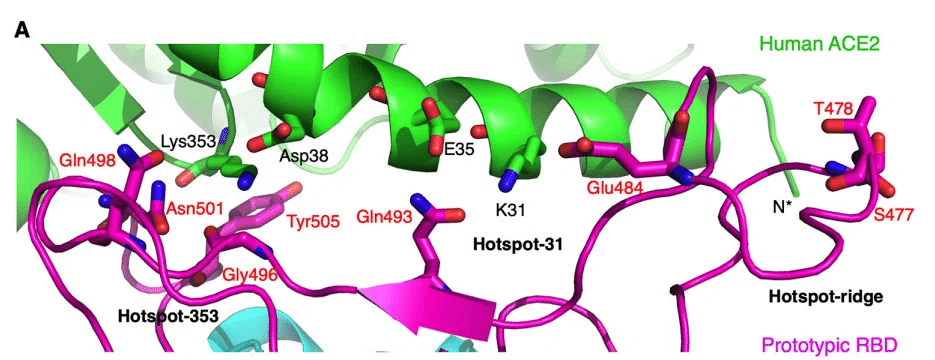
SARS-CoV-1 RBDと比較すると、元のSARS-CoV-2武漢株のRBD(すなわち、プロトタイプRBD)は、RBMがよりコンパクトな受容体結合リッジ(ACE2とのより広範な相互作用を可能にする)とホットスポット353とホットスポット31のいくつかの残基変化(2つのホットスポットの小さな構造調整を引き起こす)を含むため、ヒトACE2にさらに強く結合します(図1A)。
オミクロン変異体のRBM変異はすべて、3つのホットスポットの周辺で発生しました(図1A)。
SARS-CoV-2の分子進化とパンデミックの将来の軌道を理解するには、オミクロン変異体のこれらのRBM変異のそれぞれがACE2結合にどのように影響するかを研究することが重要です。
この研究では、プロトタイプRBDを比較対象として、オミクロンRBDとヒトACE2の結合親和性を測定しました。
また、オミクロン変異体の各RBM変異がACE2結合にどのように影響するかも測定しました。
さらに、ACE2と複合したオミクロンRBDの結晶構造を決定し、ACE2結合における個々のRBM変異の構造的役割を解明しました。
私たちの発見は、オミクロン変異体の組織向性、感染性、および進化に影響を与えます。
RESULTS
オミクロンRBDとヒトACE2の結合相互作用を評価するために、組み換えオミクロンRBDとヒトACE2エクトドメインを調製し、表面プラズモン共鳴(SPR)を使用してそれらの結合親和性を測定しました。
この目的のために、Fcタグ付きヒトACE2(ACE2-Fc)をプロテインAチップ上にコーティングし、Hisタグ付きオミクロンRBD(RBD-His)を流し、結合速度を計算した(図1B、補足資料の表S1も参照)。
プロトタイプRBD-Hisは、オミクロンRBD-Hisとの比較に使用されました。
結果は、オミクロンRBD-HisがプロトタイプRBD-Hisよりも3.9倍強くACE2-Fcに結合することを示しました。

上記の結果を確認するために、オミクロンRBD-HisとプロトタイプRBD-Hisを2つの別々の化学架橋チップにコーティングし、Hisタグ付きACE2(ACE2-His)を流し、結合速度を個別に計算しました。
結果は、オミクロンRBD-HisがプロトタイプRBD-Hisよりも1.7倍強くACE2-Hisに結合することを示しました(図1C、表S1)。
全体的に、オミクロンRBDはプロトタイプRBDよりもACE2に強く結合します。
オミクロン変異体の個々の RBM 変異が ACE2 結合にどのように影響するかを評価するために、オミクロン変異体の RBM 変異の 1 つを含むプロトタイプ RBD-His を準備し、SPR を使用してその ACE2 結合を測定しました。
ACE2-Fc をプロテイン A チップにコーティングし、変異 RBD-His を流しました。
結果は、プロトタイプ RBD と比較して、変異 S477N および N501Y は ACE2 結合を大幅に強化し、変異 Q493R、G496S、および Y505H は ACE2 結合を大幅に減少させ、変異 T478K は ACE2 結合をわずかに強化し、変異 E484A および Q498R は ACE2 結合にそれほど大きな影響を与えないことを示しました (図 1B、表 S1)。
これらの変異のうち、S477N および T478K 変異 (ホットスポットリッジの一部) は、ACE2 の N 末端との新たな相互作用を導入することで ACE2 結合を強化することが知られています。
しかし、その他の変異(ホットスポット353とホットスポット31の一部)の構造的基礎は不明です。
ACE2結合に関するオミクロン変異(ホットスポット353とホットスポット31の一部)の構造的理解を提供するために、オミクロンRBDとヒトACE2のインターフェースの構造を決定しました。
私たちは以前、SARS-CoV-1またはSARS-CoV-2のRBDとACE2の相互作用を研究するための構造プラットフォームを確立しました。
具体的には、SARS-CoV-1 RBD のコア構造と SARS-CoV-1 類似コロナウイルス (SARS-CoV-2 など) の RBM 領域を含むキメラ RBD を構築しました。
このキメラ RBD と ACE2 の複合体は、SARS-CoV-1 RBD と ACE2 の複合体と同じ条件下で確実に結晶化できます。
言い換えれば、キメラ RBD は、SARS-CoV-1 類似コロナウイルス (SARS-CoV-2 など) の RBM と ACE2 の相互作用を研究するための結晶化の足場を提供します。
実際、キメラ SARS-CoV-2 プロトタイプ RBD と ACE2 の複合体と、野生型 SARS-CoV-2 プロトタイプ RBD と ACE2 の複合体の構造を比較すると、2 つの構造は、RBD/ACE2 インターフェースの全体構造と構造詳細の両方で非常に類似していることが示され、キメラ SARS-CoV-2 プロトタイプ RBD の設計が成功したことが確認されました。
本研究では、ホットスポット 353 とホットスポット 31 の一部であるオミクロン RBM の 6 つの変異 (E484A、Q493R、G496S、Q498R、N501Y、Y505H) を組み込むことで、キメラ SARS-CoV-2 RBD を再設計しました。
私たちは、この新しいキメラ RBD (オミクロン キメラ RBD) とヒト ACE2 の複合体を結晶化することに成功し、その構造を 2.6 Å の解像度で決定しました (図 2、表 1)。

オミクロン RBD/ACE2 複合体の全体的な構造は、プロトタイプ RBD/ACE2 複合体の構造と非常に似ていますが、ホット スポット 353 とホット スポット 31 の構造の詳細は大きく異なり、ACE2 結合におけるこれらの変異のそれぞれの構造的役割が明らかになりました。
プロトタイプRBD/ACE2インターフェースとオミクロンRBD/ACE2インターフェースのホットスポット353の構造詳細を比較しました。

プロトタイプRBDとACE2のインターフェースでは、ACE2のLys353は、ACE2のTyr41とAsp38、RBDのTyr505とAsn501の4つの壁を持つ疎水性トンネルに埋め込まれています(図3A)。
トンネルの終わりでは、Lys353 は ACE2 の Asp38 と RBD の Gly496 の主鎖とそれぞれ塩橋および水素結合を形成します。
オミクロン RBD と ACE2 のインターフェースでは、ホット スポット 353 の周囲に 4 つのオミクロン変異が発生しています (図 3B)。
トンネル壁の 1 つである RBD の以前の Asn501 はチロシンになり、RBD のグリシンに変わった Ser496 の主鎖と側鎖と 2 つの水素結合を形成します。RBD の以前の Gln498 はアルギニンになり、ACE2 の Asp38 と塩橋を形成します。
ACE2 の Asp38 が新しい塩橋パートナーを見つけたため、ACE2 の Lys353 は別の方向を指し、ACE2 の Glu37 と塩橋を形成します。
トンネル壁のもう 1 つである RBD の以前の Tyr505 はヒスチジンになり、Lys353 との疎水性スタッキングが弱くなります。
代わりに、RBD の新しい Tyr501 と Arg498、および ACE2 の Tyr41 と Lys353 は疎水性および芳香族スタッキング相互作用を形成します。
全体として、RBD/ACE2 インターフェースのホット スポット 353 は、プロトタイプ RBD と比較して、オミクロン RBD で大幅な構造再配置を受けています。
次に、ホットスポット 353 の構造詳細と RBD/ACE2 結合データを相関させました (図 1B)。
まず、オミクロン RBD の N501Y 変異は、Tyr501 がホットスポット 353 の周囲に新しい好ましい相互作用ネットワークを形成したため、ACE2 結合を強化します。
新しい相互作用には、RBM を安定化する 2 つの新しい水素結合と、RBM/ACE2 結合を強化するいくつかの疎水性および芳香族スタッキング相互作用が含まれます (図 3B)。
2 番目に、オミクロン RBD の Q498R 変異は、ACE2 の Asp38 と新しい好ましい塩橋を形成する一方で、ACE2 の Lys353 と Asp38 の間の好ましい塩橋を破壊するため、ACE2 結合に実質的な影響はほとんどありません (図 3B)。
3 番目に、G496S 変異は、Ser496 が ACE2 の Lys353 と立体的に干渉するため、ACE2 結合を大幅に減少させます (図 3B)。
最後に、Y505H 変異は ACE2 の結合を減少させます。これは His505 が ACE2 の Lys353 とより弱いスタッキング相互作用を形成するためです (図 3B)。
したがって、ホット スポット 353 の構造配置は、ACE2 結合における個々のオミクロン変異の役割を説明する RBD/ACE2 結合データと一致しています。
また、プロトタイプRBD/ACE2インターフェースとオミクロンRBD/ACE2インターフェースの両方でホットスポット31の構造詳細を分析しました。
プロトタイプRBD/ACE2インターフェースでは、ACE2のLys31とGlu35は両方ともRBDのGln493と水素結合を形成しますが、RBDのGlu484はLys31から塩橋の範囲からわずかに外れています(図4A)。

オミクロンRBD/ACE2インターフェースでは、RBDの以前のGln493がアルギニンになり、Lys31と電荷反発を起こし、Lys31を別の方向に向けさせます(図4B)。
代わりに、Lys31 は ACE2 の Gln76 と水素結合を形成します。
RBD に新たに出現した Arg493 は、RBD の残基 490 の主鎖と水素結合を形成します。
RBD の E484A 変異は、新たな相互作用を形成したり、存在するループの構造を変更したりしませんでした。
したがって、Q493R 変異は、ホット スポット 31 の 2 つの好ましい相互作用 (Gln493 と Lys31 の間、および Gln493 と Glu35 の間) を阻害することで ACE2 結合を低下させますが、E484A 変異は ACE2 結合にほとんど影響を与えません。
DISCUSSION
オミクロン変異体の最近の肺から呼吸器への向性変化は、COVID-19パンデミックの重要な段階を示しています。なぜなら、新たに獲得した呼吸器向性により、オミクロン変異体はより伝染性が高くなり、症状はより軽度で致死率も低くなるからです。
コロナウイルスの種および組織指向性の重要な決定要因は、スパイクタンパク質とその宿主受容体との結合親和性と、宿主プロテアーゼによるスパイクタンパク質の切断の 2 つです。
オミクロンスパイクタンパク質が以前の株と比較してプロテアーゼ感受性を変えたかどうかはまだ不明ですが、この研究では、スパイクRBDとヒトACE2の結合親和性がオミクロン変異体で変化したかどうかを調べました。
私たちの研究では、オミクロンRBDはプロトタイプRBDの3.9倍の強さでFcタグ付き二量体ACE2に結合することが実証されました。
これは、オミクロンRBDとプロトタイプRBDが同様の親和性でFcタグ付きACE2に結合することを示す最近発表された研究とは対照的です。
しかし、今回の研究と公開された研究の SPR 方法論には重要な違いがありました。
今回の研究では、Fc タグ付き ACE2 は固定された向きでプロテイン A チップにコーティングされ、ACE2 のウイルス結合面が上を向き、通過した His タグ付き RBD に完全にアクセス可能でした;公開された研究では、Fc タグ付き ACE2 は化学架橋によりランダムな向き (または特定の未知の優先向き) で CM5 チップにコーティングされました。
細胞表面では、ACE2 は二量体であり、ウイルス結合面が外側を向いていることは注目に値します。
したがって、私たちの SPR 測定は生理学的に関連性が高いと言えます。
私たちは、リバース コーティング SPR を使用して結果を確認しました:His タグ付き RBD を化学架橋によりランダムな方向に CM5 チップにコーティングし、His タグ付き単量体 ACE2 を流しました。
結果から、オミクロン RBD はプロトタイプ RBD よりも ACE2 に強く結合することが確認されましたが、その差はわずか 1.7 倍でした。
ここでも、Fc タグ付き ACE2 をプロテイン A チップにコーティングした最初の SPR アプローチが最も生理学的に関連性が高く、2 番目の SPR アプローチで結論が確認されました。
私たちの研究では、オミクロン変異体の各 RBM 変異が ACE2 結合にどのように影響するかも測定しました。
S477N、N501Y、および T478K は ACE2 結合を強化し、Q493R、G496S、および Y505H は ACE2 結合を減少させ、E484A および Q498R は ACE2 結合にそれほど大きな影響を与えないことが示されました。
これらの変異は、以前に特定された以下の 3 つの変異ホットスポットの周囲に分布していました:ホットスポット 353 (ACE2 残基 Lys353 を中心とする)、ホットスポット 31 (ACE2 残基 Lys31 を中心とする)、およびホットスポット リッジ (RBD の受容体結合リッジを中心とする)。
ホットスポット リッジの変異の構造的根拠は解明されているため、今回の研究ではホットスポット 353 とホットスポット 31 の変異に焦点を当てました。
この目的のために、我々はキメラRBDを含む確立された結晶化プラットフォームを使用して、オミクロンRBMとヒトACE2間の構造界面を決定しました。
我々は以前、SARS-CoV-2 と SARS-CoV-1 の RBD は両方とも、疎水性残基、特にチロシンが豊富な RBD/ACE2 インターフェースで Lys353 と Lys31 を収容するように進化したことを示しました。
今回の研究では、ホットスポット353とホットスポット31の両方で、プロトタイプRBDと比較してオミクロンRBDの重要な構造配置が起こっていることが明らかになりました。
特に、Lys353 と Asp38 の間の以前の塩橋、および Lys31 と Gln493 の間と Glu35 と Gln493 の間の水素結合は、新しい変異によって切断されました;代わりに、Lys353 と Lys31 は両方とも異なる方向を指し、異なる残基と新しい水素結合を形成します。
オミクロン RBD の新しい RBM 変異 (E484A を除く) はそれぞれ、2 つのホット スポットの構造配置に役割を果たしており、RBD/ACE2 結合データを説明しています。
ホット スポットでのこれらの重要な構造配置は、SARS-CoV-2 RBD の重要な進化的ひねりを示しています。
オミクロンRBDによるACE2結合の強化に関する私たちの発見は、COVID-19パンデミックを理解する上で重要な意味を持っています。
ヒトACE2は、肺よりも呼吸器系で低いレベルで発現しています。
RBD による ACE2 結合の強化は、オミクロン変異体の呼吸器感染を促進する可能性があります。
さらに、私たちは最近、プロトタイプスパイクタンパク質のRBDは受容体結合のために立ち上がった姿勢と免疫回避のために横たわった姿勢の両方をとるのに対し、オミクロンスパイクタンパク質のRBDは主に立ち上がった構造をとり、それがACE2結合をさらに強化するはずであることを示しました。
したがって、オミクロン変異体は、ACE2結合を強化するために、RBDの進化とスパイクの開放という2つの戦略を進化させたようです。
これら両方の戦略が、オミクロン変異体の呼吸器向性に寄与した可能性があります。
私たちの研究結果は、オミクロン変異体の組織向性と感染性を明らかにし、SARS-CoV-2の分子進化とCOVID-19パンデミックの今後の軌跡についての洞察を提供します。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
