スパイクN354の糖鎖付加は、複数のメカニズムを通じてSARS-CoV-2のヒトへの適応性を高める(2024年1月)
Spike N354 glycosylation augments SARS-CoV-2 fitness for human adaptation through multiple mechanisms
スパイクN354の糖鎖付加は、複数のメカニズムを通じてSARS-CoV-2のヒトへの適応性を高める
SUMMARY
COVID-19パンデミックの長期化の過程で、選択圧により多くのSARS-CoV-2変異株が生まれました。
最近進化した変異株は、スパイクタンパク質受容体結合ドメイン(RBD)内の追加のグリコシル化において祖先と異なります。
グリコシル化の獲得がウイルスの適応度とヒトへの適応にどのように影響するかの詳細は明確に理解されていません。
ここでは、BA.2.86サブ系統によって獲得されたN354結合グリコシル化が、ウイルスの感染力を弱めるRBD構造制御要素として果たす役割を分析しました。
低下した感染力は、ヘパラン硫酸の存在下で回復できます。ヘパラン硫酸は「N354ポケット」を標的とし、構造遷移の制限を緩和して「RBDアップ」状態をもたらし、調整可能な感染力を付与します。
さらに、N354 グリコシル化によりスパイクの切断と細胞間融合が改善され、特に ADCC 抗体の 1 つのサブセットを回避しました。
ハイブリッド免疫背景における免疫原性の低下と合わせて、これらは単一のスパイクアミノ酸グリコシル化イベントが複数のメカニズムを通じてヒトに選択的優位性をもたらすことを示しています。
HIGHLIGHTS
・N354 グリコシル化は、感染性を調節する構造制御要素として機能
・ヘパラン硫酸の結合モードを変更することで、感染性の低下を回復
・N354 グリコシル化により、融合性が向上し、ADCC 抗体からの回避が可能
・N354 グリコシル化により、免疫原性が低下し、免疫回避が可能
INTRODUCTION
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)によって引き起こされた新型コロナウイルス感染症(COVID-19)のパンデミックは、ほぼ4年間続いています。
パンデミックの過程で、適応力と免疫回避能力が向上した多くの変異株が記録されています。
オミクロンの出現と循環は、この変異体がスパイク(S)に30を超える変異を持っているため、SARS-CoV-2の進化の軌跡における大きな変化を表しています。
その後、BA.2、BA.5、BQ.1、XBBなどのいくつかのオミクロンの子孫が、世界中で複数の感染の波を引き起こしました。
これらの亜系統の連続的な選択は、主に、集団ワクチン接種、自然感染、または突発感染の結果としてヒト血清中に存在する中和抗体によって及ぼされる免疫圧力によって引き起こされます。
しかし、免疫回避は機能障害を伴い、抗体回避変異体の選択や中立に近い変異体の蓄積によりコドン使用が最適ではなくなり、機能に影響を及ぼしています。
更新された(オミクロンベースの)ワクチンによるブーストまたは単一のオミクロン感染により、オミクロン変異体に対する免疫反応は「原初抗原罪」により弱まることが示されています。
しかし、オミクロンへの繰り返しの曝露は、祖先のSARS-CoV-2免疫刷り込みを無効にし、XBB亜系統を含むオミクロン変異体に対する高い中和力価をもたらします。
今日、オミクロンへの繰り返しの曝露によってもたらされた集団免疫の程度を考えると、免疫刷り込みを克服するためのより微妙な人間の適応によるウイルスの進化がすでに進行中である可能性があります。
HIV-1 エンベロープタンパク質よりもグリカンの数は少ないものの、プロトマーあたり 22~23 個の N グリコシル化シークオンからなる高密度グリカンシールドは、SARS-CoV-2 S 構造の重要な特徴です。
グリカンは、タンパク質の折り畳み、コンフォメーションの活性化、免疫回避の調整において内因的および外因的な役割を果たすことが示されています。
病因および選択的スイープ分析により、SARS-CoV-2 S のグリコシル化部位の進化は、種間伝染を成功させるためのアミノ酸配列の適応変異と絡み合っていることが明らかになっています。
たとえば、370 位の N グリコシル化の喪失により、アップ構造の受容体結合ドメイン (RBD) が増加し、それによって受容体認識のための露出とアクセス性が向上し、ヒトにおけるウイルスの感染性が向上することが実証されています。
N370 グリコシル化が果たす役割とは異なり、他の多くのグリカンは、中和抗体に弱い抗原エピトープと中和抗体を誘発できる免疫原性エピトープを保護する糖バリアを形成するだけです。
グリカンシールド密度分析により、歴史的に「回避が強い」と分類されたウイルスは、グリカンシールド密度が大幅に増加していたという強い相関関係が明らかになりました。
その結果、グリコシル化部位は、ヒト宿主におけるウイルスの進化中に、グリカンシールド密度を高めるために積極的に選択されることがよくあります。
これらは、ウイルスが免疫システムを回避するのを助け、感染性に影響を与えます。
したがって、ヒトにおけるウイルスのフィットネスと適応性を向上させると思われる余分なグリカンの獲得は、SARS-CoV-2 パンデミックの長い過程で起こった可能性があります。
S 配列に基づくサルベコウイルスの系統解析により、4 つの系統群が明らかになりました:系統群 1a (例: SARS-CoV-1)、系統群 1b (例: SARS-CoV-2)、系統群 2 (例: Rf1)、系統群 3 (例: BtKY72)。 これらの系統群のコロナウイルスは、ウイルスの感染性、抗原性、異種間感染の調節に役割を果たすことが示された重要な部位で、系統群固有の明確な配列特性を示します (図 1A)。

2002 年に出現し、2003 年に制御され、2004 年に消滅した SARS-CoV-1 とは対照的に、SARS-CoV-2 はヒトと共存しているようです。
XBB 亜種がほぼ完全に世界的に優勢だった期間が長く続いた後、BA.2.86 亜種と名付けられた大幅に変異した系統が急速に世界中に広がり、XBB を凌駕しました (図 1B)。

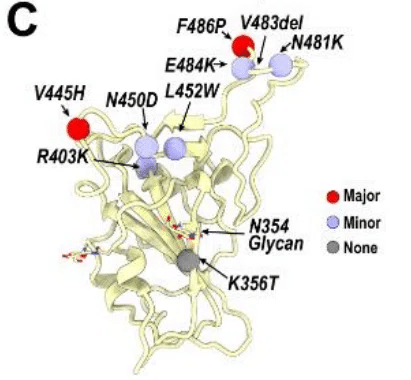
BA.2.86 亜種は、XBB またはその親 BA.2 と比較して S に 30 を超える変異を含んでおり、これらの変異の一部は、以前に流行していた変異ではほとんど見られなかったものです (図 1C)。

驚くべきことに、クレード 1a ウイルスの重要な配列特性である Δ483 は、最近になって SARS-CoV-2 変異体で観察されました。
置換 P621S も SARS-CoV-1 変異体の特徴です。
P681R は Delta に含まれる融合促進モジュレーターです。
P621S と P681R は両方とも BA.2.86 系統で選択されています (図 1A および S1A)。
標準的な N 結合型グリコシル化部位モチーフ (NXT/S) の形成により N354 でグリコシル化を獲得すると予測される変異 K356T は、初期の SARS-CoV-2 変異体や他の系統のサルベコウイルスではなく、最近出現した SARS-CoV-2 変異体でのみ発生しました (図 1A および S1A)。

さらに、BA.2.86 での H245N の新しい置換により、N245 に 1 つの余分なグリカンが生成され、グリカン シールドが徐々に蓄積されることが示唆されています。
偶然にも、2023年9月1日から2024年1月1日までに寄託された18万以上のSARS-CoV-2ゲノムをスキャンした結果、RBD内の新しい非同義変化(A1067C; K356T)の周囲に明確な正の選択の痕跡が見つかり、選択的スイープが示唆されました(図1D)。

グリコシル化部位の獲得がウイルスの適応度にどのように影響するかの詳細は、明確にはわかっていません。
Results
N354グリコシル化はRBD構造を調節
最近の変異体における N245 と N354 でのグリコシル化の推定獲得を調査するため、生理学的条件を模倣して pH 7.4 で BA.2.86 と JN.1 S-トリマーの非対称クライオ電子顕微鏡再構成を原子分解能で決定しました (図 2A、S2A、S2B、表 S1)。

WT、D614G から Alpha、Delta、Omicron、XBB、XBB.1.5 まで、RBD が上向きの構造をより頻繁にサンプリングするほとんどの変異体の S-トリマーとは対照的に (>50%)、BA.2.86 と JN.1 S-トリマーは、3 つの RBD すべてが下向きの構造で主に閉じた状態を採用します (図 2A)。これは、高度に弱毒化された SARS-CoV-2 ワクチン候補である VAS5 の構造観察に似ています。
これらの構造的観察と一致して、BA.2.86 は以前、動物モデルにおいて感染性を低下させ、病原性を弱めたことが報告されています。
他の変異体と比較して、BA.2.86 サブ系統の N245 と N354 には、グリコシル化に関連する 2 つの追加修飾があり、そのうち N245 グリカンは、S トリマーの三角形の頂点の周りの各 NTD の最外領域にあります (図 2B)。
とりわけ、N354 グリカンは、2 つの隣接するサブユニットの NTD と RBD によって形成された溝にあり、それぞれ NTD の T167 および RBD の E340 と水素結合を確立し、「ボルト」のように機能して、S トリマーを「RBD ダウン」状態にロックします (図 2B および 2C)。
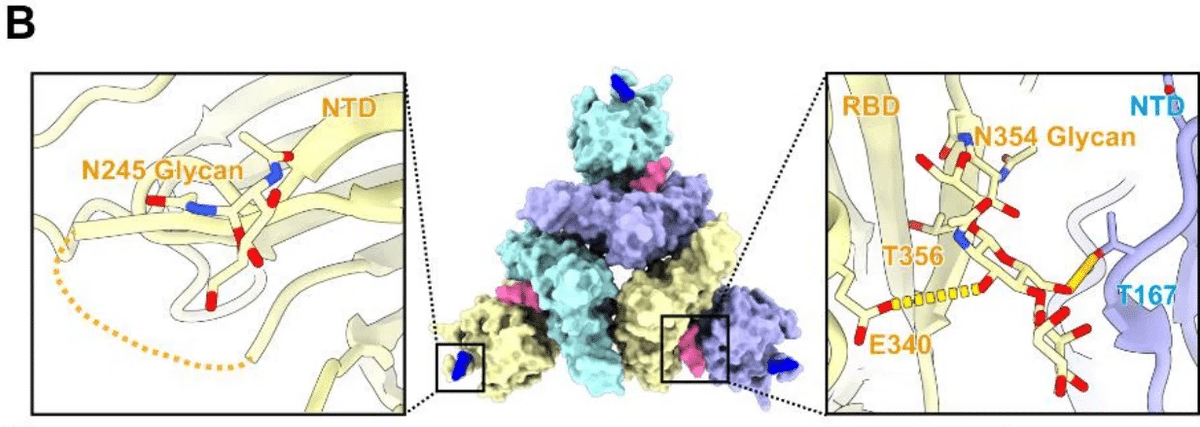

これは、RBD に含まれる多価不飽和脂肪酸である LA が S トリマーの立体配座を固定して RBD ダウン状態を安定化させる役割に似ています。
これに沿って、N354 グリコシル化により、3 つの NTD と RBD によって形成される領域に、よりコンパクトな構造がもたらされます (図 2C)。
閉じた S トリマーを XBB.1.5 の対応するものと重ね合わせると、BA.2.86 の NTD、RBD、および SD1 は、それぞれ 6Å、3Å、および 2Å のシフト距離で 3 倍軸の内側に移動し (図 2D)、NTD と RBD の間に密集したパッキングが形成されました。

N354 グリコシル化が RBD のアップ/ダウン配置の調整に果たす役割をさらに検証するために、N354 のグリコシル化を除去すると予測される BA.2.86-T356K、N354 グリカンを獲得すると予測される XBB.1.5-K356T および BA.2.75-K356T の 4 つの追加の改変コンストラクトと、対照として BA.2.86-ins483V を特徴付け、それらの構造的特徴を祖先株と比較しました (図 2E および S2C)。
N354 グリコシル化により、「閉じた」フォームの割合が BA.2.86 では 19% から 79%、BA.2.75 では 50% から 75%、XBB.1.5 では 45% から 90% に劇的に増加し、「閉じた」フォームが優勢な集団になっていることが観察されました (図 2E)。

しかし、V483 の挿入は RBD 構造の調整にほとんど影響を与えなかった (図 2E)。これは、「閉じた」形態と「開いた」形態の遷移が RBD の変異の一般的な影響によるものではなく、N354 グリコシル化の特定の存在によるものであることを示唆している。
私たちの研究結果と、RBD アップ/ダウン配置に関与できる N165、N234、N370 の N グリカン (すべての SARS-CoV-2 変異体には見られない) に関する以前の研究を組み合わせることで、RBD コンフォメーション変調の詳細な分子基盤を提案できます。RBD コンフォメーション変調では、コンパクトなサブユニット間 (S1/S1) 配置が、隣接するサブユニットとの密接な接続または固有のパッキング モードを介して特定の N グリカンによって媒介される一連の相互作用を中継し、RBD ダウン スイッチを促進します (図 2F)。

サブユニット間の接触と「RBDダウン」率の関係をさらに解明するために、S1/S1またはRBD/RBDまたはNTD-RBD/NTD-RBD相互作用を体系的に分析し、利用可能なSARS-CoV-2 S-トリマー構造(n=21)の「RBDダウン」率を計算しました。これには、本研究で使用した構造も含まれます。
RBD間の接触面積が「RBDダウン」率を決定し、0.92という強力な相関関係にあることがわかりました(図2FおよびS2D)。


注目すべきは、RBD/RBD接触面積が400Å2を超えると、S-トリマーが閉じた状態のみになることです。これは、コウモリRaTG13、センザンコウPCoV_GX、BANAL-20-52などの動物由来のサルベコウイルスに共通する特徴です。
ただし、これらのサルベコウイルスはACE2に結合できますが、ヒト細胞への感染性は低下しています。
これらの結果から、NTD と RBD の界面の間に位置する N354 グリカンが、感染性を調節するための構造制御要素として機能する可能性があるという仮説が生まれました。
N354グリコシル化は、同等のhACE2結合に関係なく感染性を低下
N354 結合グリカンの存在が BA.2.86 亜系統の閉鎖状態を有利にしているという事実を考慮すると、これは感染性の低下と病原性の弱化につながると考えられます。
これを検証するために、まず、hACE2 (293T-ACE2) または TMPRESS2 (293T-TMPRESS2)、または hACE2 と TMPRESS2 の両方 (293T-ACE2-TMPRESS2) を過剰発現する HEK293T 細胞と、Vero、H1299、Huh-7、Calu-3 などの広く使用されている細胞株で擬似型ウイルスを使用して、BA.2.86 と代表的な SARS-CoV-2 変異体の感染性を比較しました。
オミクロン株と同様に、BA.2.86 はエンドソームや TMPRSS2 を介して細胞に侵入できますが、本物の BA.2.86 感染結果と一致して、ACE2 媒介感染を好みます (図 S3A)。
全体的に BA.2.86 は、ほとんどの Omicron 変異体と比較して部分的に感染性が低下しました (図 3A および S3A)。これは最近の研究とほぼ一致しています(特定の変異体と比較して、他の細胞より肺細胞への侵入が改善されていたことを除きます)。

これらの in vitro 所見は、現在この変異体に関連する疾患の重症度上昇の報告がないという in vivo 臨床観察と相関しています。
ウイルスと宿主の受容体の結合と膜融合は、ウイルス感染効率に直接影響します。
RBD ダイナミクス モジュレーター (N354 グリコシル化) と推定融合関連変異 (P621S) が感染性に影響を与えるかどうかをさらに調査するため、それぞれの変異を持つ BA.2/XBB.1.5/BA.2.86 誘導体を構築し、293T-ACE2、Vero、Huh-7 細胞で感染性を測定した (図 3B)。
予想どおり、BA.2 と XBB.1.5 の K356T 変異によって生成された N354 グリコシル化の獲得によって感染性が低下し、BA.2.86 の逆変異 T356K によって生じた N354 グリコシル化の喪失によって感染性が上昇した (図 3B)。
驚くべきことに、BA.2 と XBB.1.5 での融合活性に影響を与えると予測された P621S の置換が感染性の増加に寄与した;一方、BA.2.86 の S621P の逆置換により、感染力がさらに低下しました (図 3B)。

偶然にも、N354 グリコシル化 (K356T 変異) は最初に BA.2.75.5 で出現し、その後 XBB.1.5.44 で出現しましたが、感染力が劇的に低下したためか、一般的な変異体と比較して増殖の利点は示されませんでした (図 S1A)。
S621P は、N354 グリコシル化によってもたらされた感染力の低下をかなり補いました。
次に、N354 グリコシル化による感染力の低下が hACE2 への結合親和性の低下と関係している可能性を検討しました。
このため、RBD に N354 グリコシル化があるかどうかという違いしかない 6 つの変異体 (BA.2.75/BA.2.75.5、XBB.1.5/XBB.1.5.44、BA.2.86/BA.2.86-T356K) の 3 つのペア グループを慎重に選択しました。
表面プラズモン共鳴 (SPR) の結果から、N354 グリコシル化の有無にかかわらず RBD は hACE2 への結合親和性が同等であることが示され、N354 グリコシル化が S トリマーの「RBD ダウン」状態を促進するにもかかわらず、N354 グリコシル化は hACE2 の結合に影響を与えないことが示されました (図 3C)。

これをさらに構造的に検証するために、hACE2 と複合体を形成した BA.2.86 S-トリマーのクライオ電子顕微鏡構造を決定しました (図 3D および S3B、表 S1)。
ほとんどの複合体構造と同様に、hACE2 の 1 つまたは 2 つのコピーが上向きの構成で RBD に結合しています (図 3D)。

結合結果と一致して、N354 グリカンと T356 は両方とも界面から遠く離れた場所にあります (図 S3C)。
ただし、N354 グリコシル化を持つ変異体は hACE2 に対して非常に高い親和性を示しており、感染力の低下をさらに回復するには、緊密な結合が必要である可能性があることが示されています (図 3E)。

BA.2.86 が示す hACE2 の強固な結合への寄与をさらに調査するため、BA.2.86 RBD における N354Q、T356K、K403R、D450N、H445V、W452L、L455S、K481N、ins483V、K484A、または P486F の個々の置換 (逆変異を含む) が hACE2 親和性に与える影響を評価しました。
驚くべきことに、JN.1 で特定された L455S を除くすべての単一変異は、ある程度、結合親和性の増加を示し、D450N、H445V、および P486F の単一の逆変異は、約 3 倍の親和性の増加を引き起こしました (図 3F)。
さらに、主要な変異体で特定された変異も評価され、その中で、N417K と H505Y の逆変異の組み合わせ、および L455F と F456L のフリップ変異のペアは、hACE2 結合を相乗的に強化しました (図 3G)。
構造比較により、N417K と Y505 の置換により、ACE2 の D30 および E37 との追加の水素結合が確立され、P486F、H445V、W452L、および L455F-F456L などの変異により、微小環境の親水性相互作用が強化され、結合能力が高まったことが明らかになりました (図 S3D)。

これらは、N354 グリコシル化の獲得のための選択が成功するには、感染性を共同で操作する P621S 置換とともに、より緊密な ACE2 結合を伴う必要がある可能性があることを示唆しています。
N354グリコシル化による感染力の低下はHSによって回復
インフルエンザやコロナウイルスなどのウイルスは、グリカンを侵入因子として利用します。
特に、宿主細胞との最初の相互作用はグリカンによって媒介されます。
ヘパラン硫酸(HS)などの負に帯電したグリカンがSARS-CoV-2の侵入補因子として役割を果たしていることを裏付ける証拠が増えています。
さらに重要なことに、これらの侵入補因子とフーリンの発現は、肺に比べて鼻上皮細胞と上気道細胞で特に豊富です。
おそらくこれと相関していると思われますが、オミクロン株は、初期のVOCと比較してHSへの結合親和性が徐々に増加しており、SARS-CoV-2の進化中に向性の変化につながっていると考えられます。
正電荷の増加(図 S4A)と、N354 グリコシル化によって媒介されるほぼすべての閉じた S 三量体(図 2A)と合わせて、これらは鼻上皮および上気道の微小環境における侵入因子の使用が変化した可能性を示唆しています。

鼻および上気道経路におけるウイルスライフサイクルの複数の段階での本物のウイルス感染を模倣するために、293T-ACE2-furin 細胞を使用して、感染前にさまざまな濃度の遊離 HS でウイルス様粒子(SC2-VLP)を前処理することにより、代表的な変異体における補因子の使用効率を評価しました(図 4A)。

遊離 HS は、BA.5、BA.2.75、および XBB.1.5 の感染を用量依存的に減少させることが観察されました。これは、本物の SARS-CoV-2 による S 結合および感染の以前に報告された阻害と一致しています。
驚くべきことに、HS 処理により BA.2.86 の感染が劇的に増加し、XBB.1.5 の感染力を上回りました (図 4A)。これは、豊富な HS とフーリンが BA.2.86 の感染力低下の回復を助けたことを示しています。
根本的なメカニズムをさらに解明するために、BA.5-K356T、BA.2.75-K356T、XBB.1.5-K356T、および BA.2.86-T356K SC2-VLP を構築し、それぞれ N354 グリコシル化を獲得または除去し、HS 処理の効果を親 SC2-VLP と比較しました。
驚くべきことに、N354 グリコシル化 SC2-VLP はすべて、HS 処理により用量依存的に感染力が高まり、親の変異体の感染力レベルまで達しました。また、N354 グリコシル化の消失により、BA.2.86 HS 処理による感染力の増強はほぼ解消されました (図 4A)。これは、フーリン/hACE2 が豊富な微小環境における N354 グリコシル化変異体の感染力の調節に HS が補因子として異なる方法で使用されていることを示し、これは最近、鼻腔上皮細胞における BA.2.86 の強力な感染の実験的観察によって反映されています。
これらの結果と一致して、N354 グリコシル化は HS の RBD への結合を部分的に阻害しました (図 4B)。

興味深いことに、293T-ACE2 細胞で擬似型ウイルスを使用すると、N354 グリコシル化変異体の HS 媒介による感染力の増強は限界に達しましたが、N354 グリコシル化のない変異体に対する HS 用量依存的な感染力の阻害は依然としてストレートラインでした (図 S4B)。

2 つのシステムから生じる差異の考えられる理由は、VSV ベースの擬似ウイルスに装飾されたスパイクの過剰な冗長性にある可能性があります。この擬似ウイルスでは、大多数が閉じた状態であっても、限られた数の「開いた」スパイクが感染を成功させることができ、RBD の上方向への遷移を促進することで N354 グリコシル化変異体の感染性を調節する HS の役割が大幅に薄められます。
これらを総合すると、HS とフーリンが豊富な微小環境は、N354 グリコシル化によって引き起こされる感染性の低下を相殺し、HS が豊富な細胞への向性のシフトをサポートする可能性さえあることが明らかになりました。
SARS-CoV-2 の HS 補因子への関与と、N354 グリカンが分子レベルで HS の使用をどのように変えるかを理解するために、3.2~3.8 Å で HS と複合した XBB.1.5、BA.2.86、JN.1、および BA.2.86-T356K のクライオ電子顕微鏡構造を決定しました (図 4C および S4C)。
興味深いことに、HS とのインキュベーションにより顕著な構造変化が起こり、N354 グリコシル化 S-トリマーの「RBD アップ」状態が大幅に増加しましたが、N354 グリコシル化のない S-トリマーの RBD 構造変調への影響は限られていました (図 4D)。
HSの構造的不均一性と柔軟性のため、HS基本単位の一部であるIdoA(2S) (2-O-スルホ-α-L-イズロン酸) の密度のみが明確であり、主要な結合部位の位置と詳細な相互作用の特定が可能です (図4C)。

HKU1およびMERS-CoVにおけるシアログリカンのドメインA(SARS-CoVのNTDに相当)への結合とは対照的に、HSは主に、RBD上の多数の正に帯電した残基で構成された半開放型の浅い細長い空洞を標的とし、RBDの残基N354、R355、K356T、R357と隣接するNTDのT157およびF168によって構築されたN354ポケットと呼ばれる深い溝内の下流にHSフラグメントが占められている(図4C)。
HS フラグメントは水素結合と塩橋を介して R355 および R357 と直接相互作用する態勢にあり、一方、残基 K356、N354、R346、および R466 はオリゴ糖のさらなる配位に寄与する可能性があります (図 4C)。
特に、結合溝のすぐ近くに N354 グリカンが存在しないことは、観察された親和性と一致して、HS の妨げのない結合を促進すると考えられます;しかし、結合した HS とともに N354 グリカンが存在すると、結合溝が 3 Å 広がり、隣接する NTD が外側に押し出され、それによって比較的緩やかな上部配置がもたらされます (図 4E)。

N354 グリカンを介したコンパクトな上部構造によってもたらされる「3-RBD ダウン」状態の割合が高いため、HS 結合時に部分的に「RBD アップ」状態に変換される可能性があり、これにより、HS 処理によって N354 グリコシル化変異体の感染性が増加するという実験的観察が説明されました。
N354グリコシル化はS切断と融合性に影響を与える
次に、一部の細胞における N354 グリコシル化によって引き起こされる感染性の低下が、異なる S 切断に関連している可能性を検討しました。
たとえば、感染性が高いことが知られているデルタ株は、高度に切断された S タンパク質と、侵入のためのより効率的な TMPRSS2 の使用に関連しています。
S1 と S2 の間の多塩基切断部位 (PBCS) に依存するフーリン切断は、ウイルスの感染性と融合活性を制御する重要なステップです。
PBCS の P681 の変化は、複数の SARS-CoV-2 系統で観察されており、アルファ株 およびほとんどのオミクロン株では H681、Delta および BA.2.86 では R681 です (図 5A)。

切断効率を評価するために、まずWT、BA.2、およびBA.2.86擬似ウイルスの生産に使用した細胞をウェスタンブロット分析でテストしました。
BA.2.86では、S1/S2対全長Sの比率から明らかなように、BA.2と比較して切断が大幅に改善されましたが、WTおよびDeltaの比率よりわずかに低いことがわかりました(図5Bおよび5C)。これは、P681の変異がS切断に排他的ではない形で寄与していることを示唆しています。
切断強化への推定寄与をさらに調査するために、BA.2.86-T356K および BA.2.86-S621P の S 切断も評価しました。

興味深いことに、T356K 変異による N354 グリコシル化の劇的な喪失により切断効率が低下し、S621P の復帰により S 切断が中程度に増加しました (図 5C)。これは、BA.2.86 S トリマーがフューリンが豊富な微小環境下で融合後の構造をとる可能性が高いことを示しています。
BA.2.86 サブ系統での TMPRSS2 の使用が効率的でないことを示すデータを考慮すると、N354 グリコシル化は切断効率と感染性の間の負の相関に寄与しているようです (図 3B および 5C)。
SARS-CoV-2 S が細胞間融合を誘導する能力は、ウイルス拡散のさらなる経路を提供し、免疫回避を促進する可能性があり、PBCS、S 切断効率、および TMPRSS2 の使用と相関しています。最適な細胞間融合には TMPRSS2 と S 切断が必要であることを考慮すると、デルタ株は最も高い融合活性を示しました。対照的に、BA.1 は融合性が非常に低かったです。
切断効率の向上に基づいて、BA.2.86 では BA.2 と比較して融合効率が変化しているという仮説を立てました。
これを調べるために、スプリット GFP システムを使用して細胞間融合をリアルタイムで監視しました。
BA.2.86 は BA.2 と比較して細胞間融合が増加しましたが、WT およびデルタ株よりも明らかに低いことがわかりました (図 5D)。

融合の効率は、S-トリマーの安定性と逆相関しています (図 S5A)。これは、融合前段階から融合後段階への構造遷移には、ドメインとサブユニット間の一連の構造変化が伴うという事実によって説明できます。これは、ウイルス融合の前提条件です。
BA.1 との構造比較により、BA.2.86 の NTD-RBD、RBD-SD1/SD1-S2、S2-S2 などのドメイン間の相互作用が減少していることが明らかになり、構造的に安定性が低下していることが説明されました (図 S5B)。

予想どおり、BA.2.86 の N354 グリカンの喪失または R681P/H の置換により、細胞間融合活性が大幅に減少しました;逆に、N354 グリカンの獲得または XBB.1.5 に基づく H681R の変異は、融合活性の増加に寄与しました (図 5E)。

S 処理と融合の改善は、構造観察と関係している可能性があります。 N354 グリカンが隣接するサブユニットの NTD と RBD をしっかりと固定し、S1 の切断を助けていると考えられます。
予想どおり、BA.2.86 に基づく単一の変異 S621P は融合活性を改善し、XBB.1.5 の変異 P621S は融合効率を劇的に低下させました (図 5E)。
機能的観察と一致して、変異 P621S は、融合の重要な調節因子である 630 ループの α ヘリックス形成を促進し、P621 バリアントでは部分的に無秩序なループとして採用され、その後の融合のための構造再配置をある程度構造的に妨げます (図 5F)。

これらのデータは、N354 グリコシル化と P621S の組み合わせにより、複数のウイルス学的特性が変化し、細胞間融合活性により N354 グリコシル化変異体が抗体によって中和されにくくなることを示しています。
N354グリコシル化はADCC抗体のサブセットから特別に逃れる
世界中で感染の波を引き起こした Delta、BA.2、BA.5、XBB などの以前の VOC の主な選択圧は、特定のクラスの抗体による免疫回避から生じました。
FLip や他の XBB 変異体と比較すると、BA.2.86 は実質的な体液性免疫回避を示さなかったが、BA.2.86 に 1 つの追加変異 (L455S) を持つ JN.1 は、3 種類の抗体に対する広範な耐性により、免疫回避性がより高くなりました。
以前、私たちはディープミューテーションスキャン(DMS)によってワクチン接種を受けた人やブレイクスルー感染(BTI)の人から分離された合計3051の抗体のエスケープ変異プロファイルとエピトープ分布を決定し、12のサブグループに分類しました(図6A)。

免疫回避パターンアッセイにより、BA.2.86サブ系統は、XBB.1.5と比較して、A2、D3、パートD4、および多くのE抗体を特異的に回避することが明らかになりました(図6B)。
驚くべきことに、K356T 置換による N354 グリコシル化の獲得により、E1、E2.1、E2.2 グループの抗体は大部分が不活性化されましたが、これらの抗体は比較的低いものの幅広い中和活性を示しました (図 6B および S6A)。

E1 から E3 までのクラス E 抗体は、左脇腹から胸部、右脇腹までの範囲の RBD 上のエピトープを標的とし、ほとんどの E1、E2.1、E2.2 抗体は K356 および N354 と広範囲に関連し、これは S309 (E1) を含む複雑な構造によって検証されています (図 6C および S6B)。

K356T 変異は電荷/親水性相互作用を減少させ、N354 グリカンは致命的な立体衝突を引き起こし、ほとんどの E1、E2.1、E2.2 抗体の結合を無効にします (図 S6B)。

Fc 依存性エフェクター機構、例えばナチュラルキラー細胞が媒介する抗体依存性細胞傷害 (ADCC) は、感染者からのウイルス除去を促進する可能性があります。
驚くべきことに、SARS-CoV-2 S トランスフェクト細胞では、E 抗体を介した効率的な ADCC が観察され (図 6D および S6C)、N354 グリコシル化変異体が ADCC 抗体の 1 つのサブセットを特に回避していることが明らかになりました。

細胞間融合の改善と相まって、これらにより、ウイルスに感染した個人から N354 グリコシル化変異体が除去されにくくなる可能性があります。
N354グリコシル化はハイブリッド免疫背景における免疫原性を低下
免疫回避に加えて、ウイルスは一般にタンパク質表面に新しいグリコシル化部位を獲得するように進化します。これはグリカンシールドの自然現象であり、これにより糖タンパク質の免疫原性が変わります。
N354 グリコシル化が免疫原性に影響を与えるかどうかを調べるために、まず、変異 S タンパク質による 2 回投与の一次シリーズ免疫後のナイーブ (非免疫) BALB/c マウスの体液性免疫応答を評価しました (図 7A)。
すべての S タンパク質には、融合前の構造で安定化するための 6 つのプロリン置換 (S6P) と PBCS の変異が含まれていました。
マウスのグループ (グループあたり n = 10) に、0 日目と 14 日目に BA.5、XBB.1.5、EG.5.1、BA.2.86、および BA.2.86-T356K を含む変異 S タンパク質 10 μg を筋肉内接種し、28 日目 (2 回目の投与から 2 週間後) に血清を採取しました。
BA.5、XBB.1.5、EG.5.1 Sタンパク質の投与では、BA.2.86、BA.2.86-T356K、JN.1(水疱性口内炎ウイルスベースの擬似ウイルスを使用)に対する血清50%中和力価(NT50)が非常に低く、一方、BA.2.86とBA.2.86-T356Kの免疫化では、Omicron亜系統に対する中和力価が非常に限られており、単一免疫背景分析からOmicronとBA.2.86の抗原距離が大きいことが示唆されています(図7Bおよび7C)。


特に、N354グリコシル化により、BA.2.86の免疫原性がBA.2.86-T356Kと比較して約40%低下し、BA.2.86はSARS-CoV-2変異体の中で比較的免疫原性が低くなりました(図7C)。
ブレイクスルー感染によって誘発される SARS-CoV-2 免疫刷り込みにおける N354 グリコシル化の影響をさらに評価するために、マウスで現実世界の模倣免疫背景をモデル化しました。
これを実現するために、0.3 μg CoronaVac (ヒトの 1/10 用量、WT 由来の不活化ワクチン) を 2 回投与して一次免疫化を行い、次に 2 回目の投与から 3.5 か月後に 0.3 μg 不活化 BA.5 ワクチンを 1 回投与して BA.5 BTI を模倣し、3 回目の投与から 4 か月後に 10 μg 変異体 S タンパク質を 1 回投与して BTI + 再感染を模倣しました (図 7A)。
単一免疫背景と比較して、ハイブリッド免疫背景下での Omicron BA.5、XBB.1.5、および EG.5.1 S タンパク質の単回投与では、BA.2.86 亜系統に対する交差中和が約 5 ~ 20 倍改善され、BA.2.86 および BA.2.86-T356K の単回投与免疫では、Omicron 亜変異体に対する中和力価が約 50 ~ 200 倍増加しました (図 7D および 7E)。これは、ハイブリッド免疫刷り込みの存在が交差反応性 B 細胞のリコールを促進し、抗原距離を短縮することを示唆しています。
進化が進むにつれ、変異体 S タンパク質の免疫原性が徐々に低下するという本質的な傾向が観察され、N354 グリカンの獲得により、ハイブリッド免疫背景下での免疫原性がさらに約 2 倍低下し、結果として免疫刷り込みが緩和されました (図 7E)。


それにもかかわらず、現実世界の免疫背景を模倣した状態での BA.2.86、特に BA.2.86-T356K の 1 回投与ブースターは、現在普及している JN.1 を含む BA.2.86 サブ系統に対する中和抗体を高レベルで誘発する可能性があり (図 7E)、微調整された (BA.2.86 ベースの) ワクチンでブースター接種することで、免疫応答を BA.2.86 サブ系統に微調整できることが明らかになりました。
これらは、N354 グリカンの獲得を通じて、ヒトのより洗練された適応に向けた進化の軌跡が変化したことを示しています。
Discussion
選択的に好ましい突然変異が集団の全体または一部に広がると、通常、近くのゲノム部位での配列の変動性のレベルが低下し、選択スイープシグネチャとして現れることがあります。
OmegaPlus と RAiSD を使用して、GISAID EpiCoV データベースから過去 4 か月間 (2023 年 9 月 1 日から 2024 年 1 月 1 日まで) に寄託された 184,224 個の SARS-CoV-2 ゲノムの推定スイープ領域をマッピングしました。
野生型、BA.2、BA.5、XBB のいずれを参照として使用したかに関係なく、両方のデータセットの S で 4 つの類似した選択的スイープ領域が検出されました (図 1D)。
RBD の残基 356 (K→T) と 372 (T→A) のコドン内の 2 つの非同義変化 (A1067C と A1114G) は、スイープ領域の 1 つに中央に位置し、それぞれ N354 と N370 グリコシル化の獲得と喪失につながりました (図 1D)。

N370 グリコシル化の喪失は、SARS-CoV-2 が動物リザーバーから出現し、パンデミックの初期段階でヒトからヒトへの感染が促進された重要な進化イベントであることが示されています。
私たちの研究結果は、長期にわたる SARS-CoV-2 パンデミックの過程で変異体が獲得した N354 グリコシル化が、調節可能な感染性、免疫原性の低下、排除を逃れた免疫回避を伴う向性のシフトを通じて、ヒトへの最適な適応のための選択的利点をもたらす可能性が高いことを示唆しています。
RBD の構造的ダイナミクスとその調節により、サルベコウイルスは宿主細胞への付着と免疫回避のバランスをとるのが巧妙になります。
アップ状態への移行により、RBD は hACE2 への結合に晒され、また S 媒介ウイルス融合の前提条件でもあり、感染力と直接相関しています。
したがって、ほとんどの循環 SARS-CoV-2 変異体の S タンパク質は、妥当な割合 (> 50%) で RBD アップ状態で観察されています。
しかし、驚くべきことに、最近流行している BA.2.86 サブ系統は、N354 グリコシル化の獲得により、JN.1 の S タンパク質の RBD ダウン状態で最大 100% を占め、RBD を中和抗体から保護し、RBD-hACE2 の関与を防止しています。
これらの観察結果は、人間との共存という目標のために、感染性を犠牲にして免疫回避を高めており、免疫刷り込みを少なくするというウイルスの進化のトレードオフを示唆しています。
驚くべきことに、減少した感染性は、HS補因子の結合モードを変更してRBDアップ構造遷移を促進することで回復することができ、これは明らかにアロステリック機構を通じて、調整可能な感染性とHSが豊富な細胞への向性の変化をもたらしてます。
ウイルスの進化の過程で、ウイルスはさまざまなグリコシル化修飾を発達させ、生存、伝染性、適応性に顕著な影響を及ぼします。
一般的に、N-グリカンを付加する変異体の大部分は感染性と伝染効率が低下しますが、免疫シールドグリカンは免疫回避に有益であり、これはN-グリカン部位の蓄積に対する洗練されたバランスのとれた進化戦略を反映しています。
このさらなる証拠は、インフルエンザAのウイルス進化において、5~7年ごとにNグリカン部位が追加されていることで記録されています。
SARS-CoV-1、SARS-CoV-2、中東症候群コロナウイルス(MERS)で観察される限られたグリカンシールド密度が、病原体の人獣共通感染症と相関しているかどうかは不明です。
注目すべきことに、ベータコロナウイルス属の中で、季節性ヒトコロナウイルス HKU1 および OC43 はヒトと長く共存しており、S モノマーあたり 26~31 個の N グリカン部位を有するのに対し、SARS および MERS コロナウイルスでは 22~23 個の N 結合グリカンセクオンを有する (図 S1B)。

注目すべきことに、OC43 S 上の N グリカン部位は過去 60 年間に蓄積され、20 年ごとに約 2 個の N グリカン部位が追加されている (図 S1C)。

HKU1 では、おそらく 2004 年に初めて分離および特定されたため、ヒトにおける N グリカン部位と流行期間の関係にわずかな傾向が見られました。
グリカン シールドの蓄積を監視するには十分な流行期間が必要であるか、HKU1 が比較的成熟した段階に進化し、S モノマーと RBD にそれぞれ約 30 個と 5 個の N グリカン部位を持つようになったのではないかと推測したくなります (図 S1C)。
それでも、コロナウイルスのSタンパク質のNグリカン修飾は、HIV、インフルエンザ、ラッサ熱などの他のウイルスのグリカン密度と比較すると、真正で効果的なシールドを構成するものではなく、全体的な構造、スパース性、オリゴマンノースの豊富さ、免疫回避に反映されている可能性があります。
免疫原性反応の点でウイルスを直接比較することは困難ですが、SARS-CoVは、感染または免疫付与後にSタンパク質を標的とする強力な中和抗体を容易に誘発します。
対照的に、HIVの効果的なグリカンシールドは、十分な免疫反応と広範囲に中和する抗体の生成を妨げます。
私たちは、SARS-CoV-2スパイクRBDの高い可塑性が、それ自体へのグリカンの蓄積を制限する可能性があると推測しました。
SARS-CoV-2の感染性と免疫反応の調節におけるN354グリコシル化の生物学的重要性は、コロナウイルスワクチン研究に応用できる可能性があります。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
