デルタ株B.1.617.2の受容体結合インターフェースの変異による変化と免疫回避への影響
Mutation-induced Changes in the Receptor-binding Interface of the SARS-CoV-2 Delta Variant B.1.617.2 and Implications for Immune Evasion
SARS-CoV-2デルタバリアントB.1.617.2の受容体結合インターフェースの変異による変化と免疫回避への影響
元→https://www.biorxiv.org/content/10.1101/2021.07.17.452576v1.full.pdf
Abstract
SARS-CoV-2感染症に対するワクチン接種の取り組みは世界中で進行中ですが、ウイルスの新しい遺伝的変異が出現し、広がっています。
アルファ(B.1.1.7)とベータ(B.1.351)の亜種の最初の急増に続いて、より感染性の高いデルタの亜種(B.1.617.2)が急増し、パンデミックによって引き起こされる健康危機がさらに深刻化しています。
デルタ株に起因する症例の急増は、それを特に不安にさせており、懸念のバリアントです。
幸いなことに、現在のワクチンは、デルタ株を含む既知の懸念のある変異株に対する防御を提供します。
ただし、デルタ株は、以前の感染またはワクチンからの中和抗体がデルタ株スパイクタンパク質との結合をあまり受け入れないことがわかっているため、免疫系をかわす能力を示しています。
ここでは、デルタ株の受容体結合インターフェースの変異によって引き起こされる構造変化を調査し、ACE2受容体および中和抗体との結合への影響を調査しました。
受容体結合β-ループ-βモチーフは、変化しているが安定したコンフォメーションを採用しており、抗体結合エピトープの一部で分離を引き起こしていることがわかりました。
私たちの研究は、中和抗体の結合の低下を示し、デルタ株が示す免疫回避のメカニズムの可能性を示しています。
1. Introduction
SARS-CoV-2感染によって引き起こされたパンデミックは、世界中で1億8800万件を超え、2021年7月15日時点で400万人近くが死亡しています。SARS-CoV-2感染症に対するいくつかのワクチンが開発されており、他のワクチン候補も臨床試験に参加しています。緊急使用が許可されているワクチンは、症例数と死亡数を減らすのに非常に効果的です。また、並行して治療対策も進めています。これらには、治療用小分子、回復期血漿、おとり受容体、中和抗体の同定が含まれます。いくつかの研究では、ウイルスの受容体結合ドメイン(RBD)に結合でき、有利な薬物動態と大規模な生産能力を持つ中和抗体(Abs)が検討されています。
ワクチンまたはAbsの主なターゲットは、スパイクタンパク質の受容体結合ドメイン(RBD)です。これは、ウイルスが宿主細胞上のヒトACE2受容体に結合し、ウイルスがヒト細胞に侵入するのを促進する役割を果たします。
ワクチン接種の取り組みは世界中で進行中ですが、新しい遺伝的変異が出現し、広がっています。
懸念される注目すべき亜種には、アルファ亜種B.1.1.7(英国原産)、ベータ亜種B.1.351(南アフリカ原産)、デルタ亜種B.1.617.2(インド原産)があります。
B.1.617バリアントの致命的な形態は、インドでの感染の第2波の主な原因であると考えられています。インドだけでも3000万人以上が感染し、40万人が死亡するという深刻な健康危機を引き起こしています。
B.1.617.2デルタ株は、すべてのバリアントの中で最も感染性が高いと見なされており、2021年6月の時点で、報告された症例数が最も多い最も感染性の高いバリアントの1つになり、B.1.617.1がそれに続きます。デルタ株は、多くの国で急速に最も優勢なバリアントになりつつあります。
幸いなことに、現在のワクチンは、デルタ株を含む多くの懸念のあるバリアントに対して効果的であるように見えます。
ただし、世界中で予防接種が受けられないため、ウイルスは拡散して進化し続け、パンデミックを迅速に終わらせる可能性が低くなっています。
RBDの変異は、ウイルススパイクタンパク質が宿主細胞に結合して侵入する能力を変化させる可能性があります。
B.1.617.1のスパイクタンパク質には、T95I、G142D、E154K、L452R、E484Q、D614G、P681R、Q1071Hの変異があります。B.1.617.2には、T19R、G142D、Δ156-157、R158G、L452R、T478K、D614G、P681R、およびD950Nの変異があります。
スパイクタンパク質の受容体結合ドメイン(RBD)は、主に宿主細胞上のACE2との相互作用に関与しているため、B.1.617.1のRBD変異L452R / E484QおよびB.1.617.2のL452R / T478Kは、ウイルスの感染性と伝染性に重要な役割を果たすと想定されています。
最近、ベータ株に存在するRBD変異K417Nがデルタ株でも特定され、デルタプラス株として知られるさらに別の新しいバリアントが提供されています。
以前の急増を克服したと思われる地域(インドなど)や、効果的なワクチンの接種率が高い地域(イスラエルなど)でのデルタ株による感染による症例数の大幅かつ急速な増加は、ワクチンから誘発された抗体、SARS-CoV-2の他の株による以前の感染、または分子模倣による他の病原体は、デルタ変異体に対してそれほど効果的ではないことを示しています。
実際、最近の研究では、以前の亜種と比較して、デルタ亜種は以前の感染によって与えられた免疫を回避できるだけでなく、回復した患者からの抗体の中和に対する感受性も低いことが示されています。
一部の抗RBDAbは、RBD結合が低下していることが示されています。その結果、以前の感染による血清の効力が4分の1に減少し、デルタ株に対するワクチン生成抗体が3〜5倍減少しました。
同様に、最近、B.1.427 / B.1.429バリアントの変異により、RBD結合抗体(Abs)に対する感受性が低下または完全に失われることが示されています。
これは、おそらくRBDのACE2への高い親和性、またはスパイク三量体のアップコンフォメーションでそれ自体を提示する能力に加えて、RBD変異による抗体回避も、デルタ株の伝達率の増加に寄与している可能性があることを示唆しています。
したがって、RBD-ACE2結合とRBD-Ab結合の両方を理解することが重要です。
この研究では、RBDの受容体結合インターフェースの構造、RBD-ACE2相互作用、RBD中和抗体相互作用に対するデルタ株の変異の影響を調査します。
タンパク質データバンク(PDB)で利用可能なSARS-CoV-2 Ab-RBD複合体を調べ、デルタ株の変異によるRBD-Ab相互作用の違いを比較します。
私たちの結果は、デルタ株が安定しているがわずかに再編成された受容体結合インターフェースを特徴とし、免疫回避をもたらすいくつかの中和抗体との相互作用を弱める可能性があることを示唆しています。
2. Materials and Methods
※省略します
3. Results and Discussion
スパイクタンパク質のRBDには、B.1.1.7にN501Y、B.1.351にK417N / E484K / N501Y、デルタB.1.617.2にL452R / T478Kの変異があります。
ACE2と複合体を形成したRBD構造を図1に示し、デルタ株のRBD変異の位置を強調表示しています。

RBDのACE2相互作用インターフェースは、中央に逆平行βシート(残基452-455、492-495)を備え、両端にループセグメントを備えています。
界面領域内またはその周辺のRBD変異は、ACE2または中和抗体に結合するRBDの能力に直接影響を与える可能性があります。
3.1 Structural changes due to mutation in Delta variant
デルタ株の変異による構造変化
RBDのダイナミクスと変異による構造変化を調査するために、デルタ株B.1.617.2のRBDのMDシミュレーションを実行し、その結果をWT、B.1.1.7、およびB.1.351バリアントと比較しました。
デルタ RBDのL452RとT478Kの両方の変異は、残基438から508にまたがるモチーフで構成される受容体結合インターフェースにあります。
同じインターフェースが多くの中和抗体の標的です。
したがって、受容体結合インターフェースの変更は、ホストACE2への受容体結合とAb結合の両方に影響を与える可能性があります。
このインターフェースの構造変化を評価するために、図1に示すように、インターフェースのさまざまな領域を分析しました。

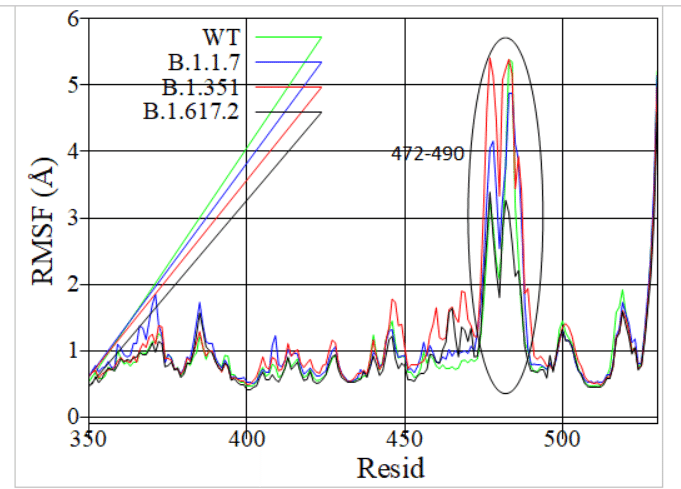
RBDの二乗平均平方根変動(RMSF)を計算し、その結果を図S1にプロットしました。これは、βloop-βモチーフのアミノ酸残基(領域3、残基472-490)がすべてのバリアントに対して最大の柔軟性を持っていることを示しています。

リージョン1のループセグメントはWTと比較して大幅に変化することはないため、リージョン2のβシートとリージョン3のβ-loop-βモチーフに焦点を当てました。
3.1.1 Structural rearrangements in the interfacial beta sheet region
界面βシート領域における構造再配置
図2aは、安定したインターフェースを作成する水素結合ネットワーク(図2b)を含む受容体結合モチーフ(RBM)インターフェースのβシート領域(残基448-455、491-498で構成される領域2)を示しています。WTでは、各セグメントの残基は、バックボーン水素結合を持つβ-二次構造(β5:452-455およびβ6:491-495)を持っています。一方、各セグメント(448-451および496-498)の追加の残基は、ほとんど構造化されていません。
図2bは、600 nsMDシミュレーションの終了時のWT株とデルタ株B.1.617.2のRBMの水素結合を示しています。

インターフェースの領域2の水素結合分析(図2c)は、WTとB.1.1.7のH結合相互作用パターンが類似しているのに対し、B.1.351とB.1.617.2のH結合パターンは著しく異なることを示しています。

興味深いことに、図2cの分析は、デルタ株の残基G496のわずかな再配向が、βストランド間のはるかに強い水素結合をもたらすことを示しています。
特にデルタ株の場合、①バックボーン水素結合のより安定したネットワークが確立され、新しい水素結合N448(N)-F497(O)が形成されます。②R454側鎖とD467側鎖の間に大幅に強化された塩橋相互作用が観察されます。

これらの2つの変化は、β5でわずかに強化されたβ構造の傾向を与える変異L452Rによるものと思われます。
最近、懸念の別の変異株であるB.1.427 / B.1.429のL452R変異が、テストされたモノクローナル抗体のほぼ半分の減少を引き起こしたことが示され、この変異の危険な結果が浮き彫りになりました。
これらのバリアントのそれぞれについて300nsの再実行を分析し、図S2で比較しました。
R454-D467バックボーン水素結合は、デルタ株の再実行で300 nsまで側鎖相互作用に切り替わりませんでしたが、βストランド間のN448(N)-F497(O)水素結合の存在は一貫しています(図S2)。
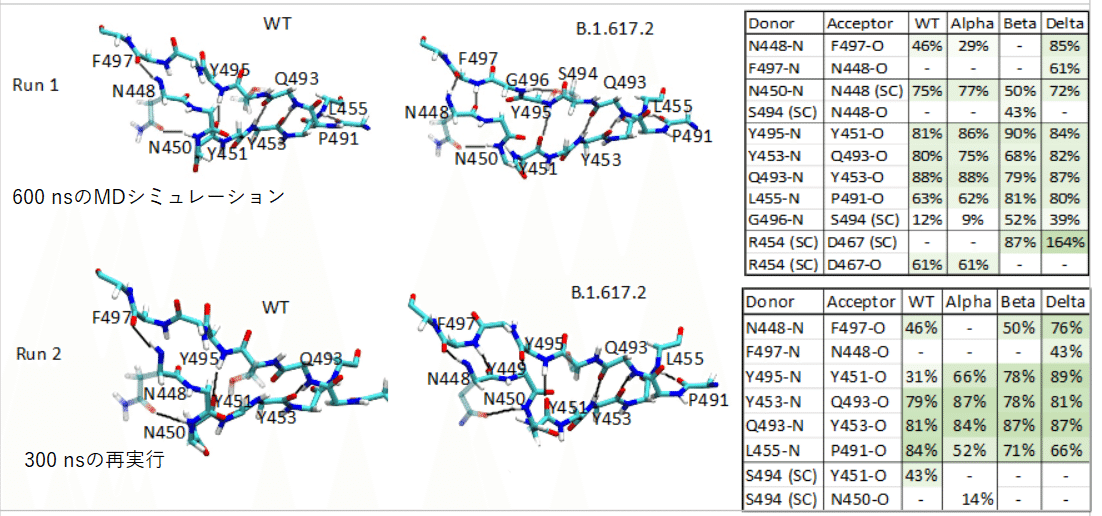
図1および2に見られるように、図2bおよび2cでは、逆平行βストランドの相互作用がデルタ株B.1.617.2で強化されているため、受容体結合インターフェースが安定しています。
これは、RBDがACE2および中和抗体と結合する方法に直接影響する可能性があります。
L452RバリアントB.1.617.1(PDB ID 7orb)の最近解明された結晶構造は、これらの水素結合を示さないことに注意してください。ここで観察された変化は、おそらく動的な再編成の結果であることを示唆しています。
同様に、ほとんどすべてのRBD構造は、R454側鎖がD467および/またはS469のバックボーンと水素結合を形成することを示していますが、一部の構造はD467(例:PDB ID 7n1q33、7kdj51)との側鎖相互作用の可能性を示しています。このリージョンにおける水素結合の機敏なネットワークを示唆している。
3.1.2 Structural rearrangements in the β-loop-β motif
βループβモチーフの構造再編成
柔軟なβ-ループ-βモチーフ(図1、領域3、残基472-490)には、C480-C488の間にジスルフィド結合が含まれており、デルタ株の変異T478Kもこのループにあります。
この領域の柔軟性の突然変異による変化と、さまざまなバリアント(WT、B.1.1.7、B.1.351、B.1.617.2)の水素結合の再配列を調査しました。デルタ株は大幅に異なるループ構造を備えていることがわかりました。
すべてのバリアントはこの領域に柔軟なループを持っていますが、デルタ株は他のバリアントと比較してより安定しているが異なるコンフォメーションを採用しているため、柔軟性が低下しています(図S1)。
ループのコンフォメーション変化の違いは、図3aに示すように、C480のジスルフィド結合二面角C-Cα-Cβ-SGの変化から見ることができます。

WTと比較すると、デルタ株の時間の関数としての二面角は、早い段階ですばやく反転し、その後、新しい方向で安定したままになります。
βシート領域(図1b、領域2)とβ-ループ-βモチーフ(図1b、領域3)の変化の組み合わせにより、受容体結合インターフェースが全体的に変化するようです。
デルタ株では、リージョン2とリージョン3がさらに離れています。
これは、リージョン2の2つのβストランド(図1b:βストランド452-455および492-495)の重心(COM)とリージョン3の2つのβストランド(図1b:472-475および487-490)のCOMの間の分離距離(図3bの点線)によって示されます。

図3b(右)の距離プロットは、COM分離距離が1.5Å増加したデルタ株(黒い曲線)の安定しているがわずかに拡張された領域2 –領域3受容体結合インターフェースを示しています。
全体として、これらの構造変化とループの柔軟性の違いは、ACE2とAb結合に影響を与える可能性があります。
受容体結合インターフェースが変更されたデルタRBDの変動が減少すると、中和抗体との相互作用が弱くなり、免疫回避につながる可能性があります。
3.2 Antibody binding to the Delta RBM and possible mechanism of immune evasion
デルタRBMへの抗体の結合と免疫回避の可能性のあるメカニズム
最近の研究では、懸念される変異株B.1.427 /B.1.429による免疫回避のメカニズムが示されています。
具体的には、デルタ株で見つかった同じ変異であるL452Rが、テストしたモノクローナル抗体の多くで中和活性の低下の原因でしたが、別のRBDサイトでのジスルフィド結合の再グループ化により、テストしたすべての抗体の活性が失われました。
デルタRBDの変異によって引き起こされる受容体結合界面の変化による、Ab結合への影響を評価するために、最初に、WTのタンパク質データバンク(PDB)で利用可能なAb-RBD複合体の界面相互作用を調べました。
Protein Data Bankから取得した受容体結合インターフェースにAbが結合した118個のRBD-Ab複合体のうち、47個の非反復複合体をさらに分析するために検討しました。
Ab-RBDコンプレックス(pdb ID)は表S2にリストされており、MovieS2で視覚化されています。
各複合体のイオン結合または水素結合の相互作用に関与するRBD残基を特定し、すべての複合体の重要な残基の発生頻度を図4にプロットしました。
この分布は、複合体の利用可能なpdb構造のために本質的に偏っている可能性がありますが、Absのサンプルに適した界面RBD結合エピトープ部位の一般的な考え方を提供します。

図4から、Absの大部分がβ-loop-β残基Y473、A475、N487、E484などと相互作用していることがわかります。
WTのAb-RBD複合体を調べると、Absの多くが複数のサイトに固定されていることがわかります。
たとえば、6xe1、7b3o、7cdi、7cjfなどの多くのAb-RBD複合体では、Absは1つのサイト(図4のサイトA)でA475 / G485に結合し、別のサイト(図4のサイトF)でR457 / K458に結合します。図4に示すように、さまざまなサイトをグループ化し、色分けしました。
これらの部位の変化がAb結合にどのように影響するかを調べるために、WTとデルタ株の両方について、図5の2つのAb結合部位に属する残基K458とA475の間のCα距離をプロットしました。
図5bに示すように、これらの残基間の距離(458-475)は、WTではほとんど9Åのままです。
ただし、図5cのデルタ株の同じ(458-475)距離は、150 nsで約14Åに増加し、その距離で安定したままです。
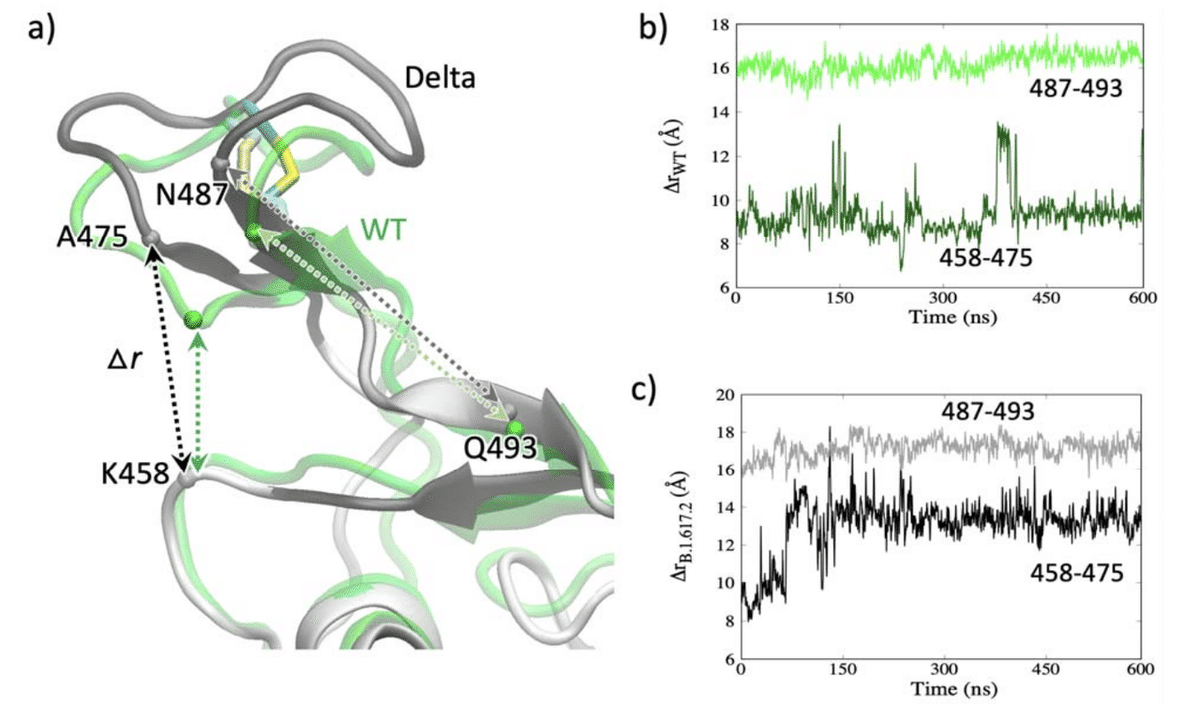
Ab結合部位のこの4〜5Åの増加は、Ab結合が深刻な影響を受け、AbがデルタRBD結合に対して非感受性になることを示唆しています。
ACE2は475/487のサイト(図4のサイトA)で結合しますが、457/458のサイト(サイトF)では結合しないため、K458-A475距離の増加はACE2の結合に影響しません。
代わりに、ACE2は475/487とQ493(β6の中央)で結合します。
したがって、残基N487とQ493の間の距離もプロットしました。
興味深いことに、構造の変化にもかかわらず、WTとデルタ株の両方でのこの距離は、図5bと5cに見られるように、ほぼ同じ(16〜17Å)のままです。
これは、構造変化がACE2結合部位に影響を与えていないが、Ab結合部位に大きな影響を与えていることを示唆しており、受容体結合の能力を維持しながら、Abによる免疫回避の可能性を示唆しています。
3.3 ACE2 binding vs. antibody binding in the Delta variant
デルタ株におけるACE2結合と抗体結合
デルタ RBMの2つのサイト間の距離の増加を観察して、変更がACE2とAbの結合にどのように影響するかを調査しました。
ACE2結合が維持または強化されているが、少なくとも中和抗体のセットで抗体結合が弱まっている場合、ウイルスは抗体に対する感受性が低く、感染と拡散の効果が高くなります。
これを調査するために、デルタ株のRBD-ACE2複合体とAb-RBD複合体のシミュレーションを実行し、WTの複合体と比較しました。
600 nsのシミュレーションから取得したRBDからモデル化されているため、デルタ株の複合体は相互作用は進化するが、WTの複合体は安定していると予想されます。
RBD-ACE2およびAb-RBD複合体の水素結合相互作用を図6に示します。
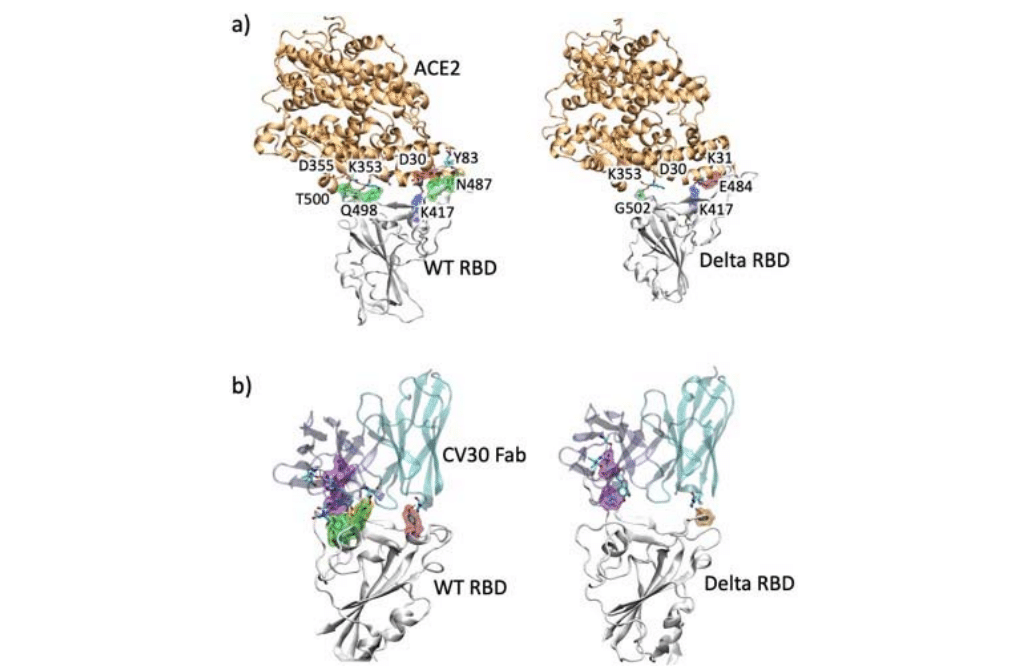
WT RBD-ACE2複合体では、主に水素結合相互作用に関与するRBD残基には、K417、Y489、G502、E484、T500、およびN487が含まれます。
RBD残基K417は、WTおよびB.1.1.7ではACE2のD30と強力な塩橋を形成しますが、K417変異のため、B.1.351では形成されません。
これらのWTの相互作用は、占有率が低下しますが、デルタRBDとの複合体には引き続き存在します(表S3)。

K417-D30塩橋を含むいくつかの主要な相互作用がまだ複合体に存在しているため、ACE2結合はデルタRBDの構造変化を許容しているようです。
次に、WTとデルタRBDのAb結合を比較しました。
中和AbCV30 Fab(pdb ID 6xe1)と複合体を形成し、Ab BD-236 Fab(pdb ID 7chb)と複合体を形成したWTRBDからモデル化されたAb-デルタRBD複合体の2つの例を検討しました。
CV30-DeltaRBDモデルの100nsシミュレーションでは、相互作用が大幅に減少した、安定性の低い複合体が示されています。
図6bに示すように、WTのAbは、シミュレーション中に無傷である3つのクラスターの残基と相互作用します。ただし、デルタRBDでは、AbはサイトAまたはFでのみバインドでき、両方ではバインドできません。
これは、図5に基づいて行われた議論と一致しています。

WTのY473、Y421、L455、A475、R457、R403、K417、およびY505との水素結合を含む主要な水素結合は、デルタ株では切断または弱化されています。7chbからモデル化されたAb-RBD複合体(BD-236 Fabとの複合体)も、水素結合の数と強度の低下を示しています。
WT BD-236複合体のY453、G502、D420、およびK417との主要な水素結合の一部は、100 nsシミュレーション中もデルタ株に存在します(表S4)。
図6bは、CV30 AbのAb-RBD複合体の最終的なコンフォメーションを示しており、RBD残基は図4のグループに従って色付けされています。WTおよびデルタ株のBD-236と複合体を形成したRBD構造を図S3に示し、残基と水素結合占有率を表S4に示します。

MaSIF-search47を使用した結合分析では、デルタ株の両方のAb-RBD複合体の結合が大幅に減少していることが示されています(図S4)。

図S4のバイオリン図は、SAbDab構造抗体データベースのAb-タンパク質複合体から抽出された結合コストの分布を示しています。
WT複合体のスコアは分布内にありますが、デルタの複合体は大幅に高いバインディングコストを示しています。
他のサイトで結合するAbは影響を受けない可能性がありますが、A-Fで結合するAbは、デルタRBD結合に対して、差異はあるものの、鈍感になる可能性があります。
4. Conclusion
SARS-CoV-2のデルタ株(B.1.617.2)は、パンデミックの最中にこれまでで最も気になるバリアントの1つになり、世界中に急速に広がっています。最近の感染症と死亡の急増の原因になっています。
現在のワクチンはまだこの亜種に対して防御的であることが示されていますが、また、以前の感染から中和抗体を作成したり、ワクチンによって誘発された抗体をスパイクタンパク質との結合に対する感受性を低下させたりすることで、免疫系から逃れることができることも明らかになりつつあります。
この作業では、変異L452R / T478Kを使用したデルタ株RBDの分子動力学シミュレーションを実行し、受容体とAbの結合インターフェースで結果として生じる構造変化を調査しました。
デルタ株は、WT、B.1.1.7、およびB.1.351と比較して著しく異なる受容体結合インターフェースを示すことがわかりました。
具体的には、受容体結合β-ループ-βモチーフは、一部の中和Abに対する結合親和性を低下させる可能性のある、Ab結合エピトープ領域のシフトを引き起こすように見える変更されたコンフォメーションを採用しています。
2つのAb-RBD複合体のシミュレーションを実行してこれを調査したところ、複合体の1つがAbとRBDの間の相互作用が大幅に減少していることがわかりました。デルタ株による免疫回避の可能なメカニズムを示唆しています。
これらのシミュレーションで得られたAb耐性コンフォメーションは、コンホメーションアンサンブルのサブセットのみを表している可能性がありますが、それでもAbの感度の低下に大きく寄与する可能性があります。
受容体結合インターフェースのコンフォメーション空間の完全なマッピングに関する将来の研究は、一般的な抗RBD Abとの相互作用の性質にさらに光を当て、ワクチンの有効性に関する有用な情報を提供する可能性があります。
構造の変化が、スパイク三量体のアップコンフォメーションで現れるRBDの能力、またはそのACE2結合親和性をどのように変化させるかを理解することで、バリアントの伝達性についても知ることができます。
以下省略。
この記事が気に入ったらサポートをしてみませんか?
